一种电化学还原-热化学循环分解水制氢的方法与流程
本发明涉及制备氢气的方法,具体涉及一种电化学还原-热化学循环分解水制氢的方法。
背景技术:
氢能作为一种清洁高效的二次能源载体,具有来源丰富、质量轻、热值高、绿色环保、利用形式和储存方式多样等特点,不仅能够满足现阶段的低碳发展需求,也能在未来能源格局中发挥重要作用。利用太阳能分解水制氢是人类梦寐以求的,然而h2o是非常稳定的化合物。研究表明,当温度在2250℃以上时,水直接热分解制氢反应才比较明显。由于水的直接分解需要的温度太高,且在高温下,氢气和氧气很难及时分离,逆反应明显,因此直接热分解水目前几乎是不可行的。
热化学循环水分解制氢技术起源于20世纪60年代。该循环通常以金属氧化物作为循环物质,主要是利用金属及其氧化物之间的互相转换或者不同价态的金属氧化物之间的氧化还原反应来实现循环制氢。分两步进行:
第一步,高价的金属氧化物mxoy在高温下直接分解产生氧气和次价的金属氧化物mxoy-1或者金属单质;(mxoy→mxoy-1+1/2o2)
第二步,次价的金属氧化物或者金属单质在相对较低的温度下与水反应生成氢气和高价的金属氧化物,高价的金属氧化物又循环回到第一步。(mxoy-1+h2o→h2+mxoy)
经过两步反应,最终利用热能将水分解成氢气和氧气,而中间金属氧化物不消耗。(h2o→h2+1/2o2)
铁资源丰富,廉价易得,对环境友好。以fe3o4/feo铁氧化物为代表的热化学循环制氢受到广泛关注,也是最早被提出的热化学循环之一,其循环反应如下:
2fe3o4→6feo+o2
3feo+h2o→fe3o4+h2
虽然氢气的理论产量很高,然而fe3o4的分解温度高达2300℃以上,已经超过了fe3o4的沸点,容易出现fe3o4气化的现象,使fe3o4在循环过程中逐渐变少,影响循环效率。
研究者们尝试使用很多金属氧化物进行热化学循环制氢,先从简单的金属氧化物开始,然后通过其他的金属掺杂对材料改性,制备二元或多元的金属氧化物,总体来说金属氧化物热化学循环分解水制氢法取得了一定的效果,但是到目前为止,如果想要得到理想的氢气产量,温度基本还维持在1400℃左右。如此高的温度,热源匹配是一大问题;另一个问题是材料在高温下易于烧结,影响材料的循环性能。
技术实现要素:
本发明的目的是提供一种电化学还原-热化学循环分解水制氢的方法,这种电化学还原-热化学循环分解水制氢的方法用于解决金属氧化物热化学循环分解水制氢法需要的温度高,热源难以匹配的问题。
本发明解决其技术问题所采用的技术方案是:这种电化学还原-热化学循环分解水制氢的方法先进行电化学还原过程,然后再进行热化学分解水制氢过程;
电化学还原过程采用阴极和阳极在熔盐电解质中进行铁氧化物电解,电解形成新生态fe,铁氧化物添加量为0.25-1.0mol/电解质kg,电解温度为450-600°c,电解电流为0.25-1.0a,电解时间为10-60min;
热化学水分解产氢过程是在所述电化学还原过程结束,切断电源后,水蒸气发生器一边通入水,一边输送出水蒸气,水蒸气被通入到所述电解池内阴极处,进行水分解产氢反应,反应时间为20-30min;水通入量为0.1-1.0ml/min。
上述方案中阴极采用铁片、不锈钢片中的一种;阳极采用镍片、铂片中的一种;熔盐电解质采用56.5mol%li0.87na0.63k0.50co3–43.5mol%lioh和li0.87na0.63k0.50co3中的一种;铁氧化物采用三氧化二铁、四氧化三铁、氧化亚铁中的一种。
上述方案中向所述电解池内的阴极通入水蒸气时,通入n2携带水蒸气。
上述方案中n2和水蒸气的温度为200-300°c。
上述方案中n2通入量为50-100ml/min。
本发明具有以下有益效果:
1、与fe3o4/feo铁氧化物为代表的热化学循环制氢相比,本发明开发的电化学还原-热化学循环分解水制氢的方法在500°c进行分解水制氢,无须在1400°c以上的高温,避免了高温下的材料问题,在工程上更易于实现,水分解产氢与电化学还原步骤在等温条件下工作,避免了传统两步法的温度切换,消除了因温度切换带来的热量损失和时间浪费。
2、本发明电化学还原-热化学循环分解水制氢两步在同一反应器内工作,简化了工艺路线。
3、本发明采用n2携带水蒸气,可以使水蒸气均匀的通入到电解池中。
附图说明
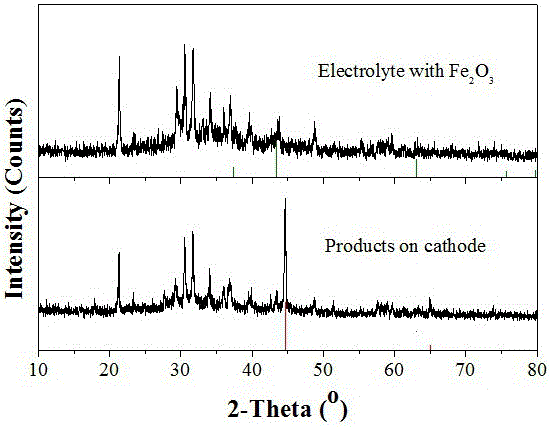
图1为采用本发明实施例1电解后的效果图,图中红色垂线为pdf:06-0696纯铁的xrd标准谱线。
图2为采用本发明实施例2不同电解时间下产氢的效果图。
图3为采用本发明实施例3电化学还原-热化学分解水制氢过程4次循环下产氢的效果图。
具体实施方式
下面对本发明作进一步的说明:
实施例1:电化学还原生成铁。
步骤一:称23.55g的56.5mol%li0.87na0.63k0.50co3–43.5mol%lioh混合物,再称取1.87g的fe2o3充分研磨混合均匀,以镍片作阳极(1cm×3cm),304不锈钢片(1cm×3cm)作阴极,将阳极和阴极固定,连同研磨混合好的电解质一起装入刚玉坩埚。
步骤二:将刚玉坩埚放入电炉加热升温至500°c,并将阳极和阴极与直流电源连接。
步骤三:接通电源,在0.5a电流下恒电流电解240min。
步骤四:电解结束后切断电源,取出阴极,采用xrd分析电解质和阴极上的电解产物,结果见图1,由图1可以看出,电解后有铁在阴极上生成。
实施例2:
本实施例的步骤一和步骤二与具体实施例1中的步骤一和步骤二相同。
步骤三:接通电源,在0.5a恒电流下,分别电解5、10、20、40和60min。
步骤四:电解结束后切断电源,然后采用流量为80ml/min的n2将250°c的水蒸气携带吹向不锈钢片阴极与电解形成的新生态fe反应120min。
步骤五:采用排水集气法收集从电解池排出的气体,采用气相色谱分析氢气含量。结果见图2,由图可以看出,随着电解时间的增加,产生的氢气量增加,5、10、20、40和60min时的电流效率分别为13.3%、28.9%、21.5%、23.1%和27.1%。
实施例3:
本实施例的步骤一和步骤二与具体实施例1中的步骤一和步骤二相同。
步骤三:接通电源,在0.5a恒电流下,电解60min。
本实施例的步骤四与具体实施例2中的步骤四相同。
步骤五:采用排水集气法收集从电解池排出的气体,采用气相色谱分析氢气含量。
步骤六:再循环回本实施例的步骤一进行下一个电化学还原过程-热化学分解水制氢过程。结果见图3,由图可以看出,电化学还原过程-热化学分解水制氢过程循环4次的产氢量和电流效率基本恒定,说明电化学还原过程-热化学分解水制氢过程可以多次循环,反复利用产氢。
实施例4:
这种电化学还原-热化学循环分解水制氢的方法,该方法的原理是fe2o3在一定温度下电化学还原为fe,然后在同样温度下生成的fe与水反应产氢。
第一步电化学还原:fe2o3→2fe+3/2o2
第二步水分解产氢:3h2o+2fe→3h2+fe2o3
这种电化学还原-热化学循环分解水制氢的方法先进行电化学还原过程,再进行热化学分解水制氢过程,然后再按照电化学还原过程,热化学分解水制氢过程重复循环。
电化学还原过程:称取23.55g的56.5mol%li0.87na0.63k0.50co3–43.5mol%lioh混合物,再称取1.87g的fe2o3充分研磨混合均匀,以镍片作阳极(1cm×3cm),304不锈钢片(1cm×3cm)作阴极,将阳极和阴极固定,连同研磨混合好的电解质一起装入刚玉坩埚;将刚玉坩埚放入电炉加热升温至500°c,并将阳极和阴极与直流电源连接;接通电源,在0.5a电流下恒电流电解40min,铁在阴极上生成。
热化学水分解产氢过程:电化学还原过程结束,切断电源后,向阴极通入n2携带水蒸气进行水分解产氢反应,n2通入量为50ml/min的n2,将250°c的水蒸气携带吹向不锈钢片阴极与电解形成的新生态fe,反应20min,采用排水集气法收集气体,得到氢气。水蒸气由水通过水蒸气发生器制得,水蒸气发生器一边通入水,一边输送出水蒸气到刚玉坩埚,水通入量为0.1ml/min。
实施例5:
这种电化学还原-热化学循环分解水制氢的方法先进行电化学还原过程,然后再进行热化学分解水制氢过程;
电化学还原过程:称取23.55g的li0.87na0.63k0.50co3,再称取1.87g的氧化亚铁充分研磨混合均匀,以铂片作阳极(1cm×3cm),铁片(1cm×3cm)作阴极,将阳极和阴极固定,连同研磨混合好的电解质一起装入刚玉坩埚;将刚玉坩埚放入电炉加热升温至600°c,并将阳极和阴极与直流电源连接;接通电源,在0.25a电流下恒电流电解60min,铁在阴极上生成。
热化学水分解产氢过程:电化学还原过程结束,切断电源后,向阴极通入n2携带水蒸气进行水分解产氢反应,n2通入量为80ml/min的n2,将200°c的水蒸气携带吹向铁片阴极与电解形成的新生态fe,反应20min,采用排水集气法收集气体,得到氢气。水蒸气由水通过水蒸气发生器制得,水蒸气发生器一边通入水,一边输送出水蒸气到刚玉坩埚,水通入量为0.5ml/min。
实施例6:
这种电化学还原-热化学循环分解水制氢的方法先进行电化学还原过程,然后再进行热化学分解水制氢过程;
电化学还原过程:称取23.55g的li0.87na0.63k0.50co3,再称取1.87g的四氧化三铁充分研磨混合均匀,以铂片作阳极(1cm×3cm),不锈钢片(1cm×3cm)作阴极,将阳极和阴极固定,连同研磨混合好的电解质一起装入刚玉坩埚;将刚玉坩埚放入电炉加热升温至600°c,并将阳极和阴极与直流电源连接;接通电源,在1.0a电流下恒电流电解10min,铁在阴极上生成。
热化学水分解产氢过程:电化学还原过程结束,切断电源后,向阴极通入n2携带水蒸气进行水分解产氢反应,n2通入量为100ml/min的n2,将300°c的水蒸气携带吹向不锈钢片阴极与电解形成的新生态fe,反应30min,采用排水集气法收集气体,得到氢气。水蒸气由水通过水蒸气发生器制得,水蒸气发生器一边通入水,一边输送出水蒸气到刚玉坩埚,水通入量为1.0ml/min。
- 还没有人留言评论。精彩留言会获得点赞!