碘化锂非水溶液、碘化锂、碘化锂的非水溶剂化物、碘化锂非水溶液的制造方法、碘化锂的制造方法和碘化锂的非水溶剂化物的制造方法与流程
1.本公开涉及碘化锂非水溶液、碘化锂、碘化锂的非水溶剂化物、碘化锂非水溶液的制造方法、碘化锂的制造方法和碘化锂的非水溶剂化物的制造方法。
背景技术:
2.碘化锂被用于吸收式冷冻机用的吸收液、乙酸制造用的助催化剂、电池的电解质等。
3.作为碘化锂水溶液及其含水盐的制造方法,非专利文献1中公开了使碳酸锂与氢碘酸反应的方法。另外,非专利文献2中,公开了向在碳酸锂中分散有水的浆料吹入碘化氢气体的方法。
4.碘化锂的吸水性高,认为作为电池的电解质使用时水分含量少为优选。作为低含水量的碘化锂非水溶液的制造方法,专利文献1的实施例中公开了使用分子筛等干燥剂或水分离膜对碘化碱金属的醇溶液或碘化碱土金属的醇溶液进行脱水的方法。
5.另外,专利文献1的参考例中,记载了通过进行使用原甲酸甲酯和甲酸的脱水工序,从而能够降低含水量。
6.碘化锂无水盐可以通过将由碘化锂水溶液得到的其含水盐利用加热等进行脱水的方法而得到。专利文献2中,公开了通过将碘化锂含水盐与在1-丁醇中混合了水的溶剂混合,使碘化锂含水盐中的水分与1-丁醇成分共沸,从而在低温且短时间内得到碘化锂无水盐的制造方法。
7.现有技术文献
8.专利文献
9.专利文献1:日本特开2015-157743号公报
10.专利文献2:日本专利第6006994号公报
11.非专利文献
12.非专利文献1:《化学大辞典9缩印版》、发行所共立出版发行年1993年426页
13.非专利文献2:《新实验化学讲座8无机化合物的合成(ii)》、发行所丸善昭和52年发行462页
技术实现要素:
14.发明要解决的问题
15.碘化锂的吸水性强,具有与水牢固地结合的性质,因此,本发明人等发现,通过以往制法得到的碘化锂非水溶液、碘化锂中包含有一定量的水分,其降低是有限的。即,本发明人等发现,专利文献1的实施例和专利文献2的实施例所记载的方法中,得到的碘化锂非水溶液的含水量为2900ppm左右,得到的固体的碘化锂的含水量为3200ppm左右。
16.另外,专利文献1的参考例所记载的方法中,可以进一步降低碘化锂非水溶液的含水量。然而,通过该方法,甲酸会残留在非水溶液中。非水溶液中残留酸的情况下,作为用于电池用途的碘化锂非水溶液是不优选的。因此,期望通过不残留酸的方法来降低碘化锂非水溶液的含水量。
17.另外,专利文献1所记载的方法中,公开了得到碘化锂
·
醇络合物(碘化锂的醇化物)。此处,在考虑使用碘化锂盐作为电池的电解质的情况下,由于电池的构成(即,正极、负极、电解液等)的组合涉及多方面,因此,从与构成电池的各部件的相容性、相溶性的观点出发,作为碘化锂的溶剂化物,优选能够选择适当的溶剂化物。从这样的观点出发,本发明人等发现除了专利文献1所记载的碘化锂的醇化物以外,还期望得到使用醇以外的适当的非水溶剂的碘化锂的非水溶剂化物。
18.因此,本公开中,课题在于,提供含水量少且酸的含量也少的碘化锂非水溶液、和含水量少且酸的含量也少的碘化锂及它们的制造方法。另外,课题在于,提供由醇以外的非水溶剂和碘化锂形成的碘化锂的非水溶剂化物和其制造方法。
19.用于解决问题的方案
20.本发明人等鉴于上述问题而进行深入研究,结果发现,在非水溶剂中使金属锂与碘反应,可以不使用酸而得到含水量少的碘化锂非水溶液和碘化锂。另外,发现可以得到由醇以外的非水溶剂和碘化锂形成的碘化锂的非水溶剂化物。由这些见解,完成了本公开。
21.即,本公开的碘化锂非水溶液的特征在于,其为含有非水溶剂和碘化锂的碘化锂非水溶液,由上述碘化锂非水溶液中的含水量y(ppm)相对于上述碘化锂非水溶液中的碘化锂浓度x(重量%)而确定的、每单位碘化锂的含水量(y/x)为7以下,源自酸的成分的含量为4000ppm以下。
22.本公开的碘化锂的特征在于,其含水量不足500ppm、源自酸的成分的含量为12000ppm以下。
23.本公开的碘化锂的非水溶剂化物的特征在于,其由醇以外的非水溶剂和碘化锂形成。
24.本公开的碘化锂非水溶液的制造方法的特征在于,通过在非水溶剂中使金属锂与碘反应,从而在上述非水溶剂中生成碘化锂,得到碘化锂非水溶液。本公开中,用于反应的非水溶剂的含水量通常不足10ppm、优选不足1ppm。另外,用于反应的非水溶剂优选实质上不包含源自酸的成分。
25.本公开的碘化锂的制造方法的特征在于,进行使本公开的方法中得到的碘化锂非水溶液干燥的干燥工序,得到含水量不足500ppm、源自酸的成分的含量为12000ppm以下的碘化锂。
26.本公开的碘化锂的非水溶剂化物的制造方法的特征在于,进行使本公开的方法中得到的碘化锂非水溶液干燥的干燥工序,得到由非水溶剂和碘化锂形成的、碘化锂的非水溶剂化物。
27.发明的效果
28.根据本公开,可以提供含水量少且酸的含量也少的碘化锂非水溶液、和含水量少且酸的含量也少的碘化锂及它们的制造方法。
29.另外,可以提供由醇以外的非水溶剂和碘化锂形成的碘化锂的非水溶剂化物和其
制造方法。
附图说明
30.图1为实施例3的碘化锂的xrd谱图。
31.图2为比较例1的碘化锂的xrd谱图。
32.图3为市售品的碘化锂的xrd谱图。
33.图4为实施例3的碘化锂的1h nmr谱图。
34.图5为实施例1的碘化锂非水溶液的阴离子色谱法的谱图。
35.图6为在与图5相同条件下仅导入水并测定得到的空白的阴离子色谱法的谱图。
36.图7为实施例1的碘化锂非水溶液的阳离子色谱法的谱图。
具体实施方式
37.以下,关于本公开进行详细说明,但以下记载的构成要件的说明为本公开的实施方式的一例,并不限定于这些具体的内容。可以在其主旨的范围内进行各种变形并实施。
38.根据本公开的碘化锂非水溶液的制造方法,可以得到含水量少且酸的含量也少的碘化锂非水溶液。
39.首先,关于本公开的碘化锂非水溶液的制造方法进行说明。
40.本公开的碘化锂非水溶液的制造方法的特征在于,通过在非水溶剂中使金属锂与碘反应,从而在上述非水溶剂中生成碘化锂,得到碘化锂非水溶液。若这样的话,可以得到含水量少的碘化锂非水溶液。
41.进而,可以不使用酸而得到含水量少的碘化锂非水溶液。
42.本公开的碘化锂非水溶液的制造方法中,通过在非水溶剂中使金属锂与碘反应,从而在非水溶剂中生成碘化锂。其结果,可以得到以使用的非水溶剂为溶剂、包含碘化锂作为溶质的碘化锂非水溶液。
43.得到的碘化锂非水溶液优选的是,由上述碘化锂非水溶液中的含水量y(ppm)相对于碘化锂非水溶液中的碘化锂浓度x(重量%)而确定的、每单位碘化锂的含水量(y/x)为7以下,源自酸的成分的含量为4000ppm以下。上述每单位碘化锂的含水量(y/x)优选5以下,更优选3以下。另外,得到的碘化锂非水溶液中所包含的源自酸的成分越少越优选,优选实质上不包含。另外,碘化锂非水溶液中所包含的源自酸的成分优选1000ppm以下,可以为250ppm以下,可以为50ppm以下,可以为20ppm以下,可以为10ppm以下。
44.非水溶剂中的金属锂与碘的反应时,不需要特别使用催化剂。因此,无需去除催化剂的工序。另外,无需特别的高温。反应温度优选不足80℃,更优选20~50℃,进而优选20~45℃。另外,优选抑制由反应热导致的升温而使反应温度设为不足80℃,更优选设为20~50℃,进而优选设为20~45℃。
45.对于金属锂的用量,相对于碘1摩尔优选2.1~20.0摩尔,进而优选2.1~5.0摩尔。金属锂与碘的摩尔比率若为上述范围则金属锂与碘的反应顺利地进行,因此,可以提高碘化锂的收率。另外,在过度地添加锂的情况下,反应后锂作为过滤物回收,可以在另一批次的反应中再使用。
46.另外,非水溶剂中投入的金属锂的形态没有特别限定,可以为锂棒、锂箔等形态。
47.反应温度高至80℃以上、体系内包含水、且金属锂的用量相对于碘不是过量的情况下,通过碘化锂与水的反应产生碘化氢和氢氧化锂,作为酸的碘化氢有时包含在碘化锂非水溶液内。因此,优选不成为上述那样有可能产生碘化氢的条件。
48.作为非水溶剂,优选含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂、腈系溶剂、碳酸酯系溶剂、酮系溶剂、酰胺系溶剂和含硫系溶剂组成的组中的至少一种。
49.另外,非水溶剂优选为非质子性溶剂。
50.非水溶剂更优选含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂和酰胺系溶剂组成的组中的至少一种。
51.对于非水溶剂的具体例,作为醚系溶剂,可列举出四氢呋喃、2-甲基四氢呋喃、1,4-二噁烷、二乙醚、1,2-二甲氧基乙烷(以下,也记为dme)、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚、丙二醇二甲醚、二乙二醇二甲醚、二丙二醇二甲醚、3-甲氧基丙腈、甲氧基乙腈、乙二醇双(丙腈)醚等。
52.作为缩醛系溶剂,可列举出1,3-二噁烷、1,3-二氧戊环(以下,也记为dol)、4-甲基二氧戊环、1,3,5-三氧杂已环、二甲氧基甲烷、1,2-亚甲二氧基苯等。
53.作为酯系溶剂,可列举出γ-丁内酯、ε-己内酯、γ-戊内酯、甲酸甲酯、乙酸甲酯、乙酸乙酯、乙酸异丙酯、丙酸甲酯、丙二醇单甲醚乙酸酯等。
54.作为碳酸酯系溶剂,可列举出碳酸亚乙酯、碳酸甲乙酯。
55.作为酮系溶剂,可列举出丙酮。
56.作为酰胺系溶剂,可列举出二甲基甲酰胺、二甲基乙酰胺、n-甲基-2-吡咯烷酮等。
57.需要说明的是,优选非水溶剂不包含醇系溶剂。醇系溶剂与金属锂反应产生氢。从作业环境的安全性的观点出发,产生氢是不优选的,因此,优选不产生氢者。因此,优选使用不包含醇系溶剂的非水溶剂。
58.非水溶剂不包含醇溶剂意味着,通过基于1h nmr的测定,醇的检测量不足10ppm。
59.本公开的碘化锂非水溶液的制造方法中,由于制造时不使用水,因此可以使所制造的碘化锂非水溶液的含水量极少。
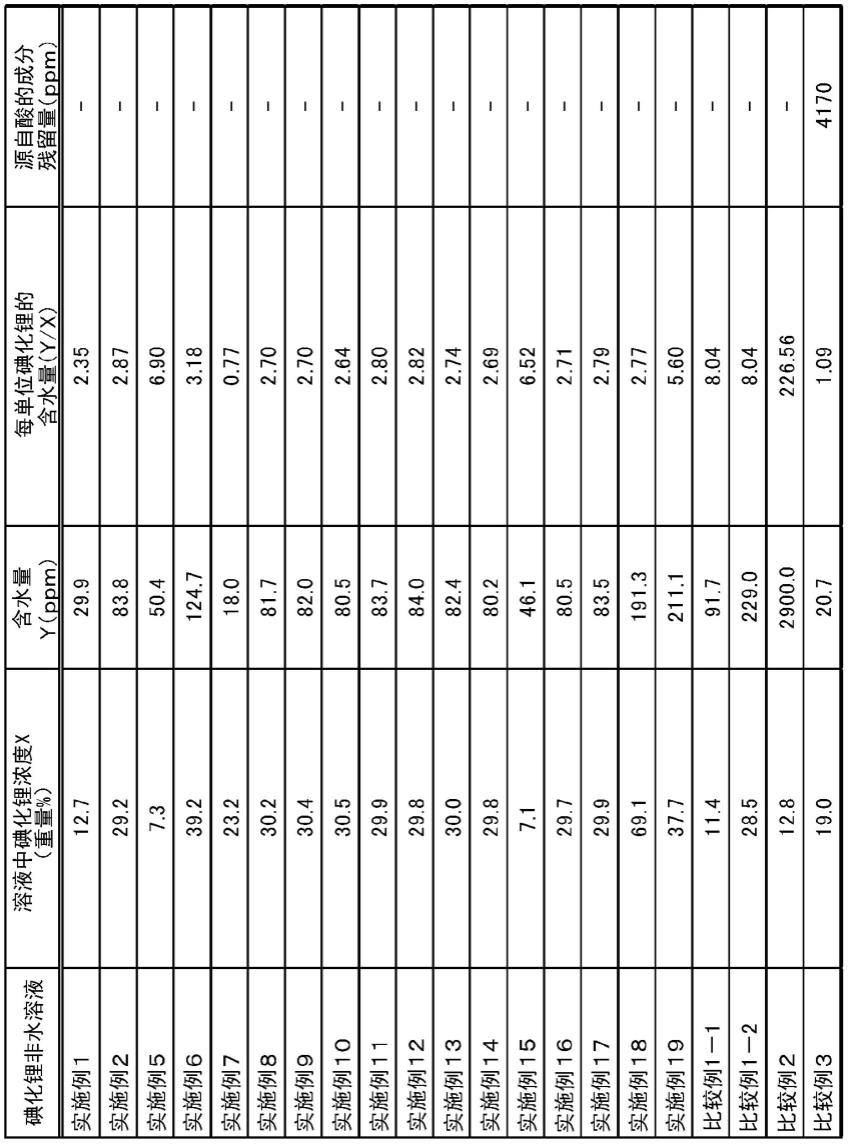
60.专利文献1的参考例中,公开了含水量达到0.00wt%的碘化锂溶液的制造条件,但不能去除干燥工序中使用的源自酸催化剂的杂质。作为电池用途中使用的碘化锂非水溶液的源自酸催化剂的成分的含量优选为50ppm以下,另外,优选实质上不包含源自酸催化剂的成分。
61.已知在电池的电解液中存在酸是不优选的(例如专利第5679719号、日本特开2001-307772号公报等)。
62.本公开的碘化锂非水溶液的制造方法中,与专利文献1的参考例所公开的方法不同,由于制造时不使用酸,因此,所制造的碘化锂非水溶液中包含的源自酸催化剂的成分的含量可以为4000ppm以下。另外,可以在所制造的碘化锂非水溶液中实质上不包含源自酸催化剂的成分。
63.本公开的碘化锂非水溶液的制造方法与以往已知的方法不同,是不使用水的反应,并且也不使用酸。因此,可以制造水分量与以往技术相比格外低、且源自酸的成分少的碘化锂非水溶液。
64.接着,关于本公开的碘化锂非水溶液进行说明。
65.本公开的碘化锂非水溶液的特征在于,其为含有非水溶剂和碘化锂的碘化锂非水溶液,由上述碘化锂非水溶液中的含水量y(ppm)相对于上述碘化锂非水溶液中的碘化锂浓度x(重量%)而确定的、每单位碘化锂的含水量(y/x)为7以下,源自酸的成分的含量为4000ppm以下。
66.本公开的碘化锂非水溶液中,每单位碘化锂的含水量(y/x)为7以下,源自酸的成分的含量为4000ppm以下。即,为含水量和源自酸的成分的含量均少的碘化锂非水溶液。
67.参照后述的实施例1和2可以理解,由于溶液中的含水量y与溶液中的碘化锂浓度x成比例关系,因此,溶液中的含水量的大小以相对于溶液中的碘化锂浓度的含水量为指标来判断是妥当的。因此,可以说每单位碘化锂的含水量(y/x)为7以下的非水溶液是含水量少的碘化锂非水溶液。
68.本公开的碘化锂非水溶液由于每单位碘化锂的含水量(y/x)小至7以下,并且源自酸的成分的含量小至4000ppm以下,因此,可以适合用于电池用途。
69.本公开的碘化锂非水溶液中,上述每单位碘化锂的含水量(y/x)优选5以下,更优选3以下。另外,源自酸的成分的含量优选1000ppm以下,可以为250ppm以下,可以为50ppm以下,可以为20ppm以下,可以为10ppm以下。
70.碘化锂非水溶液中所包含的非水溶剂是电池的电解液中使用的非水溶剂的情况下,不进行特别的纯化操作,可以将在非水溶剂中溶解了碘化锂的碘化锂非水溶液直接作为电池的电解液使用。另外,也可以添加其他必要成分而作为电池的电解液使用。
71.例如,可以含有作为其他电解质的lipf6、libf4、liclo4、lifsi(双(氟磺酰)亚胺锂)等。
72.另外,碘化锂非水溶液可以去除溶剂而形成固体的碘化锂,因此,可以作为用于得到固体的碘化锂的原料使用。
73.碘化锂非水溶液中的碘化锂浓度x优选5~70重量%,进而优选10~50重量%。
74.另外,碘化锂非水溶液中的含水量y优选不足200ppm。另外,优选碘化锂非水溶液实质上不包含水分。碘化锂非水溶液实质上不包含水分是指,意味着在下述说明的含水量测定方法中含水量为检测极限以下(0.1ppm以下)。
75.另外,最优选在碘化锂非水溶液中实质上不包含源自酸的成分。
76.碘化锂非水溶液实质上不包含源自酸的成分是指,意味着在下述说明的源自酸的成分的含量的测定方法中未检测到源自酸的成分(检测极限以下)。
77.碘化锂非水溶液中的碘化锂浓度的测定可以通过使用阴离子色谱法的以下的顺序而进行。
78.精密称量碘化锂非水溶液,使用用超纯水稀释至约10ppm的水溶液、用阴离子色谱法测定碘化物离子浓度。然后,由碘化物离子浓度换算成碘化锂浓度。
79.碘化锂非水溶液中的含水量可以使用电量法卡尔费舍尔水分计进行测定。测定碘化锂非水溶液中的含水量的情况下,可以精密称量碘化锂非水溶液的试样约1g,进行直接分析。
80.本说明书中的碘化锂非水溶液中的含水量是指,意味着使用电量法卡尔费舍尔水分计对碘化锂非水溶液的试样约1g进行测定而得到的含水量(ppm)。
81.碘化锂非水溶液中的源自酸的成分的含量的测定可以通过使用1h nmr进行侧链
氢的定量,从而进行作为有机酸的源自酸的成分的含量的测定。另外,可以通过使用阴离子色谱法来测定碘化物离子以外的阴离子成分的浓度,从而进行作为无机酸的源自酸的成分的含量的测定。
82.本说明书中的碘化锂非水溶液中的源自酸的成分的含量是指,意味着通过使用1h nmr进行侧链氢的定量,从而作为有机酸测定得到的源自酸的成分的含量(ppm)。
83.在使用1h nmr的侧链氢的定量中未检测到侧链氢(10ppm以下)、且使用阴离子色谱法未检测到碘化物离子以外的阴离子(100ppm以下)的情况下,可以说在碘化锂非水溶液中实质上不包含源自酸的成分。
84.作为碘化锂非水溶液中所包含的非水溶剂,优选含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂、腈系溶剂、碳酸酯系溶剂、酮系溶剂、酰胺系溶剂和含硫系溶剂组成的组中的至少一种。
85.另外,优选非水溶剂为非质子性溶剂。
86.更优选非水溶剂含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂和酰胺系溶剂组成的组中的至少一种。
87.对于非水溶剂的具体例,作为醚系溶剂,可列举出四氢呋喃、2-甲基四氢呋喃、1,4-二噁烷、二乙醚、1,2-二甲氧基乙烷(以下,也记为dme)、二甘醇二甲醚、三甘醇二甲醚、四甘醇二甲醚、丙二醇二甲醚、二乙二醇二甲醚、二丙二醇二甲醚、3-甲氧基丙腈、甲氧基乙腈、乙二醇双(丙腈)醚等。
88.作为缩醛系溶剂,可列举出1,3-二噁烷、1,3-二氧戊环(以下,也记为dol)、4-甲基二氧戊环、1,3,5-三氧杂已环、二甲氧基甲烷、1,2-亚甲二氧基苯等。
89.作为酯系溶剂,可列举出γ-丁内酯、ε-己内酯、γ-戊内酯、甲酸甲酯、乙酸甲酯、乙酸乙酯、乙酸异丙酯、丙酸甲酯、丙二醇单甲醚乙酸酯等。
90.作为碳酸酯系溶剂,可列举出碳酸亚乙酯、碳酸甲乙酯。
91.作为酮系溶剂,可列举出丙酮。
92.作为酰胺系溶剂,可列举出二甲基甲酰胺、二甲基乙酰胺、n-甲基-2-吡咯烷酮等。
93.需要说明的是,优选非水溶剂不包含醇系溶剂。
94.接着,关于本公开的碘化锂的制造方法进行说明。
95.本公开的碘化锂的制造方法的特征在于,进行使本公开的方法中得到的碘化锂非水溶液干燥的干燥工序,得到含水量不足500ppm、源自酸的成分的含量为12000ppm以下的碘化锂。
96.本公开的碘化锂的制造方法中,进行使本公开的方法中得到的碘化锂非水溶液干燥的干燥工序。
97.作为干燥的方法,可以使用利用干燥机的热风干燥、减压干燥、红外线干燥等方法。
98.干燥工序优选包括将碘化锂非水溶液在非活性气体气氛下减压的工序,更优选包括将碘化锂非水溶液在非活性气体气氛下以0.1kpa以上且5.0kpa以下减压、且将此时的气氛温度保持在20℃以上且100℃以下的工序。
99.另外,优选在非活性气体气氛下或干燥室环境下进行直至将干燥得到的碘化锂保管在容器中的保管工序,以避免干燥得到的碘化锂被环境中的水蒸气吸湿。优选干燥室环
境的露点为例如-30℃以下的环境。
100.干燥温度高至超过100℃、且体系内包含水的情况下,通过碘化锂与水的反应产生碘化氢和氢氧化锂,作为酸的碘化氢有时包含在碘化锂内。因此,优选不成为上述那样有可能产生碘化氢的条件。
101.得到的碘化锂的含水量不足500ppm、源自酸的成分的含量为12000ppm以下。
102.上述碘化锂的含水量优选不足400ppm,更优选不足200ppm,进而优选不足100ppm。另外,也优选碘化锂实质上不包含水。
103.另外,得到的碘化锂中所包含的源自酸的成分越少越优选,优选实质上不包含。另外,碘化锂中所包含的源自酸的成分优选2500ppm以下,可以为400ppm以下,可以为50ppm以下,可以为20ppm以下,可以为10ppm以下。
104.需要说明的是,干燥工序中,不进行使用酸催化剂的干燥。因此,源自酸的成分不会由于干燥工序而增加,因此,若本公开的方法中得到的碘化锂非水溶液中所包含的源自酸的成分的含量为4000ppm以下,则可以使碘化锂中所包含的源自酸的成分的含量为12000ppm以下。
105.接着,关于本公开的碘化锂进行说明。
106.本公开的碘化锂的特征在于,其含水量不足500ppm、源自酸的成分的含量为12000ppm以下。
107.本公开的碘化锂为含水量极少、源自酸的成分的含量也极少的、固体的碘化锂。本公开的碘化锂可以为粉体。
108.本公开的碘化锂的含水量极少、源自酸的成分的含量也极少,因此,可以作为电池的电解质优选使用。另外,将本公开的碘化锂溶解于不包含水和源自酸的成分的非水溶剂,从而可以作为含水量和源自酸的成分的含量极少的电池的电解液使用。
109.碘化锂的含水量优选不足400ppm,更优选不足200ppm,进而优选不足100ppm。另外,优选碘化锂实质上不包含水。
110.碘化锂实质上不包含水分是指,意味着在下述说明的含水量测定方法中含水量为检测极限以下(0.1ppm以下)。
111.另外,本公开的碘化锂中,源自酸的成分的含量可以为2500ppm以下,可以为400ppm以下,可以为50ppm以下,可以为20ppm以下,可以为10ppm以下。
112.另外,最优选碘化锂实质上不包含源自酸的成分。
113.碘化锂实质上不包含源自酸的成分是指,意味着在下述说明的源自酸的成分的含量的测定方法中未检测到源自酸的成分。
114.碘化锂中的含水量可以使用电量法卡尔费舍尔水分计进行测定。测定碘化锂中的含水量的情况下,可以精密称量碘化锂的试样约1g,使其溶解于水分量已知的甲醇约2g,作为测定试样进行分析。
115.本说明书中的碘化锂中的含水量是指,意味着使碘化锂的试样约1g溶解于水分量已知的甲醇约2g,使用电量法卡尔费舍尔水分计测定得到的含水量(ppm)。
116.碘化锂的源自酸的成分的含量的测定可以通过使用1h nmr进行侧链氢的定量,从而进行作为有机酸的源自酸的成分的含量的测定。另外,可以通过使用阴离子色谱法来测定碘化物离子以外的阴离子成分的浓度,从而进行作为无机酸的源自酸的成分的含量的测
定。
117.本说明书中的碘化锂中的源自酸的成分的含量是指,意味着通过使用1h nmr进行侧链氢的定量,从而作为有机酸测定得到的源自酸的成分的含量(ppm)。
118.在使用1h nmr的侧链氢的定量中未检测到侧链氢、且使用阴离子色谱法未检测到碘化物离子以外的阴离子的情况下,可以说在碘化锂中实质上不包含源自酸的成分。
119.本公开的碘化锂优选包含碘化锂的非水溶剂化物。
120.非水溶剂化物中所包含的非水溶剂优选含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂、腈系溶剂、碳酸酯系溶剂、酮系溶剂、酰胺系溶剂和含硫系溶剂组成的组中的至少一种。
121.另外,优选非水溶剂化物中所包含的非水溶剂为非质子性溶剂。
122.非水溶剂化物中所包含的非水溶剂更优选含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂和酰胺系溶剂组成的组中的至少一种。
123.另外,优选碘化锂具有晶体结构。
124.碘化锂为非水溶剂化物、碘化锂具有晶体结构可以通过1h nmr分析和xrd分析来判断。
125.通过使本公开的碘化锂溶解于非水溶剂,也可以得到本公开的碘化锂非水溶液。非水溶剂的种类没有特别限定,可以使用能够用于本公开的碘化锂非水溶液的非水溶剂。另外,使碘化锂溶解的非水溶剂可以为与制造碘化锂时所使用的非水溶剂不同的非水溶剂。
126.接着,关于本公开的碘化锂的非水溶剂化物的制造方法和碘化锂的非水溶剂化物进行说明。
127.本公开的碘化锂的非水溶剂化物的制造方法的特征在于,进行使本公开的方法中得到的碘化锂非水溶液干燥的干燥工序,得到由非水溶剂和碘化锂形成的、碘化锂的非水溶剂化物。
128.通过该方法,可以得到由非水溶剂和碘化锂形成的、碘化锂的非水溶剂化物。
129.对于这样的碘化锂的非水溶剂化物,从与构成电池的各部件的相容性、非相溶性的观点出发,可以选择适当的物质来使用。
130.本公开的碘化锂的非水溶剂化物的制造方法中,在使用醇以外的非水溶剂作为非水溶剂的情况下,可以得到特征在于由醇以外的非水溶剂和碘化锂形成的、本公开的碘化锂的非水溶剂化物。
131.醇以外的非水溶剂优选含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂、腈系溶剂、碳酸酯系溶剂、酮系溶剂、酰胺系溶剂和含硫系溶剂组成的组中的至少一种。
132.另外,优选醇以外的非水溶剂为非质子性溶剂。
133.另外,醇以外的非水溶剂更优选含有选自由醚系溶剂、缩醛系溶剂、酯系溶剂和酰胺系溶剂组成的组中的至少一种。
134.另外,优选碘化锂的非水溶剂化物具有晶体结构。
135.碘化锂为非水溶剂化物、碘化锂的非水溶剂化物具有晶体结构可以通过1h nmr分析和xrd分析来判断。
136.实施例
137.以下,通过实施例对本发明进行具体说明,但本发明不限定于这些实施例。
138.〔碘化锂收率、纯度的测定方法〕
139.精密称量碘化锂非水溶液或碘化锂粉体试样约0.2g,使用用超纯水稀释至约10ppm的水溶液,利用阴离子色谱法测定碘化物离子浓度。将由测定结果得到的值换算成碘化锂浓度,作为收率、纯度。
140.〔粉体和溶液中的含水量的测定方法〕
141.使用电量法卡尔费舍尔水分计进行测定。
142.在液体试样的情况下,精密称量试样约1g,进行直接分析。
143.在固体试样的情况下,精密称量碘化锂粉体试样约1g,使其溶解于水分量已知的甲醇约2g,作为测定试样。
144.〔粉体中的非水溶剂量的测定方法〕
145.通过1h nmr分析进行定量。精密称量碘化锂非水溶剂化物约1g、和作为内标物质的1,4-三氟甲基苯约0.1g,使其溶解于氘代乙腈约2g,作为测定用溶液。通过源自内标物质的峰与源自非水溶剂的峰的积分值比率而算出粉体中的非水溶剂量。
146.〔化学试剂〕
147.用于合成的各化学试剂使用由下述购入的无需进行进一步纯化的试剂。
148.1,3-二氧戊环(以下记为“dol”):sigma-aldrich japan k.k.制
149.1,2-二甲氧基乙烷(以下记为“dme”)电化学用:关东化学株式会社制
150.1,3,5-三氧杂已环(以下记为“tox”):sigma-aldrich japan k.k.制
151.二乙二醇二甲醚(以下记为“dg”)电化学用:关东化学株式会社制
152.3-甲氧基丙腈(以下记为“mpn”):东京化成株式会社制
153.乙酸乙酯(以下记为“etoac”)超脱水:fujifilm wako pure chemical corporation制
154.碳酸亚乙酯(以下记为“ec”)锂电池等级:kishida chemical co.,ltd.制
155.碳酸甲乙酯(以下记为“emc”)锂电池等级:kishida chemical co.,ltd.制
156.丙酮(以下记为“ac”)超脱水:fujifilm wako pure chemical corporation制
157.γ-丁内酯(以下记为“gbl”)电化学用:关东化学株式会社制
158.n-甲基-2-吡咯烷酮(以下记为“nmp”):nacalai tesque,inc.制锂箔厚度0.1mm、宽18mm:本城金属株式会社制
159.锂棒直径10mm、长度10mm:honjo chemical corporation制
160.碘:株式会社合同资源制
161.[实施例1](碘化锂非水溶液的制作1)
[0162]
将具备搅拌叶片、热电偶保护管和浸渍管的1l sus316制高压釜设置在氩气气氛手套箱内,投入锂棒9.63g(1.41摩尔)、dol 265g。密封反应容器后,减压至0.05kpa以下,在将使碘63.5g(0.250摩尔)溶解于dme 217g的溶液导入的同时,将手套箱内的温度维持为45℃以下。导入总量的碘后,搅拌10小时继续熟化。反应中的溶液的最高温度为45℃。开放反应容器后,过滤剩余的锂,得到收率97.7%、513g的碘化锂非水溶液。得到的非水溶液中的含水量为29.9ppm、碘化锂的浓度为12.7重量%。
[0163]
[实施例2](碘化锂非水溶液的制作2)
[0164]
在氩气气氛的手套箱内、向具备搅拌子、内部温度计的50ml的2颈烧瓶投入碘3.63g(0.0143摩尔)、dol 5.05g、dme 4.14g。接着,在将锂箔210mg(0.0300摩尔)各少量地导入的同时,将手套箱内的温度维持为45℃以下。导入总量的锂后,搅拌10小时继续熟化。反应中的溶液的最高温度为45℃。
[0165]
过滤剩余的锂箔,得到收率94.6%、12.4g的碘化锂非水溶液。得到的非水溶液中的含水量为83.8ppm、碘化锂的浓度为29.2重量%。
[0166]
[实施例5](碘化锂非水溶液的制作3)
[0167]
在氩气气氛的手套箱内、向具备搅拌子、内部温度计的50ml的2颈烧瓶投入锂箔40mg(0.0058摩尔)、dol 5.05g。密封反应容器后,减压至0.05kpa以下,在将使碘0.65g(0.0026摩尔)溶解于dme 4.14g的溶液导入的同时,将手套箱内的温度维持为45℃以下。导入总量的碘后,搅拌10小时继续熟化。反应中的溶液的最高温度为45℃。释放反应容器后,过滤剩余的锂,得到收率97.7%、9.2g的碘化锂非水溶液。得到的非水溶液中的含水量为50.4ppm、碘化锂的浓度为7.3重量%。
[0168]
[实施例6](碘化锂非水溶液的制作4)
[0169]
使用锂箔320mg(0.0461摩尔)、dol 2.86g、碘5.44g(0.0214摩尔)、dme6.43g,除此以外,利用与实施例5同样的方法,得到收率96.6%、14.1g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为124.7ppm、碘化锂的浓度为39.2重量%。
[0170]
[实施例7](碘化锂非水溶液的制作5)
[0171]
使用锂箔990mg(0.1426摩尔)、dol 6.43g、碘3.63g(0.0143摩尔)、dme2.86g,除此以外,利用与实施例5同样的方法,得到收率95.3%、12.3g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为18.0ppm、碘化锂的浓度为23.2重量%。
[0172]
[实施例8](碘化锂非水溶液的制作6)
[0173]
使用锂箔210mg(0.0303摩尔)、dol 5.05g、碘3.63g(0.0143摩尔)、代替dme的dg 2.86g,除此以外,利用与实施例5同样的方法,得到收率96.4%、12.2g的碘化锂非水溶液。反应中的溶液的最高温度为43℃。得到的非水溶液中的含水量为81.7ppm、碘化锂的浓度为30.2重量%。
[0174]
[实施例9](碘化锂非水溶液的制作7)
[0175]
使用锂箔210mg(0.0303摩尔)、代替dol的tox 5.05g、碘3.63g(0.0143摩尔)、dme 2.86g,除此以外,利用与实施例5同样的方法,得到收率96.9%、12.2g的碘化锂非水溶液。反应中的溶液的最高温度为41℃。得到的非水溶液中的含水量为82.0ppm、碘化锂的浓度为30.4重量%。
[0176]
[实施例10](碘化锂非水溶液的制作8)
[0177]
使用锂箔210mg(0.0303摩尔)、代替dol的tox 5.05g、碘3.63g(0.0143摩尔)、代替dme的dg 2.86g,除此以外,利用与实施例5同样的方法,得到收率97.7%、12.3g的碘化锂非水溶液。反应中的溶液的最高温度为39℃。得到的非水溶液中的含水量为80.5ppm、碘化锂的浓度为30.5重量%。
[0178]
[实施例11](碘化锂非水溶液的制作9)
[0179]
在氩气气氛的手套箱内、向具备搅拌子、内部温度计的50ml的2颈烧瓶投入锂箔210mg(0.0303摩尔)、dol 5.05g、dme 4.14g。接着,使用漏斗,在将碘3.63g(0.0143摩尔)导入的同时,将手套箱内的温度维持为45℃以下。导入总量的碘后,搅拌10小时继续熟化。反应中的溶液的最高温度为45℃。释放反应容器后,过滤剩余的锂,得到收率94.8%、12.1g的碘化锂非水溶液。得到的非水溶液中的含水量为83.7ppm、碘化锂的浓度为29.9重量%。
[0180]
[实施例12](碘化锂非水溶液的制作10)
[0181]
不使用dme,使用dol 9.19g,除此以外,利用与实施例11同样的方法,得到收率95.3%、12.2g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为84.0ppm、碘化锂的浓度为29.8重量%。
[0182]
[实施例13](碘化锂非水溶液的制作11)
[0183]
不使用dol,使用mpn 9.19g,除此以外,利用与实施例12同样的方法,得到收率94.9%、12.1g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为82.4ppm、碘化锂的浓度为30.0重量%。
[0184]
[实施例14](碘化锂非水溶液的制作12)
[0185]
不使用dol,使用etoac 9.19g,除此以外,利用与实施例12同样的方法,得到收率94.3%、12.1g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为80.2ppm、碘化锂的浓度为29.8重量%。
[0186]
[实施例15](碘化锂非水溶液的制作13)
[0187]
不使用dol,使用ec 5.05g、emc 4.14g,使用锂箔40mg(0.0058摩尔)、碘0.65g(0.0026摩尔),除此以外,利用与实施例12同样的方法,得到收率94.8%、9.2g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为46.1ppm、碘化锂的浓度为7.1重量%。
[0188]
[实施例16](碘化锂非水溶液的制作14)
[0189]
使用代替dol的ac 9.19g,除此以外,利用与实施例12同样的方法,得到收率93.8%、12.1g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为80.5ppm、碘化锂的浓度为29.7重量%。
[0190]
[实施例17](碘化锂非水溶液的制作15)
[0191]
使用代替dol的gbl 9.19g,除此以外,利用与实施例12同样的方法,得到收率95.1%、12.2g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为83.5ppm、碘化锂的浓度为29.9重量%。
[0192]
[实施例18](碘化锂非水溶液的制作16)
[0193]
使用代替dol的nmp 9.19g,使用锂箔1.04g(0.150摩尔)、碘18.0g(0.0709摩尔),除此以外,利用与实施例12同样的方法,得到收率98.5%、27.1g的碘化锂非水溶液。反应中的溶液的最高温度为45℃。得到的非水溶液中的含水量为191.3ppm、碘化锂的浓度为69.1重量%。
[0194]
[实施例19](碘化锂非水溶液的制作17)
[0195]
在氩气气氛的手套箱内、向具备搅拌子、内部温度计的50ml的2颈烧瓶投入锂箔280mg(0.0403摩尔)、dol 2.86g。密封反应容器后,减压至0.05kpa以下,在将使碘5.44g(0.0214摩尔)溶解于dme 6.43g的溶液投入的同时,将手套箱内的温度维持为45℃以下。反
应中的溶液的最高温度为45℃。导入总量的碘后,搅拌10小时继续熟化,得到收率90.6%、13.8g的碘化锂非水溶液。得到的非水溶液中的含水量为211.1ppm、碘化锂的浓度为37.7重量%。
[0196]
需要说明的是,本实施例1、2、5~19中由于未使用酸等干燥剂,因此,在体系中不存在源自该干燥剂(酸)的成分。将结果示于表1。
[0197]
[实施例3](固体的碘化锂的制作1)
[0198]
将实施例1中得到的碘化锂非水溶液79.9g放入具备搅拌子的500ml的3颈烧瓶中,缓慢地减压至0.1kpa并进行溶剂去除。向在氩气气氛的手套箱中得到的固体物28.3g添加200ml的dme,搅拌悬浮液1小时后,进行粉体的过滤,接着,将粉体在0.05kpa下干燥2小时,从而得到25.7g的粉体。
[0199]
该粉体通过1h nmr和xrd分析结果,确认到包含碘化锂-dme络合物(碘化锂的dme化物)的碘化锂。粉体中的非水溶剂的含量为61.6重量%、含水量为94.9ppm。
[0200]
[实施例4](固体的碘化锂的制作2)
[0201]
将实施例2中得到的碘化锂非水溶液10.0g放入具备搅拌子的500ml的3颈烧瓶中,缓慢地减压至0.1kpa并进行溶剂去除。在氩气气氛手套箱中得到的固体物7.9g中添加200ml的dme,搅拌悬浮液1小时后,进行粉体的过滤,接着,将粉体在0.05kpa下干燥2小时,从而得到7.4g的粉体。该粉体通过1h nmr和xrd分析结果,确认到包含碘化锂-dme络合物(碘化锂的dme化物)的碘化锂。粉体中的非水溶剂的含量为59.0重量%、含水量为116.0ppm。
[0202]
[实施例20](固体的碘化锂的制作3)
[0203]
将实施例5中得到的碘化锂非水溶液10.0g放入具备搅拌子的500ml的3颈烧瓶中,缓慢地减压至0.1kpa并进行溶剂去除。向在氩气气氛的手套箱中得到的固体物8.0g添加200ml的dme,搅拌悬浮液1小时后,进行粉体的过滤,接着,将粉体在0.05kpa下干燥2小时,从而得到7.5g的粉体。
[0204]
该粉体通过1h nmr和xrd分析结果,确认到包含碘化锂-dme络合物(碘化锂的dme化物)的碘化锂。粉体中的非水溶剂的含量为59.9重量%、含水量为97.2ppm。
[0205]
[实施例21](固体的碘化锂的制作4)
[0206]
使用实施例6中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到8.3g的粉体。粉体中的非水溶剂的含量为53.3重量%、含水量为92.8ppm。
[0207]
[实施例22](固体的碘化锂的制作5)
[0208]
使用实施例7中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到5.8g的粉体。粉体中的非水溶剂的含量为61.1重量%、含水量为96.5ppm。
[0209]
[实施例23](固体的碘化锂的制作6)
[0210]
使用实施例8中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到7.6g的粉体。粉体中的非水溶剂的含量为59.7重量%、含水量为83.3ppm。
[0211]
[实施例24](固体的碘化锂的制作7)
[0212]
使用实施例9中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到7.6g的粉体。粉体中的非水溶剂的含量为60.1重量%、含水量为84.0ppm。
[0213]
[实施例25](固体的碘化锂的制作8)
[0214]
使用实施例10中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到7.7g的粉体。粉体中的非水溶剂的含量为61.6重量%、含水量为89.6ppm。
[0215]
[实施例26](固体的碘化锂的制作9)
[0216]
使用实施例11中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到7.4g的粉体。粉体中的非水溶剂的含量为58.7重量%、含水量为73.7ppm。
[0217]
[实施例27](固体的碘化锂的制作10)
[0218]
使用实施例12中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到7.3g的粉体。粉体中的非水溶剂的含量为58.4重量%、含水量为77.9ppm。
[0219]
[实施例28](固体的碘化锂的制作11)
[0220]
使用实施例13中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到5.0g的粉体。粉体中的非水溶剂的含量为54.1重量%、含水量为60.3ppm。
[0221]
[实施例29](固体的碘化锂的制作12)
[0222]
使用实施例14中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到6.2g的粉体。粉体中的非水溶剂的含量为53.0重量%、含水量为65.1ppm。
[0223]
[实施例30](固体的碘化锂的制作13)
[0224]
使用实施例15中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到1.2g的粉体。粉体中的非水溶剂的含量为53.9重量%、含水量为53.8ppm。
[0225]
[实施例31](固体的碘化锂的制作14)
[0226]
使用实施例16中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到7.4g的粉体。粉体中的非水溶剂的含量为59.6重量%、含水量为82.2ppm。
[0227]
[实施例32](固体的碘化锂的制作15)
[0228]
使用实施例17中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到5.8g的粉体。粉体中的非水溶剂的含量为51.2重量%、含水量为82.4ppm。
[0229]
[实施例33](固体的碘化锂的制作16)
[0230]
使用实施例18中得到的碘化锂非水溶液10.0g,除此以外,利用与实施例20同样的方法,得到6.0g的粉体。粉体中的非水溶剂的含量为50.4重量%、含水量为89.2ppm。
[0231]
需要说明的是,本实施例3、4、20~33中由于未使用酸等干燥剂,因此,在体系中不存在源自该干燥剂(酸)的成分。将结果示于表2。
[0232]
[比较例1(比较例1-1、比较例1-2)](比较用的固体的碘化锂和碘化锂非水溶液的制作1)
[0233]
将按照非专利文献1记载的方法合成得到的碘化锂(含水量7290ppm)300g放入1l的茄型烧瓶中,使用蒸发器边搅拌边减压至1kpa后,在80℃下进行1小时、在100℃下进行1小时、在120℃下进行2小时的干燥。
[0234]
将烧瓶用氮气复压后,在手套箱内将附着于烧瓶壁面的晶体削落,然后,在120℃、1kpa下进一步进行6小时的加热干燥。从烧瓶内用氮气复压直至将晶体削落并在120℃、1kpa下干燥2小时为止的操作再重复2次、总计进行3次,得到经减压干燥的碘化锂298g。测定得到的粉体的含水量,结果含水量为524.0ppm。该粉体通过1h nmr和xrd分析结果,确认到不包含碘化锂的非水溶剂化物。需要说明的是,本比较例中由于未使用酸等干燥剂,因此,在体系中不存在源自该干燥剂(酸)的成分。将结果示于表2。
[0235]
另外,将上述中得到的粉体在dol:dme=1:1(容量比)的混合溶剂中溶解,使非水溶液中的碘化锂的浓度成为表1所示的浓度,测定得到的非水溶液的含水量。
[0236]
将碘化锂的浓度与实施例1的碘化锂的浓度相匹配的例子作为比较例1-1,将碘化锂的浓度与实施例2的碘化锂的浓度相匹配的例子作为比较例1-2。
[0237]
需要说明的是,本比较例中,由于未使用酸等干燥剂,因此,在体系中不存在源自该干燥剂(酸)的成分。将结果示于表1。
[0238]
[比较例2](比较用的固体的碘化锂和碘化锂非水溶液的制作2)
[0239]
按照专利文献1的方法进行了碘化锂的合成。将具备搅拌装置、带旋塞的分馏头的回流冷却器、具备温度计、滴液漏斗和固体投入口的容量200ml的反应容器内用氮气充分地置换。从该滴液漏斗向反应容器内投入乙醇70.0g。在搅拌下、从该固体投入口投入氢氧化锂一水合物4.25g(0.101摩尔)。从该滴液漏斗向反应容器内投入碘甲烷21.5g(0.151摩尔)。将反应容器内的温度保持为30℃的同时搅拌21小时并继续熟化。
[0240]
将反应容器内冷却至室温,利用真空泵减压至1kpa,从而蒸馏去除过多的碘甲烷和生成的甲乙醚。将反应容器内的减压状态通过氮气解除之后,从滴液漏斗投入乙醇19.8g。反应液中的水分为43300ppm。
[0241]
在该反应容器中,拆下回流冷却器、分馏头、滴液漏斗和固体投入口,安装填充了合成沸石(商品名:分子筛3a-1/8)43.1g的索氏提取器。然后,将反应容器加热至乙醇开始回流,回流9小时并继续脱水。冷却后,反应液中的含水量为2900ppm、碘化锂的浓度为12.8重量%。需要说明的是,本比较例中由于未使用酸等干燥剂,因此,在体系中不存在源自该干燥剂(酸)的成分。将结果示于表1。
[0242]
将反应液放入容量200ml的茄型烧瓶中,使用蒸发器在75℃/3kpa的条件下用1小时蒸馏去除乙醇。然后,在130℃/1kpa的条件下用3小时进一步使反应液浓缩干固,得到白色粉末状的碘化锂的晶体13.2g(收率97.4%)。碘化锂的纯度为99.1%,晶体中的含水量为3200ppm。该粉体通过1h nmr和xrd分析结果,确认到不包含碘化锂的非水溶剂化物。需要说明的是,本实施例中由于未使用酸等干燥剂,因此,在体系中不存在源自该干燥剂(酸)的成分。将结果示于表2。
[0243]
[比较例3](比较用的固体的碘化锂和碘化锂非水溶液的制作3)
[0244]
将专利文献1的方法作为参考进行碘化锂的合成。
[0245]
将具备搅拌装置、带旋塞的分馏头的回流冷却器、具备温度计、滴液漏斗和固体投入口的容量200ml的反应容器内用氮气充分地置换。从该滴液漏斗向反应容器内投入乙醇70.0g。在搅拌下、从该固体投入口投入氢氧化锂一水合物4.25g(0.101摩尔)。从该滴液漏斗向反应容器内投入碘甲烷21.5g(0.151摩尔)。将反应容器内的温度保持为30℃的同时搅拌21小时并继续熟化。
[0246]
将反应容器内冷却至室温,利用真空泵减压至1kpa,从而蒸馏去除过多的碘甲烷和生成的甲乙醚。将反应容器内的减压状态通过氮气解除之后,从滴液漏斗投入乙醇19.8g。反应液中的水分为43300ppm。
[0247]
从反应混合物中、在减压下蒸馏去除乙醇之后,从该滴液漏斗向反应容器内投入2-丙醇15g。
[0248]
在搅拌下、从该滴液漏斗投入原甲酸甲酯7.43g(0.070摩尔)和甲酸0.12g(0.003
摩尔)。将反应容器内的温度保持为50℃并搅拌3小时继续熟化。冷却至室温后,测定反应液中的含水量,结果为20.7ppm、源自酸的成分的残留量为4170ppm。需要说明的是,本比较例中,未去除反应系中所包含的源自甲酸的成分,因此,反应系中所包含的源自甲酸的成分100%残留。将结果示于表1。
[0249]
将得到的反应混合物放入具备搅拌子的100ml的2颈烧瓶,在80℃下缓慢地减压至0.1kpa并进行溶剂去除。将得到的粉体在0.05kpa下干燥2小时,得到粉体。该粉体通过1h nmr,确认到包含碘化锂-2-丙醇络合物(碘化锂的2-丙醇化物)的碘化锂。粉体中的非水溶剂的含量为11.0重量%、含水量为167.0ppm。
[0250]
将得到的粉体0.5g溶解于氘代甲醇2g,加入1,4-三氟甲基苯作为内标物质,使用1h nmr进行源自甲酸的成分的定量,结果确认了相当于源自酸的成分的残留量14400ppm、添加量的69.2%的甲酸锂的残留。将结果示于表2。
[0251]
[表1]
[0252][0253]
[表2]
[0254][0255]
根据表1和表2可知,实施例1~33中,可以得到含水量少、未包含源自酸的成分的碘化锂非水溶液、和固体(粉体)的碘化锂。
[0256]
与实施例1相比,实施例2的含水量y大,但实施例2的碘化锂浓度x也大。从每单位碘化锂的含水量(y/x)来看,实施例1和实施例2可以说是含水量相同程度少的碘化锂非水溶液。
[0257]
与实施例1相比,实施例5是以碘的用量少、且金属锂的用量相对于碘1摩尔变少的方式调整的碘化锂非水溶液,与实施例1相比,溶液中碘化锂浓度x低、含水量y变大。
[0258]
与实施例5相比,实施例6是金属锂和碘的用量多、增加溶液中的dol比率而调整的碘化锂非水溶液,与实施例5相比,溶液中碘化锂浓度x高、含水量y变大。
[0259]
与实施例6相比,实施例7是金属锂的用量多、增加溶液中的dme比率而调整的碘化锂非水溶液,与实施例6相比,溶液中碘化锂浓度x低、含水量y变小。
[0260]
与实施例5相比,实施例8是代替dme使用dg而调整的碘化锂非水溶液,与实施例5相比,金属锂和碘的用量多、溶液中碘化锂浓度x和含水量y变高。
[0261]
与实施例5相比,实施例9是代替dol使用tox而调整的碘化锂非水溶液,与实施例5相比,金属锂和碘的用量多、溶液中碘化锂浓度x和含水量y变高。
[0262]
与实施例9相比,实施例10是代替dme使用dg而调整的碘化锂非水溶液,与实施例9相比,溶液中碘化锂浓度x和含水量y为相同水平。
[0263]
与实施例5相比,实施例11是在溶液中导入粒状的碘颗粒而调整的碘化锂非水溶液,与实施例5相比,金属锂和碘的用量多、溶液中碘化锂浓度x和含水量y变高。
[0264]
与实施例11相比,实施例12是未使用dme、仅使用dol而调整的碘化锂非水溶液,与实施例11相比,溶液中碘化锂浓度x和含水量y为相同水平。
[0265]
与实施例11相比,实施例13是未使用dol、dme、替代地使用mpn而调整的碘化锂非水溶液,与实施例11相比,溶液中碘化锂浓度x和含水量y为相同水平。
[0266]
与实施例11相比,实施例14是未使用dol、dme、替代地使用etoac而调整的碘化锂非水溶液,与实施例11相比,溶液中碘化锂浓度x和含水量y为相同水平。
[0267]
与实施例11相比,实施例15是金属锂和碘的用量少、未使用dol、dme、替代地使用ec、emc而调整的碘化锂非水溶液,与实施例11相比,溶液中碘化锂浓度x低、含水量y变小。
[0268]
与实施例11相比,实施例16是未使用dol、dme、替代地使用ac而调整的碘化锂非水溶液,与实施例11相比,溶液中碘化锂浓度x和含水量y为相同水平。
[0269]
与实施例11相比,实施例17是未使用dol、dme、替代地使用gbl而调整的碘化锂非水溶液,与实施例11相比,溶液中碘化锂浓度x和含水量y为相同水平。
[0270]
与实施例11相比,实施例18是金属锂和碘的用量多、未使用dol、dme、替代地使用nmp而调整的碘化锂非水溶液,与实施例11相比,溶液中碘化锂浓度x高、含水量y变大。
[0271]
实施例19是以实施例6的金属锂的用量相对于碘1摩尔成为不足2.1摩尔的方式调整的碘化锂非水溶液,与实施例6相比,溶液中碘化锂浓度x低、含水量y变大。
[0272]
另外,对于金属锂的用量相对于碘1摩尔为2.1~20.0摩尔的、金属锂和碘的用量满足规定的关系的实施例1~18而言,与不满足上述规定的关系的实施例19相比,收率变得更高。
[0273]
比较例1-1是以碘化锂浓度成为与实施例1相同程度的方式调整的碘化锂非水溶液,但与实施例1相比,含水量y变大。比较例1-2是以碘化锂浓度成为与实施例2相同程度的方式调整的碘化锂非水溶液,但与实施例2相比,含水量y变大。比较例1-1和比较例1-2中的任一者从每单位碘化锂的含水量(y/x)来看可知均比实施例1和2大。
[0274]
比较例2的每单位碘化锂的含水量(y/x)变大。
[0275]
比较例3的每单位碘化锂的含水量(y/x)小,但源自酸的成分有残留,故不优选。
[0276]
实施例3和4以及实施例20~33的碘化锂的含水量少,比较例1和2的碘化锂的含水量变多。
[0277]
比较例3的碘化锂的含水量少,但源自酸的成分有残留,故不优选。
[0278]
以下,关于实施例的碘化锂非水溶液和碘化锂的分析数据进行说明。
[0279]
图1为实施例3的碘化锂的xrd谱图。
[0280]
图2为比较例1的碘化锂的xrd谱图。
[0281]
图3为市售品的碘化锂的xrd谱图。
[0282]
比较图2和图3时,xrd中的峰位置大致相同。即,市售品的碘化锂和比较例1的碘化锂的结构相同,不包含碘化锂的非水溶剂化物。
[0283]
另一方面,图1中可以看到多个图2和图3中没有表示的峰。该峰表明存在碘化锂的非水溶剂化物。
[0284]
图4是实施例3的碘化锂的1h nmr谱图。
[0285]
该谱图中,示出了起因于非水溶剂dme的峰(3.4ppm:-och
2-、3.3ppm:ch3o-)。另一方面,未示出起因于甲酸的峰(7.9~8.2ppm)(7.9ppm中发现的峰是内标物质的1,4-三氟甲基苯)。
[0286]
由此可知,实施例3的碘化锂包含与dme的非水溶剂化物,不包含甲酸等酸。
[0287]
图5为实施例1的碘化锂非水溶液的阴离子色谱法的谱图。
[0288]
图6为在与图5相同条件下仅导入水而测定的空白的阴离子色谱法的谱图。
[0289]
图5中,在21min附近观察到碘化物离子的峰。在16~17min附近观察到的峰与空白中观察到的峰相同,因此,相当于噪声。即,图5中观察到的峰中,只有21min附近观察到的碘
化物离子的峰为有效峰。
[0290]
碘化锂非水溶液中存在源自酸的成分的情况下,应观察到碘化物离子以外的阴离子(例如甲酸离子),但碘化物离子以外的阴离子观察不到。由此可知,碘化锂非水溶液中不存在源自酸的成分。
[0291]
图7为实施例1的碘化锂非水溶液的阳离子色谱法的谱图。
[0292]
图7中,在5min附近观察到锂离子的峰,其他峰观察不到。
[0293]
结合图5所示的结果可知,实施例1的碘化锂非水溶液中,仅存在碘化锂作为离子化的成分。
[0294]
产业上的可利用性
[0295]
可以提供能够用于电池用途的、含水量少且酸的含量也少的碘化锂非水溶液和含水量少且酸的含量也少的碘化锂。
[0296]
本技术以2020年7月16日提出的日本国专利申请2020-122068号为基础,要求基于巴黎公约或进入国家的法规的优先权。该申请的内容全部作为参照援引至本技术中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1