一种柱芳烃纳米硒及其制备方法与防治油菜菌核病中的应用
1.本发明涉及纳米材料技术领域,具体涉及一种柱芳烃纳米硒及其制备方法与防治油菜菌核病中的应用。
背景技术:
2.核盘菌(s.sclerotiorum)是一种全球性的、普遍存在的、寄主广泛的植物致病性真菌,可感染400多种植物物种。包括大多数十字花科蔬菜,尤其是油菜大豆等许多经济作物。油菜在中国和世界其它地区广泛种植,是生物燃料和食用油的重要来源。但是由于缺乏有效的防止手段,油菜菌核病导致油菜每年的产量损失10%-30%,严重时产量下降至80%。近年来,该病症逐年加重,已成为影响油菜产量和治疗的重要因素之一。
3.目前,化学药物仍然是防治油菜菌核病的主要手段,多菌灵(carbendazim)目前是一种应用广泛,并且具有广谱高效、低毒、内吸性的苯并咪唑类杀菌剂,其原理是干扰病原菌有丝分裂中纺锤体的形成,影响细胞分裂,起到杀菌作用。但是由于长期单一使用多菌灵进行防治,导致核盘菌田间菌株对产生了抗药性。此外,植株吸收率低进一步导致了多菌灵生物利用率低。调查发现每年合成农药(包括除草剂、杀虫剂、杀菌剂和其他农用化学品)使用量高达35亿公斤,而生物吸收率仅为0.1%,加之浸出、蒸发、漂移等原因直接导致90%的农药流失,造成严重的环境污染和健康威胁。因此,如何提高多菌灵的生物利用率降低耐药性成为亟待解决的问题。
4.随着人们对核盘菌的研究深入发现核盘菌分泌的草酸(oa)在核盘菌的致病过程中起决定作用。它可以通过降低侵染区ph值,在感染早期抑制ros的产生和植物的初级防御反应,增加真菌的致病性。
5.近年来随着纳米技术的发展,纳米材料的独特结构和理化性质已广泛应用于药物递送、医学、环境修复等领域。然而,并未有现有报道将柱芳烃纳米硒用于防治核盘菌并促进植物生长。因此,进一步提高一种能用于防治核盘菌以及能够促进植物生长的柱芳烃纳米硒,尤其是提供一种具有ph响应性的柱芳烃纳米硒对于精准释放多菌灵具有重要的应用价值。
技术实现要素:
6.为了克服现有技术中存在的至少之一的技术问题,本发明首先提供了一种柱芳烃纳米硒的制备方法。
7.本发明所要解决的上述技术问题通过以下技术方案予以解决:
8.一种柱芳烃纳米硒的制备方法,其包含如下步骤:
9.(1)将模板剂加入到水中,然后再加入zn和na2seo3搅拌均匀后得分散液;在分散液中加入还原剂,接着将ph调节至中性或碱性,搅拌反应至溶液呈鲜红色后,将溶液进行固液分离;去除固体中的模板剂得红色固体,将红色固体加入到peg-sh水溶液中搅拌反应,反应结束后得多孔纳米硒(mse nps);
10.(2)将多孔纳米硒(mse nps)分散在水中,然后加入含有季铵盐柱[5]芳烃和甲基橙的水溶液进行搅拌反应,反应结束后收集沉淀,即得所述的柱芳烃纳米硒。
[0011]
优选地,步骤(1)中模板剂、水、zn、na2seo3、还原剂以及peg-sh水溶液的用量比为0.15~0.25mmol:15~20ml:0.12~0.18mmol:0.8~0.12mmol:0.15~0.25mmol:2~4ml.
[0012]
最优选地,步骤(1)中模板剂、水、zn、na2seo3、还原剂以及peg-sh水溶液的用量比为0.2mmol:16ml:0.15mmol:0.1mmol:0.2mmol:3ml。
[0013]
优选地,步骤(1)中所述的模板剂为十六烷基三甲基溴化铵。
[0014]
优选地,步骤(1)中所述的还原剂选自l-抗坏血酸、硼氢化钠、柠檬酸、天冬氨酸、谷氨酸和维甲酸中的一种或一种以上的混合。
[0015]
优选地,步骤(1)中将ph调节至6~9;
[0016]
最优选地,步骤(1)中将ph调节至8。
[0017]
优选地,步骤(1)中的搅拌反应是指搅拌反应1~3h。
[0018]
最优选地,步骤(1)中的搅拌反应是指搅拌反应2h。
[0019]
优选地,步骤(1)peg-sh水溶液中peg-sh的含量为1~2mg/ml。
[0020]
优选地,步骤(2)中多孔纳米硒、水以及含有季铵盐柱[5]芳烃和甲基橙的水溶液的用量比为8~12mg:8~12ml:0.8~1.2ml。
[0021]
最优选地,步骤(2)中多孔纳米硒、水以及含有季铵盐柱[5]芳烃和甲基橙的水溶液的用量比为10mg:10ml:1ml。
[0022]
优选地,含有季铵盐柱[5]芳烃和甲基橙的水溶液中季铵盐柱[5]芳烃的浓度为0.5~1mm;
[0023]
含有季铵盐柱[5]芳烃和甲基橙的水溶液中甲基橙的浓度为0.1~0.5mm。
[0024]
优选地,步骤(2)中所述的搅拌是指搅拌8~16h。
[0025]
最优选地,步骤(2)中所述的搅拌是指搅拌12h。
[0026]
本发明还提供了一种由上述制备方法制备得到的柱芳烃纳米硒。
[0027]
本发明还提供了一种上述柱芳烃纳米硒在防治油菜菌核病中的应用。
[0028]
本发明还提供了一种上述柱芳烃纳米硒在制备具有抗核盘菌作用的抗菌剂或制备植物生长促进剂中的应用。
[0029]
优选地,所述的柱芳烃纳米硒作为载体在制备具有抗核盘菌作用的抗菌剂或制备植物生长促进剂中的应用。
[0030]
优选地,柱芳烃纳米硒负载有多菌灵;其中,柱芳烃纳米硒和多菌灵的质量比为1:1~1:5。
[0031]
进一步优选地,柱芳烃纳米硒和多菌灵的质量比为1:1~1:2。
[0032]
有益效果:
[0033]
(1)本发明提供了一种由全新制备方法制备得到的柱芳烃纳米硒;本发明创新的采用季铵盐柱[5]芳烃结合甲基橙修饰多孔纳米硒,制备得到的柱芳烃纳米硒可直接保存和使用,并且具有一定的抗核盘菌以及促进植物生长作用;因此,可以用于防治油菜菌核病和作为植物生长促进剂使用。
[0034]
(2)本发明所述的柱芳烃纳米硒作为多菌灵的载体,相对于传统的纳米硒以及单纯的农药,所述的柱芳烃纳米硒具有高负载效率,解决长期、单一使用多菌灵造成的利用率
低、耐药性等的问题,并且增强植物的抗氧化能力。
[0035]
(3)采用本发明所述的柱芳烃纳米硒负载多菌灵后,通过季铵盐柱[5]芳烃和甲基橙包裹多孔纳米硒,有效提高了多孔纳米硒的环境响应性;季铵盐柱[5]芳烃对称的柱状结构和富含电子的内腔实现对多菌灵进一步富集,增加载药量。
[0036]
(4)采用本发明所述的柱芳烃纳米硒负载多菌灵后可以在核盘菌染区的低ph下实现对多菌灵的精准控制释放,最大限度的减少药物的损失,在最大药效下高效灭活核盘菌,以阻止其进一步入侵植物。
[0037]
(4)本发明所述的柱芳烃纳米硒在水溶液中具有良好的稳定性和分散性,可在室温环境中保存使用。
附图说明
[0038]
图1是多孔纳米硒(mse)的透射电镜图和比表面检测图;其中,图1a、图1b为mse的tem图;图1c为mse的n2吸附-解吸等温线;图1d为mse的孔径分布图。
[0039]
图2是加载多菌灵的柱芳烃纳米硒(car@mam nps)的透射电镜图;其中,图2a、图2b为car@mam nps的tem图;图2c为mse、加载多菌灵的多孔纳米硒(car@mse)、car@mam nps的红外光谱图。
[0040]
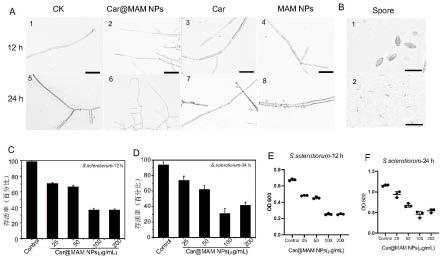
图3是多菌灵(car)、加载多菌灵的柱芳烃纳米硒(car@mam nps)、柱芳烃纳米硒(mam nps)对核盘菌菌丝体和孢子(spore)的损伤结果图;其中图3a为核盘菌正常菌丝体、100μg/ml的car@mam nps、car、mam nps处理12h、24h的菌丝光学显微镜图像;图3b为100μg/mlcar@mam nps处理12h、24h的孢子光学显微镜图像;图3c、图3d分别为不同浓度的(25μg/ml、50、100、200)car@mam nps与菌液共孵育12h、24核盘菌的存活率;图3e、图3f分别为对应的菌液在600nm的od值。
[0041]
图4是不同浓度的加载多菌灵的柱芳烃纳米硒促进油菜植株生长图;其中,图4a为(50、100、200μg/ml)car@mam nps与油菜种子孵育12h、24h、48h的发芽情况;图4b为48h后对应的油菜种子的发芽率;图4c为对应的4周后统计的油菜根、径的长度;图4d为正常油菜(未处理)、100μg/mlcar@mam nps处理4周后拍摄的油菜生长图。
具体实施方式
[0042]
以下结合具体实施例来进一步解释本发明,但实施例并不限定本发明的范围。下列实施例中所述的peg-sh选用的是分子量为2000的cooh-peg-sh;如未特殊说明,实施例中的所有物料均为常规物料,均可从商业渠道获得。
[0043]
下列实施例中所述的季铵盐柱[5]芳烃的具体制备方法如下:首先,在氮气气氛下,将四溴甲烷(23.81mmol)在0℃下缓慢加入到含有对苯二酚双(2-羟乙基)醚(10mmol)和三苯膦(21.81mmol)的50ml无水乙腈中的混合物中;在反应混合物达到室温后,再搅拌4小时;然后,加入40毫升冷水;产物沉淀为白色固体并通过真空过滤收集,用甲醇/水洗涤3次,然后从甲醇中重结晶;真空干燥白色晶体,得到化合物1;将制备得到的化合物1溶解在二氯甲烷(230ml)中,然后加入多聚甲醛(30.87mmol)和三氟化硼乙醚合物(33.86mmol)得混合溶液,并将溶液在室温下搅拌2小时得反应混合物;然后,将反应混合物用水、饱和碳酸氢钠溶液和盐水洗涤,有机层用无水硫酸钠干燥并真空浓缩;将残余物通过硅胶色谱法纯化,使
用二氯甲烷/己烷(27:23)作为洗脱剂,得到化合物白色固体2;取化合物2(1.19mmol)溶于乙醇(100ml)中,加入三甲胺(48.11mmol),并将反应在回流下搅拌过夜;然后,将混合物在真空下过滤,并将获得的固体用乙醇洗涤;将产物在真空下干燥,得到最终产物季铵盐柱[5]芳烃化合物(简称为ap5)。
[0044]
实施例1柱芳烃纳米硒的制备
[0045]
(1)将0.2mmol的十六烷基三甲基溴化铵(ctab)溶于16ml蒸馏水中在常温下搅拌至澄清,再加入0.15mmol zn、0.1mmol na2seo3、常温搅拌4h,得到均匀分散的溶液;在上述均匀分散的溶液中滴加0.2mmol l-抗坏血酸,然后加入氢氧化钠调节至ph=8,持续搅拌6h,得到鲜红色溶液;反应完成后离心洗涤3次,将固体分散于由体积比为19:1的无水乙醇和盐酸(质量分数为37%浓盐酸)组成的混合溶液中,冰浴,搅拌12h以洗去模板剂;接着用丙酮洗涤3次,经冷冻干燥后得到红色固体;将上述所得红色固体加入到3ml含5mg peg-sh的水溶液中,并在室温下搅拌2h,离心并用pbs缓冲液洗3次,得多孔纳米硒(简称为mse nps);
[0046]
(2)取10mg多孔纳米硒分散在10ml蒸馏水中,然后逐滴加入1ml置于4℃过夜的含有季铵盐柱[5]芳烃和甲基橙的水溶液(其中,季铵盐柱[5]芳烃和的甲基橙浓度分别为0.5mm),室温搅拌12h;离心收集沉淀并洗涤3次后得柱芳烃纳米硒(简称为mam nps)。
[0047]
实施例2加载多菌灵的柱芳烃纳米硒的制备
[0048]
(1)将0.2mmol的十六烷基三甲基溴化铵(ctab)溶于16ml蒸馏水中在常温下搅拌至澄清,再加入0.15mmol zn、0.1mmol na2seo3、常温搅拌4h,得到均匀分散的溶液;在上述均匀分散的溶液中滴加0.2mmol l-抗坏血酸,然后加入氢氧化钠调节至ph=8,持续搅拌6h,得到鲜红色溶液;反应完成后离心洗涤3次,将固体分散于由体积比为19:1的无水乙醇和盐酸(质量分数为37%浓盐酸)组成的混合溶液中,冰浴,搅拌12h以洗去模板剂;接着用丙酮洗涤3次,经冷冻干燥后得到红色固体;将上述所得红色固体加入到3ml含5mg peg-sh的水溶液中,并在室温下搅拌2h,离心并用pbs缓冲液洗3次,得多孔纳米硒(简称为mse nps);
[0049]
(2)将20mg含多菌灵(car)置于15ml无水乙醇中超声处理10min得到均匀溶液,再将上述得到的多孔纳米硒10mg加入上述溶液,常温搅拌24h;随后将所得混合物离心、洗涤并干燥得car@mse固体,将所得固体重悬于10ml蒸馏水中,然后逐滴加入1ml置于4℃过夜的含有季铵盐柱[5]芳烃和甲基橙的水溶液(其中,季铵盐柱[5]芳烃和的甲基橙浓度分别为0.5mm),室温搅拌12h;离心收集沉淀并洗涤3次后得加载多菌灵的柱芳烃纳米硒(简称为car@mam nps)。
[0050]
对上述制备得到的car@mam nps进行透视电镜观察,结果见图2。实验结果:通过透射电镜(tem)结果显示所合成的mse呈绒毛状、多孔结构均匀分布在其表面,粒径大约为70nm左右,通过氮气吸附脱附实验进一步检测显示mse nps为明显的多孔结构,其孔径主要集中在2.817nm。柱芳烃和甲基橙修饰之后的多孔纳米硒纳米粒径则增加到约为100nm,紫外和红外则表明季铵盐柱芳烃和甲基橙成功修饰在多孔纳米硒上。
[0051]
实施例2加载多菌灵的柱芳烃纳米硒在不同ph、不同时间对多菌灵的累积释放实验
[0052]
car@mam nps的药物释放实验通过紫外-可见光谱来监测不同时间间隔的
carbendazim分子的吸光度来进行。简而言之,将(1mg/ml,3ml)的car@mam nps置于透析袋(mwco 8000-14000)中,然后浸入含有不同ph值(分别为(100ml,ph 2、3、4和7)的pbs缓冲液的烧杯中,在25℃下,以100rpm的搅拌速度激活基于季铵盐柱[5]芳烃(简称为ap5)和甲基橙(简称为mo)的纳米。carbendazim的最大吸收波长为281nm,释放的carbendazim的量可以通过溶解在pbs缓冲液中的carbendazim的浓度和carbendazim的吸光度制成的标准曲线来确定。
[0053]
实验结果:ap5和mo作为mse的封端剂,可以有效地防止carbendazim从纳米载体中过早释放,正如紫外-可见光谱所证实的那样。carbendazim的紫外-可见吸收光谱表明,其在281nm处具有最大吸收波长,并且carbendazim的浓度与281nm处的吸光度之间存在良好的线性关系。为了研究car@mam nps的ph响应释放情况,我们将car@mam nps分别置于ph为2、3、4、7的pbs缓冲溶液中进行实验。实验结果表明,随着时间的增加,相比于中性条件,car@mam nps在酸性条件下的累积释放量在任何时间段都远高于中性组。这是由于mo中的so
3-基团的质子化导致mo和ap5之间的主客体相互作用减弱。在40h,ph=2的药物累积释放量达到95%左右,ph=7的药物累积释放量为40%左右。这说明,car@mam nps在ph(2-4)下,具有精准的响应释放,有利于提高药物的利用率,并可能在短时间内大量累积在核盘菌周围,从而提高核盘菌的灭活率。
[0054]
实施例3多菌灵、载多菌灵的柱芳烃纳米硒、柱芳烃纳米硒对核盘菌的形态损伤实验。
[0055]
(1)光学显微镜观察:将(直径5mm)sclerotinia sclerotiorum的菌饼分别接种在含有car、car@mam nps、mam nps的pda培养基中,浓度均为100μg/ml(以空白pda培养基为对照组)。在第12h和第24h时,切下菌落边缘的菌丝体,用pbs缓冲液(0.1mm,ph 7.2)彻底冲洗,并在光学显微镜下观察以鉴定形态变化。每个处理重复三次。同时,用15ml pbs缓冲液(0.1mm,ph 7.2)洗涤sclerotinia sclerotiorum新鲜孢子,然后用血细胞计数器检测孢子数,孢子悬液(2
×
106cfu/ml)。在不同处理组中孵育12h后,通过光学显微镜鉴定孢子的形态变化。结果如图3。
[0056]
(2)s.sclerotiorum存活率的定量分析:分别用不同浓度的纳米材料(25μg/ml、50、100、200)与菌液于(30℃,200rpm)条件下共孵育12h、24h后,分别检测其在600nm处的od值并计算存活率。结果如图3。
[0057]
实验结果:通过对不同组分处理后的核盘菌菌丝体和孢子的形态观察,进一步确定了car@mam nps的生物活性。光学显微镜图像显示,在没有任何处理的pda培养基中(ck组),核盘菌的菌丝体呈现出光滑且规则的结构(图a)。然而,在含有car、car@mam nps、mam nps的pda培养基中接种12h、24h后,菌丝结构发生明显变化,呈现变形、肿胀、断裂、宽度不规则,菌丝体失去光滑表面(图a)。由此可见,本发明制备得到的car@mam nps以及mam nps均具有一定的抗核盘菌作用。
[0058]
此外,在光学显微镜观察下,ck组的核盘菌孢子,表现出丰满,和完整的梭形结构(图b1)。然而,在用浓度为100μg/ml的car@mam nps在pda中处理24h后,无菌水冲洗得到的孢子变干、畸形、扁平(图b2),表明car@mam nps有效抑制了菌丝体和孢子的生长。同时,浓度为100μg/ml的car@mam nps与菌液孵育24h后,其菌液光密度相比于对照组明显减小,存活率降到40%以下。光学显微镜以及菌液存活率的量化都表明,car@mam nps在体外具有良
好的抑制核盘菌生长的效果。
[0059]
实施例4不同浓度的柱芳烃纳米硒对油菜植株的生物相容性实验。
[0060]
为了进一步确定其有效抑菌浓度,同时降低因用药量导致对植物的毒性,我们分别对油菜种子的发芽率、4周龄油菜植株生长情况进行评估。将油菜种子分别浸泡在水、50、100、200μg/ml的car@mam nps溶液中,记录油菜种子12h~48h的发芽情况。从其发芽与生长情况来看,三种浓度的car@mam nps处理过的油菜均能发芽,结果见图4。
[0061]
实验结果:水以及三种浓度的油菜种子发芽率分别为13%、13.3%、45%、8.67%。四周后,均长成多片叶幼苗,均表现出很好的生物安全性,其中幼苗的根和茎有不同程度的增长。可以发现的是,我们的纳米制剂对于油菜长期生长来说都没有安全问题。并且低浓度的car@mam nps可提高种子发芽率,并能促进植株茎叶部位的伸长,高浓度(200μg/ml)下可能不利于植物根系的生长,但不会影响植物其他器官的发育,可能是长期暴露于高浓度纳米制剂,使其逐渐聚集于植物根部。综上,可以初步证明,car@mam nps对于植株的生长没有明显的毒害作用,具有良好的生物相容性,促进植株生长。为了保证良好的抗菌效果和植物生长的需求,建议选用具有良好生物相容性的100μg/ml的car@mam nps作为后续实验的施用浓度。
[0062]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1