多级PCR检测HPV的方法和试剂盒与流程
本发明涉及生物和检测领域,具体地,本发明涉及多级PCR检测HPV的方法和试剂盒及其应用。
背景技术:
人乳头瘤病毒是乳头瘤病毒科(Papillomaviridae)的成员,是具有8000bp环状基因组的DNA肿瘤病毒。已知,人乳头瘤病毒(HPV)与某些肿瘤的发病率显示强烈的相关。
HPV在99%宫颈癌病人中可检测到。以流行病学资料为基础,在感染的病人中,不同HPV基因型在形成宫颈癌中不会造成相同的风险水平。根据这些发现基因型可分为低风险、中等风险和高风险等级,除了这些,也存在未分类的基因型。因为风险在很大的范围内变化,并且HPV感染的发病率很高,所以确定基因型极为重要。
已确定了很多的乳头瘤病毒序列,见此处引用作为参考的出版物:HPV-6:de Villiers等人,J.Virology,40(1981);HPV-11:Dartmann等人,Virology151,124-130(1986);HPV-16:Seedorf等人,Virology145,181-185(1985);HPV-18:Cole和Danos,Journal of Molecular Biology93,599-608(1987);HPV-31:Goldsborough等人,Virology171,306-311(1989);HPV-33:Cole和Streeck,J.Virology,58,991-995(1986);HPV-54:Favre等人,J.Cancer45,40-46(1990);HPV-56:J.,Gen.Virol.70,3099(1989)。
DNA检测是测定一种灵敏的检测HPV的方法。主要包括三类:
第一类是直接探针结合法,如有HPV类型特异性探针的Sourthern印迹和点印迹等法。但其缺点是低灵敏度、操作繁琐费时及需要大量纯化的HPV探针。
第二类是信号放大法,如杂交捕获法(Digene公司)和bDNA法(Bayer公司)。杂交捕获(HybridCapture)法是美国Digene公司的检测HPV DNA的技术(HC2),是目前美国获得FDA批准并在国际上临床最广泛使用的一种检测HPV DNA的检测技术,HC2可以检测出混合高危型HPV,该试剂盒用的是一套核酸杂交信号扩增 系统杂交捕获二代试验(HC2)HPV DNA检测试剂,能同时检测13种高危型HPV(HPV16,18,31,33,35,39,45,51,52,56,58,59和68)。然而,HC2最大的缺点是,不能检测出单一高危HPV基因型。当同一高危HPV型持续感染病人时,则感染者患宫颈癌的机率显著增加,此时,HC2的用途就极其有限了。另外,HC2检测存在着高比率的假阴性和假阳性。
第三类方法是基于PCR的靶序列片段扩增技术,应用PCR对特异性HPV靶序列片段进行扩增,用型特异性的寡核苷酸探针鉴别HPV型别。HPV DNA检测法的优点是:取样简便,检测及结果报告人为因素影响极少,适合在宫颈癌高危人群中进行大规模的初筛。但存在与HC2类似的缺点。
该类目前主要检测方法有:特异性PCR(Type-specific PCR)法:该法根据E6、E7基因的变异区设计型特异性的引物进行PCR分析(Walboomers,1999),其灵敏度大约在几十至数百个HPV拷贝每反应,随HPV型别不同而稍有差异。然而,因为每份样本都需要同时作多份PCR,则导致无法高通量的使用。
PCR是涉及通过多个循环,指数扩增某种多核苷酸序列的技术。PCR技术是众所周知的,并且已经被广泛使用。
PCR技术一般包括以下步骤:变性多核苷酸,然后将至少一对引物寡核苷酸退火到变性的多核苷酸上(使引物与变性的多核苷酸模板杂交)。退火步骤之后,具有聚合酶活性的酶,使用最初的变性多核苷酸作为合成模板,催化合成一条新的掺入了引物寡核苷酸的多核苷酸链。这一系列步骤(变性、引物退火和引物延伸)构成一个PCR循环。
随着循环的重复,新合成的多核苷酸的量指数增加,因为由较早循环新合成的多核苷酸可用作后续循环的合成模板。
DNA的变性一般发生在约90-95℃,引物一般在约40-60℃退火至变性的DNA,用聚合酶延伸退火的引物的步骤一般在约70-75℃进行。因此,在PCR循环中,必须改变反应混合物(反应体系)的温度,在多循环PCR实验中要多次改变。
PCR技术具有广泛的生物学应用,包括例如,DNA序列分析、探针产生、克隆核酸序列、定位诱变、检测基因突变、诊断病毒感染、分子“指纹分析”和监测生物液体和其他来源中的污染微生物。
然而,在实际应用中,无论的常规PCR反应还是多重PCR反应体系,如果环境或操作过程中引入极少量外源性DNA污染,就可能出现假阳性结果。为了防止污染,一些实验不得不在高度洁净的操作设备或操作室进行。
在PCR反应过程中,各种试验条件控制不当很容易导致扩增失败,降低其灵敏度和特异性。
此外,现有PCR技术能够检测的灵敏度还难以令人满意,尤其是在对含量极低的核酸样品(如仅含1-10个拷贝目标序列的样品)。在活检、尸检样品中检测病原体(如HPV)时,因无关核酸物质的存在,检测灵敏度一直难以提高。
综上所述,目前还缺乏在封闭反应体系中,对PCR扩增产物简便有效地进行定量或半定量转移的方法。
因此本领域迫切需要开发一种灵敏度高、特异性好、抗干扰能力强的HPV型别的鉴定方法。
技术实现要素:
本发明的目的就是提供一种灵敏度高、特异性好、抗干扰能力强的PCR反应设备和方法。
本发明的第一方面,提供了一种鉴别HPV型别的方法,包括步骤:
(a)在封闭的第一级PCR反应腔或隔室中,以HPV基因组DNA为模板,通过HPV特异性的第一引物对进行扩增,从而获得第一扩增产物P1;
(b)将第一扩增产物从第一级PCR隔室转移至第二级PCR隔室中,作为第二级PCR的模板,并在封闭的第二级PCR隔室中,通过HPV特异性的第二引物对进行扩增,从而获得第二扩增产物P2;
(c)任选地,将上一步骤的扩增产物Pi从第i级PCR隔室转移至第i+1级PCR隔室中,作为第i+1级PCR的模板,并在封闭的第i+1级PCR隔室中,通过HPV特异性的第i+1引物对进行扩增,从而获得第i+1扩增产物Pi+1,其中i为≥2的正整数;本步骤可进行一次或多次;
(d)对上一步骤中获得的所述第二扩增产物P2或所述第i+1扩增产物Pi+1,进行测序,从而获得HPV的序列;和
(e)将测得的HPV序列与HPV标准序列进行比对,从而鉴别出HPV的型别。
在另一优选例中,在步骤(b)和(c)中,将第j扩增产物Pj从第j级PCR隔室转移至第j+1级PCR隔室过程中,第j级PCR隔室和第j+1级PCR隔室都处于封闭状态,其中j为≥1的正整数,并且在第j级PCR隔室和第j+1级PCR隔室之间设有封闭的或可封闭的连接通道,所述连接通道用于让携带PCR扩增产物的固体颗粒从Pj级隔室(或 上游隔室)转移至Pj+1级隔室(或下游隔室)。
在另一优选例中,在步骤(a)、(b)和(c)的整个过程中,所有的PCR隔室都处于封闭状态。
在另一优选例中,在步骤(a)中,第一级PCR隔室中放置有可携带PCR扩增产物的固体颗粒,从而在PCR反应过程中或之后,形成携带PCR扩增产物的固体颗粒。
在另一优选例中,所述的固体颗粒是磁性微球。
在另一优选例中,在步骤(b)和(c)中,利用磁铁或电磁铁,通过所述携带PCR扩增产物的固体颗粒,将第j扩增产物Pj从第j级PCR隔室转移至第j+1级PCR隔室,其中j为≥1的正整数。
在另一优选例中,所述的第一引物对选自下组:简并引物MY09/11(Bosch,1995)及其改进型PGMY09/11(Gravitt PE,1998);SPF1/2(Reesink-Peters N,2001)。
在另一优选例中,所述的第二引物对选自下组:
MY11/GP6;PGMY11/GP6;MY11/GP6+;PGMY11/GP6+;
MY09/GP5;PGMY09/GP5;MY09/GP5+;PGMY09/GP5+。
在另一优选例中,当i=2时,所述的第三引物对选自下组:通用引物GP5和GP6(De Roda Husman AM,1995);GP5+和GP6+(Hutchinson,1994)。
在另一优选例中,在步骤(d)中,将GP5、GP6、GP5+和/或GP6+作为通用引物,进行测序。
在另一优选例中,用步骤(d1)替换步骤(d)和(e):
(d1)对上一步骤中获得的所述第二扩增产物P2或所述第i+1扩增产物Pi+1,用HPV型别特异性探针进行杂交,并根据杂交结果鉴别出HPV的型别。
在另一优选例中,在步骤(e)中,所述的HPV标准序列包括选自下组的一种或多种HPV型别的标准序列:HPV16、18、31、33、35、39、45、51、52、56、58、59、66、67、68、69、73、82、26、53、6、11、40、42、43、44、54、61、70、72、和81。
在另一优选例中,所述的HPV标准序列包括已知的所有HPV型别的标准序列。
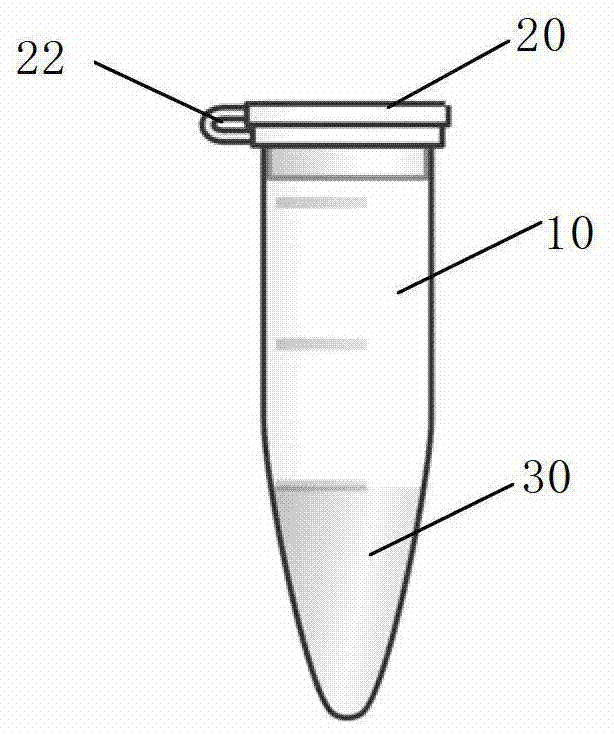
在另一优选例中,步骤(a)、(b)和(c)在多级PCR反应管中进行,其中所述反应管包括二个或多个可封闭的的PCR反应腔或隔室(10),并且在至少两个隔室之间设有封闭的或可封闭的连接通道(40),所述连接通道用于让携带PCR扩增产物的固体颗粒(50)从一个隔室(或上游隔室)转移至另一隔室(或下游隔室)。
在另一优选例中,所述的反应管包括n个隔室,其中n为2-5000的任一正整数。
在另一优选例中,所述的反应管包括M个多级组,各多级组分别具有2、3、4或5个相互连通的隔室,其中M为1-1000的任一正整数。
在另一优选例中,所述的PCR反应管的隔室呈直链构型、支链构型、或环形构型;和/或
所述的隔室呈矩阵排列,所述矩阵为a×b矩阵,其中a为2-100的正整数,b为2-100的正整数。
在另一优选例中,所述的隔室具有腔盖(20),并且对于相互连通的多个隔室而言,当各自的腔盖全部盖上后,就构成一个封闭空间。
在另一优选例中,所述连接通道位于反应腔或隔室上部。
在另一优选例中,当所述上游隔室盖上腔盖后,所述连接通道在上游隔室的入口隔室上部,并且位于腔盖下沿下方,从而使得携带PCR扩增产物的固体颗粒被抬升从而离开位于隔室下方的反应体系后,进入所述入口,经过连接通道,再通过所述连接通道在下游隔室的出口,进入下游隔室。
在本发明的第二方面,提供了一种可用于特异性扩增HPV的PCR反应系统,所述系统包括:
(i)多级PCR反应管,其中所述反应管包括二个或多个可封闭的的PCR反应腔或隔室(10),并且在至少两个隔室之间设有封闭的或可封闭的连接通道(40),所述连接通道用于让携带PCR扩增产物的固体颗粒(50)从一个隔室(或上游隔室)转移至另一隔室(或下游隔室);
(ii)固体颗粒,所述固体颗粒位于所述多级PCR反应管的至少一个上游隔室中,并且在所述上游隔室内进行PCR反应时,所述固体颗粒能吸附在扩增过程中形成的扩增产物;以及
(iii-1)用于特异性扩增HPV的多个引物对,所述的各引物对分别位于不同的容器中,并且在PCR扩增时各所述引物对被分别置于第j级PCR隔室中,从而在第j级PCR隔室中用所述的第j引物对进行PCR扩增时,形成第j扩增产物Pj,其中j为≥1的正整数;或
(iii-2)分别位于第j级PCR隔室中的HPV特异的第j引物对,从而在第j级PCR隔室中用所述的第j引物对进行PCR扩增时,形成第j扩增产物Pj,其中j为≥1的正整数。
在另一优选例中,所述的固体颗粒是磁性微球。
在另一优选例中,各PCR隔室中引物对是不同的。
在本发明的第三方面,提供了一种对HPV的基因组DNA进行多级PCR反应方法,所述方法包括步骤:
(a)提供一多级PCR反应管,其中所述反应管包括二个或多个可封闭的的PCR反应腔或隔室(10),并且在至少两个隔室之间设有封闭的或可封闭的连接通道(40),所述连接通道用于让携带PCR扩增产物的固体颗粒(50)从一个隔室(或上游隔室)转移至另一隔室(或下游隔室);
(b)在所述多级PCR反应管的PCR反应隔室中加入进行PCR反应所需的试剂,形成液相PCR反应体系,并且在一个或多个上游隔室中加入PCR模板材料和用于吸附扩增产物的固体颗粒,但在下游隔室中不加入PCR模板材料,并且各隔室内的液相PCR反应体系互不连通且互不接触;
(c)封闭所述多级PCR反应管的上游隔室和下游隔室,从而对于相互连通的多个隔室而言,当各自的腔盖全部盖上后,构成一个封闭空间;
(d)在上游隔室R1中,用HPV特异性的第一引物对进行PCR反应,形成第一PCR扩增产物P1以及吸附有所述第一PCR扩增产物P1的固体颗粒;
(e)抬升所述吸附PCR扩增产物的固体颗粒,离开位于所述上游隔室下方的液相PCR反应体系后,进入所述连接通道的入口,经过连接通道,进入位于所述上游隔室下游的另一下游隔室R2,作为所述下游隔室中的PCR模板材料;
(f)在所述下游隔室R2中,用HPV特异性的第二引物对进行PCR反应,形成第二PCR扩增产物P2;
(g)任选的,将上一步骤的扩增产物Pi从第i级PCR隔室转移至第i+1级PCR隔室中,作为第i+1级PCR的模板,并在封闭的第i+1级PCR隔室中,通过HPV特异性的第i+1引物对进行扩增,从而获得第i+1扩增产物Pi+1,其中i为≥2的正整数;并且本步骤可进行一次或多次。
在另一优选例中,所述的进行PCR反应所需的试剂选自下组:PCR引物、缓冲液、dNTP、聚合酶、镁离子。
在另一优选例中,位于所述上游隔室中的PCR引物或引物对与位于所述下游隔室中PCR引物或引物对,是不同的或相同的。
在另一优选例中,所述方法包括:
(g)当所述多级PCR反应管具有下游隔室Ri时,其中i为≥2的正整数,
则在下游隔室Ri中进行PCR反应,形成吸附有第i级PCR扩增产物的固体颗粒;和
将所述吸附有第i级PCR扩增产物的固体颗粒通过另一连接通道转移至次一级的下游隔室Ri+1,并在所述下游隔室Ri+1中进行PCR反应,从而形成第i+1级PCR扩增产物和任选的形成吸附有第i+1级PCR扩增产物的固体颗粒;
(h)任选地重复步骤(g)一次或多次。
在另一优选例中,所述方法还包括步骤:对上一步骤中获得的所述第二扩增产物P2或所述第i+1扩增产物Pi+1进行检测;
在另一优选例中,所述的检测包括探针杂交、测序、和/或电泳。
较佳地,所述检测包括测序或用HPV型别特异性探针进行杂交。
在另一优选例中,在所述下游隔室Ri中也放置用于吸附扩增产物的固体颗粒。
在另一优选例中,所述的PCR模板材料包括:生物组织样品、器官样品、穿刺样品、细胞样品、核酸抽提物、血液、血清、体液、唾液、毛发、粪便样品、羊水样品、尿液、分泌物、培养液、食品样品、疫苗、土壤样品、水样、和空气样品。
在另一优选例中,所述的多级PCR反应在PCR自动扩增设备(仪)上进行。
在另一优选例中,所述PCR扩增设备包括:
用于放置PCR反应管的反应孔,其中所述PCR反应管包括多级PCR反应管,其中所述反应管包括二个或多个可封闭的的PCR反应腔或隔室,并且在至少两个隔室之间设有封闭的或可封闭的连接通道,所述连接通道用于让携带PCR扩增产物的固体颗粒从一个隔室(或上游隔室)转移至另一隔室(或下游隔室);
用于控制所述反应孔温度的控温装置,从而使得反应管的隔室内能够进行预定的PCR反应;和
用于控制携带PCR扩增产物的固体颗粒从上游隔室通过所述连接通道转移至下游隔室的控制装置。
在另一优选例中,所述的固体颗粒包括磁性微球,而所述的控制装置是磁铁或电磁铁。
在另一优选例中,所述的各反应孔设有独立的控温装置。
在另一优选例中,所述的设备还设有自动控制磁场的装置,用于控制磁铁的移动或控制电磁铁的开启/移动,从而实现磁性微球同步和自动可控转移。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示了现有技术中PCR反应管的示意图。
图2显示了本发明一种多级PCR反应管(已加入液相PCR反应体系)的示意图。
图3显示了本发明一种多级PCR反应管(未加入液相PCR反应体系)的示意图。
图4显示了本发明另一种多级PCR反应管(三联体)的示意图。
具体实施方式
本发明人经过广泛而深入的研究,首次开发了一种灵敏度高、特异性好、抗干扰能力强的多级PCR反应管、设备、系统和方法。实验表明,使用本发明的多级PCR反应管以及HPV型别分析方法,不仅可以使得检测灵敏度达到1-2个拷贝,而且具有极其优异的抗污染和抗干扰能力。此外,本发明的设备还可在封闭反应体系内实现PCR扩增产物的定量或半定量转移。在此基础上完成了本发明。
术语
术语“探针”指一组与互补和部分互补核酸显示序列特异杂交的寡核苷酸。为实施杂交后的步骤,或为改变它们的杂交特性,可修饰寡核苷酸的结构。
术语“型特异性探针”指一组在严谨条件下仅与与它们精确互补的靶区域结合的寡核苷酸。适用于这种需要的杂交条件在本领域已众所周知(见,如Sambrook等,1985,Molecular Cloning Laboratory Manual,Cold Spring Harbor Laboratory,Cold Spring Harbor,N.Y.USA)。一般地,在规定的离子强度和pH下,严谨条件选择为低于特异序列的解链温度(Tm)约5℃。Tm是在存在适当的互补靶分子时,50%探针是结合状态的温度(在规定的离子强度和pH下)。降低杂交条件的严谨性(例如提高盐浓度或降低温度)将允许与非精确互补序列结合。假如为非精确互补模板,不与模板中的模板核酸结合的核苷酸是“错配 核苷酸”。
术语“引物”指在一定条件下可作为DNA合成(启动)起始点的核苷酸,其中在该条件下,与核酸链互补的引物延伸产物的合成在核酸模板上得到诱导,即在四种不同核苷三磷酸和用于聚合的试剂(即DNA聚合酶或逆转录酶)存在下、在适当的缓冲液和适合的温度下。引物优选为单链DNA分子。引物的适当长度一般为15-40个核苷酸。引物不需要反映模板的确切序列,因此,通过改变结合(反应)温度,类似的靶分子组可作为合成(一致扩增子)的模板。为使它可与固相结合以及为了其它目的,具有化学特征的基团可连接至引物寡核苷酸。
本发明中的术语“引物”也指一组连续相关的寡核苷酸,其中该组寡核苷酸可引发某组模板序列(如上所述)。另外,该组的成员由这样的寡核苷酸组成,所述寡核苷酸可与一组给定模板核酸中的一些或所有成员形成错配。但在适当的条件下,这些引物也可参与启动。术语“一致引物(consensus primer)”指可用于引发相关模板核酸的特定区域的引物或引物组。这些区域的特征是,它们的变异性显著低于全部核酸的变异性,即它们是保守的,因此在这些序列上所选择的一致引物可引发模板核酸序列的所有组。一致引物不必要是单一引物,它可是一组引物。
术语“热稳定聚合酶”指在热变性温度下保持相对稳定、并可催化核苷三磷酸聚合以形成与靶序列的一条核酸链互补的引物延伸产物的酶。纯化的热稳定聚合酶可用常规方法制备或购得(如购自Applera)。
虽然聚合酶链式反应是优选的扩增方法,但可使用其他任何方法中扩增感兴趣的基因组区域和寡核苷酸。例如,连接酶链式反应(Wu和Wallace1989,Genomics4:560-569)、TAS扩增系统(Kwoh等,1989,Proc.Natl.Acad.Sci.USA86:1173-1177)和自我维持的序列复制(Guatelli等,1990,Proc.Natl.Acad.Sci.USA87:1874-1878)也可用于靶序列的正确扩增。
HPV特异性引物
在本发明中,
一类优选的引物是简并/通用引物PCR。通过针对高保守的L1基因设计引物,可以扩增HPV,随后使用型特异性探针杂交分型,可区分大约30种型别。
大多数情况下,可用三种不同的引物对来进行HPV DNA的通用扩增(“广谱引物”)。其中三种引物对是MY11/MY09,GP5/GP6以及SPF10系统,它们被扩增不同类型HPV的L1区域的保守区域(Manos等,1989;Van der Brule etal.,1990,WO9914377)。MY09/11的改进型即PGMY引物系统同样也可使用(见Gravitt,P.,2000.Improved am plification of genital human papillomaviruses.J.Clin.Microbiol.38:357-361)。此外,另一引物对CP1/CP11g,被用于E1区域的保守区域(见美国专利申请公开号20090053687)。
此外,一些可用于本发明的引物对在诸如美国专利Nos.6,482,588和5,705,627,美国专利申请公布号US2003/0059806A1,以及欧洲专利申请公布号EP1302550A1中均有提及。这些文献都通过引用方式引入本文。
在本发明中,常用的引物包括简并引物MY09/11(Bosch,1995)及其改进型PGMY09/11(Gravitt PE,1998),SPF1/2(Reesink-Peters N,2001),通用引物GP5/6(De Roda Husman AM,1995)和GP5+/6+(Hutchi nson,1994),SPF1/2的极限灵敏度达到约1-10fg(20-200个拷贝)。
PCR产物还可通过各自不同的常规手段进行进一步分析:例如序列分析,限制性长度多态性分析(RFLP,Wang TS,1999),以及使用特异性的探针进行斑点杂交(LaconiS,2001)等。
多级PCR反应管
本发明还提供了一种多级PCR反应管,所述反应管包括二个或多个可封闭的PCR反应腔或隔室(10)(compartment),并且在至少两个隔室之间设有封闭的或可封闭的连接通道(40),所述连接通道用于让携带PCR扩增产物的固体颗粒(50)从一个隔室(或上游隔室)转移至另一隔室(或下游隔室)。
如本文所用,术语“本发明反应管”、“多级PCR反应管”、“PCR多级反应管”、“多级PCR反应管”、“级联PCR反应管”可互换使用,指具有至少二个相对独立的、PCR反应隔室的PCR反应管,并且在所述PCR反应隔室之间设有允许携带PCR扩增产物的固体颗粒通过的转移通道。
在本发明中,对于通过转移通道进行连通的任何两个PCR反应隔室,可将其中先进行PCR反应的反应隔室称为“上游隔室”、“上游反应隔室”或“上游PCR反应隔室”,而将另一PCR反应隔室称为“下游隔室”、“下游反应隔 室”或“下游PCR反应隔室”。
参见图2和图3。图中示出的本发明多级PCR反应管包括二个可封闭的PCR反应腔或隔室(10)(compartment)。各隔室10设有腔盖(20)。较佳地,所述腔盖通过连接件(22)与隔室本体连为一体。
此外,在两个隔室之间设有封闭的或可封闭的连接通道(40),所述连接通道用于让携带PCR扩增产物的固体颗粒(50)从通过一个隔室(即上游隔室)转移至另一隔室(即下游隔室)。
当所述隔室竖直放置时,所述的连接通道可以是水平的或倾斜的。通常,连接通道的倾斜角度(连接通道与水平线的夹角)为0-30度,较佳地为0-15度,更佳地为0-10度。
当连接通道呈现一定倾斜角度时,来自上游隔室的、携带PCR扩增产物的固体颗粒可方便地借助重力,从连接通道的入口端滚向或滑向连接通道的出口端,从而进入下游隔室。
在本发明中,所述连接通道的内径和长度没有特别限制,只要能够让携带PCR扩增产物的固体颗粒通过即可。
典型地,连接通道的内径为0.1-20mm,较佳地为0.2-10mm,更佳地为0.2-5mm。
典型地,连接通道的长度为0.1-100mm,较佳地0.2-50mm。
在本发明中,连接通道可以是已封闭的或可封闭的。例如,当多级PCR反应管的腔盖与隔室腔体是分离式时,可将腔盖制成一体式的上盖,该上盖不仅具有对应于隔室腔体的腔盖,而且还具有对应于连接通道的密封盖。这样,当盖上所述上盖时,不仅封闭了各隔室,还封闭了相应的连接通道,从而形成封闭的反应空间。
在本发明中,一体式的上盖特别适用于当隔室具有a×b矩阵结构的情况。
本发明多级PCR反应管的隔室大小没有特别限制。通常,单个PCR隔室的容积约为10-10000微升,较佳地20-2000微升,更佳地30-1000微升,最佳地40-500微升。
本发明多级PCR反应管的隔室形状没有特别限制,可以是圆柱形、圆锥形、或其他类似形状。
本发明多级PCR反应管的材质没有特别限制,可以是塑料、玻璃或可透过磁场的其他材料。优选塑料,例如聚丙烯塑料等。
在另一优选例中,所述的反应管包括n个隔室,其中n为2-5000的任一正整数;较佳地,n为2-500的任一正整数。
在另一优选例中,所述的反应管包括M个多级组,各多级组分别具有2、3、4或5个相互连通的隔室,其中M为1-1000的任一正整数。
在另一优选例中,M为192、96、48、24、12、10、9、8、7、6、5、4、3、2、或1。
在另一优选例中,所述的PCR反应管的隔室呈直链构型、支链构型、或环形构型。较佳地,呈“一”字构型、“V”字构型、或“□”或“○”字等构型。
在另一优选例中,所述的各隔室为串联设置。
在另一优选例中,所述的隔室呈矩阵排列,所述矩阵为a×b矩阵,其中a为2-100的正整数,b为2-100的正整数。
在另一优选例中,所述的矩阵为6×8、6×16、8×12、12×16矩阵。
在另一优选例中,所述腔盖为密封盖。
在另一优选例中,所述腔盖与隔室是一体化的;更佳地,上述腔盖通过连接件(22)与隔室腔体连接。
在另一优选例中,所述的腔盖与隔室腔体是分离的。
在另一优选例中,所述多个或全部腔盖是一体的。
在另一优选例中,所述连接通道位于反应腔或隔室上部。
在另一优选例中,所述的连接通道高于隔室中预定的液相PCR反应体系的液面。
在另一优选例中,所述的连接通道入口的下沿距离隔室上沿的距离H1与隔室上沿与隔室底部的垂直高度H之比满足:H1/H≤1/2,较佳地≤1/3,更佳地≤1/4,最佳地≤1/5。
在另一优选例中,所述PCR反应管具有2个或3个互相连通的PCR隔室。
在另一优选例中,所述的上游隔室设有引导板,用于引导携带PCR扩增产物的固体颗粒从上游隔室进入连接通道入口。
携带PCR扩增产物的固体颗粒
在本发明中,在隔室中进行PCR反应之中或之后,形成的PCR扩增产物中的一部分会吸附或粘附于置于所述隔室的固体颗粒表面,从而形成携带PCR扩增产物的固体颗粒。当所述固体颗粒从上游隔室转移下游隔室时,所携带的PCR扩增产物就可作为下游隔室中的PCR模板。
在本发明中,固体颗粒的形状没有特别限制,可以是球形、卵圆形、圆柱形、锥形、立方形或其他形状。固体颗粒可以是实心的、空心的、网格状的或其他结构,只要该固体颗粒可以吸附或携带PCR扩增产物。
固体颗粒的材质没有特别限制,然而优选的固体颗粒是磁性颗粒,如磁性微球。在本发明中,所述的磁性颗粒包括已具有磁性的颗粒以及在磁场作用下具有磁性的颗粒。
在另一优选例中,所述的磁性微球为核壳结构。
在另一优选例中,所述的磁性微球是表面未修饰的、表面修饰的、或表面带有涂层。
在本发明中,所述固体颗粒的大小没有特别限制。通常,固体颗粒的平均粒径为0.01~10mm,较佳地为0.1-5mm,最佳地为0.2-2mm。
所述固体颗粒的核酸吸附力受到颗粒表面积和表面性质等因素的影响。技术人员可以购得或用常规方法制备各种不同的能携带PCR扩增产物的固体颗粒。
一种优选的固体颗粒是表面亲水性的或带有羟基等亲水性基团的颗粒。这样,不仅能够吸附核酸分子,还可在转移时携带部分反应混合液,从而将一定量的PCR扩增产物转移至下游隔室。
当颗粒大小和材质确定后,通过常规方法,可以测定出每个固体颗粒所携带的PCR产物的数量。通常,每个颗粒可携带整个PCR反应体系中PCR扩增产物的约1/200-1/10,较佳地约1/100-1/15,更佳地1/50-1/20。按体积计,通常一个颗粒可携带0.1-2微升的反应液体,这取决于颗粒的大小以及表面特性。
取决于需要以及固体颗粒的大小,可以在上游隔室中放置一个或多个固体颗粒。此外,可以在下游隔室中放置或不放置一个或多个固体颗粒。
当一个隔室中有多个颗粒时,这些颗粒可以一起或分别被转移至一个或多个下游隔室。
多级PCR反应
在本发明中,对于通过转移通道连通的上游反应隔室和下游PCR反应隔室而言,通常在所述上游PCR反应隔室进行了PCR反应(“第一级PCR反应”)之后或之中,置于反应体系中固体颗粒会吸附一部分扩增产物。将所述吸附有一部分PCR扩增产物的固体颗粒,通过所述转移通道从上游反应隔室转移至下游隔 室,就可在下游隔室内作为后续PCR反应的模板,从而进行下一级的PCR反应。
应理解,在本发明中,虽然会在至少两个上游PCR反应隔室进行PCR反应,然而,在某些PCR反应隔室也可不进行任何反应,或不进行PCR反应。例如,仅进行探针杂交、测序、电泳或其他检测反应。
在本发明中,对于进行PCR反应所需的试剂没有特别限制,可以采用本领域常规的各种不同的PCR反应所需的试剂。代表性的试剂包括(但并不限于):PCR引物、聚合酶;dNTP、缓冲液、镁离子等。
在本发明中,所述的PCR反应包括常规PCR(高温PCR)、低温PCR、多级PCR、双引物PCR反应、多引物PCR反应、RT-PCR反应、DNA聚合酶PCR反应、RNA聚合酶PCR反应。
在另一优选例中,所述PCR引物的长度为12-100bp,较佳地15-50bp,更佳地18~30bp。
在另一优选例中,所述反应体系包括以下组分:10×扩增缓冲液、4种dNTP混合物、各类DNA聚合酶、Mg2+。
在另一优选例中,所述反应体系的各组分含量如下:10×扩增缓冲液5~20μl、4种dNTP混合物50~500μl、PCR引物10~100μl、模板DNA0.1~2μg、Taq DNA聚合酶1~5μl、Mg2+0.5~3mmol/L、水50~200μl。
在本发明中,各隔室内的PCR引物可相同或不同。例如,对于通过两个连接通道连通的三个PCR反应隔室而言,第一PCR引物对、第二PCR引物对和第三PCR引物对分别位于不同的PCR隔室内。一种代表性的三级PCR反应管(三联体)如图4所示。
现结合图2,描述本发明的代表性的多级PCR方法。该方法包括:
先在所述多级PCR反应管的PCR反应隔室中加入进行PCR反应所需的试剂,形成液相PCR反应体系31和32,并且在上游隔室中加入PCR模板材料和用于吸附扩增产物的固体颗粒(如磁性颗粒),但在下游隔室中不加入PCR模板材料,并且两个隔室内的液相PCR反应体系31和32互不连通且互不接触;
封闭所述多级PCR反应管的上游隔室和下游隔室,构成一个封闭空间;
在上游隔室R1中进行PCR反应,形成第一PCR扩增产物以及吸附有所述第一PCR扩增产物的固体颗粒50;
抬升(如通过磁力或磁场)所述吸附PCR扩增产物的固体颗粒50,离开位于所述上游隔室下方的液相PCR反应体系后,进入所述连接通道的入口,经过连接通道,进入位于所述上游隔室下游的另一下游隔室R2,作为所述下游隔室中的PCR模板材料;
在所述下游隔室R2中进行PCR反应,形成第PCR扩增产物;
如果需要,可重复上述步骤:将下游隔室Ri(i为≥2的正整数)中形成的吸附有第i级PCR扩增产物的固体颗粒,通过另一连接通道转移至次一级的下游隔室Ri+1,并在所述下游隔室Ri+1中进行PCR反应,从而形成第i+1级PCR扩增产物。
与现有技术的PCR反应管(图1)相比,本发明的多级PCR反应管可在反应空间处于封闭的情况下,将第一次PCR反应产物吸附于固体颗粒(如磁性微球),然后方便地将其从上游隔室转移至下游隔室,从而在下游隔室中将转移的扩增产物作为模板进行第二次PCR,从而在保持高特异性的情况下,通过两次或多次PCR反应显著提高了检测灵敏度。
另外,本发明的另一显著特点是在两次或多次PCR反应过程中,整个多级PCR反应管或各连通的多级组处于封闭状态,故有效防止了环境以及操作过程中引入污染源,也防止了对环境的污染,因而不必需要洁净程度极高的操作设备或操作室。
在本发明中,虽然整个多级PCR反应管或各连通的多级组处于封闭状态,但仍可非常简便地利用固体颗粒在将反应产物(如PCR扩增产物)从上游隔室定量或半定量地转移下游隔室,从而在下游进行下一级的PCR反应。核酸转移量的大小,可通过调节固体颗粒的大小和数量来实现。
PCR扩增设备
本发明还提供了一种可用于本发明方法的PCR扩增设备。一种优选设备包括:
用于放置PCR反应管的反应孔,其中所述PCR反应管具有上游隔室和下游隔室,以及连接所述上游隔室和下游隔室的连接通道;
用于控制所述反应孔温度的控温装置,从而使得反应管的隔室内能够进行预定的PCR反应;和
用于控制携带PCR扩增产物的固体颗粒从上游隔室通过所述连接通道转移至下游隔室的控制装置。
通常,所述的固体颗粒是磁性微球,而所述的控制装置是磁铁或电磁铁。该磁体一般位于反应孔的上方,其磁场可以覆盖反应孔区域的全部或部分,从而将磁性微球一次性或分批从上游隔室转移至下游隔室。
在另一优选例中,所述的反应孔呈矩阵排列,所述矩阵为a×b矩阵,其中a为2-100的正整数,b为2-100的正整数,以便与常规的96孔板等配合使用。
使用本发明的PCR扩增设备,可以实现大规模、高通量和自动化操作。
本发明的主要优点包括:
(a)灵敏度高;
(b)特异性好;
(c)抗干扰能力强;
(d)操作简便。
(e)可实现定量和半定量的转移。在多级PCR过程中,按需在级间转移PCR扩增产物。
(f)可在普通医院的实验室进行。
(g)检测结果可靠、精确。
(h)减少或消除对环境的污染。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1
多级PCR反应
在本实施例中,采用图2所示的二联体多级PCR反应管,
引物如下:
MY09:5’-CGTCCMARRGGAWACTGATC-3’(SEQ ID NO.:1)
MY11:5’-GCMCAGGGWCATAAYAATGG-3’(SEQ ID NO.:2)
GP5:5’-TTTGTTACTGTGGTAGATACYAC-3’(SEQ ID NO.:3)
GP6:5’-GAAAAATAAACTGTAAATCATATTC-3’(SEQ ID NO.:4)
其中,在上游隔室中的引物为MY09/MY11,下游隔室中的引物为GP6/MY11或GP5/MY9。
将含HPV(人乳头状病毒)的分泌物用常规方法抽提核酸后,经5倍或10倍系列稀释后,制得HPV拷贝数约为1、2、5、10、25、50、100、200的样品。将所述样品作为模板加入上游隔室。上游隔室R1中分别加入25微升的常规的PCR反应体系(其中包括DNA核酸模板、聚合酶、dNTP、引物、ddH2O)和2个直径约200nm的磁性微球(无修饰的钢珠)。
先进行第一次PCR反应,预变性95℃,3分钟,95℃,30S;60℃退火30s,72℃延伸1分钟,共30个循环。然后,75℃再延伸10分钟。
然后通过磁场,将2个磁性微球通过连接通道转移到下游隔室,进行第二次PCR反应。条件是95℃,30S;60℃退火30s,72℃延伸1分钟,共30个循环。
对下游隔室R2中获得的第PCR扩增产物通过测序进行检测。然后将检测结果与HPV标准序列数据库进行比较,从而得出HPV的存在与否和种类。
检测结果表明,该方法可以检测出微量(样品中仅含5-10个拷贝)的HPV病毒。此外,不仅灵敏度显著提高,而且假阴性和假阳性率都显著低于常规PCR法(减少约10倍,即提高约1个数量级)或HC2方法(减少约50%)。
实施例2
多级PCR反应
重复实施例1,不同点在于:使用的多级PCR反应管包括2个多级组,各多级组分别具有2个相互连通的隔室。4个隔室呈矩形排列。这样,可同时对两个样品进行多级PCR反应。
实施例3
多级PCR反应
重复实施例1,不同点在于:使用的多级PCR反应管包括48个多级组,各多级组分别具有2个相互连通的隔室;或使用的多级PCR反应管包括32个多级组,各多级组分别具有3个相互连通的隔室。
96个隔室呈现矩形排列,与常规的96孔板对应,该多级PCR反应管可放置于 96孔板上。这样,可同时对48个样品进行二级的多级PCR反应;或可同时对32个样品进行三级的多级PCR反应。
实施例4
三级的多级PCR反应
重复实施例1,不同点在于:下游隔室R3中的引物为GP6/GP5。
第一级PCR:同实施例1。
第二级PCR:同实施例1。
第三级PCR:将下游隔室R2中的携带第PCR扩增产物的磁性颗粒转移至下游隔室R3,然后进行第三次PCR,从而获得第三PCR扩增产物。
对下游隔室R3中获得的第三PCR扩增产物通过测序进行检测。然后将检测结果与HPV标准序列数据库进行比较,从而得出HPV的存在与否和种类。
检测结果表明,该检测结果可以检测样品中仅含1-2个拷贝的HPV病毒分子。此外,不仅灵敏度显著提高,而且假阴性和假阳性率都显著低于常规PCR法或HC2方法(减少约50%)。
实施例5
HPV型别鉴定
5.1.宫颈表皮取样:
(1)临床医生在取检测样本时,用取样刷,刮取病人样本后,先插入一只无菌的5ml取样管内,取样刷贴管壁轻旋半周,使得小部分病人样本粘在取样管内;
(2)确保有足够样本进行多级PCR技术检测HPV后,将取样刷从5ml取样管内抽出放入检测保存液;
(3)在步骤1的5ml取样管内加入2ml95%乙醇,盖上盖子,上下振荡取样管数次,使得贴在管壁上的样本保存在液体内;
(4)将步骤3的取样管上做好标记,使其与相应检测实验一一对应;
(5)将步骤4的取样管放4℃冰箱保存,待测。
5.2多级PCR
(1)第一级PCR
反应体系20μL,引物MY091μL,引物MY111μL,病人样本DNA1μL和水2μL,总计25μL;
(2)第二级PCR
反应体系20μL,引物GP61μL,引物MY111μL,通过磁珠转移的第一PCR产物(约1μL),水2μL,总计25μL。
(3)第三级PCR
反应体系20μL,引物GP51μL,引物GP61μL,第二次PCR产物(约1μL),水2μL,总计25μL。
用2%的Agarose检测第三次PCR反应的结果,阳性产物用于测序。
5.3用于样本质量检测的β血红蛋白PCR
反应体系20μL,引物Β11μL,引物Β21μL,病人样本DNA1μL,水2μL,总计25μL。
B1:5’-ACACAACTGTGTTCACTAGC(SEQ ID NO.:5)
Β2:5’-CAACTTCATCCACGTTCACC(SEQ ID NO.:6)
5.4测序
水13.5μL,5倍反应缓冲液3.5μL,BigDye1.11μL,测序引物1μ,第二次PCR产物1μL,在PCR仪上进行测序反应。PCR产物用Centri-Sep strip纯化柱纯化,纯化后从PCR管内吸取10μL纯化产物至测序板,测序引物可从最后一次PCR引物中选择,上机器测序,然后对测序结果与HPV标准序列(可获自已公开的公用数据库)进行分析。所获DNA序列以100%与基因库中标准HPV基因型DNA相符作为HPV定型标准(即美国FDA有关HPV定型的最高金标准)。
结果
本发明方法,对3320个检测样品的检测结果表明:
1319个样本是非HPV感染的,1352个样本是高危型HPV感染,377个样本是低危型HPV感染和272个样本是混合感染。
表1二种方法的结果比较
在3320个样本中,有约60%([1352+377+272]/3320)感染有HPV病毒,而约40%(1319/3320)没有感染HPV病毒。
此外,本发明的检测结果还发现,在其他常规方法中有20种HPV交叉反应,而本发明方法均可以将其准确地检测出(表2)。
表2用多级PCR检测方法发现现有方法存在着严重的交叉反应
结论:多级PCR技术标准(最后以DNA序列检测确定HPV型别)是一种检测HPV的高灵敏、精确和可靠的技术,符合美国公布的检测HPV的“金标准”。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!