核酸扩增的制作方法
对于用于核酸扩增的方法和试剂的需求日益增加。生成特定核酸的多个拷贝通常是必要的或有用的,以便核酸可用于给定的应用。例如,为了分析感兴趣的核酸的核苷酸序列,在分析该序列之前经常复制核酸以增加它的拷贝数。在另一个实例中,为了确定样品中特定核酸的存在或不存在,可在一定条件下处理样品以使得如果特定核酸存在于该样品中则它可被扩增。在另一个实例中,用作探针的核酸可进行重复拷贝以生成大量含有与原始核酸模板相同的序列的核酸,从而生成核酸的许多拷贝,该拷贝可用作探针。
已知多种用于核酸扩增的方法。例如,聚合酶链反应(“PCR”)(参见,例如,美国专利号4,683,202)是一种用于核酸扩增的普遍方法。为了成功地进行PCR反应,该反应必须在重复多个循环的多个不同温度下进行。这需要用于重复地改变PCR反应的温度的硬件或其他机构。用于核酸扩增的另一种方法被称为环介导等温扩增(“LAMP”)(参见,例如,美国专利号6,410,278)。LAMP反应可在等温下进行,但通常包括四种不同引物的使用,这些引物识别靶核酸上总计六种不同的序列。
为促进生成扩增的核酸以用于使用扩增的核酸的多个和增加数量的应用,需要用于核酸扩增的新的方法和试剂。
援引并入
本说明书中提到的所有出版物、专利和专利申请均通过引用而以相同程度并入本文,犹如特别地且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。然而,在本公开的内容与本文通过引用并入的文献的内容之间冲突的情况下,以本公开的内容为准。
技术实现要素:
本文提供了涉及核酸扩增和多联体生成的方法和组合物。
在一些实施方式中,本文提供了用于生成包含双链核酸模板的两个或更多个拷贝的多联体的方法,该方法包括:(A)在使得合成与双链核酸模板的第一链退火的第一引物的第一拷贝的延伸产物的条件下,用第一引物的第一拷贝和聚合酶处理包含双链核酸模板的一级双链核酸,其中第一引物包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(ii)模板结合区,其包括:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,并且第一引物的第一拷贝的模板结合区与双链核酸模板的第一链退火,(B)在使得合成与步骤(A)的第一引物的第一拷贝的延伸产物退火的第二引物的延伸产物的条件下,用第二引物和聚合酶处理步骤(A)的第一引物的第一拷贝的延伸产物,其中第二引物包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(ii)模板结合区,其包含:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,第二引物的尾区包含与第一引物的尾区的核苷酸序列互补的核苷酸序列,如果将所述序列对齐使得第二引物的5’末端核苷酸与第一引物的尾区的最内核苷酸对齐并且第一引物的5’末端核苷酸与第二引物的尾区的最内核苷酸对齐,第二引物的模板结合区与步骤(A)的第一引物的第一拷贝的延伸产物退火,并且第二引物的延伸产物含有5’末端核苷酸、3’末端核苷酸以及包含3’末端核苷酸的3’末端区,其中该3’末端区含有与在5’至3’方向读取的第二引物的尾区的核苷酸序列相同的核苷酸序列,且3’末端区的最后的核苷酸是第二引物的延伸产物的3’末端核苷酸,(C)在使得合成与步骤(B)的第二引物的延伸产物退火的第一引物的第二拷贝的延伸产物的条件下,用第一引物的第二拷贝和聚合酶处理步骤(B)的第二引物的延伸产物,以产生包含步骤(B)的第二引物的延伸产物和第一引物的第二拷贝的延伸产物的二级核酸的第一拷贝,其中第一引物的第二拷贝的延伸产物含有5’末端核苷酸、3’末端核苷酸以及包含3’末端核苷酸的3’末端区,其中该3’末端区含有与在5’至3’方向读取的第一引物的尾区的核苷酸序列相同的核苷酸序列,并且该3’末端区的最后的核苷酸是第二引物的延伸产物的3’末端核苷酸,(D)将至少步骤(C)重复另外一次或多次以生成步骤(C)的二级核酸的至少第二拷贝,(E)在使得二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物的3’末端区与二级核酸的第二拷贝的第二引物的延伸产物的3’末端区退火的条件下,处理步骤(C)的二级核酸的第一拷贝以及步骤(D)的二级核酸的第二拷贝,以产生包含二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物以及二级核酸的第二拷贝的第二引物的延伸产物的交换结构,(F)在使得合成二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物的延伸产物以及合成二级核酸的第二拷贝的第二引物的延伸产物的延伸产物的条件下,用聚合酶处理步骤(E)的交换结构,以产生包含步骤(A)的双链核酸模板的两个拷贝的多联体,其中该多联体包含二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物的延伸产物以及二级核酸的第二拷贝的第二引物的延伸产物的延伸产物。
在一些实施方式中,本文提供了用于生成包含多核苷酸模板或其类似序列的两个或更多个拷贝的多联体的方法,该方法包括:(A)在使得合成与多核苷酸模板退火的第一引物的第一拷贝的延伸产物的条件下,用第一引物的第一拷贝和聚合酶处理包含多核苷酸模板的一级核酸,其中第一引物包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(ii)模板结合区,其包括:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,并且第一引物的第一拷贝的模板结合区与多核苷酸模板退火,(B)在使得合成与步骤(A)的第一引物的第一拷贝的延伸产物退火的第二引物的延伸产物的条件下,用第二引物和聚合酶处理步骤(A)的第一引物的第一拷贝的延伸产物,其中第二引物包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,(ii)模板结合区,其包含:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,第二引物的尾区包含与第一引物的尾区的核苷酸序列互补的核苷酸序列,如果将所述序列对齐使得第二引物的5’末端核苷酸与第一引物的尾区的最内核苷酸对齐以及第一引物的5’末端核苷酸与第二引物的尾区的最内核苷酸对齐,第二引物的模板结合区与步骤(A)的第一引物的第一拷贝的延伸产物退火,并且第二引物的延伸产物含有5’末端核苷酸、3’末端核苷酸以及包含3’末端核苷酸的3’末端区,其中该3’末端区含有与在5’至3’方向读取的第二引物的尾区的核苷酸序列相同的核苷酸序列,且3’末端区的最后的核苷酸是第二引物的延伸产物的3’末端核苷酸,(C)在使得合成与步骤(B)的第二引物的延伸产物退火的第一引物的第二拷贝的延伸产物的条件下,用第一引物的第二拷贝和聚合酶处理步骤(B)的第二引物的延伸产物,以产生包含步骤(B)的第二引物的延伸产物和第一引物的第二拷贝的延伸产物的二级核酸的第一拷贝,其中第一引物的第二拷贝的延伸产物含有5’末端核苷酸、3’末端核苷酸以及包含3’末端核苷酸的3’末端区,其中该3’末端区含有与在5’至3’方向读取的第一引物的尾区的核苷酸序列相同的核苷酸序列,并且该3’末端区的最后的核苷酸是第二引物的延伸产物的3’末端核苷酸,(D)将至少步骤(C)重复另外一次或多次以生成包含步骤(B)的第二引物的延伸产物和步骤(C)的第一引物的第二拷贝的延伸产物的二级核酸的至少第二拷贝,(E)在使得二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物的3’末端区与二级核酸的第二拷贝的第二引物的延伸产物的3’末端区退火的条件下,处理步骤(C)的二级核酸的第一拷贝以及步骤(D)的二级核酸的第二拷贝,以产生包含二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物以及二级核酸的第二拷贝的第二引物的延伸产物的交换结构,(F)在使得合成二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物的延伸产物以及合成二级核酸的第二拷贝的第二引物的延伸产物的延伸产物的条件下,用聚合酶处理步骤(E)的交换结构,以产生包含步骤(A)的多核苷酸模板的两个拷贝的多联体,其中该多联体包含二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物的延伸产物以及二级核酸的第二拷贝的第二引物的延伸产物的延伸产物。在一些实施方式中,步骤(A)的核酸聚合酶是DNA聚合酶。在一些实施方式中,步骤(A)的核酸聚合酶是逆转录酶。
在一些实施方式中,本文提供了用于生成包含双链核酸模板的两个或更多个拷贝的多联体的方法,该方法包括:(A)制备反应混合物,其包含:(i)包含双链核酸模板的一级核酸,(ii)分离的核酸聚合酶,(iii)第一引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(a)尾区,其包含:(1)引物的5’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(3)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(b)模板结合区,其包括:(1)引物的3’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(3)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,其中模板结合区与核酸模板的第一链互补,(iv)第二引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(a)尾区,其包含:(1)引物的5’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(3)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(b)模板结合区,其包含:(1)引物的3’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(3)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,并且其中模板结合区与核酸模板的第二链互补,并且其中如果将所述序列对齐使得第二引物的5’末端核苷酸与第一引物的尾区的最内核苷酸对齐并且第一引物的5’末端核苷酸与第二引物的尾区的最内核苷酸对齐,第二引物的尾区含有与第一引物的尾区的核苷酸序列互补的核苷酸序列,以及(B)在没有热循环的情况下将反应混合物温育至少3分钟。
在一些实施方式中,本文提供了用于生成包含多核苷酸模板的两个或更多个拷贝的多联体的方法,该方法包括:(A)制备反应混合物,其包含:(i)包含多核苷酸模板的核酸,(ii)分离的核酸聚合酶,(iii)第一引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(a)尾区,其包含:(1)引物的5’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(3)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(b)模板结合区,其包括:(1)引物的3’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(3)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,并且其中模板结合区与多核苷酸模板互补,(iv)第二引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(a)尾区,其包含:(1)引物的5’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(3)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(b)模板结合区,其包含:(1)引物的3’末端核苷酸,(2)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(3)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,并且其中模板结合区与互补于多核苷酸模板的核苷酸序列互补,并且其中如果将所述引物的序列对齐使得第二引物的5’末端核苷酸与第一引物的尾区的最内核苷酸对齐并且第一引物的5’末端核苷酸与第二引物的尾区的最内核苷酸对齐,第二引物的尾区含有与第一引物的尾区的核苷酸序列互补的核苷酸序列,以及(B)在不高于80℃的温度下将反应混合物温育至少3分钟。
在一些实施方式中,本文提供了用于生成包含双链核酸模板的两个或更多个拷贝的多联体的方法,该方法包括:将包含双链核酸模板的双链核酸分子的第一拷贝和第二拷贝与聚合酶一起温育,以产生包含与交换结构的第二链的延伸产物退火的交换结构的第一链的延伸产物的多联体,其中该多联体包含双链核酸模板的两个拷贝,其中双链核酸分子包含各自含有多个核苷酸的第一链和第二链,第一链包含5’末端核苷酸和3’末端核苷酸,并含有5’至3’方向的通用格式的区域:A1-B-A2,第二链包含5’末端核苷酸和3’末端核苷酸,并含有5’至3’方向的通用格式的区域:C1-D-C2,区域B包含双链核酸模板的第一链的核苷酸序列,区域D包含双链核酸模板的第二链的核苷酸序列,在双链核酸分子中,区域A1与C2退火,B与D退火,且A2与C1退火,生成了包含双链核酸分子的第一拷贝的第一链以及双链核酸分子的第二拷贝的第二链的交换结构,其中第一链的A2区域与第二链的C2区域退火,合成了交换结构的第一链的延伸产物,并合成了交换结构的第二链的延伸产物。
在实施方式中,本文提供了拷贝多核苷酸模板的方法,该方法包括:在包含第一引物的多个拷贝和第二引物的多个拷贝的反应混合物中温育多核苷酸模板,其中:第一引物包含第一区域和第二区域,其中第一引物的第二区域包含与多核苷酸模板的第一部分互补的核苷酸序列;第二引物包含第一区域和第二区域,其中第二引物的第二区域包含与配偶体核苷酸序列互补的核苷酸序列,其中该配偶体核苷酸序列与多核苷酸模板的第二部分互补;并且在多核苷酸模板与第一引物的多个拷贝和第二引物的多个拷贝一起温育时,形成至少一条多联体链,其中该多联体链包含5’端和3’端,并且包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列,其中:C’表示第二引物的第一区域的核苷酸序列,T表示多核苷酸模板的核苷酸序列或其类似序列,且X表示任何数目和序列的核苷酸。
在一些实施方式中,在本文提供的包括形成包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列的多联体链的方法中,该多联体链是第一多联体链,并且还形成了第二多联体链,其中该第二多联体链包含5’端和3’端,并且包含具有5’至3’方向的通用结构C-X’-T’-C-T’-C的核苷酸序列,其中:C表示第一引物的第一区域的核苷酸序列,T’表示与多核苷酸模板互补的核苷酸序列,且X’表示与X的核苷酸序列互补的核苷酸序列。
在实施方式中,本文提供了测定生物样品中的靶多核苷酸模板的方法,该方法包括:A)在包含第一引物的多个拷贝和第二引物的多个拷贝的反应混合物中温育生物样品或其部分,其中:第一引物包含第一区域和第二区域,其中第一引物的第二区域包含与多核苷酸模板的第一部分互补的核苷酸序列;第二引物包含第一区域和第二区域,其中第二引物的第二区域包含与配偶体核苷酸序列互补的核苷酸序列,其中该配偶体核苷酸序列与多核苷酸模板的第二部分互补;并且在多核苷酸模板与第一引物的多个拷贝和第二引物的多个拷贝一起温育时,形成至少一条多联体链,其中该多联体链包含5’端和3’端,并且包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列,其中:C’表示第二引物的第一区域的核苷酸序列,T表示多核苷酸模板的核苷酸序列或其类似序列,且X表示任何数目和序列的核苷酸;以及B)在A)温育步骤开始后在一个或多个点测量A)的反应混合物中扩增的核酸的量。在实施方式中,测量反应混合物中扩增的核酸的量可包括确定反应混合物中的荧光的水平。在实施方式中,该方法可进一步包括确定反应混合物中的核酸扩增的转变时间。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器(vessel)或试剂盒中,X可含有具有5’至3’方向的通用结构[(C’-T)N]的序列,其中C’表示第二引物的第一区域的核苷酸序列,T表示多核苷酸模板的核苷酸序列或其类似序列,且N为0至2000之间的任何整数。在实施方式中,N可以是0至10、0至100、0至1000、0至5000、0至10,000、1至10、1至100、1至1000、1至2000、1至5000或1至10,000之间的任何整数。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,X可含有不多于0、1、2、3、4、5、6、7、8、9、10、15、20、25、50、100、500、1000、10,000、50,000、100,000或500,000个核苷酸。在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、容器或试剂盒中,X可含有至少1、2、3、4、5、6、7、8、9、10、15、20、25、50、100、500、1000、10,000、50,000、100,000或500,000个核苷酸。在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、容器或试剂盒中,X可含有至少1、2、3、4、5、6、7、8、9、10、15、20、25、50、100、500、1000、10,000、50,000、100,000个核苷酸,并且不多于2、3、4、5、6、7、8、9、10、15、20、25、50、100、500、1000、10,000、50,000、100,000或500,000个核苷酸。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,在至少一个C’与T之间,存在并非C’或T序列的一部分的一个或多个额外的核苷酸。所述一个或多个额外的核苷酸可以是,例如,1至10、1至20、1至100或1至1000个核苷酸。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,至少一个C’或T序列可缺失一个或多个核苷酸。在2个或更多个核苷酸缺失的情况下,缺失的核苷酸可以是邻近的,或者可以在分开的位置。所述一个或多个缺失的核苷酸可以是,例如,1至10、1至20、1至100或1至1000个核苷酸。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,至少一个C’或T序列可具有一个或多个点突变。在存在两个或更多个点突变的情况下,点突变可以是邻近的,或者可以在分开的位置。所述一个或多个点突变可以是,例如,1至10、1至20、1至100或1至1000个点突变。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,核苷酸序列具有以下特点中的两个或全部三个:i)在至少一个C’与T之间,存在并非C’或T序列的一部分的一个或多个额外的核苷酸;ii)至少一个C’或T序列缺失一个或多个核苷酸;以及iii)至少一个C’或T序列含有一个或多个点突变。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,在多核苷酸模板是RNA分子的实施方式中,T可表示与多核苷酸模板的RNA序列类似的DNA序列的核苷酸序列。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,该多联体链进一步包含位于最5’的C’序列的5’的一个或多个核苷酸。所述一个或多个核苷酸可以是,例如,1至10、1至20、1至100或1至1000个核苷酸。
在实施方式中,在本文提供的包含多联体链(其包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,该多联体链进一步包含位于最3’的C’序列的3’的一个或多个核苷酸。所述一个或多个核苷酸可以是,例如,1至10、1至20、1至100或1至1000个核苷酸。
在实施方式中,本文提供了生成包含双链核酸模板的至少两个拷贝的多联体的方法,该方法包括:在反应混合物中温育至少第一模板分子和第二模板分子,其中:第一模板分子包含第一核酸链和第二核酸链,其中:第一模板分子的第一核酸链包含具有5’至3’方向的通用结构H’-S-Y1-H’的核苷酸序列,其中:H’表示第一同源序列的核苷酸序列,S表示双链核酸模板的第一链的核苷酸序列,且Y1表示任何数目和序列的核苷酸;并且第一模板分子的第二核酸链包含具有5’至3’方向的通用结构H-Y1’-S’-H的核苷酸序列,其中:H表示第二同源序列的核苷酸序列,其中第一同源序列与第二同源序列彼此互补,Y1’表示与Y1的核苷酸序列互补的核苷酸序列,且S’表示双链核酸模板的第二链的核苷酸序列,其中双链核酸模板的第一链和第二链彼此互补;并且第二模板分子包含第一核酸链和第二核酸链,其中:第二模板分子的第一核酸链包含具有5’至3’方向的通用结构H’-S-Y2-H’的核苷酸序列,其中:H’表示第一同源序列的核苷酸序列,S表示双链核酸模板的第一链的核苷酸序列,且Y2表示任何数目和序列的核苷酸;且第一模板分子的第二核酸链包含具有5’至3’方向的通用结构H-Y2’-S’-H的核苷酸序列,其中:H表示第二同源序列的核苷酸序列,Y2’表示与Y2的核苷酸序列互补的核苷酸序列,且S’表示双链核酸模板的第二链的核酸序列;并且在反应混合物中的第一模板分子与第二模板分子一起温育时,形成包含双链核酸模板的至少两个拷贝的至少一个多联体,其中多联体包含第一多联体链和第二多联体链,其中第一多联体链包含5’端和3’端,并包含具有5’至3’方向的通用结构H’-S-Y2-H’-S-Y1-H’的核苷酸序列,其中H’、Y1、S和Y2中的每一个均表示如上所述的核苷酸序列;并且其中第二多联体链包含5’端和3’端,并包含具有5’至3’方向的通用结构H-Y1’-S’-H-Y2’-S’-H的序列,其中,H’、Y1、S和Y2中的每一个均表示如上所述的核苷酸序列。
在实施方式中,在本文提供的包含第一多联体链(其包含具有5’至3’方向的通用结构H’-S-Y2-H’-S-Y1-H’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,Y1和Y2中的至少一个或两者可表示0个核苷酸。
在实施方式中,在本文提供的包含第一多联体链(其包含具有5’至3’方向的通用结构H’-S-Y2-H’-S-Y1-H’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,Y1可含有具有5’至3’方向的通用结构[(H’-S)N1]的序列,其中H’和S表示如上所述的核苷酸序列,且N1是0至2000之间的任何整数。
在实施方式中,在本文提供的包含第一多联体链(其包含具有5’至3’方向的通用结构H’-S-Y2-H’-S-Y1-H’的核苷酸序列)的方法、反应混合物、容器或试剂盒中,Y2可含有具有5’至3’方向的通用结构[(H’-S)N2]的序列,其中H’和S表示如上所述的核苷酸序列,且N2是0至2000之间的任何整数。
在实施方式中,在本文提供的包含第一模板分子和第二模板分子的方法、反应混合物、容器或试剂盒中,第一模板分子和第二模板分子两者均为双链DNA分子。
在实施方式中,在本文提供的包含第一模板分子的第一核酸链的方法、反应混合物、容器或试剂盒中,其中第一核酸链包含具有5’至3’方向的通用结构H’-S-Y1-H’的核苷酸序列,其中H’表示第一同源序列的核苷酸序列,第一同源序列可含有不多于4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、40、50、60、70、80、90或100个核苷酸。在实施方式中,第一同源序列可含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、40、50、60、70、80、90或100个核苷酸。在实施方式中,第一同源序列可含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、40、50、60、70、80、90或100个且不多于5、6、7、8、9、10、11、12、13、14、15、20、25、30、40、50、60、70、80、90、100或200个核苷酸。
在实施方式中,本文提供的反应混合物、容器或试剂盒包含核酸聚合酶。在实施方式中,核酸聚合酶是具有链置换活性的DNA聚合酶。在实施方式中,核酸聚合酶是RNA聚合酶。在实施方式中,核酸聚合酶是逆转录酶。在实施方式中,反应混合物、容器或试剂盒包含多于一种核酸聚合酶,诸如具有链置换活性的DNA聚合酶和逆转录酶两种酶。在实施方式中,本文提供的反应混合物、容器或试剂盒包含核苷酸和缓冲液。
在实施方式中,在本文提供的包含多核苷酸模板的方法、反应混合物、容器或试剂盒中,多核苷酸模板是单链分子。在实施方式中,在本文提供的包含多核苷酸模板的方法、反应混合物、容器或试剂盒中,多核苷酸模板包含双链核酸模板的一条链。在实施方式中,在本文提供的包含多核苷酸模板的方法、反应混合物、容器或试剂盒中,多核苷酸模板是DNA或RNA分子。
在实施方式中,在本文提供的包含核酸模板的方法、反应混合物、容器或试剂盒中,核酸模板是RNA或DNA分子。在实施方式中,核酸模板可以是单链或双链分子。
在实施方式中,在本文提供的包括温育反应混合物的方法中,在温育反应混合物的过程中,反应混合物的温度不超过90、85、80、75、70、65、60、55、50、45、40、37、35、30、25或20℃。在实施方式中,在本文提供的方法中,该方法的所有步骤均在不高于90、85、80、75、70、65、60、55、50、45、40、37、35、30、25或20℃的温度下进行。在实施方式中,本文提供的反应混合物、容器或试剂盒保持不高于90、85、80、75、70、65、60、55、50、45、40、37、35、30、25、或20℃的温度。在实施方式中,本文提供的方法在没有热循环的情况下进行。
在实施方式中,在本文提供的包含含有第一部分的多核苷酸模板的方法、反应混合物、容器或试剂盒中,第一部分含有不多于5、10、15、20、25、30、35、40、50、60、70、80、90、100或200个核苷酸。在实施方式中,在本文提供的包含含有第一部分的多核苷酸模板的方法、反应混合物、容器或试剂盒中,第一部分含有至少5、10、15、20、25、30、35、40、50、60、70、80、90、100或200个核苷酸。在实施方式中,在本文提供的包含含有第一部分的多核苷酸模板的方法、反应混合物、容器或试剂盒中,第一部分含有至少5、10、15、20、25、30、35、40、50、60、70、80、90或100个且不多于10、15、20、25、30、35、40、50、60、70、80、90、100或200个核苷酸。
在实施方式中,在本文提供的包含含有第一区域的引物的方法、反应混合物、容器或试剂盒中,第一区域含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、或100个核苷酸。在实施方式中,在本文提供的包含含有第一区域的引物的方法、反应混合物、容器或试剂盒中,第一区域含有不多于4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有第一区域的引物的方法、反应混合物、容器或试剂盒中,第一区域含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80或90个且不多于5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有第一区域的第一引物和含有第一区域的第二引物的方法、反应混合物、容器或试剂盒中,第一引物和第二引物两者均可具有以上所述的任何特征。在实施方式中,在本文提供的包含含有第一区域的第一引物和含有第一区域的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的第一区域和第二引物的第一区域可含有相同数目的核苷酸。在实施方式中,在本文提供的包含含有第一区域的第一引物和含有第一区域的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的第一区域和第二引物的第一区域可含有不同数目的核苷酸。
在实施方式中,在本文提供的包含含有第二区域的引物的方法、反应混合物、容器或试剂盒中,第二区域含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、或100个核苷酸。在实施方式中,在本文提供的包含含有第二区域的引物的方法、反应混合物、容器或试剂盒中,第二区域含有不多于4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有第二区域的引物的方法、反应混合物、容器或试剂盒中,第二区域含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80或90个且不多于5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有第二区域的第一引物和含有第二区域的第二引物的方法、反应混合物、容器或试剂盒中,第一引物和第二引物两者均可具有以上所述的任何特征。在实施方式中,在本文提供的包含含有第二区域的第一引物和含有第二区域的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的第二区域和第二引物的第二区域可含有相同数目的核苷酸。在实施方式中,在本文提供的包含含有第二区域的第一引物和含有第二区域的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的第二区域和第二引物的第二区域可含有不同数目的核苷酸。
在实施方式中,在本文提供的包含含有第二区域的第二引物和包含第二部分的多核苷酸模板的方法、反应混合物、容器或试剂盒中,第二引物的第二区域的核苷酸序列与多核苷酸模板的第二部分的核苷酸序列相同。
在实施方式中,在本文提供的包含含有尾区的引物的方法、反应混合物、容器或试剂盒中,尾区含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有尾区的引物的方法、反应混合物、容器或试剂盒中,尾区含有不多于4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有尾区的引物的方法、反应混合物、容器或试剂盒中,尾区含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80或90个且不多于5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有尾区的第一引物和含有尾区的第二引物的方法、反应混合物、容器或试剂盒中,第一引物和第二引物两者均可具有以上所述的任何特征。在实施方式中,在本文提供的包含含有尾区的第一引物和含有尾区的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的尾区和第二引物的尾区可含有相同数目的核苷酸。在实施方式中,在本文提供的包含含有尾区的第一引物和含有尾区的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的尾区和第二引物的尾区可含有不同数目的核苷酸。
在实施方式中,在本文提供的包含含有模板结合区的引物的方法、反应混合物、容器或试剂盒中,该模板结合区含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有模板结合区的引物的方法、反应混合物、容器或试剂盒中,模板结合区含有不多于4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有模板结合区的引物的方法、反应混合物、容器或试剂盒中,模板结合区含有至少4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80或90个且不多于5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90或100个核苷酸。在实施方式中,在本文提供的包含含有模板结合区的第一引物和含有模板结合区的第二引物的方法、反应混合物、容器或试剂盒中,第一引物和第二引物两者均可具有以上所述的任何特征。在实施方式中,在本文提供的包含含有模板结合区的第一引物和含有模板结合区的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的模板结合区和第二引物的模板结合区可含有相同数目的核苷酸。在实施方式中,在本文提供的包含含有模板结合区的第一引物和含有模板结合区的第二引物的方法、反应混合物、容器或试剂盒中,第一引物的模板结合区和第二引物的模板结合区可含有不同数目的核苷酸。
在实施方式中,在本文提供的包含多核苷酸模板的方法、反应混合物、容器或试剂盒中,多核苷酸模板可含有至少8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000或5000个核苷酸。在实施方式中,在本文提供的包含多核苷酸模板的方法、反应混合物、容器或试剂盒中,多核苷酸模板可含有不多于8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000、5000或10,000个核苷酸。在实施方式中,在本文提供的包含多核苷酸模板的方法、反应混合物、容器或试剂盒中,多核苷酸模板可含有至少8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000或5000个且不多于9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000、5000或10,000个核苷酸。
在实施方式中,在本文提供的包含双链核酸模板的方法、反应混合物、容器或试剂盒中,双链核酸模板的每一条链可含有至少8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000或5000个核苷酸。在实施方式中,在本文提供的包含双链核酸模板的方法、反应混合物、容器或试剂盒中,双链核酸模板的每一条链可含有不多于8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000、5000或10,000个核苷酸。在实施方式中,在本文提供的包含双链核酸模板的方法、反应混合物、容器或试剂盒中,双链核酸模板的每一条链可含有至少8、9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000或5000个且不多于9、10、11、12、13、14、15、20、25、30、35、40、50、60、70、80、90、100、200、500、1000、2000、5000或10,000个核苷酸。
在实施方式中,本文提供的反应混合物、容器或试剂盒不含有重组酶。
在实施方式中,本文提供的方法、反应混合物、容器或试剂盒可含有或包含引物的多个拷贝。所述多个拷贝可以是,例如,引物的至少5、10、15、20、50、100、500、1000、10,000、100,000或1,000,000个拷贝。
在实施方式中,本文提供的反应混合物或容器可包含来自受试者的生物样品的至少一部分。该生物样品可以是,例如,唾液、血液、尿液、脸颊拭子或鼻拭子。该受试者可以是人。
在一些实施方式中,本文提供的方法的所有步骤均在不高于70、65、60、65、60、55、50、45、40、35、30、25、20、15或10℃的温度下进行。在一些实施方式中,本文提供的方法的一些步骤在不高于70、65、60、65、60、55、50、45、40、35、30、25、20、15或10℃的温度下进行。
在一些实施方式中,本文提供的方法的两个或更多个步骤在相同的反应混合物中同时进行。在一些实施方式中,本文提供的方法的所有步骤均在相同的反应混合物中同时进行。
在一些实施方式中,在本文提供的方法中,在该方法开始后的5、10、15、20、30、40、50、60、70、80、90、120或180分钟内核酸模板扩增了至少10、100、1000、10,000、100,000或1,000,000倍。在一些实施方式中,在本文提供的方法中,在该方法开始后的5、10、15、20、30、40、50、60、70、80、90、120或180分钟内反应混合物中核酸模板的拷贝数增加了至少10、100、1000、10,000、100,000或1,000,000倍。
在实施方式中,本文提供的核酸模板可以是单链或双链核酸模板。
在实施方式中,本文提供了一种容器,该容器包含在其中流体连通的:第一引物,其中该第一引物包含第一区域和第二区域,并且其中第一引物的第二区域包含与多核苷酸模板的第一部分互补的核苷酸序列;第二引物,其中该第二引物包含第一区域和第二区域,并且其中第二引物的第二区域包含与配偶体核苷酸序列互补的核苷酸序列,其中该配偶体核苷酸序列与多核苷酸模板的第二部分互补;以及至少一条多联体链,其中该多联体链包含5’端和3’端,并且包含具有5’至3’方向的通用结构C’-T-C’-T-X-C’的核苷酸序列,其中:C’表示第二引物的第一区域的核苷酸序列,T表示多核苷酸模板的核苷酸序列或其类似序列,且X表示任何数目和序列的核苷酸。
在一些实施方式中,本文提供了一种容器,该容器包含在其中流体流通的:(A)分离的核酸聚合酶,(B)包含至少第一链的核酸模板,(C)第一引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(ii)模板结合区,其包括:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,其中模板结合区与核酸模板的第一链互补,以及(D)第二引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(ii)模板结合区,其包含:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,并且其中模板结合区与互补于核酸模板的第一链的核苷酸序列互补,并且其中如果将引物的序列对齐使得第二引物的5’末端核苷酸与第一引物的尾区的最内核苷酸对齐并且第一引物的5’末端核苷酸与第二引物的尾区的最内核苷酸对齐,第二引物的尾区含有与第一引物的尾区的核苷酸序列互补的核苷酸序列。
在实施方式中,本文提供了一种试剂盒,其包含两个或更多个流体隔离的器皿(container),该器皿共同包含:第一引物,其中第一引物包含第一区域和第二区域,并且其中第一引物的第二区域包含与多核苷酸模板的第一部分互补的核苷酸序列;第二引物,其中第二引物包含第一区域和第二区域,并且其中第二引物的第二区域包含与配偶体核苷酸序列互补的核苷酸序列,其中该配偶体核苷酸序列与核苷酸模板的第二部分互补;以及分离的具有链置换活性的DNA聚合酶;其中:第一引物的第一区域和第二引物的第一区域互补。
在一些实施方式中,本文提供了一种用于检测包含至少第一链的感兴趣的靶核酸的试剂盒,该试剂盒包含两个或更多个流体隔离的器皿,该器皿共同包含:(A)分离的核酸聚合酶,(B)第一引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(ii)模板结合区,其包括:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,其中模板结合区与靶核酸的第一链互补,以及(C)第二引物,其包含5’末端核苷酸、3’末端核苷酸以及两个区域:(i)尾区,其包含:(a)引物的5’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,(c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,以及(ii)模板结合区,其包含:(a)引物的3’末端核苷酸,(b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,(c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸,并且其中模板结合区与互补于靶核酸的第一链的核苷酸序列互补,并且其中如果将引物的序列对齐使得第二引物的5’末端核苷酸与第一引物的尾区的最内核苷酸对齐并且第一引物的5’末端核苷酸与第二引物的尾区的最内核苷酸对齐,第二引物的尾区含有与第一引物的尾区的核苷酸序列互补的核苷酸序列。
在一些实施方式中,本文提供的试剂盒包含具有感兴趣的靶核酸的核苷酸序列的核酸。
在一些实施方式中,本文提供的反应混合物、容器或试剂盒包含核酸染料。
在一些实施方式中,在本文提供的包含分离的核酸聚合酶的容器或试剂盒中,分离的核酸聚合酶是DNA聚合酶。在一些实施方式中,在本文提供的包含分离的核酸聚合酶的容器或试剂盒中,分离的核酸聚合酶是逆转录酶。在一些实施方式中,在本文提供的包含分离的核酸聚合酶的容器或试剂盒中,该容器或试剂盒包含DNA聚合酶和逆转录酶两者。
在一些实施方式中,在本文提供的包含核酸聚合酶的方法、容器或试剂盒中,该核酸聚合酶具有链置换活性。
在一些实施方式中,本文提供的方法包括用核酸染料处理一个或多个反应组分或该方法的步骤。
在一些实施方式中,在本文提供的包含核酸模板的方法、容器或试剂盒中,模板是DNA分子。在一些实施方式中,在本文提供的包含核酸模板的方法、容器或试剂盒中,模板是RNA分子。
在一些实施方式中,在本文提供的包含第一引物的方法、容器或试剂盒中,第一引物的尾区包含至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些实施方式中,在本文提供的包含第一引物的方法、容器或试剂盒中,第一引物的尾区包含不多于4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50或60个核苷酸。
在一些实施方式中,在本文提供的包含第二引物的方法、容器或试剂盒中,第二引物的尾区包含至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些实施方式中,在本文提供的包含第二引物的方法、容器或试剂盒中,第二引物的尾区包含不多于4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50或60个核苷酸。
在一些实施方式中,在本文提供的包含第一引物的方法、容器或试剂盒中,第一引物的模板结合区包含至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些实施方式中,在本文提供的包含第一引物的方法、容器或试剂盒中,第一引物的模板结合区包含不多于4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50或60个核苷酸。
在一些实施方式中,在本文提供的包含第二引物的方法、容器或试剂盒中,第二引物的模板结合区包含至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些实施方式中,在本文提供的包含第二引物的方法、容器或试剂盒中,第二引物的模板结合区包含不多于4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50或60个核苷酸。
在一些实施方式中,在本文提供的其中RNA分子是模板分子或一级核酸的方法和组合物中,模板的扩增可以指对应于RNA分子的DNA链的拷贝的生成。
在一些实施方式中,本文提供的方法包括测量来自包括本方法的测定的荧光信号。
在一些实施方式中,核酸连接酶可包含在本文提供的方法或组合物中。在一些实施方式中,相比于如果核酸连接酶不包含在反应中,当连接酶包含在反应混合物中用于本文提供的方法时,采用本文提供的方法可更快速地扩增核酸模板。在实施方式中,本文提供的反应混合物、容器或试剂盒可含有具有连接酶活性的酶。
在实施方式中,本文提供了测定样品中的病原体的方法,该方法包括进行如本文提供的方法以从病原体中扩增核酸。在实施方式中,在本文提供的组合物或方法中使用的靶核酸可以是来自病原体的核酸。在实施方式中,在本文提供的方法中使用的第一和第二引物可各自含有与病原体的核酸中的序列互补的区域,或者与互补于病原体核酸中的序列的序列互补的区域。在实施方式中,病原体的核酸可以是DNA或RNA。病原体可包括但不限于病毒、细菌、真菌和原生生物。样品可来自受试者,并可具有本文其他地方所述的任何样品特征。
在实施方式中,本文提供的用于核酸扩增的方法可用于人体或动物体外部的诊断方法。例如,样品可从人或动物中获得,并且可用本文提供的用于核酸扩增的方法测定样品中感兴趣的靶核酸。
在实施方式中,本文提供的方法可包括:a)在反应混合物中提供一种或多种用于进行如本文所述的方法的试剂(例如,第一引物、第二引物、核酸模板、核酸聚合酶、核苷酸、缓冲液、水等中的一种或多种),以及b)在基本等温的温度下温育反应混合物,其中在温育期间反应混合物的温度偏离中心温度不多于或少于20、15、10、9、8、7、6、5、4、3、2或1摄氏度。在实施方式中,中心温度可以是,例如,30、35、40、45、50、55、60、65、70、75或80摄氏度。
在实施方式中,本文提供的方法可以在基本等温的温度下进行。在实施方式中,基本等温的温度可以是30、35、40、45、50、55、60、65、70、75或80摄氏度加或减20、15、10、9、8、7、6、5、4、3、2或1摄氏度中的任何温度。
在实施方式中,本文提供的方法可在一个或多个温度下进行,该温度均不超过90、85、80、75、70、65、60、55、50、45、40、35、30、或25摄氏度。
在实施方式中,本文提供的方法可在没有热循环的情况下进行/反应混合物可在没有热循环(即没有升高和降低温育温度以分离链或使引物杂交的循环,如在例如基于PCR的方法中使用的)的条件下温育。
在本文提供的包含含有第一区域的第一引物和含有第一区域的第二引物的组合物和方法中,其中第一引物的第一区域与第二引物的第一区域互补,在实施方式中,第一引物的第一区域和第二引物的第一区域含有核苷酸序列,使得双链结构不会形成限制酶识别序列,该双链结构根据沃森-克里克(Watson-Crick)碱基配对原则通过第一引物的第一区域与第二引物的第一区域退火而形成。
在本文提供的包含核酸聚合酶的组合物和方法中,在实施方式中,该核酸聚合酶具有3’至5’外切核酸酶活性。
在实施方式中,本文提供了用于扩增靶核酸链的方法,该方法包括:在基本上等温的条件下温育包含靶核酸链、第一引物和第二引物的反应混合物,其中:所述靶核酸链包含第一部分和第二部分;所述第一引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与该核酸链的第一部分互补;所述第二引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同该核酸链的第二部分互补的序列互补;所述第一引物的第一区域与所述第二引物的第一区域互补;并扩增靶核酸链。任选地,该靶核酸链可进一步包含第三部分,其中所述第三部分位于该靶核酸链中第一部分与第二部分之间,并且其中所述第二引物的第一区域与所述靶核酸链的第三部分互补。
在实施方式中,在本文提供的任何方法中,多核苷酸模板、靶核酸链等可含有内部基序,其中本文提供的用于扩增靶核酸链的引物的尾区与该内部基序互补。
在实施方式中,本文提供的方法可进一步包括向本文提供的反应混合物中添加肽-核酸(PNA)探针和与DNA-PNA杂合体结合的染料,其中该PNA探针与用于在反应混合物中扩增的靶核酸或其互补序列互补。
在实施方式中,本文提供的反应混合物可包含具有链置换活性的DNA聚合酶。
当核酸在本文被描述为被“扩增”等时,该核酸还可被描述为被“拷贝”等。
在实施方式中,在本文描述为具有第一区域和第二区域的引物中,所述第一区域可含有该引物的5’端,并且所述第二区域可含有该引物的3’端。
在实施方式中,在本文描述为具有尾区和模板结合区的引物中,所述第一区域可含有该引物的5’端,并且所述第二区域可含有该引物的3’端。
在实施方式中,本文提供了用于拷贝多核苷酸模板的方法,该方法包括:在没有热循环的条件下温育包含多核苷酸模板、第一引物和第二引物的反应混合物,其中:所述多核苷酸模板包含第一部分和第二部分;所述第一引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与该多核苷酸模板的第一部分互补;所述第二引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同该多核苷酸模板的第二部分互补的序列互补;所述第一引物的第一区域与所述第二引物的第一区域互补;并生成该多核苷酸模板的多个拷贝。任选地,该多核苷酸模板可进一步包含第三部分,其中所述第三部分位于该多核苷酸模板中第一部分与第二部分之间,并且其中所述第二引物的第一区域与所述多核苷酸模板的第三部分互补。
在实施方式中,本文提供了用于扩增多核苷酸模板的方法,该方法包括在包含第一引物和第二引物的反应混合物中温育所述多核苷酸模板,其中:所述多核苷酸模板包含第一部分、第二部分和第三部分,其中所述第三部分位于该多核苷酸模板中第一部分与第二部分之间;所述第一引物包含第一区域和第二区域,其中所述第一引物的第二区域与所述多核苷酸模板的第一部分互补;并且所述第二引物包含第一区域和第二区域,其中所述第二引物的第二区域与同所述多核苷酸模板的第二部分互补的序列互补,所述第二引物的第一区域与所述第一引物的第一区域互补,并且所述第二引物的第一区域与所述多核苷酸模板的第三部分互补。
在实施方式中,本文提供了用于评估在多核苷酸模板中核苷酸序列的感兴趣位置处的核苷酸的身份的方法,该方法包括:A)在至少第一反应混合物和第二反应混合物的每一个中提供所述多核苷酸模板的拷贝,其中:该多核苷酸模板包含第一部分、第二部分和第三部分,其中所述第三部分位于该多核苷酸模板中所述第一部分与所述第二部分之间,并且其中所述感兴趣的位置在第三部分中;所述第一反应混合物包含所述多核苷酸模板的拷贝、第一引物和第二引物,其中:所述第一引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与所述多核苷酸模板的第一部分互补;所述第二引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同所述多核苷酸模板的第二部分互补的序列互补;所述第一引物的第一区域与所述第二引物的第一区域互补;并且所述第二引物的第一区域与所述多核苷酸模板的第三部分互补;所述第二反应混合物包含所述多核苷酸模板的拷贝、第三引物和第四引物,其中:所述第三引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与所述多核苷酸模板的第一部分互补;所述第四引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同所述多核苷酸模板的第二部分互补的序列互补;所述第三引物的第一区域与所述第四引物的第一区域互补;并且所述第四引物的第一区域与所述多核苷酸模板的第三部分互补;并且所述第二引物的第一区域的核苷酸序列与所述第四引物的第一区域的核苷酸序列相差一个核苷酸,其中如果为了序列的最大互补而用所述多核苷酸模板的第三部分的核苷酸序列定位所述第二引物或第四引物的第一区域的核苷酸序列,则在所述第二引物与第四引物中不同的核苷酸的位置对应于所述多核苷酸模板中感兴趣的核苷酸的位置;B)在没有热循环的条件下温育所述第一反应混合物和第二反应混合物;以及C)比较所述第一反应混合物中多核苷酸模板的扩增速率或量与所述第二反应混合物中多核苷酸模板的扩增速率或量,其中所述多核苷酸模板的扩增速率或量指示所述第二或第四引物的第一区域与所述多核苷酸模板的第三部分的核苷酸序列之间的互补程度。
任选地,在本文提供的涉及多核苷酸模板的实施方式中,该多核苷酸模板是DNA链。
任选地,在本文提供的涉及多核苷酸模板的实施方式中,该多核苷酸模板是RNA链。
任选地,在本文提供的涉及多核苷酸模板的实施方式中,该多核苷酸模板是双链体核酸分子的一条链。在实施方式中,该双链体核酸分子是双链体DNA分子或双链体RNA分子。
任选地,在本文提供的涉及反应混合物、容器或试剂盒的实施方式中,该反应混合物、容器或试剂盒包含具有链置换活性的DNA聚合酶。
任选地,在本文提供的涉及反应混合物、容器或试剂盒的实施方式中,该反应混合物、容器或试剂盒包含逆转录酶。
任选地,在本文提供的涉及反应混合物、容器或试剂盒的实施方式中,该反应混合物、容器或试剂盒包含核酸染料、核苷酸或缓冲液。
任选地,在本文提供的涉及含有第一部分、第二部分和第三部分的多核苷酸模板的实施方式中,该多核苷酸模板可具有3’至5’方向的元件的通用结构1P-1S-3P-2S-2P,其中“1P”是所述第一部分,“1S”是第一间隔区(space),“3P”是所述第三部分,“2S”是第二间隔区,并且“2P”是所述第二部分。所述“第一间隔区”和“第二间隔区”是所述多核苷酸模板的部分,它们含有不是所述第一部分、第二部分或第三部分的一部分的核苷酸。在实施方式中,所述第一部分可具有,例如,6至30个核苷酸或如本文其他地方所述的任何其他数目的核苷酸。在实施方式中,所述第一间隔区可具有,例如,2至30个核苷酸或如本文其他地方所述的任何其他数目的核苷酸。在实施方式中,所述第三部分可具有,例如,4至14个核苷酸或如本文其他地方所述的任何其他数目的核苷酸。在实施方式中,所述第一间隔区可具有,例如,2至30个核苷酸或如本文其他地方所述的任何其他数目的核苷酸。在实施方式中,所述第一部分可具有,例如,6至30个核苷酸或如本文其他地方所述的任何其他数目的核苷酸。
在实施方式中,在本文提供的涉及在反应混合物中温育多核苷酸模板的方法中,可以在该反应混合物的温育过程中生成包含所述多核苷酸模板的至少2、3、4、5或10个拷贝的多联体链。
在实施方式中,本文提供了用于扩增双链核酸分子的方法,该方法包括在包含第一引物和第二引物的反应混合物中温育所述双链核酸分子,其中:所述双链核酸分子包含第一链和第二链,其中所述第一链包含第一部分和第三部分,并且所述第二链包含第二部分;所述第一引物包含第一区域和第二区域,其中所述第一引物的第二区域与所述第一链的第一部分互补;并且所述第二引物包含第一区域和第二区域,其中所述第二引物的第二区域与所述第二链的第二部分互补,所述第二引物的第一区域与所述第一链的第三部分互补,并且所述第二引物的第一区域与所述第一引物的第一区域互补。
在实施方式中,本文提供了一种反应混合物,其包含:多核苷酸模板、第一引物和第二引物,其中:所述多核苷酸模板包含第一部分、第二部分和第三部分,其中所述第三部分位于该多核苷酸模板中第一部分与第二部分之间;所述第一引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与所述多核苷酸模板的第一部分互补;所述第二引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同所述多核苷酸模板的第二部分互补的序列互补;所述第一引物的第一区域与所述第二引物的第一区域互补;并且所述第二引物的第一区域与所述多核苷酸模板的第三部分互补。
在实施方式中,本文提供了用于扩增多核苷酸模板的试剂盒,该试剂盒包含:第一引物和第二引物,其中:所述第一引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与所述多核苷酸模板的第一部分互补;所述第二引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同所述多核苷酸模板的第二部分互补的序列互补;所述第一引物的第一区域与所述第二引物的第一区域互补;并且所述第二引物的第一区域与所述多核苷酸模板的第三部分互补,其中所述第三部分位于该多核苷酸模板中第一部分与第二部分之间。
任选地,在本文提供的涉及试剂盒的实施方式中,该试剂盒的组分可以在至少两个单独的流体隔离的器皿之间分配。
在实施方式中,本文提供了包含两个或更多个流体隔离的器皿的试剂盒,所述器皿共同包含:第一引物、第二引物、第三引物和第四引物,其中:所述第一引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与多核苷酸模板的第一部分互补;所述第二引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同所述多核苷酸模板的第二部分互补的序列互补;所述第三引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与所述多核苷酸模板的第一部分互补;所述第四引物包含第一区域和第二区域,其中所述第一区域包含该引物的5’端,所述第二区域包含该引物的3’端,并且所述第二区域与同所述多核苷酸模板的第二部分互补的序列互补;所述第一引物的第一区域与所述第二引物的第一区域互补;所述第三引物的第一区域与所述第四引物的第一区域互补;并且所述第一引物的第一区域的核苷酸序列与所述第三引物的第一区域的核苷酸序列相差一个核苷酸。任选地,所述第二引物的第一区域和所述第四引物的第一区域均与所述多核苷酸模板的第三部分互补,其中所述第三部分位于该多核苷酸模板中第一部分与第二部分之间。任选地,所述第一引物、第二引物、第三引物和第四引物中的每一个的第二区域为6至30个核苷酸的长度。任选地,所述第一引物、第二引物、第三引物和第四引物中的每一个的第二区域为6至30个核苷酸的长度。
在本文提供的涉及试剂盒的实施方式中,该试剂盒可包含对照核酸链,该对照核酸链包含有待用该试剂盒的试剂检测的多核苷酸模板的核苷酸序列。
在本文提供的方法和组合物中,任选地,可包括PNA探针和染料DiSc2(5)。该PNA探针可以与用于在相关反应中扩增的靶序列及其拷贝特异性地退火,从而形成DNA-PNA双链体。本文提供的方法可包括检测在染料DiSc2(5)与DNA-PNA双链体结合时该染料的颜色变化。在实施方式中,可以在反应开始之后或反应结束之后,向本文提供的反应混合物中添加PNA探针和染料。在实施方式中,可以在反应开始之后至少5、10、15、20、30、40、50、60、70、80、90或100分钟,向本文提供的反应混合物中添加PNA探针和染料。在实施方式中,可以在反应开始之后不超过5、10、15、20、30、40、50、60、70、80、90或100分钟,向本文提供的反应混合物中添加PNA探针和染料。
除非上下文另外明确指出,本文中对生成多核苷酸模板或核酸模板的拷贝或扩增多核苷酸模板或核酸模板的提及包括生成含有多核苷酸模板/核酸模板的序列的拷贝,以及生成含有多核苷酸模板/核酸模板的类似序列的拷贝。例如,如果多核苷酸模板是RNA,则生成模板的拷贝可包括生成这样的拷贝,该拷贝是含有多核苷酸模板的RNA序列的DNA形式的DNA分子(即,在DNA序列中,含有“T”而非“U”)。
附图说明
在附图中,
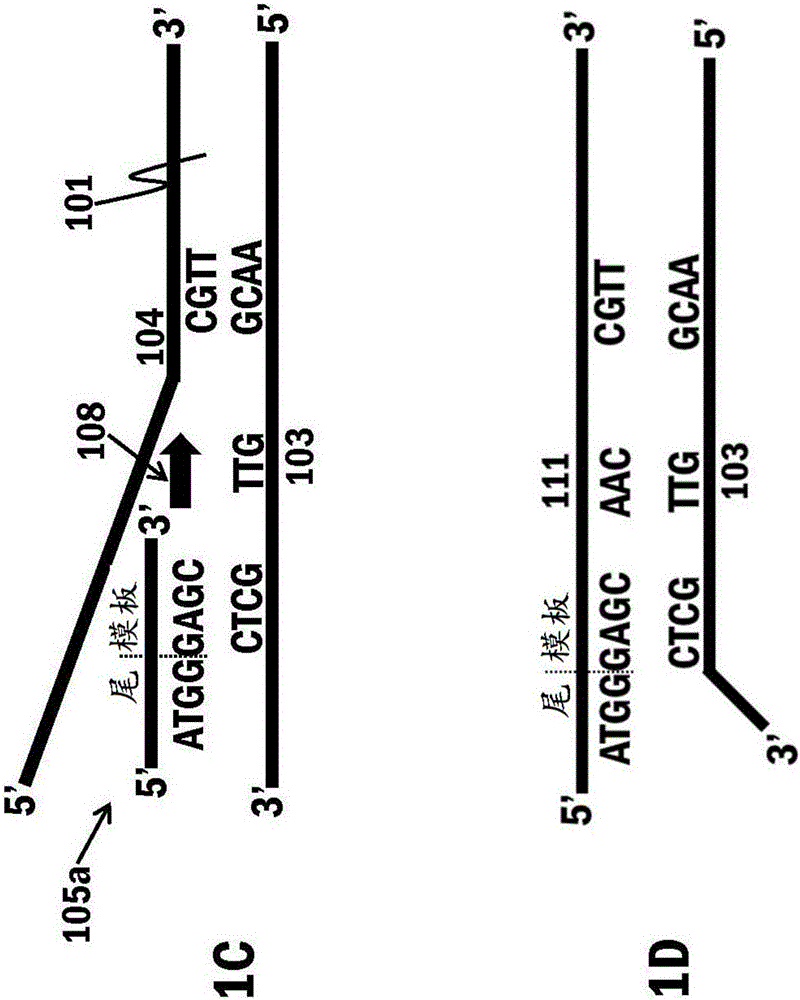
图1为本文提供的方法的总的示意图;图1A-1K示出了本方法的步骤和特征。图1包含以下的核苷酸序列:103:AACGGTTGCTC(SEQ ID NO:1);104:GAGCAACCGTT(SEQ ID NO:2);105:ATGGGAGC(SEQ ID NO:3);106:CCATAACG(SEQ ID NO:4);111:ATGGGAGCAACCGTT(SEQ ID NO:5);112:CCATAACGGTTGCTCCCAT(SEQ ID NO:6);113:ATGGGAGCAACCGTTATGG(SEQ ID NO:7);121:CCATAACGGTTGCTCCCATAACGGTTGCTCCCAT(SEQ ID NO:8);122:ATGGGAGCAACCGTTATGGGAGCAACCGTTATGG(SEQ ID NO:9)。
图2A示出了与本文提供的方法一起使用的某些引物的核苷酸序列。图2A包含以下的核苷酸序列:P1引物,37个核苷酸:CGCCGGATGGCTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:10);P1引物,35个核苷酸:CCGGATGGCTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:11);P1引物,33个核苷酸:GGATGGCTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:12);P1引物,31个核苷酸:ATGGCTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:13);P1引物,30个核苷酸:TGGCTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:14);P1引物,29个核苷酸:GGCTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:15);P1引物,28个核苷酸:GCTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:16);P1引物,27个核苷酸:CTCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:17);P1引物,26个核苷酸:TCTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:18);P1引物,25个核苷酸:CTTGGGAAACCAAACCGTACCAACC(SEQ ID NO:19);P1引物,24个核苷酸:TTGGGAAACCAAACCGTACCAACC(SEQ ID NO:20);P1引物,23个核苷酸:TGGGAAACCAAACCGTACCAACC(SEQ ID NO:21);P2引物,36个核苷酸:GTTTCCCAAGAGCCATCCGGCGATGCGGAATGTACC(SEQ ID NO:22);P2引物,34个核苷酸:GTTTCCCAAGAGCCATCCGGATGCGGAATGTACC(SEQ ID NO:23);P2引物,32个核苷酸:GTTTCCCAAGAGCCATCCATGCGGAATGTACC(SEQ ID NO:24);P2引物,30个核苷酸:GTTTCCCAAGAGCCATATGCGGAATGTACC(SEQ ID NO:25);P2引物,29个核苷酸:GTTTCCCAAGAGCCAATGCGGAATGTACC(SEQ ID NO:26);P2引物,28个核苷酸:GTTTCCCAAGAGCCATGCGGAATGTACC(SEQ ID NO:27);P2引物,27个核苷酸:GTTTCCCAAGAGCATGCGGAATGTACC(SEQ ID NO:28);P2引物,26个核苷酸:GTTTCCCAAGAGATGCGGAATGTACC(SEQ ID NO:29);P2引物,25个核苷酸:GTTTCCCAAGAATGCGGAATGTACC(SEQ ID NO:30);P2引物,24个核苷酸:GTTTCCCAAGATGCGGAATGTACC(SEQ ID NO:31);P2引物,23个核苷酸:GTTTCCCAAATGCGGAATGTACC(SEQ ID NO:32);以及P2引物,22个核苷酸:GTTTCCCAATGCGGAATGTACC(SEQ ID NO:33)。
图2B为示出了根据本文提供的方法进行的反应的结果的图。
图3A和3B示出了与本文提供的方法一起使用的某些引物的核苷酸序列。图3A包含以下的核苷酸序列:C5:ATGGCTCTTGGGAAACTGAAACCGTACCAACC(SEQ ID NO:34);D5:GTTTCCCAAGAGCCATGGATGCGGAATGTACC(SEQ ID NO:35);C6:GGCTCTTGGGAAACTGAAACCGTACCAACC(SEQ ID NO:36);D6:GTTTCCCAAGAGCCGGATGCGGAATGTACC(SEQ ID NO:37);C7:CTCTTGGGAAACTGAAACCGTACCAACC(SEQ ID NO:38);D7:GTTTCCCAAGAGGGATGCGGAATGTACC(SEQ ID NO:39);C8:TCTTGGGAAACTGAAACCGTACCAACC(SEQ ID NO:40);D8:GTTTCCCAAGAGGATGCGGAATGTACC(SEQ ID NO:41);C9:CTTGGGAAACTGAAACCGTACCAACC(SEQ ID NO:42);D9:GTTTCCCAAGGGATGCGGAATGTACC(SEQ ID NO:43);C10:TTGGGAAACTGAAACCGTACCAACC(SEQ ID NO:44);D10:GTTTCCCAAGGATGCGGAATGTACC(SEQ ID NO:45);C11:TGGGAAACTGAAACCGTACCAACC(SEQ ID NO:46);D11:GTTTCCCAGGATGCGGAATGTACC(SEQ ID NO:47);C12:GGGAAACTGAAACCGTACCAACC(SEQ ID NO:48);以及D12:GTTTCCCGGATGCGGAATGTACC(SEQ ID NO:49)。图3B包含以下的核苷酸序列:A1:ATGGCTCTTGGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:50);B1:GTTTCCCAAGAGCCATACAGGGATGCGGAATGTACC(SEQ ID NO:51);A2:GGCTCTTGGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:52);B2:GTTTCCCAAGAGCCACAGGGATGCGGAATGTACC(SEQ ID NO:53);A3:CTCTTGGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:54);B3:GTTTCCCAAGAGACAGGGATGCGGAATGTACC(SEQ ID NO:55);A4:TCTTGGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:56);B4:GTTTCCCAAGAACAGGGATGCGGAATGTACC(SEQ ID NO:57);A5:CTTGGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:58);B5:GTTTCCCAAGACAGGGATGCGGAATGTACC(SEQ ID NO:59);A6:TTGGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:60);B6:GTTTCCCAAACAGGGATGCGGAATGTACC(SEQ ID NO:61);A7:TGGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:62);B7:GTTTCCCAACAGGGATGCGGAATGTACC(SEQ ID NO:63);A8:GGGAAACTGCCTGAAACCGTACCAACC(SEQ ID NO:64);以及B8:GTTTCCCACAGGGATGCGGAATGTACC(SEQ ID NO:65)。
图3C和3D为示出了根据本文提供的方法进行的反应的结果的图。
图4为示出了根据本文提供的方法进行的反应的结果的图。
图5为示出了根据本文提供的方法进行的反应的结果的图。
图6为示出了根据本文提供的方法进行的反应的结果的图。
图7为示出了根据本文提供的方法进行的反应中生成的产物的核苷酸序列的序列比对。图7包含以下的核苷酸序列(按从比对中的顶部序列到比对中的底部序列的顺序):SEQ ID NO:66:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGA;SEQ ID NO:67:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:68:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:69:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:70:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACTGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:71:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:72:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:73:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:74:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:75:TCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAATTCTTGAGAGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:76:GAACCCACTAACAGTAGAAGTACCATACATTTGTACAGAAGGGGAAGACCAAATGAACCCACTAACAGTAGAAGTACCATACATTT;SEQ ID NO:77:TCTTGAGAGAACCCACTAACTCTTGAGAGAACCCACTAAC;以及SEQ ID NO:78:GGAAGACCAAATTCTTGAGA。
图8A-8C是本文提供的分子的实施方式的特征的一般示意图。
图9是本文提供的分子的实施方式的特征的一般示意图。
图10A-10C是本文提供的分子的实施方式的特征的一般示意图。
图11是描绘根据本文提供的方法进行的反应的结果的图。
图12是描绘根据本文提供的方法进行的反应的结果的图。
需要注意的是,附图和其中的元件不必要按形状或比例绘制。例如,为便于呈现或使呈现清楚,附图中元件的形状或比例可进行简化或修改。应进一步理解,附图和其中的元件仅用于示例性说明目的,不应理解为以任何方式进行限制。
具体实施方式
尽管本发明包括各种修改和替代形式,但其具体实施方式通过附图中的示例示出并将在本文中详细描述。然而,应理解,并非意在将本发明限于所公开的特定形式,而是相反,本发明覆盖如由权利要求所限定的本发明的精神和范围内的所有修改、等同项和替代方案。
在一些实施方式中,本文提供了涉及核酸扩增和多联体生成的方法和组合物。
在本文提供的方法中,核酸多联体的生成还增加了该多联体中的核酸模板/特定核酸的拷贝数。因此,本文中对用于生成多联体的方法和组合物的提及还适用于核酸的扩增。
如本文所用的,“多核苷酸”指的是含有两个或更多个核苷酸的聚合链。“多核苷酸”包括引物、寡核苷酸、核酸链等。多核苷酸可含有标准或非标准核苷酸。通常,多核苷酸在链的一个末端(“5’末端”)含有5’磷酸并在链的另一末端(“3’末端”)含有3’羟基基团。多核苷酸的最5’核苷酸在本文中可被称为多核苷酸的“5’末端核苷酸”。多核苷酸的最3’核苷酸在本文中可被称为多核苷酸的“3’末端核苷酸”。
在含有5’末端核苷酸和3’末端核苷酸的多核苷酸的上下文中如本文所用的术语“下游”指的是比多核苷酸中的参考位置更接近3’末端核苷酸的该多核苷酸中的位置。例如,在具有序列5’ATAAGC 3’的引物中,“G”在“T”和全部“A”的下游。
在含有5’末端核苷酸和3’末端核苷酸的多核苷酸的上下文中,如本文所用的术语“上游”指的是比多核苷酸中的参考位置更接近5’末端核苷酸的该多核苷酸中的位置。例如,在具有序列5’ATAAGC 3’的引物中,“T”在“G”、“C”以及最接近“G”的两个“A”的上游。
如本文所用的,“核酸”包括DNA和RNA两者,包括含有非标准核苷酸的DNA和RNA。“核酸”含有至少一个多核苷酸(“核酸链”)。核酸可以是单链或双链的。
如本文所用的,“多联体”指的是在其内含有特定核酸的两个或更多个拷贝的核酸分子,其中这些拷贝串联连接。在该多联体内,特定核酸的拷贝可彼此直接连接,或者它们可间接地连接(例如,在特定核酸的拷贝之间可具有核苷酸)。在一个实例中,该特定核酸可以是双链核酸模板的核酸,以使得多联体可含有该双链核酸模板的两个或更多个拷贝。在另一个实例中,该特定核酸可以是多核苷酸模板的核酸,以使得多联体可含有该多核苷酸模板的两个或更多个拷贝。
如本文所用的,“靶”核酸或分子指的是感兴趣的核酸。靶核酸/分子可以是任何类型,包括单链或双链DNA或RNA(例如,mRNA)。
如本文所用的,“互补”序列指的是这样的两个核苷酸序列,这两个核苷酸序列在彼此反平行对齐时,含有按照标准碱基配对原则(例如,A-T、G-C或A-U)可彼此配对的多个单独的核苷酸碱基,使得含有该序列的分子可彼此特异性地退火。对于被认为“互补”的序列,不必要两个序列中的每一个核苷酸碱基均能够彼此配对。例如,如果当两个序列对于互补而最佳对齐时,该两个序列中至少30%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的核苷酸碱基可彼此配对,则该序列可被认为是互补的。此外,当两个序列的总长度彼此明显不同时,该序列仍可被认为“互补”。例如,如果当15个核苷酸的引物与含有数百个核苷酸的更长的多核苷酸的特定区域反向平行对齐时,该引物的多个单独的核苷酸碱基可与更长的多核苷酸中的核苷酸碱基配对,则该15个核苷酸的引物可被认为与该含有数百个核苷酸的更长的多核苷酸“互补”。此外,“互补”序列可含有一种或多种核苷酸类似物或核碱基类似物。如本文所用的,“完全互补的”或“完全互补”等是指彼此100%互补的两个序列(即当所述序列为了最大互补而配对时,所述序列的核苷酸之间没有错配)。
如本文所用的,当应用于蛋白质、核酸或其他生物分子时,术语“分离的”指的是已从其天然存在的环境的组分中纯化或分离的分子(例如,从其天然产生的细胞中纯化的蛋白质)。“分离的”分子可与其他分子相接触(例如,作为反应混合物的一部分)。如本文所用的,“分离的”分子还包括具有天然存在的氨基酸或核苷酸序列的重组产生的蛋白质或核酸。“分离的”核酸包括在细胞中包含的编码多肽的核酸分子,该细胞通常在例如该核酸分子在与天然细胞不同的染色体位置时表达多肽。在一些实施方式中,“分离的”多肽被纯化为至少50%、60%、70%、80%、90%、95%、98%或100%的同质性,如通过多肽的SDS-PAGE以及随后的考马斯蓝、银或其他蛋白质染色方法所显示的。
除非上下文中另外明确指出,如本文所用的,描述为含有模板或其他核酸的“序列”的核酸分子也可被认为含有该模板或其他核酸本身(例如,被描述为含有模板的序列的分子也可以被描述为含有该模板)。
如本文所用的,当第一多核苷酸被描述为与第二多核苷酸“退火”等时,第一多核苷酸全部或其任何部分可与第二多核苷酸退火,反之亦然。
如本文所用的,提及在某一条件下或采用其他对象等“处理”给定对象指的是直接或间接地将给定对象暴露于所提及的条件或其他对象。因此,尽管“处理”步骤可包括不同的相关操作(例如,将酶加入到容器中,振动容器等),但并非每一个“处理”步骤都需要不同的相关操作。例如,包括一种或多种试剂的反应可设置在容器中,并且一旦反应已经开始,则多个事件或步骤可以在容器中发生而不进一步人为或机械干预容器中的内容物。在容器中进行的这些多个事件或步骤中的一个或多个可以被描述为“处理”容器中的对象,即使在反应开始后不单独地干预容器中的内容物。
可参考图1对本文提供的方法和组合物的实施方式进行描述。可提供一级核酸101(图1A)。一级核酸101可含有核酸模板102的序列。核酸模板102可以是含有第一链103和第二链104的双链核酸。在图1中,双链核酸模板的第一链103具有5’至3’方向的示例性核苷酸序列AACGGTTGCTC(SEQ ID NO:1)。第一链103还包含5’末端核苷酸(最5’的A)和3’末端核苷酸(最3’的C)。第二链104具有5’至3’方向的示例性核苷酸序列GAGCAACCGTT(SEQ ID NO:2)。第二链104还包含5’末端核苷酸(最5’的G)和3’末端核苷酸(最3’的T)。
还可提供第一引物105和第二引物106(图1B)。在图1中,第一引物105具有5’至3’方向的示例性核苷酸序列ATGGGAGC(SEQ ID NO:3)。第一引物还包含5’末端核苷酸(最5’的A)和3’末端核苷酸(最3’的C)。第二引物106具有5’至3’方向的示例性核苷酸序列CCATAACG(SEQ ID NO:4)。第二引物还包含5’末端核苷酸(最5’的C)和3’末端核苷酸(最3’的G)。虽然图1的核酸模板102是11个核苷酸的长度并具有示例性核苷酸序列,但这些是示例性的,并不被认为是限制。
第一引物105可包含两个区域:i)尾区以及ii)模板结合区(“模板”区)。第一引物105的尾区可包含三个部分:a)引物的5’末端核苷酸,b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,以及c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸。在图1中,第一引物105的尾区具有5’至3’方向的示例性核苷酸序列:ATGG,在该序列中,引物的5’末端核苷酸为A,中间部分为中间的TG,且最内核苷酸为最3’的G。第一引物105的模板结合区可包含三个部分:a)引物的3’末端核苷酸,b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,以及c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸。在图1中,第一引物105的模板结合区具有5’至3’方向的示例性核苷酸序列:GAGC,在该序列中,引物的3’末端核苷酸为C,中间部分为中间的AG,且最内核苷酸为最5’的G。
第二引物106可包含两个区域:i)尾区以及ii)模板结合区。第一引物106的尾区可包含三个部分:a)引物的5’末端核苷酸,b)最内核苷酸,其中该最内核苷酸在5’末端核苷酸的下游,以及c)5’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸。在图1中,第二引物106的尾区具有5’至3’方向的示例性核苷酸序列:CCAT,在该序列中,引物的5’末端核苷酸为最5’的C,中间部分为中间的CA,且最内核苷酸为T。第二引物106的模板结合区可包含三个部分:a)引物的3’末端核苷酸,b)最内核苷酸,其中该最内核苷酸在3’末端核苷酸的上游,以及c)3’末端核苷酸与最内核苷酸之间的中间部分,该中间部分包含一个或多个核苷酸。在图1中,第二引物106的模板结合区具有5’至3’方向的示例性核苷酸序列:AACG,在该序列中,引物的3’末端核苷酸为G,中间部分为中间的AC,且最内核苷酸为最5’的A。
在一些实施方式中,如果将引物的序列对齐使得第二引物的5’末端核苷酸与第一引物的尾区的最内核苷酸对齐并且第一引物的5’末端核苷酸与第二引物的尾区的最内核苷酸对齐,则第二引物的尾区可含有与第一引物的尾区的核苷酸序列互补的核苷酸序列。例如,在图1中,第二引物106的尾区具有5’至3’方向的核苷酸序列CCAT,并且第一引物105的尾区具有5’至3’方向的核苷酸序列ATGG。当第二引物的5’末端核苷酸(C)与第一引物的尾区的最内核苷酸(G)对齐并且第一引物的5’末端核苷酸(A)与第二引物的尾区的最内核苷酸(T)对齐107时,这些序列是互补的(图1B)。
应注意,虽然第二引物的尾区可含有与第一引物的尾区的核苷酸序列互补的核苷酸序列,但通常由第一引物与第二引物退火而形成的产物对于本文提供的方法或组合物不是期望的或有用的。因此,在一些实施方式中,可以采取步骤来最小化第一引物-第二引物退火产物的形成。这样的步骤可包括,例如,在开始本文提供的方法之前不在引物可相互作用持续延长的时间段的条件下对第一引物和第二引物进行预温育。
可在使得第一引物的第一拷贝105a的模板结合区与核酸模板的第一链103退火(图1C)并且形成第一引物的第一拷贝的延伸产物111(图1D)的条件下,用第一引物的第一拷贝105a和聚合酶108处理一级核酸101。聚合酶108可催化第一引物的第一拷贝的延伸产物111的形成。该聚合酶可具有链置换活性。在合成第一引物的第一拷贝的延伸产物111的过程中,聚合酶可从核酸模板的第一链103置换核酸模板的第二链104。通常,由第一引物的第一拷贝105a的3’端生成延伸产物。在生成第一引物的第一拷贝的延伸产物111的过程中,第一引物的第一拷贝105a可与合成的延伸产物共价连接,使得第一引物的第一拷贝变为本文描述为“第一引物的第一拷贝的延伸产物”的分子的一部分。第一引物的第一拷贝的延伸产物111与核酸模板的第一链103互补。在一些实施方式中,当第一引物的第一拷贝105a与核酸模板的第一链103退火时,模板结合区而非第一引物的第一拷贝105a的尾区与核酸模板的第一链退火。
在一些实施方式中,使得第一引物的第一拷贝105a的模板结合区与核酸模板的第一链103退火并形成第一引物的第一拷贝的延伸产物111的条件可包括足以支持基于聚合酶的核酸合成的任何条件。针对基于聚合酶的核酸合成的示例性条件是本领域已知的并提供于例如,Molecular Cloning:A Laboratory Manual,M.R.Green and J.Sambrook,Cold Spring Harbor Laboratory Press(2012)中,该文献通过引用全文并入本文。在实施方式中,第一引物或第二引物的模板结合区可支持由核酸聚合酶进行的引物的模板依赖性延伸,这可从引物的3’端延伸引物。
可在使得第二引物106的模板结合区与第一引物的第一拷贝的延伸产物111退火(图1E)并形成第二引物的延伸产物112(图1F)的条件下,用第二引物106和聚合酶108处理第一引物的第一拷贝的延伸产物111。聚合酶108可催化第二引物106的延伸产物的形成。该聚合酶可具有链置换活性。聚合酶可以是与用于生成第一引物的第一拷贝的延伸产物111的聚合酶相同类型的聚合酶,或者它可以是不同类型的聚合酶。在合成第二引物的延伸产物112的过程中,聚合酶可从第一引物的第一拷贝的延伸产物111置换核酸模板的第一链103。通常,由第二引物106的3’端生成延伸产物。在生成第二引物的延伸产物112的过程中,第二引物106可与合成的延伸产物共价连接,使得第二引物变为本文描述为“第二引物的延伸产物”的分子的一部分。第二引物的延伸产物112与第一引物的第一拷贝的延伸产物111互补。在一些实施方式中,当第二引物106与第一引物的第一拷贝的延伸产物111退火时,模板结合区而非第二引物106的尾区与第一引物的第一拷贝的延伸产物111退火。第二引物的延伸产物112含有5’末端核苷酸、3’末端核苷酸以及3’末端区。3’末端区的最后的核苷酸(T)是第二引物的延伸产物的3’末端核苷酸(T),并且该3’末端区含有与在5’至3’方向读取的第二引物的尾区的核苷酸序列(CCAT)相同的核苷酸序列。
在一些实施方式中,使得第二引物106的模板结合区与第一引物的第一拷贝的延伸产物111退火并形成第二引物的延伸产物112的条件可包括足以支持基于聚合酶的核酸合成的任何条件,包括本文其他地方讨论的任何条件。该条件可与用于生成第一引物的第一拷贝的延伸产物111的条件相同,或者它们可以是不同的条件。
可在使得第一引物的第二拷贝105b的模板结合区与第二引物的延伸产物112退火(图1G)并形成第一引物的第二拷贝的延伸产物113(图1H)的条件下,用第一引物的第二拷贝105b和聚合酶108处理第二引物的延伸产物112。聚合酶108可催化第一引物的第二拷贝的延伸产物113的形成。该聚合酶可具有链置换活性。聚合酶可以是与用于生成第一引物的第一拷贝的延伸产物111或第二引物的延伸产物112的聚合酶相同类型的聚合酶,或者它可以是不同类型的聚合酶。在合成第一引物的第二拷贝的延伸产物113的过程中,聚合酶可从第二引物的延伸产物112置换第一引物的第一拷贝的延伸产物111。通常,由第一引物的第二拷贝105b的3’端生成延伸产物。在生成第一引物的第二拷贝的延伸产物113的过程中,第一引物的第二拷贝105b可与合成的延伸产物共价连接,使得第一引物的第二拷贝变为本文描述为“第一引物的第二拷贝的延伸产物”的分子的一部分。第一引物的第二拷贝的延伸产物113与第二引物的延伸产物112互补。在一些实施方式中,当第一引物的第二拷贝105b与第二引物的延伸产物112退火时,第一引物的第二拷贝105b的模板结合区和尾区均与第二引物的延伸产物112退火。第一引物的第二拷贝的延伸产物113含有5’末端核苷酸、3’末端核苷酸以及3’末端区。3’末端区的最后的核苷酸(G)是第二引物的延伸产物的3’末端核苷酸(G),并且该3’末端区含有与在5’至3’方向读取的第一引物的尾区的核苷酸序列(ATGG)相同的核苷酸序列。
在一些实施方式中,使得第一引物的第二拷贝105b的模板结合区与第二引物的延伸产物112退火并形成第一引物的第二拷贝的延伸产物113的条件可包括足以支持基于聚合酶的核酸合成的任何条件,包括本文其他地方讨论的任何条件。该条件可与用于生成第一引物的第一拷贝的延伸产物111或第二引物的延伸产物112的条件相同,或者它们可以是不同的条件。
第一引物的第二拷贝的延伸产物113的生成可导致生成包含第一引物的第二拷贝的延伸产物113和第二引物的延伸产物112的分子,该分子在本文中可被称为“二级核酸”115。在二级核酸115内,第一引物的第二拷贝的延伸产物113可与第二引物的延伸产物112退火。此外,二级核酸115含有核酸模板102的序列。该二级核酸115具有比单独核酸模板102长的核苷酸长度,因为除核酸模板102的序列之外,它还可包含第一引物和第二引物的尾区的序列及其互补序列。具体而言,二级核酸115可具有第一端区域116和第二端区域117。第一端区域116可包含第二引物的延伸产物112的3’末端区及其互补序列。第二端区域117可包含第一引物的第二拷贝的延伸产物113的3’末端区及其互补序列。
可形成或提供二级核酸115的第一拷贝115a和第二拷贝115b(图1I)。二级核酸115的第一拷贝115a和第二拷贝115b可采用通过其可生成具有二级核酸115的通用结构的核酸的任何方法生成,包括本文其他地方讨论的任何方法。例如,如上文所述的用于由一级核酸101生成二级核酸115的全部过程可重复两次,以便生成该二级核酸的第一拷贝115a和第二拷贝115b。在另一个实例中,二级核酸的第一拷贝115a和第二拷贝115b可由第一引物的第一拷贝的延伸产物111的单一拷贝生成。在这一实例中,第二引物的延伸产物的两个拷贝112a、112b可由第一引物的第一拷贝的延伸产物111的单一拷贝生成,这在从第一引物的第一拷贝的延伸产物111的单一拷贝置换第二引物的延伸产物的第一拷贝112a时,可能发生,从而允许由第一引物的第一拷贝的延伸产物111的单一拷贝生成第二引物的延伸产物的第二拷贝112b。然后,例如,第一引物的第二拷贝的延伸产物113a、113b可分别由第二引物的延伸产物的各个拷贝112a、112b生成。也可进行用于生成二级核酸的第一拷贝115a和第二拷贝115b的另外的程序并将该程序与本文提供的方法一起使用。
可在使得二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物113a的3’末端区与二级核酸的第二拷贝的第二引物的延伸产物112b的3’末端区退火的条件下,处理二级核酸的第一拷贝115a和第二拷贝115b,以产生包含这些链的交换结构118(图1J)(为简单起见,未示出链113b和112a)。可在使得形成两个组分链112b、113a的延伸产物(该延伸产物在本文中可分别称为“第一多联体链”121和“第二多联体链”122)的条件下,用聚合酶进一步处理交换结构118。第一多联体链121和第二多联体链122可退火在一起并可共同被称为多联体120(图1K)。多联体120可含有核酸模板102的两个或更多个拷贝。在多联体120内,核酸模板102的两个或更多个拷贝中的一些或全部可通过第一引物105和第二引物106的尾区的序列彼此分隔开,其中尾区的序列彼此退火。例如,在图1K的多联体120中,双链核酸模板的第一链的第一拷贝通过5’-3’顺序的序列CCAT与双链核酸模板的第一链的第二拷贝分隔开。CCAT还是第二引物106的尾区的5’-3’顺序的序列。类似地,在图1K的多联体120中,双链核酸模板的第二链的第一拷贝通过5’-3’顺序的序列ATGG与双链核酸模板的第二链的第二拷贝分隔开。ATGG还是第一引物105的尾区的5’-3’顺序的序列。在多联体内,第一多联体链的CCAT与第二多联体链的ATGG退火。
在一些实施方式中,使得形成交换结构118或交换结构的链的延伸产物的条件可包括足以支持基于聚合酶的核酸合成的任何条件,包括本文其他地方讨论的任何条件。该条件可与如用于生成第一引物的第一拷贝的延伸产物111、第二引物的延伸产物112或第一引物的第二拷贝的延伸产物111的条件相同,或者它们可以是不同的条件。
在一些实施方式中,本文提供的多联体可根据图1I-1K中的总体概述的过程进一步增加长度。例如,可处理如图1K所示的多联体分子120中的两个,使得它们形成与图1J中所示的结构相似的交换结构(除了具有更长的链),随后生成包含核酸模板102的四个拷贝的更大的多联体分子。在另一实例中,二级核酸115和多联体120可形成交换结构,随后生成含有核酸模板102的三个拷贝的更大的多联体分子。在一些实施方式中,在本文提供的方法中,可同时生成多个不同长度的多个不同的多联体。
在实施方式中,可参考图8对本文提供的方法和组合物进行描述。多核苷酸模板800(图8A)可以是用于扩增的靶标。多核苷酸模板800是单一核酸链。该多核苷酸模板链可作为游离的单链分子存在,或者它可作为双链分子的一部分存在,在该双链分子中该多核苷酸模板链与其互补链退火。多核苷酸模板800可以是DNA或RNA。
多核苷酸模板800可含有至少第一部分801(也用“(i)”表示)和第二部分802(也用“(ii)”表示)。第一部分801和第二部分802可各自含有任何数目的核苷酸,诸如各自少于1000、500、400、300、200、100、90、80、70、60、50、40、30、20、15、10、9、8、7、6、5、4或3个核苷酸或各自至少1000、500、400、300、200、100、90、80、70、60、50、40、30、20、15、10、9、8、7、6、5、4或3个核苷酸。通常,第一部分801和第二部分802可以各自含有10至30个核苷酸,尽管第一部分801和第二部分802也可以是如本文其他地方所述的其他长度。第一部分801和第二部分802可含有相同或不同数目的核苷酸。在一些实施方式中,除第一部分801和第二部分802之外,多核苷酸模板800还可含有其他部分。在其他实施方式中,第一部分801和第二部分802可构成多核苷酸模板800的全部。多核苷酸模板800可具有本文其他地方所述的核酸模板的长度。多核苷酸模板800可以是一级核酸的一部分。多核苷酸模板可存在于从受试者获得的样品中。
多核苷酸模板800可在含有第一引物810和第二引物820的反应混合物中进行温育(图8B)。通常,该反应混合物含有每个引物的多个拷贝,例如,每个引物的至少4、5、6、10、15、20、50、100、1000、10,000、100,000或1百万个拷贝或更多个拷贝。第一引物810可具有第一区域811(也用“(i)”表示)和第二区域812(也用“(ii)”表示)。第一引物的第一区域811可具有5’端,并且第一引物的第二区域812可具有3’端。第一引物的第一区域可具有与第一引物的第二区域的核苷酸序列不同的核苷酸序列。第二引物820可具有第一区域821(也用“(i)”表示)和第二区域822(也用“(ii)”表示)。第二引物的第一区域821可具有5’端,并且第二引物的第二区域822可具有3’端。第二引物的第一区域可具有与第二引物的第二区域的核苷酸序列不同的核苷酸序列。
第一引物的第二区域812可具有与多核苷酸模板的第一部分801的核苷酸序列互补的核苷酸序列。在图8中,多核苷酸模板的第一部分801的核苷酸序列由字母A表示,并且第一引物的第二区域812的核苷酸序列由字母A’表示,其中A和A’彼此互补。第二引物的第二区域822可具有与配偶体核苷酸序列830互补的核苷酸序列,其中配偶体核苷酸序列830与多核苷酸模板的第二部分802的核苷酸序列互补。在图8中,多核苷酸模板的第二部分802的核苷酸序列由字母B表示,配偶体核苷酸序列830的核苷酸序列由字母B’表示,并且第二引物的第二区域822的核苷酸序列由字母B表示,其中B和B’彼此互补。换言之,如图8所示,多核苷酸模板的第二部分802的核苷酸序列(B)可与第二引物的第二区域822的核苷酸序列(B)相同。通过采用本文提供的组合物和方法,可生成配偶体核苷酸序列830,例如,作为来自第一引物的3’端的延伸产物的一部分。在实施方式中,第一引物的第一区域811可与第二引物的第一区域821互补。在图8中,第一引物的第一区域的核苷酸序列由字母C表示,并且第二引物的第一区域的核苷酸序列由字母C’表示,其中C和C’彼此互补。
在实施方式中,图8的第一引物和第二引物可分别具有本文其他地方所述的第一引物和第二引物的任何特征(例如,如图1中的)。而且,在实施方式中,图8的第一引物的第一区域可具有本文其他地方所述的第一引物的尾区的任何特征。在实施方式中,图8的第一引物的第二区域可具有本文其他地方所述的第一引物的模板结合区的任何特征。在实施方式中,图8的第二引物的第一区域可具有本文其他地方所述的第二引物的尾区的任何特征。在实施方式中,图8的第二引物的第二区域可具有本文其他地方所述的第二引物的模板结合区的任何特征。
在实施方式中,含有多核苷酸模板800和第一引物810的至少两个拷贝以及第二引物820的至少两个拷贝的反应混合物可含有一个或多个可支持如本文其他地方所述的基于聚合酶的核酸合成的其他组分(例如,聚合酶、核苷酸、缓冲液、水等)。相似地,含有多核苷酸模板800和第一引物810的至少两个拷贝以及第二引物820的至少两个拷贝的反应混合物可在本文其他地方所述的用于支持核酸模板的扩增或多联体的生成的任何反应条件下进行温育。
在实施方式中,在如本文所述在反应混合物中温育多核苷酸模板800和第一引物810的至少两个拷贝以及第二引物820的至少两个拷贝时,可形成一个或多个多联体链(图8C)。在实施方式中,形成的多联体链840可具有5’和3’端,并可具有含有5’至3’方向的通用结构C’-T-C’-T-X-C’的序列,其中C’是第二引物的第一区域的核苷酸序列,T是多核苷酸模板的序列或其类似序列,并且X是任何数目和序列的核苷酸。因此,如由多联体链的通用结构所示的,多联体链可含有多核苷酸模板的序列或其类似序列的至少两个拷贝,其中多核苷酸模板的序列的拷贝由至少第二引物的第一区域的序列分隔开。在实施方式中,T可以是多核苷酸模板的类似序列。如本文所用的,多核苷酸模板的“类似序列”指的是含有作为多核苷酸模板的相似序列,而非含有多核苷酸模板中的核苷酸的一个或多个相似的核苷酸的序列。因此,例如,如果多核苷酸模板含有RNA序列,则其类似序列可以是相同序列的DNA形式(即,RNA序列中的尿嘧啶在类似的DNA序列中是胸腺嘧啶),或反之亦然。继续该实例,如果多核苷酸模板含有5’UACCUG 3’的RNA序列,则类似的序列是5’TACCTG 3’的DNA序列。
在实施方式中,在含有5’至3’方向的通用结构C’-T-C’-T-X-C’的序列中,X是零个核苷酸(即,X的任一侧上的T和C序列直接连接)。在其他实施方式中,X是少于10,000、5000、4000、3000、2000、1000、500、400、300、200、100、90、80、70、60、50、40、30、20、15、10、9、8、7、6、5、4或3个核苷酸。X中的核苷酸(如果有)可具有任何序列。在实施方式中,X含有具有5’至3’方向的通用结构[(C’-T)N]的序列,其中C’是第二引物的第一区域的核苷酸序列,T是多核苷酸模板的序列或其类似序列,并且N是小于1000、500、200、100、50或10的任何整数,诸如1至500、1至200、1至100、1至50或1至10之间的整数。例如,如果当X含有5’至3’方向的通用结构[(C’-T)N]的序列时“N”是3,则在结构C’-T-C’-T-X-C’的X位置上存在3个连续重复的(C’-T),使得相应的结构可以写成:C’-T-C’-T–C’-T–C’-T–C’-T-C’,其中,带下划线的C’和T是式[(C’-T)3]的C’-T的重复。因此,例如,根据本文提供的组合物和方法,可形成含有多核苷酸模板的数十或数百个拷贝的多联体链。在实施方式中,如图8所提供的多联体链可具有本文其他地方所述的多联体链的任何特征。而且,在一些实施方式中,在生成多联体链的过程中,在具有通用结构C’-T-C’-T-X-C’的序列中的C’或T的一个或多个位置处,可在C’与T之间插入少量的核苷酸(例如,15个或更少、10个或更少、5个或更少、或3个或更少)。而且,在一些实施方式中,在生成多联体链的过程中,在具有通用结构C’-T-C’-T-X-C’的序列中的C’或T的一个或多个位置处,少量的核苷酸(例如,15个或更少、10个或更少、5个或更少、或3个或更少)可从C’或T序列中缺失。因此,根据本文提供的方法生成的多联体链可包括具有如本文提供的通用结构的链,但该链可在多联体链的不同序列组分之间的一个或多个接合点(即,模板序列与引物序列/T和C’之间的接合)处添加或去除少量核苷酸。而且,在实施方式中,如本文提供的多联体链可在含有多联体(该多联体含有具有通用结构C’-T-C’-T-X-C’的序列)的分子的5’或3’端含有附加的核苷酸(例如,多达3、5、10、20、50、100、500、1000个或更多个附加的核苷酸)。在实施方式中,通用结构C’-T-C’-T-X-C’的C’可具有本文其他地方所述的第二引物的尾区的任何特征(例如,长度、序列)。在实施方式中,通用结构C’-T-C’-T-X-C’的T可具有本文其他地方所述的多核苷酸模板链的任何特征(例如,长度、序列)。
在实施方式中,根据本文提供的方法生成的多联体链840可以是单链分子的一部分。在其他实施方式中,根据本文提供的方法生成的多联体链840可以是双链多联体的一部分,在该双链多联体中多联体链840与互补于多联体链850的链退火。虽然图8C描绘了含有具有5’至3’方向的通用结构C’-T-C’-T-X-C’(链840)或C-T’-C-T’-X’-C(链850)的序列的多联体链(其中X是0个核苷酸),但根据图8的示意图生成的多联体链可具有上文或本文其他地方所述的多联体链的任何特征。而且,关于图8C,序列A和B是模板链的一部分,并且因此不在通用结构C’-T-C’-T-X-C’或C-T’-C-T’-X’-C中单独用符号表示。
为了进一步说明在图8的实施方式中元件的关系,图8提供了区块(blocks)860、862、864、866和868。区块860(具有反斜线样填充)指示总多核苷酸模板序列(即元件800)或其互补序列的相对位置。区块862(具有垂直线填充)指示所述多核苷酸模板的第一部分的序列(即元件801的序列的相对位置)或其互补序列的相对位置。因此,区块862还表示第一引物的第二区域(即元件812)的序列,它与元件801互补。区块864(具有垂直和水平线填充)指示所述多核苷酸模板的第二部分的序列(即元件802的序列的相对位置)或其互补序列的相对位置。因此,区块864还表示配偶体核苷酸序列(即元件830)的序列,它与元件802互补。区块864还指示第二引物的第二区域822的序列的相对位置,该序列可以是与所述多核苷酸模板的第二部分(元件802)的序列相同的序列,或相似的序列。换言之,在实施方式中,822的核苷酸序列可以与802的核苷酸序列相同或相似。例如,如图8A中所示,在实施方式中,在多核苷酸模板中具有不是该多核苷酸模板的第一部分或第二部分的一部分的核苷酸。例如,在一个实例中,所述多核苷酸模板的第一部分可含有15个核苷酸,所述多核苷酸模板的第二部分可含有15个核苷酸,并且所述多核苷酸模板的第一部分与第二部分之间为25个核苷酸。通常,所述多核苷酸模板的第一部分和所述多核苷酸模板的第二部分各自为10至30个核苷酸的长度,尽管也考虑其他数目。例如,所述多核苷酸模板的第一部分和第二部分中的每一个可以为至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50或100个核苷酸,不多于5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50或100个核苷酸,或至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45或50个核苷酸且不多于6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50或100个核苷酸(上限高于下限)。在实施方式中,在所述多核苷酸模板中第一部分与第二部分之间可以具有例如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200或500个核苷酸,不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200或500个核苷酸,或至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100或200个核苷酸且不多于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、100、200或500个核苷酸(上限高于下限)。区块866(具有波浪线填充)指示第一引物的第一区域的序列(即元件811/区域“C”的序列的相对位置)或其互补序列的相对位置。因此,区块866还表示第二引物的第一区域(元件821/区域“C”)的序列,它与元件811互补。区块868(具有菱形填充)指示多联体链(即元件840)的序列或其互补序列的相对位置。因此,区块868还表示与所述多联体链互补的链(元件850)的序列。如图8C中所示,在多联体链或其互补体(868)中存在所述多核苷酸模板序列或其互补体(860)的两个拷贝,这两个拷贝被第一引物的第一区域的核苷酸序列或其互补体(866)分隔开。此外,在多联体链或其互补体(868)中,第一引物的第一区域的核苷酸序列或其互补体(866)在两端侧接所述多核苷酸模板序列或其互补体(860)。而且,在多联体链或其互补体(868)中,具有第一引物的第二区域的序列或其互补体(862)的两个拷贝和第二引物的第二区域的序列或其互补体(864)的两个拷贝,它们均作为所述多核苷酸模板序列或其互补体的两个拷贝的一部分而以两个拷贝存在。区块860、862、864、866和868不应被解释为规定图8的元件之间的任何所需的特定大小关系;相反,在本文提供的某些实施方式中,区块860、862、864、866和868仅用于帮助说明图8的元件相对于彼此的一般位置。
根据本文提供的方法和组合物生成的多联体可以是任何长度的核苷酸。在一些实施方式中,本文生成的多联体分子可以是至少30、40、50、60、70、80、90、100、150、200、250、300、400、500、600、700、800、900、1000、1500、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000或25,000个核苷酸的长度。在一些实施方式中,本文生成的多联体分子可以是不多于30、40、50、60、70、80、90、100、150、200、250、300、400、500、600、700、800、900、1000、1500、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000或25,000个核苷酸的长度。在一些实施方式中,本文生成的多联体分子可具有选自最小值为30、40、50、60、70、80、90、100、150、200、250、300、400、500、600、700、800、900、1000、1500、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000或20,000个核苷酸的长度且最大值为40、50、60、70、80、90、100、150、200、250、300、400、500、600、700、800、900、1000、1500、2000、3000、4000、5000、6000、7000、8000、9000、10,000、15,000、20,000或25,000个核苷酸的长度的范围的长度。在一些实施方式中,根据本文提供的方法或组合物生成的至少一些多联体具有上文所述的特征。在一些实施方式中,根据本文提供的方法或组合物生成的至少10%、20%、30%、40%、50%、60%、70%、80%、90%或95%的多联体具有上文所述的特征。
根据本文提供的方法和组合物生成的多联体可含有核酸模板或特定核酸的任何数目的拷贝。在一些实施方式中,本文生成的多联体分子可含有核酸模板或特定核酸的至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80、90或100个拷贝。在一些实施方式中,本文生成的多联体分子可含有核酸模板或特定核酸的不多于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80、90或100个拷贝。在一些实施方式中,本文生成的多联体分子可具有核酸模板或特定核酸的选自最小值为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80或90个拷贝且最大值为3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80、90或100个拷贝的范围的多个拷贝。在一些实施方式中,根据本文提供的方法或组合物生成的至少一些多联体具有上文所述的特征。在一些实施方式中,根据本文提供的方法或组合物生成的至少10%、20%、30%、40%、50%、60%、70%、80%、90%或95%的多联体具有上文所述的特征。
本文提供的方法的过程可以采用多种不同方式进行监测。在实施方式中,可测定反应的核酸扩增产物(例如,产物的量或其生成速率)。在其他实施方式中,可测定反应的聚合酶沿核酸模板的活性(例如,聚合酶沿模板链的移动)。因此,在一些实施方式中,由于由方法产生的产物的积累(可能在该方法的步骤期间或完成后)或由于在方法的步骤期间发生的可检测事件,使得可观察到本文提供的方法的事件。
可测定扩增的核酸的存在,例如,通过检测反应产物(扩增的核酸或反应副产物)或通过检测与反应进展相关的探针。
在一些实施方式中,可通过用染料将产物染色来鉴定反应产物。在一些实施方式中,染料在与核酸结合时比未与核酸结合时可具有更大的荧光。在实施方式中,染料可插入双链核酸或它可与核酸的外部区域结合。可与本文提供的方法和组合物一起使用的核酸染料包括,例如,花青染料、染料、Gold、Green I、Green II、溴化乙锭、二氢乙锭、BlueViewTM、染料、染料、染料、染料、染料、染料、染料、染料、染料、碘化丙啶、碘化己啶(hexidium iodide)、亚甲蓝、DAPI、吖啶橙、奎纳克林(quinacrine)、吖啶二聚体(acridine dimer)、9-氨基-6-氯-2-甲氧基吖啶、双苯酰亚胺染料、Hoechst染料、7-氨基放线菌素D、放线菌素D、羟芪巴脒、派洛宁Y(pyronin Y)、DiamondTM染料、GelRedTM、GelGreenTM和LDS 751。
在一些实施方式中,可通过分析扩增反应的浊度来鉴定反应产物。例如,在实施方式中,增加的浊度可能与反应产物和反应副产物(例如,与镁复合的焦磷酸)的形成相关。
在一些实施方式中,可通过分离根据本文方法通过凝胶电泳进行的反应并随后用核酸染料将凝胶染色来鉴定反应产物。该染料可以是本文公开的或本领域以其他方式已知的任何核酸染料。
在一些实施方式中,本领域已知的用于检测核酸或用于生成核酸的任何方法或组合物可与本文提供的方法和组合物一起使用。
在一些实施方式中,含有与核酸模板链(或具有相似或相同的序列的链)的一部分互补的核苷酸序列和含有荧光报道分子(荧光团)和猝灭剂中的一种或两种的核酸探针包含在本文提供的反应中。
在实例中,核酸探针可含有在其5’或3’末端的荧光报道分子,以及在另一末端的猝灭剂。该探针可进一步具有含有按顺序的至少第一、第二和第三区域的核苷酸序列,在该核苷酸序列中第一和第三区域彼此互补,并且第二区域的至少一部分与核酸模板链(探针“检测序列”)的一部分互补。在一些实施方式中,第二区域的长度可大于第一或第三区域的长度。在一些实施方式中,第二区域的长度可为10至40个核苷酸,并且第一和第三区域的长度可为4至10个核苷酸。该探针可具有至少两种不同的构型:(A)其中探针不与其检测序列退火且第一和第三区域彼此退火的构型;该构型可以是“茎-环”结构,在该结构中第一和第三区域形成茎而第二区域形成环,以及(B)其中探针与其检测序列退火的构型;在该构型中,第二区域或其一部分与其检测序列退火,并且第一和第三区域彼此不退火。在探针的构型(A)中,荧光报道分子和猝灭剂(它们位于探针的相对末端/第一和第三区域的外端)可彼此紧密靠近(均在通过第一和第三区域退火形成的茎结构的末端处),以使得荧光报道分子被猝灭。在探针的构型(B)中,荧光报道分子和猝灭剂可不彼此紧密靠近,以使得荧光报道分子不被猝灭。探针可用于监测所选反应产物的积累,例如,在探针可形成茎环结构或与其检测序列退火的反应条件下。在一些实施方式中,如果存在检测序列,则探针可与检测序列退火,并且探针可响应于荧光团的激发光谱的波长的光而发荧光。相反,如果不存在检测序列,则探针可形成茎环结构,并且探针不响应于荧光团的激发光谱的波长的光而发荧光。
在另一实例中,核酸探针可在其5’或3’末端含有荧光报道分子,并且它可与含有猝灭剂的核酸引物退火。含有猝灭剂的核酸引物可在引物的位置上含有猝灭剂,使得当核酸探针与引物退火时,荧光报道分子被猝灭。探针可用于监测所选反应产物的积累,例如,在探针可与引物退火或与其检测序列(在反应产物中)退火的反应条件下。在一些实施方式中,如果存在检测序列,则探针可与检测序列退火,并且探针可响应于荧光团的激发光谱的波长的光而发荧光(由此指示反应产物的存在)。相反,如果不存在检测序列,则探针可保持与引物配对,并且探针不响应于荧光团的激发光谱的波长的光而发荧光。
在含有荧光报道分子和猝灭剂对的探针中,可选择荧光报道分子和猝灭剂,以使得猝灭剂可有效地猝灭报道分子。在一些实施方式中,荧光报道分子与猝灭剂配对,其中荧光报道分子的发射最大值类似于猝灭剂的吸收最大值。可用作荧光报道分子的荧光团包括,例如,CAL Fluor Gold、CAL Fluor Orange、Quasar 570、CAL Fluor Red 590、CAL Fluor Red 610、CAL Fluor Red 610、CAL Fluor Red 635、Quasar 670(Biosearch Technologies)、VIC、NED(Life Technologies)、Cy3、Cy5、Cy5.5(GE Healthcare Life Sciences)、Oyster 556、Oyster 645(Integrated DNA Technologies)、LC red 610、LC red 610、LC red 640、LC red 670、LC red 705(Roche Applies Science)、德克萨斯红(Texas red)、FAM、TET、HEX、JOE、TMR和ROX。可使用的猝灭剂包括,例如,DDQ-I、DDQ-II(Eurogentec)、Eclipse(Epoch Biosciences)、Iowa Black FQ、Iowa Black RQ(Integrated DNA Technologies)、BHQ-1、BHQ-2、BHQ-3(Biosearch Technologies)、QSY-7、QSY-21(分子探针)和Dabcyl。
在一些实施方式中,本文提供的组合物或方法使用的探针可以是肽核酸(PNA)探针。肽核酸是合成的DNA类似物,在其中,例如,磷酸二酯骨架被N-(2-氨乙基)甘氨酸的重复单元代替,并且嘌呤和嘧啶碱基经由甲基羰基连接体附接至所述合成DNA类似物上。任选地,在本文提供的反应中可以提供PNA探针,它进一步含有能与PNA-DNA双链体结合并且当与PNA-DNA双链体结合时改变颜色的染料。这样的染料的一个实例是3,3’-二乙基噻二碳菁碘化物[DiSc2(5)]。DiSc2(5)在与PNA-DNA双链体结合时从蓝色变为紫色,并且通过图像分析,例如在分光光度计中,或通过人类肉眼,可以观察到这一颜色变化。例如,在Wilhelmsson等人,Nucleic Acids Research,2002,Vol.30,No.2e3中描述了使用PNA探针和DiSc2(5)检测PNA-DNA双链体,该文献通过引用并入于此用于所有目的。在使用PNA探针的实施方式中,通常将PNA探针设计为与有待于在相关扩增反应中扩增的序列互补。因此,如果序列成功扩增,则PNA探针将与含有扩增的序列的DNA链退火,并且可以检测到此退火(例如,通过观察DiSc2(5)与PNA-DNA双链体结合时的颜色变化)。因此,本文提供的实施方式使用PNA探针可以帮助准确地确定序列得到成功扩增的反应,并且帮助将这些反应与具有核酸的非特异性扩增的反应区分开。为了随本文提供的实施方式使用PNA探针,任选地,PNA探针可以在反应开始时包含在本文提供的反应混合物中。在其他实例中,可以在反应开始之后或反应结束之后的某一时间,向反应混合物中添加PNA探针。可以在添加PNA探针的同时或在不同时间向反应混合物中添加染料。例如,在实施方式中,可以在反应开始时向反应混合物中添加染料,而可以在反应开始之后的某一时间点添加PNA。在实施方式中,本文提供的试剂盒可进一步含有与有待通过该试剂盒的试剂扩增的核苷酸序列互补的PNA探针和能与PNA-DNA双链体结合的染料。
在一些实施方式中,根据本文提供的方法进行的反应可在含有光源和光学传感器的装置中进行监测。在一些情况下,可将反应定位于来自光源的光路上,并且可测量由样品吸收(例如,在混浊的反应的情况下)、由样品散射(例如,在混浊的反应的情况下)或由样品发射(例如,在含有荧光分子的反应的情况下)的光。在一些实施方式中,本文提供的方法可在如在2013年2月18日提交的美国专利申请系列号13/769,779中公开的设备或其中的模块中进行或监测,该专利申请通过引用全文并入本文。
通过使用本文提供的方法,感兴趣的核酸模板的特异性扩增产物可在扩增反应开始后例如30秒、1分钟、3分钟、5分钟、10分钟、15分钟、20分钟、30分钟、45分钟、60分钟、90分钟、120分钟、180分钟或240分钟内进行鉴定。在其他实例中,当生成模板的少至10、50、100、500、1000、5000、10,000、50,000、100,000、500,000或1,000,000个拷贝时,通过使用本文提供的方法可鉴定对于感兴趣的核酸模板为阳性的扩增反应。在其他实例中,通过使用本文提供的方法,可鉴定样品中感兴趣的核酸模板的存在,该样品在该方法开始时含有感兴趣的模板的少至1、2、3、4、5、10、15、20、25、30、40、50、100、200、500、1000、5000或10,000个拷贝。
在实施方式中,本文提供的方法可用于测定样品中的感兴趣的靶核酸。在某些实施方式中,可通过包括测定反应中核酸扩增的转变时间的方法来确定样品中感兴趣的靶核酸的存在或量。转变时间/转变点是扩增反应被确定为对核酸模板为阳性的时间或点。转变时间/转变点可以通过一个或多个指标来鉴定,例如,反应开始后在反应中已经生成所选量的核酸的时间,当反应的扩增速率由基线期变为指数期时的时间,或者当反应的扩增速率由指数期变为平台期(plateau phase)时的时间等。在实施方式中,转变时间/转变点可以基于反应的荧光或吸光度的变化或基于反应的荧光或吸光度达到所选值来鉴定。在某些实施方式中,样品中感兴趣的靶核酸的存在或量可通过包括比较反应的核酸扩增的转变时间来
确定,该反应相对于以下反应中的一者或两者具有未知量的感兴趣的靶核酸:i)已知缺乏感兴趣的靶核酸的反应(即,阴性对照);或ii)已知含有感兴趣的靶核酸的反应(即,阳性对照)。在实施方式中,可测量含有感兴趣的靶核酸的反应和不含有靶核酸的反应两者的所选的转变时间。在实施方式中,样品中感兴趣的靶核酸的存在可基于这样的方法来确定,该方法包括评价包含可含有或可不含有感兴趣的靶核酸的样品的反应的转变点与具有感兴趣状态(例如,已知其含有或不含有感兴趣的靶核酸)的已知靶核酸的一个或多个反应的转变时间之间的时间差异。例如,如果根据本文提供的方法的反应的转变时间比已知不含有感兴趣的靶核酸的相应反应早至少3、5、10、15、20、30、40、50、60、90、120或180分钟,则样品可被鉴定为含有感兴趣的靶核酸。在另一实例中,如果根据本文提供的方法的反应的转变时间比已知不含有感兴趣的靶核酸的相应反应晚不多于3、5、10、15、20、30、40、50、60、90、120或180分钟,则样品可被鉴定为含有感兴趣的靶核酸。
本文提供的方法可进行任意时间长度。通常,该方法将进行足以监测例如核酸复制速率、聚合酶活性的出现或扩增产物的积累的时间长度。在一些实施方式中,本文提供的方法可进行总计少于10秒、30秒、1分钟、5分钟、10分钟、20分钟、30分钟、45分钟、1小时、2小时、3小时、4小时、6小时、8小时、12小时、16小时或24小时,到该时间时测量核酸复制速率、聚合酶活性的出现或扩增产物的积累。
本文提供的方法可以以各种方式终止。在一个实施方式中,方法的步骤可在浓度降低时或该方法的一个或多个步骤中包含的一种或多种试剂(例如,dNTP)完全消耗时结束。在另一个实施方式中,方法的步骤可在该方法的一个或多个步骤中包含的一种或多种酶(例如,聚合酶)失活时结束。酶可通过各种方式失活。例如,由于影响酶结构的随机事件,导致酶可随时间逐渐失去酶活性,或者酶可暴露于加速酶活性失活的条件(例如,高热量、极端pH等)。
在一些实施方式中,一级核酸可以是单链或双链的。单链一级核酸在本文也可被称为“一级多核苷酸”。一级核酸可以是线形或环形的。一级核酸可以包含核酸模板。在一些实施方式中,整个一级核酸可以是核酸模板。在其他实施方式中,一级核酸可以含有不是核酸模板的一部分的一个或多个核苷酸(例如,一级核酸可具有比包含在一级核酸内的核酸模板更长的长度)。在一些实施方式中,一级核酸可含有核酸模板的两个或更多个拷贝。一级核酸可含有DNA、RNA或其混合物。双链线形一级核酸可具有平端或粘端(“粘端”指的是具有突出链的末端,该突出链具有一个或多个未配对的核苷酸)。
一级核酸可以是任何长度的核苷酸。例如,一级核酸可以是至少2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在另一个实例中,一级核酸可以是2至100,000、5至100,000、10至100,000、15至100,000、20至100,000、25至100,000、30至100,000、50至100,000、70至100,000、100至100,000、200至100,000、2至10,000、5至10,000、10至10,000、15至10,000、20至10,000、25至10,000、30至10,000、50至10,000、70至10,000、100至10,000、200至10,000、2至5,000、5至5,000、10至5,000、15至5,000、20至5,000、25至5,000、30至5,000、50至5,000、70至5,000、100至5,000、200至5,000、2至3,000、5至3,000、10至3,000、15至3,000、20至3,000、25至3,000、30至3,000、50至3,000、70至3,000、100至3,000、200至3,000、2至1,000、5至1,000、10至1,000、15至1,000、20至1,000、25至1,000、30至1,000、50至1,000、70至1,000、100至1,000、200至1,000、2至500、5至500、10至500、15至500、20至500、25至500、30至500、50至500、70至500、100至500或200至500个核苷酸碱基的长度。
在一些实施方式中,核酸模板可以是单链或双链的。核酸模板的单链在本文可被称为“多核苷酸模板”。如本文提及的“多核苷酸模板”并不排除与其互补序列结合。换言之,“多核苷酸模板”可以是例如整个单链核酸模板,或者它可以是双链核酸模板的一条链。核酸模板可以包含在一级核酸分子中。在一些实施方式中,核酸模板可构成整个一级核酸分子。在其他实施方式中,核酸模板可包含在含有不是核酸模板的一部分的一个或多个核苷酸的一级核酸中(例如,核酸模板可具有比含有核酸模板的一级核酸更短的长度)。
核酸模板可以是任何长度的核苷酸。例如,核酸模板可以是至少2、3、4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在另一个实例中,核酸模板可以是2至100,000、5至100,000、10至100,000、15至100,000、20至100,000、25至100,000、30至100,000、50至100,000、70至100,000、100至100,000、200至100,000、2至10,000、5至10,000、10至10,000、15至10,000、20至10,000、25至10,000、30至10,000、50至10,000、70至10,000、100至10,000、200至10,000、2至5,000、5至5,000、10至5,000、15至5,000、20至5,000、25至5,000、30至5,000、50至5,000、70至5,000、100至5,000、200至5,000、2至3,000、5至3,000、10至3,000、15至3,000、20至3,000、25至3,000、30至3,000、50至3,000、70至3,000、100至3,000、200至3,000、2至1,000、5至1,000、10至1,000、15至1,000、20至1,000、25至1,000、30至1,000、50至1,000、70至1,000、100至1,000、200至1,000、2至500、5至500、10至500、15至500、20至500、25至500、30至500、50至500、70至500、100至500或200至500个核苷酸碱基的长度。
如本文所用的“引物”可以指这样一种多核苷酸,该多核苷酸i)能够与原始核酸链杂交,并且ii)充当合成新的核酸链的起始点,其中新的核酸链是引物的延伸产物并与原始链互补。引物可在其3’末端具有游离的–OH基团,其可充当延伸产物合成的起点。
引物可含有标准核苷酸[例如,标准DNA脱氧核糖核苷酸(脱氧腺苷单磷酸、脱氧鸟苷单磷酸、胸苷单磷酸、脱氧胞苷单磷酸)或标准RNA核糖核苷酸(腺苷单磷酸、鸟苷单磷酸、尿苷单磷酸、胞苷单磷酸)]、替代性核苷酸(例如,肌苷)、修饰的核苷酸、核苷酸类似物或其组合。例如,寡核苷酸引物可包括肽核酸、吗啉代寡核苷酸(例如,磷二酰胺吗啉代寡核苷酸)、锁定核酸[参见,例如,Kaur,H,等人,Biochemistry 45(23),7347-55(2006)]、乙二醇核酸或苏糖核酸。引物可具有骨架,包括,例如,磷酸二酯键、硫代磷酸酯键(用硫替代非桥接O)或肽键(作为肽核酸的一部分)。替代性核苷酸、修饰的核苷酸以及核苷酸类似物可在本文中通称为“非标准核苷酸”。
引物中非标准核苷酸的存在可影响该引物的各种特性。在一些实施方式中,在引物中包含非标准核苷酸可增加或降低引物对其互补序列的热力学稳定性。例如,具有增加的热力学稳定性的引物可含有锁定核酸。具有降低的热力学稳定性的引物可含有,例如,肌苷(由Auer等人,Nucl.Acids Res.24;5021-5025(1996)描述的)或带负电荷的化学基团,诸如羧酸。
本文提供的第一引物或第二引物可以是任何长度。第一引物和第二引物可含有相同数目的核苷酸或不同数目的核苷酸。在一些实施方式中,第一或第二引物可以为至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在一些实施方式中,第一或第二引物可以为不多于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在一些实施方式中,第一或第二引物可具有选自最小值为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750或1000个核苷酸的长度并且最大值为3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度的范围的长度。
本文提供的第一引物或第二引物的尾区可以是任何长度。通常,针对于同一模板的第一引物和第二引物的尾区含有相同数目的核苷酸。在一些实施方式中,第一或第二引物的尾区可以为至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在一些实施方式中,第一或第二引物的尾区可以为不多于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在一些实施方式中,第一或第二引物的尾区可具有选自最小值为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750或1000个核苷酸的长度并且最大值为3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度的范围的长度。
本文提供的第一引物或第二引物的模板结合区可以是任何长度。针对于同一模板的第一引物和第二引物的模板结合区可含有相同数目的核苷酸或不同数目的核苷酸。在一些实施方式中,第一或第二引物的模板结合区可以为至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在一些实施方式中,第一或第二引物的模板结合区可以为不多于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度。在一些实施方式中,第一或第二引物的模板结合区可具有选自最小值为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750或1000个核苷酸的长度且最大值为3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、60、70、80、90、100、150、200、250、300、350、400、500、750、1000或1500个核苷酸的长度的范围的长度。
在一些实施方式中,引物可以是任何长度,并含有在用于包括该引物的方法或其步骤的温度下允许该引物与其互补序列足够稳定且特异性地退火的任何核苷酸序列。引物所需的确切长度可能依赖于多种因素,包括反应的温度、引物的化学组成以及包括引物的反应。在一些实施方式中,引物的模板结合区可以是任何长度,并含有在用于包括该引物的方法或其步骤的温度下允许该引物的模板结合区与其互补序列足够稳定且特异性地退火的任何核苷酸序列。引物的模板结合区所需的确切长度可能依赖于多种因素,包括反应的温度、引物的模板结合区的化学组成以及包括引物的反应。与缺乏非标准核苷酸的相应引物的长度相比,在引物中包含一个或多个非标准核苷酸可改变在本文提供的方法中使用的引物的所需长度。例如,如果采用本文提供的方法,期望有具有某一解链温度(“Tm”)的引物,在一些实施方式中,相比于如果引物仅含有标准核苷酸,如果引物含有至少一些非标准核苷酸,具有所选Tm的引物可以具有更短的长度。通常,核苷酸序列的“解链温度”指的是50%的具有核苷酸序列的核酸与其互补序列碱基配对(即在双链分子中),而50%的具有核苷酸序列的核酸是单链形式时的温度。
在一些实施方式中,本文提供的第一引物或第二引物中的一个或两者可被设计为在引物的尾区中含有与靶核酸序列内的内部基序(即核苷酸序列)互补的核苷酸序列。例如,再次参考图1,第一引物105的尾区可含有与双链核酸模板的第二链104中的内部基序互补的核苷酸序列,第一引物的第一拷贝的延伸产物111或第一引物的第二拷贝的延伸产物113。类似地,仍然参考图1,第二引物106的尾区可含有与双链核酸模板的第一链103中的内部基序互补的核苷酸序列或第二引物的延伸产物112。在至少一些情况下,如本文所述,在引物的尾区中具有与靶核酸序列内的内部基序互补的核苷酸序列可以提高反应的速度或特异性。
不受理论束缚,根据图9中概括的机理,可以认为在引物的尾区中具有与靶核酸序列内的内部基序互补的核苷酸序列可以提高反应的速度或特异性。为简洁起见,图9和这一机理仅就第一引物的第一拷贝来描述,但根据具体情况,同样可应用于第一引物的第二拷贝、第二引物等。另外,图9和这一机理仅就第一引物的第一拷贝的延伸产物111来描述,该延伸产物与第二引物的延伸产物112退火,但其同样可应用于含有本文所述的引物的延伸产物的其他分子。现在转向图9,第一引物的尾区的至少一部分可含有与在第一引物的第一拷贝的延伸产物111中的内部基序902(反斜线样填充)互补的核苷酸序列901(棋盘状填充),并且该第一引物可被整合到第一引物的第一拷贝的延伸产物(如本文其他地方所述)111中。第一引物的第一拷贝的延伸产物111可与第二引物的延伸产物112退火。在含有第一引物的第一拷贝的延伸产物111和第二引物的延伸产物112的双链体核酸的“呼吸(breathing)”过程中,引物的尾区901可向存在于第一引物的第一拷贝的延伸产物中的内部基序902移动并可与之暂时退火。在与第一引物的第一拷贝的延伸产物中的内部基序902暂时退火之后,引物的尾区901可退回到与第二引物的延伸产物112退火的原始位置,并且任选地,它可以在这些结构之间反复地来回移动(由图9中的箭头表示)。在尾区901的核苷酸序列与内部基序902退火的时间过程中,第二引物的延伸产物112的3’末端处的一个或多个核苷酸可能未退火,并且可用于结合第一引物的新拷贝或另一双链体核酸(例如,二级核酸)中的互补序列。在第二引物的延伸产物112的3’末端处的一个或多个核苷酸结合第一引物的新拷贝或另一双链体核酸(例如,二级核酸)中的互补序列的事件中,这些事件中的任意一个均可以如本文其他地方所述提高反应的速率,例如,通过生成第一引物的新延伸产物(在其生成过程中,它代替原始的第一引物延伸产物)。而且,即使在第一引物中不具有与内部基序902互补的核苷酸序列901,在本文提供的方法中在双链体核酸中的互补序列之间仍然可以存在“呼吸”。然而,当在第一引物中具有与内部基序902互补的核苷酸序列901时,双链体核酸可以“呼吸”的时间长度可以增加,并且根据本文提供的方法这可能转而提高反应的速率。
在实施方式中,内部基序可以含有至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75或100个核苷酸。在实施方式中,内部基序可以含有不多于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75或100个核苷酸。在实施方式中,内部基序可以含有至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50或75个且不多于3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75或100个核苷酸(其中上限值高于下限值)。通常,在引物中与内部基序互补的核苷酸序列含有与该内部基序中相同数目的核苷酸。而且,在引物中与内部基序互补的核苷酸序列可与该内部基序完全互补,或者在引物与内部基序中的核苷酸序列之间可以存在一个或多个错配的核苷酸。内部基序的起点可与引物的3’末端核苷酸隔开任意距离,该3’末端核苷酸延伸以形成含有该内部基序的引物延伸产物,但是该内部基序的起点通常可与该引物的3’末端核苷酸隔开例如至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75或100个核苷酸。在实施方式中,内部基序的起点可与引物的3’末端核苷酸隔开不多于2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75或100个核苷酸,该3’末端核苷酸延伸以形成含有该内部基序的引物延伸产物。在实施方式中,内部基序的起点可与引物的3’末端核苷酸隔开至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50或75个且不多于3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、75或100个核苷酸(其中上限数目大于下限数目),该3’末端核苷酸延伸以形成含有该内部基序的引物延伸产物。
如本文所用的,在单一靶核酸链/多核苷酸模板的情况下,“内部基序”是该靶核酸链的一部分,它与用于扩增本文提供的靶核酸的引物对的一个引物的尾区互补,并且具有与该引物对的另一引物的尾区相同或相似的核苷酸序列。因此,例如,如果靶核酸中的内部基序具有5’至3’方向的核苷酸序列GGGATGGA,则用来根据本文提供的方法扩增靶核酸的引物对的一个引物的尾区/第一区域将具有5’至3’方向的核苷酸序列TCCATCCC(或类似序列),并且该引物对的另一引物的尾区/第一区域将具有5’至3’方向的核苷酸序列GGGATGGA(或类似序列)。在双链靶核酸的情况下,术语“内部基序”是指两条链的任意一条的相关区域,如以上对于单链所描述的。在本文描述的引物延伸产物的情况下,“内部基序”是指与引物延伸产物的一部分互补的延伸产物的一部分,所述引物延伸产物的一部分对应于延伸以形成特定引物延伸产物的引物的尾区。而且,如果提到与特定链中的“内部基序”互补的不同链中的核苷酸序列,该互补序列可在本文中被称为“内部基序互补体”。值得注意的是,在存在两条互补核酸链的情况下(例如,在含有两个互补引物延伸产物的双链分子中),每条链将具有不同的“内部基序”(所述不同链的“内部基序”将彼此互补),因此在适当的情况下,本文提供的“内部基序”的描述可根据相关链或引物来限定。例如,可以描述双链核酸,其中该核酸的第一链以5’-3’顺序具有部分C’-B-C-A-C’,并且该核酸的第二链以5’-3’顺序具有部分C-A’-C’-B’-C,其中第一链的部分C’与第二链的部分C退火,第一链的部分A与第二链的部分A’退火,以此类推。如果第一链的部分C’对应于本文提供的引物的尾区,并且部分C’与部分C互补,那么第一链的部分C可被称为第一链的“内部基序”,并且第二链的部分C’可被称为相对于第一链的“内部基序互补体”。同时,如果第二链的部分C也对应于本文提供的引物的尾区,并且它与部分C’互补,那么第二链的部分C’可被称为第二链的“内部基序”,并且第一链的部分C可被称为相对于第二链的“内部基序互补体”。
在实施方式中,本文提供的方法和组合物可以结合图10进行描述。可按照与图8大体相同的方式描述图10的特征,除了图10的模板还包括内部基序之外。
多核苷酸模板1000(图10A)可以是扩增的靶标。多核苷酸模板1000是单核酸链。多核苷酸模板链可作为游离的单链分子而存在,或者它可作为双链分子的一部分而存在,其中该多核苷酸模板链与其互补链退火。多核苷酸模板1000可以是DNA或RNA。
多核苷酸模板1000可以含有至少第一部分1001(也用“(i)”和字母“A”表示)和第二部分1002(也用“(ii)”和字母“B”表示)。第一部分1001和第二部分1002可各自含有任意数目的核苷酸,例如对于图8中的模板的第一部分和第二部分所描述的。第一部分1001和第二部分1002可含有相同或不同数目的核苷酸。此外,多核苷酸模板1000可含有第三部分1003(也用“(iii)”和字母“C”表示),它还可被称为“内部基序”。内部基序通常含有6至10个核苷酸,尽管任选地可含有其他数目的核苷酸,诸如至少4、5、6、7、8、9、10、11或12个核苷酸,不多于6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸,或至少4、5、6、7、8、9、10、11或12个核苷酸且不多于6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个核苷酸(上限值大于下限值)。内部基序1003通常与第一部分1001和第二部分1002在任一侧隔开2至25个核苷酸,尽管可以隔开其他数目的核苷酸,诸如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45或50个核苷酸,不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50或60个核苷酸,或1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45或50个核苷酸至2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50或60个核苷酸(上限值大于下限值)。在实施方式中,第一部分1001与内部基序1003之间相比于第二部分1002与内部基序1003之间可具有相同数目的核苷酸(例如,第一部分与内部基序之间可具有6个核苷酸,并且第二部分与内部基序之间可具有6个核苷酸)。在其他实施方式中,第一部分1001与内部基序1003之间可具有不同于第二部分1002与内部基序1003之间的核苷酸数目(例如,第一部分与内部基序之间可具有6个核苷酸,而第二部分与内部基序之间可具有8个核苷酸)。在实施方式中,内部基序与第一部分1001或第二部分1002之间没有核苷酸(例如在实施方式中,内部基序可以直接挨着第一部分1001或第二部分1002中的一个或两者)。
多核苷酸模板1000可以在含有第一引物1010和第二引物1020的反应混合物中温育(图10B)。通常,该反应混合物含有每个引物的多个拷贝,例如,每个引物的至少4、5、6、10、15、20、50、100、1000、10,000、100,000个或1百万个或更多拷贝。第一引物1010可以具有第一区域1011(也用“(i)”表示)和第二区域1012(也用“(ii)”表示)。第一引物的第一区域1011可具有5’端,而第一引物的第二区域1012可具有3’端。第一引物的第一区域可具有与第一引物的第二区域的核苷酸序列不同的核苷酸序列。第二引物1020可以具有第一区域1021(也用“(i)”表示)和第二区域1022(也用“(ii)”表示)。第二引物的第一区域1021可具有5’端,而第二引物的第二区域1022可具有3’端。第二引物的第一区域可具有与第二引物的第二区域的核苷酸序列不同的核苷酸序列。
第一引物的第二区域1012可具有与多核苷酸模板的第一部分1001的核苷酸序列互补的核苷酸序列。在图10中,多核苷酸模板的第一部分1001的核苷酸序列由字母A表示,而第一引物的第二区域1012的核苷酸序列由字母A’表示,其中A与A’彼此互补。第二引物的第二区域1022可具有与配偶体核苷酸序列1030互补的核苷酸序列,其中配偶体核苷酸序列1030与多核苷酸模板的第二部分1002的核苷酸序列互补。在图10中,多核苷酸模板的第二部分1002的核苷酸序列由字母B表示,配偶体核苷酸序列1030的核苷酸序列由字母B’表示,并且第二引物的第二区域1022的核苷酸序列由字母B表示,其中B与B’彼此互补。换言之,如图10所示,多核苷酸模板的第二部分1002(B)的核苷酸序列可与第二引物的第二区域1022(B)的核苷酸序列相同。采用本文提供的组合物和方法,可以生成配偶体核苷酸序列1030,例如,作为从第一引物的3’端延伸的延伸产物的一部分。在实施方式中,第一引物的第一区域1011可与第二引物的第一区域1021互补。在图10中,第一引物的第一区域的核苷酸序列由字母C表示,而第二引物的第一区域的核苷酸序列由字母C’表示,其中C与C’彼此互补。
此外,第二引物的第一区域1021可与多核苷酸模板中的内部基序1003互补。在图10中,多核苷酸模板的内部基序1003的核苷酸序列由字母C表示,其中C与C’彼此互补。因此,如图10所示,在实施方式中,第一引物的第一区域1011可具有与多核苷酸模板的内部基序1003相同的核苷酸序列,而第二引物的第一区域1021具有与内部基序1003互补的序列。此外,第二引物的第一区域1021与第一引物的第一区域1011和内部基序都互补,而第一引物的第一区域1011与第二引物的第一区域1021和内部基序互补体互补。
在实施方式中,图10的第一引物和第二引物可分别具有在本文其他地方(例如,如图1或8中)所述的第一引物和第二引物的任何特征。而且,在实施方式中,图10的第一引物的第一区域可具有在本文其他地方所述的第一引物的尾区的任何特征。在实施方式中,图10的第一引物的第二区域可具有在本文其他地方所述的第一引物的模板结合区的任何特征。在实施方式中,图10的第二引物的第一区域可具有在本文其他地方所述的第二引物的尾区的任何特征。在实施方式中,图10的第二引物的第二区域可具有在本文其他地方所述的第二引物的模板结合区的任何特征。
在实施方式中,含有多核苷酸模板1000和第一引物1010的至少两个拷贝以及第二引物1020的至少两个拷贝的反应混合物可含有如本文其他地方所述可支持基于聚合酶的核酸合成的一个或多个其他组分(例如聚合酶、核苷酸、缓冲液、水等)。类似地,含有多核苷酸模板1000和第一引物1010的至少两个拷贝以及第二引物1020的至少两个拷贝的反应混合物可在本文其他地方所述用于支持核酸模板的扩增或多联体的生成的任何反应条件下温育。
在实施方式中,在多核苷酸模板1000和第一引物1010的至少两个拷贝以及第二引物1020的至少两个拷贝在反应混合物中如本文所述进行温育时,可形成一条或多条多联体链(图10C)。在实施方式中,形成的多联体链1040可具有5’端和3’端,并且可具有含有5’至3’方向的通用结构C’-T-C’-T-X-C’的序列,其中C’是第二引物的第一区域的核苷酸序列,T是多核苷酸模板的序列或其类似序列,并且X是任意数目和序列的核苷酸。如图10C进一步所示,在链1040的多核苷酸模板的序列内,在5’至3’方向上,存在该模板的以下部分的序列:B(多核苷酸模板的第二部分),C(内部基序),和A(多核苷酸模板的第一部分)。因此,如图10C所示,在本文提供的实施方式中,内部基序/内部基序互补体的序列在多联体链中的多个位置处存在。特别地,在链1040中,内部基序互补体(C’)的序列出现在多联体链中所述多核苷酸模板的序列的两个拷贝之间和该链的末端处,并且内部基序(C)的序列在多核苷酸模板的序列内的同一条链中存在。因此,如多联体链1040的通用结构所示,多联体链可含有多核苷酸模板的序列或其类似序列的至少两个拷贝,其中多核苷酸模板的序列的拷贝由至少第二引物的第一区域的序列分隔开。在实施方式中,在以上提供的通用结构C’-T-C’-T-X-C’中的T可以是多核苷酸模板的类似序列。
在实施方式中,根据本文提供的方法生成的多联体链1040可以是单链分子的一部分。在其他实施方式中,根据本文提供的方法生成的多联体链1040可以是双链多联体的一部分,其中多联体链1040与互补于多联体链的链1050退火。尽管图10C描绘了含有具有5’至3’方向的通用结构C’-T-C’-T-X-C’(链1040)或C-T’-C-T’-X’-C(链1050)的序列的多联体链,其中X为0个核苷酸,但根据图10的示意图生成的多联体链可具有以上或本文其他地方描述的多联体链的任意特征。而且,如图10C所示,序列A和B和C是模板链的一部分,因此在通用结构C’-T-C’-T-X-C’或C-T’-C-T’-X’-C中没有单独以符号表示。
为了进一步说明在图10的实施方式中元件的关系,图10提供了区块1060、1062、1064、1066和1068。区块1060(具有反斜线样填充)指示总多核苷酸模板序列(即元件1000)或其互补序列的相对位置。区块1062(具有垂直线填充)指示所述多核苷酸模板的第一部分的序列(即元件1001的序列的相对位置)或其互补序列的相对位置。因此,区块1062还表示第一引物的第二区域(即元件1012)的序列,它与元件1001互补。区块1064(具有垂直和水平线填充)指示所述多核苷酸模板的第二部分的序列(即元件1002的序列的相对位置)或其互补序列的相对位置。因此,区块1064还表示配偶体核苷酸序列(即元件1030)的序列,它与元件1002互补。区块1064还指示第二引物的第二区域1022的序列的相对位置,该序列可以是与所述多核苷酸模板的第二部分(元件1002)的序列相同的序列,或相似的序列。换言之,在实施方式中,1022的核苷酸序列可以与1002的核苷酸序列相同或相似。例如,如图10A中所示,在实施方式中,在多核苷酸模板中具有不是该多核苷酸模板的第一部分、第二部分或第三部分(内部基序)的一部分的核苷酸。区块1066(具有波浪线填充)指示第一引物的第一区域的序列(即元件1011/区域“C”的序列的相对位置)或其互补序列的相对位置。因此,区块1066还表示第二引物的第一区域(即元件1021/区域“C”)的序列,它与元件1011互补。此外,区块1066还表示内部基序的序列或其互补序列。值得注意的是,内部基序的序列或其互补序列既在模板序列中又在第一和第二引物的尾区中。如本文其他地方所述,内部基序可以直接邻近所述多核苷酸模板的第一部分或第二部分中的一个或两者,或者在内部基序与第一部分或第二部分之间可以具有额外的核苷酸。区块1068(具有菱形填充)指示多联体链(即元件1040)的序列或其互补序列的相对位置。因此,区块1068还表示与多联体链互补的链(元件1050)的序列。如图10C中所示,在多联体链或其互补体(1068)中,存在所述多核苷酸模板序列或其互补体(1060)的两个拷贝,这两个拷贝被第一引物的第一区域的核苷酸序列或其互补体(1066)分隔开。这种将所述多核苷酸模板的拷贝分隔开的序列也是内部基序或其互补体(1066)的序列。此外,在多联体链或其互补体(1068)中,第一引物的第一区域的核苷酸序列或其互补体(1066)在两端侧接所述多核苷酸模板序列或其互补体(1060)。而且,在多联体链或其互补体(1068)中,具有第一引物的第二区域的序列或其互补体(1062)的两个拷贝和第二引物的第二区域的序列或其互补体(1064)的两个拷贝,它们均作为所述多核苷酸模板序列或其互补体的两个拷贝的一部分而以两个拷贝存在。区块1060、1062、1064、1066和1068不应被解释为规定图10的元件之间的任何所需的特定大小关系;相反,在本文提供的某些实施方式中,区块1060、1062、1064、1066和1068仅用于帮助说明图10的元件相对于彼此的一般位置。
本文提供的引物可通过任何合适的方法进行制备。例如,引物可化学合成。在另一实例中,天然存在的核酸可进行分离、裂解(例如,采用限制酶)和/或修饰以生成或变为本文所述的引物的一部分。
在一些实施方式中,标记物可附接至引物。标记物包括,例如,结合配体(例如,地高辛或生物素)、酶、荧光分子/荧光团、发光的分子、猝灭剂分子或放射性同位素。在其他实施方式中,可将寡核苷酸的碱基替代为荧光类似物,诸如2-氨基嘌呤(参见,例如,Proc.Acad.Sci.USA,91,6644—6648(1994),该文献通过引用全文并入本文)。
在一些实施方式中,使得i)第一引物的第一拷贝的模板结合区与核酸模板链退火,ii)第二引物的模板结合区与第一引物的第一拷贝的延伸产物退火,iii)第一引物的第二拷贝的模板结合区与第二引物的延伸产物退火,或iv)二级核酸的第一拷贝的第一引物的第二拷贝的延伸产物的3’末端区与二级核酸的第二拷贝的第二引物的延伸产物的3’末端区退火,以产生包含这些链的交换结构的条件,可各自包括(即,i)、ii)、iii)或iv)中的任何一个可包括)在使得双链核酸分子的链以一定程度“呼吸(breathe)”(即经历连接碱基对的氢键的局部断裂的短暂时期)的温度下温育核酸,该程度足以促进引物或不同的核酸链进入双链分子的链之间,并足以使引物或不同的核酸链与打开的双链核酸分子的一条链退火。在一些实施方式中,方法或其步骤可在至少10、15、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、90或95℃的温度下执行或温育。在一些实施方式中,方法或其步骤可在不高于10、15、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、90或95℃的温度下执行或温育。在一些实施方式中,方法或其步骤可在10、15、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85或90℃至15、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、90或95℃之间的温度下执行或温育。
在一些实施方式中,对于本文提供的方法或其步骤,在低于相关潜在配对的核苷酸链或其区域(例如,第一引物的模板结合区与核酸模板的第一链配对,第二引物的模板结合区与第一引物的第一拷贝的延伸产物配对,第一引物与第二引物的延伸产物配对,第二引物的延伸产物的3’末端区与其互补序列配对,第一引物的第一拷贝的延伸产物的3’末端区与其互补序列配对,等等)的解链温度(Tm)的温度下执行步骤或方法。在一些实施方式中,对于本文提供的方法或其步骤,在高于相关潜在配对的核苷酸链或其区域(例如,第一引物的模板结合区与核酸模板的第一链配对,第二引物的模板结合区与第一引物的第一拷贝的延伸产物配对,第一引物与第二引物的延伸产物配对,第二引物的延伸产物的3’末端区与其互补序列配对,第一引物的第一拷贝的延伸产物的3’末端区与其互补序列配对,等等)的Tm的温度下执行步骤或方法。在一些实施方式中,对于本文提供的方法或其步骤,在处于相关潜在配对的核苷酸链或其区域(例如,第一引物的模板结合区与核酸模板的第一链配对,第二引物的模板结合区与第一引物的第一拷贝的延伸产物配对,第一引物与第二引物的延伸产物配对,第二引物的延伸产物的3’末端区与其互补序列配对,第一引物的第一拷贝的延伸产物的3’末端区与其互补序列配对,等等)的Tm或在其+/-1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或25℃或+/-1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20或25℃以内的温度下执行步骤或方法。
在一些实施方式中,核酸聚合酶包含在本文提供的方法或组合物中。聚合酶可生成引物的延伸产物。引物及其延伸产物可与模板核酸链互补。通常,核酸聚合酶将在引物的3’端处引发引物的延伸产物的合成。在一些实施方式中,DNA聚合酶包含在本文提供的方法或组合物中。如本文所用的,“DNA聚合酶”指的是对DNA模板具有主要的或专一的聚合酶活性的核酸聚合酶。在一些实施方式中,逆转录酶包含在本文提供的方法或组合物中。如本文所用的,“逆转录酶”指的是可从RNA模板合成DNA链的核酸聚合酶。在一些实施方式中,RNA聚合酶可包含在本文提供的方法或组合物中。如本文所用的,“RNA聚合酶”指的是可从DNA或RNA模板合成RNA链的核酸聚合酶。
在一些实施方式中,本文提供的聚合酶可具有链置换活性。具有链置换活性的聚合酶包括,例如,exo-Bca DNA聚合酶、phi29DNA聚合酶、大肠杆菌DNA聚合酶I的Klenow片段、VentR DNA聚合酶、Deep VentR DNA聚合酶、9°Nm DNA聚合酶、Bst 2.0DNA聚合酶以及Bst DNA聚合酶的大片段。也可以使用具有链置换活性的其他聚合酶。
聚合酶的修饰形式也可以与本文提供的方法和组合物一起使用,条件是修饰的聚合酶具有序列依赖性核酸合成活性。聚合酶的修饰形式(“修饰的聚合酶”)可以具有,例如,100个或更少的、70个或更少的、50个或更少的、40个或更少的、30个或更少的、20个或更少的、10个或更少的、5个或更少的、4个或更少的、3个或更少的、2个或更少的或1个与聚合酶的亲代形式的序列不同的氨基酸。在一些实施方式中,修饰的聚合酶可含有比亲代聚合酶多或少不多于1000、700、500、400、300、200、100、50、40、30、20、10或5个氨基酸。在一些实施方式中,修饰的聚合酶可含有亲代聚合酶的片段。在一些实施方式中,修饰的聚合酶可包含具有来源于聚合酶的一部分和来源于非聚合酶蛋白质的一部分的嵌合多肽。在一些实施方式中,修饰的聚合酶可具有,例如,与亲代聚合酶相比提高的催化活性、提高的稳定性或提高的热稳定性。
在一些实施方式中,本文提供的聚合酶是热稳定的。热稳定的聚合酶在高达25、30、35、40、45、50、55、60、65、70、75、80、85、90或95℃的温度下可具有例如至少5、10、15、20、30、40、50、60、90、120或180分钟的半衰期。在一些实施方式中,修饰的聚合酶可以是热稳定的。
在一些实施方式中,本文提供的方法和其步骤包括足以支持基于聚合酶的核酸合成的条件或在该条件下进行。针对基于聚合酶的核酸合成的示例性条件是本领域已知的并提供于例如Green和Sambrook(同上)中。用于基于聚合酶的核酸合成反应的非限制性组分可包括以下的一种或多种:聚合酶(例如,以每50微升反应体积0.01至10个单位的酶,或者其中的任何范围,包括例如,每50微升反应体积0.01-1、0.1-10、0.1-5、0.5-10、0.5-5、0.5-2、1-10或1-5个单位的酶的浓度,其中1单位的酶在75℃下将使15nmol的dNTP在30分钟内掺入聚合产物中);模板(以每个反应至少例如1、10、100、1,000、10,000或100,000个拷贝的浓度);引物(以例如0.01至10微摩尔,或者其中的任何范围,包括例如0.01-1、0.1-10、0.1-5、0.5-5或0.5-2微摩尔的浓度);dNTP(例如dATP、dTTP、dGTP和dCTP,以例如每个dATP、dTTP、dGTP和dCTP 50至500微摩尔,或者其中的任何范围,包括例如每个dATP、dTTP、dGTP和dCTP 50-350、100-500、100-300、200-500或300-400微摩尔的浓度);盐(例如KCl或乙酸钾,以例如1至200毫摩尔,或者其中的任何范围,包括例如1-100、1-50、1-20、1-10、10-20、10-50或10-200毫摩尔的浓度);缓冲液(例如Tris-HCl或Tris-乙酸盐(Tris-acetate),pH 7.8-8.5,以例如1至100毫摩尔,或者其中的任何范围,包括例如1-50、1-20、1-10、1-5、10-100、20-100或50-100毫摩尔的浓度);以及镁离子(以例如0.1至10毫摩尔,或者其中的任何范围,包括例如,0.1-5、0.1-1、0.5-10、0.5-5或0.5-2.5毫摩尔的浓度)。用于基于聚合酶的核酸合成反应的另外的非限制性组分可提高反应速度、提高反应的保真度或提高反应中的酶或DNA的稳定性,并且可以包括以下的一种或多种:明胶(以例如0.0001%至0.1%w/v的浓度)、BSA(以例如0.01至1微克每微升的浓度)、蔗糖(以例如0.01摩尔至0.8摩尔的浓度)、海藻糖(以例如0.01摩尔至0.8摩尔的浓度)、DMSO(以例如0.01%至10%v/v的浓度)、甜菜碱(以例如0.1至10摩尔的浓度)、甲酰胺(以例如0.1%至10%v/v的浓度)、甘油(以例如0.1%至20%v/v的浓度)、聚乙二醇(以例如0.1%至20%v/v的浓度)、非离子型去污剂[例如NP-40(以例如0.01%至1%v/v的浓度)]、Tween-20(以例如0.01%至1%v/v的浓度)或Triton X-100(以例如0.01%至1%v/v的浓度)]、铵离子[例如硫酸铵(以例如1至100毫摩尔的浓度)]和EDTA(以例如0.001至0.1毫摩尔的浓度)。其他的试剂也可存在于本文提供的基于聚合酶的核酸合成反应中。例如,可以使用足以合成RNA反应产物或含有非标准核苷酸的反应产物的试剂。足以支持基于聚合酶的核酸合成的条件可包括多个温度和pH值。例如,基于聚合酶的核酸合成反应的pH可为例如pH 6.0至pH 10.0,诸如pH 6.5、7、7.5、7.8、7.9、8、8.1、8.2、8.5、9或9.5。基于聚合酶的核酸合成反应的温度可以是恒定的或变化的。恒定的温度可以在例如10℃至95℃之间,诸如20、25、30、35、37、40、42、45、50、55、60、65、70、75、80或85℃。变化的温度可以是例如10℃至95℃之间的两个或更多个不同的温度,诸如选自20、25、30、35、37、40、42、45、50、55、60、65、70、75、80或85℃的两个或更多个温度。
本文提供的方法可在多个温度下进行。在一些实施方式中,方法的所有步骤在相同的温度下进行。因此,诸如在PCR中的温度循环在本文公开的方法中是不必要的。在一些实施方式中,本文提供的方法可在两个或更多个不同的温度下进行。在一些实施方式中,含有用于本文提供的方法的试剂的反应混合物在两个或更多个不同的温度下进行温育。在一些实例中,可选择不同的温度来优化速率、准确度或本文提供的方法的不同步骤的其他特征。例如,可选择温度来提高聚合酶的酶活性。在一些实例中,可选择不同的温度来提高引物与模板的结合特异性或提高模板对引物的可及性(例如较高的温度可促进双链体模板核酸的分离)。在一些实施方式中,本文提供的方法的所有步骤在不高于80、70、60、50、40、30、20或10℃的温度下进行。在一些实施方式中,本文提供的方法在20-60、30-70、40-80、20-40、30-50、40-60、50-70、60-80、30-40、35-45、40-50、45-55、50-60、55-65℃的温度下进行。在某些实施方式中,含有靶核酸的样品可在本文提供的方法开始之前加热至大于40、50、60、70、80、90或95℃的温度。在某些实施方式中,本文提供的反应混合物可在本文提供的方法开始之前或之后一次加热至大于40、50、60、70、75、80、85、90或95℃的升高的温度。将反应混合物加热至升高的温度之后,反应混合物可维持在如本文其他地方提供的较低的温度下(例如,在40-70℃的温度下)用于进行该方法的其余部分。在实施方式中,如果在本文提供的方法开始之前将反应混合物或样品加热至升高的温度,则可在反应混合物或样品已经加热至升高的温度并且反应混合物或样品已经回到如本文提供的较低温度之后,将核酸聚合酶添加至反应混合物或样品中。本文公开的方法可在有或没有热循环仪的情况下进行。
作为一种考虑,可选择用于本文提供的方法或其步骤的温度以适合在该方法的步骤中使用的酶。在一些实施方式中,对于使用聚合酶的方法,选择反应的温度,使得该温度不会显著损害聚合酶的活性(例如,可选择反应的温度使得聚合酶具有至少24、12、6、4、3、2、1、0.75、0.5、0.25或0.1小时的半衰期)。或者,可在损害方法中使用的酶的活性的温度下执行方法(例如,可选择反应的温度使得反应中的酶具有不多于24、12、6、4、3、2、1、0.75、0.5、0.25或0.1小时的半衰期)。在一些实施方式中,如果在损害一种或多种酶的活性的温度或其他条件(例如pH)下执行方法,则可在该方法开始后以一个或多个间隔向反应中加入另外的酶以补充受损的酶的活性。
在一些实施方式中,本文提供的方法的一个或多个步骤在相同的反应容器(例如,管、尖端、器皿等)中发生。在一些实施方式中,方法的所有步骤均在相同的反应容器中发生。
用于本文提供的方法的试剂可在反应开始时一起提供,或者它们可以按顺序加入,其中在一个、两个或更多个步骤之后向反应中添加新的试剂。在一些情况下,可在反应过程期间向反应容器中添加新的试剂(例如,酶、引物),以增加可作用于底物或代替已变得失活的试剂(例如酶)的功能的试剂的量。可在本文提供的方法的反应开始后的一个或多个选定的时间间隔(例如,在反应开始后1、3、5、7、10、15、20、30、45或60分钟)向反应中添加新的试剂。
在一些实施方式中,本文提供的方法的一个或多个步骤可同时发生。例如,在生成第一引物的第一拷贝的延伸产物的单一拷贝后,可由该第一引物的第一拷贝的延伸产物的单一拷贝按顺序生成第二引物的延伸产物的多个拷贝。由于第二引物的延伸产物的拷贝由第一引物的第一拷贝的延伸产物的单一拷贝按顺序生成,因此第二引物的延伸产物的单独的拷贝可以例如,充当用于形成第一引物的第二拷贝的延伸产物的模板,是二级核酸的组分,是交换结构的组分,或者可以是用于形成第二引物/第一多联体链的延伸产物的延伸产物的起始点。在另一实例中,二级核酸的两个拷贝可在由核酸模板的第一链生成第一引物的第一拷贝的延伸产物的同时形成交换结构。在另一实例中,在由核酸模板的第一链生成第一引物的第一拷贝的延伸产物的一个拷贝的同时,由第一引物的第一拷贝的延伸产物的不同拷贝生成第二引物的延伸产物。本文提供的其他步骤也可同时发生。此外,在本文提供的包括双链核酸模板的方法和组合物中,核酸模板的任一条链可被认为是“第一链”,并且本文提供的引物对的任一引物可被认为是“第一引物”。因此,在一些实例中,双链核酸的两条链可以根据本文提供的方法同时用作核酸的“第一链”,且引物对的相对引物充当不同的“第一链”的“第一引物”。而且,根据本文提供的方法生成的各种结构可任选地进入本文提供的方法的不同途径。例如,在实施方式中,第一二级核酸可与第二二级核酸配对以形成如本文其他地方所述的交换结构。在其他实施方式中,第一二级核酸可被第一引物侵入,并且第二引物的延伸产物可充当用于生成第一引物的新的延伸产物的模板。为生成第一引物的新的延伸产物,置换作为二级核酸的一部分的第一引物的延伸产物。在另一实例中,在实施方式中,第一多联体可与另一多联体配对以形成交换结构。在其他实施方式中,第一多联体可被第一引物侵入,并且第一多联体链可充当用于生成新的第二多联体链的模板。为生成新的第一多联体链,置换作为多联体的一部分的第一多联体链。其他类似事件也可在本文提供的方法的过程中发生。
本文提供的反应和组合物可含有第一引物、第二引物、一级核酸、二级核酸、第一引物的第一拷贝的延伸产物、第一引物的第二拷贝的延伸产物、第二引物的延伸产物、交换结构、多联体等的多个拷贝。因此,本文提供的方法可包括这样的过程,其中本文提供的多个步骤同时发生,并且这样的步骤可与相关分子的多个拷贝一起发生。
在一些实施方式中,在本文提供的方法或组合物中提供了两组或更多组第一和第二引物,其中每一组均含有第一引物和第二引物,并且其中不同的引物组与不同的核酸模板互补。组中的第一和第二引物两者的模板结合区可与同一双链核酸模板的不同链互补。通常,给定组中的第一和第二引物的尾区具有不同于将在同一方法或组合物中使用的其他引物组的第一和第二引物的尾区的非互补序列,使得来自不同引物组的引物尾部不是互补的。这可能是理想的以便防止形成含有来源于不同核酸模板的链的杂合交换结构。或者,在两个或更多个不同的引物组中的第一和第二引物的尾区可具有互补序列,以便形成杂合交换结构和含有来源于不同核酸模板的链的多联体。在本文提供的方法或组合物中包含两个或更多个引物组可支持在同一反应容器中同时扩增多个不同的核酸模板。这例如对于扩增样品中感兴趣的多个模板或对于测定样品中多个不同模板的存在可能是有用的。在一些实施方式中,在本文提供的方法中提供了1、2、3、4、5、6、7、8、9、10、15、20、25、30、40、50、60、70、100、200、500组或更多组第一和第二引物,以便扩增1、2、3、4、5、6、7、8、9、10、15、20、25、30、40、50、60、70、100、200、500个或更多个不同的核酸模板或测定该核酸模板的存在。
在一些实施方式中,在本文提供的方法中,可快速扩增核酸模板。例如,在一些实施方式中,在该方法开始后0.1、0.5、1、3、5、10、15、20、30、40、50、60、90、120或180分钟内核酸模板可扩增至少500倍。在另一实例中,在一些实施方式中,在该方法开始后0.1、0.5、1、3、5、10、15、20、30、40、50、60、90、120或180分钟内核酸模板可扩增至少10,000倍。在另一实例中,在一些实施方式中,在该方法开始后0.1分钟、0.5分钟、1分钟、3分钟、5分钟、10分钟、15分钟、20分钟、30分钟、40分钟、50分钟、60分钟、90分钟、2小时、3小时、4小时、6小时、8小时、12小时、16小时或24小时内,核酸模板相对于该方法开始时反应混合物中存在的核酸模板的原始量可扩增至少5、10、25、50、100、250、500、1,000、5,000、10,000、50,000、100,000、500,000或1,000,000倍。在一些实施方式中,当方法开始时,用于该方法的第一步骤的所有试剂均在含有用于该方法的反应混合物的容器中。在一些实施方式中,当方法开始时,用于该方法的所有步骤的所有试剂均在含有用于该方法的反应混合物的容器中。
在一些实施方式中,在本文提供的方法中,核酸模板可以以比线性速率更高的速率进行扩增。在一些实施方式中,在本文提供的方法中,核酸模板可以以指数方式进行扩增。在一些实施方式中,在本文提供的方法中,在该方法开始后每1、2、3、5、10、15、20、25、30、45、60、90、120、180或240分钟,核酸模板的数目可至少加倍。在一些实施方式中,相对于该方法开始时反应中存在的核酸模板的原始量,核酸模板可扩增至少5、10、25、50、100、250、500、1,000、5,000、10,000、50,000、100,000、500,000、1,000,000或10,000,000倍。
根据本文提供的方法生成的多联体中核酸模板的多个拷贝的存在可有助于根据本文提供的方法快速扩增核酸模板。特别地,由于核酸模板的链的多个拷贝可存在于单一多联体链中,因此将单一聚合酶负载至单一多联体链上可导致随着聚合酶沿着该多联体链移动而生成核酸模板的链的多个拷贝。在一些情况下,核酸聚合酶遇到并负载至核酸链上所需的时间可显著影响扩增反应的总体速度。例如,如果聚合酶在复制反应期间遇到的每个核酸链仅含有核酸模板的链的单一拷贝,则在生成该模板的链的每个拷贝后聚合酶可能需要遇到并负载至新的模板链上。相比之下,通过采用多联体,在聚合酶遇到并负载至多联体链上后,它可合成模板的链的多个拷贝而无需使多联体链留下或遇到并负载至另一条链上。
在一些实施方式中,本文提供了用于由单链或双链RNA模板生成双链DNA多联体的方法和组合物。除了逆转录酶(例如,AMV逆转录酶、M-MLV逆转录酶、Superscript IITM逆转录酶、Superscript IIITM逆转录酶或ThermoScriptTM逆转录酶)也包含在本文提供的方法中外,可如本文所述执行该方法。第一引物的第一拷贝可与RNA模板退火,并且逆转录酶可生成第一引物的第一拷贝的延伸产物,该延伸产物通过逆转录的过程形成为DNA链。用于RNA的逆转录的方法和条件是本领域已知的并公开在例如RNA:A Laboratory Manual,D.Rio等人,Cold Spring Harbor Laboratory Press(2011)中,该文献通过引用全文并入本文。在通过逆转录酶(由RNA链)生成第一引物的第一拷贝的延伸产物(为DNA链)后,用于生成多联体的其余步骤可与本文其他地方所述的相同。
在一些实施方式中,本文提供的方法和组合物可包括一个或多个“暴沸(bumping)引物”。暴沸引物可与本文提供的方法和组合物一起使用,以通过例如提高从核酸模板的第一链置换核酸模板的第二链的速率,提高从第一引物延伸产物置换核酸模板的第一链的速率或者提高从第二引物延伸产物置换第一引物延伸产物的速率来例如提高生成反应产物的速率或特异性。如本文所用的“暴沸引物”指的是与在核酸模板的第一链或第二链上的序列互补的引物,该序列在与第一引物或第二引物的模板结合区结合的相同链上的序列的下游。因此,当暴沸引物与同一核酸链(第一引物或第二引物与该核酸链退火)退火时,暴沸引物的3’末端朝向第一引物或第二引物的5’末端(即,第一引物或第二引物的5’末端核苷酸和尾区)。当与核酸聚合酶一起温育并在支持生成引物延伸产物的条件下时,暴沸引物的延伸产物可通过该聚合酶由暴沸引物的3’末端形成。由于暴沸引物的3’末端朝向第一引物或第二引物的5’末端,因此随着暴沸引物的延伸产物的长度增加,它可最终遇到作为延伸产物的第一引物或第二引物的5’末端。聚合酶可随后从链以及第一引物或第二引物的任何延伸产物中置换第一引物或第二引物。因此,暴沸引物可加快本文提供的反应。
在一些实施方式中,本文提供了含有一种或多种酶、引物或本文提供的其他试剂的容器。容器可包含能够支持或含有液体或固体材料的任何结构,并可包括管、器皿、尖端等。在一些实施方式中,容器壁可允许光穿过壁透射。容器可以是光学透明的。容器可含有,例如,分离的核酸聚合酶、分离的DNA聚合酶、分离的逆转录酶、第一引物、第二引物、核酸染料或核酸探针中的任意一种或多种,如本文其他地方所述。可提供容器的任何内容物的任何数目的拷贝(例如,第一拷贝、第二拷贝、第三拷贝等)。容器的内容物可以是流体连通的。在一些实施方式中,容器可进一步含有核酸模板。在一些实施方式中,容器可进一步含有核苷酸、缓冲液、盐、水或本文提供的用于核酸扩增的其他试剂。在一些实施方式中,容器可含有两个或更多个引物组,其中每个引物组包含第一引物和第二引物,并且不同的引物组与不同的核酸模板互补。
可将对于本文提供的方法有用的两种或更多种试剂包装并作为试剂盒提供。例如,试剂盒可包含以下的任意两种或更多种:核酸模板、第一引物、第二引物、核酸聚合酶、DNA聚合酶、逆转录酶、缓冲液、核酸染料、核酸探针或dNTP,如本文其他地方所述。在试剂盒内,两种或更多种试剂可包装于分开的容器或同一容器中。在一些实施方式中,试剂盒可进一步含有核苷酸、缓冲液、盐、水或本文提供的用于核酸扩增的其他试剂。
在实施方式中,如本文提供的第一引物和第二引物可作为引物组一起提供。引物组可作为单独的试剂盒或组合物提供,或者该引物组可与用于执行本文提供的方法的一种或多种其他试剂一起提供于试剂盒中。
在一些实施方式中,核酸连接酶可包含在本文提供的方法或组合物中。连接酶催化核苷酸之间(通常在一个核苷酸的5’磷酸与另一个核苷酸的3’羟基基团之间)磷酸二酯键的形成。相比于不包含连接酶的反应,本文提供的反应通过在反应中包含连接酶可以以更高的速率扩增靶核酸。连接酶可以例如增加存在于本文提供的反应中的多联体的大小或数目。
核酸连接酶包括大肠杆菌DNA连接酶、Taq DNA连接酶、T3DNA连接酶、T4DNA连接酶、T7DNA连接酶、AmpligaseTM、T4RNA连接酶1和T4RNA连接酶2。
为催化连接反应,某些连接酶需要ATP(例如T4DNA连接酶)或NAD+(大肠杆菌DNA连接酶)。在一些实施方式中,连接酶可连接具有平端的核酸。在一些实施方式中,连接酶可连接具有粘端的核酸。在一些实施方式中,连接酶可连接具有平端和粘端两者的核酸。
连接酶的修饰形式也可与本文提供的方法和组合物一起使用,条件是修饰的连接酶具有催化核苷酸之间磷酸二酯键的形成的能力。连接酶的修饰形式(“修饰的连接酶”)可以具有例如,100个或更少的、70个或更少的、50个或更少的、40个或更少的、30个或更少的、20个或更少的、10个或更少的、5个或更少的、4个或更少的、3个或更少的、2个或更少的、或1个与天然存在的亲代连接酶形式的序列不同的氨基酸。在一些实施方式中,修饰的连接酶可含有比亲代连接酶多或少不多于1000、700、500、400、300、200、100、50、40、30、20、10或5个的氨基酸。在一些实施方式中,修饰的连接酶可含有亲代连接酶的片段。在一些实施方式中,修饰的连接酶可包含具有来源于连接酶的一部分和来源于非连接酶蛋白质的一部分的嵌合多肽。在一些实施方式中,修饰的连接酶可具有,例如,与亲代连接酶相比提高的催化活性、提高的稳定性或提高的热稳定性。
在一些实施方式中,本文提供的连接酶是热稳定的。热稳定的连接酶在高达25、30、35、40、45、50、55、60、65、70、75、80、85、90或95℃的温度下可具有例如至少5、10、15、20、30、40、50、60、90、120或180分钟的半衰期。在一些实施方式中,修饰的连接酶可以是热稳定的。
在一些实施方式中,包含在本文提供的方法和组合物中的连接酶可以是在本文中被称为“p50-Tth”的修饰的连接酶,其具有氨基酸序列:MGHHHHHHHHHHSSGHIEGRASMTLEEARKRVNELRDLIRYHNYRYYVLADPEISDAEYDRLLRELKELEERFPELKSPDSPTLQVGARPLEATFRPVRHPTRMYSLDNAFNLDELKAFEERIERALGRKGPFAYTVEHKVDGLSVNLYYEEGVLVYGATRGDGEVGEEVTQNLLTIPTIPRRLKGVPERLEVRGEVYMPIEAFLRLNEELEERGERIFKNPRNAAAGSLRQKDPRITAKRGLRATFYALGLGLEEVEREGVATQFALLHWLKEKGFPVEHGYARAVGAEGVEAVYQDWLKKRRALPFEADGVVVKLDELALWRELGYTARAPRFAIAYKFPAEEKETRLLDVVFQVGRTGRVTPVGILEPVFLEGSEVSRVTLHNESYIEELDIRIGDWVLVHKAGGVIPEVLRVLKERRTGEERPIRWPETCPECGHRLLKEGKVHRCPNPLCPAKRFEAIRHFASRKAMDIQGLGEKLIERLLEKGLVKDVADLYRLRKEDLVGLERMGEKSAQNLLRQIEESKKRGLERLLYALGLPGVGEVLARNLAARFGNMDRLLEASLEELLEVEEVGELTARAILETLKDPAFRDLVRRLKEAGVEMEAKEKGGEALKGLTFVITGELSRPREEVKALLRRLGAKVTDSVSRKTSYLVVGENPGSKLEKARALGVPTLTEEELYRLLEARTGKKAEELV(SEQ ID NO:79)。连接酶p50-Tth在至少60℃的温度下具有热稳定的平端连接活性。连接酶p50-Tth是嵌合蛋白,其包括含His10的前导序列、来自人类NF-kappa-B蛋白登录号NP_003989氨基酸40-366的p50序列(以斜体字表示)、柔性富甘氨酸序列以及来自嗜热栖热菌(Thermus Thermophilus)HB8,登录YP_144363的Tth DNA连接酶序列(用下划线表示)。在一些实施方式中,p50-Tth连接酶的修饰形式可与本文提供的方法和组合物一起使用(例如具有100个或更少的、70个或更少的、50个或更少的、40个或更少的、30个或更少的、20个或更少的、10个或更少的、5个或更少的、4个或更少的、3个或更少的、2个或更少的、或1个与p50-Tth连接酶不同的氨基酸)。在实施方式中,与本文提供的组合物或方法一起使用的连接酶可以是描述于2013年3月15日提交的美国临时专利申请号61/802,124或2014年3月15日提交的PCT申请号PCT/US14/30003中的连接酶,这两个专利申请均通过引用全文并入本文用于所有目的。
本文提供的用于扩增核酸模板/生成含有该模板的至少两个拷贝的多联体的各种方法和组合物可实现先前已通过用于等温的依赖热循环仪的核酸扩增的其他方法和组合物实现的许多功能。根据本文提供的方法用于扩增的核酸模板在本文也可称为“靶核酸”等。本文提供的方法和组合物可用于,例如感兴趣的核酸的分离和克隆、基因表达分析、核酸的诊断鉴定、新型核酸的合成、核酸探针合成和标记、受试者的法医学鉴定、受试者的等位基因鉴定、遗传筛查、核酸测序以及相关的应用。靶核酸分子可以是任何类型,包括单链或双链DNA或RNA(例如,mRNA)。靶核酸可以是任何类型或功能(例如,编码蛋白质的序列、调节序列、内含子等)。靶核酸可以是整个基因或其一部分。
在一些实施方式中,本文提供的方法或组合物可用于检测样品中靶核酸的量(包括靶标的存在或不存在),测量在所选时间段内由样品形成的靶标的扩增产物的量,或确定由样品生成模板的一定数目的拷贝所必需的时间量。可与本文提供的方法和组合物一起使用的样品在本文其他地方进行了描述,并且可包括,例如受试者的体液、分泌物或组织。在实施方式中,可在测定中使用样品之前处理样品以根据本文提供的方法扩增样品中的靶核酸。样品的处理可包括如本文其他地方所述的任何处理步骤,并可包括例如声处理或化学裂解步骤。
在一些实施方式中,可执行本文提供的方法以在同一反应容器中同时测定至少2、3、4、5、6、7、8、9、10、12、15、20、25、30、35、40、45、50、75、100种或更多种不同的靶核酸。通常,对于每种感兴趣的靶核酸,提供了第一引物和第二引物,每一个均与核酸靶标的链或其互补序列互补。可通过例如使用对不同靶核酸中的检测序列具有序列特异性的核酸探针和不同的荧光团,来监测在同一容器中不同靶核酸的扩增。
在一些实施方式中,本文提供的方法或组合物可用于检测靶核酸中感兴趣的特定核苷酸的存在或不存在(例如,在突变或SNP的情况下)。例如,可选择与靶核酸中包括感兴趣的核苷酸或与之相邻的区域选择性结合的第一或第二引物。该引物可设计为使得其选择性地:i)当该区域含有感兴趣的核苷酸时与该区域结合,或ii)当该区域含有感兴趣的核苷酸时不与该区域结合。可用所选引物来执行如本文所述的方法,并且扩增反应的结果可提供关于靶核酸中感兴趣的核苷酸存在或不存在的信息。例如,如果第一引物的模板结合区被设计为具有与包含感兴趣的特定核苷酸(例如突变)的靶核酸中的序列互补的核苷酸序列,则用所选引物从样品中成功扩增靶核酸可表明该样品含有具有感兴趣的特定核苷酸的靶核酸。在一些实施方式中,用于分析靶核酸中感兴趣的核苷酸的引物可在该引物的3’末端含有关键核苷酸(即对应于靶核酸中感兴趣的核苷酸的同一位置的核苷酸)。在这样的情况下,引物的3’末端核苷酸的退火可能依赖于靶核酸中感兴趣的核苷酸的存在。如果引物的3’末端核苷酸不与靶核酸中的核苷酸退火(例如由于核苷酸之间的错配),则该错配可显著影响核酸聚合酶由引物合成延伸产物。因此,在一些实施方式中,具有对应于感兴趣的核苷酸的3’末端核苷酸的引物可用于确定靶核酸中特定核苷酸的存在或不存在。在这样的实施方式中,在一些情况下可选择在引物的3’末端的关键核苷酸与靶核酸中感兴趣的核苷酸互补,并且在一些其他情况下可选择在引物的3’末端的关键核苷酸与靶核酸中感兴趣的核苷酸不互补。感兴趣的核苷酸可代表例如靶核酸的野生型形式、突变体形式或多态性。
在其他实施方式中,可通过选择引物,使得感兴趣的核苷酸存在于不与第一或第二引物的模板结合区互补的区域中的靶核酸中,来检测靶核酸中感兴趣的特定核苷酸(例如突变或SNP)。例如,感兴趣的核苷酸可以大约在靶核酸序列的中间。在实施方式中,感兴趣的核苷酸可以在本文其他地方所述的“内部基序”中。在实施方式中,当感兴趣的核苷酸在内部基序中时,可以将引物对制备成在引物的尾区中含有与内部基序或其互补体互补,并且可用于确定在靶序列中的内部基序中存在或不存在感兴趣的核苷酸的核苷酸序列。如本文其他地方所解释的,引物的尾区中的核苷酸序列与该引物的延伸产物中的内部基序暂时退火可提高本文提供的反应的速率。在一些情况下,引物的尾区中的核苷酸序列对该引物的延伸产物中的内部基序的亲和力越大,反应可越快发生。而且,通常,在引物的尾区中的核苷酸序列中可与该引物的延伸产物中的内部基序中的核苷酸结合的核苷酸数目越大,该延伸产物的尾区中的核苷酸序列对于延伸产物中的内部基序的亲和力越大。因此,在实施方式中,采用本文提供的组合物和方法,可以通过使用引物来确定在靶序列中存在或不存在感兴趣的核苷酸,所述引物在引物的尾区中具有能与靶序列中的内部基序或其互补体结合的核苷酸序列,并且在尾区内具有或不具有与内部基序或其互补体中感兴趣的特定核苷酸特异性结合的核苷酸。通常,当引物的尾区中的核苷酸序列含有与该引物的延伸产物中的核苷酸(对应于靶标中感兴趣的核苷酸)互补的核苷酸时,将比当引物的尾区中的相关核苷酸不与该引物的延伸产物中的核苷酸(对应于靶标中感兴趣的核苷酸)互补时更快地发生反应。例如,野生型形式的靶核酸链的内部基序可具有核苷酸序列:5’TATTGCAT 3’。然而,在群体中的许多个体中,该序列中的“G”可频繁突变为“A”。为了确定特定靶核酸是否在序列中含有“G”或其他核苷酸,可以制备在其尾区中含有具有序列5’ATGCAATA 3’的核苷酸序列的引物。如果使用该引物(和合适的第二引物)根据本文提供的方法扩增靶核酸,则当“G”存在于内部基序中时,相对于当在该内部基序中“G”的位置处存在不同的核苷酸时,扩增反应可具有特定的反应速率。这是因为如果“G”存在于内部基序中,则引物的尾区中的核苷酸序列将与内部基序完全互补,但是如果在G的正常位置处存在非“G”的核苷酸,则将不会完全互补。通常,在这一实例中,如果“G”存在于内部基序中,与不存在“G”相比,引物的尾区将与内部基序更频繁地退火,并且这可以转而导致存在“G”时比不存在“G”时更快的反应速率。采用本文提供的系统和方法,可以制备引物,以确定存在或不存在感兴趣的核苷酸(例如,可以制备引物,使得当存在突变形式的核苷酸时比存在野生型形式的核苷酸时更快地发生反应,或反之亦然)。而且,在实施方式中,可以制备引物,以便确定在靶标中的内部基序中在感兴趣的位置处的未知核苷酸的身份。例如,可以制备四个不同的引物对,每一个根据情况含有对应于靶核酸中感兴趣的核苷酸的A、T、G或C。在实施方式中,产生最快反应结果的引物对可能指示哪个核苷酸存在于靶核酸中的内部基序中感兴趣的位置处。例如,靶核酸可具有通常具有5’至3’方向的序列GTAACGAG的内部基序。然而,靶核酸的不同变体可在内部基序的第5位置(即“C”的位置)处具有不同的核苷酸。继续该实例,如果提供含有靶核酸的样品,其中不知道在内部基序的第5位置处是何种核苷酸,则可将该样品分成至少4个部分,并且这四个部分可用于第一反应混合物、第二反应混合物、第三反应混合物和第四反应混合物。向第一反应混合物中提供第一引物对,其中引物分别具有包含5’至3’方向的序列CTCGTTAC和GTAACGAG的尾区。如果“C”存在于内部基序的第5位置处,则这些尾区将与该内部基序或其互补体完全互补。因此,如果靶标在这一反应混合物中扩增最快,则表明“C”存在于该靶标中的内部基序中感兴趣的核苷酸的位置处。向第二反应混合物中提供第二引物对,其中引物分别具有包含5’至3’方向的序列CTCATTAC和GTAATGAG的尾区。如果“T”存在于内部基序的第5位置处,则这些尾区将与该内部基序或其互补体完全互补。因此,如果靶标在这一反应混合物中扩增最快,则表明“T”存在于该靶标中的内部基序中感兴趣的核苷酸的位置处。向第三反应混合物中提供第三引物对,其中引物分别具有包含5’至3’方向的序列CTCCTTAC和GTAAGGAG的尾区。如果“G”存在于内部基序的第5位置处,则这些尾区将与该内部基序或其互补体完全互补。因此,如果靶标在这一反应混合物中扩增最快,则表明“G”存在于该靶标中的内部基序中感兴趣的核苷酸的位置处。向第四反应混合物中提供第四引物对,其中引物分别具有包含5’至3’方向的序列CTCTTTAC和GTAAAGAG的尾区。如果“A”存在于内部基序的第5位置处,则这些尾区将与该内部基序或其互补体完全互补。因此,如果靶标在这一反应混合物中扩增最快,则表明“A”存在于该靶标中的内部基序中感兴趣的核苷酸的位置处。在实施方式中,如果例如不希望筛选所有可能的核苷酸变体(例如,如果在感兴趣的位置通常发现仅2个不同的核苷酸),则以上概述的方法或组合物可以任选地仅用2或3种反应混合物来准备,这些反应混合物具有对应于在感兴趣的位置处仅有2或3个核苷酸选项的引物对。
在实施方式中,根据本文提供的方法,含有靶核酸的样品可被分成至少第一和第二部分,其中第一部分在具有第一引物对的第一反应混合物中温育,并且第二部分在具有第二引物对的第二反应混合物中温育。在实施方式中,第一引物对和第二引物对彼此仅在引物各自的尾区/第一区域中相差一个核苷酸(例如,第一对的第一引物的第一区域的序列与第二对的第一引物的第一区域的序列仅相差一个核苷酸)。在引物的尾区中不同的单一核苷酸可对应于靶核酸中感兴趣的核苷酸的位置。通过比较在第一反应混合物中与在第二反应混合物中靶核酸的扩增速率或量,可以确定在靶核酸中的感兴趣的核苷酸的身份。在实施方式中,以上概述的方法可采用样品的第一、第二、第三和第四部分以及第一引物对、第二引物对、第三引物对和第四引物对进行,其中如上所述,第一引物对、第二引物对、第三引物对和第四引物对彼此仅在引物各自的尾区/第一区域中相差一个核苷酸。
在实施方式中,可提供至少第一靶核酸和第二靶核酸,其中第一靶核酸和第二靶核酸如本文其他地方所述在内部基序中感兴趣的位置处相差一个核苷酸。在实施方式中,根据本文提供的方法,第一靶核酸可在含有本文所述的引物对的第一反应混合物中温育,并且第二靶核酸可在含有相同引物对的第二反应混合物中温育。通过比较在第一反应混合物中的第一靶核酸与在第二反应混合物中的第二靶核酸的扩增速率或量,或与绝对值比较,根据本文其他地方所述的原理,可以确定在第一靶核酸和第二靶核酸的一个或两者中感兴趣的位置处的核苷酸的身份。
此外,在实施方式中,本文所述用于检测感兴趣的单一核苷酸的组合物和方法也可以用来检测多个核苷酸突变或多态性。
本文提供的方法和组合物可用于从可含有核酸的任何样品中扩增核酸。样品的实例可包括各种流体样品。在一些情况下,样品可以是来自受试者的体液样品。样品可包含一个或多个流体组分。在一些情况下,可提供固体或半固体样品。样品可包括从受试者采集的组织。样品可包括受试者的体液、分泌物或组织。样品可以是生物样品。该生物样品可以是体液、分泌物或组织样品。生物样品的实例可以包括但不限于,血液、血清、唾液、尿液、胃液和消化液、泪液、粪便、精液、阴道液、来源于肿瘤组织的间质液、眼部液体、汗液、粘液、耳垢、油、腺体分泌物、呼气、脊髓液、毛发、指甲、皮肤细胞、血浆、鼻拭子或鼻咽洗液、脊髓液、脑脊髓液、组织、咽喉拭子、活检物、胎盘液、羊水、脐带血、重点流体(emphatic fluid)、腔液、痰、脓、微生物群、胎粪、母乳或其他排泄物。样品可以由人或动物提供。样品可以来自植物、微生物(例如病毒、细菌)或其他生物物质。
在一些实施方式中,本文提供的方法和组合物可在服务点位置(例如受试者的家中或工作地点、食品杂货店、药店、诊所或学校等)执行或使用。本文提供的方法和组合物可允许快速扩增来自受试者的样品中的核酸,以便帮助诊断或治疗受试者。例如,此处提供的方法和组合物可用于检测来自受试者的样品中来自病原体如病毒(例如流感病毒)或细菌(例如链球菌属(streptococcus))的核酸的存在。
在实施方式中,本文提供的方法和组合物可用来检测病原体或病原体的特征(例如病原体内的基因或基因变异)。可采用本文提供的方法或组合物检测的病原体或其特征可包括,例如,鲍氏不动杆菌(Acinetobacter baumannii)、blaROB抗性基因、blaTEM抗性基因、Bordetalla holmesii、洋葱伯克霍尔德氏菌(Burkholderia cepacia)、白假丝酵母(Candida albicans)、艰难梭菌(Clostridium difficile)、索氏梭菌(Clostridium sordellii)、产气肠杆菌(Enterobacter aerogenes)、阴沟肠杆菌(Enterobacter cloacae)、粪肠球菌(Enterococcus faecaelis)、屎肠球菌(Enterococcus faecium)、大肠杆菌(Escherichia coli)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、KPC抗性基因、侵肺军团菌(Legionella pneumophila)、mecA抗性基因、mecC抗性基因、卡他莫拉菌(Moraxella catarrhalis)、脓肿分枝杆菌(Mycobacterium abscessus)、铜绿假单胞菌(Pseudomonas aeruginosa)、粘质沙雷氏菌(Serratia marcescens)、金黄色葡萄球菌(Staphylococcus aureus)、金黄色葡萄球菌(万古霉素抗性)VRSA、无乳链球菌(Strep B)(Streptococcus agalactiae(Strep B))、肺炎链球菌(Streptococcus pneumonia)、肺炎链球菌(青霉素敏感性)、酿脓链球菌(Streptococcus pyogenes)、vanA抗性基因、vanB抗性基因、腺病毒B(Adenovirus B)、腺病毒C(Adenovirus C)、腺病毒E、博卡病毒1+3(Bocavirus 1+3)、博卡病毒2+4、副百日咳博德特氏菌(Bordetella parapertussis)、百日咳博德特氏菌(Bordetella pertussis)、肺炎衣原体(Chlamydia pneumonia)、索氏梭菌、冠状病毒229E(Coronavirus 229E)、冠状病毒HKU1、冠状病毒MERS、冠状病毒NL63、冠状病毒OC43、人偏肺病毒A(Human metapneumovirus A)、人偏肺病毒B、甲型流感-MP(Influenza A–MP)、乙型流感-MP(Influenza B–MP)、流感H1N1(2009)、流感H1N1(季节性)、流感H3N2、流感H5N1、流感H7N9(HA基因)、流感H7N9(NA基因)、麻疹病毒(measles virus)、腮腺炎病毒(mumps virus)、结核分枝杆菌(Mycobacterium tuberculosis)、肺炎支原体(Mycoplasma pneumonia)、副流感1(Parainfluenza 1)、副流感2、副流感3、副流感4a、副流感4b、人呼吸道合胞病毒A(RSV A)(Respiratory syncytial virus A(RSV A))、人呼吸道合胞病毒B(RSV B)、鼻病毒A(Rhinovirus A)、鼻病毒B、鼻病毒C、风疹病毒(rubella virus)、酿脓链球菌、白假丝酵母、砂眼衣原体(Chlamydia trachomatis)、人乳头瘤病毒(human papilloma virus)、HPV 16、HPV 18、HSV-1/2、生殖道支原体(mycoplasma genitalium)、淋病奈瑟氏球菌(Neisseria gonorrhoeae)、苍白密螺旋体(梅毒)(Treponema pallidum(syphilis))、阴道毛滴虫(Trichomonas vaginalis)、水痘-带状疱疹病毒(Varicella-zoster virus)、EB病毒(Epstein-Barr Virus)、甲型肝炎(Hepatitis A)、乙型肝炎(Hepatitis B)、丙型肝炎(Hepatitis C)、丁型肝炎(Hepatitis D)、HIV、HIV-1组M、HIV-1组O1、HIV-1组O3、HIV-2组A、HIV-2组B、人型支原体(Mycoplasma hominis)、奇异变形菌(Proteus mirabilis)、彭氏变形菌(Proteus penneri)、普通变形菌(Proteus vulgaris)、腐生葡萄球菌(S.saprophyticus)、解脲支原体(Ureaplasma urealyticum)、炭疽芽孢杆菌(Bacillus anthracis)、鼠疫耶尔森氏菌(Yersina pestis)、登革病毒(Dengue virus)、疟原虫(Plasmodium)、克氏锥虫(锥虫病)(Tryponosoma cruzi(chagas))、西尼罗病毒1(West Nile Virus 1)、西尼罗病毒2、诺如病毒谱系1(Norovirus lineage 1)、诺如病毒谱系2、埃博拉病毒(Ebola virus)。在实施方式中,可使用本文提供的方法针对来自受试者的单一样品测定1、2、3、5、10、20、30、50个或更多个这样的病原体或其特征。在实施方式中,在2014年9月5日提交的国际申请号PCT/US2014/54424或2014年5月20日提交的美国临时专利申请号62/001,050中描述的任何基于核酸扩增的测定或测定组,可使用本文所述的核酸扩增方法进行,这些申请通过引用以全文并入于此用于所有目的。类似地,在国际申请号PCT/US2014/54424或美国临时专利申请号62/001,050中描述的任何病原体或其特征可采用本文提供的核酸扩增方法进行测定。
在实施方式中,流感组可以使用本文提供的用于从一个或多个流感菌株扩增核酸的方法来进行。例如,使用本文提供的方法可以从甲型流感、甲型流感H3N2、甲型流感H5N1、甲型流感H7N9-HA基因、甲型流感H7N9-NA基因或乙型流感中的一个或多个扩增一个或多个核酸。可以使用本文提供的方法进行的其他组包括,例如,呼吸组、性传播疾病组、血源性病原体组或医源性感染组。这些组中的任何一个可包括针对至少2、3、4、5、10、15或20个不同的病原体或基因的测定。
在实施方式中,本文提供的方法和组合物可用于甲型流感病毒检测和亚型分型。甲型流感亚型由以下两种病毒基因的类型确定:血凝素(HA)和神经氨酸酶(NA)。目前有18种已知的HA基因(H1-H18)和11种已知的NA基因(N1-N11)。这些基因在甲型流感病毒中的不同分子上编码,因而甲型流感亚型可能携带不同HA和NA基因的任何组合。为了准确地对甲型流感病毒进行检测和分型,可能需要测试可能含有或已知含有甲型流感病毒的样品的至少两种至高达全部18种已知的HA基因和至少两种至高达全部11种已知的NA基因。在实施方式中,来自受试者的单一样品可被分成两个或更多个部分,并且这些部分可在本文提供的反应条件下与具有对于所述18种已知HA基因和11种已知NA基因中的每一种为特异性的模板结合区的引物对(即29个不同的引物对)一起温育。在实施方式中,来自受试者的单一样品可被分成至少29个不同的部分,其中第一部分在本文提供的反应条件下与具有对于H1为特异性的模板结合区的引物对一起温育,其中第二部分在本文提供的反应条件下与具有对于H2为特异性的模板结合区的引物对一起温育,其中第三部分在本文提供的反应条件下与具有对于H3为特异性的模板结合区的引物对一起温育,其中第四部分在本文提供的反应条件下与具有对于H4为特异性的模板结合区的引物对一起温育,其中第五部分在本文提供的反应条件下与具有对于H5为特异性的模板结合区的引物对一起温育,其中第六部分在本文提供的反应条件下与具有对于H6为特异性的模板结合区的引物对一起温育,其中第七部分在本文提供的反应条件下与具有对于H7为特异性的模板结合区的引物对一起温育,其中第八部分在本文提供的反应条件下与具有对于H8为特异性的模板结合区的引物对一起温育,其中第九部分在本文提供的反应条件下与具有对于H9为特异性的模板结合区的引物对一起温育,其中第十部分在本文提供的反应条件下与具有对于H10为特异性的模板结合区的引物对一起温育,其中第十一部分在本文提供的反应条件下与具有对于H11为特异性的模板结合区的引物对一起温育,其中第十二部分在本文提供的反应条件下与具有对于H12为特异性的模板结合区的引物对一起温育,其中第十三部分在本文提供的反应条件下与具有对于H13为特异性的模板结合区的引物对一起温育,其中第十四部分在本文提供的反应条件下与具有对于H14为特异性的模板结合区的引物对一起温育,其中第十五部分在本文提供的反应条件下与具有对于H15为特异性的模板结合区的引物对一起温育,其中第十六部分在本文提供的反应条件下与具有对于H16为特异性的模板结合区的引物对一起温育,其中第十七部分在本文提供的反应条件下与具有对于H17为特异性的模板结合区的引物对一起温育,其中第十八部分在本文提供的反应条件下与具有对于H18为特异性的模板结合区的引物对一起温育,其中第十九部分在本文提供的反应条件下与具有对于N1为特异性的模板结合区的引物对一起温育,其中第二十部分在本文提供的反应条件下与具有对于N2为特异性的模板结合区的引物对一起温育,其中第二十一部分在本文提供的反应条件下与具有对于N3为特异性的模板结合区的引物对一起温育,其中第二十二部分在本文提供的反应条件下与具有对于N4为特异性的模板结合区的引物对一起温育,其中第二十三部分在本文提供的反应条件下与具有对于N5为特异性的模板结合区的引物对一起温育,其中第二十四部分在本文提供的反应条件下与具有对于N6为特异性的模板结合区的引物对一起温育,其中第二十五部分在本文提供的反应条件下与具有对于N7为特异性的模板结合区的引物对一起温育,其中第二十六部分在本文提供的反应条件下与具有对于N8为特异性的模板结合区的引物对一起温育,其中第二十七部分在本文提供的反应条件下与具有对于N9为特异性的模板结合区的引物对一起温育,其中第二十八部分在本文提供的反应条件下与具有对于N10为特异性的模板结合区的引物对一起温育,并且其中第二十九部分在本文提供的反应条件下与具有对于N11为特异性的模板结合区的引物对一起温育。在一些实施方式中,如本文其他地方所述,针对2、3、4、5个或更多个不同的HA或NA亚型的引物对可以与来自受试者的样品的单一部分一起温育(例如在常规容器中),并且可以使用序列特异性探针(例如DNA探针或PNA探针)鉴定扩增反应产物。在实施方式中,可以进行一组(panel),其中单一样品用于以针对至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25个或全部上述29个HA和NA亚型的引物对进行扩增反应。在实施方式中,组(panel)可包括用来扩增H1、H2、H3、H5、H7或N9中的一个或多个的反应。在实施方式中,本文所述的用于检测甲型流感或其亚型的组或方法可进一步包括用来检测例如甲型流感基质蛋白基因(它存在于全部甲型流感亚型中,从而可用于鉴定样品中的甲型流感)、人RNA酶P(以确保从人类受试者中充足地收集样品;对于非人类受试者,可以使用其他合适的物种特异性对照基因)或掺加核酸对照的试剂或反应,该掺加核酸对照可在样品收集或处理步骤的过程中的一个或多个时间点添加,以便确保充分的样品收集或处理。在实施方式中,可提供试剂盒来进行以上提供的任何方法或任何组。
在实施方式中,与可能使用其他核酸扩增方法(例如PCR或LAMP)采用一对引物进行扩增相比,通过使用本文提供的方法,可以使用一对引物来扩增更多种类的靶核酸序列。例如,在实施方式中,本文提供的引物的模板结合区可与模板充分退火,以根据本文提供的方法扩增该模板,即使当引物的模板结合区与模板之间具有1、2、3、4、5个或更多个核苷酸错配时。在实施方式中,当在本文提供的方法中使用的至少第一引物和任选的第二引物的模板结合区中至少6%、8%、10%、12%、14%、16%、18%、20%、22%或24%的核苷酸不与模板序列中的相应核苷酸互补时,可进行本文提供的方法。因此,本文提供的引物和方法的使用可有助于用同一对引物扩增多个类似但不同的序列。例如,本文提供的引物和方法可用于检测甲型流感的多个不同的菌株,其中所述菌株具有类似但不同的核苷酸序列。例如,可能有甲型流感的两个不同的菌株,其中这两个菌株均被确定为H1N1亚型,但所述菌株具有略微不同的H1或N1核苷酸序列。在实施方式中,使用本文提供的组合物和方法,第一菌株和第二菌株均可使用相同的引物对得到扩增。
此外,可基于病原体的核酸中的高度保守区选择用于从病原体中扩增核酸的引物,以进一步帮助根据本文提供的方法采用相同引物对检测病原体的多个不同的菌株。这样的高度保守区可通过例如在病原体的多个菌株之间的感兴趣的基因的序列比对来鉴定。例如,Genbank ID号为AEK98400、ABG47862、AEO00689、ABF17954、AFG99237、AFG99027、ABO33069、ABE12623、AFG72790、AAA87553、AAZ38605、AFN19700、ABB04371、ABC39805的HA3序列来自H3N2甲型流感病毒的不同隔离群。这些HA3基因各自具有略微不同的核苷酸序列。尽管如此,通过细心选择引物,可根据本文提供的方法采用同一组引物扩增全部这些HA3基因。例如,根据本文提供的方法可选择以5’-3’顺序具有序列AACCTCACTACGTAAGTCTTGACGTAAACGGTTACCCACGTAGACTAGAGTAATAACTCGAAAAGGGT(SEQ ID NO:91)的HA3基因的一部分作为扩增靶标(该序列以DNA形式,而非RNA形式提供)。以5’至3’方向描述该序列,第一下划线序列是模板的第二部分,第二下划线序列是内部基序,第三下划线序列是模板的第一部分,如这些术语在例如图10中使用一样。在这个和其他这样的实例中,可以选择用于扩增的总靶序列以及充当模板的第一部分、模板的第二部分和内部基序的特定序列,使得如本文所述的引物可用于根据本文提供的方法成功地扩增范围广泛的相关序列。在实施方式中,可提供如本文所述的第一引物,其中该引物的模板结合区与以上模板的第一部分互补,并且可以提供如本文所述的第二引物,其中该引物的模板结合区与同该模板的第二部分互补的配偶体序列互补。任选地,所述引物可进一步具有与内部基序或其互补序列互补的尾区。这样的引物可在例如本文提供的组合物或方法中提供。
采用本文提供的方法,可以在样品或反应混合物中在低至例如小于1000、500、100、50、10、5、2或1个拷贝/微升的浓度下明确鉴定病原体或基因。在实施方式中,本文提供的方法可从一种类型的病原体或基因特异性地扩增核酸,并且不从相关的病原体或基因扩增核酸。例如,本文提供的用于扩增甲型流感基质蛋白基因的试验可从甲型流感的多个不同菌株中扩增该基因,但不从乙型流感中扩增遗传物质。
在实施方式中,本文提供的方法可在一种或多种潜在干扰性物质的存在下成功进行。潜在干扰性物质的实例包括BSA、葡萄糖、胆红素、亚硝酸盐、β-hCG、丙酮、低pH条件、高pH条件、醋氨酚、阿司匹林、黄体酮、炔雌醇、尿防腐剂、精液、人体润滑剂、避孕凝胶剂、杀精剂、女性粉剂、痔疮乳膏、咪康唑、人类基因组DNA、洗剂、通用转运培养基(病毒的)、艾米斯(amies)转运培养基(细菌的)、血液、粘蛋白、阿昔洛韦、冷疱治疗、尿、粪便、血红蛋白、甘油三酯、EDTA、肝素、胆固醇、γ-球蛋白、氨苄青霉素、烟碱、可替宁、喷鼻剂、滴鼻剂或它们的任意组合。在实施方式中,本文提供的方法可在潜在干扰性物质的存在下进行,该物质的浓度可达至少与2014年5月20日提交的美国临时专利申请号62/001,050中提供的一样大,该申请通过引用并入于此用于所有目的。在实施方式中,本文提供的方法可在潜在干扰性物质的存在下进行,该物质的浓度可达比美国临时专利申请号62/001,050中提供的大至少10%、25%、50%或100%。
本文公开的测定和方法可在用于处理样品的装置或系统上执行。本文公开的测定和方法可容易地并入用于处理样品的装置或用于处理样品的系统中并在其中使用,该装置或系统可以是自动化的测定装置或者可以是自动化的测定系统。这样的装置以及这样的系统可用于实施本文公开的方法。例如,装置可用于接收样品。装置可用于制备或用于处理样品。装置可用于对样品进行测定。装置可用于从样品获得数据。装置可用于传送从样品中获得的数据。装置可用于处理或测定样品之后处置样品。
装置可以是系统的一部分,该系统的组件可以是样品处理装置。装置可以是样品处理装置。样品处理装置可配置为促进样品的采集、制备用于临床检验的样品或执行使用一种或多种试剂的方法,如本文所公开的。样品处理装置可配置为从样品获得数据。样品处理装置可配置为传送从样品中获得的数据。样品处理装置可配置为分析来自样品的数据。样品处理装置可配置为与另一装置或实验室或附属于实验室的个体通信,以分析从样品中获得的数据。
样品处理装置可配置为放置在受试者体内或受试者上。样品处理装置可配置为直接或间接地接纳来自受试者的样品。样品可以是,例如,血液样品(例如,由手指针刺或由静脉穿刺获得的样品或动脉血样品)、尿液样品、活检样品、组织切片、粪便样品或其他生物样品;水样品、土壤样品、食物样品、空气样品;或其他样品。血液样品可以包括,例如,全血、血浆或血清。样品处理装置可通过装置的外壳接收来自受试者的样品。样品采集可发生在样品采集地点或其他地方。可在样品采集地点向装置提供样品。
在一些实施方式中,样品处理装置可配置为接收或容纳筒匣。在一些实施方式中,样品处理装置可包含筒匣。该筒匣可从样品处理装置中移除。在一些实施方式中,可向样品处理装置的筒匣提供样品。或者,可向样品处理装置的另一部分提供样品。筒匣和/或装置可包含可配置为容纳样品的样品采集单元。
筒匣可包含样品,并可包含用于在处理或测试样品中使用的试剂、用于在处理或测试样品中使用的一次性用品或其他材料。筒匣可包含本文公开的用于执行本文公开的方法的试剂。将筒匣放置在样品处理装置上或将筒匣插入样品处理装置之后,筒匣的一个或多个组件可与样品处理装置的其他组件流体连通。例如,如果样品在筒匣收集,则样品可转移至样品处理装置的其他部分。类似地,如果在筒匣上提供了一种或多种试剂,则该试剂可转移至样品处理装置的其他部分,或者样品处理装置的其他组件可得到该试剂。在一些实施方式中,筒匣的试剂或组件可保持在筒匣上。在一些实施方式中,不包含需要装管或需要维护(例如,人工或自动维护)的流体元件。
样品或试剂可转移至装置,诸如样品处理装置。样品或试剂可在装置内转移。样品或试剂的这种转移可在不提供从筒匣到装置的连续流体途径的情况下完成。样品或试剂的这种转移可在不提供装置内的连续流体途径的情况下完成。在实施方式中,样品或试剂的这种转移可以通过样品处理系统(例如移液管)来完成;例如,样品、试剂或其等分试样可被吸入顶端开放的转移组件,诸如移液管尖端,该转移组件可以可操作地连接到样品处理系统,该样品处理系统将该尖端以及包含在该尖端内的样品、试剂或其等分试样一起转移至样品处理装置之上或之内的位置。样品、试剂或其等分试样可放置在样品处理装置之上或之内的位置。样品和试剂或多种试剂可使用样品处理系统以相似的方式进行混合。筒匣的一个或多个组件可以以自动化方式转移至样品处理装置的其他部分,反之亦然。
装置,诸如样品处理装置,可具有流体处理系统。流体处理系统可进行或可帮助进行运输、稀释、提取、等分、混合以及对于流体如样品的其他操作。在一些实施方式中,流体处理系统可包含在装置外壳内。流体处理系统可允许流体的采集、递送、处理和/或运输,干燥试剂的溶解,液体和/或干燥试剂与液体的混合,以及非流体组分、样品或材料的采集、递送、处理和/或运输。该流体可以是样品、试剂、稀释液、洗液、染料或可被装置使用的任何其他流体,并且可以包括但不限于均匀流体、不同的液体、乳液、悬浮液和其他流体。流体处理系统(包括但不限于移液管)还可用于在装置周围运输容器(其中含有或不含有流体)。流体处理系统可分配或抽吸流体。样品可包含漂浮在流体内的一个或多个微粒或固体物质。
在实施方式中,流体处理系统可包含移液管、移液管尖端、注射器、毛细管或其他组件。流体处理系统可具有含内表面和外表面以及开放端的部分。流体处理系统可包括移液管(其可包含移液管主体和移液管的管嘴)并且可包括移液管尖端。移液管尖端可以从或不可以从移液管管嘴上拆除。在实施方式中,流体处理系统可使用与移液管尖端配对的移液管;移液管尖端可以是一次性的。尖端在与移液管配对时,可形成流体密封。移液管尖端可使用一次、两次或更多次。在实施方式中,流体处理系统可使用具有或不具有移液管尖端的移液管或相似装置来抽吸、分配、混合、运输或以其他方式处理流体。需要时,可从流体处理系统分配流体。在从例如移液管尖端的孔口中分配之前流体可包含在移液管尖端内。在实施方式或情况中,在使用期间,可分配全部流体;在其他实施方式或情况中,在使用期间,可分配尖端内流体的一部分。移液管可选择性地抽吸流体。移液管可抽吸所选量的流体。移液管可以能够致动搅拌机构以混合尖端或容器内的流体。移液管可合并尖端或容器,从而产生连续的流动回路以用于包括非液体形式的材料或试剂的混合。移液管尖端还可通过多个流体的同时或顺序计量递送来促进混合,诸如在两段式底物反应中。
流体处理系统可包括一个或多个流体隔离的或液压独立的单元。例如,流体处理系统可包含一个、两个或更多个移液管尖端。移液管尖端可被配置为接纳并限制流体。尖端可以是彼此流体隔离或彼此液压独立的。包含在每个尖端内的流体可以与其他尖端内的流体以及与装置内的其他流体为流体隔离或液压独立的。流体隔离或液压独立的单元可以是相对于装置的其他部分和/或彼此可移动的。流体隔离或液压独立的单元可以是单独可移动的。流体处理系统可以包含一个或多个基部或支持体。基部或支持体可支持一个或多个移液管或移液管单元。基部或支持体可将流体处理系统的一个或多个移液管彼此连接。
样品处理装置可配置为对从受试者获得的样品执行处理步骤或操作。样品处理可包括样品制备,包括,例如,样品稀释、将样品分为等分试样、提取、与试剂接触、过滤、分离、离心或其他的预备或处理操作或步骤。样品处理装置可配置为对样品执行一个或多个样品制备操作或步骤。任选地,样品可制备用于化学反应和/或物理处理步骤。样品制备操作或步骤可包括以下的一个或多个:离心、分离、过滤、稀释、富集、纯化、沉淀、温育、移液、运输、色谱分析、细胞裂解、细胞计数、粉碎、研磨、活化、超声处理、微柱处理、用磁珠处理、用纳米颗粒处理或其他样品制备操作或步骤。例如,样品制备可包括将血液分离为血清和/或微粒部分或者将任何其他样品分离为各个组分的一个或多个步骤。样品制备可包括稀释和/或浓缩样品如血液样品或其他生物样品的一个或多个步骤。样品制备可包括向样品中加入抗凝剂或其他成分。样品制备还可包括样品的纯化。在实施方式中,所有的样品处理、制备或测定操作或步骤均由单一装置执行。在实施方式中,所有的样品处理、制备或测定操作或步骤均在单一装置的外壳内执行。在实施方式中,大多数的样品处理、制备或测定操作或步骤由单一装置执行,并且可在单一装置的外壳内执行。在实施方式中,许多的样品处理、制备或测定操作或步骤由单一装置执行,并且可在单一装置的外壳内执行。在实施方式中,样品处理、制备或测定操作或步骤可由多于一个装置执行。
样品处理装置可配置为对样品运行一个或多个测定,并从该样品获得数据。样品处理装置可执行本文提供的方法以及附加的测定。测定可包括一种或多种物理或化学处理,并可包括运行一个或多个化学或物理反应。样品处理装置可配置为对体液的小样品执行一个、两个或更多个测定。可在具有一定体积的样品上进行一个或多个化学反应,如本文其他地方所述。例如,可在具有小于飞升(femtoliter)体积的丸剂中进行一个或多个化学反应。在实例中,样品采集单元被配置为接收相当于单滴或更少的血液或间质液体积的体液样品。在实施方式中,样品的体积可以是小体积,其中小体积可以是小于约1000μL、或小于约500μL、或小于约250μL、或小于约150μL、或小于约100μL、或小于约75μL、或小于约50μL、或小于约40μL、或小于约20μL、或小于约10μL、小于约5μL、小于约1μL、小于约0.5μL、小于约0.1μL的体积或其他的小体积。在实施方式中,对单一样品执行全部的样品测定操作或步骤。在实施方式中,所有的样品测定操作或步骤均由单一装置执行。在实施方式中,所有的样品测定操作或步骤均在单一装置的外壳内执行。在实施方式中,大多数的样品测定操作或步骤由单一装置执行,并且可在单一装置的外壳内执行。在实施方式中,许多的样品测定操作或步骤由单一装置执行,并且可在单一装置的外壳内执行。在实施方式中,样品处理、制备或测定操作或步骤可由多于一个装置执行。
样品处理装置可配置为对样品进行多个测定。在一些实施方式中,样品处理装置可以配置为执行本文提供的方法以及一个、两个或更多个附加测定。在实施方式中,样品处理装置可配置为对单一样品进行多个测定。在实施方式中,样品处理装置可配置为对单一样品进行多个测定,其中该样品是小样品。例如,小样品可以具有为小于约1000μL、或小于约500μL、或小于约250μL、或小于约150μL、或小于约100μL、或小于约75μL、或小于约50μL、或小于约40μL、或小于约20μL、或小于约10μL、小于约5μL、小于约1μL、小于约0.5μL、小于约0.1μL的小体积或其他小体积的样品体积。样品处理装置可以能够对单一样品进行多重测定。多个测定可同时运行;可按顺序运行;或者一些测定可同时运行而其他测定按顺序运行。一个或多个对照测定和/或校准物(例如,包括具有用于测定/测试的校准物的对照的配置)也可并入装置中;对照测定和对校准物的测定可与对样品进行的测定同时进行,或可在对样品进行的测定之前或之后进行,或以其任何组合方式进行。在实施方式中,所有的样品测定操作或步骤均由单一装置执行。在实施方式中,全部多个样品测定操作或步骤均在单一装置的外壳内执行。在实施方式中,多个测定中的大多数的样品测定操作或步骤由单一装置执行,并且可在单一装置的外壳内执行。在实施方式中,多个测定中的许多的样品测定操作或步骤由单一装置执行,并且可在单一装置的外壳内执行。在实施方式中,样品处理、制备或测定操作或步骤可由多于一个装置执行。
在实施方式中,全部多个测定可在短的时间段内进行。在实施方式中,这样的短的时间段包括少于约三小时、或少于约两小时、或少于约一小时、或少于约40分钟、或少于约30分钟、或少于约25分钟、或少于约20分钟、或少于约15分钟、或少于约10分钟、或少于约5分钟、或少于约4分钟、或少于约3分钟、或少于约2分钟、或少于约1分钟或其他短的时间段。
样品处理装置可配置为检测与样品相关的一种或多种信号。样品处理装置可配置为鉴定样品的一个或多个特性。例如,样品处理装置可配置为检测样品中一种分析物(例如靶核酸)或多种分析物或疾病状况的存在或浓度(例如,在体液、分泌物、组织或其他样品中或通过体液、分泌物、组织或其他样品)。或者,样品处理装置可配置为检测一种或多种可被分析以检测样品中一种或多种分析物(其可以指示疾病状况)或疾病状况的存在或浓度的信号。信号可在装置上或另一位置进行分析。运行临床检验可以包括或可以不包括对收集的数据的任何分析或比较。
可在有或没有样品的情况下进行化学反应或其他处理步骤。可由装置制备或运行的步骤、测试或测定的实例可包括但不限于,免疫测定、核酸测定(例如本文所提供的方法)、基于受体的测定、细胞计数测定、比色测定、酶测定、电泳测定、电化学测定、光谱测定、色谱测定、显微测定、地形测定(topographic assay)、量热测定、浊度测定、凝集测定、放射性同位素测定、粘度测定、凝聚测定、凝固时间测定、蛋白质合成测定、组织学测定、培养测定、摩尔渗透压浓度测定和/或其他类型的测定,离心、分离、过滤、稀释、富集、纯化、沉淀、粉碎、温育、移液、运输、细胞裂解或其他样品制备操作或步骤或其组合。可由装置制备或运行的步骤、测试或测定可包括成像,包括显微镜检查、细胞计数以及制备或使用图像的其他技术。可由装置制备或运行的步骤、测试或测定可进一步包括对样品的组织学、形态学、运动学、动力学和/或状态的评估,该评估可包括对细胞的这种评估。
装置可以能够在短的时间量内进行所有的机载步骤(例如,由单一装置执行的步骤或操作)。装置可以能够在短的时间量内对单一样品进行所有的机载步骤。例如,从受试者样品采集到传输数据和/或分析可能花费约3小时或更少、2小时或更少、1小时或更少、50分钟或更少、45分钟或更少、40分钟或更少、30分钟或更少、20分钟或更少、15分钟或更少、10分钟或更少、5分钟或更少、4分钟或更少、3分钟或更少、2分钟或更少、或1分钟或更少的时间。从将样品接纳在装置内到传输数据和/或关于这样的样品的装置分析的时间量可能依赖于对样品执行的步骤、测试或测定的类型或数目。从将样品接纳在装置内到传输数据和/或关于这样的样品的装置分析的时间量可能花费约3小时或更少、2小时或更少、1小时或更少、50分钟或更少、45分钟或更少、40分钟或更少、30分钟或更少、20分钟或更少、15分钟或更少、10分钟或更少、5分钟或更少、4分钟或更少、3分钟或更少、2分钟或更少或1分钟或更少的时间。
装置可配置为准备样品以供处置或配置为在样品的处理或测定后处置样品,诸如生物样品。
在实施方式中,样品处理装置可配置为传送从样品获得的数据。在实施方式中,样品处理装置可配置为通过网络进行通信。样品处理装置可包括可与网络接合的通信模块。样品处理装置可经由有线连接或无线地连接至网络。该网络可以是局域网(LAN)或广域网(WAN)诸如因特网。在一些实施方式中,该网络可以是个人局域网。该网络可包括云。样品处理装置可连接至网络而无需中间装置,或者可能需要中间装置将样品处理装置连接至网络。样品处理装置可以通过网络与另一装置通信,该另一装置可以是任何类型的联网装置,包括但不限于个人计算机、服务器计算机或膝上型计算机;个人数字助理(PDA),诸如Windows CE装置;电话,诸如蜂窝电话、智能电话(例如,iPhone、Android、Blackberry等)或位置感知的便携式电话(例如GPS);漫游装置,诸如联网的漫游装置;无线装置,诸如无线电子邮件装置或能够与计算机网络无线通信的其他装置;或可以通过网络而可能通信并处理电子交易的任何其他类型的网络装置。这样的通信可包括向云计算基础设施或可被其他装置访问的任何其他类型的数据存储基础设施提供数据。
样品处理装置可以向例如卫生保健专业人员、健康护理专业场所诸如实验室或其附属机构提供关于样品的数据。实验室、卫生保健专业人员或受试者中的一个或多个可具有能够接收或访问由样品处理装置提供的数据的网络装置。样品处理装置可配置为向数据库提供关于样品的数据。样品处理装置可配置为向电子病历系统、向实验室信息系统、向实验室自动化系统或其他系统或软件提供关于样品的数据。样品处理装置可以以报告的形式提供数据。
实验室、装置或其他实体或软件可对关于样品的数据进行实时分析。软件系统可进行化学分析和/或病理分析,或者这些可分布在实验室、临床以及专业或专家人员的组合中。分析可包括样品的定性和/或定量评估。数据分析可包括随后的样品的定性和/或定量评估。任选地,报告可基于原始数据、预处理的数据或分析的数据生成。可制作这样的报告以便维持从样品获得的数据的机密性、关于从中获得样品的受试者的身份和其他信息、数据的分析以及其他机密信息。报告和/或数据可传输至卫生保健专业人员。可向数据库、电子病历系统、向实验室信息系统、向实验室自动化系统或其他系统或软件提供由样品处理装置获得的数据或对这样的数据的分析或报告。
可使用或可与本文公开的方法、组合物或其他试剂一起使用的试剂、测定、方法、试剂盒、装置和系统的实例的描述和公开内容可发现于,例如,美国专利8,088,593;美国专利8,380,541;2013年2月18日提交的美国专利申请序列号13/769,798;2013年2月18日提交的美国专利申请序列号13/769,779;2011年9月26日提交的美国专利申请序列号13/244,947;2012年9月25日提交的国际申请号PCT/US2012/57155;2011年9月26日提交的美国申请序列号13/244,946;2011年9月26日提交的美国专利申请13/244,949;以及2011年9月26日提交的美国申请序列号61/673,245;2014年3月15日提交的国际申请号PCT/US14/30034;和2014年3月15日提交的美国专利申请号14/214,850,这些专利和专利申请的公开内容均通过引用全文并入于此。
本申请要求2013年11月22日提交的美国临时专利申请号61/908,027;2014年5月20日提交的美国临时专利申请号62/001,050;2014年3月15日提交的美国非临时专利申请号14/214,850;以及2014年3月15日提交的国际专利申请号PCT/US14/30034的权益和优先权,其中每一个专利申请的公开内容通过引用全文并入于此用于所有目的。2013年3月15日提交的美国临时专利申请号61/800,606的公开内容也通过引用全文并入于此用于所有目的。
实施例
提供以下实施例仅仅是为了说明性目的,并非旨在以任何方式限制本发明。
实施例1-用可变尾区长度的引物扩增模板核酸
使用如本文提供的方法扩增靶核酸。准备反应以测定靶核酸T124A1的102核苷酸部分,其是A型流感病毒血凝素(HA3)基因(RNA分子)的464核苷酸部分。在SEQ ID NO:89中提供了T124A1的核苷酸序列。制备第一引物(“P1”)的12个变体和第二引物(“P2”)的12个变体。图2A中提供了全部引物变体的序列。所有的引物均含有15个核苷酸长度的模板结合区。第一引物的所有变体的模板结合区的序列为:CAAACCGTACCAACC(SEQ ID NO:80)(在5’-3’方向)。第二引物的所有变体的模板结合区的序列为:ATGCGGAATGTACC(SEQ ID NO:81)(在5’-3’方向)。不同的引物变体含有范围为8至22个核苷酸长度特别是8、9、10、11、12、13、14、15、16、18、20或22个核苷酸长度的尾区。第一引物的尾区具有碱基序列:CGCCGGATGGCTCTTGGGAAAC(SEQ ID NO:82)(在5’-3’方向)。碱基序列为22个核苷酸的长度;第一引物的较短尾区具有相同的序列,从尾区的5’端减去适当数目的核苷酸(例如具有18个核苷酸长度的尾区的引物具有含有与碱基序列减去碱基序列的前4个核苷酸(CGCC)相同的序列的尾区)。第二引物的尾区具有碱基序列:GTTTCCCAAGAGCCATCCGGCG(SEQ ID NO:83)(在5’-3’方向)。碱基序列为22个核苷酸的长度;第一引物的较短尾区具有相同的序列,从尾区的3’端减去适当数目的核苷酸(例如具有18个核苷酸长度的尾区的引物具有含有与碱基序列减去碱基序列的最后4个核苷酸(GGCG)相同的序列的尾区)。
制备150微升的反应混合物,每一个含有:50mM乙酸钾,20mM Tris-乙酸盐(pH 7.9),10mM乙酸镁,1mM DTT,30μg牛血清白蛋白(BSA),0.8M甜菜碱,各为1.4mM的dATP、dTTP、dGTP和dCTP,2uM59(Life Technologies),0.8单位/μl Bst DNA聚合酶(New England BioLabs),0.016单位/μl AMV逆转录酶(New England Biolabs),1单位/μl鼠核糖核酸酶抑制剂(New England Biolabs),0.8μM的第一引物变体,0.8μM的第二引物变体以及每微升100,000个拷贝T124A1模板,并在59℃下在CFX 96Touch仪器(Bio-Rad)中温育100分钟。测定的转变点使用采用CFX Manager软件(Bio-Rad)的单一阈值方法来确定并示于图2B中。X轴提供了反应中使用的第一和第二引物的尾区的核苷酸长度,而Y轴提供了测定的转变时间(以分钟计)。对于每一个尾区核苷酸长度,示出了两个相邻的条:左边的条是含有模板的反应的转变时间,而右边的条是没有模板的反应[“无模板对照”(“NTC”)]的转变时间。对于超过90分钟的转变时间,不显示条。如图2B所示,在这些反应条件下,具有8-15个核苷酸并且尤其是8-11个核苷酸的尾区的引物支持最快的转变时间。无模板对照反应最后显示转变时间;这是由于随着时间的推移形成了背景非特异性产物。
实施例2-用可变尾区长度和可变模板结合区长度的引物扩增模板核酸
使用如本文提供的方法扩增靶核酸。准备反应以测定靶核酸T124A1,该靶核酸T124A1在上文实施例1中进行了描述。制备两个不同组的第一引物和第二引物对组。在第一组的引物对中,每一个引物均具有20个核苷酸长度的模板结合区(“20核苷酸模板结合区”组)。在第二组的引物对中,每一个引物均具有16个核苷酸长度的模板结合区(“16核苷酸模板结合区”组)。在各组中,制备具有8个不同尾区长度的第一和第二引物对组:7、8、9、10、11、12、14和16个核苷酸。图3提供了针对16核苷酸模板结合区组(图3A)和20核苷酸模板结合区组(图3B)的不同的引物对组的核苷酸序列。在图3A和3B中,“尾”序列指尾区,而“引物”区指引物的模板结合区。引物的序列以5’-3’方向显示。
制备110微升的反应混合物,每一个含有:50mM乙酸钾,20mM Tris-乙酸盐(pH 7.9),10mM乙酸镁,1mM DTT,30μg牛血清白蛋白(BSA),0.8M甜菜碱,各为1.4mM的dATP、dTTP、dGTP和dCTP,2uM59(Life Technologies),0.8单位/μl Bst DNA聚合酶(New England BioLabs),0.016单位/μl AMV逆转录酶(New England Biolabs),1单位/μl鼠核糖核酸酶抑制剂(New England Biolabs),0.8μM的第一引物变体,0.8μM的第二引物变体以及每微升100,000个拷贝T124A1模板,并在56℃下在CFX 96Touch仪器(Bio-Rad)中温育100分钟。测定的转变点示于图3C(20核苷酸模板结合区组)和3D(16核苷酸模板结合区组)中。在图3C和3D中,X轴提供了反应中使用的第一和第二引物的尾区的核苷酸长度,而Y轴提供了测定的转变时间(以分钟计)。对于每一个尾区核苷酸长度,示出了两个相邻的条:左边的条是含有模板的反应的转变时间,而右边的条是没有模板的反应的转变时间。如图3所示,在这些反应条件下,含有具有相对较短尾区的引物的反应显示了更快的转变时间以及含模板的反应与没有模板的反应的转变时间之间的更大的分离。例如,对于16bp和20bp引物,含有具有7、8或9个核苷酸的尾区长度的引物的反应显示了比含有具有12、14或16个核苷酸的尾区长度的引物的反应更快的转变时间。
实施例3-在可变的温度下扩增模板核酸
使用如本文提供的方法扩增靶核酸。准备反应以测定在上文实施例1中描述的靶核酸T124A1。第一引物“RLX0892”(序列:5’TTGGGAAACCAAACCGTACCAACC 3’)(SEQ ID NO:20)和第二引物“RLX0893”(序列:5’GTTTCCCAAATGCGGAATGTACC 3’)(SEQ ID NO:32)用于扩增T124A1。这两种引物均具有9核苷酸尾区,RLX0892具有15核苷酸模板结合区而RLX0893具有14核苷酸模板结合区。RLX0892的尾区为:5’TTGGGAAAC 3’(SEQ ID NO:84)而RLX0893的尾区为:5’GTTTCCCAA 3’(SEQ ID NO:85)。
制备80微升的反应混合物,每一个含有:50mM乙酸钾,20mM Tris-乙酸盐(pH 7.9),10mM乙酸镁,1mM DTT,20μg牛血清白蛋白(BSA),0.8M甜菜碱,各为1.4mM的dATP、dTTP、dGTP和dCTP,2uM59(Life Technologies),0.8单位/μl Bst DNA聚合酶(New England BioLabs),0.016单位/μl AMV逆转录酶(New England Biolabs),1单位/μl鼠核糖核酸酶抑制剂(New England Biolabs),0.8μM的第一引物RLX0892,0.8μM的第二引物RLX0893以及每微升10,000、1,000、100或0个拷贝T124A1模板,并一式三份在52、52.7、54、55.9、58.4、60.3、61.4或62℃下在CFX 96Touch仪器(Bio-Rad)中温育100分钟。测定的转变点示于图4中。X轴提供了反应的温育温度,而Y轴提供了测定的转变时间(以分钟计)。对于各个温度,示出了4个相邻的条,从左至右为:10,000个拷贝模板/微升、1000个拷贝模板/微升、100个拷贝模板/微升或无模板对照。如图4所示,在这些反应条件下,该试验在52-62℃的整个温度范围内在1000个拷贝模板/微升下,并且在一些温度下在至少低至100个拷贝模板/微升的模板浓度下有效地扩增了模板。
实施例4-在人基因组DNA的存在下扩增模板核酸
使用如本文提供的方法扩增靶核酸。在人DNA的存在下准备反应以测定靶核酸T124A1(上文所述的)。使用第一引物“RLX0892”(上文所述的)和第二引物“RLX0893”(上文所述的)来扩增T124A1。
制备160微升的反应混合物,每一个含有:50mM乙酸钾,20mM Tris-乙酸盐(pH 7.9),10mM乙酸镁,1mM DTT,20μg牛血清白蛋白(BSA),0.8M甜菜碱,各为1.4mM的dATP、dTTP、dGTP和dCTP,0.4x59(Life Technologies),0.8单位/μl Bst DNA聚合酶(New England BioLabs),0.016单位/μl AMV逆转录酶(New England Biolabs),1单位/μl鼠核糖核酸酶抑制剂(New England Biolabs),0.8μM的第一引物RLX0892,0.8μM的第二引物RLX0893,和每微升1,000、100或0个拷贝T124A1模板,以及0、1、2.5、5或10纳克的人基因组DNA,并在56℃下在CFX 96Touch仪器(Bio-Rad)中温育100分钟。测定的转变点示于图5中。X轴提供了反应中人基因组DNA(“hDNA”)的量,而Y轴提供了测定的转变时间(以分钟计)。对于hDNA的每个量,示出了4个相邻的条,从左至右为:1000个拷贝模板/微升、100个拷贝模板/微升或无模板。如图5所示,在这些反应条件下,该试验在至少10ng hDNA的存在下在1000个拷贝模板/微升下有效地扩增了模板。而且,反应中加入hDNA仅引起了NTC转变时间相对较小的降低,即使在5或10ng hDNA的浓度下。
实施例5-从病毒裂解物洗脱液扩增模板核酸
使用如本文提供的方法从含有靶标的两个不同样品中扩增靶核酸。在以下两个样品中制备靶核酸T124A1:1)含有分离的T124A1RNA分子(如在实施例1中的)的样品,以及2)含有从甲型流感H3N2病毒样品中分离的核酸的样品。T124A1是HA3基因的一部分,并因此被预期存在于从甲型流感H3N2病毒中分离的核酸的样品中。根据制造商的说明用Chemagic病毒DNA/RNA试剂盒(PerkinElmer)制备甲型流感病毒裂解物。通过qPCR定量两个不同样品中的T124A1的浓度,并且稀释样品以将样品中T124A1的浓度归一化。使用第一引物“RLX0892”和第二引物“RLX0893”扩增T124A1。
制备25微升的反应混合物,每一个含有:50mM乙酸钾,20mM Tris-乙酸盐(pH 7.9),10mM乙酸镁,1mM DTT,20μg牛血清白蛋白(BSA),0.8M甜菜碱,各为1.4mM的dATP、dTTP、dGTP和dCTP,2uM59(Life Technologies),0.8单位/μl Bst DNA聚合酶(New England BioLabs),0.016单位/μl AMV逆转录酶(New England Biolabs),1单位/μl鼠核糖核酸酶抑制剂(New England Biolabs),0.8μM的第一引物RLX0892,0.8μM的第二引物RLX0893以及每微升10,000、1000或0个拷贝T124A1模板,并在56℃下在CFX 96Touch仪器(Bio-Rad)中温育100分钟。测定的转变点示于图6中。X轴提供了反应中的模板拷贝数/微升,而Y轴提供了测点的转变点(以分钟计)。对于模板拷贝数/微升的各个量,示出了2个相邻的条,从左至右为:分离的T124A1和甲型流感病毒裂解物。还示出了NTC的转变点。如图6中所示,在这些反应条件下,该试验有效地扩增了分离的T124A1模板以及甲型流感病毒裂解物中的T124A1模板。
实施例6-模板核酸的扩增
使用如本文提供的方法扩增靶核酸。准备反应以测定T129D1的54核苷酸部分,其为乙型流感病毒血凝素(HA)基因(RNA分子)的298核苷酸部分。在SEQ ID NO:90中提供了T129D1的核苷酸序列。第一引物“A8”(核苷酸序列:5’TCTTGAGAGAACCCACTAAC 3’)(SEQ ID NO:86)和第二引物“B8”(核苷酸序列:5’TCTCAAGAATTTGGTCTTCC 3’)(SEQ ID NO:87)用于扩增T129D1。在这两种引物中,前8个核苷酸(从5’末端)是尾区,而最后的12个核苷酸是模板结合区。这些引物一起靶向T129D1的54核苷酸部分。
制备100微升的反应混合物,其含有:50mM乙酸钾,20mM Tris-乙酸盐(pH 7.9),10mM乙酸镁,1mM DTT,20μg牛血清白蛋白(BSA),0.8M甜菜碱,各为1.4mM的dATP、dTTP、dGTP和dCTP,0.4x59(Life Technologies),0.8单位/μl Bst DNA聚合酶(New England BioLabs),0.016单位/μl AMV逆转录酶(New England Biolabs),1单位/μl鼠核糖核酸酶抑制剂(New England Biolabs),0.8μM的第一引物A8,0.8μM的第二引物B8以及每微升100,000T129D1模板,并在58℃下在CFX 96Touch仪器(Bio-Rad)中温育100分钟。100分钟后,从反应中取出样品并将其连接入克隆载体。使用针对于克隆位点的载体特异性引物对含有反应产物的载体进行测序。多个示例性测序反应的结果的一部分示于图7中。测序结果表明形成了具有期望的结构的多联体。特别地,在这些实例中,在反应产物的单一链中,存在来自T129D1基因的靶向的54核苷酸序列的多个拷贝,这些拷贝由A8引物的尾区的序列(5’TCTTGAGA 3’)(SEQ ID NO:88)分隔开。在图7中,仅显示了T129D1的第二次(从左至右)出现的一部分;序列在图中所示的核苷酸之外继续。
实施例7-具有与内部基序互补的尾区的引物
为了进一步描述本文提供的实施方式,其中引物尾区含有与靶核酸内的内部基序互补的序列,现将提供具有示例性核酸序列的实例。可提供54个核苷酸总长度的多核苷酸模板(“实施例7模板”)。实施例7模板对应于图10的元件1000。实施例7模板的序列如下:5’TCGCTTGAACTGAGGACTTAGCGCCTAGAAACTTGGCTCAGGTAACCAACTGGT 3’(SEQ ID NO:92)。以5’至3’方向描述实施例7模板,第一下划线序列是多核苷酸模板的第二部分(例如类似于图10中提供的元件1002),第二下划线序列是内部基序(例如对应于图10中提供的元件1003),第三下划线序列是多核苷酸模板的第一部分(例如对应于图10中提供的元件1001)。实施例7模板和本文提供的其他序列的特定核苷酸可就它们在5’至3’方向读取的各自序列中的位置而被提及。因此,例如,实施例7模板的5’端的“T”在第1位置,与5’端的“T”相邻的“C”在第2位置,以此类推。可提供24个核苷酸总长度的第一引物(“实施例7第一引物”)。实施例7第一引物对应于图10的元件1010。实施例7第一引物的序列如下:5’CTAGAAACACCAGTTGGTTACCTG 3’(SEQ ID NO:93)。下划线序列是实施例7第一引物的第一区域/尾区(对应于图10的元件1011),而非下划线序列是实施例7第一引物的第二区域/模板结合区(对应于图10的元件1012)。还应当注意以下事实,实施例7第一引物的第一区域具有与实施例7模板的内部基序相同的核苷酸序列。实施例7第一引物可如下与实施例7模板退火:当实施例7模板和实施例7第一引物被定向为使得实施例7模板的3’端和实施例7第一引物的5’端面向相同的方向时,实施例7第一引物的非下划线序列(以5’至3’方向读取,如ACCAG…)与实施例7模板的第一部分(以3’至5’方向读取,如TGGTC...)退火。更具体地,在实施例7第一引物的第9位置的“A”与在实施例7模板的第54位置的“T”配对,在实施例7第一引物的第10位置的“C”与在实施例7模板的第53位置的“G”配对,在实施例7第一引物的第11位置的“C”与在实施例7模板的第52位置的“G”配对,等等。当实施例7第一引物与实施例7模板退火时,如本文其他地方所述,具有链置换活性的聚合酶可延伸实施例7第一引物,以生成实施例7第一引物延伸产物。实施例7第一引物延伸产物将具有5’至3’方向的核苷酸序列:5’CTAGAAACACCAGTTGGTTACCTGAGCCAAGTTTCTAGGCGCTAAGTCCTCAGTTCAAGCGA 3’(SEQ ID NO:94)。以5’至3’方向描述实施例7第一引物延伸产物,第一非下划线序列是实施例7第一引物的第一区域的序列,第一下划线序列是与实施例7模板的第一部分互补的序列,第二下划线序列是实施例7第一引物延伸产物的内部基序的序列,第三下划线序列是与实施例7模板的第二部分互补的序列。在实施方式中,当实施例7第一引物延伸产物与实施例7模板退火时,在一些情况下,实施例7第一引物延伸产物的一部分(它是实施例7第一引物的第一区域的序列)可与实施例7第一引物延伸产物的内部基序暂时退火,使得在第1位置的“C”与在实施例7第一引物延伸产物的第38位置的“G”退火,在第2位置的“T”与在第37位置的“A”退火,在第3位置的“A”与在第36位置的“T”退火,以此类推,直到在第8位置的“C”与在第31位置的“G”退火。当实施例7第一引物延伸产物的一部分(它是实施例7第一引物的第一区域的序列)与实施例7第一引物延伸产物的内部基序的一部分暂时退火时,这些部分之间的实施例7第一引物延伸产物的部分(包括,例如,与实施例7模板的第一部分互补的序列)可变为不与实施例7模板退火,从而有助于,例如,实施例7第一引物的另一拷贝与实施例7模板的结合,以及另外的实施例7第一引物延伸产物的后续生成。
还可提供24个核苷酸总长度的第二引物(“实施例7第二引物”)。实施例7第二引物对应于图10的元件1020。实施例7第二引物的序列如下:5’GTTTCTAGTCGCTTGAACTGAGGA 3’(SEQ ID NO:95)。下划线序列是实施例7第二引物的第一区域(对应于图10的元件1021),而非下划线序列是实施例7第二引物的第二区域(对应于图10的元件1022)。实施例7第二引物可如下与实施例7第一引物延伸产物退火:在实施例7第二引物的第9位置的“T”与在实施例7第一引物延伸产物的第62位置的“A”配对,在实施例7第二引物的第10位置的“C”与在实施例7第一引物延伸产物的第61位置的“G”配对,在实施例7第二引物的第11位置的“G”与在实施例7第一引物延伸产物的第60位置的“C”配对,以此类推。实施例7第二引物可由如本文其他地方所述具有链置换活性的聚合酶进行延伸,以产生实施例7第二引物延伸产物。实施例7第二引物延伸产物将具有5’至3’方向的核苷酸序列:5’GTTTCTAGTCGCTTGAACTGAGGACTTAGCGCCTAGAAACTTGGCTCAGGTAACCAACTGGTGTTTCTAG 3’(SEQ ID NO:96)。以5’至3’方向描述实施例7第二引物延伸产物,第一非下划线序列是实施例7第二引物的第一区域的序列,第一下划线序列是实施例7模板的第二部分的序列,第二下划线序列是实施例7第二引物延伸产物的内部基序的序列,第三下划线序列是实施例7模板的第一部分的序列,第四非下划线序列是实施例7第二引物的第一区域的序列和与实施例7第一引物的第一区域互补的序列的序列。在实施方式中,当实施例7第二引物延伸产物与实施例7第一引物延伸产物退火时,在一些情况下,实施例7第二引物延伸产物的一部分(它是实施例7第二引物的第一区域的序列)可与实施例7第二引物延伸产物的内部基序暂时退火,使得在第1位置的“G”与在实施例7第二引物延伸产物的第40位置的“C”退火,在第2位置的“T”与在第39位置的“A”退火,在第3位置的“T”与在第38位置的“A”退火,以此类推,直到在第8位置的“G”与在第33位置的“C”退火。当实施例7第二引物延伸产物的一部分(它是实施例7第二引物的第一区域的序列)与实施例7第二引物延伸产物的内部基序暂时退火时,这些部分之间的实施例7第二引物延伸产物的部分(包括,例如,实施例7模板的第二部分的序列)可变为不与实施例7第一引物延伸产物退火,从而有助于,例如,实施例7第二引物的另一拷贝与实施例7第一引物延伸的结合,以及另外的实施例7第二引物延伸产物的后续生成。
在实施方式中,本文其他地方提供的方法可根据以上概述的一般机理进行。本文其他地方提供的关于引物、靶核酸、反应条件、反应产物等的任何描述和细节可应用于涉及以上在实施例7中描述的一般机理的反应。
实施例8-SNP检测
本文提供的方法用于鉴定在靶核酸中的SNP/突变。提供了靶核酸的两种版本,它们相差一个核苷酸。该核酸模板的版本1(“版本1模板”;还被称为“野生型”序列)的第一链具有5’至3’方向的序列:GCATTCATCACGTTTTTGCGAGTCCTTTCCTCCCACCAACAGCAGGGATTCTGAAGAGATGGGGACAGTT(SEQ ID NO:97)。以5’至3’方向描述版本1模板,第一下划线序列是版本1模板的第二部分,第二下划线序列是版本1模板的内部基序,第三下划线序列是版本1模板的第一部分。该核酸模板的版本2(“版本2模板”;还被称为“SNP”序列)的第一链具有5’至3’方向的序列:GCATTCATCACGTTTTTGCGAGTCCTTTCCTCCCACCAACAGCAGGGATTCTGAAGAGATGGGGACAGTT(SEQ ID NO:98)。以5’至3’方向描述版本2模板,第一下划线序列是版本2模板的第二部分,第二下划线序列是版本2模板的内部基序,第三下划线序列是版本2模板的第一部分。版本1模板和版本2模板序列仅在各自模板的内部基序序列中相差一个核苷酸。具体地,版本1模板在序列的第31位置具有“A”(用粗体和斜体字体强调),而版本2模板在序列的第31位置具有“T”(用粗体和斜体字体强调)。还提供了第一引物和第二引物以扩增模板序列。第一引物(“实施例8引物1”)具有序列:5’TCCATCCCAACTGTCCCCATCT3’(SEQ ID NO:99)。下划线序列是实施例8引物1的第一区域/尾区,而非下划线序列是实施例8引物1的第二区域/模板结合区。第二引物(“实施例8引物2”)具有序列:5’GGGATGGAGCATTCATCACGTTT 3’(SEQ ID NO:100)。下划线序列是实施例8引物2的第一区域/尾区,而非下划线序列是实施例8引物2的第二区域/模板结合区。
对于版本1模板或版本2模板进行如本文其他地方所述的单独的扩增反应,版本1模板和版本2模板的反应都使用实施例8引物1和实施例8引物2作为引物。对于每个模板进行相同的条件下的多个反应。
在版本1模板反应中,当实施例8引物1与版本1模板退火且通过聚合酶生成实施例8引物1的延伸产物(“版本1模板引物1延伸产物”)时,版本1模板引物1延伸产物将具有如下序列:5’TCCATCCCAACTGTCCCCATCTCTTCAGAATCCCTGCTGTTGGTGGGAGGAAAGGACTCGCAAAAACGTGATGAATGC(SEQ ID NO:101)。以5’至3’方向描述版本1模板引物1延伸产物,第一非下划线序列是实施例8引物1的第一区域/尾区的序列,第一下划线序列是与版本1模板的第一部分互补的序列,第二下划线序列是版本1模板引物1延伸产物的内部基序的序列(其中黑体、斜体“T”是感兴趣的核苷酸),第三下划线序列是与版本1模板的第二部分互补的序列。根据本文所述的方法,在实施方式中,对应于实施例8引物1序列的第一区域/尾区的序列的版本1模板引物1延伸产物的部分可与版本1模板引物1延伸产物的内部基序暂时退火,使得在第1位置的“T”与在第52位置的“A”退火,在第2位置的“C”与在第51位置的“G”退火,在第3位置的“C”与在第50位置的“G”退火,以此类推,直到在第8位置的“C”与在第45位置的“G”退火。值得注意的是,对应于实施例8引物1序列的第一区域/尾区的序列的版本1模板引物1延伸产物的部分与版本1模板引物1延伸产物的内部基序序列完全互补(即在8组配对的核苷酸中的任一组之间没有错配)。
在版本2模板反应中,当实施例8引物1与版本2模板退火且通过聚合酶生成实施例8引物1的延伸产物(“版本2模板引物1延伸产物”)时,版本2模板引物1延伸产物将具有如下序列:5’TCCATCCCAACTGTCCCCATCTCTTCAGAATCCCTGCTGTTGGTGGGAGGAAAGGACTCGCAAAAACGTGATGAATGC(SEQ ID NO:102)。以5’至3’方向描述版本2模板延伸产物,第一非下划线序列是实施例8引物1的第一区域/尾区的序列,第一下划线序列是与版本2模板的第一部分互补的序列,第二下划线序列是版本2模板引物1延伸产物的内部基序的序列(其中黑体、斜体“A”是感兴趣的核苷酸),第三下划线序列是与版本2模板的第二部分互补的序列。根据本文所述的方法,在实施方式中,对应于实施例8引物1序列的第一区域/尾区的序列的版本2模板引物1延伸产物的部分可与版本2模板引物1延伸产物的内部基序暂时退火,使得在第1位置的“T”与在第52位置的“A”退火,在第2位置的“C”与在第51位置的“G”退火,在第3位置的“C”与在第50位置的“G”退火,以此类推,直到在第8位置的“C”与在第45位置的“G”退火。值得注意的是,对应于实施例8引物1序列的第一区域/尾区的序列的版本2模板引物1延伸产物的部分与版本2模板引物1延伸产物的内部基序序列不完全互补,因为在第4位置的“A”与在第49位置的“A”之间存在错配。因此,通过比较版本1模板引物1延伸产物与版本2模板引物1延伸产物,与版本2模板引物1延伸产物中的内部基序相比,对应于实施例8引物1的第一区域/尾区的各自延伸产物的部分将与版本1模板引物1延伸产物中的内部基序更大互补并且将更稳定地退火。具体地,版本1模板引物1延伸产物中的序列“TCCATCCC”与版本1模板引物1延伸产物中的内部基序完全互补(8个核苷酸中的8个可正确配对),而版本2模板引物1延伸产物中的序列“TCCATCCC”与版本2模板引物1延伸产物中的内部基序不完全互补(8个核苷酸中仅有7个可正确配对)。通常,对应于引物尾区的延伸产物的部分与该延伸产物中的内部基序之间更大的互补性导致这两个部分之间更稳定的退火。当延伸产物被配置为使得这两个部分退火时,这可加快本文提供的反应的速率,例如,通过根据本文提供的方法,允许新的引物与经由延伸产物的区域的内部退火或经由提高的多联体形成速率而暴露的互补链中未退火的核苷酸的结合。
对于版本1模板和版本2模板引物2延伸产物还存在如上所述的类似机理,其中延伸产物的尾区的部分对于版本1模板引物2延伸产物而言完全互补,但对于版本2模板引物2延伸产物而言不完全互补。
图11显示采用这些模板和引物的扩增反应的结果,其中X轴表示时间,Y轴表示相对荧光单位(RFU)(指示扩增的DNA)。如图11所示,采用版本1模板(“野生型”序列)的扩增反应比采用版本2模板(“SNP”序列)的反应更快发生。因此,这些结果表明,本文提供的方法可用于例如区别具有单核苷酸变异的序列。
实施例9-SNP检测
本文提供的方法用于鉴定在人类靶核酸中的SNP/突变。BRCA1蛋白质的Q356R变异可能与增加的癌症风险有关。例如,当在野生型BRCA1蛋白质的356氨基酸位置处编码谷氨酰胺的密码子(核苷酸序列CAG)具有核苷酸序列CGG,使得该密码子编码精氨酸而非谷氨酰胺时,可发生Q356R变异。
获得了BRCA1基因组序列的一部分的四种不同版本,该基因组序列的部分除了其他核苷酸之外还含有356氨基酸位置的以下密码子。第一版本(“野生型靶标”)在356氨基酸位置处含有编码谷氨酰胺的野生型密码子(序列CAG),并且具有5’至3’方向的核苷酸序列:AAGATGTTCCTTGGATAACACTAAATAGCAGCATTCGAAAGTTAATGAGTGGTTTTCCAGA(SEQ ID NO:103)。第二版本(“Q356R靶标”)在356氨基酸位置处含有编码精氨酸的密码子(序列CGG),并且具有5’至3’方向的核苷酸序列:AAGATGTTCCTTGGATAACACTAAATAGCAGCATTCGAAAGTTAATGAGTGGTTTTCCAGA(SEQ ID NO:104)。第三版本(“Q356P靶标”)在356氨基酸位置处含有编码脯氨酸的密码子(序列CCG),并且具有5’至3’方向的核苷酸序列:AAGATGTTCCTTGGATAACACTAAATAGCAGCATTCGAAAGTTAATGAGTGGTTTTCCAGA(SEQ ID NO:105)。第四版本(“Q356L靶标”)在356氨基酸位置处含有编码亮氨酸的密码子(序列CTG),并且具有5’至3’方向的核苷酸序列:AAGATGTTCCTTGGATAACACTAAATAGCAGCATTCGAAAGTTAATGAGTGGTTTTCCAGA(SEQ ID NO:106)。在以上四个靶标的每一个中,在5’至3’方向上,第一下划线序列是靶标的第二部分,第二下划线序列是靶标的内部基序,第三下划线序列是靶标的第一部分。
以上四个靶标序列仅在各自靶标的内部基序中相差一个核苷酸。具体地,野生型靶标在序列的第37位置具有“A”(用粗体和斜体字体强调),而Q356R靶标在序列的第37位置具有“G”,Q356P靶标在序列的第37位置具有“C”,而Q356L靶标在序列的第37位置具有“T”。还提供了第一引物和第二引物以扩增靶标序列。第一引物(“实施例9引物1”)具有序列:5’ATTCAGAATCTGGAAAACCACTC 3’(SEQ ID NO:107)。下划线序列是实施例9引物1的第一区域/尾区,而非下划线序列是实施例9引物1的第二区域/模板结合区。第二引物(“实施例9引物2”)具有序列:5’TTCTGAATAAGATGTTCCTTGGAT 3’(SEQ ID NO:108)。下划线序列是实施例9引物2的第一区域/尾区,而非下划线序列是实施例9引物2的第二区域/模板结合区。
对于以上四个靶标中的每一个进行如本文所述的单独的扩增反应,全部四个靶标的反应均使用实施例9引物1和实施例9引物2作为引物。反应的条件如下:50mM乙酸钾,20mM Tris-乙酸盐,pH 7.9,10mM乙酸镁,1mM DTT,0.8M甜菜碱,2uM59(Life Technologies),0.8单位/μl Bst DNA聚合酶(New England BioLabs),0.8μM实施例9引物1,0.8μM实施例9引物2,和10个拷贝的靶分子/μl。将反应在56℃下保持90分钟,并采用CFX Manager软件(Bio-Rad)使用单阈值方法确定每个反应的拐点。对于每个靶标进行相同的条件下的多个反应。
所述扩增反应根据本文其他地方,例如,如实施例8中所述的机理而发生。例如,在每个各自的反应中,实施例9引物1和实施例9引物2延伸产物由以上每个靶标核酸形成,以形成例如野生型靶标实施例9引物1延伸产物,Q356R靶标实施例9引物1延伸产物,Q356P靶标实施例9引物1延伸产物和Q356L靶标实施例9引物1延伸产物,以及由实施例9引物2从每个靶标延伸的相应的延伸产物。
值得注意的是,例如,对应于实施例9引物1的第一区域/尾区的野生型靶标实施例9引物1延伸产物的部分与野生型靶标实施例9引物1延伸产物中的内部基序完全互补,而对应于针对Q356R靶标、Q356P靶标和Q356L靶标引物1延伸产物中每一个的实施例9引物1的第一区域/尾区的延伸产物的部分与各自延伸产物中的内部基序不完全互补。具体地,如上所述,在涉及靶序列的第37位置的核苷酸的位置处具有单核苷酸错配。该错配可能影响本文提供的反应的速率。
采用每一个不同靶标进行的测定的平均拐点时间如下:野生型靶标:24.5分钟;Q356R靶标:49.5分钟;Q356P靶标:55.7分钟,Q356L靶标:59.8分钟。因此,如所述测定的拐点时间所示,所述反应可容易地区分在内部基序中相差一个核苷酸的靶标。与其他靶标相比,采用野生型靶标进行的测定的显著更快的拐点时间可能是对应于实施例9引物1的第一区域/尾区的野生型靶标实施例9引物1延伸产物的部分与野生型靶标实施例9引物1延伸产物中的内部基序之间完全互补的结果,这不同于对应于实施例9引物1的第一区域/尾区的Q356R靶标、Q356P靶标和Q356L靶标实施例9引物1延伸产物的部分与各自的实施例9引物1延伸产物中的内部基序之间的不完全互补。类似的推论还适用于引物2延伸产物的延伸产物。
实施例10-流感N9基因扩增
使用本文提供的方法从含有甲型流感病毒亚型H7N9的样品中扩增神经氨酸酶基因(N9)的一部分。在5’至3’方向上,来自N9的靶序列为(DNA形式):AACTTTAAGGACGAACAAGAGAGAAGGTAAACCTACAACCACTACAAACAAAGTAATATTATCAACAAATAATAACAAACCGAACACAACCAACAAAGT(SEQ ID NO:109)。用于扩增所述模板的第一引物具有5’至3’方向的序列:CTTCCATTTGAAACAACCAACAC(SEQ ID NO:110)。描述第一引物,下划线区域是该引物的尾区/第一区域,非下划线区域是第二区域/模板结合区。用于扩增所述模板的第二引物具有5’至3’方向的序列:AATGGAAGTTGAAATTCCTGCTTG(SEQ ID NO:111)。描述第二引物,下划线区域是该引物的尾区/第一区域,非下划线区域是第二区域/模板结合区。如本文所述的多个反应使用第一引物和第二引物进行,其中所述反应含有模板序列或不含模板序列。含有所述模板的反应具有每一反应250,000个拷贝模板序列。所述反应的结果提供于图12中。X轴上的数字为分钟,Y轴值为相对荧光单位(RFU)。如图所示,在模板化反应中,RFU在约20分钟时快速升高,这表明模板序列的扩增。在无模板反应中约60分钟时及以后的RFU增加是非特异性背景产物的结果。
除非另外指出,本文提供的核苷酸和氨基酸序列是人工序列。
尽管本文中已经示出并描述了本发明的优选实施方式,但对于本领域技术人员显而易见的是,这些实施方式仅以示例的方式提供。前述的描述并非详尽的或将本发明限于所公开的精确的实施方式,并且根据以上教导在不脱离本发明的情况下其他的修改和变化是可能的。无论优选与否的任何特征均可与无论优选与否的任何其他特征相组合。还应当理解,虽然出于方便的目的,本文中已经使用有限数目的术语和短语描述了本文提供的发明,但本发明也可以使用本文未提供的同样准确描述本发明的其他术语和短语进行描述。所附权利要求书不应被解释为包括装置加功能的限定,除非这样的限定在给定的权利要求中使用短语“用于…的装置”而被明确阐述。应当理解,如此处的说明书和随后的权利要求书全文中所使用,“一个”、“一种”和“该”的含义包括复数指代对象,除非上下文另有明确规定。例如,提及“测定”可以指一个测定或多个测定。此外,如此处的说明书和随后的权利要求书全文中所使用,“之中”的含义包括“之中”和“之上”,除非上下文另有明确规定。如在此处的说明书和随后的整个权利要求书中所用的,描述为含有第二个对象的“至少一部分”的第一对象可含有所有量的/完整的第二对象。如在此处的说明书和随后的整个权利要求书中所用的,术语“包含”、“包括”和“含有”以及相关的时态是包含在内且开放式的,并且不排除附加的、未叙述的要素或方法步骤。而且,在一些情况下,拓宽词语和短语诸如“一个或多个(一种或多种)”、“至少”、“但不限于”或其他类似的短语的存在不应被理解为在这类拓宽短语可能不存在的情况下意味着较窄的情况是有意或需要的。最后,如此处的说明书和随后的权利要求书全文中所使用,“或”的含义同时包括结合的和分离的,除非上下文另有明确规定。因此,除非上下文另外明确规定,术语“或”包括“和/或”。
本文档包含受到版权保护的材料。版权所有者(本文的申请人)不反对对专利文件或专利公开内容中的任何一个的摹本复制,因为它们出现于美国专利商标局专利文件或记录中,但除此之外保留任何所有的版权。以下声明应当适用:Copyright 2013-14Theranos,Inc。
- 还没有人留言评论。精彩留言会获得点赞!