女性黄体功能快速无创监测技术的制作方法
本发明涉及女性生育能力无创监测技术,具体而言,涉及一种全定量或半定量的快速无创尿检技术来测定女性尿中孕酮代谢物的周期生成量,以此来监测和评估女性黄体功能、判断不同排卵周期类型、确定是否真正排卵及排卵后能否受孕。
背景技术:
据2012年《中国不孕不育现状调研报告》显示,中国不孕不育率高达12.5%,女方原因占50%以上。人数超过5000万。不孕不育治疗失败的患者占66%,其中98.9%是因没有及时准确检测而造成的。因此,发明一种无创、价廉、医院及家庭易用的女性黄体功能监测技术,特别适用于中国优生优育的需要。
在月经周期开始时,每个卵巢中大约有15-20卵子开始成熟。装有卵子的卵泡产生雌激素。最终,一个卵泡占优势地位并继续不断成熟,而其余的卵泡开始瓦解。该优势卵泡的雌激素水平在排卵前几天大幅上升,直到达到临界水平。这种高雌激素水平,触发了另一种激素称为促黄体激素(LH)的激增。触发排卵,导致卵子从卵巢释放。标志着排卵周期的结束。
月经周期中先后出现的雌激素和LH峰与卵巢排卵时间具有密切关系。一旦雌激素或LH峰的出现,排卵通常会发生在未来12-48小时内。因此,在月经周期中监测雌激素或LH峰值,可以用来确定最佳受孕时间,或需要釆取避孕措施的时间。
在排卵前,雌激素峰和LH峰的出现并不能确认排卵实际发生,因为雌激素激增和LH释放高峰并不总是导致排卵。即使有了真正的排卵,但由于卵后黃体期不足或黄体期短,而导致不孕。这种有排卵但不能受孕的现象,是目前妇女中不孕最常见的原因。
目前市场上的商品化检验仅局限于激素血检或LH尿检,由于激素血检需大型仪器,既不方便,而且检查结果对于不孕症的诊断,又无统一标准。而LH尿检(包括昆明云南大学的CN00112779.9专利、甘肃兰州大学的CN200610200333专利、以及武汉璟泓万方堂的CN20110072240.9专利)则 主要应用于排卵期的初步估测。因此,至今为止,国内外还没有一种方便易用的商品化不孕不育体外无创诊断产品,用来定量监测女性黄体功能、确定有无排卵、排卵后能否受孕、以及相关的女性生育力和激素不孕症。
技术实现要素:
本发明的目的是,根据排卵期间女性尿中激素孕酮生成量与排卵和受孕的密切关系,来测定排卵后孕酮尿代谢物-孕二醇葡糖苷酸(pregnanediol glucuronide PdG)的生成量,从而提供一种医院、家庭及个人进行全定量或半定量、价廉方便的免疫分析方法及检测试剂盒。以排卵期为参考点,通过定量测定排卵后6天内尿中PdG的浓度,来监测黄体功能的变化,从而核实有无真实排卵和排卵后能否受孕。(1)当孕二醇值<2.0mg/24h时,表明无排卵或黃素化不破裂卵泡(luteinized unruptured follicle,LUF)。(2)如果孕二醇值在2.0-3.0mg/24h之间时,表示有排卵,但排卵后黄体期不足或短,不能受孕。(3)只有当孕二醇值>3.0mg/24h时,该周期才是具有完全生育力的排卵周期。因此,排卵后6天内孕二醇值超过3.0mg/24h是女性具有完全生育力和能正常受孕的判断标准。
如果用排卵后6天内孕二醇值是否超过3.0mg/24h作为标准,本发明也可用定性免疫分析如胶体金半定量免疫试剂条,来确定女性是否具有完全生育力能正常受孕(>3.0mg/24h)或患有不孕症(≤3.0mg/24h)。
本发明通过将孕二醇葡糖苷酸通过连接物(linker)与偶联蛋白连接起来形成孕二醇葡糖苷酸的蛋白杂交偶联体,并测定孕二醇葡糖苷酸的蛋白杂交偶联体,来监测黄体功能的变化,从而核实有无真实排卵和排卵后能否受孕。
本发明连接物分为疏水性(如简单非弹性碳链)和亲水性(如含氧、硫、氮等的杂原子的弹性碳链),其长度为1-100个碳原子,优选5-25个碳原子,更优选6-20个碳原子,最优选6-18个碳原子,其中一个或多个碳原子可以被选自氧、硫、氮等的杂原子取代。尽管,连接物的长短和它的亲水性或疏水性能,同时以不同方式、不同程度地影响着免疫分析的灵敏度和特异性。但两者之间的关系至今尚无系统地研究,更没有报道就如何有效利用连接物长短及亲水性/疏水性能,来为免疫分析的商业应用如免疫分析试剂盒的开发应用,进行合理地设计。
本发明通过改变连接物的亲疏水性及链的长短,可以控制孕二醇葡 糖苷酸在偶联蛋白上的连接数量,也就调节了孕二醇葡糖苷酸在试剂条检测线上的密度,即密度越高,线性范围越宽,密度越低,灵敏度越好。同时,碳链的长短和类型也影响孕二醇葡糖苷酸-偶联蛋白杂交偶联体与抗体的结合好坏,可有效避免与抗体的非特异性结合,而且适当长的碳链可以减少和抗体结合的立体位阻。
本发明的第一实施方案,涉及一种用于测定孕二醇葡糖苷酸的蛋白杂交偶联体,包含孕二醇葡糖苷酸和偶联蛋白,其特征在于,还包含连接两者的连接物。
本发明的第二实施方案,涉及第一实施方案的偶联体,其特征在于,所述连接物为包含1-100个碳原子,优选5-25个碳原子,更优选6-20个碳原子,最优选6-18个碳原子的直链或支链基团。
本发明的第三实施方案,涉及第二实施方案的偶联体,其特征在于,所述连接物的一个或多个碳原子被杂原子取代。
本发明的第四实施方案,涉及第三实施方案的偶联体,其特征在于,所述杂原子选自氧、氮和硫。
本发明的第五实施方案,涉及第一到第四实施方案中任一项的偶联体,其特征在于,所述偶联蛋白选自卵清蛋白(OVA)、牛血清白蛋白(BSA)、血蓝蛋白(KLH)。
本发明的第六实施方案,涉及第一到第四实施方案中任一项的偶联体,所述偶联体选自:
(1)孕二醇葡糖苷酸--6原子碳链--卵清蛋白偶联体
(2)孕二醇葡糖苷酸--13原子碳链--卵清蛋白偶联体
(3)孕二醇葡糖苷酸--20原子碳链--卵清蛋白偶联体
(4)孕二醇葡糖苷酸--18原子碳链--卵清蛋白偶联体。
本发明的第七实施方案,涉及第一到第四实施方案中任一项的偶联体,其特征在于,所述孕二醇葡糖苷酸与连接物和偶联蛋白比例为1:1至100:1。
本发明的第八实施方案,涉及一种用于检测孕二醇葡糖苷酸的试剂盒,所述试剂盒包含本发明的第一到第七实施方案中任一项的蛋白杂交偶联体,其特征在于,还包含与所述蛋白杂交偶联体特异性结合的抗体。
本发明的第九实施方案,涉及第八实施方案的试剂盒,其特征在于,所述抗体是单克隆抗体或多克隆抗体。
本发明的第十实施方案,涉及第九实施方案的试剂盒,其特征在于, 还含有与所述抗体连接的可检测标记物。
本发明的第十一实施方案,涉及第九实施方案的试剂盒,其特征在于,还含有与所述抗体特异性结合的第二抗体。
本发明的第十二实施方案,涉及第十一实施方案的试剂盒,其特征在于,所述抗体与第二抗体的比例为1:2至2:1。
本发明的第十三实施方案,涉及第十一或第十二实施方案的试剂盒,其特征在于,还含有与所述第二抗体连接的可检测标记物。
本发明的第十四实施方案,涉及第十或第十三实施方案的试剂盒,其特征在于,所述可检测标记物选自胶体、生色团、化学发光基团、荧光团、同位素或酶。
本发明的第十五实施方案,涉及一种用于监测黄体功能的试剂盒,其特征在于,包含本发明的第一至第十四实施方案中任一项的偶联体或试剂盒。
本发明的有益效果在于,对于具有完全生育力的女性,本发明无疑为自然受孕的理想时间和妊娠的开始时间提供了准确的信息。对于患有不孕症并正在治疗的女性,本发明也给医生和患者同时提供了一个能判断治疗效果是否成功的理想工具。在生殖中心,本发明所提供的孕酮测定无疑为确定人工授精的最佳时间,试管婴儿(IVF)发展初期用于促性腺激素诱导排卵的监测及确定排卵和取卵的时间,从而提高妊娠成功率,给予了巨大的帮助。
应理解,在本发明范围内,本发明的上述各种技术特征和在下文(实施例)中具体描述的各技术特征之间都可以相互组合,从而构成新的或优选的技术方案。
附图说明
图1.PdG免疫试纸条及荧光定量分析原理图
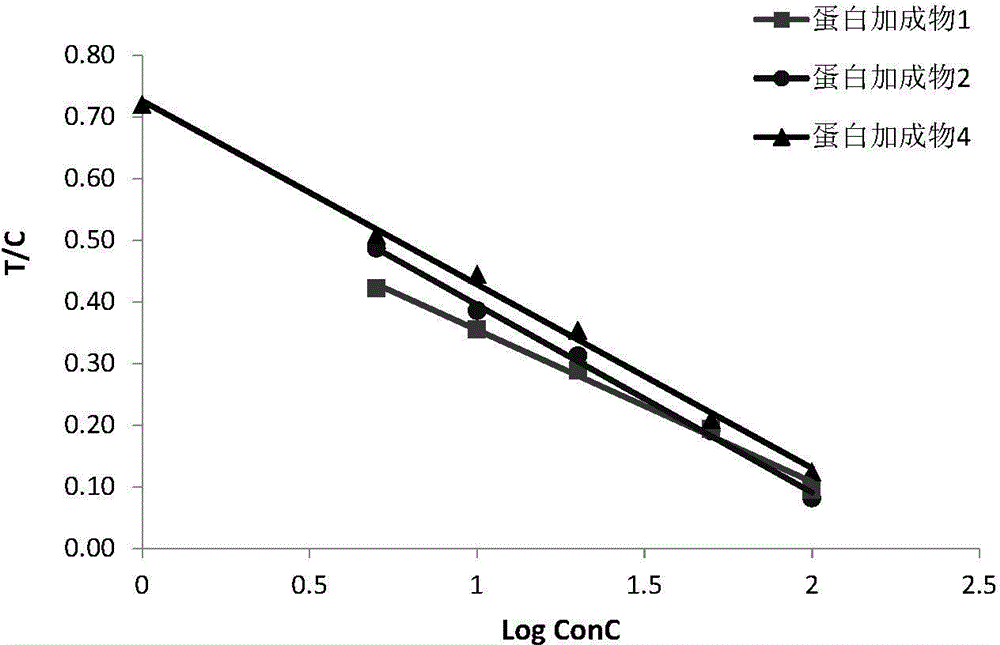
图2.蛋白加成胶体金免疫分析的线性范围分析图
图3.蛋白加成荧光免疫分析的线性范围分析图
具体实施方式
本发明人经过广泛而深入的研究,首次意外发现,本发明的孕二醇葡糖苷酸的蛋白杂交偶联体及其检测方法和检测试剂盒,通过改变连接物 的亲疏水性及链的长短,可以控制孕二醇葡糖苷酸在偶联蛋白上的连接数量,使得测定灵敏度可达1ng/ml,线性范围可控制在0.1-50ng/ml之间,从而完成了本发明。
连接物
本申请所述“连接物”,是指能够将孕二醇葡糖苷酸与偶联蛋白连接在一起的连接基,包括但不限于US7521425和US8288349中记载的可用作连接基的化合物。
偶联蛋白
本申请所述“偶联蛋白”,是指能够通过本发明所述连接物与孕二醇葡糖苷酸连接在一起的蛋白质,包括但不限于卵清蛋白、牛血清白蛋白、血蓝蛋白。
偶联体
本申请所述“偶联体”,是指孕二醇葡糖苷酸与偶联蛋白通过本发明所述连接物连接在一起的加合物,包括但不限于:
孕二醇葡糖苷酸--6原子碳链--卵清蛋白偶联体(1)
孕二醇葡糖苷酸--13原子碳链--卵清蛋白偶联体(2)
孕二醇葡糖苷酸--20原子碳链--卵清蛋白偶联体(3)
孕二醇葡糖苷酸--18原子聚乙二醇碳链--卵清蛋白偶联体(4)
抗体
本申请所述“抗体”,是指能够特异性地与孕二醇葡糖苷酸和/或偶联体中孕二醇葡糖苷酸结合的抗体,在本申请中,术语“抗体”和“特异性抗体”可互换使用。本发明还包括对孕二醇葡糖苷酸具有特异性的多克隆抗体和单克隆抗体,尤其是单克隆抗体。这里,“特异性”是指抗体能结合于孕二醇葡糖苷酸,但不识别和结合于其它非相关分子。本发明不仅包括完整的单克隆或多克隆抗体,而且还包括具有免疫活性的抗体片段,如Fab'或(Fab)2片段;抗体重链;抗体轻链;遗传工程改造的单链Fv分子(Ladner等,美国专利No.4,946,778);或嵌合抗体,如具有鼠抗体结合特异性但保留来自人的抗体部分的抗体。本发明的抗体可以通过本领域内技术人员已知的各种技术进行制备。
可检测标记物
本申请所述“可检测标记物”,是指可产生检测信号的物质,所述可检测标记物包括但不限于胶体、生色团、化学发光基团、荧光团、同位素或酶。
如图1所例示,本发明的试纸条,可以由硝酸纤维素膜、样品垫、吸水垫及PVC或PS底板等所构成。硝酸纤维素膜上划有两条线:一条为PdG-蛋白结合物包被的检测线,另一条为独立二抗抗体包被的内标质控线。 胶体金(20nm-100nm)或各种荧光试剂既可直接标记PdG单克隆抗体,也可先标记二抗多克隆抗体,然后再与PdG单克隆抗体免疫结合。作为优选方案,先标记二抗多克隆抗体,然后,再调整和优化二抗标记物与PdG单克隆抗体的最佳比例,从而获得最有效的免疫结合。适用于本发明的与胶体金或荧光定量检测试纸条通用的便携式定量分析仪(TSR3000上海捷宁生物科技有限公司),可对试剂条上胶体金红颜色的深浅或荧光强度值进行快速准确定量分析。其荧光强度值或胶体金红色的深浅度与女性尿中PdG浓度成反比关系。
本发明的检测原理:将按一定比例稀释后的女性尿液滴到样品垫上(一步干法),或加入到一试管中,经充分混匀后再滴到样品垫上(二步湿法)。样品垫上或试管中含有PdG单抗鼠抗体和分别用荧光标记的羊抗鼠二抗及羊抗兔二抗(作为内标)。在样品垫上或试管中,尿样中PdG首先与荧光PdG单抗结合。通过毛细作用,样品垫上剩余的荧光PdG单抗再流向试剂条上的检测线,与事先包被在检测线上的PdG-蛋白结合物进行免疫结合,从而使检测线显示荧光。而样品垫上的羊抗兔二抗荧光,将流到质控线上与包被的兔抗体结合,使质控线也显示荧光。将荧光试纸条插入便携式定量分析仪后,对试纸条检测线、质控线上的荧光强度同时进行定量分析,并应用检测线与质控线上荧光强度的比例,来确定尿中PdG的浓度。无论尿样中是否含有激素PdG,质控线始终显荧光,如果质控线不显荧光,则表明试纸条无效。本领域技术人员应理解,当胶体金取代荧光来标记二抗抗体时,上述定量免疫分析原理同样适用于用胶体金免疫试纸条定量分析。
如图2所示,灵敏度可低达1ng/ml,线性范围可控制在5-100ng/ml(激素蛋白偶联体1,2)或1-100ng/ml之间(激素蛋白偶联体4)(见图2),胶体金定量检测试纸条完全可以满足医院和家庭个人对PdG(即黄体功能)的定量监测。
如图3所示,用不饱和标记抗体检测PdG,其灵敏度可达0.1ng/ml,线性范围可控制在0.5-20ng/ml(激素蛋白偶联体1,2)或0.1-50ng/ml之间(激素蛋白偶联体4),荧光定量检测试纸条完全可以满足医院和家庭个人对PdG(即黄体功能)的定量监测。
本发明的上述发明内容并不旨在描述本发明的每个公开的实施例或每种实施方案。以下描述更具体地例示了示例性实施例。在整个说明书中, 通过示例提供指导,这些实例可以各种组合加以使用。在每一种情形下,所示例的内容仅仅作为代表性示例,而不应理解为排他性示例。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例
本领域技术人员应理解,以下实施例仅以举例方式对本发明偶联体的合成进行说明,任何可用来将连接物连接于孕二醇葡糖苷酸和偶联蛋白连接起来的方法都可以使用,根据本发明实施例的教导,本领域技术人员可以通过调节孕二醇葡糖苷酸与连接物和偶联蛋白的反应比例来控制两者的比例。
实施例1:PdG-Linker-CO2H(1)的制备
PdG(0.1mmol)溶解于DMF(0.5mL)中,加入DCC(0.143mmol)和NHS(0.143mmol)的DMF溶液(0.8ml)。将反应混合物搅拌7小时,随后加入6-氨基己酸的(0.119mmol)氯仿(1mL)和三乙胺(0.5mL)溶液。搅拌反应过夜,除去溶剂后,残留物以二氯甲烷:甲醇(8:2)在硅胶上层析:得到产物PdG-Linker-CO2H(1;0.025mmol)。产率:25%。
实施例2:PdG-Linker-OVA偶联体(1)的制备
PdG-linker-CO2H(1;0.05mmol)于小试管中,搅拌下加入上述DCC/DMF溶液0.2ml溶解,然后再加入0.2ml,置于室温下反应3个小时直至有大量沉淀析出(尿素为其副产物)。NaH2PO4.2H2O(0.1186g)和无水Na2HPO4(0.46g)溶解于20ml水中制备成0.2M磷酸缓冲液(pH7.4)。在4℃下,将OVA(44.34mg,1μmol)搅拌溶解于上述4ml,0.2M磷酸缓冲液中;将上述DCC/NHS PdG溶液(0.4ml的DMF溶液)在搅拌下滴入至OVA溶液中。PdG-linker-OVA的偶联反应于4℃搅拌过夜。PdG-Linker-OVA的偶联体以水透析4次(每次1.2L),48小时,然后以磷酸缓冲液(1.2L,pH7.4)透析24小时。经纯化的PdG-Linker-OVA偶联体(1)透析后收集、冻干贮存。
实施例3:PdG-Linker-OVA偶联体(2-4)的制备
以上述实施例1的类似方法,取三份PdG(0.1mmol)溶解于DMF(0.5mL)中,加入DCC(0.143mmol)和NHS(0.143mmol)的DMF溶液(0.8ml)。将反应混合物搅拌7小时,随后分别加入7-氮杂-8-氧代-13-氨基-十三烷酸、7,14-二氮杂-8,15-二氧代-20-氨基-二十烷酸和4-氧代-5-氮杂-9,12,15-三氧杂-18-氨基-十八烷酸的(0.119mmol)氯仿(1mL)和三乙胺(0.5mL)溶液。搅拌反应过夜,除去溶剂后,残留物以二氯甲烷:甲醇(8:2)在硅胶上层析:得到产物PdG-Linker-CO2H(2-4;0.023-0.026mmol)。产率分别为:23-26%。
以上述实施例2的方法,分别取上述PdG-linker-CO2H(2-4;0.05mmol)于小试管中,搅拌下加入上述DCC/DMF溶液0.2ml溶解,然后再加入0.2ml,置于室温下反应3个小时直至有大量沉淀析出(尿素为其附产物)。NaH2PO4.2H2O(0.1186g)和无水Na2HPO4(0.46g)溶解于20ml水中制备成0.2M磷酸缓冲液(pH7.4)。在4℃下,将OVA(44.34mg,1μmol)搅拌溶解于上述4ml,0.2M磷酸缓冲液中;将上述DCC/NHS PdG溶液(0.4ml的DMF溶液)在搅拌下滴入至OVA溶液中。PdG-linker-OVA的偶联反应于4℃搅拌过夜。PdG-Linker-OVA的偶联体以水透析4次(每次1.2L),48小时,然后以磷酸缓冲液(1.2L,pH7.4)透析24小时。经纯化的PdG-Linker-OVA偶联体(2)透析后收集、冻干贮存。
实施例4:胶体金试剂条的制备
激素孕二醇葡糖苷酸单克隆抗体(mAb)的标记:将胶体金溶液的pH值调节到7.5-8.5后,mAb标记使用饱和标记量的一半,已满足灵敏度的需要。如果以线性范围为目标,则mAb使用饱和标记。mAb标记完后,进行1%BSA的封闭。最后,实施离心分离,小心除去上层清液后,加入常规缓冲液(10mM PBS,pH7.4,1%BSA)重悬mAb-胶体金结合物,并在4°下保存。将吸水垫、8964材料(样品垫和偶联体结合垫)分别与硝酸纤维素膜相互交叠重合1-2mm后,进行点膜或划膜。将二抗用加载缓冲液稀释至1mg/ml后,在质控线上进行点膜(0.5-1μl)或划膜(1μl/cm,0.8mg/ml)。应用同样原理,将PdG-蛋白结合物在检测线上进行点膜(1μl)或划膜(1μl/cm)。待自然干燥1小时后,将试纸条切成细条(4mm宽)。
测试(二步湿法):将PdG抗原标样用磷酸盐缓冲液(PB,10mM,pH7.2)稀释,标样空白为稀释液。以灵敏度为目标,采用不饱和标记胶体金(即饱 和标记一半抗体mAb用量),与工作溶液1:1稀释后,点样(10μl)于样品垫上。以线性范围为目标,则采用饱和标记胶体金(饱和标记全部抗体mAb)。同样1:1稀释后,点样(10-12μl/每条样品垫)上。在控制时间(7分钟)的前提下,将试纸条装卡、插入定量分析仪(TSR3000,上海捷宁生物科技有限公司)进行读卡器读数,获得定量分析结果。
用不饱和标记抗体检测PdG:灵敏度可低达1ng/ml,线性范围可控制在5-100ng/ml(激素蛋白偶联体1,2)或1-100ng/ml之间(激素蛋白偶联体4)。由图2结果可见:上述胶体金定量检测试纸条完全可以满足医院和家庭个人对PdG(即黄体功能)的定量监测。
实施例5:荧光试剂条的制备
将PdG-linker-OVA(1-4)在检测线上进行点膜(1μl)或划膜(1μl/cm)。待自然干燥1小时后,将试纸条切成细条(4mm宽),在控制线上羊抗兔二抗进行点膜或划膜。含PdG样品0.1ml和0.05ml PdG单抗鼠抗体,0.05ml荧光(如Cy3)标记的二抗混合物(羊抗鼠和羊抗兔二抗)定量点到样品垫上后进行侧向层析,在控制时间(7分钟)的前提下,将试纸条装卡、插入定量分析仪进行读卡器读数(ESE-Quant FLUO reader,DCN Inc),获得定量分析结果。
实施例6:数据分析实验
激素蛋白偶联体用于免疫试剂盒的分析
【注】:激素蛋白结合度(半抗原密度),即每个蛋白分子上所连接激素分子的平均数目,是通过基质辅助激光解吸电离飞行时间质谱(Matrix-Assisted Laser Desorption/Ionization Time of Flight Mass Spectrometry,MALDI-TOF-MS,Bruker Daltonics AutodlexTM spectrometer) 的测定而获得的。
本发明人出人意料地发现,免疫试剂盒分析灵敏度的高低和线性范围的大小,将同时取决于“激素蛋白质结合度”和“激素蛋白质的水溶解性”两个因素,本发明人不囿于既有的原理,首次开创性地提出以下绝然不同于常规的全新的设计思路,并取得了绝佳的技术效果:
(1)在激素蛋白偶联体的合成中,激素蛋白质结合度(即半抗原密度)同时与激素分子和连接物的亲水性能、以及激素与蛋白的分子摩尔比例紧密相关;一般来讲,两者的亲水性能越好,激素分子与蛋白分子的摩尔比越高,则激素与蛋白的结合度就越高;反之亦然。由于激素分子的疏水性,连接物的亲水性能就显得特别重要。在控制相同激素/蛋白分子摩尔比的前提下,当疏水性的连接物由6原子(1)增长到13原子(2)或20原子(3)时,其激素蛋白结合度也相应从4.1降到2.4。与其绝然不同的是,当亲水性的18原子聚乙二醇作为连接物时(4),其激素蛋白质结合度高达11,几乎是具有相似链长疏水性连接物(3)的5倍。
(2)在激素和蛋白分子之间引进的不同性能(亲水性或疏水性)以及不同长度的连接物,不仅导致激素蛋白质结合度的超出常规预想的巨大差别,还直接影响着最终产品-激素蛋白质的水溶解性;而它的水溶解性又决定了该激素蛋白质在免疫试剂条检测线上的数量。因此,检测线上激素蛋白质的数量和每个蛋白分子上所连接的激素数目,就决定了检测线上激素分子密度。从而影响着免疫试剂盒分析的灵敏度和线性范围。当疏水性的连接物由6原子(1)增长到20原子(3)时,不仅其激素蛋白结合度从4.1降到2.4,而且其合成后的激素蛋白偶联体的水溶解性也急剧降低,这种由于超低激素蛋白结合度和水溶解性,导致检测线上激素分子密度太低,无法进行有效地免疫试剂盒分析。而当亲水性的18原子聚乙二醇作为连接物,不仅提供了很高地激素蛋白结合度(11),而且,由于长链聚乙二醇连接物的良好亲水性,使得激素-聚乙二醇-蛋白偶联体具有很好的水溶解性,从而可让激素蛋白结合物高浓度地点样到检测线上。这种由高蛋白浓度、高激素结合度而导致的激素分子高密度的检测线,无疑为免疫试剂盒分析提供了较宽的线性范围。另外,由于聚乙二醇连接物的长链(18原子)提高了抗体/激素的有效结合,再加上聚乙二醇碳链具有避免抗体非特异性结合的优良性能,因此,激素-聚乙二醇-蛋白偶联体(4)在免疫试剂盒分析中 的灵敏度也最优秀。
当引入本发明的元素或本发明的优选实施方式时,冠词“一”、“该”和“所述”意为存在一个或多个元素。术语“包含”、“包括”和“具有”是包含的,意为可以存在除了所列出的元素之外的额外的元素。
由于可在上文中进行各种变化,而不脱离本发明的范围,这意为包含在以上描述中的所有内容应被解读为说明性的,没有限制性的含义。本发明的范围通过所附的权利要求书而限定,且可以对上文的实施方式进行不脱离本发明的范围的修改。
- 还没有人留言评论。精彩留言会获得点赞!