磁感应受体蛋白和其复合物及它们的用途的制作方法
本发明涉及生物学和其应用领域。具体地,本发明涉及一种科学上首次研究和制备得到的自身具有磁性的蛋白,即磁感应受体蛋白,以及所述磁感应受体蛋白的纯合蛋白复合物,以及所述磁感应受体蛋白和光感应蛋白形成的杂合蛋白复合物。本发明还提供了所述蛋白或复合物的用途。
背景技术:
铁是生命体必需的微量元素,和铁结合、转运相关的蛋白质也得到了较多的关注和研究。铁结合蛋白是含铁的金属结合蛋白,其中有一个亚类称之为铁硫蛋白,其结合的铁是以铁硫中心(Iron-sulfur cluster)的形式存在。铁硫蛋白是非常重要的电子传递的载体,主要牵涉到呼吸链和植物的光合作用等生化反应过程。对铁结合蛋白和铁硫蛋白的研究非常广泛和深入,主要集中在和生化代谢相关的各个方面。生物中最重要的两个铁结合蛋白是乳铁蛋白和转铁蛋白,其中转铁蛋白构成的复合笼状结构,能装载大约3000-5000个铁原子,是生物中重要的储存铁的机制。一些研究也表明,可以利用装载铁原子的转铁蛋白作为纳米颗粒用于生物医学和其它领域的应用。然而,迄今为止,所有已经发现的铁结合蛋白都不具备自身的磁性,即都不是“磁性蛋白”。例如,上述载铁能力极高的转铁蛋白在磁场下能够被磁场吸引,具备顺磁的特性,但也不具备自身的磁性。该蛋白具有类似于铁球在磁场下的反应,但因为不具备自身的磁性,所以不能作为如同用作指南针的磁铁那样的磁性材料使用。
另外,动物的磁感应能力一直是生物学领域中最引人注目的未解之谜。很多年以来,人们已经知道许多动物在进行长距离迁徙时是通过感应地磁场来判断方向和导航的,例如黑脉金斑蝶、家鸽、蜜蜂、龙虾、海龟、鲨鱼、蝙蝠、牛羚羊以及众所周知的候鸟等等。除此之外,还有一些物种利用地磁场来引导自身的朝向和筑巢的走向,例如名为 Tritonias diomedea的海洋软体动物、指南白蚁、裸鼹鼠等。然而,人们对动物体感应磁场的分子机理了解甚少。
动物能够通过某种分子机制(例如,通过某种特定的基因或者蛋白质,或者通过某条细胞信号通路)来感应地磁场的这一说法,从无人相信到被学界认可,经历了很长的一段时间。迄今为止,与动物体感应磁场有关的最关键的一个研究是隐花色素蛋白(Cryptochrome,简称为Cry)的发现和研究。2008年,在Gegear,R.J.,Casselman,A.,Waddell,S.&Reppert,S.M.等的Cryptochrome mediates light-dependent magnetosensitivity in Drosophila.Nature 454,1014-1018(2008)中描述了将模式动物果蝇的Cry基因敲除后,果蝇就失去了对磁场的感知能力。这一实验充分说明了动物对磁场的感知和利用磁场导航存在某种分子机制,并且这一过程由特定的基因和蛋白质参与。这表明,动物具有磁感应能力不是伪科学,而是由特定基因决定的,并证明Cry蛋白是动物磁感应信号通路中非常关键的一个环节。但是,该发现并不能确认Cry蛋白是直接感应磁场的受体蛋白。事实上,其后有很多该领域的相关文献也进一步说明了这一点,如Gould,J.L.的Magnetoreception.Curr Biol 20,R431-435(2010),其指出当前的几种假说都有缺陷,尤其是Cry作为磁感应蛋白的假说并不能解释蛋白质如何识别磁场的磁极,而Cry蛋白质在磁场下的反应并没有任何直接的实验证据支持。值得注意的是,Cry蛋白并不是一种含铁的蛋白质,因此Cry蛋白不能提供其具有感磁特性的让人信服的机理。
本领域尚未发现本身具有磁性和/或光磁性的蛋白或蛋白复合物。本领域亦未得到过本身具有磁性和/或光磁性的蛋白或蛋白复合物以及将其应用于人类生产生活中。
发明概述
本发明涉及一种在现代生物学研究中新研究和制备得到的自身具有磁性和/或能够形成具有磁性之复合物的蛋白,即磁感应受体蛋白,以及所述磁感应受体蛋白的纯合蛋白复合物,以及所述磁感应受体蛋白和光感应蛋白形成的杂合蛋白复合物。本发明还提供了所述磁感应受体蛋白或复合物的用途。
本发明提供了一种分离的磁感应受体蛋白。磁感应受体蛋白(或称 “Magnetoreceptor”,或称“MagR”)是本申请发明人在现代生物学研究中首个研究、鉴定并命名的一种其核酸编码序列在生物体基因组中广泛存在并高度保守,可形成具有生物磁性的蛋白单体或纯合复合物或杂合复合物的蛋白质。本发明提供的磁感应受体蛋白的核酸序列在大量不同物种的基因组中都存在,其编码的蛋白序列高度保守,并具有多个高度保守的结构域,例如特征性的结合铁和/或硫的结构域。本发明的磁感应受体蛋白可为磁感应受体蛋白家族中的其中一种。本发明的磁感应受体蛋白可来自脊椎动物或来自无脊椎动物。示例性的MagR的核酸或蛋白序列为本申请发明人从家鸽(pigeon,拉丁名Columba livia)和黑脉金斑蝶(或称美洲帝王蝶,monarch butterfly,拉丁名Danaus plexippus)得到,其氨基酸序列分别如SEQ ID NO:1和SEQ ID NO:2所示。这些序列在本发明之前是未被公开的。
本发明提供的磁感应受体蛋白还包括其它生物物种的磁感应受体蛋白,例如来自果蝇(Fruit fly,拉丁名Drosophila melanogaster),蜜蜂(Honey bee,拉丁名Apis mellifera),文昌鱼(Lancelet,拉丁名Branchiostoma floridae),斑马鱼(Zebrafish,拉丁名Danio rerio),蟒蛇(Burmese python,拉丁名Python bivittatus),草雀(Zebra finch,拉丁名Taeniopygia guttata),鸡(Chicken,拉丁名Gallus gallus),鲸鱼(Minke whale,拉丁名Balaenoptera acutorostrata),蝙蝠(Little brown bat,拉丁名Myotis lucifugus),裸鼹鼠(Naked mole rat,拉丁名Heterocephalus glaber),小鼠(Mouse,拉丁名Mus musculus),人(Human,拉丁名Homo sapiens)。上述来自果蝇、蜜蜂、文昌鱼、斑马鱼、蟒蛇、草雀、鸡、鲸鱼、蝙蝠、裸鼹鼠、小鼠和人的磁感应受体蛋白的氨基酸序列分别如SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13和SEQ ID NO:14所示。
在本发明的其中一个方面,提供了一种分离的磁感应受体蛋白,其具有:
(1)如SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14所示的氨基酸序列,或
(2)在与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14进行比较时具有至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性的氨基酸序列。其中所述序列同一性可通过Clustal V比对方法计算得到。
优选地,其中不相同的残基位置的差异为保守性氨基酸取代。“保守性氨基酸取代”指其中氨基酸残基被另一种具有化学性质(例如:电荷或亲水性)类似之侧链R基的氨基酸残基取代。通常,保守性氨基酸取代实质上不会改变蛋白质的功能性质。具有相似化学性质之侧链的氨基酸基团实例包括:1)脂肪族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸与异亮氨酸;2)脂肪族-羟基侧链:丝氨酸与苏氨酸;3)含酰胺侧链:天冬酰胺与谷氨酰胺;4)芳香族侧链:苯丙氨酸、酪氨酸、与色氨酸;5)碱性侧链:赖氨酸、精氨酸与组氨酸;6)酸性侧链:天冬氨酸与谷氨酸;及7)含硫侧链:半胱氨酸与甲硫氨酸。优选的保守性氨基酸取代组合为:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸、谷氨酸-天冬氨酸、及天冬酰胺-谷氨酰胺。
在本发明的其中一个方面,提供了一种分离的磁感应受体蛋白,其具有:在与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14进行比较时具有一个或多个(通常为2-8个,例如为2个,3个,4个或5个)氨基酸的取代、缺失、添加的氨基酸序列。例如,其中取代、缺失、添加的氨基酸为保守性氨基酸。本发明提供的具有所述取代、缺失、添加的磁感应受体蛋白具有磁感应受体蛋白活性。
在本发明的其中一个方面,提供了一种分离的磁感应受体蛋白,其氨基酸序列不为如SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14所示的氨基酸 序列。
在本发明的其中又一个方面,上述分离的磁感应受体蛋白具有磁性和/或能够形成具有磁性的蛋白复合物。在本发明的其中又一个方面,上述分离的磁感应受体蛋白具有结合铁和/或硫的结构域。在本发明的其中又一个方面,上述分离的磁感应受体蛋白能形成具有磁性的纯合蛋白复合物,和/或能与隐花色素蛋白(Cryptochrome,简称为Cry)形成杂合蛋白复合物。在本发明的其中又一个方面,上述纯合蛋白复合物或杂合蛋白复合物具有特定的蛋白立体结构,例如长条形;在所述纯合蛋白复合物或杂合蛋白复合物中,具有多个铁原子,其在棒状结构蛋白质的中央也形成有序排列,由此使得所述蛋白复合物具有磁性。
在本发明的其中一个方面,本发明还提供了前述磁感应受体蛋白的活性片段或衍生物。
在本发明的其中一个方面,本发明提供了一种前述磁感应受体蛋白,其中所述磁感应受体蛋白含有铁原子。在本发明的其中又一个方面,所述磁感应受体蛋白还含有硫原子。
在本发明的其中一个方面,本发明提供了一种重组DNA构建体,其包含编码如前所述的磁感应受体蛋白或其活性片段或衍生物的核苷酸序列。在所述构建体中,所述编码如前所述的磁感应受体蛋白或其活性片段或衍生物的核苷酸序列可操作地连接至少一个调控元件,例如可在真核细胞或原核细胞中有功能的启动子。
本发明提供了一种分离的蛋白复合物,其包含多个(两个或两个以上)前述磁感应受体蛋白或其活性片段或衍生物,即纯合蛋白复合物。
在本发明的其中一个方面,所述蛋白复合物中所述磁感应受体蛋白来自脊椎动物,例如家鸽、蟒蛇、草雀、鸡、鲸鱼、斑马鱼、蝙蝠、裸鼹鼠、小鼠和人,或来自无脊椎动物,例如果蝇、文昌鱼、蜜蜂和黑脉金斑蝶。
在本发明的其中一个方面,所述分离的蛋白复合物中的磁感应受体蛋白具有:
(1)如SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14所示的氨基酸序列,或
(2)在与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14进行比较时具有至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性的氨基酸序列。其中所述序列同一性可通过Clustal V比对方法计算得到。
优选地,其中不相同的残基位置的差异为保守性氨基酸取代。
在本发明的其中又一个方面,所述分离的蛋白复合物中的磁感应受体蛋白具有:在与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14进行比较时具有一个或多个(通常为2-8个,例如为2个,3个,4个或5个)氨基酸的取代、缺失、添加的氨基酸序列。例如,其中取代、缺失、添加的氨基酸为保守性氨基酸。本发明提供的具有所述取代、缺失、添加的磁感应受体蛋白具有磁感应受体蛋白活性。
在本发明的其中一个方面,所述分离的蛋白复合物中含有铁原子。在本发明的其中一个方面,所述分离的蛋白复合物中还含有硫原子。
在本发明的其中一个方面,所述分离的蛋白复合物含有2个或4个所述磁感应受体蛋白。
在本发明的其中一个方面,所述蛋白复合物含有8个或以上所述磁感应受体蛋白,优选为20个或以上所述磁感应受体蛋白,更优选为20-24个所述磁感应受体蛋白。
在本发明的其中一个方面,所述蛋白复合物的立体结构为“长条形”。蛋白质立体结构是指蛋白质分子的空间结构。长条形的蛋白立体结构也可称为“棒状结构”或“棍状结构”。蛋白质的立体结构可以通过电子显微镜观察和测量。在本发明的蛋白复合物中,所述多个磁感应受体蛋白或其活性片段或衍生物发生聚合,形成棒状结构的蛋白复合物。在本发明的其中一个方面,所述蛋白复合物中的多个磁感应受体蛋 白或其活性片段或衍生物发生线性聚合形成两条蛋白长链(通常为两条等长的蛋白长链,即两条蛋白单链中含有相同个数的蛋白单体)。在本发明的其中又一个方面,所述两条蛋白长链以螺旋形式结合,形成棒状结构的蛋白复合物。在本发明的所述蛋白复合物中还包含多个铁原子。在本发明的其中一个方面,所述多个铁原子位于所述棒状结构蛋白复合物的中央。例如,每个形成所述蛋白复合物的单个磁感应受体蛋白都结合铁原子,又例如,每个磁感应受体蛋白单体结合铁原子的位置都相同或相近,由此,在由磁感应受体蛋白单体线性聚合形成的棒状结构蛋白复合物中,所述多个铁原子在棒状结构的中央也形成有序排列。
在本发明的其中一个方面,所述蛋白复合物中每个磁感应受体蛋白含有1个2Fe2S的铁硫中心,即每个磁感应受体蛋白可含有2个铁原子和2个硫原子。在本发明的其中又一个方面,所述蛋白复合物含有约20个磁感应受体蛋白,由此,所述蛋白复合物含有约40个铁原子。
在本发明的其中一个方面,在前述蛋白复合物中还具有光感应元件。光感应元件是可感受/传递光信号的部分,如可结合到蛋白上的分子、复合物或蛋白等,例如可以是可感受/传递光信号的蛋白。在生物界已发现多种可感受/传递光信号的蛋白。其中一种是隐花色素蛋白(Cryptochrome,简称为Cry)或其活性片段或衍生物。在本发明的其中又一个方面,在所述蛋白复合物中,每2个磁感应受体蛋白与1个隐花色素蛋白结合。
隐花色素蛋白(Cryptochrome,简称为Cry)是一类能够感受蓝光(400~500nm)和近紫外光(320~400nm)的黄素蛋白(Flavoprotein),分子量为70~80KD,生色团可为黄素腺嘌呤二核苷酸(FAD)和蝶呤(pterin)。Cry蛋白及其编码基因普遍存在于植物、动物以及整个高等真核生物中。Cry蛋白在动物中可能与动物时钟节律和生物钟的控制有关。Cry蛋白家族包括Cry、Cry1、Cry2、Cry3和Cry4等。在哺乳动物、昆虫体内都有其同源基因编码隐花色素蛋白。
在本发明的其中一个方面,在本发明的蛋白复合物中,所述隐花色素蛋白可选自Cry、Cry1、Cry2、Cry3或Cry4。在本发明的其中又一个方面,在本发明的蛋白复合物中,所述隐花色素蛋白具有:
(1)如SEQ ID NO:15或SEQ ID NO:16所示的氨基酸序列,或
(2)在与SEQ ID NO:15或SEQ ID NO:16进行比较时具有至少 50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性的氨基酸序列,并且具有隐花色素蛋白的活性。其中所述序列同一性可通过Clustal V比对方法计算得到。
优选地,其中不相同的残基位置的差异为保守性氨基酸取代。
在本发明的其中又一个方面,所述分离的蛋白复合物中的隐花色素蛋白具有:在与SEQ ID NO:15或SEQ ID NO:16进行比较时具有一个或多个(通常为2-8个,例如为2个,3个,4个或5个)氨基酸的取代、缺失、添加的氨基酸序列。例如,其中取代、缺失、添加的氨基酸为保守性氨基酸。本发明提供的具有所述取代、缺失、添加的磁感应受体蛋白具有磁感应受体蛋白活性。
在本发明的其中一个方面,前述本发明的蛋白复合物具有磁性。“蛋白质具有磁性”或者“磁性蛋白质”是指蛋白质或者蛋白质复合物作为磁性材料的主体存在,自身具备磁性。所述磁性蛋白质可具有类似磁铁的磁极(南北极),可以被外源的磁场牵引运动,也具备吸引铁、钴、镍等铁磁性物质的性质。值得指出的是,本发明所述的蛋白质具有自身的磁性,其磁性不依赖于外界磁场而存在。
在本发明的其中一个方面,前述的本发明蛋白复合物为晶体。
本发明还提供了生产前述的本发明蛋白复合物的方法,其包含下述步骤:
在允许形成蛋白复合物的条件下,使所述磁感应受体蛋白或其活性片段或衍生物相互直接聚合形成同源聚合物;分离该同源聚合物。
在上述生产本发明的蛋白复合物的方法中,所述磁感应受体蛋白具有铁原子。在本发明的其中又一个方面,所述磁感应受体蛋白中还含有硫原子。
在本发明的其中一个方面,在生产前述的本发明蛋白复合物的方法中,其中所述磁感应受体蛋白或其活性片段或衍生物在细胞中表达和形成复合物。所述细胞可以是培养的原核或者真核动物细胞,例如大肠杆菌或者哺乳动物细胞。在本发明的其中一个方面,在培养所述细胞过程中,所述磁感应受体蛋白或其活性片段或衍生物含有铁和/或硫原子,因 此培养液中需加入可生物利用的铁元素和/或硫元素(单体或化合物)。
在本发明的其中一个方面,生产前述的本发明蛋白复合物的方法在存在磁场的条件下进行。例如,其中分离同源聚合物的步骤在存在磁场的条件下进行。在本发明的其中又一个方面,所述磁场为外加磁场。在本发明的其中又一个方面,分离蛋白质同源聚合物通过亲和层析法进行,例如通过亲和层析柱;在采用亲和层析法分离所述蛋白质时,提供磁场条件。在本发明的其中一个方面,在生产前述的本发明蛋白复合物的方法中,所述磁场的磁场强度大于约5倍地球磁场,例如是地球磁场的约10-100倍。在生产前述的本发明蛋白复合物的方法中,所述磁场的磁场强度大于约100倍地球磁场也可以获得良好的效果。
在本发明的一个方面,提供了前述的本发明磁感应受体蛋白或蛋白复合物的应用。
在本发明的其中一个方面,提供了前述的本发明磁感应受体蛋白或蛋白复合物的与磁性相关的应用,例如,其作为磁性材料的应用。本发明的磁感应受体蛋白或蛋白复合物具有对磁场的高度敏感,更特殊的是,其存在内在的磁性,可作为各种与磁性相关的应用中的磁性材料。与磁性相关的应用的领域非常广泛,包括但不限于生物医药和医疗器械如磁性生物材料、生物分子提纯、细胞内物质的定向移动、通过磁场控制某些细胞生命活动等,磁记录介质,超导应用如纳米环形电流超导体、磁流变流体等,电器设备如电磁转换设备,通讯和导航设备如分子陀螺仪中的应用等。
本发明还提供了一种分离的杂合蛋白复合物,其包含1)磁感应受体蛋白或其活性片段或衍生物,以及2)光感应蛋白(例如隐花色素蛋白)或其活性片段或衍生物。
在本发明的其中一个方面,所述杂合蛋白复合物中所述磁感应受体蛋白来自脊椎动物,例如家鸽、蟒蛇、草雀、鸡、鲸鱼、斑马鱼、蝙蝠、裸鼹鼠、小鼠和人,或来自无脊椎动物,例如果蝇、文昌鱼、蜜蜂和黑脉金斑蝶。
在本发明的其中一个方面,所述杂合蛋白复合物中的磁感应受体蛋白具有:
(1)如SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO: 8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14所示的氨基酸序列,或
(2)在与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14进行比较时具有至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%的序列同一性的氨基酸序列。其中所述序列同一性可通过Clustal V比对方法计算得到。
优选地,其中不相同的残基位置的差异为保守性氨基酸取代。
在本发明的其中一个方面,在本发明的所述杂合蛋白复合物中,所述隐花色素蛋白可选自Cry1、Cry2、Cry3和Cry4。在本发明的其中又一个方面,在本发明的杂合蛋白复合物中,所述隐花色素蛋白具有:
(1)如SEQ ID NO:15或SEQ ID NO:16所示的氨基酸序列,或
(2)在与SEQ ID NO:15或SEQ ID NO:16进行比较时具有至少50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或100%的序列同一性的氨基酸序列,并且具有隐花色素蛋白的活性。其中所述序列同一性可通过Clustal V比对方法计算得到。
优选地,其中不相同的残基位置的差异为保守性氨基酸取代。
在本发明的其中一个方面,所述杂合蛋白复合物中含有铁原子。在本发明的其中一个方面,所述分离的杂合蛋白复合物中还含有硫原子。
在本发明的其中一个方面,在所述杂合蛋白复合物中,每2个磁感应受体蛋白与1个隐花色素蛋白结合。
在本发明的其中一个方面,所述杂合蛋白复合物含有20个或以上所述磁感应受体蛋白,更优选为20-24个所述磁感应受体蛋白。在本发明的其中又一个方面,所述复合物含有10个或以上所述隐花色素蛋白,更优选为10-12个所述隐花色素蛋白。
在本发明的其中一个方面,所述杂合蛋白复合物具有光磁性。
在本发明的其中一个方面,前述的本发明杂合蛋白复合物为晶体。
本发明还提供了生产前述的本发明杂合蛋白复合物的方法,其包含下述步骤:
在允许形成蛋白复合物的条件下,使1)磁感应受体蛋白或其活性片段或衍生物与2)光感应蛋白(例如隐花色素蛋白)或其活性片段或衍生物接触和聚合,形成杂合聚合物,其中1)和2)的蛋白中的至少一种是分离形式或被重组表达;和
分离该杂合聚合物。
在本发明的其中一个方面,在生产前述的本发明杂合蛋白复合物的方法中,其中磁感应受体蛋白和光感应蛋白在细胞中表达和形成复合物。所述细胞可以是培养的原核细胞或者真核动物细胞,例如大肠杆菌和哺乳动物细胞。在本发明的其中一个方面,在培养所述原核或真核动物细胞过程中,所述磁感应受体蛋白或其活性片段或衍生物含有铁和/或硫原子,因此培养液中需加入可生物利用的铁元素和/或硫元素(单体或化合物)。
在上述生产本发明杂合蛋白复合物的方法中,所述磁感应受体蛋白具有铁原子。在本发明的其中又一个方面,所述磁感应受体蛋白中还含有硫原子。
在本发明的其中一个方面,生产前述的本发明杂合蛋白复合物的方法在存在磁场的条件下进行。例如,其中分离该杂合复合物的步骤在存在磁场的条件下进行。在本发明的其中又一个方面,所述磁场为外加磁场。在本发明的其中又一个方面,分离杂合蛋白复合物通过亲和层析法进行,例如通过亲和层析柱;在采用亲和层析法分离所述蛋白质时,提供磁场条件。在本发明的其中一个方面,在生产前述的本发明蛋白复合物的方法中,所述磁场的磁场强度大于约5倍地球磁场,例如是地球磁场的约10-100倍。在生产前述的本发明蛋白复合物的方法中,所述磁场的磁场强度大于约100倍地球磁场也可以获得良好的效果。
在本发明的其中一个方面,提供了鉴别前述本发明磁感应受体蛋白可形成之光磁感应复合物的方法,其包含下述步骤:
a.在允许形成蛋白复合物的条件下,使1)前述磁感应受体蛋白或其活性片段或衍生物与待测蛋白或衍生物接触;
b.测定所述磁感应受体蛋白或其活性片段或衍生物与待测蛋白或衍生物是否可形成复合物;
c.测定所形成的复合物内1)的蛋白与待测蛋白之间的相互作用。
在本发明的一个方面,提供了前述本发明杂合蛋白复合物的应用。在本发明的其中一个方面,提供了前述本发明杂合蛋白复合物的与磁性相关的应用,例如,其作为磁性材料的应用。本发明的杂合蛋白复合物具有对磁场的高度敏感,更特殊的是,其存在内在的磁性,可作为各种与磁性相关的应用中的磁性材料。与磁性相关的应用的领域非常广泛,包括但不限于生物医药和医疗器械如磁性生物材料、生物分子提纯、细胞内物质的定向移动、通过磁场控制某些细胞生命活动等,磁记录介质,超导应用如纳米环形电流超导体、磁流变流体等,电器设备如电磁转换设备,通讯和导航设备如分子陀螺仪中的应用等。
本文所引用的全部出版物都并入本文作为参考。除非另有定义,在本文中使用的全部技术和科学术语都具有与本发明所属领域的普通技术人员一般理解的相同的含义。
术语“多肽”、“蛋白”和“肽”在本文中互换地用于指氨基酸链,其中氨基酸残基通过肽键或修饰的肽键相连。氨基酸链可以是大于2个氨基酸的任意长度。除非另有说明,术语“多肽”、“蛋白”和“肽”也包括它们的各种修饰形式。这些修饰形式可以是天然存在的修饰形式或化学修饰形式。修饰形式的实例包括但不限于:糖基化形式、磷酸化形式、核糖基化形式、乙酰化形式、泛素化形式等。修饰也包括分子内交联和与各种部分(例如脂质、黄素、生物素、聚乙二醇或其衍生物等)的共价附着。另外,修饰也可以包括环化、分支和交联。此外,在多肽中也可以包含由基因密码子编码的20个常见氨基酸以外的氨基酸。
“磁感应受体蛋白”(或称“Magnetoreceptor”,或称“MagR”)是本申请发明人在现代生物学研究中首个研究、得到、鉴定并命名的一种其核酸编码序列在生物体基因组中广泛存在并高度保守,可形成具有生物磁性单体或复合物的蛋白质。本发明提供的磁感应受体蛋白的核酸序列在大量不同物种的基因组中都存在,其编码的蛋白序列高度保守,并具有多个高度保守的结构域,如结合铁和/或硫的结构域。磁感应受体蛋白能形成具有特定形态结构、具有自身磁性的纯合蛋白复合物,和/或能与隐花色素蛋白(Cryptochrome,简称为Cry)形成杂合蛋白复合物。 “蛋白家族”是指生物物种中存在的一系列具有同源性结构域或序列、进化上相关的、功能相同或相似的蛋白质。磁感应受体蛋白的蛋白家族中包括家鸽磁感应受体蛋白和黑脉金斑蝶磁感应受体蛋白,其氨基酸序列分别如SEQ ID NO:1和SEQ ID NO:2所示。磁感应受体蛋白的蛋白家族的其它成员包括果蝇(Drosophila melanogaster)、黑脉金斑蝶(Danaus plexippus)、蜜蜂(Apis mellifera)、文昌鱼(Branchiostoma floridae)、斑马鱼(Danio rerio)、蟒蛇(Python bivittatus)、家鸽(Columba livia)、草雀(Taeniopygia guttata)、鸡(Gallus gallus)、鲸鱼(Balaenoptera acutorostrata)、蝙蝠(Myotis lucifugus)、裸鼹鼠(Heterocephalus glaber)、小鼠(Mus musculus)、人(Homo sapiens)的磁感应受体蛋白,其氨基酸序列分别如SEQ ID NO:3、SEQ ID NO:2、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:1、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14所示。磁感应受体蛋白的纯合蛋白复合物或磁感应受体蛋白与隐花色素蛋白形成的杂合蛋白复合物具有特定的蛋白立体结构,例如长条形;在所述纯合蛋白复合物或杂合蛋白复合物中,具有多个铁原子,其在棒状结构蛋白质的中央也形成有序排列,由此使得所述蛋白复合物具有磁性。例如,多个所述磁感应受体蛋白发生线性聚合,并进而聚集形成棒状结构。其中,多个所述磁感应受体蛋白线性聚合形成两条蛋白长链;所述两条蛋白长链以螺旋形式结合,形成棒状结构的蛋白复合物。磁感应受体蛋白的纯合蛋白复合物或磁感应受体蛋白与隐花色素蛋白形成的杂合蛋白复合物中还包含多个铁原子;所述多个铁原子位于所述棒状结构蛋白复合物的中央。例如,每个形成所述蛋白复合物的单个磁感应受体蛋白都结合铁原子,又例如,每个磁感应受体蛋白单体结合铁原子的位置都相同或相近,由此,在由磁感应受体蛋白单体线性聚合形成的棒状结构蛋白复合物中,所述多个铁原子在棒状结构的中央也形成有序排列。
物质的“磁性”是指能够产生磁场、具有吸引铁磁性物质(如铁、镍、钴等金属)的特性。
“蛋白质具有磁性”或者“磁性蛋白质”是指蛋白质或者蛋白质复合物自身具备磁性,体现出类似磁铁的磁极(南北极),可以被外源的磁场牵引运动,也具备吸引铁、钴、镍等铁磁性物质的性质,可作为磁 性材料。
“光磁性”是指物质受到光照后,磁学性质(如磁化率、磁晶各向异性、磁滞回线等)发生变化的现象,包括基于对光信号和磁场信号中的一种感应引发另一种基于光或磁场的作用。
本文使用的“磁感应受体蛋白的活性片段”是指磁感应受体蛋白的部分或片段,其包含磁感应受体蛋白中维持它以类似于全长磁感应受体蛋白的方式并具有磁感应受体蛋白全部活性或部分活性的部分,或为具有该蛋白的多种活性中的某种或某几种活性的片段,例如其结构域片段。
本文使用的“磁感应受体蛋白的衍生物”是指,具有与磁感应受体蛋白的天然形式类似的一级和/或三级结构,但与所述天然形式相差一个或多个氨基酸残基(例如一个或多个氨基酸取代、插入和/或缺失)的蛋白(多肽),或是具有/额外具有其它可以与之结合的化学基团或蛋白(多肽)基团;这些衍生物具有或保持磁感应受体蛋白的全部或部分活性。所述可结合的化学基团包括例如多肽的翻译后的衍生化或修饰,例如PEG化和/或巯基基团。所述可结合的蛋白(多肽)基团包括例如His标签或IgG蛋白等。
术语“分离的”用于描述这样的物质(例如核酸和/或蛋白质),该物质不同于自然界中其天然存在或在原始细胞或生物环境中发现的形式的物质。该物质基本上不含在天然存在的环境中通常伴随该物质或与其反应的组分,或者说,该物质已从所述组分中移出。
“分离的蛋白”是这样的蛋白:它基本上与蛋白的天然来源中存在的至少一种组分或其它蛋白分离,或当化学合成所述蛋白时,它基本上不含有至少一种化学前体或其它化学药品。当存在小于约30%、20%、10%或5%(按干重计)的其它蛋白或其它化学药品(在本文中也称作“污染蛋白”或“污染化学药品”)时,在蛋白的制剂中蛋白“基本上分离于”或“基本上不含有”其它蛋白或其它化学药品。
分离的蛋白可以具有几种不同的物理形式。分离的蛋白可以作为全长新生的或未加工的多肽,或者作为部分加工的多肽,或者作为加工的多肽,或者它们的组合存在。
分离的多肽可以是非天然存在的多肽。例如,“分离的多肽”可以是“杂种多肽(hybrid peptide)”。“分离的多肽”也可以是通过氨基酸的添加、缺失或取代从天然存在的多肽衍生的多肽。分离的多肽也可以是“纯 化的多肽”,后者在本文中用于指基本上均质的制剂中基本上不含有其它细胞组分、其它多肽、病毒材料或培养基的特定多肽,或当化学合成所述多肽时,基本上不含有化学前体或与化学合成有关的副产物。“纯化的多肽”可以通过标准的纯化技术或通过化学合成从天然或重组宿主细胞得到,如技术人员显而易见的。
如本文所使用的,术语“相互作用”是指,2个蛋白结构域、片段或完整蛋白彼此表现出足够的物理亲和力,以便使所述2个“相互作用”蛋白结构域、片段或蛋白彼此物理上接近。相互作用可以来自一个或多个化学键的形成,其导致2个相互作用实体的连续且稳定的接近。相互作用也可以仅仅基于物理亲和力,这在共同定位(co-localize)2个蛋白方面同样有效。物理亲和力和化学键的实例包括但不限于,由电荷差异造成的力、疏水性、氢键、范德华力、离子力、共价键以及它们的组合。相互作用域、片段或蛋白之间的接近状态可以是瞬时的或永久的,可逆的或不可逆的。在任何情况下,其与2个实体的天然随机运动造成的接触形成对照且可以区分开。通常,通过相互作用域、片段或蛋白之间的结合,表现出“相互作用”。相互作用的实例包括抗原和抗体、配体和受体、酶和底物等之间的特异性相互作用。
如本文所使用的,术语“蛋白复合物”或“多肽复合物”是指一种复合单位,它是通过蛋白之间的相互作用形成的2个或更多个蛋白的组合。通常,通过特异性非共价结合亲和力将2个或更多个蛋白结合到一起,形成“蛋白复合物”。“纯合蛋白复合物”是指由同一种蛋白质组分通过聚合(或称之为“同源聚合”)形成的多聚物。“杂合蛋白复合物”是指由两种或者多种不同的蛋白质组分通过聚合(或称之为“异源聚合”)形成的多聚物。
术语“分离的蛋白复合物”是指在不同于其在自然界中天然存在或在原始细胞或生物环境中发现的形式的蛋白复合物。该蛋白复合物基本上不含在天然存在的环境中通常伴随该蛋白复合物或与其反应的组分,或者说,该蛋白复合物已从所述组分中移出。“分离的蛋白复合物”也可以是未在自然界发现的蛋白复合物。
“分离的”核酸分子是这样的,它基本上与核酸的天然来源中存在的至少一种其它核酸分子分离,或当化学合成所述核酸分子时,它基本上不含有至少一种化学前体或其它化学药品。“分离的”核酸分子也可以 是,例如,基本上不含有在该核酸的来源生物基因组DNA中在5'和3'末端天然侧接该核酸分子的至少一个核苷酸序列的核酸分子。在核酸分子的制剂中,当存在小于约30%、20%、10%或5%(按干重计)的其它核酸分子或其它化学药品(在本文中也称作“污染核酸分子”或“污染化学药品”)时,核酸分子“基本上分离于”或“基本上不含有”其它核酸分子或其它化学药品。
“序列”是指聚合物中单体出现的线性次序,例如,多肽中氨基酸的次序或多核苷酸中核苷酸的次序。“核苷酸序列”指单链或双链形式的聚合物中脱氧核糖核苷酸或核糖核苷酸残基的排列。核酸序列可以由包含下述碱基的天然核苷酸组成:胸腺嘧啶、腺嘌呤、胞嘧啶、鸟嘌呤和尿嘧啶;分别缩写为T、A、C、G和U,和/或所述天然核苷酸的合成类似物。
核苷酸序列或氨基酸序列比对和序列的同一性百分比可用设计用于鉴别同源序列的多种比较方法来确定,这些方法包括但不限于生物信息计算包(Inc.,Madison,WI)的程序。除非另外说明,否则本文提供的序列多重比对用Clustal V比对方法(Higgins和Sharp,1989,CABIOS.5:151-153)采用默认参数(空位罚分=10,空位长度罚分=10)执行。用Clustal V方法进行成对比对和蛋白质序列的同一性百分比计算的默认参数为KTUPLE=1、空位罚分=3、窗口(WINDOW)=5和DIAGONALS SAVED=5。而对于核酸,这些参数为KTUPLE=2,空位罚分=5,窗口=4和DIAGONALS SAVED=4。用Clustal V程序比对序列后,可通过查看同一程序中的“序列距离”表来获得“同一性百分比”和“趋异”值。
“重组DNA构建体”指在自然界中通常不会一起存在的核酸片段的组合。因此,重组DNA构建体可包含源于不同来源的调控序列和编码序列,或源于相同来源但以不同于通常天然存在的方式排列的调控序列(如启动子等)和编码序列。
分子生物学和蛋白-蛋白相互作用领域的技术人员使用常规实验,可以在磁感应受体蛋白或其活性片段或衍生物中导入氨基酸序列变异。例如,本领域技术人员可以导入位点特异性的突变,例如将“CTT”密码子变成“ATT”密码子,从而造成天然多肽中的亮氨酸残基被替换为合成同源物中的异亮氨酸残基。
在另一个一般方面,本发明提供了制备本发明蛋白复合物的方法。本发明的蛋白复合物可以通过多种方法来制备。具体而言,蛋白复合物可以直接分离自含有该蛋白复合物的动物组织样品,例如人组织样品。蛋白复合物也可以分离自重组表达蛋白复合物成员的宿主细胞。或者,可以通过组合蛋白复合物的个别成员来体外构建蛋白复合物。
本领域技术人员会明白,为了表达蛋白或蛋白复合物的目的,在本发明中可以使用任何重组表达方法。例如,可以将编码MagR和Cry的核酸导入合适的宿主细胞中。通常,将核酸(优选地以DNA形式)整合入表达载体中,从而在导入宿主细胞后指导生产相互作用蛋白成员。许多类型的载体可以用于本发明。获知本公开内容的技术人员应了解构建用于本发明目的的表达载体的方法。
通常,表达载体包括具有启动子的表达盒,所述启动子可操作地连接到编码相互作用蛋白成员的DNA上。所述启动子可以是天然启动子,即在天然存在的细胞中发现的负责在该细胞中表达相互作用蛋白成员的启动子。或者,所述表达盒可以是嵌合表达盒,即,具有不是在天然存在的细胞中负责表达相互作用蛋白成员的天然启动子的异源启动子。表达载体还可以包括用于在宿主细胞中复制载体的DNA复制起点。优选地,表达载体包括用于在例如大肠杆菌中扩增载体的复制起点,和用于仅选择和维持携带表达载体的那些宿主细胞的选择标记。另外,表达盒优选地也含有诱导型元件,其功能是控制从编码相互作用蛋白成员的DNA的转录。其它调节序列例如转录增强子序列和翻译调节序列(例如,SD序列)也可以可操作地包含在表达盒中。终止序列(例如来自牛生长激素、SV40和lacZ)也可以可操作地与表达盒中编码蛋白成员的DNA连接。当需要在单个宿主细胞中表达2个或更多个相互作用蛋白成员时,编码相互作用蛋白成员的DNA片段可以整合入单个载体或不同载体中。
通过本领域已知的任意技术,例如,通过直接DNA转化、显微注射、电穿孔、病毒感染、脂转染、基因枪等,可以将表达载体导入宿主细胞中。或者可通过常规技术例如稳定细胞系的选择或位点特异性的重组,可以将表达载体整合入宿主细胞的染色体中。
可以将载体构建体设计成适合在各种宿主细胞中表达,宿主细胞包括但不限于细菌、酵母细胞、植物细胞、昆虫细胞和哺乳动物和人细胞。
其中,可以将哺乳动物细胞用作用于表达融合蛋白和检测蛋白-蛋 白相互作用的宿主细胞。为此,实际上可以使用任何哺乳动物细胞,包括正常组织细胞、稳定的细胞系和转化的肿瘤细胞。方便地,使用哺乳动物细胞系,例如CHO细胞、Jurkat T细胞、NIH 3T3细胞、HEK-293细胞、CV-1细胞、COS-1细胞、HeLa细胞、VERO细胞、MDCK细胞、WI38细胞等。哺乳动物表达载体是本领域众所周知的,且许多可商业得到。用于在哺乳动物细胞中转录嵌合基因的合适启动子的实例包括源自下述病毒的病毒转录启动子:腺病毒、猿猴病毒40(SV40)(例如,SV40的早期和晚期启动子)、劳斯肉瘤病毒(RSV)和巨细胞病毒(CMV)(例如,CMV立即早期启动子)、人免疫缺陷病毒(HIV)(例如,长末端重复序列(LTR))、痘苗病毒(例如,7.5K启动子)和单纯疱疹病毒(HSV)(例如,胸苷激酶启动子)。也可以使用诱导型启动子。合适的诱导型启动子包括,例如,四环素响应元件(TRE)(参见Gossen等人,Proc.Natl.Acad.Sci.USA,89:5547-5551(1992))、金属硫蛋白IIA启动子、蜕皮激素-响应启动子和热激启动子。用于在哺乳动物细胞中复制和维持表达载体的合适复制起点包括,例如,在有Epstein Barr核抗原存在下的Epstein Barr复制起点(参见Sugden等人,Mole.Cell.Biol.,5:410-413(1985))和在有SV40T抗原(它存在于COS-1和COS-7细胞中)存在下的SV40复制起点(参见Margolskee等人,Mole.Cell.Biol.,8:2837(1988))。合适的选择标记包括,但不限于,赋予对新霉素、潮霉素、zeocin等的抗性的基因。许多可商业得到的哺乳动物表达载体可以用于本发明,包括,例如,pCEP4、pcDNAI、pIND、pSecTag2、pVAX1、pcDNA3.1和pBI-EGFP和pDisplay。使用任何已知的技术,例如磷酸钙沉淀、脂转染、电穿孔等,可以将载体导入哺乳动物细胞。可以将诱饵载体和猎物载体共转化进相同细胞,或者,导入2个不同的细胞,随后通过细胞融合或其它合适的技术将它们融合到一起。
允许通过病毒感染将重组基因导入细胞中的病毒表达载体,也可以用于表达融合蛋白。本领域普遍已知的病毒表达载体包括基于腺病毒、牛乳头瘤病毒、鼠干细胞病毒和反转录病毒等的病毒载体。
使用上述的重组方法,也可以容易地表达天然相互作用蛋白成员的同源物和片段。例如,为了表达蛋白片段,可以选择整合入表达载体中的DNA片段,从而使它仅仅编码该蛋白片段。同样,使用编码杂种蛋白的重组DNA,可以表达特定的杂种蛋白。类似地,同源物蛋白可以从 编码该同源物蛋白的DNA序列表达。通过使用重组DNA技术操作编码天然蛋白的序列,可以得到编码同源物蛋白的DNA序列。为此,可以使用本领域普遍已知的技术,进行随机的或定点诱变。
另外,通过使某些用于修饰蛋白的部分经由化学方式连接到天然蛋白的氨基酸侧链上,由此制备本发明的蛋白的衍生物。
如果需要,可以测试这样产生的同源物和衍生物,以确定它们是否能与它们预期的配体相互作用,以形成蛋白复合物。测试可以通过例如酵母双杂交系统或本领域已知的检测蛋白-蛋白相互作用的其它方法来进行。
通过本领域技术人员众所周知的常规生化和免疫化学方法,可以纯化表达的蛋白。转染的真核细胞或生物组织样品可以匀浆,并在将不同细胞组分进行分离的适宜条件下分级分离。通常,将细胞裂解物在蔗糖梯度(或基于大小和密度分离细胞组分的其它材料)上运行。使用本领域技术人员众所周知的方法,例如免疫印迹或免疫沉淀方法,用适宜的抗体分析目标蛋白的存在。
然后将纯化的蛋白用于亲和层析处理:将来自培养的细胞或匀浆的组织样品的提取物在适宜的缓冲液中装载到柱上,目的蛋白或蛋白复合物可与柱上的成分结合;洗脱非结合蛋白;然后使用各种方法,例如pH梯度或盐浓度梯度,洗脱结合蛋白或蛋白复合物;最后可以通过二维凝胶电泳,分离洗脱的蛋白,也可以通过微量测序进行鉴别。所有这些方法是本领域技术人员众所周知的。
纯化的目标蛋白或复合物,也可以用于在兔子、小鼠、大鼠、鸡、山羊、绵羊、猪、豚鼠、牛和马中制备抗体。用于抗体生成和表征的方法是本领域技术人员众所周知的。
附图说明
图1家鸽MagR蛋白的聚丙烯酰胺凝胶电泳分析图;
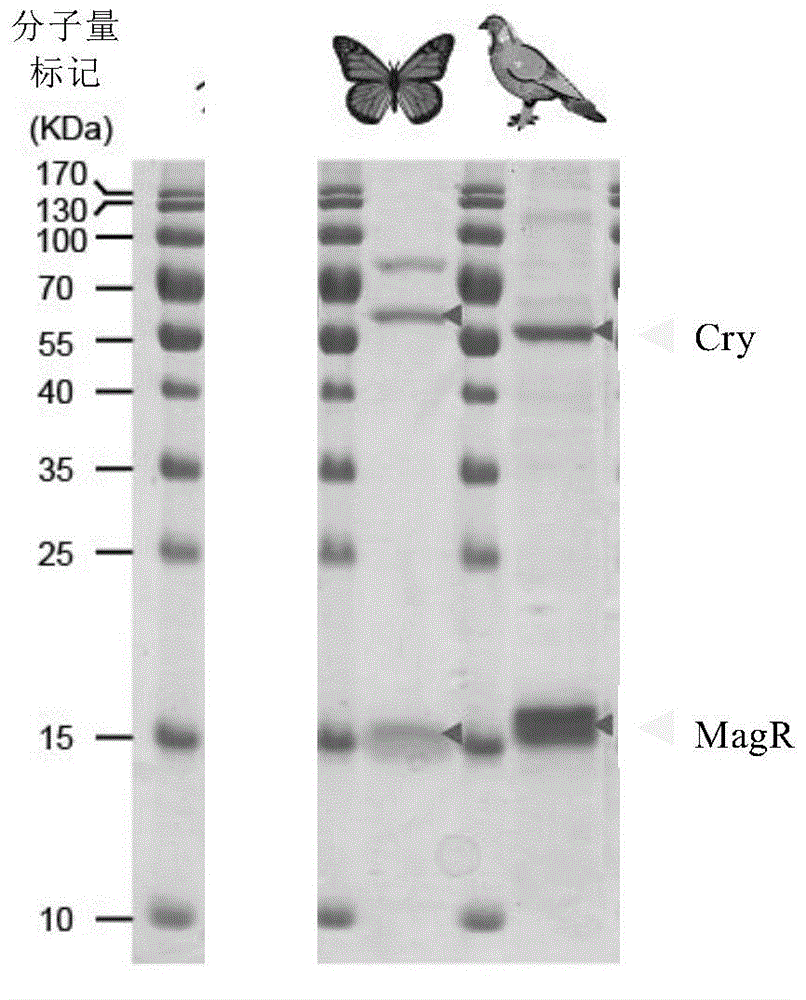
图2家鸽和黑脉金斑蝶的MagR-Cry蛋白复合物的聚丙烯酰胺凝胶电泳分析图;
图3家鸽MagR蛋白样品全波长扫描结果图;
图4家鸽MagR形成的纯合蛋白复合物或杂合蛋白复合物的电镜观察结果图。A:家鸽MagR形成的纯合蛋白复合物的横截面结构;B: 家鸽MagR形成的纯合蛋白复合物的纵截面结构;C:家鸽MagR-Cry4杂合蛋白复合物的横截面结构;D:家鸽MagR-Cry4杂合蛋白复合物的纵截面结构;
图5家鸽MagR纯合蛋白复合物的结构图。A:家鸽MagR纯合蛋白复合物的横截面的电镜形态和结构示意;B:家鸽MagR纯合蛋白复合物的纵截面的电镜形态和结构示意;
图6家鸽MagR和Cry形成的杂合蛋白复合物的结构图。A:杂合蛋白复合物的横截面;B:杂合蛋白复合物的纵截面;
图7家鸽MagR纯合蛋白复合物晶体受磁场影响的电镜观察结果图。A:电子显微镜照片;B:统计结果;
图8用铁粉从细胞裂解液中分离和纯化家鸽MagR-Cry4杂合蛋白复合物的实验示意和电泳检测结果图;
图9家鸽MagR纯合蛋白复合物晶体在旋转磁场中同步旋转实验结果图;
图10黑脉金斑蝶MagR蛋白的聚丙烯酰胺凝胶电泳分析图;
图11黑脉金斑蝶MagR-Cry1杂合蛋白复合物的晶体在旋转磁场中同步旋转实验结果图;
图12家鸽MagR突变体蛋白样品全波长扫描结果图;
图13各物种MagR蛋白的序列比对图。
具体实施方式
实施例1:家鸽MagR蛋白的表达和纯化
1.人工合成编码以下氨基酸序列的插入片段(表达框):
MWSHPQFEKGGGTSMASSASSVVRATVRAVSKRKIQATRAALTLTPSAVQKIKELLKDKPEHVGVKVGVRTRGCNGLSYTLEYTKSKGDSDEEVVQDGVRVFIEKKAQLTLLGTEMDYVEDKLSSEFVFNNPNIKGTCGCGESFNI
其中,第2-9个氨基酸WSHPQFEK为Strep II亲和标签序列;第10-14个氨基酸GGGTS为链接区序列;带下划线的序列为家鸽(Columba livia)的MagR的蛋白质序列,即如SEQ ID NO:1所示的氨基酸序列。
2.将上述合成的编码家鸽MagR蛋白的氨基酸序列且N端具有Strep II亲和标签的插入片段通过SalI/XhoI位点克隆到pET-21a(+)质粒(Novagen)。
3.将上述包含具有编码家鸽MagR蛋白的氨基酸序列且N端具有Strep II亲和标签的插入片段的质粒转化大肠杆菌BL21(DE3)(商购)。挑取单克隆接种至LB液体培养基中扩大培养,低温诱导目的蛋白的表达,20-24小时后收菌。
4.将上述得到的表达了MagR蛋白的转化菌用缓冲液重悬后,用超声破碎仪裂解,完成后进行高速离心,取上清液进行亲和纯化。通过Strep-Tactin亲和柱亲和纯化后,进行阴离子交换柱或者分子筛凝胶层析进一步纯化,得到纯度较高的家鸽MagR蛋白。纯化全过程在4℃进行。纯化后得到的MagR蛋白在浓度较高时呈现明显的棕黄色或棕褐色,这提示蛋白质中结合了二价或三价的铁。
5.对收集的MagR蛋白样品进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。实验结果如图1所示,其中各泳道的样品为:(1):蛋白分子量标准;(2):纯化的含有Strep II亲和标签的家鸽MagR蛋白,分子量约为15KDa。
实施例2:家鸽MagR蛋白形成二聚体和多聚体的纯合复合物
将实施例1中表达和纯化的家鸽MagR蛋白,在通过Strep-Tactin亲和柱亲和纯化后进一步用Superdex 20010/300GL纯化柱(GE Healthcare)进行分子筛凝胶层析,即凝胶过滤(Gel-filtration)或凝胶排阻层析(Size-exclusion chromatography)。
样品的分子筛凝胶层析呈现出单体峰、二聚体峰和多聚体峰,分别收集三个峰的样品,获得纯化蛋白。这显示,纯化的MagR蛋白在分子筛凝胶层析中以三种形式存在。与蛋白质分子量标准进行比较可知,三个峰(洗脱体积大约为:17.5ml、16.2ml、9.5ml)的大致分子量为15KDa、30KDa和大于200KDa,这与MagR蛋白的单体、二聚体和多聚体的分子量相吻合。由于Superdex S200的分辨率最高为约200KDa,所以,尚无法判断多聚体的分子量和多聚体所含单体个数。
实施例3:家鸽MagR蛋白和家鸽Cry4蛋白形成的杂合蛋白复合物的表达和纯化
1.人工合成编码以下氨基酸序列的插入片段(表达框):
MHHHHHHHHHHGGGGSTSMPHRTIHLFRKGLRLHDNPTLLAALESSETIYPVYVLDRRFLASAMHIGALRWHFLLQSLEDLHKNLSRLGARLLVIQGEYESVLRDHVQKWNITQVTLDAEMEPFYKEMEANIRRLGAELGFEVLSRVGHSLYDTKRILDLNGGSPPLTYKRFLHILSQLGDPEVPVRNLTAEDFQRCMSPEPGLAERYRVPVPADLEIPPQSLSPWTGGETEGLRRLEQHLTDQGWVANFTKPRTIPNSLLPSTTGLSPYFSMGCLSVRTFFQRLSNIYAQAKHHSLPPVSLQGQLLWREFFYTVASATQNFTQMAGNPICLQIHWYEDAERLHKWKTAQTGFPWIDAIMTQLRQEGWIHHLARHAVACFLTRGDLWISWEEGMKVFEELLLDADYSINAGNWMWLSASAFFHHYTRIFCPVRFGKRTDPEGQYIRKYLPVLKNFPTKYIYEPWTASEEEQRQAGCIIGRDYPFPMVNHKEASDRNLQLMRRVREEQRGTAQLTR
其中,第2-11个氨基酸为10个组氨酸的His亲和标签序列;第12-18个氨基酸GGGGSTS为链接区序列;带下划线的序列为家鸽的Cry4的氨基酸序列,即如SEQ ID NO:15所示的氨基酸序列。
2.将上述合成的编码家鸽Cry4蛋白的氨基酸序列并且N端具有His亲和标签的插入片段通过SalI/XhoI位点克隆到pET-21a(+)质粒(Novagen)。
3.将前述具有家鸽Cry4蛋白的编码基因并融合了组氨酸标签(His-tag)的质粒与实施例1步骤2得到的具有家鸽MagR蛋白的编码基因并融合了StrepII标签的质粒共同转化大肠杆菌BL21(DE3),挑取含有两种质粒的大肠杆菌单克隆接种至LB液体培养基中扩大培养,低温诱导目的蛋白的表达,20-24小时后收菌。
4.将上述得到的共表达了家鸽MagR蛋白和Cry4蛋白的转化菌用缓冲液重悬后,用超声破碎仪裂解,完成后进行高速离心,取上清液进行亲和纯化。通过Ni-NTA亲和柱亲和纯化后,再通过Strep-Tactin亲和柱纯化,得到家鸽MagR蛋白和Cry4蛋白形成的MagR-Cry4杂合蛋白复合物。进一步通过阴离子交换柱和分子筛凝胶层析纯化,得到纯度较高的杂合蛋白复合物。纯化全过程在4℃和存在外加磁场的条件下进行。外加磁场通过下述方法施加:当样品过亲和柱时,将两个相同的条形磁铁分别绑在亲和柱的两侧,该两个相同的条形磁铁的南极和北极分别相对,提供一个均匀稳定的磁场。结果显示,在纯化时施加外加磁场(例如,外加磁场的强度是地球磁场的10-100倍),纯化蛋白的产率有显著增加;在洗脱纯化蛋白时,撤去磁场,蛋白质洗脱效率更高。
5.对收集的家鸽MagR-Cry4杂合蛋白复合物样品进行变性聚丙烯酰 胺凝胶电泳(SDS-PAGE)分析。实验结果如图2所示,其中从左向右第5泳道加载的样品为蛋白质分子量标准,第6泳道加载的样品为家鸽MagR-Cry4杂合蛋白复合物。结果:由于使用变性电泳分析,泳道6中显示出两种蛋白质样品,即含有Strep II亲和标签的家鸽MagR蛋白(分子量约为15KDa)以及含有His标签的家鸽Cry4蛋白(分子量约为70KDa)。
实施例4:家鸽MagR蛋白以及MagR纯合蛋白复合物含有铁的证明实验
将实施例2得到的家鸽MagR蛋白的单体峰样品用分光光度计(Nanodrop 2000)进行全波长扫描。
如图3所示,结果显示在Fe元素的特征吸收位置(320nm和410nm)有吸收峰。第一个吸收峰为UV280的蛋白质吸收峰。
将实施例2中得到的家鸽MagR蛋白形成的二聚物或多聚物样品,用分光光度计(Nanodrop 2000)进行全波长扫描。结果与图3相似。
实施例5:家鸽MagR纯合蛋白复合物和家鸽MagR-Cry4杂合蛋白复合物的电子显微镜图像和结构
将实施例2中经分子筛凝胶层析纯化后获得的家鸽MagR纯合蛋白复合物的蛋白样品以及实施例3中经分子筛凝胶层析纯化后的家鸽MagR-Cry4杂合蛋白复合物的蛋白样品采用乙酸铀或甲酸铀负染,制备蛋白质的负染电镜样品,将样品放置于透射电镜下观察并拍照,按照标准的电镜结构分析方法解析其结构,并测量大小(包括蛋白长度和宽度)。所述电镜结构分析方法可参照Ohi,M.,et al.(2004),"Negative Staining and Image Classification-Powerful Tools in Modern Electron Microscopy."Biol Proced Online 6:23-34。
结果如图4所示。其中A和B是家鸽MagR形成的纯合蛋白复合物的电镜结构,其中A为横截面结构,B为纵截面结构。C和D为家鸽MagR-Cry4杂合蛋白复合物的电子显微镜结构,其中C为横截面结构,D为纵截面结构。MagR和/或Cry蛋白在复合物中的组织形式和相对位置的示意图如右侧所示,并标出了在电镜下测量的大小尺寸(单位为纳米)。
如图4的A和B显示,家鸽MagR纯合蛋白复合物呈现为长条形的棒状结构,长度为约20-24纳米长,宽度为约7-11纳米。“宽度”是指电镜下该棒状结构的横截面为圆形或类似圆形的形状时测量到的半径。根据同源晶体结构和分子模型计算,结果表明该复合物具有约20个MagR蛋白。如图4的C和D显示,家鸽MagR-Cry4杂合蛋白复合物呈现为长条形的棒状结构,长度为约20-24纳米长,宽度为约13-18纳米。根据同源晶体结构和分子模型计算,结果表明该多聚体具有约20个MagR蛋白和10个Cry4蛋白。
图5为家鸽MagR纯合蛋白复合物的结构图。图5中,A显示复合物的横截面的电镜形态和结构示意,B显示复合物的纵截面的电镜形态和结构示意。每一个MagR纯合蛋白复合物包括约20个MagR蛋白,有序排列形成线性双螺旋聚合体,其中每10个MagR蛋白单体以线性聚合的形式首尾相接,形成两条蛋白长链,两条蛋白长链以螺旋形式结合,由此形成长条形棒状结构的蛋白复合物。图5中的虚线框显示出一个MagR四聚体的结构:如图所示的MagR纯合蛋白复合物棒状结构由5个该四聚体构成。另外,每一个MagR蛋白包括一个2Fe2S的铁硫中心,也即每一个MagR蛋白包括一个铁结合位点,结合了2个铁原子。整个棒状的纯合蛋白复合物包含约20个铁结合位点,结合了约40个铁原子。所述多个铁原子位于棒状结构的蛋白复合物的中央。磁感应受体蛋白单体结合铁原子的位置相同或相近,处于棒状结构的蛋白复合物的立体结构的内部,由此,在磁感应受体蛋白单体线性聚合棒状结构的蛋白复合物中,所述多个铁原子也在蛋白复合物中形成有规律的排列。
图6为家鸽MagR-Cry4杂合蛋白复合物的结构图。图6中,A显示杂合蛋白复合物的横截面的电镜形态(左上)、组织形式(左下)和结构示意(右),B显示杂合蛋白复合物的纵截面的电镜形态(左上)、组织形式(左下)和结构示意(右)。在MagR-Cry4杂合蛋白复合物中,在由约20个MagR组成的纯合蛋白复合物所形成的棒状线性双螺旋聚合体的外围,有约10个感光的Cry4蛋白缠绕排列,从而形成杂合复合物。同样地,整个棒状的杂合蛋白复合物包含约20个铁结合位点,结合了约40个铁原子。所述多个铁原子位于棒状结构的蛋白复合物的中央,也形成有规律的排列。
实施例6:家鸽MagR蛋白复合物结晶
将实施例2中经分子筛凝胶层析纯化后获得的家鸽MagR纯合蛋白复合体的蛋白样品以及实施例3中经分子筛凝胶层析纯化后的家鸽MagR-Cry4杂合蛋白复合物的蛋白样品浓缩,然后进行结晶。蛋白质结晶方法按照如教科书McPherson,A.(2009).Introduction to macromolecular crystallography.Hoboken,N.J.,Wiley-Blackwell记载的标准实验流程采用悬滴法进行。在硅化过的显微镜盖玻片上将蛋白质溶液与等体积的沉淀剂溶液混合形成液滴;盖玻片被倒置在盘子的空穴上方,空穴中放置了所需的沉淀剂溶液,在盖玻片放置前,在空穴的边缘涂抹油或脂以密封空穴。大约2-7天后可以观察到MagR蛋白复合物形成的晶体。
图9显示了本发明的家鸽MagR蛋白形成的纯合复合物的晶体照片。
结果:共观察到两种类型的晶体:
第一种是黑色不透明的长方体形状的晶体(参见图9中上排给出的晶体照片;所使用的结晶条件为:0.1M HEPES,pH 7.5,3.0M氯化钠),其长度约为0.5mm,显示铁元素在晶体中已被氧化成均一的三价。第二种晶体为浅黄色或黄色的透明晶体(参见图9中下排给出的晶体照片;所使用的结晶条件为:0.1M BIS-TRIS,pH6.5,3.0M氯化钠),形状不规则或呈小片状,显示铁元素可能以二价存在。在以下实施例的实验中证明,两种晶体都表现出非常强的磁性。
本发明的家鸽MagR蛋白与Cry4蛋白形成的杂合复合物的晶体的形态与图9的照片显示的晶体相似。
实施例7:家鸽MagR蛋白复合物的磁性测试
家鸽MagR纯合蛋白复合物以及家鸽MagR-Cry4杂合蛋白复合物的磁性测试通过以下几个实验来进行:
(1)电子显微镜下的磁性测试:
在实施例5中描述的电镜分析制样中,将实施例2中经分子筛凝胶层析纯化后获得的家鸽MagR纯合蛋白复合物的蛋白样品以及实施例3中经分子筛凝胶层析纯化后的家鸽MagR-Cry4杂合蛋白复合物的蛋白样品制备负染电镜样品,此时在电镜铜网样品上标记制样时的地球磁场 方向或者人工外加的磁场方向,在电镜得到的蛋白颗粒的图像中,统计所有的棍状的蛋白复合物颗粒的方向(蛋白为长条形棒状,其方向是指该蛋白长度方向,即长轴的轴向),按照图示的三个方向统计(平行于地球或者外加磁场方向的,垂直于地球或者外加磁场方向的,以及在两者之间不能归于上述两个方向的),计算各个方向的棍状蛋白复合物所占的比例。
结果如图7所示。图7为利用电子显微镜对MagR纯合蛋白复合物在磁场下的排列方向进行研究,显示MagR蛋白复合物具有自身磁性,达到了类似“蛋白质指南针”的效果。图7的A为电子显微镜照片,其中用深色方框标示平行于磁场方向(即与磁场方向相同或相差小于等于30度)的蛋白质复合物颗粒,浅色方框标示垂直于磁场方向(即与磁场垂直的方向相同或相差小于等于30度)的蛋白质复合物颗粒,圆圈显示介于两者之间的其它方向。图7的B显示对于大样本的颗粒数目按排列方向进行统计的结果。每次实验包括大约1500个蛋白复合物颗粒进行统计分析,实验重复三次,取平均值和标准差作图。图7的B中横坐标为磁场的强度,以mT为单位,地球磁场为0.04mT(以北京的地理位置为准),试验中所采用的外加的磁场通过永磁铁获得,磁场强度经过磁力计测量为1mT。纵坐标为沿着三个不同的方向(平行于地球磁场或者外加磁场的方向,垂直于地球磁场或者外加磁场的方向,介于两者之间的其它方向)排列的MagR蛋白复合物在所有蛋白复合物中所占的比例。结果显示,家鸽磁感应受体蛋白MagR形成的纯合蛋白复合物有将近或超过一半的蛋白质颗粒顺应(平行于)地球磁场或者外加人工磁场的方向。增加磁场强度,平行于磁场方向的蛋白质颗粒所占比例将随之上升,其它两个方向的比例将相应地下降。这充分说明即使在微观条件下的纳米尺度的蛋白质颗粒也呈现了非常明显的磁性,具备与指南针类似的物理性质。蛋白质颗粒在磁场中的方向不是象宏观世界的指南针一样100%地顺应磁场方向分布,是因为在微观的纳米尺度下,分子热运动和溶液中的布朗运动严重影响了蛋白质颗粒的取向,使得微观粒子(如本实验中的纳米尺度下的蛋白质颗粒)的取向只遵循统计物理学的规律。
本发明的家鸽MagR蛋白与Cry4蛋白形成的杂合复合物的晶体受磁场影响的实验和电镜观察结果与图7的照片显示的相似。
(2)利用蛋白质的磁性对蛋白质进行分离和纯化:
家鸽MagR纯合蛋白复合物和家鸽MagR-Cry4杂合蛋白复合物可用铁粉从细胞裂解液中快速分离和纯化出来,表明它们均具有磁性。
以家鸽MagR-Cry4杂合蛋白复合物为例,具体方法如图8所示:将实施例3中共表达MagR与Cry4蛋白质的大肠杆菌细胞收集起来,用缓冲液重悬,超声破碎后取上清液,向其加入市售的纳米铁粉颗粒(海狸生物科技有限公司,#70301),室温孵育10min后,用标准TBS缓冲液清洗铁粉颗粒,然后用蛋白电泳上样缓冲液对铁粉进行洗脱,对洗脱液进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE),分析蛋白成分。
结果显示,经上述方法得到的纳米铁粉洗脱液中含有对应的蛋白。如图8所示,在实施例3中共表达MagR与Cry4蛋白质的大肠杆菌细胞的样品中经上述方法得到的纳米铁粉洗脱液中同时含有分子量约为15KDa的条带(MagR)和约为70KDa的条带(Cry4)。
另外,在实施例1中表达家鸽MagR的大肠杆菌细胞的样品中经上述方法得到的纳米铁粉洗脱液中则含有分子量约为15KDa的条带(MagR)。
(3)蛋白质晶体的磁性检测:
将实施例6中获得的MagR纯合蛋白复合物的晶体或MagR-Cry4杂合蛋白复合物的晶体置于光学显微镜下观察,在显微镜的载物台上安装旋转的磁场,保持均匀的磁场强度(10高斯)。将晶体生长的液滴(其中含有蛋白质晶体)置于旋转磁场的中心。图9为家鸽MagR纯合蛋白复合物晶体在旋转磁场中同步旋转实验结果图。如图9所示,在磁场(圆圈中指针方向为磁场方向)旋转的时候,可以观察到蛋白质晶体几乎完全同步地沿着磁场旋转,如同由磁铁构成的指南针一样。当用磁铁去接近蛋白质晶体时,蛋白质晶体会立即靠近,当颠倒磁铁的磁极时,蛋白质晶体会即刻远离并颠倒方向,然后重新靠近,显示蛋白质形成的晶体如同磁铁一样,具有自身的磁性和磁极。
本发明的家鸽MagR蛋白与Cry4蛋白形成的杂合复合物的晶体在旋转磁场中同步旋转实验的结果与图9的照片显示的相似。
另外,当用铁磁性物质(如铁棒)接近前述晶体生长的液滴(其中含有蛋白质晶体)时,蛋白质晶体会向该铁磁性物质迅速靠近,甚至飞出液滴去接近该铁性物质,显示蛋白质晶体具备非常强的磁性。
实施例8:黑脉金斑蝶MagR蛋白的表达和纯化
1.人工合成编码以下氨基酸序列的插入片段(表达框):
MWSHPQFEKGGSTSMSTKTIASATVRAVKKRLLPSRAALVLTSSAVNKVKEIMAKEEGKGYIGLKVGVRQRGCNGLSYTLDYATSKGKLDEEVKQDGVTIIIDKKAQLTLLGTEMDFVEDKLSAEFVFNNPNIKGTCGCGESFSI
其中,第2-9个氨基酸WSHPQFEK为Strep II亲和标签序列;第10-14个氨基酸GGGTS为链接区序列;带下划线的序列为黑脉金斑蝶(或称美洲帝王蝶,拉丁名Danaus plexippus,以下也可简称为“蝴蝶”)的MagR的蛋白质序列,即如SEQ ID NO:2所示的氨基酸序列。
2.将上述合成的编码蝴蝶MagR蛋白的氨基酸序列并且N端具有Strep II亲和标签的插入片段通过SalI/XhoI位点克隆到pET-21a(+)质粒(Novagen)。
3.将上述包含具有编码蝴蝶MagR蛋白的氨基酸序列且N端具有Strep II亲和标签的插入片段的质粒转化大肠杆菌BL21(DE3)(商购)。挑取单克隆接种至LB液体培养基中扩大培养,低温诱导目的蛋白的表达,20-24小时后收菌。
4.将上述得到的表达了MagR蛋白的转化菌用缓冲液重悬后,用超声破碎仪裂解,完成后进行高速离心,取上清液进行亲和纯化。通过Strep-Tactin亲和柱亲和纯化后,进行阴离子交换柱或者分子筛凝胶层析进一步纯化,得到纯度较高的蝴蝶MagR蛋白。纯化全过程在4℃进行。纯化后得到的MagR蛋白在浓度较高时可呈现明显的棕黄色或棕褐色,这提示蛋白质中结合了二价或三价的铁。
5.对收集的MagR蛋白样品进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。实验结果如图10所示,其中各泳道的样品为:(1):蛋白质分子量标准;(2):纯化的含有Strep II亲和标签的蝴蝶MagR蛋白,分子量约为15KDa。
实施例9:黑脉金斑蝶MagR蛋白形成纯合复合物的实验
将实施例8中表达和纯化的蝴蝶MagR蛋白,在通过Strep-Tactin亲和柱亲和纯化后进一步用Superdex 200 10/300GL纯化柱(GE Healthcare)进行分子筛凝胶层析。
样品的分子筛凝胶层析呈现出单体峰、二聚体峰和多聚峰,分别收 集三个峰的样品,获得纯化蛋白。这显示,纯化的MagR蛋白在分子筛凝胶层析中以三种形式存在。与蛋白质分子量标准进行比较可知,三个峰的大致分子量为15KDa、30KDa和大于200KDa,这与MagR蛋白的单体、二聚体和多聚体的分子量相吻合。由于Superdex S200的分辨率最高为约200KDa,所以,尚无法判断多聚体的分子量范围和多聚体所含单体个数。
实施例10:黑脉金斑蝶MagR蛋白和Cry1蛋白形成的杂合蛋白复合物的表达和纯化
1.人工合成编码以下氨基酸序列的插入片段(表达框):
MHHHHHHHHHHGGGGSTSMLGGNVIWFRHGLRLHDNPSLHSALEDASSPFFPIFIFDGETAGTKMVGYNRMRYLLEALNDLDQQFRKYGGKLLMIKGRPDLIFRRLWEEFGIRTLCFEQDCEPIWRPRDASVRALCRDIGVSCREHVAHTLWNPDTVIKANGGIPPLTYQMFLHTVEIIGNPPRPVDDVDLNGVNFGSLPESFYREFVVFDKAPKPEDLGVFLENEDIRMIRWVGGETAALKQMQERLAVEYETFCRGSYLPTHGNPDLLGPPISLSPALRFGCLSVRRFYWSLQDLFQQVHQGRLASTQFITGQLIWREYFYTMSVNNPNYAQMSGNPICLDIPWKEPENDELQRWKEGRTGFPFVDAAMRQLRTEGWLHHVVRNTVASFLTRGTLWLSWEHGLQHFLKYLLDADWSVCAGNWMWVSSSAFEALLDSGECACPVRLGRRLEPTGHYVRRYVPELARMPGEYIYEPWRAPLEVQEAAGCVIGRDYPAPVVDHTAAAARNRANMQELRRLLEKAPPHCCPSSEDEVRQFMWLGDDSQPELTTT
其中,第2-11个氨基酸为10个组氨酸的His亲和标签序列;第12-18个氨基酸GGGGSTS为链接区序列;带下划线的序列为蝴蝶的Cry1的氨基酸序列,即如SEQ ID NO:16所示的氨基酸序列。
2.将上述合成的编码蝴蝶Cry1的氨基酸序列并且N端具有His亲和标签的插入片段通过SalI/XhoI位点克隆到pET-21a(+)质粒(Novagen)。
3.将前述具有蝴蝶Cry1蛋白的编码基因并融合了组氨酸标签(His-tag)的质粒与实施例8步骤2得到的具有蝴蝶MagR蛋白的编码基因并融合了StrepII标签的质粒共同转化大肠杆菌BL21(DE3),挑取含有两种质粒的大肠杆菌单克隆接种至LB液体培养基中扩大培养,低温诱导目的蛋白的表达,20-24小时后收菌。
4.将上述得到的共表达了蝴蝶MagR蛋白和Cry1蛋白的转化菌用缓冲液重悬后,用超声破碎仪裂解,完成后进行高速离心,取上清液进行亲 和纯化。通过Ni-NTA亲和柱亲和纯化后,再通过Strep-Tactin亲和柱纯化,得到蝴蝶MagR蛋白和Cry1蛋白形成的MagR-Cry1杂合蛋白复合物。进一步通过阴离子交换柱和分子筛凝胶层析纯化,得到纯度较高的杂合蛋白复合物。纯化全过程在4℃和存在外加磁场的条件下进行。外加磁场通过下述方法施加:当样品过亲和柱时,将两个相同的条形磁铁分别绑在亲和柱的两侧,该两个相同的条形磁铁的南极和北极分别相对,提供一个均匀稳定的磁场。结果显示,在纯化时施加外加磁场(例如,外加磁场的强度是地球磁场的10-100倍),纯化蛋白的产率有显著增加;在洗脱纯化蛋白时,撤去外加磁场,蛋白质洗脱效率更高。
5.对收集的蝴蝶MagR-Cry1蛋白复合物样品进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。实验结果如图2所示,其中从左向右第3泳道加载的样品为蛋白质分子量标准,第4泳道加载的样品为蝴蝶MagR-Cry1杂合蛋白复合物。结果:由于使用变性电泳分析,泳道4中显示出两种蛋白质样品,即含有Strep II亲和标签的蝴蝶MagR蛋白(分子量约为15KDa)以及含有His标签的蝴蝶Cry1蛋白(分子量约为70KDa)。
实施例11:黑脉金斑蝶MagR蛋白以及MagR纯合蛋白复合物含有铁的证明实验
将实施例9得到的蝴蝶MagR蛋白的单体峰样品用分光光度计(Nanodrop 2000)进行全波长扫描。结果与图3相似。
将实施例9中得到的蝴蝶MagR蛋白形成的二聚物或多聚物样品,用分光光度计(Nanodrop 2000)进行全波长扫描。结果与图3相似。
实施例12:黑脉金斑蝶MagR纯合蛋白复合物和黑脉金斑蝶MagR-Cry1杂合蛋白复合物的电子显微镜图像和结构
将实施例9中经分子筛凝胶层析纯化后获得的蝴蝶MagR纯合蛋白复合物的蛋白样品以及实施例10中经分子筛凝胶层析纯化后的蝴蝶MagR-Cry1杂合蛋白复合物的蛋白样品采用乙酸铀或者甲酸铀负染,制备蛋白质的负染电镜样品,将样品放置于透射电镜下观察并拍照,按照标准的电镜结构分析方法解析其结构,并测量大小(包括蛋白长度和宽度)。
电镜结果显示,蝴蝶MagR纯合蛋白复合物和蝴蝶MagR-Cry1杂合 蛋白复合物的结构形式与实施例5图4中观测到的家鸽MagR纯合蛋白复合物和MagR-Cry4杂合蛋白复合物的结构形式相同。
电镜观测到的结果显示,蝴蝶MagR纯合蛋白复合物呈现为长条形的棒状结构,长度为约20-24纳米长,宽度为约7-11纳米。根据同源晶体结构和分子模型计算,结果表明该复合物具有约20个MagR蛋白。电镜观测到的结果显示,蝴蝶MagR-Cry1杂合蛋白复合物呈现为棒状,长度为约20-24纳米长,宽度为约13-18纳米宽。根据同源晶体结构和分子模型计算,结果表明该复合物具有约20个MagR蛋白和10个Cry1蛋白。
电镜结果还显示,每一个MagR纯合蛋白复合物包括约20个MagR蛋白质,有序排列形成线性双螺旋聚合体,其中每10个MagR蛋白单体以线性聚合的形式首尾相接,形成两条蛋白长链,两条蛋白长链以螺旋形式结合,由此形成长条形棒状结构的蛋白复合物。
电镜结果还显示,在蝴蝶MagR-Cry1杂合蛋白复合物中,在由约20个MagR组成的蛋白复合物所形成的棒状线性双螺旋聚合体的外围,有约10个感光的Cry1蛋白质缠绕排列,从而形成杂合复合物。
实施例13:黑脉金斑蝶MagR蛋白复合物结晶
将实施例9中经分子筛凝胶层析纯化后获得的蝴蝶MagR纯合蛋白复合物的蛋白样品以及实施例10中经分子筛凝胶层析纯化后的蝴蝶MagR-Cry1杂合蛋白复合物的蛋白样品浓缩,然后进行结晶。蛋白质结晶方法按照如教科书McPherson,A.(2009).Introduction to macromolecular crystallography.Hoboken,N.J.,Wiley-Blackwell记载的标准实验流程采用悬滴法进行。
蝴蝶MagR纯合蛋白复合物的晶体和蝴蝶MagR-Cry1杂合蛋白复合物的晶体的形态与对应的家鸽MagR纯合蛋白复合物的晶体或家鸽MagR-Cry4杂合蛋白复合物的晶体类似,分别制备和观察到两种类型的晶体:第一种是黑色不透明的长方体形状的晶体,提示铁元素在晶体中已被氧化成均一的三价;第二种晶体为浅黄色或黄色的透明晶体,形状不规则或呈小片状,提示铁元素可能以二价存在。图11示出了蝴蝶MagR-Cry1杂合蛋白复合物的晶体照片,可见该晶体具有黑色不透明的长方体形状,长度约为0.5mm。
实施例14:黑脉金斑蝶MagR蛋白复合物的磁性测试
采用与实施例7中同样的方法对蝴蝶MagR蛋白形成的纯合蛋白复合物以及蝴蝶MagR-Cry1杂合蛋白复合物的磁性进行测试。结果显示,蝴蝶MagR纯合蛋白复合物和蝴蝶MagR-Cry1杂合蛋白复合物的磁性测试结果与家鸽的测试结果(如实施例7中观察到的)类似。这表明,蝴蝶MagR纯合蛋白复合物和蝴蝶MagR-Cry1杂合蛋白蛋白复合物具有磁性。
图11为蝴蝶MagR纯合蛋白复合物晶体在旋转磁场中同步旋转实验结果图。实验方法如实施例7的(3)所描述。如图11所示,可以观察到蝴蝶MagR-Cry1杂合蛋白复合物的晶体为黑色,并且在旋转磁场中发生同步旋转。同样,蝴蝶MagR纯合蛋白复合物的晶体在旋转磁场中也出现同步旋转的现象。
实施例15:家鸽MagR蛋白以及MagR纯合蛋白复合物具有结合铁的保守结构域的证明实验
根据实施例1、2和4描述的方法和步骤,测试将家鸽MagR的如SEQ ID NO:1所示的氨基酸序列中的三个半胱氨酸C60、C124、C126突变为丝氨酸(S)后得到的蛋白结合铁的能力。
即将实施例1步骤1中人工合成的插入片段改变为:MWSHPQFEKGGGTSMASSASSVVRATVRAVSKRKIQATRAALTLTPSAVQKIKELLKDKPEHVGVKVGVRTRGSNGLSYTLEYTKSKGDSDEEVVQDGVRVFIEKKAQLTLLGTEMDYVEDKLSSEFVFNNPNIKGTSGSGESFNI。
根据实施例1和2描述的方法和步骤表达和纯化具有上述C60S、C124S、C126S突变的家鸽MagR蛋白以及MagR纯合蛋白复合物。突变的家鸽MagR蛋白经过分子筛凝胶层析,也呈现出单体峰、二聚体峰和多聚体峰。分别收集三个峰的样品。将得到的蛋白样品分别根据实施例4描述的方法用分光光度计(Nanodrop 2000)进行全波长扫描。
如图12所示,结果显示上述突变蛋白形成的家鸽MagR单体蛋白的吸收曲线(实线所示)在Fe元素的特征吸收位置(320nm和410nm)没有吸收峰。作为对照的野生型的家鸽MagR蛋白以及MagR纯合蛋白复合物的吸收曲线(虚线所示)则显示在320nm和410nm有明显的吸收峰。类似的,根据前述方法经过分子筛凝胶层析和纯化后得到的突变 蛋白形成的家鸽MagR的二聚物或多聚物的吸收曲线在Fe元素的特征吸收位置(320nm和410nm)也没有吸收峰。
结果表明,家鸽MagR蛋白具有结合铁的结构域,其包括C60、C124、C126三个位点中的一个或多个。
实施例16:各物种MagR蛋白的序列比对
测序或根据NCBI数据库获得果蝇(Drosophila melanogaster)、黑脉金斑蝶(Danaus plexippus)、蜜蜂(Apis mellifera)、文昌鱼(Branchiostoma floridae)、斑马鱼(Danio rerio)、蟒蛇(Python bivittatus)、家鸽(Columba livia)、草雀(Taeniopygia guttata)、鸡(Gallus gallus)、鲸鱼(Balaenoptera acutorostrata)、蝙蝠(Myotis lucifugus)、裸鼹鼠(Heterocephalus glaber)、小鼠(Mus musculus)、人(Homo sapiens)的磁感应受体蛋白的氨基酸序列,其分别如SEQ ID NO:3、SEQ ID NO:2、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:1、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13或SEQ ID NO:14所示。
用Clustal V比对方法对获得的氨基酸序列进行比对。
图13是上述各物种MagR蛋白的序列比对的结果。其中从上至下的来源物种名称以及基因在NCBI的序列号(如果有的话)分别为:(1)果蝇(Drosophila melanogaster),基因序列号为NP_573062.1;(2)黑脉金斑蝶(Danaus plexippus);(3)蜜蜂(Apis mellifera),基因序列号为XP_624993.1;(4)文昌鱼(Branchiostoma floridae),基因序列号为XP_002589524.1;(5)斑马鱼(Danio rerio),基因序列号为NP_001020349.1;(6)蟒蛇(Python bivittatus),基因序列号为XP_007429307.1;(7)家鸽(Columba livia);(8)草雀(Taeniopygia guttata),基因序列号为XP_002194930.1;(9)鸡(Gallus gallus),基因序列号为XP_003643055.1;(10)鲸鱼(Balaenoptera acutorostrata);(11)蝙蝠(Myotis lucifugus),基因序列号为XP_006102189.1;(12)裸鼹鼠(Heterocephalus glaber),基因序列号为XP_004879403.1;(13)小鼠(Musmusculus),基因序列号为NP_081197.1;(14)人(Homo sapiens),基因序列号为NP_112202.2。其中(2)黑脉金斑蝶、(7)家鸽和(10)鲸鱼的序列为本申请发明人测序获得。
结果显示,本申请发明人首次研究、制得、鉴定并命名的磁感应受体 蛋白的核酸编码序列在生物体基因组中广泛存在。本发明提供的磁感应受体蛋白的核酸序列在大量不同物种的基因组中都存在,其编码的蛋白序列高度保守,并具有多个高度保守的结构域,如结合铁和/或硫的结构域,在图13中箭头所指的三个100%保守的半胱氨酸残基(C),其为结合铁(或铁硫中心)的位置。
除非另外指出,本发明的实施方式可使用生物技术、有机化学、无机化学等的常规技术,显然除在上述说明和实施例中所特别描述之外,还可以别的方式实现本发明。其它在本发明范围内的方面与改进将对本发明所属领域的技术人员是显而易见的。根据本发明的教导,许多改变和变化是可行的,因此其在本发明的范围之内。本文所提到的所有专利、专利申请与科技论文均据此通过引用并入本文中。
- 还没有人留言评论。精彩留言会获得点赞!
- 5‑HT2B拮抗剂的制造方法与工艺
- 1‑(噻唑‑2‑基)哌啶‑4‑醇的合成方法与制造工艺
- 一种大麻酚类化合物的合成方法与制造工艺
- 一类对GPR84具有激动作用的化合物及其制备方法和用途与制造工艺
- eGFP标记GPR120阳性细胞的小鼠模型构建方法
- 靶向生长抑素受体的Al<sup>18</sup>F?NOTA?PEG<sub>6</sub>?TATE及其制备方法和应用
- 吡咯烷衍生物的口服制剂的制作方法
- 胰高血糖素样肽-1受体激动剂制备治疗肺动脉高压药物的应用
- 一种armc5基因检测试剂盒及突变位点的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法