血管生成素-2的抗体及其应用的制作方法
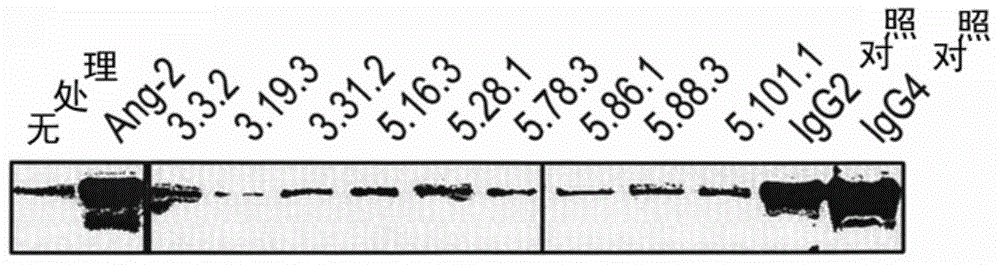
本申请要求并入本文参考的2004年12月21日提交的美国临时申请系列号60/638,354和2005年8月25日提交的美国临时申请系列号60/711,289的优先权。发明领域本发明涉及抗血管生成素-2(Angiopoietin-2,Ang-2)的单克隆抗体及这些抗体的应用。更特别地,本发明涉及针对Ang-2的完全人单克隆抗体及这些抗体的应用。本发明还涉及表达这些抗体的杂交瘤或其它细胞系。所述抗体可用于诊断及治疗与Ang-2的活性和/或过量产生相关的疾病。发明背景血管生成是从现有的血管中形成新的毛细血管的过程,是胚胎发生、正常生理性生长、修复和肿瘤扩展的基本成分。尽管有许多因素可以调节体外内皮细胞(EC)应答及体内血管生长,但是只有血管内皮生长因子(VEGF)家族成员和血管生成素被认为是几乎专门地对血管EC起作用。Yancopoulosetal,Nature407:242-48(2000)。已发现血管生成素是Ties的配体,Ties是在血管内皮中选择性表达的酪氨酸激酶家族(Yancopoulosetal,Nature407:242-48(2000))。目前血管生成素家族有四个确定的成员。血管生成素-3和-4(Ang-3和Ang-4)可代表小鼠和人中相同基因座的非常不同的对应物(Kimetal,FEBSLet,443:353-56(1999);Kimetal,JBiolChem274:26523-28(1999))。Ang-1和Ang-2最初是分别作为激动剂和拮抗剂在组织培养实验中鉴别的(Davisetal,Cell87:1161-69(1996);Maisonpierreetal,Science277:55-60(1997))。所有已知的血管生成素均主要结合Tie2,Ang-1和-2均以3nM(Kd)的亲和性结合Tie2(Maisonpierreetal,Science277:55-60(1997))。Ang-1示出支持EC存活并促进内皮完整性(Davisetal,Cell87:1161-69(1996);Kwaketal.,FEBSLett448:249-53(1999);Surietal,Science282:468-71(1998);Thurstonetal,Science286:2511-14(1999);Thurstonetal,Nat.Med.6:460-63(2000)),而Ang-2具有相反作用并且在没有存活因子VEGF或碱性成纤维细胞生长因子的条件下促进血管不稳定和退化(Maisonpierreetal,Science277:55-60(1997))。然而,关于Ang-2功能的许多研究提示一种更复杂的情况。Ang-2也许是一种血管重塑的复杂调节物,在血管萌发和血管退化中均起作用。支持Ang-2这种作用的表达分析表明在成人血管发生性萌发中Ang-2与VEGF一起被快速诱导,Ang-2在血管退化的情况中在没有VEGF的条件下被诱导(Holashetal,Science284:1994-98(1999);Holashetal,Oncogene18:5356-62(1999))。与邻近依赖性(context-dependent)作用一样,Ang-2结合由Ang-1激活的相同内皮特异性受体Tie-2,但是对其激活具有邻近依赖性效应(Maisonpierreetal,Science277:55-60(1997))。角膜血管发生测定示出Ang-1和Ang-2具有相似作用,与VEGF协同起作用以促进新血管的生长(Asaharaetal,Circ.Res.83:233-40(1998))。通过在体外高浓度Ang-2也具有促进血管发生的观测结果,提示可能存在剂量依赖性内皮细胞应答(Kimetal,Oncogene19:4549-52(2000))。在高浓度下,Ang-2在经PI-3激酶和Akt途径激活Tie2而导致血清剥夺凋亡期间作为内皮细胞的凋亡存活因子而起作用(Kimetal,Oncogene19:4549-52(2000))。其它体外实验提示在持续暴露期间,Ang-2的作用可逐渐从Tie2的拮抗剂转变为激动剂,在随后的时间点,其可直接有助于血管形成和新血管稳定化(Teichert-Kuliszewskaetal,Cardiovasc.Res.49:659-70(2001))。另外,如果将EC在血纤蛋白凝胶上培养,也观测到Ang-2对Tie2的激活,这也许提示Ang-2的作用依赖于EC分化状态(Teichert-Kuliszewskaetal,Cardiovasc.Res.49:659-70(2001))。在三维胶原凝胶中培养的微血管EC中,Ang-2也可诱导Tie2激活并促进毛细血管样结构形成(Mochizukietal,J.Cell.Sci.115:175-83(2002))。3-D球形共培养物作为体外血管成熟的模型的应用表明EC与间充质细胞之间的直接接触消除了对VEGF的应答性,而VEGF和Ang-2的存在诱导萌发(Korffetal,FasebJ.15:447-57(2001))。Etoh等证实组成型表达Tie2的EC,MMP-1、-9和u-PA的表达在存在VEGF的情况下由Ang-2强力地正调节(Etoh,etal,CancerRes.61:2145-53(2001))。在体内瞳孔膜模型中,Lobov等揭示了Ang-2在存在内源VEGF的条件下促进毛细血管直径迅速增加、基底层重塑、内皮细胞的增殖和迁移,并刺激新血管的萌发(Lobovetal,Proc.Natl.Acad.Sci.USA99:11205-10(2002))。相反,在无内源VEGF的条件下,Ang-2促进内皮细胞死亡及血管退化(Lobovetal,Proc.Natl.Acad.Sci.USA99:11205-10(2002))。相似地,在体内肿瘤模型中,Vajkoczy等证实多细胞聚集体通过宿主和肿瘤内皮同时表达VEGFR-2和Ang-2导致血管发生萌发从而引发血管生长(Vajkoczyetal,J.Clin.Invest.109:777-85(2002))。这个模型例证了生长中的肿瘤的已建立的微脉管系统特征在于持续重塑,推测其通过VEGF和Ang-2的表达介导(Vajkoczyetal,J.Clin.Invest.109:777-85(2002))。Tie-2和血管生成素-1的敲除小鼠研究示出相似的表型,提示血管生成素-l刺激的Tie-2磷酸化介导发育中的血管的重塑和稳定,在血管发生期间促进血管成熟及维持内皮细胞-支持细胞附着(Dumontetal,Genes&Development,8:1897-1909(1994);Sato,Nature,376:70-74(1995);Thurston,G.etal.,2000NatureMedicine:6,460-463))。认为血管生成素-1的作用在成人中是保守的,并且在其中广泛及组成型表达(Hanahan,Science,277:48-50(1997);Zagzag,etal,ExpNeurology,159:391-400(1999))。相反,血管生成素-2表达主要限于血管重塑位置,认为其在此阻断血管生成素-1的组成型稳定或成熟功能,使得血管回复至并保持对萌发信号更加应答的可塑状态(Hanahan,1997;Holashetal,Oncogene18:5356-62(1999);Maisonpierre,1997))。对血管生成素-2表达在病原性血管发生中的研究发现许多类型的肿瘤显示出血管血管生成素-2表达(Maisonpierreetal,Science277:55-60(1997))。功能研究提示在小鼠异种移植模型中血管生成素-2参与肿瘤的血管发生,且血管生成素-2过表达与肿瘤生长增加相关(Ahmad,etal,CancerRes.,61:1255-1259(2001))。其它研究也表明血管生成素-2过表达与肿瘤超高血管状态(hypervascularity)相关(Etoh,etal,CancerRes.61:2145-53(2001);Tanakaetal,CancerRes.62:7124-29(2002))。近年来,提出血管生成素-1、血管生成素-2和/或Tie-2可能是抗癌治疗靶位。例如US6166185、US5650490和US5814464均揭示了抗-Tie-2配体和受体抗体。使用可溶的Tie-2的研究报道降低啮齿动物中肿瘤的数目和大小(Lin,1997;Lin1998)。Siemester等(1999)产生了表达Tie-2胞外结构域的人黑素瘤细胞系,将其注射进裸鼠中,报道可溶的Tie-2导致肿瘤生长及肿瘤血管发生明显抑制。鉴于血管生成素-1和血管生成素-2均结合Tie-2,从这些研究中不清楚血管生成素-1、血管生成素-2或Tie-2是否是抗癌治疗的有吸引力的靶位。然而,认为有效的抗-血管生成素-2治疗在治疗如癌症等疾病(其中疾病的进展依赖于异常的血管发生,其中阻断该过程可防止疾病的进展)中是有益的(Folkman,J.,NatureMedicine.1:27-31(1995)。另外,一些研究小组报道了结合血管生成素-2的抗体的应用,见例如美国专利No.6,166,185和美国专利申请公开No.2003/0124129A1所述。对血管生成素-2的病灶表达作用的研究示出拮抗血管生成素-1/Tie-2信号使得紧密的血管结构松解,从而使得EC暴露于来自血管发生诱导剂例如VEGF的激活的信号(Hanahan,1997)。这种得自血管生成素-1抑制的促血管发生(pro-angiogenic)作用表明抗-血管生成素-1治疗不是有效的抗癌治疗。Ang-2在发生血管重塑的部位发育期间表达(Maisonpierreetal,Science277:55-60(1997))。在成人中,Ang-2表达限于血管重塑部位以及高度血管化的肿瘤,包括神经胶质瘤(Osadaetal,Int.J.Oncol.18:305-09(2001);Kogaetal,CancerRes.61:6248-54(2001))、肝细胞癌(Tanakaetal,J.Clin.Invest.103:341-45(1999))、胃癌(Etoh,etal,CancerRes.61:2145-53(2001);Leeetal,Int.J.Oncol.18:355-61(2001))、甲状腺肿瘤(Bunoneetal,AmJPathol155:1967-76(1999))、非小细胞肺癌(Wongetal,LungCancer29:11-22(2000))及结肠癌(Ahmadetal,Cancer92:1138-43(2001))和前列腺癌(Wurmbachetal,AnticancerRes.20:5217-20(2000))。发现一些肿瘤细胞表达Ang-2。例如,Tanakaetal,J.Clin.Invest.103:341-45(1999)在12个人肝细胞癌(HCC)样品中的10个样品中检测到Ang-2mRNA。Ellis研究小组报道Ang-2在肿瘤上皮中遍在表达(Ahmadetal,Cancer92:1138-43(2001))。其它研究者报道了相似的发现(Chenetal,J.TongjiMed.Univ.21:228-30,235(2001))。通过检测存档的人乳腺癌样品中Ang-2mRNA水平,Sfilogoietal,Int.J.Cancer103:466-74(2003)报道了Ang-2mRNA与辅助淋巴结侵润(auxiliarylymphnodeinvasion)、较短的无疾病时间及较差的全面存活显著相关。Tanakaetal.,CancerRes.62:7124-29(2002)回顾了共236名病理阶段分别为I至IIIA期的非小细胞肺癌(NSCLC)患者。使用免疫组织化学分析,发现16.9%的NSCLC患者是Ang-2阳性。Ang-2阳性肿瘤的微血管密度显著高于Ang-2阴性的。Ang-2的这种血管发生作用仅当VEGF表达较高时才可见。另外,Ang-2的阳性表达是预知较差的手术后存活的重要因素(Tanakaetal,CancerRes.62:7124-29(2002))。然而,他们发现Ang-1表达与微血管密度之间无显著关联(Tanakaetal,CancerRes.62:7124-29(2002))。这些结果提示Ang-2是某些类型癌症患者预后较差的指征。最近,Yancopoulos研究小组使用Ang-2敲除小鼠模型报道了Ang-2是出生后血管发生所必需的(Galeetal,Dev.Cell3:411-23(2002))。他们示出在眼中玻璃体脉管系统的进展性程序化退化在Ang-2-/-小鼠中不发生,其视网膜血管不能从中央视网膜动脉中萌出(Galeetal,Dev.Cell3:411-23(2002))。他们还发现Ang-2的缺失导致淋巴脉管系统的式样和功能明显缺陷(Galeetal,Dev.Cell3:411-23(2002))。用Ang-1的遗传拯救纠正了淋巴缺陷,但是未纠正血管发生缺陷(Galeetal,Dev.Cell3:411-23(2002))。Peters及其同事报道了可溶的Tie2当作为重组蛋白质或者在病毒表达载体中给予小鼠模型时,抑制鼠乳腺癌和黑素瘤的体内生长(Linetal,Proc.NatlAcad.SciUSA95:8829-34(1998);Linetal,J.Clin.Invest.100:2072-78(1997))。如此处理的肿瘤组织中血管密度显著降低。另外,可溶的Tie2阻断肿瘤细胞条件培养基刺激的大鼠角膜中血管发生(Linetal,J.Clin.Invest.100:2072-78(1997))。另外,Isner及其小组证实了向VEGF中加入Ang-2比单独的VEGF显著促进更长和更多的环形新血管化(circumferentialneovascularity)(Asaharaetal,Circ.Res.83:233-40(1998))。过量的可溶Tie2受体阻碍Ang-2对VEGF-诱导的新血管化的调节(Asaharaetal,Circ.Res.83:233-40(1998))。Siemeisteretal,CancerRes.59:3185-91(1999)使用裸鼠异种移植物揭示了异种移植物中Flt-1或Tie2的胞外配体结合结构域的过表达导致不能由另一途径弥补的途径的显著抑制,提示VEGF受体途径和Tie2途径应被认为是体内血管发生过程必需的两个独立介导物(Siemeisteretal.,CancerRes.59:3185-91(1999))。这个结论由最近的出版物Whiteetal,Proc.Natl.Acad.SciUSA100:5028-33(2003)所证实。在其研究中,证实了特异性结合和抑制Ang-2的核酸酶抗性RNA适体(aptamer)显著抑制大鼠角膜微囊(micropocket)血管发生模型中bFGF诱导的新血管化。发明概述本发明的实施方案涉及特异性结合血管生成素-2并由此抑制肿瘤血管发生和降低肿瘤生长的靶向结合剂。可以实现这个目的的机制可包括但不限于抑制Ang-2与其受体Tie2的结合、抑制Ang-2诱导的Tie2信号传导或者增加Ang-2的清除,由此降低Ang-2的有效浓度。本发明的一个实施方案是所述靶向结合剂是结合Ang-2并防止Ang-2结合Tie2的完全人抗体。本发明的另一实施方案是结合Ang-2和Ang-1并还抑制Ang-2诱导的Tie2磷酸化的完全人单克隆抗体。所述抗体可结合Ang-2,Kd低于100pM、30pM、20pM、10pM或者5pM。所述抗体可包含重链氨基酸序列,该重链氨基酸序列具有互补决定区(CDR),所述CDR具有表11所示的序列之一。注意本领域技术人员可易于完成CDR确定。见例如Kabatetal,SequencesofProteinsofImmunologicalInterest,FifthEdition,NIHPublication91-3242,BethesdaMD(1991),vols.1-3。本发明的一个实施方案包含特异性结合Ang-2的完全人单克隆抗体3.3.2(ATCC登记号PTA-7258)、3.19.3(ATCC登记号PTA-7260)和5.88.3(ATCC登记号PTA-7259),如下文详细描述。本发明另一实施方案是结合Ang-2的抗体,其包含轻链氨基酸序列,该轻链氨基酸序列具有包含表12所示序列之一的CDR。在某些实施方案中,所述抗体是完全人单克隆抗体。本发明另一实施方案是结合Ang-2的抗体,其包含重链氨基酸序列及轻链氨基酸序列,所述重链氨基酸序列具有表11所示CDR序列之一,所述轻链氨基酸序列具有表12所示CDR序列之一。在某些实施方案中,所述抗体是完全人单克隆抗体。本发明另一实施方案是与本发明的完全人抗体交叉竞争结合Ang-2的抗体,优选包含重链氨基酸序列及轻链氨基酸序列的抗体,所述重链氨基酸序列具有表11所示CDR序列之一,所述轻链氨基酸序列具有表12所示CDR序列之一。本发明另一实施方案是结合Ang-2上的与本发明的完全人抗体结合相同表位的抗体,优选包含重链氨基酸序列及轻链氨基酸序列的抗体,所述重链氨基酸序列具有表11所示CDR序列之一,所述轻链氨基酸序列具有表12所示CDR序列之一。本发明另一实施方案包括特异性结合血管生成素-2的人单克隆抗体,其中所述抗体包含相应于典范类别1(canonicalclass1)的重链互补决定区1(CDR1)。本发明提供的抗体也可以包括相应于典范类别3的重链互补决定区2(CDR2),相应于典范类别2的轻链互补决定区1(CDR1),相应于典范类别1的轻链互补决定区2(CDR2)及相应于典范类别1的轻链互补决定区3(CDR3)。本发明进一步提供了分析患者样品中血管生成素-2(Ang-2)水平的方法,所述方法包括将抗-Ang-2抗体与患者的生物学样品接触,检测所述样品中所述抗体与Ang-2之间的结合水平。在更特异的实施方案中,所述生物学样品是血液。在其它实施方案中,本发明提供了组合物,其包括抗体或其功能片段及药物可接受的载体。本发明另外的实施方案包括有效治疗患有血管发生相关疾病的动物的方法,包括选择需要治疗肿瘤或非肿瘤疾病的动物,给予所述动物治疗有效量的特异性结合血管生成素-2(Ang-2)的完全人单克隆抗体。可治疗的血管发生相关疾病包括肿瘤疾病,如黑素瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞(肝)癌、甲状腺肿瘤、胃癌、前列腺癌、乳腺癌、卵巢癌、膀胱癌、肺癌、成胶质细胞瘤、子宫内膜癌、肾癌、结肠癌、胰腺癌、食管癌、头颈癌、间皮瘤、肉瘤、胆管癌(胆管细胞癌)、小肠腺癌、儿童恶性肿瘤及表皮样癌。本发明其它实施方案包括抑制动物中血管生成素-2(Ang-2)诱导的血管发生的方法。这些方法包括选择需要治疗Ang-2诱导的血管发生的动物,给予所述动物治疗有效量的完全人单克隆抗体,其中所述抗体特异性结合Ang-2。本发明另外的实施方案包括抗体在制备用于治疗动物中血管发生相关疾病的药物中的应用,其中所述单克隆抗体特异性结合血管生成素-2(Ang-2)。可治疗的血管发生相关疾病可包括肿瘤疾病,如黑素瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞(肝)癌、甲状腺肿瘤、胃癌、前列腺癌、乳腺癌、卵巢癌、膀胱癌、肺癌、成胶质细胞瘤、子宫内膜癌、肾癌、结肠癌、胰腺癌、食管癌、头颈癌、间皮瘤、肉瘤、胆管细胞癌、小肠腺癌、儿童恶性肿瘤及表皮样癌。在另外的实施方案中,本发明描述的抗体可用于制备有效治疗动物中血管生成素-2诱导的血管发生的药物,其中所述单克隆抗体特异性结合血管生成素-2(Ang-2)。本文描述的本发明的实施方案涉及单克隆抗体,其结合Ang-2及影响Ang-2功能。其它实施方案涉及从治疗观点看具有希望性质的完全人抗-Ang-2抗体及抗-Ang-2抗体制备物,所述希望性质包括与Ang-2的高度结合亲和性、在体外和体内中和Ang-2的能力及抑制Ang-2诱导的血管发生的能力。在一个优选的实施方案中,本文描述的抗体以非常高的亲和性(Kd)结合Ang-2。例如,能以如下Kd结合Ang-2的人、兔、小鼠、嵌合或人源化抗体,所述Kd低于但不限于10-5、10-6、10-7、10-8、10-9、10-10、10-11、10-12、10-13或10-14M,或者其中的任何范围或数值。亲和性和/或亲和力测定可通过如本文所述的和/或测定。因此,本文描述的一个实施方案包括结合Ang-2的分离的抗体或其片段。如本领域所已知,所述抗体可有利地是多克隆抗体、寡克隆抗体、单克隆抗体、嵌合抗体、人源化抗体和/或完全人抗体。本文描述的本发明的实施方案还提供了生产这些抗体的细胞。本发明的另一实施方案是结合其它血管生成素-2家族成员的完全人抗体,所述成员包括但非限于血管生成素-1、血管生成素-3和血管生成素-4。本发明另一实施方案是与本发明的完全人抗体交叉竞争结合与Ang-2结合的Tie2的抗体。在本发明一个实施方案中,所述抗体结合并中和血管生成素-2,而且还结合并中和血管生成素-1。应意识到本发明的实施方案非限于任何特定形式的抗体或者产生或生产方法。例如抗-Ang-2抗体可以是全长抗体(例如具有完整的人Fc区域)或者抗体片段(例如Fab、Fab'或F(ab')2)。另外,所述抗体可以产生自分泌所述抗体的杂交瘤,或者得自已经用编码所述抗体的一或多个基因转化或转染的重组产生的细胞。本发明的其它实施方案包括编码本文描述的任何抗体的分离的核酸分子,具有编码抗Ang-2抗体的分离的核酸分子的载体或者用任何这种核酸分子转化的宿主细胞。另外,本发明的一个实施方案是产生抗-Ang-2抗体的方法,通过将宿主细胞在核酸分子被表达的条件下培养以产生所述抗体,随后回收所述抗体而进行。应认识到本发明的实施方案还包括编码本发明抗体或其片段的任何核酸分子,其包括经优化的当转染进宿主细胞中生产抗体时增加抗体或其片段产量的核酸序列。本发明另一实施方案包括产生Ang-2的高亲和性抗体的方法,通过用人Ang-2或其片段及一或多个直系同源序列或其片段免疫一种哺乳动物而进行。其它实施方案基于特异性结合Ang-2的分离的抗体的产生和鉴别。Ang-2在血管发生相关疾病如肿瘤疾病中表达水平增加。Ang-2的生物学活性的抑制可防止Ang-2诱导的血管发生及其它希望的作用。本发明的另一实施方案包括诊断疾病或病变的方法,其中将如本文所述制备的抗体用于检测患者样品中Ang-2水平。在一个实施方案中,所述患者样品是血液或血清。在另外的实施方案中,提供了鉴别危险因素、诊断疾病及对疾病进行分期的方法,包括使用抗-Ang-2抗体鉴别Ang-2的过表达。本发明的另一实施方案包括诊断与细胞中Ang-2表达相关的病变的方法,通过将血清或细胞与抗-Ang-2抗体接触,之后检测Ang-2的存在与否而进行诊断。优选的病变包括血管发生相关疾病,包括但非限于肿瘤疾病,如黑素瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞(肝)癌、成胶质细胞瘤、甲状腺癌、胃癌、前列腺癌、乳腺癌、卵巢癌、膀胱癌、肺癌、子宫癌、肾癌、结肠癌、胰腺癌、唾液腺癌及结肠直肠癌。在另一个实施方案中,本发明包括一个检测哺乳动物组织、细胞或体液中血管生成素-2和血管生成素家族成员的分析试剂盒,以筛选血管发生相关疾病。所述试剂盒包括与血管生成素-2结合的抗体及指示所述抗体与血管生成素-2(如果存在的话)反应的方式。优选地,所述抗体是单克隆抗体,在一个实施方案中,结合Ang-2的所述抗体被标记。在另一个实施方案中,所述抗体是未标记的一级抗体,所述试剂盒进一步包括检测所述一级抗体的方式。在一个实施方案中,所述方式包括一种标记的二级抗体,其是抗免疫球蛋白。优选地,所述抗体是用选自如下的标记物进行标记的:荧光染料、酶、放射性核素和不透射线的材料。另一实施方案包括治疗患者与Ang-2表达相关的疾病或病变的方法,通过给予患者有效量的抗-Ang-2抗体而进行。所述抗-Ang-2可以单独给予,或者组合其它抗体或化疗药物或放疗给予。例如,阻断血管发生的Ang-2抗体的单克隆抗体、寡克隆抗体或多克隆抗体混合物可以与示出直接抑制肿瘤细胞增殖的药物组合给予。所述方法可以在体内进行,所述患者优选是人类患者。在一个优选的实施方案中,所述方法涉及治疗血管发生相关疾病的方法,所述疾病包括但非限于肿瘤疾病,如黑素瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞(肝)癌、成胶质细胞瘤、甲状腺癌、胃癌、前列腺癌、乳腺癌、卵巢癌、膀胱癌、肺癌、子宫癌、肾癌、结肠癌、胰腺癌、唾液腺癌及结肠直肠癌。在另一个实施方案中,本发明提供了一种包括容器的生产物品。所述容器包括含有抗-Ang-2抗体的组合物,及指示所述组合物可用于治疗特征在于Ang-2过表达的血管发生相关疾病的包装插入页或标签。在一些实施方案中,将抗-Ang-2抗体给予患者,随后给予清除剂以从血液中除去过量的循环中的抗体。本发明另一实施方案是抗Ang-2抗体在制备治疗如血管发生相关疾病的药物中的应用。在一个实施方案中,所述血管发生相关疾病包括癌症,如乳腺癌、卵巢癌、胃癌、子宫内膜癌、唾液腺癌、肺癌、肾癌、结肠癌、结肠直肠癌、食管癌、甲状腺癌、胰腺癌、前列腺癌和膀胱癌。在另一个实施方案中,所述血管发生相关疾病包括但非限于肿瘤疾病,如黑素瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞(肝)癌、肉瘤、头颈癌、间皮瘤、胆管癌(胆管细胞癌)、小肠腺癌、儿童恶性肿瘤和成胶质细胞瘤。Ang-2是血管发生的重要“开关”。因此,期望拮抗这种分子以抑制病理生理过程,从而作为多种血管发生依赖性疾病的有效治疗方法。除了实体肿瘤及其转移瘤之外,血液系统恶性肿瘤如白血病、淋巴瘤和多发性骨髓瘤也是血管发生依赖性的。过量的血管生长导致众多的非肿瘤疾病。这些非肿瘤血管发生依赖性疾病包括:动脉硬化症、血管瘤、血管内皮瘤、血管纤维瘤、血管畸形(例如遗传性出血性毛细血管扩张症(HHT)或者Osier-Weber综合征)、疣、脓性肉芽肿、过度毛发生长、Kaposis'肉瘤、瘢痕疙瘩、变应性水肿、银屑病、功能失调性子宫出血、滤胞囊肿、卵巢超刺激、子宫内膜异位、呼吸窘迫、腹水、糖尿病患者腹膜硬化、得自腹部手术的粘连形成、肥胖、类风湿性关节炎、滑膜炎、骨髓炎、血管翳生长、骨赘、血友病性关节、炎症和感染性过程(例如肝炎、肺炎、肾小球性肾炎)、哮喘、鼻息肉、肝再生、肺动脉高压、早产儿视网膜病、糖尿病性视网膜病、年龄相关的黄斑变性、白质软化(leukomalacia)、新生血管性青光眼、角膜移植新血管化、沙眼、甲状腺炎、甲状腺肥大、及淋巴增殖性疾病。附图简述图1是示出Ang-2mAb抑制在HEK293F细胞中异位表达的Tie2经Ang-2诱导的磷酸化的Western印迹。图2是抗Ang-2单克隆抗体抑制Ang-2诱导的Tie2磷酸化的剂量应答关系的线图。图3是示出使用mAb3.19.3或Tie2/Fc以剂量依赖性方式抑制Ang-1(上图)和Ang-2(下图)与Tie2结合的线图。图4是示出mAb3.19.3在Eahy926内皮细胞上抑制血管生成素-1刺激的Tie-2磷酸化的Western印迹。在这个系统中观测到对血管生成素-1诱导的Tie-2磷酸化的抑制。所述抗体浓度以nM示出。图5是示出mAb3.19.3在Eahy926内皮细胞上抑制血管生成素-1刺激的Tie-2磷酸化的线图。IC50=99nM。X轴是mAb3.19.3的浓度,y轴表示应答。图6是人Ang-2和Ang-2443的蛋白质结构示意图。上面的数字表示氨基酸序列(图表取自Injuneetal.,(2000)JBC275:18550)。图7示出小鼠/人嵌合分子的氨基酸序列(SEQIDNO:1)。下划线处为人残基(克隆为StuI-TfiI片段)310-400。图8是人Ang-1(SEQIDNO:2)、人Ang-2(SEQIDNO:3)和小鼠Ang-2(SEQIDNO:4)蛋白质的氨基酸序列对比。Ang-2嵌合分子的融合点和点突变以黑体字示出。图9是小鼠Ang-1(SEQIDNO:5)、人Ang-1(SEQIDNO:2)、小鼠Ang-2(SEQIDNO:4)和人Ang-2(SEQIDNO:3)的氨基酸序列对比。箭头指示疏水性前导序列的切割位点。箭头指出了卷曲螺旋与血纤蛋白原样结构域的界限。实心圆表示保守的半胱氨酸残基(图取自Maisonpierreetal.,1997,Science277:55)。图10是表示小鼠剂量应答关系的交叉反应性的线图。图中示出了单克隆抗体克隆5.2.1、5.28.1、3.19.3和3.31.2。图11是示出使用mAb3.19.3以剂量依赖性方式对人(黑色三角形)和小鼠(黑色正方形)Ang-2结合人Tie2的抑制的线图。图12是抗体对MCF-7细胞诱导的血管发生的作用的条形图分析。图12A示出抗-Ang-2抗体对血管末端数目的作用,其中x轴表示实验组,y轴表示血管末端的平均数目(+/-SD)。图12B示出抗-Ang-2抗体对血管长度的作用,其中x轴表示实验组,y轴表示平均血管长度(+/-SD)。图13是示出抗-Ang-2单克隆抗体克隆3.19.3的抗肿瘤作用的线图,使用A431细胞系在人皮肤表皮样癌的小鼠异种移植模型中测试。X轴表示植入肿瘤细胞后的天数,y轴表示平均肿瘤体积+/-SEM(以cm3表示)。实心黑色三角形表示植入肿瘤后注射抗-Ang-2单克隆抗体克隆3.19.3的小鼠的肿瘤体积测量;实心黑色圆形表示植入肿瘤后注射同种型对照抗体PK16.3.1的小鼠的肿瘤体积测量。图14A是示出在人结肠腺癌LoVo异种移植模型中阻止肿瘤生长的线图,示出用0.5、2和10mg/kg所述抗体或同种型对照抗体处理小鼠的肿瘤大小。X轴表示肿瘤细胞植入后的天数,y轴表示平均肿瘤体积+/-SEM(以cm3表示)。图14B是示出在人结肠腺癌SW480异种移植模型中mAb的肿瘤生长抑制作用的线图。图15A是示出HT29异种移植模型中阻止肿瘤生长的线图。X轴表示植入肿瘤细胞后的天数,y轴表示平均肿瘤体积+/-SEM(以cm3表示)。图15B是示出在Calu-6异种移植模型中阻止肿瘤生长的线图,图中示出了用10mg/kg的mAb克隆3.3.2或3.19.3或者用同种型对照抗体处理的小鼠的肿瘤大小。图15C是示出用IgG对照抗体或10mg/kg3.19.3mAb处理的MDA-MB-231肿瘤携带小鼠的肿瘤中CD31+染色的强度的条形图。图中示出了阈值和人工网格计数方法的结果。发明详述本文描述的本发明的实施方案涉及结合Ang-2的单克隆抗体。在一些实施方案中,所述抗体结合Ang-2并抑制Ang-2与其受体Tie2的结合。其它本发明的实施方案包括完全人抗-Ang-2抗体,及具有治疗效用的抗体制备物。这种抗-Ang-2抗体制备物优选具有希望的治疗性质,包括与Ang-2的强结合亲和性、在体外中和Ang-2的能力及在体内抑制Ang-2诱导的血管发生的能力。本发明的一个实施方案包括结合并中和Ang-2但不结合Ang-1的抗体。在一个实施方案中,所述抗体既结合Ang-2也结合Ang-1,但仅中和Ang-2。在另一个实施方案中,所述抗体既结合Ang-2也结合Ang-1,并且中和Ang-1和Ang-2与Tie2的结合。本发明的实施方案还包括抗-Ang-2抗体的分离的结合片段。优选地,所述结合片段衍生自完全人抗-Ang-2抗体。所述片段例如包括Fv、Fab'或其它熟知的抗体片段,如下文详细描述。本发明的实施方案还包括表达抗Ang-2的完全人抗体的细胞。所述细胞的例子包括杂交瘤,或者重组产生的细胞,如中国仓鼠卵巢(CHO)细胞,CHO细胞的变体(例如DG44)及产生Ang-2抗体的NS0细胞。关于CHO细胞变体的另外的信息可见于以其全文并入本文作参考的AndersenandReilly(2004)CurrentOpinioninBiotechnology15,456-462。另外,本发明的实施方案包括使用这些抗体治疗疾病的方法。抗-Ang-2抗体可用于防止Ang-2介导的Tie2信号转导,从而抑制血管发生。这种抑制作用的机制可包括抑制Ang-2与其受体Tie2的结合,抑制Ang-2诱导的Tie2信号传导,或者增强Ang-2的清除,由此降低Ang-2与Tie-2结合的有效浓度。可通过这种治疗机制治疗的疾病包括但非限于肿瘤疾病,如黑素瘤,小细胞肺癌,非小细胞肺癌,神经胶质瘤,肝细胞(肝)癌,成胶质细胞瘤,甲状腺癌,胃癌,前列腺癌,乳腺癌,卵巢癌,膀胱癌,肺癌,子宫癌,肾癌,结肠癌,胰腺癌,唾液腺癌和结肠直肠癌。其它本发明的实施方案包括特异性确定生物学样品中Ang-2数量的诊断分析。所述分析试剂盒可包括抗-Ang-2抗体及检测这种抗体的必需标记物。这些诊断分析可用于筛选血管发生相关疾病,包括但非限于肿瘤疾病,如黑素瘤,小细胞肺癌,非小细胞肺癌,神经胶质瘤,肝细胞(肝)癌,成胶质细胞瘤,甲状腺癌,胃癌,前列腺癌,乳腺癌,卵巢癌,膀胱癌,肺癌,子宫癌,肾癌,结肠癌,胰腺癌,唾液腺癌和结肠直肠癌。根据本发明的一方面,提供了一种血管生成素-1和血管生成素-2的生物学活性的拮抗剂,其中所述拮抗剂不结合Tie-2的ATP结合位点。根据本发明的另一方面,提供了一种血管生成素-1和血管生成素-2的生物学活性的拮抗剂,其中所述拮抗剂结合血管生成素-1和血管生成素-2。根据本发明的另一方面,提供了一种血管生成素-1和血管生成素-2的生物学活性的拮抗剂,其中所述拮抗剂不是化合物。在本发明的一个实施方案中,提供了一种血管生成素-1和血管生成素-2的生物学活性的拮抗剂,其中所述血管生成素-1拮抗剂活性和血管生成素-2拮抗剂活性包含在一个分子中。在本发明的另一个实施方案中,提供了一种拮抗剂,其中所述血管生成素-1拮抗剂活性和血管生成素-2拮抗剂活性包含在一个以上的分子中。在本发明的一个实施方案中,提供了一种血管生成素-1和血管生成素-2的生物学活性的拮抗剂,其中所述拮抗剂可结合:i)Tie-2受体;ii)血管生成素-1和/或血管生成素-2;iii)Tie-2受体-血管生成素-1复合物;或者iv)Tie-2受体-血管生成素-2复合物,或者这些物质的任何组合。在本发明的一个实施方案中,血管生成素-1和血管生成素-2的生物学活性的拮抗剂可结合血管生成素-1和/或血管生成素-2和/或Tie-2,从而阻止血管生成素-1和血管生成素-2介导的Tie-2信号转导,从而抑制血管发生。这种抑制作用的机制可包括:i)所述拮抗剂与血管生成素-1的结合及抑制血管生成素-1与其受体Tie-2的结合,和/或ii)所述拮抗剂与血管生成素-2的结合及抑制血管生成素-2与其受体Tie-2的结合,和/或iii)增强血管生成素-1和/或血管生成素-2的清除,由此降低血管生成素-1和/或血管生成素-2可用于与Tie-2结合的有效浓度,或者这些作用机制的组合,足以拮抗血管生成素-1和血管生成素-2的生物学活性。不希望受到理论的束缚,可以拮抗血管生成素-1和血管生成素-2的生物学活性的机制包括但非限于:抑制血管生成素-1和血管生成素-2与受体Tie-2的结合,抑制血管生成素-1和血管生成素-2诱导的Tie-2信号传导,或者增加血管生成素-1和血管生成素-2的清除,由此降低血管生成素-1和血管生成素-2的有效浓度。在本发明的一个实施方案中,提供了一种血管生成素-1和血管生成素-2生物学活性拮抗剂,其中所述拮抗剂是抗体。优选所述抗体能在体外和体内拮抗血管生成素-1和/或血管生成素-2的生物学活性。优选所述抗体是多克隆或单克隆抗体。更优选所述抗体是单克隆抗体,更优选所述抗体是完全人单克隆抗体。最优选所述抗体是完全人单克隆抗体3.19.3。在本发明的一个实施方案中,提供了一种结合与完全人单克隆抗体3.19.3结合的表位相同的表位的抗体。在本发明的一个实施方案中,提供了一种完全人抗体,其结合血管生成素-1并阻止血管生成素-1结合Tie-2。本发明另一实施方案是完全人单克隆抗体,其结合血管生成素-1并抑制血管生成素-1诱导的Tie-2磷酸化。在一个实施方案中,所述抗体结合血管生成素-1,Kd小于1纳摩尔(nM)。更优选地,所述抗体以Kd小于500皮摩尔(pM)结合。更优选地,所述抗体以Kd小于100皮摩尔(pM)结合。更优选地,所述抗体以Kd小于30皮摩尔(pM)结合。更优选地,所述抗体以Kd小于20pM结合。甚至更优选地,所述抗体以Kd小于10或5pM结合。在本发明的一个实施方案中,提供了一种完全人抗体,其结合血管生成素-2并阻止血管生成素-2结合Tie-2。本发明的另一实施方案是完全人单克隆抗体,其结合血管生成素-2并抑制血管生成素-2诱导的Tie-2磷酸化。在一个实施方案中,所述抗体结合血管生成素-2,Kd小于1纳摩尔(nM)。更优选地,所述抗体以Kd小于500皮摩尔(pM)结合。更优选地,所述抗体以Kd小于100皮摩尔(pM)结合。更优选地,所述抗体以Kd小于30皮摩尔(pM)结合。更优选地,所述抗体以Kd小于20pM结合。甚至更优选地,所述抗体以Kd小于10或5pM结合。在本发明的一个实施方案中,提供了一种杂交瘤,其产生如上述抗体的轻链和/或重链。优选所述杂交瘤产生完全人单克隆抗体的轻链和/或重链。更优选地,所述杂交瘤产生完全人单克隆抗体3.19.3、3.3.2或5.88.3的轻链和/或重链。或者,所述杂交瘤产生结合与完全人单克隆抗体3.19.3、3.3.2或5.88.3结合的表位相同的一或多个表位的抗体。在本发明的一个实施方案中,提供了编码如上述抗体的轻链或重链的核酸分子。优选提供了编码完全人单克隆抗体的轻链或重链的核酸分子。更优选提供了编码完全人单克隆抗体3.19.3的轻链或重链的核酸分子。在本发明的一个实施方案中,提供了包含如上述一或多个核酸分子的载体,其中所述载体编码如上述抗体的轻链和/或重链。在本发明的一个实施方案中,提供了包含如上述载体的宿主细胞。或者所述宿主细胞可包含一个以上的载体。另外,本发明的一个实施方案是产生抗体的方法,通过将宿主细胞在核酸分子被表达的条件下培养以产生抗体,随后回收所述抗体而进行。在本发明的一个实施方案中,提供了一种产生抗体的方法,包括用编码如上述抗体的至少一种核酸分子转染至少一种宿主细胞,在所述宿主细胞中表达所述核酸分子及分离所述抗体。根据本发明的另一方面,提供了一种拮抗所述血管生成素-1和血管生成素-2的生物学活性的方法,包括给予上述拮抗剂。所述方法可包括选择需要治疗与疾病相关的血管发生的动物,给予所述动物治疗有效量的血管生成素-1和血管生成素-2的生物学活性拮抗剂。根据本发明的另一方面,提供了一种拮抗血管生成素-1和血管生成素-2的生物学活性的方法,包括给予如上述的抗体。所述方法可包括选择需要治疗与疾病相关的血管发生的动物,给予所述动物治疗有效量的拮抗血管生成素-1和血管生成素-2的生物学活性的抗体。根据本发明另一方面,提供了一种治疗哺乳动物中疾病相关血管发生的方法,包括给予治疗有效量的血管生成素-1和血管生成素-2的生物学活性的拮抗剂。所述方法包括选择需要治疗与疾病相关的血管发生的动物,给予所述动物治疗有效量的血管生成素-1和血管生成素-2的生物学活性拮抗剂。根据本发明另一方面,提供了一种治疗哺乳动物中与疾病相关的血管发生的方法,包括给予治疗有效量的拮抗血管生成素-1和血管生成素-2的生物学活性的抗体。所述方法可包括选择需要治疗与疾病相关的血管发生的动物,给予所述动物治疗有效量的拮抗血管生成素-1和血管生成素-2的生物学活性的抗体。所述抗体可以单独给予,或者可以组合其它抗体或化疗药物或放疗给予。根据本发明的另一方面,提供了一种治疗哺乳动物中癌症的方法,包括给予治疗有效量的血管生成素-1和血管生成素-2的生物学活性拮抗剂。所述方法可包括选择需要治疗癌症的动物,给予所述动物治疗有效量的拮抗血管生成素-1和血管生成素-2的生物学活性的拮抗剂。所述拮抗剂可以单独给予,或者可以组合其它抗体或化疗药物或放疗给予。根据本发明另一方面,提供了一种治疗哺乳动物中癌症的方法,包括给予治疗有效量的拮抗血管生成素-1和血管生成素-2的生物学活性的抗体。所述方法可包括选择需要治疗癌症的动物,给予所述动物治疗有效量的拮抗血管生成素-1和血管生成素-2的生物学活性的抗体。所述抗体可以单独给予,或者可以组合其它抗体或化疗药物或放疗给予。根据本发明另一方面,提供了血管生成素-1和血管生成素-2的生物学活性拮抗剂在生产用于治疗与疾病相关的血管发生的药物中的应用。根据本发明的另一方面,提供了拮抗血管生成素-1和血管生成素-2的生物学活性的抗体在生产用于治疗与疾病相关的血管发生的药物中的应用。在一个优选的实施方案中,本发明特别适用于在肿瘤患者中以单独或部分依赖于Tie-2受体方式拮抗血管生成素-1或血管生成素-2。本发明的另一实施方案包括检测哺乳动物组织、细胞或体液中血管生成素-1和/或血管生成素-2的分析试剂盒,以筛选血管发生相关疾病。所述试剂盒包括结合血管生成素-1和/或血管生成素-2的抗体,及表示所述抗体与血管生成素-1和/或血管生成素-2(如果存在的话)反应的方式。所述抗体可以是单克隆抗体。在一个实施方案中,结合血管生成素-2的抗体是标记的。在另一个实施方案中,所述抗体是未标记的一级抗体,所述试剂盒进一步包括检测所述一级抗体的方式。在一个实施方案中,所述方式包括一种标记的二级抗体,其是一种抗免疫球蛋白。优选所述抗体用选自荧光染料、酶、放射性核素及不透射线的材料的标记物标记。本发明关于抗-Ang-2抗体的其它实施方案、特征在下文详细描述。序列表本发明的实施方案包括在下表1中列出的特异性抗-Ang-2抗体。这个表报道了每种抗-Ang-2抗体的标识号,以及相应重链和轻链基因的SEQID编号。给出了每种抗体的标识号,其包括由一或两个小数点隔开的两或三个数字。对于大多数抗体而言,仅列出了由一个小数点隔开的两个标识号。然而,在一些情况中,制备了一种抗体的几个克隆。尽管所述克隆具有与亲代序列相同的核酸和氨基酸序列,但它们也是通过在第二个小数点右侧的数字而标示克隆编号而单独列出的。因此,例如抗体5.35的核酸和氨基酸序列与抗体5.35.1、5.35.2和5.35.3的序列相同。表1术语除非特别指出,本文使用的科学和技术术语应具有本领域技术人员通常已知的含义。另外,除非特别需要,则单数术语应包括复数,复数术语应包括单数。通常地,本文描述的细胞和组织培养、分子生物学及蛋白质和寡核苷酸或多核苷酸化学及杂交方面的术语为本领域技术人员所熟知及常规使用。使用标准技术进行重组DNA、寡核苷酸合成、及组织培养和转化(例如电穿孔、脂染)。根据厂商说明书或如本领域通常确认的或者如本文所述进行酶反应和纯化技术。前述技术和方法通常根据本领域熟知的及在许多普通或本说明书引用及论述的更特殊的参考文献所述的常规方法进行。见例如并入作参考的Sambrooketal.MolecularCloning:ALaboratoryManual(3rded.,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,N.Y.(2001))所述。本文描述的分析化学、合成有机化学及医药化学的实验程序和技术中的所用术语为本领域所熟知和通用。使用标准技术进行化学合成、化学分析、药物制备、配方、及输送和治疗患者。如本发明所用,如下术语除非特别说明则应具有如下含义:拮抗剂可以是多肽、核酸、碳水化合物、脂质、小分子量化合物、寡核苷酸、寡肽、RNA干扰(RNAi)、反义RNA、重组蛋白质、抗体、或者其缀合物或融合蛋白。关于RNAi,见MilhavetO,GaryDS,MattsonMP.(PharmacolRev.2003Dec;55(4):629-48.Review.),关于反义RNA,见OpalinskaJB,GewirtzAM.(SciSTKE.2003Oct28;2003(206):pe47.)。疾病相关的血管发生可以是任何异常、不希望的或病理性血管发生,例如肿瘤相关的血管发生。血管发生相关的疾病包括但非限于非实体肿瘤如白血病、多发性骨髓瘤或淋巴瘤,及实体肿瘤如黑素瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞(肝)癌、成胶质细胞瘤、甲状腺癌、胆管癌、骨癌、胃癌、脑/CNS癌、头颈癌、肝癌、胃癌、前列腺癌、乳腺癌、肾癌、睾丸癌、卵巢癌、皮肤癌、子宫颈癌、肺癌、肌肉肿瘤、神经元肿瘤、食管癌、膀胱癌、肺癌、子宫癌、阴道癌、子宫内膜癌、肾癌、结肠直肠癌、胰腺癌、胸膜/腹膜肿瘤、唾液腺癌和表皮样癌。化合物是指任何小分子量的化合物,分子量低于约2000道尔顿。术语“Ang-2”是指血管生成素-2分子。术语“中和”当描述抗体时是指抗体消除或显著降低靶抗原活性的能力。因此,“中和”抗-Ang-2抗体能消除或显著降低Ang-2的活性。中和Ang-2抗体可例如通过阻断Ang-2与其受体Tie2的结合而起作用。通过阻断这种结合,Tie2介导的信号转导被显著或完全消除。理想的抗Ang-2的中和抗体抑制血管发生。如本文所用术语“分离的多核苷酸”是指已经从其天然发生的环境中分离的多核苷酸。这种多核苷酸可以是基因组、cDNA或合成的多核苷酸。分离的多核苷酸优选与其天然缔合的所有或部分多核苷酸不相结合。所述分离的多核苷酸可以与天然不连接的另一种多核苷酸可操纵地连接。另外,分离的多核苷酸优选天然不以较大序列的一部分而出现。术语“分离的蛋白质”是指已经从其天然发生的环境中分离出的蛋白质。这种蛋白质可衍生自基因组DNA、cDNA、重组DNA、重组RNA或者是合成的或者这些组合,根据其来源或衍生来源,所述“分离的蛋白质”:(1)与自然发现的蛋白质不相结合,(2)没有相同来源的其它蛋白质,例如没有鼠蛋白质,(3)由不同物种的细胞表达,或者(4)自然不发生。在本文作为专业术语使用的术语“多肽”是指天然蛋白质、多肽序列的片段或类似物。因此,天然蛋白质、片段及类似物是所述多肽属种。本发明优选的多肽包含人重链免疫球蛋白分子和人κ轻链免疫球蛋白分子,以及包含通过重链免疫球蛋白分子与轻链免疫球蛋白分子如κ或λ轻链免疫球蛋白分子的组合形成的抗体分子(反之亦然),以及其片段或类似物。本发明优选的多肽也可仅包含人重链免疫球蛋白分子或其片段。如本文针对一个物体所用术语“天然发生的”是指该物体可在自然界发现。例如,存在于生物体(包括病毒)中可分离自一个天然来源及未在实验室中或另外人工有意修饰的多肽或多核苷酸序列是天然发生的。如本文所用术语“可操纵地连接”是指使所述成分以指定方式发挥作用的放置方式。例如,控制序列与编码序列“可操纵地连接”是指以这种方式所述编码序列的表达在与控制序列相容的条件下完成。如本文所用术语“控制序列”是指作用于或影响与其连接的编码序列的表达和加工所必需的多核苷酸序列。这种控制序列的性质依赖于宿主生物体而有所不同;在原核生物中,这种控制序列通常包括启动子、核糖体结合位点及转录终止序列;在真核生物中,这种控制序列可包括启动子、增强子、内含子、转录终止序列、聚腺苷酸化信号序列,及5'和3'非翻译区。术语“控制序列”是指最少包括其存在是表达和加工所必需的所有成分,也可包括其存在是有利的其它成分,例如前导序列和融合配偶体序列。术语“多核苷酸”是指长度为至少10个碱基的核苷酸的聚合形式,是核糖核苷酸或脱氧核苷酸或任一类型核苷酸的修饰形式,或者RNA-DNA杂合双链体。该术语包括单链和双链形式的DNA。术语“寡核苷酸”是指包括通过天然发生的及非天然发生的键连接在一起的天然发生的及修饰的核苷酸。寡核苷酸是通常包含200个或更少碱基的多核苷酸亚单位。优选地,寡核苷酸的长度为10-60个碱基,最优选长度为12、13、14、15、16、17、18、19或20至40个碱基。寡核苷酸通常是单链的,例如探针;但是寡核苷酸也可以是双链的,例如用于构建基因突变体。寡核苷酸可以是有义或反义寡核苷酸。术语“天然发生的核苷酸”是指包括脱氧核糖核苷酸及核糖核苷酸。术语“修饰的核苷酸”是指包括具有修饰或取代的糖基团等的核苷酸。术语“寡核苷酸键”是指包括如硫代磷酸酯、二硫代磷酸酯、phosphoroselenoate、phosphorodiselenoate、phosphoroanilothioate、phosphoraniladate、氨基磷酸盐等的寡核苷酸键。见例如LaPlancheetal.Nucl.AcidsRes.14:9081(1986);Stecetal.J.Am.Chem.Soc.106:6077(1984);Steinetal.Nucl.AcidsRes.16:3209(1988);Zonetal.Anti-CancerDrugDesign6:539(1991);Zonetal.OligonucleotidesandAnalogues:APracticalApproach,pp.87-108(F.Eckstein,Ed.,OxfordUniversityPress,OxfordEngland(1991));Stecetal.U.S.PatentNo.5,151,510;UhlmannandPeymanChemicalReviews90:543(1990)所述,所述文献内容在此并入作参考。如果需要,则寡核苷酸可包括一个标记以进行检测。术语“选择性杂交”是指可检测及特异性结合。多核苷酸、寡核苷酸及其片段在使与非特异性核酸的可检测结合的可测量降低至最小的杂交和洗涤条件下与核酸链选择性杂交。可使用高度严格条件达到本领域已知及本文论述的选择性杂交条件。通常地,多核苷酸、寡核苷酸或者抗体片段与感兴趣的核酸序列之间的核酸序列同源性为至少80%,更优选为至少85%、90%、95%、99%和100%同源性。两个氨基酸序列如果其序列之间部分或完全相同,则这两个氨基酸序列是“同源的”。例如,85%同源性是指当将两个氨基酸序列进行最大匹配排列对比时,85%的氨基酸是相同的。在最大匹配中允许缺口(在匹配的两个序列中的任一个中);优选缺口长度为5个或更少,更优选缺口长度为2个或更少。或者及优选地,如本文所用的该术语所描述,所述两个蛋白质序列在使用具有突变数据矩阵及缺口罚分为6或更高的ALIGN程序进行排列对比分值为5(标准差单位)以上,则这两个蛋白质序列是同源的。见Dayhoff,M.O.,inAtlasofProteinSequenceandStructure,pp.101-110(Volume5,NationalBiomedicalResearchFoundation(1972))及Supplement2tothisvolume,pp.1-10。当使用ALIGN程序最佳排列对比两个序列或其一部分时,如果其氨基酸是大于或等于50%相同的,则这两个序列或其一部分是更优选同源的。应意识到可以是在两个直系同源序列内同源的不同区域。例如,小鼠和人直向同源物的功能位点较非功能区可以具有较高程度的同源性。本文所用术语“相应于”是指一个多核苷酸序列与参考多核苷酸序列的全部或一部分是同源的(即相同的,非严格进化相关),或者一个多肽序列与参考多肽序列是相同的。对比之下,本文所用术语“互补于”是指所述互补序列与参考多核苷酸序列的全部或一部分是同源的。例如,核苷酸序列“TATAC”相应于参考序列“TATAC”,与参考序列“GTATA”互补。如下术语用于描述两或多个多核苷酸或氨基酸序列之间的序列关系:“参考序列”、“对比窗”、“序列相同性”、“序列相同性百分比”,及“基本上相同性”。“参考序列”是指用作序列对比基础的指定序列。参考序列可以是较大序列的亚单位,例如序列表中示出的全长cDNA或基因序列的节段,或者可以包含完全cDNA或基因序列。通常地,参考序列的长度为至少18个核苷酸或者6个氨基酸,通常为至少24个核苷酸或8个氨基酸,经常是至少48个核苷酸或16个氨基酸。由于两个多核苷酸或氨基酸序列可以均(1)包含在两个分子之间相似的一个序列(即完整多核苷酸或氨基酸序列的一部分),及(2)可进一步包含在两个多核苷酸或氨基酸序列之间不同的一个序列,因此两(或多)个分子之间的序列对比典型在“对比窗”中对比两个分子的序列而进行,以鉴别和对比序列相似性的局部区域。如本文所用术语“对比窗”是指至少大约18个连续的核苷酸位置或大约6个氨基酸的一个概念上的节段,其中将所述多核苷酸序列或氨基酸序列与至少18个连续核苷酸或6个氨基酸序列的参考序列进行对比,及其中所述对比窗中多核苷酸序列的一部分可包括与参考序列(不包含添加或缺失)相比有20%或更少的添加、缺失、取代等(即缺口)以进行两个序列的最佳排列对比。对于排列对比窗而进行的序列的最佳排列对比可通过SmithandWatermanAdv.Appl.Math.2:482(1981)的局部同源算法、通过NeedlemanandWunschJ.Mol.Biol.48:443(1970)的同源排列对比算法、通过PearsonandLipmanProc.Natl.Acad.Sci.(U.S.A.)85:2444(1988)的相似性搜索方法、通过这些算法的计算机执行方法(GAP,BESTFIT,FASTA,和TFASTA,theWisconsinGeneticsSoftwarePackageRelease7.0,(GeneticsComputerGroup,575ScienceDr.,Madison,Wis.),GENEWORKSTM,或软件包),或者通过审查(inspection)进行,选择通过各种方法产生的最佳排列对比(即在对比窗中产生最高百分比的同源性)。术语“序列相同性”是指在对比窗中的两个多核苷酸或氨基酸序列是相同的(即基于核苷酸-核苷酸或残基-残基)。术语“序列相同性百分比”是通过在对比窗中对比两个最佳排列的序列,确定这两个序列中出现的相同核酸碱基(例如A、T、C、G、U或I)或氨基酸残基的位置数目,产生匹配位置数目,将匹配位置数目除以对比窗中总位置数目(即窗大小),将结果乘以100而获得序列相同性百分比。如本文所用术语“基本上相同性”表示多核苷酸或氨基酸序列的一种特性,其中所述多核苷酸或氨基酸包含与至少18个核苷酸(6个氨基酸)位置的对比窗之上的参考序列相对比具有至少85%序列相同性、优选至少90-95%序列相同性、更优选至少99%序列相同性的序列,所述对比窗通常为至少24-48个核苷酸(8-16个氨基酸)位置,其中所述序列相同性百分比通过在对比窗中将参考序列与可包含参考序列的共20%或更少的缺失或添加的序列进行对比而计算。所述参考序列可以是较大序列的亚单位。如本文所用,常规应用二十个常规氨基酸及其缩略语。见并入本文作参考的Immunology-ASynthesis(2ndEdition,E.S.GolubandD.R.Gren,Eds.,SinauerAssociates,Sunderland,Mass.(1991))所述。所述二十个常规氨基酸的立体异构体(例如D-氨基酸)、非天然的氨基酸如α、α-双取代的氨基酸、N-烷基氨基酸、乳酸,及其它非常规的氨基酸也可以是本发明多肽的合适成分。非常规氨基酸的例子包括:4-羟基脯氨酸、γ-羧基谷氨酸、ε-N,N,N-三甲基赖氨酸、ε-N-乙酰赖氨酸、O-磷酸丝氨酸、N-乙酰丝氨酸、N-甲酰甲硫氨酸、3-甲基组氨酸、5-羟基赖氨酸、σ-N-甲基精氨酸,及其它相似的氨基酸和亚氨基酸(例如4-羟基脯氨酸)。在本文所用多肽表示法中,根据标准用法和惯例,左手方向是氨基末端方向,右手方向是羧基末端方向。相似地,除非特别说明,单链多核苷酸序列的左手末端是5'末端,双链多核苷酸序列的左手方向称作5'方向。新生的RNA转录体的5'至3'添加的方向称作转录方向;在具有与所述RNA相同序列的DNA链上的并且位于所述RNA转录体的5'末端的5’的序列区称作“上游序列”;在具有与所述RNA相同序列的DNA链上的并且位于所述RNA转录体的3'末端的3’的序列区称作“下游序列”。如对于多肽所用术语“实质上相同性(substantialidentity)”是指两个多肽序列当通过GAP或BESTFIT程序使用默认缺口权重进行最佳排列对比时,呈现至少80%的序列相同性、优选至少90%的序列相同性、更优选至少95%的序列相同性,最优选至少99%序列相同性。优选地,通过保守氨基酸取代,不同的残基位置不相同。保守的氨基酸取代是指具有相似侧链的残基的可交换性。例如,具有脂肪族侧链的一组氨基酸是:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;具有脂肪族-羟基侧链的一组氨基酸是丝氨酸和苏氨酸;具有含有酰胺侧链的一组氨基酸是天冬酰胺和谷氨酰胺;具有芳族侧链的一组氨基酸是苯丙氨酸、酪氨酸和色氨酸;具有碱性侧链的一组氨基酸是赖氨酸、精氨酸和组氨酸;具有含硫侧链的一组氨基酸是半胱氨酸和甲硫氨酸。优选的保守氨基酸取代组是:缬氨酸-亮氨酸-异亮氨酸,苯丙氨酸-酪氨酸,赖氨酸-精氨酸,丙氨酸-缬氨酸,谷氨酸-天冬氨酸,及天冬酰胺-谷氨酰胺。如本文所论述,本发明涵盖了抗体或免疫球蛋白分子的氨基酸序列中少量变化,条件是所述氨基酸序列中的变化保持与本文所述抗体或免疫球蛋白分子至少75%、更优选至少80%、90%、95%及更优选99%的序列相同性。特别地,本发明涵盖保守氨基酸置换。保守置换是在具有相关侧链的氨基酸家族内发生的置换。遗传编码的氨基酸通常被分为如下家族:(1)酸性=天冬氨酸,谷氨酸;(2)碱性=赖氨酸,精氨酸,组氨酸;(3)非极性=丙氨酸,缬氨酸,亮氨酸,异亮氨酸,脯氨酸,苯丙氨酸,甲硫氨酸,色氨酸;及(4)无电荷极性=甘氨酸,天冬酰胺,谷氨酰胺,半胱氨酸,丝氨酸,苏氨酸,酪氨酸。更优选的家族是:丝氨酸和苏氨酸是脂肪族-羟基家族;天冬酰胺和谷氨酰胺是含有酰胺的家族;丙氨酸、缬氨酸、亮氨酸和异亮氨酸是脂肪族家族;苯丙氨酸、色氨酸和酪氨酸是芳族家族。例如,有理由期望亮氨酸由异亮氨酸或缬氨酸置换、天冬氨酸由谷氨酸置换、苏氨酸由丝氨酸置换、或者氨基酸由具有结构相关的氨基酸的相似置换对所得分子的结合功能或性质无显著作用,特别是如果所述置换不涉及构架位点内的氨基酸。氨基酸改变是否产生一种功能性肽可易于通过分析所述多肽衍生物的特异性活性而确定。本文详细描述了分析方法。抗体或免疫球蛋白分子的片段或类似物可易于通过本领域技术人员已知的那些方法制备。片段或类似物的优选氨基和羧基末端在功能性结构域的边界附近出现。结构和功能性结构域可以通过将核苷酸和/或氨基酸序列数据与公开或私有的序列数据库进行对比而鉴别。优选地,使用计算机对比方法鉴别在已知结构和/或功能的其它蛋白质中出现的序列基序或预测的蛋白质构象结构域。本领域已知鉴别折叠成已知三维结构的蛋白质序列的方法(Bowieetal.Science253:164(1991))。因此,前述实例表明本领域技术人员可以识别可用于限定本文所述抗体的结构和功能结构域的序列基序和结构构象。优选的氨基酸取代是:(1)降低对蛋白酶解的易感性,(2)降低对氧化的易感性,(3)改变形成蛋白质复合物的结合亲和性,(4)改变结合亲和性,及(4)赋予或修饰这种类似物的其它物理化学或功能性质。类似物可包括除了天然发生的肽序列之外的序列的各种突变蛋白。例如,单一或多个氨基酸取代(优选保守氨基酸取代)可以在天然发生的序列中产生(优选在所述多肽形成分子间接触的结构域之外的部分中产生)。保守的氨基酸取代应不显著改变亲代序列的结构特性(例如氨基酸置换应不趋于破坏在亲代序列中出现的螺旋,或者不破坏亲代序列特征性的其它类型二级结构)。本领域认可的多肽二级和三级结构的例子在ProteinsStructuresandMolecularPrinciples(Creighton,Ed.W.H.FreemanandCompany,NewYork(1984));IntroductiontoProteinStructure(C.BrandenandJ.Tooze,eds.,GarlandPublishing,NewYork,N.Y.(1991));及Thorntonetat.Nature354:105(1991)中描述,所述文献在此并入本文作参考。如本文所用术语“多肽片段”是指这样的多肽,其具有氨基末端和/或羧基末端缺失、但仍保留与例如从全长cDNA序列中推导出的天然发生的序列中相应位置相同的氨基酸序列。所述片段的长度典型为至少5、6、8或10个氨基酸,优选至少14个氨基酸、更优选至少20个氨基酸、通常至少50个氨基酸、更优选至少70个氨基酸。如本文所用术语“类似物”是指这样的多肽,其包含与推导的氨基酸序列的一部分具有实质上相同性并且具有至少一种如下性质的至少25个氨基酸的一个节段:(1)在合适的结合条件下特异性结合Ang-2,(2)阻断适当的Ang-2结合的能力,或者(3)抑制Ang-2活性的能力。典型地,多肽类似物包含与天然发生的序列相关的保守氨基酸取代(或者添加或缺失)。类似物长度典型为至少20个氨基酸,优选至少50个氨基酸或更长,通常可以是全长天然发生的多肽那样长。肽类似物通常用于制药工业,作为具有与模板肽相似性质的非肽药物。这些类型的非肽化合物称作“肽模拟物”(Fauchere,JAdv.DrugRes.15:29(1986);VeberandFreidingerTINSp.392(1985);andEvansetal.J.Med.Chem.30:1229(1987),所述文献在此并入本文作参考)。这种化合物通常借助于计算机分子建模而产生。与具有治疗作用的肽结构相似的肽模拟物可用于产生相等的治疗或预防作用。通常地,肽模拟物与范例多肽(即具有生物化学性质或药物学活性的多肽)如人抗体结构相似,但有一或多个肽键任选通过本领域熟知的方法由选自如下的键置换:-CH2NH-、-CH2S-、-CH2-CH2-、-CH=CH-(顺式和反式)、-COCH2-、-CH(OH)CH2-及-CH2SO-。共有序列的一或多个氨基酸由相同类型的D-氨基酸的系统取代(例如D-赖氨酸代替L-赖氨酸)可用于产生更稳定的肽。另外,包含共有序列或基本相同的共有序列变化的约束肽(constrainedpeptide)可以通过本领域已知的方法产生(RizoandGieraschAnn.Rev.Biochem.61:387(1992),所述文献在此并入本文作参考);例如通过加入能形成使所述肽环化的分子内二硫键的内在半胱氨酸残基。如本文所用,术语“抗体”是指包含至少一个结合结构域的多肽或一组多肽,所述结合结构域是通过具有与抗原的抗原决定簇的特征互补的内部表面形状和电荷分布的三维结合空间的多肽链的折叠而形成的。抗体典型具有一种四聚体形式,包含两对相同多肽链,每对均具有一个轻链和一个重链。每个轻链/重链对的可变区均形成一个抗体结合位点。如本文所用,“靶向结合剂”是与靶位点优先结合的抗体或其结合片段。在一个实施方案中,所述靶向结合剂仅特异于一个靶位点。在其它实施方案中,所述靶结合剂特异于一个以上的靶位点。在一个实施方案中,所述靶结合剂可以是单克隆抗体,所述靶位点可以是表位。抗体的“结合片段”是通过重组DNA技术或者通过酶或化学切割完整的抗体而产生的。结合片段包括Fab、Fab'、F(ab')2、Fv和单链抗体。除了“双特异性”或“双功能性”抗体之外的抗体是指具有相同的每一个结合位点。当过量的抗体使与反受体结合的受体的数量降低至少大约20%、40%、60%或80%及更通常高于85%时(在体外竞争结合分析中测定),所述抗体基本上抑制受体与反受体的粘附。抗体可以是寡克隆抗体、多克隆抗体、单克隆抗体、嵌合抗体、CDR-接合的抗体、多特异性抗体、双特异性抗体、催化抗体、嵌合抗体、人源化抗体、完全人抗体、抗独特型抗体及可以可溶或结合形式标记的抗体以及所述抗体的片段、变体或衍生物,单独或与其它已知技术提供的氨基酸序列组合。抗体可以来自任何物种。术语“抗体”也包括本发明抗体的结合片段;所述片段例如包括Fv、Fab、Fab'、单链抗体(svFc)、二聚化可变区(Diabody)及二硫化物稳定的可变区(dsFv)。术语“表位”包括能特异结合免疫球蛋白或T细胞受体的任何蛋白质决定簇。表位决定簇通常由分子如氨基酸或糖侧链的化学活性表面组组成,及不总是具有特异性三维结构特征,以及特异性电荷特征。当解离常数≤1μM、优选≤100nM及最优选≤10nM时,所述抗体与所述抗原特异性结合。本文所用术语“制剂”是指化学化合物,化学化合物的混合物,生物学高分子,或者从生物学材料中制成的提取物。关于Ang-2多肽所用术语“活性的”或者“活性”是指Ang-2多肽的一部分,其具有天然Ang-2多肽的生物学或免疫学活性。本文所用术语“生物学的”是指得自天然Ang-2多肽活性的生物学功能。优选的Ang-2生物学活性包括例如Ang-2诱导的血管发生。本文所用术语“哺乳动物”是指被认为是哺乳动物的任何动物。优选所述哺乳动物是人。木瓜蛋白酶对抗体的消化产生两个相同的抗原结合片段Fab片段和Fc片段,Fc片段不具有抗原结合活性但具有结晶能力。胃蛋白酶对抗体的消化产生F(ab')2片段,其中抗体分子的两个臂保持连接,包含两个抗原结合位点。F(ab')2片段具有与抗原交联的能力。本文所用术语“Fv”是指抗体的最小片段,其既保留抗原识别位点也保留抗原结合位点。本文所用术语“Fab”是指抗体的片段,其包含轻链的恒定结构域和重链的CH1结构域。术语“mAb”是指单克隆抗体。本文所用术语“脂质体”是指小运载体,其可用于将可包括本发明的Ang-2多肽或者这种Ang-2多肽的抗体的药物输送至哺乳动物。如本文所用,术语“标记”或“标记的”是指向多肽中加入可检测的部分,例如放射性标记、荧光标记、酶标记、化学发光标记或者生物素基团。放射性同位素或放射性核素可包括3H、14C、15N、35S、90Y、99Tc、111In、125I、131I,荧光标记可包括罗丹明、镧族元素荧光粉或FITC,酶标记可包括辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶。如本文所用,术语“药物制剂或药物”是指当正确给予患者时能诱导希望的治疗作用的化学化合物或组合物。本文所用其它化学术语根据本领域的常规用法应用,例如在此并入本文作参考的TheMcGraw-HillDictionaryofChemicalTerms(Parker,S.,Ed.,McGraw-Hill,SanFrancisco(1985))所述。如本文所用,“基本上纯的”是指目标物种是最主要存在物种(即在摩尔基础上,其比组合物中任何其它个别物种均更充足),优选基本上纯的级分是其中目标物种包含至少大约50%(基于摩尔)的所有存在的高分子物种的组合物。通常地,基本上纯的组合物包含组合物中存在的大约80%以上的所有高分子物种,更优选大约85%、90%、95%及99%以上。最优选地,所述目标物种被纯化为基本同质的(组合物中污染物通过常规检测方法不可检测到),其中所述组合物基本由一种高分子物种组成。术语“患者”包括人及动物。人抗体和抗体的人源化人抗体避免了一些与具有小鼠或大鼠可变和/或恒定区的抗体相关问题。这种小鼠或大鼠衍生的蛋白质的存在可以导致抗体的快速清除或者可以导致患者针对所述抗体的免疫应答的产生。为了避免利用小鼠或大鼠衍生的抗体,可以通过将功能性人抗体基因座导入啮齿动物、其它哺乳动物或动物中,由此所述啮齿动物、其它哺乳动物或动物产生完全人抗体,从而产生完全人抗体。一种产生完全人抗体的方法是通过使用小鼠品系,其已经工程化为含有小于等于1000kb大小的人重链基因座和κ轻链基因座的种系构型片段。见Mendezetal.NatureGenetics15:146-156(1997)和GreenandJakobovitsJ.Exp.Med.188:483-495(1998)所述。品系可得自Abgenix公司(Fremont,CA)。小鼠品系的产生在如下文献中进一步论述和描绘:1990年1月12日申请的美国专利申请系列号07/466,008、1990年11月8日申请的07/610,515、1992年7月24日申请的07/919,297、1992年7月30日申请的07/922,649、1993年3月15日申请的08/031,801、1993年8月27日申请的08/112,848、1994年4月28日申请的08/234,145、1995年1月20日申请的08/376,279,、1995年4月27日申请的08/430,938、1995年6月5日申请的08/464,584、1995年6月5日申请的08/464,582、1995年6月5日申请的08/463,191、1995年6月5日申请的08/462,837、1995年6月5日申请的08/486,853、1995年6月5日申请的08/486,857、1995年6月5日申请的08/486,859、1995年6月5日申请的08/462,513、1996年10月2日申请的08/724,752、1996年12月3日申请的08/759,620、2001年11月30日申请的美国出版物2003/0093820及美国专利No.6,162,963、6,150,584、6,114,598、6,075,181和5,939,598及日本专利No.3068180B2、3068506B2和3068507B2。也见于1996年6月12日准予公布的欧洲专利No.,EP0463151Bl,1994年2月3日公布的国际专利申请No.WO94/02602,1996年10月31日公布的国际专利申请No.WO96/34096,1998年6月11日公布的WO98/24893,2000年12月21日公布的WO00/76310。上述引用的专利、申请和参考文献在此均以其全文并入作参考。在另一种方法中,包括GenPharmInternational公司,利用“小基因座(minilocus)”方法。在所述小基因座方法中,通过包含Ig基因座的一部分(各个基因)而模拟外源Ig基因座。因此,一或多个VH基因、一或多个DH基因、一或多个JH基因、一个μ恒定区及通常另一个恒定区(优选γ恒定区)形成一个构建体,以插入动物中。这种方法在Surani等的美国专利No.5,545,807及Lonberg和Kay的美国专利Nos.5,545,806、5,625,825、5,625,126、5,633,425、5,661,016、5,770,429、5,789,650、5,814,318、5,877,397、5,874,299和6,255,458,Krimpenfort和Berns的美国专利No.5,591,669和6,023.010,Berns等的美国专利Nos.5,612,205、5,721,367和5,789,215,及Choi和Dunn的美国专利No.5,643,763,及GenPharm国际美国专利申请系列1990年8月29日申请的No.07/574,748、1990年8月31日申请的07/575,962、1991年12月17日申请的07/810,279、1992年3月18日申请的07/853,408、1992年6月23日申请的07/904,068、1992年12月16日申请的07/990,860、1993年4月26日申请的08/053,131、1993年7月22日申请的08/096,762、1993年11月18日申请的08/155,301、1993年12月3日申请的08/161,739、1993年12月10日申请的08/165,699、1994年3月9日申请的08/209,741中描述,所述文献在此并入本文作参考。也见于欧洲专利No.0546073Bl、国际专利申请号WO92/03918、WO92/22645、WO92/22647、WO92/22670、WO93/12227、WO94/00569、WO94/25585、WO96/14436、WO97/13852和WO98/24884及美国专利No.5,981,175所述,所述文献在此以其全部并入本文作参考。进一步见Tayloretal,1992、Chenetal,1993、Tuaillonetal,1993、Choietal,1993、Lonbergetal,(1994)、Tayloretal,(1994)及Tuaillonetal,(1995)、Fishwildetal,(1996)所描述,所述文献在此以其全文并入作参考。Kirin已经证实了从通过微细胞融合已经导入了大量染色体部分或全部染色体的小鼠中产生人抗体。见欧洲专利申请号773288和843961所述,所述文献在此以其全文并入作参考。另外,已经产生了Kirin'sTc小鼠与Medarex's小基因座(Humab)小鼠杂交培育而产生的KMTM-小鼠。这些小鼠具有Kirin小鼠的人IgH转染色体(transchromosome)及Genpharm小鼠的κ链转基因(Ishidaetal,CloningStemCells,(2002)4:91-102)。人抗体也可以通过体外方法产生。合适的例子包括但非限于噬菌体展示(CAT,Morphosys,Dyax,Biosite/Medarex,Xoma,Symphogen,Alexion(先前称作Proliferon),Affimed)、核糖体展示(CAT)、酵母展示等。抗体的制备如本文所述,抗体是通过利用如下文描述的技术制备的。然后,这种小鼠能产生人免疫球蛋白分子和抗体,不能产生小鼠免疫球蛋白分子和抗体。用于实现该目的的技术在本文发明背景章节中揭示的专利、申请和参考文献中揭示。然而,产生转基因小鼠及从中产生抗体的优选实施方案在如下文献中揭示:1996年12月3日申请的美国专利申请系列No.08/759,620及1998年6月11日公布的国际专利申请Nos.WO98/24893及2000年12月21日公布的WO00/76310,所述文献在此并入作参考。也见于Mendezetal.NatureGenetics15:146-156(1997)所述,所述文献在此并入作参考。通过应用这种技术,产生了多种抗原的完全人单克隆抗体。基本上,将小鼠品系用感兴趣的抗原(例如Ang-2)免疫,从超免疫的小鼠中回收淋巴细胞(如B-细胞),将回收的淋巴细胞与骨髓型细胞系融合以制备无限增殖的杂交瘤细胞系。对这些杂交瘤细胞系进行筛选及选择,以鉴别产生特异于所述感兴趣的抗原的抗体。本发明提供了产生特异于Ang-1和Ang-2的抗体的多个杂交瘤细胞系的生产方法。另外,本发明提供了由这种细胞系产生的抗体的鉴定,包括对这种抗体的重链和轻链进行核苷酸和氨基酸序列分析。或者,代替与骨髓瘤细胞融合以产生杂交瘤,可以对B细胞进行直接分析。例如,可以从超免疫的小鼠分离CD19+B细胞,使所述细胞增殖及分化为分泌抗体的浆细胞。然后对细胞上清中的抗体通过ELISA筛选针对Ang-2免疫原的反应性。也可以对上清筛选针对Ang-2片段的免疫反应性,以进一步对结合Ang-2上感兴趣的功能结构域的不同抗体作图。对所述抗体也可以针对Ang-1、Ang-3或Ang-4、其它相关的人趋化因子进行筛选,及针对大鼠、小鼠、非人灵长类动物如Cynomolgus猴筛选Ang-2的直向同源物,最后确定物种的交叉反应性。来自含有感兴趣的抗体的孔的B细胞可以通过多种方法无限增殖化,包括通过融合从一个或多个孔中产生杂交瘤,或者通过用EBV感染或通过已知的无限增殖化基因转染,然后铺板于合适的培养基中而进行。或者,使用Ang-1或Ang-2特异性溶血性噬斑分析分离分泌具有所需特异性的抗体的单个浆细胞(见例如Babcooketal,Proc.Natl.Acad.Sci.USA93:7843-48(1996))。靶向裂解的细胞优选是用Ang-2抗原包被的绵羊红细胞(SRBC)。在筛选也能拮抗血管生成素-1的抗体中,可同样使用上述方法,以血管生成素-1代替血管生成素-2。在存在含有分泌感兴趣的免疫球蛋白及补体的浆细胞的B细胞培养物的情况中,噬斑的形成表明特异性Ang-l/Ang-2-介导的所述感兴趣的浆细胞周围的绵羊红细胞的裂解。可以分离所述噬斑中心的单一抗原特异性浆细胞,从所述单一浆细胞中分离编码所述抗体特异性的遗传信息。使用反转录及随后的PCR(RT-PCR),可以克隆编码所述抗体重链和轻链可变区的DNA。然后,可将这种克隆的DNA进一步插入合适的表达载体中,优选载体盒如pcDNA,更优选如含有免疫球蛋白重链和轻链的恒定结构域的这种pcDNA载体。然后将产生的载体转染进宿主细胞中,例如HEK293细胞、CHO细胞,在经修改为适合诱导转录、选择转化体或者扩增编码希望序列的基因的常规营养培养基中培养。通常,通过融合的杂交瘤产生的抗体是具有完全人κ或λ轻链的人IgG2重链。本文描述的抗体具有人IgG4重链以及IgG2重链。抗体也可以是其它人同种型,包括IgGl。当通过固相和液相技术测定时,所述抗体具有高亲和性,典型具有Kd为大约10-6至大约10-12M或更低。优选Kd为至少10-11M的抗体抑制Ang-1和/或Ang-2的活性。如将为本领域所意识到,抗体可以在除了杂交瘤细胞系之外的细胞系中表达。编码特定抗体的序列可用于转化合适的哺乳动物宿主细胞。可以通过任何已知的方法进行转化,以将多核苷酸导入宿主细胞中,包括例如在病毒中包装所述多核苷酸(或者包装进病毒载体中)及用病毒(或载体)转导宿主细胞或者通过本领域已知的转染方法进行,例如美国专利Nos.4,399,216、4,912,040、4,740,461和4,959,455所例证(所述专利在此并入本文作参考)。所用的转化方法依赖于被转化的宿主。将异源多核苷酸导入哺乳动物细胞中的方法为本领域所熟知,包括葡聚糖介导的转染,磷酸钙沉淀,polybrene介导的转染,原生质体融合,电穿孔,将所述多核苷酸包囊在脂质体中,及将DNA直接显微注射进细胞核中。可用于表达的宿主的哺乳动物细胞系为本领域所熟知,包括得自美国典型培养物保藏中心(ATCC)的许多无限增殖化的细胞系,包括但非限于中国仓鼠卵巢(CHO)细胞、HeLa细胞、幼仓鼠肾(BHK)细胞、猴肾细胞(COS)、人肝细胞癌细胞(例如HepG2)、人上皮肾293细胞、及许多其它细胞系。通过确定哪个细胞系具有高表达水平及产生具有基本的Ang-2结合性质的抗体以选择特别优选的细胞系。基于mAb显著中和血管生成素-1和血管生成素-2活性的能力(在下文实施例中证实),这些抗体在治疗由于血管生成素-1和/或血管生成素-2表达所致的症状和病变中将具有治疗作用。在特异的实施方案中,本发明的抗体和方法涉及治疗血管生成素-1和/或血管生成素-2诱导的血管发生导致的症状。根据本发明的另一方面,提供了一种药物组合物,其包含血管生成素-1和血管生成素-2的生物学活性拮抗剂及一种药物可接受的载体。在一个实施方案中,所述拮抗剂包含抗体。根据本发明的另一方面,提供了一种药物组合物,其包含血管生成素-2的生物学活性拮抗剂及一种药物可接受的载体。在一个实施方案中,所述拮抗剂包含抗体。抗-Ang-2抗体可用于检测患者样品中的Ang-2及因此可用作本文所述疾病状态的诊断剂。另外,基于其显著中和Ang-2活性的能力(如下文实施例中所论述),抗-Ang-2抗体在治疗由于Ang-2表达导致的症状和病变中具有治疗作用。在特异的实施方案中,本发明的抗体和方法涉及治疗由于Ang-2诱导的血管发生导致的症状。进一步的实施方案包括使用本发明的抗体和方法治疗血管发生相关的疾病,包括肿瘤疾病如黑素瘤、小细胞肺癌、非小细胞肺癌、神经胶质瘤、肝细胞(肝)癌、甲状腺肿瘤、胃癌、前列腺癌、乳腺癌、卵巢癌、膀胱癌、肺癌、成胶质细胞瘤、子宫内膜癌、肾癌、结肠癌及胰腺癌。治疗性给药和制剂本发明的实施方案包括结合Ang-1和Ang-2的抗Ang-2抗体的无菌药物制剂,其可用于治疗疾病。这种制剂抑制Ang-2或Ang-1及Ang-2与其受体Tie2的结合,从而有效治疗其中例如血清或组织Ang-1和/或Ang-2异常增高的病理学病变。抗-Ang-2抗体优选具有足够的亲和性以有力地中和Ang-2,及优选具有足够的作用时间以可以不用频繁地给予人体。抗-Ang-1/Ang-2抗体优选具有足够的亲和性以有力中和Ang-1和Ang-2,及优选具有足够的作用时间以可以不用频繁地给予人体。作用时间延长可以不用频繁地及更方便地通过交替胃肠外途径如皮下或肌内注射途径给药。无菌制剂可以例如通过无菌过滤膜过滤而产生,之后冻干及复水(reconstitution)所述抗体。所述抗体通常以冻干形式或溶液形式贮存。治疗性抗体组合物通常置于具有无菌进出口的容器中,例如具有可以取出所述制剂的无菌盖子(adapter)的静脉内溶液包或小瓶,所述盖子如通过皮下注射器刺穿的塞子。根据已知方法确定抗体给予途径,例如通过静脉内、腹膜内、脑内、肌内、眼内、动脉内、鞘内、吸入或损伤内途径注射或灌注或者通过下文指出的持续释放系统给予。所述抗体优选通过输注或通过推注方式连续给予。治疗性应用的抗体的有效量依赖于例如治疗目的、给予途径和患者的状况而定。因此,优选医生根据需要确定剂量和修改给予途径以获得最佳的治疗作用。典型地,临床医生将给予抗体直至达到希望作用的剂量。这种治疗方法的过程易于通过常规分析或通过本文描述的分析方法而监测。如本文所述,抗体可以与一种药物可接受的载体一起制备成混合物。这种治疗组合物可以静脉内或者通过鼻或肺、优选作为液体或粉末气雾剂(冻干的)形式给予。根据需要,所述组合物也可以胃肠外或皮下给予。当系统给予时,所述治疗组合物应是无菌的、无热原的及于具有适当pH、等渗性和稳定性的胃肠外可接受的溶液中。这些条件为本领域技术人员所已知。简而言之,本文所述化合物的剂型的制备是将具有希望纯度的化合物与生理学可接受的载体、赋形剂或稳定剂混合以贮存或者给予。这种材料在应用剂量和浓度对于受体无毒性,包括缓冲液如TRISHCl、磷酸盐、柠檬酸盐、乙酸盐及其他有机酸盐;抗氧化剂如抗坏血酸;低分子量(低于大约10个残基)肽如聚精氨酸,蛋白质如血清白蛋白,明胶,或者免疫球蛋白;亲水性聚合物如聚乙烯吡咯烷酮;氨基酸如甘氨酸、谷氨酸、天冬氨酸、或精氨酸;单糖、二糖及其它碳水化合物包括纤维素或其衍生物、葡萄糖、甘露糖或糊精;螯合剂如EDTA;糖醇如甘露糖醇或山梨糖醇;带相反电荷的离子如钠和/或非离子表面活性剂如TWEEN、PLURONICS或聚乙二醇。用于注射的无菌组合物可以根据常规制药方法配制,如Remington:TheScienceandPracticeofPharmacy(20thed,LippincottWilliams&WilkensPublishers(2003))。例如,希望的是活性化合物于载体如水或天然发生的植物油如芝麻、花生或棉籽油或合成的脂肪载体如油酸乙酯等中的溶解或悬浮液。根据公认的制药方法可以掺入缓冲液、防腐剂、抗氧化剂等。合适的持续释放制备物的例子包括含有所述多肽的固体疏水性聚合物的半透性基质,所述基质是成形物品、薄膜或微胶囊形式。持续释放基质的例子包括聚酯、水凝胶(例如聚(2-羟乙基-甲基丙烯酸酯),如Langeretal,J.BiomedMater.Res.,(1981)15:167-277及Langer,Chem.Tech.,(1982)12:98-105所述,或者聚(乙烯醇)),聚交酯(美国专利No.3,773,919,EP58,481),L-谷氨酸与γ乙基-L-谷氨酸酯的共聚物(Sidmanetal.,Biopolymers,(1983)22:547-556),不可降解的乙烯-醋酸乙烯酯(Langeretal,如前),可降解的乳酸-乙醇酸共聚物如LUPRONDepotTM(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林(leuprolideacetate)组成的可注射的微球体)及聚-D-(-)-3-羟基丁酸(EP133,988)。聚合物如乙烯-醋酸乙烯酯和乳酸-乙醇酸可以释放分子100天以上,某些水凝胶则较短时间地释放蛋白质。当包囊化的蛋白质在体内长时间保持时,由于暴露于37℃的潮湿环境下也许会变性或聚集,而导致生物学活性丧失及可能的免疫原性改变。根据所涉及的机制可以设计合理的方案使得蛋白质稳定。例如,如果发现聚集机制是由于二硫化物交换而形成分子间S-S键的结果,则可以通过修饰巯基残基、从酸性溶液中冻干、控制水分含量、使用合适的添加剂及产生特异性聚合物基质组合物而实现稳定。持续释放的组合物也包括悬浮于能保持晶体在悬浮液中的合适制剂中的所述抗体晶体的制备物。这些制备物当经皮下或腹膜内注射时可产生持续释放作用。其它组合物也可包括脂质体包裹的抗体。含有这种抗体的脂质体通过如下文献所述方法制备:美国专利No.DE3,218,121;Epsteinetal,Proc.Natl.Acad.SciUSA,(1985)82:3688-3692;Hwangetal.,Proc.Natl.Acad.Sci.USA,(1980)77:4030-4034;EP52,322;EP36,676;EP88,046;EP143,949;142,641;日本专利申请83-118008;美国专利Nos.4,485,045和4,544,545;及EP102,324。给予一定患者的抗体制剂的剂量由主治医生根据考虑已知改变药物作用的不同因素包括疾病严重程度和类型、体重、性别、饮食、给予时间和途径、其它药物及其它相关临床因素而确定。治疗有效剂量可以在体外或体内方法中确定。本文描述的治疗应用的抗体的有效量依赖于例如治疗目标、给予途径及患者的状况。因此,优选医生根据需要确定给予的剂量及修改给予途径,以获得最佳治疗作用。典型的每日剂量范围依赖于上述因素可以是从大约0.001mg/kg至最多100mg/kg或更多。典型地,临床医生给予治疗性抗体直至达到实现希望的作用的剂量。这种治疗方法的过程易于通过常规或本文描述的分析方法监测。本领域意识到本发明的组合物和方法中的治疗实体的给予是与合适的载体、赋形剂及掺入制剂中的其它物质一起给予的,以提供改良的转移、输送、耐受等作用。这些制剂包括例如粉末、糊、软膏、凝胶、蜡状物、油状物、脂质、含有脂质(阳离子或阴离子)的载体(如LipofectinTM)、DNA缀合物、无水吸收糊、水包油和油包水乳状液、乳状液聚乙二醇(各种分子量的聚乙二醇)、半固体凝胶、及含有聚乙二醇的半固体混合物。任何前述混合物均可适当用于本发明的治疗中,条件是制剂中的活性成分不被该制剂失活,及所述制剂是生理学相容的及耐受给予途径。也见于BaldrickP."Pharmaceuticalexcipientdevelopment:theneedforpreclinicalguidance."Regul.Toxicol.Pharmacol.32(2):210-8(2000)、WangW."Lyophilizationanddevelopmentofsolidproteinpharmaceuticals."Int.J.Pharm.203(1-2):1-60(2000)、CharmanWN"Lipids,lipophilicdrugs,andoraldrugdelivery-someemergingconcepts."JPharmSci.89(8):967-78(2000)、Powelletal."Compendiumofexcipientsforparenteralformulations"PDAJPharmSciTechnol.52:238-311(1998)及其中引用的关于药物化学熟知的制剂、赋形剂和载体的其它信息。组合本文描述的抗血管发生治疗方法可以作为唯一的疗法应用,或者除了本发明的化合物之外还可包含常规的手术或放疗或化疗。这种化疗可包括一或多种如下抗肿瘤药物:(i)细胞生长抑制剂如抗雌激素物质(例如三苯氧胺、toremifene、raloxifene、droloxifene和iodoxyfene),雌激素受体负调节物(例如fulvestrant),抗雄激素物质(例如bicalutamide、fiutamide、nilutamide和乙酸环丙孕酮),LHRH拮抗剂或LHRH激动剂(例如goserelin、leuprorelin和buserelin),孕激素(例如乙酸甲地孕酮),aromatase抑制剂(例如anastrozole、letrozole、vorazole和exemestane)及5*还原酶的抑制剂如finasteride;(ii)抑制癌细胞侵润的物质(例如金属蛋白酶抑制剂样marimastat及尿激酶纤溶酶原激活物受体功能的抑制剂);(iii)生长因子功能抑制剂,例如这种抑制剂包括生长因子抗体,生长因子受体抗体(例如抗erbb2抗体trastuzumab[HerceptinTM]及抗erbb1抗体cetuximab[C225]),法呢基转移酶抑制剂,酪氨酸激酶抑制剂及丝氨酸/苏氨酸激酶抑制剂,例如表皮生长因子家族的抑制剂(例如EGFR家族酪氨酸激酶抑制剂如N(3氯4氟苯基)7甲氧基6(3吗啉基丙氧基)喹唑啉4胺(gefitinib,AZD1839),N(3乙炔基苯基)6,7二(2甲氧基乙氧基)喹唑啉4胺(erlotinib,OSI774)和6丙烯酰胺基N(3氯4氟苯基)7(3吗啉基丙氧基)喹唑啉4胺(CI1033)),例如血小板衍生生长因子家族抑制剂和例如肝细胞生长因子家族抑制剂;(iv)抗血管发生物质如抑制血管内皮生长因子的作用的那些(例如抗血管内皮细胞生长因子抗体bevacizumab[AvastinTM],抗血管内皮生长因子受体抗体如抗-KDR抗体和抗-fit1抗体,如国际专利申请WO97/22596、WO97/30035、WO97/3285、WO98/13354、WO00/47212和WO01/32651)揭示的化合物及其它作用机制的化合物(例如linomide,整联蛋白avb3功能的抑制剂和制管张素);(v)血管破坏物质如CombretastatinA4及国际专利申请WO99/02166、WO00/40529、WO00/41669、WO01/92224、WO02/04434和WO02/08213中揭示的化合物;(vi)反义治疗,例如针对上述靶位的那些,如ISIS2503,一种抗ras反义;(vii)基因治疗方法,包括例如替换异常基因如异常的p53或异常的BRCA1或BRCA2的方法,GDEPT(基因导向酶前体药物治疗)方法,如使用胞嘧啶脱氨酶、胸腺嘧啶激酶或细菌硝基还原酶的那些方法,及增加患者对化疗或放疗耐受性的方法,如多药物抗性基因治疗;(viii)免疫治疗方法,包括例如增加患者肿瘤细胞免疫原性的回体(exvivo)及体内方法,如用细胞因子如白细胞介素2、白细胞介素4或粒细胞巨噬细胞集落刺激因子转染,降低T细胞无反应性的方法,使用转染的免疫细胞如细胞因子转染的树突细胞的方法,使用细胞因子转染的肿瘤细胞系的方法,及使用抗独特型抗体的方法。在本发明的一个实施方案中,本发明的抗血管发生治疗与抑制血管内皮生长因子(VEGF)作用的物质(例如抗血管内皮细胞生长因子抗体bevacizumab抗血管内皮生长因子受体抗体如抗-KDR抗体和抗-fltl抗体,如国际专利申请WO97/22596、WO97/30035、WO97/3285、WO98/13354、WO00/47212和WO01/32651揭示的化合物)及具有其它作用机制的化合物(例如linomide,整联蛋白avb3功能抑制剂及制管张素)组合应用;在本发明另一实施方案中,本发明的抗血管发生治疗与抑制血管内皮生长因子受体KDR的酪氨酸激酶活性的物质(例如AZD2171或AZD6474)组合。关于AZD2171的详细描述可见于Wedgeetal(2005)CancerResearch.65(10):4389-400。关于AZD6474的另外的详细描述可见于Ryan&Wedge(2005)BritishJournalofCancer.92Suppl1:S6-13。这两个出版物在此均以其全文并入作参考。在本发明另一个实施方案中,完全人抗体3.19.3、3.3.2或5.88.3单独或与AvastinTM、AZD2171或AZD6474组合应用。这种联合治疗可以通过同时、相继或单独给予各个治疗成分而实现。这种组合产物应用在前述剂量范围内的本发明的化合物或者其药物可接受的盐及在许可剂量范围内的其它药物活性物质。实施例提供了如下实施例,包括进行的实验和获得的结果只是用于说明的目的,不应解释为限制本发明。实施例1免疫和滴定免疫使用得自R&DSystems,Inc.的重组人Ang-2(Minneapolis,MNCat.No.623-AM/CF)作为抗原。通过系列免疫小鼠(XenoMouse株系XMG2和XMG4(3C-1株系),Abgenix,Inc.Fremont,CA)而产生抗Ang-2单克隆抗体。对于所有注射,XenoMouse动物均经足垫途径进行免疫。每次注射的总体积是50μl/小鼠,25μl/足垫。第一次注射是每只小鼠使用2.35μg在无热原的Dulbecco'sPBS(DPBS)中的重组人Ang-2(rhAng-2,cat#623-AM/CF;lot#BN023202A)并以1:1v/v与10μgCpG(15μlImmunEasyMouseAdjuvant,catalog#303101;lot#11553042;Qiagen)混合。以后的6次加强是每只小鼠使用2.35μg在无热原DPBS中的rhANG-2并混合25μgAdju-Phos(磷酸铝凝胶,Catalog#1452-250,batch#8937,HCIBiosector)和10μgCpG,随后为最后一次加强,其使用2.35μg在无热原DPBS中的rhAng-2,不加佐剂。免疫XenoMouse小鼠在第0,3,6,10,13,17,20和24天进行这一方案,在第29天进行融合。通过效价选择收获动物用ELISA测定来自免疫的XenoMouse小鼠的血清中的抗Ang-2抗体效价。简而言之,将以四种程度在抗原包被缓冲液(0.1M碳酸盐缓冲液,pH9.6NaHCO38.4g/L)中的重组Ang-2(1μg/ml)过夜包被到CostarLabcoatUniversalBindingPolystyrene96孔板(Corning,Acton,MA)上。第二天,用Biotek洗板器将平板用洗涤缓冲液(0.05%Tween20于1xPBS中)洗3次。然后用200μl/孔封闭缓冲液(0.5%BSA,0.1%Tween20,0.01%Thimerosal于1xPBS中)封闭平板并在室温保温1小时。1小时封闭后,使用Biotek洗板器将平板用洗涤缓冲液洗3次。来自Ang-2免疫的小鼠或未实验过的XenoMouse动物的血清在0.5%BSA/PBS缓冲液中滴定,实验使用来自1:100初始稀释液的1:3稀释液,一式二份。最后一个孔为空白。将这些平板在室温保温2小时,然后使用Biotek洗板器将平板用洗涤缓冲液洗3次。以1μg/ml的终浓度加入山羊抗人IgGFc特异性辣根过氧化物酶(HRP,Pierce,Rockford,IL)缀合的抗体,并在室温保温1小时。然后使用Biotek洗板器将平板用洗涤缓冲液洗3次。洗涤后,加入TMB生色底物(BioFxBSTP-0100-01)使平板显色10-20分钟或直至阴性对照孔开始显示颜色。然后,通过添加终止溶液(650nM用于TMB的终止试剂(BioFxBSTP-0100-01),每瓶用100ml水复水)而终止ELISA。每个XenoMouse动物的特异性效价是根据650nm的光密度确定的,并在下表2和表3中示出。效价值是OD读数为背景的两倍的血清最大稀释度的倒数。因此,数值越高,对Ang-2的体液免疫应答越高。表2组1:10个小鼠(XMG2株系)*NC=xmg2株系,ovagp2,fp*PC=山羊AB,抗huAng-2(R&DSystems,CatalogNo.AF623)1mg/ml表3组2:10个小鼠(XMG4株系)*NC=3c-lN128-3*PC=山羊AB,抗huAng-2(R&DSystems,CatalogNo.AF623)1mg/ml实施例2回收淋巴细胞、B细胞分离、融合和产生杂交瘤免疫的小鼠通过颈错位处死,收集引流淋巴结并集合每一组的淋巴结。通过在DMEM中研磨而解离淋巴样细胞以从组织中释放细胞并且将细胞悬浮于DMEM中。计数细胞,向细胞沉淀中以每1亿个淋巴细胞中加入0.9mlDMEM而温和充分地重悬细胞。每1亿个细胞使用100μlCD90+磁珠,通过将细胞与磁珠在4℃保温15分钟而标记细胞。将含有至多108个阳性细胞(或至多2x109个总细胞)的磁标记的细胞悬液上样至LS+柱并用DMEM洗柱。收集总流出液作为CD90阴性级分(这些细胞的大多数预期是B细胞)。融合是通过以1:1的比例混合来自以上的经洗涤和富集的B细胞与购自ATCC,cat.#CRL1580(Kearneyetal,J.Immunol.123,1979,1548-1550)的非分泌型骨髓瘤P3X63Ag8.653细胞而进行。在800xg离心而温和沉淀细胞混合物。完全除去上清后,将细胞用2-4mLPronase溶液(CalBiochem,cat.#53702;0.5mg/ml于PBS中)处理不超过2分钟。然后加入3-5mlFBS以终止酶活性,并用细胞电融合溶液(ECFS,0.3M蔗糖,Sigma,Cat#S7903,0.1mM醋酸镁,Sigma,Cat#M2545,0.1mM醋酸钙,Sigma,Cat#C4705)将悬浮液调整至总体积为40ml。离心后除去上清,将细胞重悬于40mlECFS中。重复这一洗涤步骤,再次将细胞重悬于ECFS至浓度为2x106细胞/ml。细胞电融合使用融合发生器(型号ECM2001,Genetronic,Inc.,SanDiego,CA)进行。所用融合腔大小为2.0ml,使用如下仪器设置:Alignment条件:电压:50V,时间:50sec.破膜:电压:3000V,时间:30μsec融合后保持时间:3secECF之后,在无菌条件下小心地将细胞悬液从融合腔中移出,转移至一无菌试管中,该试管中含有相同体积的杂交瘤培养基(DMEM,JRHBiosciences)、15%FBS(Hyclone),补加L-谷氨酰胺、pen/strep、OPI(草酰乙酸盐、丙酮酸盐、牛胰岛素)(均来自Sigma)和IL-6(BoehringerMannheim)。细胞在37℃保温15-30分钟,然后在400xg(1000rpm)离心5分钟。将细胞轻轻重悬于小体积杂交瘤选择培养基(补加0.5xHA(Sigma,cat.#A9666)的杂交瘤培养基)中,基于每个96孔板最终铺板总共5x106个B细胞以及每孔200μl,用更多的杂交瘤选择培养基合适地调节体积。将细胞轻轻混合并吸至96孔板中生长。在第7天或第10天,除去一半培养基,并用杂交瘤选择培养基再饲养细胞。实施例3通过ELISA选择候选抗体培养14天后,筛选杂交瘤上清是否存在Ang-2特异性单克隆抗体。ELISA平板(Fisher,Cat.No.12-565-136)用50μl/孔在包被缓冲液(0.1M碳酸盐缓冲液,pH9.6,NaHCO38.4g/L)中的人Ang-2(2μg/ml)包被,然后在4℃保温过夜。保温后,用洗涤缓冲液(0.05%Tween20于PBS中)洗平板3次。加入200μl/孔封闭缓冲液(0.5%BSA,0.1%Tween20,0.01%Thimerosal于1xPBS中)并在室温保温平板1小时。保温后,用洗涤缓冲液洗平板3次。加入50μl/孔杂交瘤上清和阳性及阴性对照,在室温保温平板2小时。所用的阳性对照是来自Ang-2免疫的XenoMouse小鼠XMG2Ang-2组1,足垫(fp)N160-7的血清,阴性对照是来自KLH免疫的XenoMouse小鼠XMG2KLH组1,足垫(fp)L627-6的血清。保温后,用洗涤缓冲液洗平板3次。加入100μl/孔检测抗体山羊抗huIgGFc-HRP(Caltag,Cat.No.H10507),并在室温保温平板1小时。在第二轮筛选中,对第一轮筛选中呈阳性的进行两套筛选,一套检测hIgG,另一套检测人Igκ轻链(山羊抗hIgkappa-HRP(SouthernBiotechnology,Cat.No.2060-05),以证实IgG和Igkappa均为完全的人类组成。保温后,用洗涤缓冲液洗平板3次。加入100μl/孔TMB(BioFXLab.Cat.No.TMSK-0100-01)并使平板显色约10分钟(直至阴性对照孔刚刚开始显示颜色)。然后加入50μl/孔终止溶液(TMB终止溶液(BioFXLab.Cat.No.STPR-0100-01))并将平板在ELISA平板阅读器上于450nm读数。有185个抗Ang-2的完全人类IgGkappa抗体。对在ELISA测定中结合的所有抗体根据ELISA进行针对结合Ang-1的反筛选(counterscreened)以排除与Ang-1交叉反应的那些抗体。ELISA平板(Fisher,Cat.No.12-565-136)用在包被缓冲液(0.1M碳酸盐缓冲液,pH9.6,NaHCO38.4g/L)中的50μl/孔重组Ang-1(2μg/ml,得自R&DSystems,Cat.#293-AN-025/CF)包被,然后在4℃保温过夜。在此处所述实验条件下,当重组Ang-1分子固定在ELISA平板上时,未发现与Ang-1结合的抗体。但是,此处描述的反筛选有技术上的限制。首先,抗体衍生自品系材料(linematerials)而非克隆的杂交瘤。仅占该品系少量百分比的来自一特定克隆的结合信号可能会在检测灵敏度阈值之下。其次,在此实验中由于由抗原的固定化诱导的轻微构象变化可导致抗原中的某些表位被隐蔽不暴露于抗体。基于所有这些原因,用克隆的抗体和Biacore系统进一步检查每一抗体对Ang-1的交叉反应性(见实施例8)。如实施例8所述,确实发现一个克隆(mAb3.19.3)具有针对人重组Ang-1的强交叉反应性(实施例8、9和12)。实施例4对Ang-2结合Tie2的抑制如上述所讨论的,Ang-2通过结合Tie2受体而发挥其生物学作用。使用修改的ELISA经竞争结合测定鉴别了抑制Ang-2/Tie2结合的单克隆抗体。所用的mAb是从50ml特异于Ang-2的杂交瘤集合(见实施例3)的耗竭上清(exhaustivesupernatants)进行微纯化(micro-purification)的产物。通过在4℃保温过夜将96孔NuncImmplatesTM用100μl浓度为4μg/ml的重组人Tie2/Fc融合蛋白(R&DSystems,Inc.,Cat.No.313-TI-100)包被。用SkanTMWasher300station(SKATRON)将平板用磷酸缓冲盐水(PBS)洗四次。孔用100μlABX封闭缓冲液(0.5%BSA,0.1%Tween,0.01%Thimerosal于PBS中)封闭1小时。向具有或不具有100μg/ml的抗Ang-2mAb的每个孔中加入100ng/ml的生物素酰化的重组人Ang-2(R&DSystems,Inc.Cat.No.BT623)。平板在室温保温2小时,然后洗掉未结合的分子。然后通过在室温保温半小时,用100μl/孔的1:200的链霉抗生物素蛋白-HRP缀合物检测结合的生物素酰化的Ang-2。洗涤2次后,用HRP底物(R&DSystems,Cat.No.DY998)检测结合的链霉抗生物素蛋白。将平板保温30分钟,之后加入450终止溶液(100μl/孔,BioFX,Cat#BSTP-0100-01)以终止反应。用SpectramaxPlus读数器测定450nm的光吸收。相对于Ang-2为10倍摩尔过量的可溶性重组Tie2/Fc融合蛋白用作阳性对照。在这一浓度,Tie2/Fc抑制80%的Ang-2与固定的Tie2的结合。使用这一任意标准,175个结合Ang-2的mAb中有74个显示抑制活性。为了方便操作,选择最高的27个中和者用于随后的杂交瘤克隆。用限制稀释法经下述标准程序克隆每个杂交瘤。从每一杂交瘤收集3个姐妹克隆。对于每一克隆,用ELISA测试上清与人Ang-2的结合以及如上所述与Ang-1的反结合,以保证每个抗体仅对于Ang-2是特异性的。测定耗竭上清中IgG的浓度,选择来自每个杂交瘤的3个姐妹克隆中有最高产量的一个克隆进行IgG纯化。从每个上清中纯化0.5至1mg的IgG以用于进一步鉴定。为定量mAb对Ang-2与Tie2结合的抑制活性,用竞争结合测定确定从最高的27个候选者纯化的mAb的效价。每种mAb浓度测试双份。用GraphpadPrismTM绘图软件经曲线拟合(非线性Sigmoid曲线)发现了浓度-应答关系。由软件计算最大抑制(效力)和IC50(强度)。显示相对较高效力和强度的10个单克隆抗体被选择用于进一步研究。这10个mAb的效力和强度列于表4。表4最高10个mAb的效力和强度克隆效力*EC50(μg/ml)3.31.20.37510.041695.16.30.32790.085325.86.10.38440.13315.88.30.40320.15573.3.20.38810.16845.103.10.23170.36435.101.10.36390.37623.19.30.39450.79765.28.10.38922.6985.78.30.26215.969*效力表示为使用mAb(30μg/ml)相对于不使用mAb的结合的Ang-2的比率实施例5抗体分仓(BINNING)进行表位分仓(binning)以确定哪个抗Ang-2抗体互相会交叉竞争并因此很可能结合Ang-2上的相同表位。分仓方法如美国专利申请20030175760所述,也见Jiaetal.,J.Immunol.Methods,(2004)288:91-98所述,两篇文献均全文并入参考。简而言之,根据Luminex网站提供的蛋白质偶联方案将Luminex珠与小鼠抗huIgG(Pharmingen#555784)偶联。使用保护珠避光的下述程序制备偶联前的珠以用于偶联一级未知抗体。对每一未知上清使用单独的试管。所需上清体积使用下式计算:(nX2+10)x50μl(其中n=样品总数)。在这一测定中使用0.1μg/ml的浓度。将珠原液温和涡旋,在上清中稀释至50μl/孔中每种珠的浓度为2500或者0.5X105个珠/ml。样品在摇床中于黑暗中室温保温过夜。过滤平板通过加入200μl洗涤缓冲液/孔而预湿润,之后吸去缓冲液。向过滤平板的每个孔中加入50μl的每种珠。通过加入100μl/孔洗涤缓冲液并抽吸而洗涤样品。以50μl/孔将抗原和对照加到过滤平板。覆盖平板,在摇床上于黑暗中保温1小时,然后洗涤样品3次。然后以50μl/孔加入二级未知抗体。一级抗体使用0.1μg/ml的浓度。平板然后在摇床上于黑暗中室温保温2小时,然后洗涤样品3次。加入50μl/孔1:500稀释的生物素酰化的小鼠抗人IgG(Pharmingen#555785),样品在黑暗中于室温振荡保温1小时。样品洗涤3次。加入50μl/孔1:1000稀释度的链霉抗生物素蛋白-PE,样品在黑暗中于室温振荡保温15分钟。在Luminex100上运行2个洗涤周期后,洗涤样品3次。将每孔内容物重悬于80μl封闭缓冲液中。通过抽吸几次将样品小心地混和以重悬珠。然后在Luminex100上分析样品。结果示于下表5。表5在功能测定中为阳性的最高24个Ang-2抗体的仓*注:mAb5.56具有类似于3.38和5.103的结合模式,差别很小并且信号低得多。实施例6用BIACORE分析确定抗Ang-2抗体亲和性27个纯化的单克隆抗体的低分辨率筛选使用无标记表面等离子体共振(SPR)或Biacore来测量抗体对抗原的亲和性。为此目的,用常规胺偶联技术制备在CM5Biacore芯片上的高密度山羊抗人抗体表面。所有纯化的mAb在含有100μg/mlBSA和10mg/mL羧甲基葡聚糖的HBS-P电泳缓冲液中稀释至约8μg/ml。每种mAb用42秒的接触时间捕获在单独的表面上,并且进行5分钟洗涤以稳定mAb基线。将Ang-2以90.9nM注射到所有表面上1分钟,随后进行10分钟解离。通过减去来自对照流动池(flowcell)的信号以及减去就在Ang-2注射之前注射的缓冲液的基线漂移而制备双重参考的结合数据(Double-referencedbindingdata)。根据捕获在每一表面上的mAb的量对每一mAb的Ang-2结合数据进行标准化,确定27个mAb的标准化的并修正漂移后的应答。数据整体拟合为1:1交互作用模型以确定结合动力学。在25℃的Ang-2结合的动力学分析结果见下表。mAb从最高亲和性至最低亲和性排列。表627个纯化的单克隆抗体的Ang-2低分辨率Biacore筛选除了mAb5.101和5.86之外的所有mAb的kd结果后的星号表示这些kd保持恒定,是慢解离速率数据数量级特征的最佳估值。这些样品的拟合模型在相对较短的解离时间内未检测到可测得的解离速率变化,因此需要kd保持恒定以拟合结合速率数据。这些标出的kd的数据在模拟10-6s-1量级的kd中也拟合良好,因此相互作用可以比上述报道的高10倍或更多。对于使用具有亚100pM亲和性的mAb的高分辨率动力学实验,解离数据通常测量4-6小时。可以从捕获的mAb表面测得的无漂移假象(driftartifacts)的最大解离时间是20分钟。在如此相对短时间内用高亲和性mAb测得的信号衰变几乎可以忽略不计,因此kd估值可以变化达2个数量级。实施例7用BIACORE分析确定抗ANG-2抗体亲和性用3个纯化的单克隆抗体进行Ang-2中等/高分辨率筛选纯化的mAb5.16,5.35和5.41在10mM醋酸钠,pH5.0中稀释至约8μg/ml。每种稀释的mAb随后用常规胺偶联固定在不同的流动池表面(CM5Biacorechip)。为获得结合速率数据,将范围为90.9-0.71nM的8种浓度(2倍稀释)的Ang-2一式三份随机注射90秒,其中间插几次缓冲液注射以用于双重参考(doublereferencing),随后进行4分钟解离。抗体表面在每个注射周期后用两次9秒钟脉冲的10mM甘氨酸-HCl,pH1.5再生。为获得解离速率数据,如上所述注射在含有100μg/mlBSA的HBS-P电泳缓冲液中的3个90.9nMAng-2样品,在8小时内记录解离数据。样品注射与3个空白注射周期交替。如上所述进行再生。使用CLAMP(DavidG.MyszkaandThomasMorton(1998)":abiosensorkineticdataanalysisprogram,"TIBS23,149-150)将数据整体拟合至具有质量传送(masstransport)的1:1相互作用模型。所得到的结合常数如下表7所示。表73个纯化的单克隆抗体的Ang-2中等分辨率Biacore筛选样品Rmaxka(M-1s-1)kd(s-1)Kd(pM)5.16363.41×1052.77×10-68.135.35545.64×1051.87×10-63.315.41444.69×1058.31×10-6*17.7*在8小时解离时间内测得显著的信号衰变。使用8小时解离数据,CLAMP能更合理地估测每种mAb的kd。5.16和5.35的kd均在10-6S-1级别内。然后通过如下述实施例8所述测量mAb对Ang-1的亲和性而研究抗体对Ang-1的交叉反应性。实施例8用BIACORE分析确定抗ANG-1抗体亲和性抗体对Ang-1的交叉反应性通过测量mAb对Ang-1的亲和性进行进一步研究。与基于ELISA的反结合(实施例3)中所述的固定Ang-1不同,将Ang-2mAb固定到CM5Biacore芯片上,并注射溶液中的Ang-1以确定结合速率和解离速率。在这一实验中如下所述测定了六个mAb,即3.3.2,3.31.2,5.16.3,5.86.1,5.88.3和3.19.3,以确定它们与Ang-1的交叉反应性的强度。6个纯化的单克隆抗体的中等分辨率筛选使用无标记表面等离子体共振(SPR)或Biacore2000仪器测量对Ang-1的抗体亲和性。为此目的,用常规胺偶联技术制备在CM5Biacore芯片上的高密度山羊α人抗体表面。为了显色实验,纯化的mAb(克隆3.19.3、3.3.2、5.88.3、5.86.1、3.31.2、5.16.3)在含有100μg/mlBSA的HBS-P电泳缓冲液中稀释至约2.5-3.5μg/ml。每种mAb的捕获水平约为150RU。每个捕获周期后进行5分钟洗涤以稳定mAb基线。将在电泳缓冲液中稀释至87.4nM的单一Ang-1样品注射到全部捕获表面上1分钟。有5个mAb未显示结合,但是发现Ang-1与mAb3.19.3结合。通过增加mAb捕获水平至远超过500-600RU并注射380nMAng-11分钟而重复这一实验。因为Ang-1仅示出对mAb3.19.3的结合活性,测定这一mAb对Ang-1和Ang-2的亲和性。由于在上述显色实验中Ang-1显示出低的解离速率,中等分辨率的捕获实验不会记录足够用于精确估计kd的解离速率数据。因此,在高分辨率Biacore条件下测量Ang-1和Ang-2与mAb3.19.3的结合。实施例9用高分辨率Biacore分析确定mAb3.19.3对Ang-1和Ang-2的亲和性纯化的mAb3.19.3在10mM醋酸钠,pH4.0中稀释至12.5μg/ml。然后用常规胺偶联将mAb固定在流动池1-3(CM5Biacore芯片)上,以流动池4作为参考流动池。为获得结合速率数据,将范围为39.8-0.31nM的8种浓度(2倍稀释)的Ang-1(于含有100μg/ml的BSA的HBS-P电泳缓冲液中)一式三份随机注射90秒(100μL/min.流速),其中间插几次缓冲液注射以用于双重参考,随后进行4分钟解离。抗体表面在每个注射周期后用6秒钟脉冲的10mMNaOH再生。为获得解离速率数据,如上所述注射3个19.9nMAng-1样品,在6小时内记录解离数据。样品注射与3个空白注射周期交替。如上所述进行再生。使用CLAMP(DavidG.MyszkaandThomasMorton(1998)":abiosensorkineticdataanalysisprogram,"TIBS23,149-150)将数据整体拟合至1:1相互作用传质模型。用纯化的MAb3.19.3进行ANG-2高分辨率Biacore研究纯化的mAb3.19.3在10mM醋酸钠,pH4.0中稀释至12.5μg/ml。然后用常规胺偶联将mAb固定在流动池1-3(CM5Biacore芯片)上,以流动池4作为参考流动池。为获得结合速率数据,将范围为30.0-0.23nM的8种浓度(2倍稀释)的Ang-2(在含有100μg/mlBSA的HBS-P电泳缓冲液中)一式三份随机注射90秒(100μL/min.流速),其中间插几次缓冲液注射以用于双重参考,随后进行4分钟解离。抗体表面在每个注射周期后用6秒钟脉冲的15mMNaOH再生。为获得解离速率数据,如上所述注射3个15.0nMAng-2样品,在6小时内记录解离数据。样品注射与3个空白注射周期交替。每个表面在每个长解离速率注射周期后用6秒钟脉冲的15mMNaOH再生。使用CLAMP(DavidG.MyszkaandThomasMorton(1998)":abiosensorkineticdataanalysisprogram,"TIBS23,149-150)将数据整体拟合至1:1相互作用传质模型。结果和讨论:用mAb3.19.3进行的ANG-1和ANG-2高分辨率Biacore研究用每种抗原进行两个独立的实验。结果见下表8所示:表8Ang-1和Ang-2与纯化的mAb结合的高分辨率Biacore结果抗原ka(M-1s-1)kd(s-1)KD(pM)Ang-1(1st)1.33×1054.05×10-630.4Ang-1(2nd)1.82×1055.51×10-630.2Ang-2(1st)1.89×1051.00×10-6*5.3Ang-2(2nd)1.78×1051.00×10-6*5.6在上表中针对Ang-2的kd用星号标出是因为这些值在CLAMP软件中的1:1相互作用模型拟合过程中保持恒定。对于Ang-2实验未记录到显著的解离信号,因此最佳的解离速率估值是将kd保持恒定在1X10-6sec-1。针对Ang-2的长解离速率数据实际上在6小时的数据获得时间内显示出向上的趋势。在两种仪器进行了“超级清洗”的保养方案后,这一趋势在使用这两种不同仪器的两个不同传感器芯片上重复。为了更精确地测量mAb3.19.3对Ang-1和Ang-2的结合亲和性,进行进一步的实验(见实施例10)以确定mAb3.19.3对这些抗原的Kd。令人感兴趣地,当Ang-1被固定在ELISA平板上时,在基于ELISA的结合测定中mAb3.19.3不结合Ang-1(实施例3)。对这一不一致的可能解释是当Ang-1被固定于塑料表面上时,对于mAb3.19.3的结合是关键性的一个精细表位没有被合适暴露。但是当Ang-1在液相中时,如在Biacore实验条件中时,这一表位变得可被mAb3.19.3接近并发生结合。实施例10用高分辨率KINEXA(动力学排除测定)确定mAb3.19.3对人Ang-2的亲和性当用高分辨率Biacore测量mAb3.19.3对人Ang-2的亲和性时(实施例9),发现没有显著的解离信号。针对Ang-2的长解离速率数据显示在6小时的数据采集期间的一个向上趋势。由此,使用KinExA技术确定mAb3.19.3结合人Ang-2的KD,目的是获得更可靠的Kd值。为此目的,使用KinExA3000仪器。首先,使用10mL脱盐柱(PierceD-SaltTMpolyacrylamidecolumn,6000molecularweightcut-off,Lot#GF97965)将1mL(~271μg)Ang-2原液(R&DSystems,Inc.,Lot#BNO32510A)缓冲液交换到1xPBS,pH7.0中。使用C.NickPace(Pace,etal.,ProteinScience,Vol.4:2411-2423,1995)所述的蛋白质浓度测定方法测得合并的级分的浓度是1.7μM。接着,在24℃将200mg聚甲基丙烯酸甲酯(PMMA,Lot#206-01)珠与450μL(约122μg)Ang-2原液偶联过夜。然后离心珠并用封闭缓冲液(1xPBS,10mg/mlBSA)洗一次,再次离心,然后在封闭缓冲液中在24℃保温1小时。封闭后,将珠在标准KinExA珠储存瓶中的约30mL的HBS缓冲液(0.01MHepes,0.15MNaCl,pH7.4)中稀释并放置在仪器中。KD控制滴定含有25.3pM的mAb3.19.3结合位点浓度的12种溶液用增加浓度的Ang-2滴定。缓冲液交换的Ang-2用于样品制备。每种溶液的总体积为25mL,并在~24℃平衡5天。滴定溶液使用玻璃量具制备,Ang-2浓度在5.09nM至99.3fM变化。用于分析这些溶液的KinExA仪器方法由珠填装步骤组成,其中PMMA珠被填装在玻璃毛细管中,平衡的溶液一式二份以0.25mL/min流经珠柱6min(1.5mL)。随后,使3.4nM的荧光标记的Cy-5山羊抗人(Fc特异性)多克隆抗体以0.5mL/min流经珠填装物1分钟以标记捕获在珠上的具有游离结合位点的mAb。从珠填装物发出的荧光经在620nm激发而在670nm测量。用所附的KinExA软件包(version1.0.3,Sapidyne,Inc.)将所得的荧光测量值转化为相对于总抗原浓度的“%游离mAb结合位点”。所得的KD控制滴定曲线用KinExA软件拟合成包括漂移校正因子的1:1平衡等势线(equilibriumisotherm)。最佳拟合数据的KD值是86.4pM,低和高95%置信限分别为64.3pM和98.7pM。未进行mAb控制滴定曲线。实施例11Ang-2诱导的在HEK293细胞中异位表达的Tie2磷酸化的阻断如上述所讨论的,Tie2是一种内皮细胞特异性受体酪氨酸激酶。用血管内皮细胞进行的体外实验显示Ang-1诱导Tie2磷酸化,而Ang-2抑制由Ang-1诱导的受体磷酸化。但是,当Tie2被异位表达如在成纤维细胞中表达时,在某些条件下,包括但不限于延长暴露于血管生成素-2或暴露于高浓度的血管生成素-2,Ang-2也能诱导Tie2磷酸化。当受体在HEK293F细胞中表达时,也发生Ang-2诱导的Tie2磷酸化。用经人Tie2受体转染的HEK293F细胞检查了抗Ang-2mAb阻断Ang-2诱导的Tie2磷酸化的能力。具有Tie2cDNA的质粒载体pORK/pBS-SK得自ATCC(Cat.No.69003,GenbanksequenceBC033514)。cDNA的精确性由核苷酸测序证实。通过EcoRI消化从载体中移出含有编码人Tie2的3375bpcDNA的3.9kb片段。该片段用标准程序以正确方向亚克隆进用EcoRI消化的pCR3.1载体中。用标准方案扩增和纯化所选择的质粒。由上述程序获得的含有Tie2的构建体通过磷酸钙转染法转染进HEK293F细胞。1X106个HEK293F细胞在37℃、5%CO2条件下生长在用1%明胶包被的100mm组织培养皿中。在转染之前细胞用新鲜培养基饲养2-3小时。将10μg质粒DNA溶解在248mM磷酸钙溶液中。用标准程序进行转染。通过在0.5mg/mlG418中保温而选择稳定转染体。使用用于检测的小鼠抗Tie2mAb(R&DCat.No.MAB313)和山羊抗小鼠IgG-PE缀合抗体(Caltag,Cat.No.M30004-4)经FACS分析鉴别表达Tie2的稳定转染体。为进行Tie2磷酸化测定,在37℃、5%CO2条件下将HEK293F/Tie-2转染体以2x106细胞/平板的密度在具有完全培养基的60mm细胞培养皿中生长直至它们达到亚铺满(subconfluency)。每个平板中的完全培养基用2ml无血清培养基置换。细胞再保温16小时。随后,将培养基再次用2ml无血清培养基置换。再保温2小时后,将细胞用0.1mM正钒酸钠(Sigma,Cat.No.S6508)处理20分钟。在存在或不存在100μg/mlmAb条件下将细胞用Ang-2(2μg/ml)处理。处理一式二份进行。包括无Ang-2处理的阴性对照。细胞用冰冷的含有钒酸盐的TBS洗,并用300μl/平板的冷的NP-40裂解缓冲液(50mMHepes,pH7.2,补加0.15MNaCl,10%甘油,10mM焦磷酸盐,50mMNaF,1%NP40,100U/ml抑蛋白酶肽,1mMPMSF,0.1mM原钒酸盐,10μM亮抑蛋白酶肽和10μM胃酶抑制剂A)裂解,同时将平板置于冰上10分钟。将处理的细胞从平板上刮下,置于在冰上预冷的微型管中。将细胞裂解物短暂超声处理并在台式微型离心机中于4℃以12,000g离心10分钟。将上清收集至新鲜微型管中,向上清中加入1-5μg抗Tie2mAb(R&DSystems,Inc.),随后在4℃轻轻摇动2小时。向混合物中加入50μlImmunoPureImmobilizedProteinA(PIERCECat.No.20333),在摇床上于4℃保温至少3小时。在12,000xg离心10分钟收集复合物。小心除去上清后,将复合物用裂解缓冲液经离心(12,000xg,4℃)4分钟而洗2次。沉淀重悬于50μl具有1mMβ巯基乙醇或DTT的2X电泳样品缓冲液(Invitrogen,Cat.No.LC-2676)中,并煮沸5分钟,之后离心(12,000xg,4℃)5分钟。将上清转移至新鲜试管中。样品加样至SDS-PAGE凝胶(例如4-20%Tris-甘氨酸凝胶,Invitrogen,Cat.No.EC6025)的孔中。在Tris-甘氨酸缓冲液系统中进行电泳。电泳后,按照标准方案将凝胶印迹在PVDF膜(Invitrogen,Cat.No.LC2005)上。酪氨酸磷酸化用1μg/ml的4G10抗磷酸酪氨酸抗体(Upstate,Cat.No.05-321)通过在室温振荡保温1小时,随后用1×TBST(含有0.1%Tween-20的TBS)洗3次而探查。结合的抗体的检测通过与1:10,000稀释度的辣根过氧化物酶缀合的山羊抗小鼠IgG(SantaCruz,Cat.No.sc-2302)在室温保温1小时,随后用SuperSignalWestDuraExtendedDurationSubstratesystem(PIERCECat.No.34075)增强化学发光反应而进行。随后,将印迹用RestoreWesternBlotStripping缓冲液(PIERCE,Cat.No.21059)剥离(stripped),并用抗RTK的特异性抗体再次探查以证实样品加样的质量。发现当人Tie2在HEK293F细胞中异位表达时,Tie2的自磷酸化不可检测。作为对Ang-2(2μg/ml)处理的应答,用针对磷酸化的酪氨酸的mAb(4G10)从用该特异的mAb免疫沉淀的Tie2中检测到显著水平的酪氨酸磷酸化。在100μg/ml的浓度,所测试的所有抗Ang-2mAb均显示对Tie2磷酸化的明显的抑制,而同种型对照mAb没有抑制作用(图1)。未在图1中示出的单克隆抗体5.103.1有类似的抑制作用。为了排列各Ang-2mAb体外抑制Ang-2诱导的Tie2磷酸化的强度,建立一种基于ELISA的可定量方法以检测Tie2磷酸化。简而言之,用不同浓度的mAb从用Ang-2处理的HEK293F/Tie2转染体制备细胞裂解物。来自裂解物的总Tie2被捕获在96孔ELISA平板中,该平板用小鼠抗hTie-2mAb包被。用一级抗体4G10-HRP(购自Upstate)和HRP底物溶液检测了磷酸化的Tie2。650nm的OD用SpectraMax读数仪测定。用GraphpadPrismTM绘图软件(非线性,Sigmoid曲线)进行的曲线拟合发现了浓度-应答关系。计算了最大抑制(效力)和IC50(强度)并示于图2。EC50计算示于下表9。表9mAbEC50(μg/ml)95%CI3.19.30.0060.004-0.0095.86.10.0080.007-0.0115.88.30.0160.011-0.0243.31.20.0430.029-0.0643.3.20.0460.020-0.1055.16.30.0890.046-0.1745.103.30.0950.046-0.1995.101.10.7330.487-1.105如以上所报道的,发现mAb3.19.3与Ang-1交叉反应。然而,初始实验的结果未发现mAb3.19.3对血管生成素-1诱导的Tie-2磷酸化的抑制。值得注意的是Tie2的异位表达可能影响其对由不同配体导致的活化的易感性,这由Ang-2在HUVEC中不诱导Tie2磷酸化,但是当受体在HEK293细胞中异位表达时其确实诱导强Tie2磷酸化这一事实所表明。鉴于这些结果,进行了进一步的实验以更充分研究mAb3.19.3是否能抑制Ang-1和Ang-2与细胞结合的Tie2的结合。另外,如下述实施例12所述更详细地研究了mAb3.19.3对血管生成素-1诱导的Tie-2磷酸化的抑制。实施例12mAb3.19.3抑制血管生成素-1与Tie-2的结合以及ANG-1诱导的Tie2磷酸化mAb3.19.3与人Ang-1交叉反应(实施例8和9)。但是,初始实验表明mAb3.19.3不抑制由Ang-1诱导的Tie2的磷酸化。这一不一致可由如下原因解释:(1)可能需要远高于生理浓度的Ang-1的高浓度来产生强Tie2磷酸化信号;或(2)Tie2在HEK293中的异位表达可改变Tie2的构象,由此改变其对不同配体的易感性。为了测试这些假说,在结合测定中测试了mAb3.19.3,其中低浓度的Ang-1或Ang-2(3nM)结合细胞表面Tie2。发现mAb3.19.3在这个实验中既抑制Ang-1也抑制Ang-2的结合。另外,使用固定化的内皮细胞(EA.hy926/B3)研究Ang-1诱导的Tie2磷酸化。这个实验的结果见如下详述,其证实mAb3.19.3以剂量依赖方式抑制Ang-1诱导的Tie2磷酸化。使HEK293F/Tie2转染子生长直至在培养瓶中95%铺满,之后收获。制备在FACS缓冲液中的4百万个细胞/ml的细胞悬液,然后等分到96孔聚丙烯平板中,每孔50μl。向细胞悬液中加入具有指明浓度的mAb3.19.3。随后,向细胞悬液中加入重组人Ang-1和Ang-2的溶液,在室温保温2小时。在l,200rpm离心平板5分钟洗细胞,通过吸取除去上清,将细胞用200μl/孔FACS缓冲液重悬。重复洗涤程序2次。然后细胞用在FACS缓冲液中稀释至2μg/ml的100μl小鼠抗6X组氨酸抗体悬浮,在室温保温30分钟。洗涤后,将细胞悬浮在100μl在FACS缓冲液中1:100稀释的PE缀合的山羊抗小鼠IgG中,在室温保温30分钟。样品体积用FACS缓冲液调节至300μl,并用FACSCalibur测量。结果在图3示出并汇总在表10中。如所示,可溶性Tie2/Fc通过阻断配体而剂量依赖性地抑制Ang-1和Ang-2的结合,而同种型对照mAb,PK16.3.1对每种配体的结合均无作用。mAb3.19.3显示出浓度依赖性抑制Ang-1和Ang-2。令人感兴趣地,使用Tie2/Fc的强度作为参考,mAb3.19.3对Ang-2结合的强度比对Ang-1结合的强度高。表10Ang-1和Ang-2与Tie2结合的抑制这些结果表明mAb3.19.3不仅结合人Ang-1,也阻断其与受体Tie2的结合。这进一步通过如下所述在固定化的内皮细胞中对Ang-1诱导的Tie2磷酸化的抑制而证实。mAb3.19.3对Ang-1诱导的Tie2磷酸化的抑制活性如下进行定量。随着抗体浓度的增加该mAb显示明显增加的对Tie2磷酸化的抑制,如图4和5所示。剂量应答曲线图计算IC50为99nM。血管生成素-1配体刺激的Tie-2受体磷酸化测定用在2ml体积的DMEM;HAT;10%FCS中的2.5x105EA.hy926细胞/孔将EA.hy926/B3细胞接种在6孔板中,在标准哺乳动物细胞生长条件下保温3天。生长培养基用2mlDMEM(无FCS)置换,并将细胞进行血清饥饿总共2小时。测试化合物在DMEM;1%FCS中稀释至所需终浓度的2倍。在血清饥饿1小时40分钟后,从细胞中除去培养基并用1ml测试化合物稀释液置换。类似地,也设置无化合物处理的对照以提供代表100%配体刺激标准的样品。保温再持续10分钟,之后向每孔中加入100μl在DMEM溶液中的10mM原钒酸盐以获得每孔中1mM原钒酸盐的终浓度。然后保温细胞以完成2小时血清饥饿时间的最后10分钟。完成2小时血清饥饿时间后,向每孔中加入1ml血管生成素-1(在DMEM中稀释至合适浓度并含有1mM原钒酸盐)并在37℃再保温10分钟。然后将6孔板置于冰冷的金属板(其本身保持在冰上)上进行冷却。除去细胞培养基并用5ml冷PBS;1mM原钒酸盐洗细胞层。向每孔中加入1ml冰冷的裂解缓冲液(20mMTrispH7.6,150mMNaCl,50mMNaF,0.1%SDS,1%NP40,0.5%DOC,1mM原钒酸盐,1mMEDTA,1mMPMSF,30μl/ml抑蛋白酶肽,10μg/ml胃酶抑制剂,10μg/ml亮抑蛋白酶肽)并置于冰上10-20分钟。用细胞lifter将细胞从平板上刮下并将完整裂解物溶液转移至1.5mlEppendorf管并保持在冰上。然后在13000rpm、4℃离心样品3分钟,所有后续步骤在4℃进行。保留50μl每种裂解物以用于BCA蛋白质测定(Pierce,Cat.No.23225)(在来自Greiner的低蛋白质结合聚丙烯微滴板中)。用试剂盒提供的标准测定条件确定蛋白质浓度。将进一步的800μl每种样品裂解物转移至新鲜的2mlEppendorf管中准备用于免疫沉淀(IP)。向裂解物中加入15μl(3mg)抗P-Y(SantaCruzCat.No.E2203)并在4℃保温2小时,之后加入600μlMagnabind珠(山羊抗小鼠IgG,PierceCat.No.21354)。Magnabind珠如下制备:将所需体积转移进15ml锥形管中。然后将管置于磁场中并除去液体。用原始体积加入新鲜PBS,珠被重悬。这一过程重复2次。然后将含裂解物的溶液与珠混和,并将试管置于转子混合器上于4℃旋转过夜。样品暴露于磁铁大约1分钟并小心除去液体。加入1ml裂解缓冲液并将试管旋转5分钟进行洗涤。洗涤步骤重复2次。完全除去液体并将珠重悬于12μl热(94℃)2xLaemmli上样缓冲液+bME,然后室温保持15分钟。将试管暴露于磁铁1分钟,从珠中分离的液体在PAGE/SDS凝胶上分析。样品用具有15孔的4-12%BisTrisNuPAGE/MOPS凝胶(Novex)经PAGE/SDS凝胶进行分析。每槽上样总共12μl每种免疫沉淀物。凝胶在200V/120mA/25瓦电泳55分钟,然后在50V/250mA将样品western印迹至硝酸纤维素膜上1小时30分钟。然后所有印迹用在PBS-Tween中的5%Marvel于室温处理1小时,然后用PBS-Tween洗。兔抗Tie-2抗体(SantaCruzCat.No.C1303)在0.5%Marvel/PBS-Tween中1:500稀释,将12.5ml加至每一印迹并置于4℃过夜。然后用PBS-Tween洗印迹并向每一印迹加入山羊抗兔POD(DakoCat.No.P0448)(在0.5%Marvel/PBS-Tween中1:5000稀释),置于室温1小时。印迹用PBS-Tween洗,并用12.5mL(等体积的溶液A和B)Supersignal(PIERCECat.No.34080)显色每一印迹10分钟。印迹转移至X光盒中并在胶片上曝光(曝光5秒/15秒/30秒/60秒/150秒)。图4是显示这一测定结果的Western印迹。在这一系统中,观察到mAb3.19.3对血管生成素-1刺激的Tie-2磷酸化的抑制。然后使用FluorSBioRad图像分析系统评价在胶片上所见的每一样品的图像。像素密度作为OD/mm2测定并以体积百分比表示。体积百分比结果用BCA测定确定的蛋白质浓度和免疫沉淀中所用的每一样品的裂解物体积而标准化为1mg蛋白质/免疫沉淀。针对每一凝胶上未处理对照样品的100%磷酸化值而计算每一样品的磷酸化百分比,并且每一样品的抑制百分比相对于100%磷酸化值而计算,100%磷酸化值本身代表0%抑制。图5是这些值的图形示意,并显示出对血管生成素-1刺激的Tie-2磷酸化的抑制的IC50是99nM。总之,这些数据表明在这一系统中,所述mAb抑制血管生成素-1诱导的Tie-2的磷酸化。实施例13ANG-2抗体的结构分析对所述抗体的可变重链和可变轻链进行测序以确定其DNA序列。关于抗-Ang-2抗体的完整序列信息在序列表中提供,其具有每个γ和κ链组合的核苷酸和氨基酸序列。分析可变重链序列以确定VH家族,D-区序列和J区序列。然后翻译该序列以确定一级氨基酸序列,与种系VH、D个J区序列对比以确定体细胞高变。表11是抗体重链区与其同源种系重链区的对比表。表12是抗体κ轻链区与其同源种系轻链区的对比表。免疫球蛋白链的可变区(V)由多个种系DNA节段编码,在B细胞个体发生期间结合成功能性可变区(VHDJH或VKJK)。对所述抗体应答Ang-2的分子和遗传多样性进行详细研究。这些分析表明特异于抗Ang-2抗体的一些点。对特异于Ang-2的152个抗体进行分析,确定所述抗体衍生自21个不同种系VH基因,其中有112个衍生自VH3家族,46个抗体衍生自VH3-33基因节段。表11和12示出了这个分析的结果。应意识到从每个杂交瘤中收集的姐妹克隆之中氨基酸序列是相同的。例如,mAb3.19.3的重链和轻链序列与表11和12中示出的mAb3.19和3.19.1的序列是相同的。实施例14:抗体典范类别的确定Chothia等关于每个免疫球蛋白链的高可变区的“典范类别(canonicalclasses)”描述了抗体结构(JMolBiol.1987Aug20;196(4):901-17)。分析了许多免疫球蛋白的Fab和VL片段的原子结构,以确定其抗原结合位点的氨基酸序列及三维结构之间的关系。Chothia等发现通过其包装、氢键或采用不寻常的phi、psi或Ω构象的能力,有相对很少的残基主要负责高可变区的主链构象。发现这些残基在高可变区及保守的β折叠构架内的位点出现。通过检测具有未知结构的免疫球蛋白的序列,Chothia等示出许多免疫球蛋白具有大小与已知结构之一相似的高可变区,及另外在负责观测到的构象的位点含有相同的残基。他们的发现提示这些高可变区具有与已知结构相近的构象。对于5个高可变区,构象的所有组成成分看起来限于相对小数目的不连续的结构类别。高可变区的这些常出现的主链构象称作“典范结构”。Chothia等{Nature1989Dec21-28;342(6252):877-83}及其它研究人员(Martin,etal.JMolBiol.1996Nov15;263(5):800-15)的进一步研究证实抗体的6个高可变区中至少5个高可变区的主链构象的所有组成成分是小的。分析上述每个抗体的CDR以确定其典范类别。正如所已知的,典范类别仅是针对抗体重链的CDR1和CDR2及抗体轻链的CDR1、CDR2和CDR3指定的。下表(表13)概括了分析结果。所述典范类别数据是*HCDR1-HCDR2-LCDR1-LCDR2-LCDR3形式,其中HCDR是指重链CDR,LCDR是指轻链CDR。因此,例如典范类别1-3-2-1-5是指抗体具有属于典范类别1的HCDR1,属于典范类别3的HCDR2,属于典范类别2的LCDR1,属于典范类别1的LCDR2,及属于典范类别5的LCDR3。当抗体的氨基酸与每个典范类别的氨基酸具有70%或更高相同性时,就将其划分为特定的典范类别。在低于70%相同性时,典范类别划分以星号*表示,表明基于每个CDR长度和数据整体产生了正确典范类别的最佳估值。在没有与相同CDR长度匹配的典范类别的情况中,典范类别划分以Y表示。关于每个抗体的氨基酸可见例如上文提及的Chothia等的文章所述。表13报道了每个Ang-2抗体的典范类别数据。表13.抗Ang-2抗体的典范类别抗体典范类5.181-1-2-1-15.811-1-2-1-15.661-1-2-1-15.481-1-2-1-15.231-1-2-1-13.331-1-2-1-15.151-1-2-1-3*4.31-1-4-1-13.121-1-4-1-5*4.161-1-4-1-5*3.131-1-4-1-5*3.71-1-4-1-5*3.321-1-4-1-5*3.371-1-4-1-Y5.301-2-2-1-13.61-2-2-1-16.61-2-2-1-13.341-2*-2-1-15.741-2*-2-1-15.381-3-2-1-15.28.11-3-2-1-15.61-3-2-1-15.441-3-2-1-15.281-3-2-1-15.86.11-3-2-1-15.35.11-3-2-1-15.351-3-2-1-15.81-3-2-1-15.221-3-2-1-14.151-3-2-1-15.671-3-2-1-15.871-3-2-1-15.101-3-2-1-15.711-3-2-1-15.211-3-2-1-15.801-3-2-1-13.181-3-2-1-13.111-3-2-1-13.261-3-2-1-15.311-3-2-1-15.761-3-2-1-14.91-3-2-1-15.171-3-2-1-13.391-3-2-1-15.371-3-2-1-13.221-3-2-1-15.291-3-2-1-15.731-3-2-1-15.121-3-2-1-13.11-3-2-1-15.111-3-2-1-14.81-3-2-1-15.241-3-2-1-16.3.11-3-2-1-1*5.56.11-3-2-1-1*5.1111-3-2-1*-14.131-3-2-1*-15.521-3*-2-1-3*5.16.11-3-2-1-3*5.39.11-3-2-1-3*5.103.11-3-2-1-3*5.101.11-3-2-1-3*5.54.11-3-2-1-3*5.83.11-3-2-1-3*5.621-3-2-1-3*5.88.11-3-2-1-3*5.40.21-3-2-1-3*5.1091-3-2-1-3*5.641-3-2-1-3*5.131-3-2-1-3*3.31-3-2-1-3*5.411-3-2-1-3*3.3.11-3-2-1-3*3.31.11-3-2-1-3*5.41.11-3-2-1-3*5.62.11-3-2-1-3*5.108.11-3-2-1-3*5.13.11-3-2-1-3*5.971-3-2-1-5*5.52.11-3-2-1-Y5.78.11-3-3-1-15.601-3-3-1-15.431-3-3-1-15.901-3-3-1*-13.421-3-3-1*-14.111-3-4-1-13.401-3-4-1-15.821-3-4-1-14.181-3-4-1-13.411-3-4-1-15.921-3-4-1-13.101-3-4*-1-14.141-3-4-1-5*3.19.11-3-8*-1-16.21-3-8*-1-13.81-3-8*-1-15.581-3-8-1-1*4.51-4*-2-1-15.11-4*-2-1-14.21-4*-2-1-13.91-4*-2-1-15.451-4*-2-1-13.171-4*-2-1-15.721-4*-2-1-1*3.141-4*-2-1-Y5.1153-1-2-1-15.363-1*-2-1-13.23-1-2-1-3*3.213-1-8-1-1*5.613-Y-2-1-3*表14是对每个类别的抗体数目的分析。具有在左栏中指定的特定典范类别的抗体数目在右栏中示出。表14.每种典范类别中抗Ang-2抗体的数目H1-H2-L1-L2-L3mAb的数目1-1-2-1-161-1-2-1-3*11-1-4-1-111-1-4-1-5*51-1-4-1-Y11-2-2-1-151-3-2-1-1381-3-2-1-3*211-3-2-1-5*11-3-2-1-Y11-3-3-1-151-3-4-1-171-3-4-1-5*11-3-8*-1-141-4*-2-1-171-4*-2-1-Y13-1-2-1-123-1-2-1-3*13-1-8-1-1*13-Y-2-1-3*1注:1.*是指已经进行最佳匹配类别划分,尽管在指定位置有一些违背。2.Y表示没有与相同CDR长度匹配的典范类别。实施例15:ANG-2抗体的表位作图对27个中和Ang-2活性的抗体的结合结构域进行了分析。重组人Ang-2购白R&Dsystems(623-AN)。根据山羊抗人Ang-2多克隆抗体(R&DsystemsAF623)在直接ELISA和Western印迹中识别rhAng-2的能力而加以选择。所述多克隆抗体经生物素酰化以可以用HRP缀合的-链霉抗生物素蛋白检测。所有限制酶均由NewEnglandBiolabs提供,根据厂商指导加以应用。所有质粒DNA均使用spinminicolumns(Invitrogen,Carlsbad,CA)纯化。用于克隆和定点诱变的寡核苷酸引物由QiagenOperon合成。抗体:基于其抑制rhAng-2与其受体结合的能力选择27个杂交瘤衍生的人抗Ang-2抗体。所述抗体在下表15中列出。表1527个中和抗-Ang-2抗体的表位鉴定斑点印迹使用Bio-DotMicrofiltration设备,将RhAng-2(R&Dsystems)以其天然或还原形式点滴于硝基纤维素膜上。对针对人Ang-2产生的所有人单克隆抗体(MAb)均结合非还原的而不是还原形式的Ang-2,表明所有mAb均识别构象表位,构象表位在蛋白质还原时显然被破坏。Ang1和Ang-2蛋白质的克隆与表达为了更好地理解mAb与Ang-2相互作用的结构基础,使用一组嵌合Ang1/Ang-2分子。这种方法利用血管发生家族成员结构是相关的这一事实。尽管Ang-2与Ang1在其蛋白质序列仅示出60%同源性,但其均呈现由氨基末端卷曲螺旋结构域和羧基末端血纤蛋白原样结构域的相同模块结构。人Ang-1和Ang-2的克隆两个可变剪接形式的人Ang-2cDNA从人脐静脉内皮细胞系(HUVEC)中扩增。使用Ang-2特异性引物PCR扩增HUVECcDNA揭示了全长Ang-2(1491bp)和1330碱基对的变体Ang-2443(Injuneetal.,(2000)JBC275:18550)。Ang-2443是通过可变剪接外显子B及缺少部分卷曲螺旋结构域(第96-148位氨基酸)而产生的变体。将这两种Ang-2cDNA均克隆进pCR3.1表达载体中,在293F细胞中表达,如图6所示。人Ang-1cDNA通过RT-PCR使用从人乳腺癌细胞系MDA-MB-231中提取的总RNA而获得。将1.5KbcDNA克隆进pCR3.1表达载体中,在瞬时转染的293F细胞的上清中检测表达。ELISA使用抗体捕获ELISA测试27个mAb与Ang-2和Ang1cDNA瞬时转染产生的上清的结合。将Ang-2、Ang-2443和Ang-1与山羊抗人Ang-2或Ang-1的多克隆抗体(分别)包被的ELISA平板结合。前27个人单克隆抗体的结合用HRP缀合的山羊抗人抗体检测,随后用生色辣根过氧化物酶底物(增强的K-BlueTMB底物NeogenCorporation)检测。在微平板自动读器上在450nm测量ELISA平板的每个孔的吸收。293F细胞的转染将293F人胚胎肾细胞保持在补加了青霉素和链霉素的Dulbecco'smodifiedEagles培养基中的10%胎牛血清中。将293F细胞用磷酸钙瞬时转染。在72小时,收获培养基及过滤以进行ELISA和Western印迹分析。所有27个抗体均示出特异性结合Ang-2/Ang-2443抗原。与人Ang-1未检测到交叉反应性。排除在Ang-2443蛋白质序列中缺少的Ang-2的卷曲螺旋结构域中的第96-148位氨基酸是这27个抗体的结合结构域。Ang-1/Ang-2嵌合分子的构建人Ang-1和Ang-2基因中共有的限制性切割位点用于构建符合读框的融合血管生成素嵌合蛋白质。制备四种构建体:人Ang-1/2BsmI、Ang-2/1BsmI、Ang-1/2SspI和Ang-2/1SspI。所有蛋白质均以通过使用抗人Ang-1和Ang-2的多克隆抗体经ELISA分析可检测的水平表达和分泌。氨基酸结合点在如下位置:BsmI-117(Ang-2)/119(Ang-1)SspI-353(Ang-2)/354(Ang-l)。一个氨基酸的差异是由于与人Ang-2的496个残基相比在人Ang-1中存在第497位残基。所有构建体均在293F细胞中表达,通过对抗Ang-1和Ang-2的山羊抗人多克隆抗体检测。测试前27个抗体的结合嵌合的Ang-1/2分子的能力。所有27个抗体均只示出相似的结合Ang-1/2BsmI构建体的模式。这些实验结果表明所有抗体的结合结构域均在第117-496位残基之间,很可能在血纤蛋白原结合结构域中,其中SspI融合Ang蛋白质中所述表位在第353位氨基酸周围被破坏。小鼠/人Ang-2嵌合分子的构建由于Ang-2与Ang-1呈现~55%的氨基酸相同性,因此难以发现共同的限制位点以用于克隆嵌合分子。小鼠和人Ang-2更相似,具有大约85%的序列同源性。克隆进pCMCsport表达载体中的小鼠Ang-2cDNA购自Invitrogen。对27个选择的抗体测试其与重组小鼠Ang-2的免疫反应性。27个抗体中有6个抗体与小鼠Ang-2交叉反应,具有与人Ang-2的100%免疫反应性,表明所述小鼠抗原保留大多数的人Ang-2的免疫反应性(数据概括示于表16)。选择人-小鼠嵌合系统用于基于发现大多数抗体特异性结合人Ang-2抗原及与小鼠Ang-2不交叉反应的事实进行表位作图。产生多种Ang-2的cDNA构建体并克隆进哺乳动物表达载体中。小鼠/人Ang-2的构建体使用位于血纤蛋白原结合结构域中的共有StuI限制位点制备,氨基酸结合点在第311位残基。所有特异于人Ang-2的mAb均能结合小鼠/人Ang-2StuI,表明所述结合结构域位于血纤蛋白原结合结构域中第311-496位残基之间。为了缩小所述结合结构域,制备一种新的构建体,其中人片段StuI-TfiI取代小鼠Ang-2cDNA中小鼠序列(图9)。所有特异于人Ang-2的抗体均示出阳性ELISA信号,具有与人Ang-2的15-100%免疫反应性。具有如表17所示独特的VH基因用法的两个抗体5.35.1(VH3-20)和5.28.1(VH3-43)的结合结构域被作图为在第310-400位氨基酸之间的区域。期望与小鼠Ang-2交叉反应的抗体示出100%反应性,使用小鼠/人嵌合构建体不能作图所述抗体。定点诱变为了说明参与不同抗体的结合位点的重要残基,对人Ang-2的少数残基进行突变,通过ELISA分析针对全部抗体的结合情况进行筛选。因为通过ELISA检测的直接结合对亲和性的少量和中等量的差异不灵敏,因此在取代一个氨基酸之后观测到结合情况较大的变化可能鉴别与所述抗体相互作用的关键位点。另外,人Ang-2的多克隆抗体保持与每个构建体100%反应性,表明所述诱变程序不引起Ang-2分子任何广泛的结构变化。在第345位Val变为Met(V345M)及在第375位His变为GIn(H375G)的两个独立改变为所有27个抗体所忽视,表明这些残基不是反应性的,或者构象表位中的变化需要一个以上的氨基酸取代。在第365和367位的两个残基的改变显著改变抗体Mab5.35.1的结合。对5.35.1的序列分析示出在重链和轻链上独特的VH3-20用法和独特的CDR3。Ang-2嵌合分子的所有融合点及点突变在图8中加亮示出。图9是小鼠Ang-1(SEQIDNO:5)、人Ang-1(SEQIDNO:2)、小鼠Ang-2(SEQIDNO:4)和人Ang-2(SEQIDNO:3)氨基酸序列对比。箭头表示疏水性前导序列的切割位点。箭号表示卷曲螺旋和血纤蛋白原样结构域的界限。实心圆表示保守的半胱氨酸残基(图像取自Maisonpierreetal.,1997,Science277:55)。对所有Ang-2分子的结合数据总结于下表16表16数据表示为与人Ang-2相比的百分比结合。表17:序列分析和与小鼠Ang-2的交叉反应性对IgH和IgL序列进行序列分析是使用序列分析软件工具,通过将VH基因与种系数据库进行排列对比而实现。所述软件还评估了D元件、读框、N区域插入、P核苷酸添加、核苷酸丧失和CDR3长度。对特异于CR64的27个抗体进行分析仅产生7个种系VH基因,27个抗体中10个抗体来自相同VH1家族。对中和抗体进行选择示出表达相同IgVH及在一些情况中相同VHDJH重排及H和L链成对的抗体是保守的。这个发现提示对于任何给定的表位,仅有少数种系成员用于形成相应的互补位,对于每个抗原表位而言,只有有限数目的L和H链基因可以配对形成特异性互补位。相似的VH、VK和互补决定区(CDR)结构由不同的单克隆抗体的循环应用与这样的事实相关联,即所有Ang-2中和活性均受限于血纤蛋白原样结构域,与Procopioetal(1999,JBC274:30196)公布的研究工作结果一致,示出Ang-2对Tie2的作用与血纤蛋白原样结构域相关联。表位作图数据表明所述单克隆抗体通过包括大多数血纤蛋白原样结构域的广泛界面而结合Ang-2。实施例16与小鼠ANG-2的交叉反应性的确定通过ELISA检测抗人Ang-2mAb与小鼠Ang-2的交叉反应性。为此,构建小鼠Ang-2表达载体,瞬时转染真核细胞以产生小鼠Ang-2。小鼠血管生成素-2(mAng-2)表达构建体得自ResearchGenetics,I.M.A.G.E协会的一个销售商(见image.llnl.gov)。小鼠Ang-2cDNA(GenBankAccessionNo.BC027216,IMAGE:3494566)衍生自肺肿瘤文库NCI_CGAP_Lu29。将所述cDNA克隆进pCMV-SPORT6表达载体(InvitrogenCarlsbad,CA)的SalI(5')和NotI(3')位点之间,含有496个氨基酸的全长小鼠Ang-2(mAng-2)开放读框,以及共2471碱基对的5'及3'非翻译侧翼区。使用磷酸钙方法将10μg的上述mAng-2质粒转染进HEK293F细胞中。在前一天将大约1×106个HEK293F细胞种植于10cm组织培养平板上。在5小时或过夜转染后更换培养基,将细胞再生长2-3天,之后收集含有分泌的mAng-2蛋白质的上清。mAng-2的表达通过ELISA使用得自R&DSystems的多克隆抗体(目录号No.AF623)证实。将96孔NuncImmplates用从HEK293F/小鼠Ang-2转染体中收集的条件培养基(100μl/孔)包被。将该平板在4℃保温过夜,随后在SkanWasher300station(SKATRON)中用磷酸盐缓冲盐水洗涤4次。将所述孔用100μl的ABX-封闭缓冲液(0.5%BSA,0.1%Tween,0.01%Thimerosal于PBS中)封闭1小时。将适当浓度的及于封闭缓冲液中稀释的抗-Ang-2mAb加入孔中,体积为100μl/空,在室温保温至少1小时。mAb及其稀释物均一式两份进行测试。在洗涤两次后,结合的mAb通过1/1,000稀释的山羊抗人Fc-HPPO-缀合的抗体(Caltag,CodeH10507)在室温检测1小时。为了设立检测产色反应,在将孔用PBS洗涤3次后加入100μl的TMB底物(TMB-microwell,BioFX,Cat.No.TMSK-1000-01)。将平板保温30分钟,之后加入650终止溶液(100μl/孔,BioFX,Cat.No.BSTP-0100-01)以终止反应。用SpectramaxPlus读数器确定在650nm的光吸收。这个分析中测试了前27个中和mAb。光吸收表明单克隆抗体3.19.3、3.38、5.2.1、5.52.1、5.56.1和5.78.1在实验条件下能结合小鼠Ang-2。为了证实,将每种结合抗体均通过ELISA滴定。将平均OD650nm(±S.D.)值根据mAb的浓度(μg/ml)的Log绘图,示于图10。图中示出了克隆5.2.1、5.28.1、3.19.3和3.31.2。单克隆抗体5.2.1和3.19.3以剂量依赖性方式结合小鼠Ang-2,在大约10μg/ml达到饱和(图10)。这两种mAb的结合曲线是典型的Sigmoidal剂量应答关系曲线。除了克隆5.2.1和3.19.3之外,在测试的抗体浓度范围均未观测到剂量依赖性和饱和。基于这个结果,看来仅有mAb5.2.1和3.19.3与小鼠Ang-2具有交叉反应性。实施例17小鼠ANG-2与人TIE2结合的抑制选择单克隆抗体3.19.3进一步测试其抑制小鼠Ang-2与人Tie2结合的能力。为此,将ELISA平板以100μl/孔用4μg/ml的hTie2/Fc(R&DSystems,Inc.)包被,将所述孔在4℃常规封闭过夜。应用上述293T/mAng-2转染体的培养上清中的重组小鼠Ang-2(mAng-2)。向预包被的孔中加入100μl含有mAng-2的上清及不同浓度的mAb3.19.3,在室温保温1小时。作为对照,这个实验还包括与所述抗体混合的重组人Ang-2(R&DSystems,Inc.)。一式三份测试每种浓度的mAb。结合的小鼠和人Ang-2使用与小鼠Ang-2交叉反应、与二级兔抗山羊IgG-HRP偶联的山羊抗人Ang-2多克隆抗体(SantaCruzBiotechnology,SantaCruz,CA)检测。在加入HRP底物之后30分钟确定OD650。发现mAb3.19.3以剂量依赖性方式抑制人和小鼠Ang-2与人Tie2的结合(图11)。实施例18与猴脉管系统的交叉反应性的确定由于Ang-2在血管发生内皮细胞中特异性表达,因此对猴的这些细胞用抗-Ang-2抗体进行免疫组织化学染色,以间接确定每种抗体是否均与猴Ang-2交叉反应。在这个实验中使用猴的富集内皮细胞的卵巢组织检测如实施例4所述选择的前10个中和mAb(表4)。将完全干燥的6μm冷冻的猴(Cynomolgusmacaque)卵巢组织切片用4℃丙酮固定5分钟。在将该玻片用PBS洗涤3次后,将组织的内源过氧化物酶用0.3%的H2O2封闭10分钟。随后,将该组织用PBS洗涤,用10μg/ml山羊抗人IgGFab封闭15分钟。将该组织切片再用PBS洗涤,随后用10%正常山羊血清处理10分钟。在排出所述血清后,将10种抗-Ang-2mAb的每一种(10μg/ml)加到所述切片上,保温2小时。结合的Ang-2mAb用10μg/ml小鼠抗人IgG检测15分钟,随后与过氧化物酶缀合的山羊抗小鼠IgG一起保温30分钟。使用AEC-底物系统(DAKO,Cat.No.3464)在显微镜观测下进行染色以获得最佳结果。发现所有10个mAb在卵巢组织中均染色血管发生血管内皮细胞;而同种型对照mAb不染色。这表明表4的这10个mAb均与猴Ang-2交叉反应。实施例19mAb3.19.3在MATRIGELPLUG分析中抑制体内血管发生为了评价抗-Ang-2单克隆抗体的体内抗血管发生潜力,进行Matrigelplug血管发生分析。发现当将MCF-7细胞在体外培养或作为异种移植物植入免疫缺陷的小鼠中时,其产生Ang-2。当将MCF-7掺入Matrigel中并皮下植入裸鼠中时,发现大量血管生长进入凝胶中。为了建立Matrigelplug模型,应用6-8周龄的体重为18-20g雌性BALB/c/nu/nu小鼠(CharlesRiverLaboratories,Wilmington,MA)。将共0.5mL的含有2X106个MCF-7细胞及有或无Ang-2抗体的Matrigel或者对照制剂(仅包含Matrigel,Tie2/Fc,IgG2和IgG4同种型对照,及抗-VEGFmAb)皮下注射进裸鼠的右侧。每个测试组有5只小鼠。所有测试的mAb均调节为浓度为100μg/ml。7天后,收获Matrigelplugs及计算血管密度。为此,在深度麻醉下进行小鼠颈部错位处死。除去覆盖的皮瓣暴露Matrigelplugs。然后剥离Matrigelplugs及记录数字图像。将Matrigelplugs小心切下并切成两部分。一部分在TissueTek中速冻,另一部分在缓冲的福尔马林中固定。然后将这两部分包埋于石蜡中进行切片。每个小鼠切3个5-7μm厚度的切片,用苏木精和伊红染色。然后将切片在相差显微镜下检测。记录代表性显微照片[两幅(100X和400X)],记录内皮细胞和血管浸润。将冷冻的Matrigelplugs在Cryocut切片机中切片(10μm切片)。每只小鼠切2个独立的切片用于染色。将切片用BSA(0.1%)封闭,然后用与小鼠反应的单克隆抗体处理。将CD31与Phycoerythin(如厂商推荐稀释)缀合。充分洗涤后,将切片加上抗褪色试剂(VectaShield),使用红色滤膜在UV显微镜下观测。捕获代表性数字图像(在100X和200X放大倍率下两张图片)。细胞核用DAPI复染。将CD31染色的免疫荧光图像通过Skeletinization程序进行分析。对数据进行加工以提供每组平均血管密度、血管结和长度。结果可见于图12A和12B,示出抗-Ang-2对血管末端的数目(图12A)和血管长度(图12B)的作用。这个实验表明与单独的Matrigel相对比,掺入Matrigel中的MCF-7细胞能诱导显著水平的血管发生。诱导的血管发生可以由阳性对照抗-VEGF抗体抑制。血管发生也可以由可溶的重组Tie2/Fc蛋白质显著抑制,提示由MCF-7细胞产生的Ang-2在这个模型中在血管发生中起作用。通过与任何Ang-2结合,Tie2/Fc有效地降低暴露于MCF-7细胞的Ang-2水平。还不清楚IgG2同种型阴性对照抗体PK16.1.3怎样影响血管发生,尽管也发现这种抗体在一些异种移植模型中有时候会干扰肿瘤生长(数据未示出)。在这个模型中IgG4同种型对照抗体对于血管发生不具有任何作用。如图12A和12B所示,克隆5.88.3、3.3.2、3.19.3和5.28.1显著抑制血管发生(p<0.05,由VasculoGen进行的t-检验),其它克隆具有较低的作用。充分确定Ang-2在肿瘤中由内皮细胞表达,因此认为可作为自分泌血管发生因子。然而,也已经发现Ang-2在体外和体内由许多类型的肿瘤细胞表达。除了3.19.3之外,本文测试的mAb与小鼠Ang-2均不交叉反应。在这个体内模型中,所述mAb仅中和由MCF-7细胞产生的人Ang-2而不中和小鼠Ang-2。这些mAb的抑制作用提示肿瘤表达的Ang-2可以是旁分泌血管发生因子。mAb的全部抗血管发生活性除了归因于血管内皮表达的Ang-2的中和之外,部分可归因于肿瘤Ang-2的中和。实施例20mAb3.19.3在A431预防性异种移植模型中治疗效力的确定抗-Ang-2mAb克隆3.19.3不仅结合小鼠Ang-2,还抑制小鼠Ang-2与人Tie2的结合。在人皮肤表皮样癌的小鼠异种移植模型中使用A431细胞系测试这种单克隆抗体的抗肿瘤活性。将A431细胞在培养瓶中常规培养直至细胞达到亚铺满。将免疫缺陷的6-8周龄的雌性小鼠(Balb/c/nu/nu)用于产生模型。收获A431细胞并悬浮于Matrigel中。将含有5×106个细胞的细胞悬浮液经皮内注射进小鼠的侧面。将小鼠随机分为不同组,每组具有11只小鼠。同一天,为小鼠腹膜内注射0.5mg的mAb3.19.3或者同种型对照抗体,之后每周注射两次。每周测定两次每个肿瘤的直径。肿瘤体积如下式计算:体积=长度×(宽度)2×0.5(cm3)。如图13所例证,mAb3.19.3使A431异种移植肿瘤生长显著延缓。同种型对照组的平均肿瘤体积在实验结束时达到大约1.5cm3,而处理组的生长速度在第10天后显著减慢,在实验结束时为大约0.5cm3。第23天,T/C(处理组/对照组)的体积比例为1/3,表明66%的生长抑制作用。结果提示在这个实验中使用的剂量下,通过与小鼠Ang-2结合及阻断该配体与其受体Tie2的结合,mAb3.16.3在裸鼠中能显著延缓A431异种移植物的生长。很可能单克隆抗体的抗肿瘤作用是由于抑制宿主中血管发生所致,通过Matrigelplug分析所证实。使用肿瘤中微血管密度(MVD)作为药物动力学标记,关于抗血管发生的作用机制在实施例22中进一步证实。mAb3.19.3的作用机制非限于其阻断Ang-2/Tie2结合及随后的信号传导。如实施例7所示,还发现这种mAb结合Ang-1并阻断Ang-1与Tie2的结合。令人感兴趣地,所述mAb还阻断Ang-1-诱导的Tie2磷酸化。已知Ang-1参与血管成熟。当比较mAb3.19.3的抑制Ang-1和Ang-2结合Tie2的效力(实施例12)时,显然mAb3.19.3主要是Ang-2拮抗剂。不受任何特定理论的限制,Ang-2和Ang-1信号传导的双重阻断可能损害血管发生及随后的肿瘤生长。实施例21mAb3.19.3在确定的异种移植模型中抑制肿瘤生长Ang-2由血管发生内皮细胞正调节,与许多类型的肿瘤的进展相关。可以假定阻断Ang-2/Tie2结合的单克隆抗体能抑制血管发生,因此抑制肿瘤生长。在这个实验中,证实了抗Ang-2mAb的治疗效力。由于mAb3.19.3交叉反应并中和小鼠Ang-2/Tie2信号传导,因此选择这种mAb证实其抑制肿瘤生长的体内效力。为了测试抗-Ang-2mAb3.19.3是否也抑制确定的肿瘤及除了A-431之外的肿瘤,应用人结肠腺癌LoVo异种移植模型。每周经腹膜内给予两次剂量0.5、2和10mg/kg的Mab3.19.3。当确定肿瘤的平均体积达到0.2cm3时才开始进行所述处理。对于这些确定的肿瘤,mAb3.19.3与同种型对照相比也表现出抑制作用。图14A示出在0.5和2mg/kg剂量达到79%抑制作用(p值分别为0.022和0.027),在10mg/kg剂量发现对肿瘤生长达到75%抑制作用(p=0.006)。在一另外的异种移植物模型即使其生长至平均体积为0.2cm3的人结肠腺癌SW480中再现了肿瘤生长抑制作用。尽管在0.5mg/kg剂量未发现mAb3.19.3具有显著作用,但是在2和10mg/kg剂量,在肿瘤植入后第53天所述mAb也使肿瘤生长抑制60%(p值分别为0.003和0.006)(图14B)。总而言之,抗-Ang-2mAb3.19.3在测试的三个模型中均显著抑制肿瘤生长。令人感兴趣地,LoVo和SW480均表达人Ang-2。然而,无小鼠Ang-2交叉反应性的两种其它mAb未示出对肿瘤生长的显著抑制活性(数据未示出),尽管事实上人Ang-2是由肿瘤细胞表达。这些结果提示需要宿主Ang-2的拮抗剂以阻断血管发生和肿瘤生长。如上所述,Mab3.19.3与Ang-1交叉反应。然而,mAb3.19.3对于Ang-1/Tie2结合的效力远低于对Ang-2/Tie2结合的效力(实施例12)。为此,可以推断在这些模型中观测到的治疗效力主要是由于Ang-2拮抗作用所致。然而,在模型中体内Ang-1的封闭不可完全排除。在整个实验期间,未观测到明显的毒性作用,如体重减轻或出血。实施例22mAb3.19.3在另外的肿瘤异种移植模型中的体内效力使用9种不同的肿瘤细胞系,在人癌症的小鼠异种移植模型中测试3.19.3单克隆抗体的抗肿瘤活性。将结肠腺癌(Lovo,SW480,Colo205,HT29,HCT116)、表皮样癌(A431)、肺癌(Calu-6)和乳腺癌(MCF7,MDA-MB-231)细胞在培养瓶中常规培养直至细胞达到亚铺满。使用免疫缺陷的7-10周龄的雌性小鼠产生模型。收获细胞,悬浮于Matrigel中,然后经皮下注射进每只小鼠中。然后将小鼠随机分为具有10-12只小鼠的群组。为小鼠腹膜内注射0.5mg的mAb3.19.3或者同种型对照抗体,之后每周注射两次。所有实验均包括同种型对照抗体处理。每周测定两次每个肿瘤的直径。肿瘤体积如下计算:体积=长度×(宽度)2×0.5(cm3)。对于HT29(图15A)和Calu6(图15B)异种移植物示出了肿瘤生长抑制的图解比较。如表16所示,mAb3.19.3在测试的所有7个异种移植皮下注射模型及具有非优化剂量和方案的两个正位模型中均示出明显活性。表18.mAb3.19.3的体内效力的总结所有情况下p<0.05*生长抑制统计学不显著N.D.-未确定MDA-MB-231肿瘤组织通过CD31+血管染色密度进行分析。CD31染色密度通过阈值及通过人工网格(grid)计数方法测定。对每组11个肿瘤及每个肿瘤至少20幅图像进行分析。如图15C所示,与对照IgG抗体相比,用3.19.3抗体处理小鼠使得CD31染色密度降低40%。使用阈值(p<0.015)和人工网格计数(p<0.00004)这两种计数方法通过单尾T-检验均具有统计学意义。对Colo205和HCT116异种移植物的回体组织进行相似的CD31+血管计数。这些样品也呈现出相似的CD31+血管染色密度降低。实施例23抗-ANG-2抗体在治疗血管发生相关疾病中的应用为了确定抗-Ang-1和抗-Ang-2抗体在具有各种实体瘤的病人体内的治疗作用,为病人周期性给予有效量的抗-Ang-1和抗-Ang-2抗体。在治疗期间定期监测病人,以确定肿瘤生长是否受抑制。在治疗后,发现经历抗-Ang-1和抗-Ang-2抗体治疗的病人与未治疗的患者相比在如下一或多方面有相对改善,包括但非限于肿瘤缩小、进展时间延缓及存活时间延长。实施例24抗ANG-2抗体作为诊断剂的应用样品中Ang-2抗原的检测可以进行酶联免疫吸附测定(ELISA)以检测样品中的Ang-1或Ang-2抗原。在这个分析中,将微滴定平板如96-孔微滴定平板或384-孔微滴定平板的孔用Ang-1和Ang-2的第一种完全人单克隆抗体吸附几小时。固定的抗体作为测试样品中也许存在的任何抗原的捕获抗体。将所述孔用封闭剂如牛乳蛋白质或白蛋白漂洗及处理,以防止非特异性分析物的吸附。随后,将所述孔用怀疑含有所述抗原的测试样品或者用含有标准量所述抗原的溶液处理。这种样品可以例如是怀疑具有被认为达到病理学诊断水平的循环抗原水平的对象的血清样品。在漂洗去测试样品或标准样品之后,将所述孔用通过与生物素缀合而标记的第二种完全人单克隆抗-Ang-1和抗-Ang-2抗体处理。也可以使用单克隆或小鼠或其它物种来源的抗体。所述标记的抗-Ang-1和抗-Ang-2抗体作为检测抗体。在漂洗去过量的第二种抗体之后,将所述孔用抗生物素蛋白缀合的辣根过氧化物酶(HRP)及一种合适的生色底物处理。测试样品中所述抗原的浓度通过与得自标准样品的标准曲线对比而确定。这个ELISA分析提供了检测测试样品中Ang-1和Ang-2抗原的高度特异性和非常灵敏的分析。患者中Ang-2抗原浓度的确定进行夹心ELISA(sandwichELISA)以量化人血清中Ang-1和Ang-2水平。夹心ELISA中的两种完全人单克隆抗-Ang-2抗体识别Ang-2分子上的不同表位。或者,可以使用小鼠或其它物种来源的单克隆抗体。所述ELISA可以但非必须如下进行:将于包被缓冲液(0.1MNaHCO3,pH9.6)中浓度为2μg/mL的50μL的捕获抗-Ang-2抗体包被在ELISA平板(Fisher)上。在4℃保温过夜后,将平板用200μL的封闭缓冲液(0.5%BSA,0.1%Tween20,0.01%Thimerosal于PBS中)在25℃处理1小时。将平板用于PBS中的0.05%Tween20(洗涤缓冲液,WB)洗涤3次。将正常或患者血清(Clinomics,Bioreclaimation)于含有50%人血清的封闭缓冲液中稀释。将平板与血清样品在4℃保温过夜,用WB洗涤,然后与100μL/孔的生物素酰化的检测抗-Ang-2抗体在25℃保温1小时。在洗涤后,将平板与HRP-链霉抗生物素蛋白保温15分钟,如前述洗涤,然后用于H2O2中100μL/孔的邻苯二胺(Sigma显色溶液)处理以生色。该反应用50μL/孔H2SO4(2M)终止,在492nm用ELISA平板读数器分析。血清样品中Ang-2抗原的浓度通过与纯化的Ang-2抗原的稀释液对比而计算,使用四参数曲线拟合程序计算。参考文献本文引用的所有参考文献,包括专利、专利申请、文章、教科书等及其中引用的参考文献在此均以其全部并入本文作参考。等价物前述说明书足以使得本领域技术人员可以实施本发明。前述描述和实施例详述了某些优选的本发明实施方案,并描述了本发明人预期的最佳模式。然而,应意识到无论文中前述信息描述的内容如何,本发明可以以多种方式实施,本发明应根据所附权利要求书及其任何等价物加以解释。PTA-7258:杂交瘤细胞系,于2005年12月2日根据布达佩斯条约保藏在美国典型培养物保藏中心(ATCC)(10801UniversityBlvd,Manassas,Virginia,U.S.A.)。PTA-7259:杂交瘤细胞系,于2005年12月2日根据布达佩斯条约保藏在美国典型培养物保藏中心(ATCC)(10801UniversityBlvd,Manassas,Virginia,U.S.A.)。PTA-7260:杂交瘤细胞系,于2005年12月2日根据布达佩斯条约保藏在美国典型培养物保藏中心(ATCC)(10801UniversityBlvd,Manassas,Virginia,U.S.A.)。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1