小麦粒重基因TaGW2-6A的稀有等位变异及其分子标记和应用的制作方法
本发明涉及一种小麦粒重基因TaGW2-6A的稀有等位变异及其分子标记和应用,属于生物技术领域。
背景技术:
小麦是我国第三大粮食作物,持续提高其产量水平是保障我国粮食安全的战略需要。随着人口数量和人均消费水平的提高,预计到2030年,我国小麦的年度总需求量将达到1.7亿吨。因此,小麦高产育种和产量性状遗传学研究均面临巨大的挑战。千粒重是小麦重要的产量构成因素之一,其在我国小麦品种的遗传改良中获得了显著提高。庄巧生(2003)分析了我国1949年-2000年间培育的小麦品种,发现20世纪50年代初期的品种平均千粒重为31.4g,70年代的品种已达40.5g,增加了28.9%,认为千粒重对产量提高贡献显著。Wu et al.(2014a)通过分析我国1945年-2010年间培育的小麦品种,同样发现粒重对小麦产量提高贡献显著且可靠性最高。因而,粒重性状成为小麦遗传改良的重点。
粒重是受遗传因素影响最大的产量构成性状,其广义遗传力可达49.5%-93.0%,且主要受加性效应的基因控制(Carter et al.2011;Huang et al.2006;McCartney et al.2005;Sun et al.2009;Wang et al.2009b)。近五年来,小麦粒重及相关性状QTL(Quantitative trait locus,数量性状基因位点)的定位也进行了大量的报道。Sun et al.(2010)应用Ning7840×Clark的132个高代重组自交系,将千粒重QTL定位到1BS、4B、5AS、6AS和7AL染色体上,这些QTL所解释的总表型变异介于47%-73%之间。Ramya et al.(2010)应用111×Chinese Spring RIL群体,将小麦千粒重QTL定位到1A、1D、2B、4B和6B染色体上。Heidari et al.(2011)利用Fukuho-kumogi×Oligoculm的DH(Double haploid,加倍单倍体)群体将千粒重QTL定位到2B、2D和4B染色体上,所解释的两年平均表型变异分别为18%、14%和12%;将穗粒重QTL定位到2D和4A染色体上,所解释的表型变异均大于10%;同时,还在2D染色体上发现一个穗长主效QTL,能够解释37.5%的表型变异,在1A染色体上发现一个小穗数主效QTL。Carter et al.(2011)应用Louise/Penawawa的RIL(Recombinant inbred lines,重组自交系)群体将4个小麦产量QTL定位到1A、2D、3B和5D染色体上,表型贡献率为6%-23%。Jia et al.(2013a)以Nanda 2419/Wangshuibai RIL群体为材料,将4个环境稳定的小麦粒重QTL定位在3A、4B、4D和5A染色体上。Cui et al.(2014)以Weimai 8和Jimai 20、Yannong19和Luohan 2构建的3个RIL群体为材料,对千粒重、粒长、粒宽等性状进行了QTL检测,共检测到165个加性QTL,其中65个QTL在不同的环境下能够重复检测到,23个QTL能够在2个及以上群体中重复检测到。Li et al.(2014)以Huapei 3/Yumai 57的DH群体为材料,对小麦总生物量、籽粒产量和秸秆产量进行了QTL分析,检测到的13个加性QTL分布在2B、2D、3A、4B、4D、5A和7B染色体上,其中4B和4D染色体上存在同时控制这3个性状的QTL位点。
然而,大部分产量及其构成因子QTL为微效QTL,受环境的影响较大。这些初步定位的QTL只能从概率上说明对应基因组区段存在产量QTL的可能性较大。到目前为止,在生产上获得真正应用的小麦产量QTL仍鲜有报道。造成这种现象的主要原因有两个:其一,QTL的遗传效应不确定,多数QTL定位结果未经过其他遗传背景的检测;其二,由于初定位时QTL的置信区间一般较大,涵盖数百个基因,因而在育种中无法对目标QTL作出准确选择。鉴于 以上原因,在定位到一个主效产量及其构成因子的QTL后,应继续确定QTL的精确位置和真实效应,获得同QTL共分离的分子标记。近年来,采用图位克隆的策略,水稻上已经克隆到多个粒重及粒型QTLs,其中负向调控籽粒大小的基因包括粒长基因GS3和qGL3/GL3.1/qGL3-1、粒宽基因GW2和qSW5/GW5、谷粒充实基因GIF1及调控胚乳长度和碳水化合物运输的TGW6基因等,正向调控籽粒大小的基因包括GS5和OsSPL16/GW8等(Li et al.2011;Mao et al.2010;Qi et al.2012;Song et al.2007;Wang et al.2008;Wang et al.2012b;Weng et al.2008)。在小麦中,采用同源克隆的策略,已经克隆的小麦粒重基因有PEBP-like、TaCwi-2A、TaSus2-2A、TaSus2-2B、TaSus1-7A、TaSus1-7B、TaCKX-3D、TaGW2-6A、TaSap1-A1、TaGS1-6D和TaLsu1基因(Chang et al.2013;Guo et al.2013;Hou et al.2014;Jiang et al.2011;Kang et al.2013;Ma et al.2012;Zhang et al.2012b;常成et al.2009)。
技术实现要素:
本发明的一个目的是提供一种鉴定或辅助鉴定待测植物粒重和/或粒型性状的方法。
本发明提供的方法,包括如下步骤:检测待测植物基因组中TaGW2-6A基因的启动子是否缺失114bpDNA片段,TaGW2-6A基因的启动子缺失114bpDNA片段的待测植物的粒重大于或候选大于TaGW2-6A基因的启动子不缺失114bpDNA片段的待测植物的粒重;或TaGW2-6A基因的启动子缺失114bpDNA片段的待测植物的粒型优于或候选优于TaGW2-6A基因的启动子不缺失114bpDNA片段的待测植物的粒型;
所述114bpDNA片段(位于TaGW2-6A,即小麦6A染色体)的核苷酸序列为TaGW2-6A基因的启动子第1812-1925位或序列表中序列4第1812-1925位。
上述方法中,所述检测待测植物基因组中TaGW2-6A基因的启动子是否缺失114bpDNA片段的方法为如下1)或2):
1)直接测序;
2)用能够扩增含有所述114bpDNA片段的引物扩增所述待测植物的基因组DNA,得到PCR产物,根据所述PCR产物确定检测待测植物基因组中TaGW2-6A基因的启动子中是否缺失所述114bpDNA片段。
上述方法中,所述2)所示的方法中,所述能够扩增含有所述114bpDNA片段的引物为由序列表中序列6所示的单链DNA分子和序列表中序列7所示的单链DNA分子组成;
所述根据PCR产物确定检测待测植物基因组中TaGW2-6A基因的启动子中是否缺失所述114bpDNA片段为,若所述待测植物的PCR产物仅含有大小为222bp的片段,则所述待测植物基因组中TaGW2-6A基因的启动子中缺失114bpDNA片段;若待测小麦的PCR扩增产物仅含有大小为336bp的片段,则所述待测植物基因组中TaGW2-6A基因的启动子中不缺失114bpDNA片段;
所述TaGW2-6A基因的启动子缺失114bpDNA片段的待测植物的粒型优于或候选优于TaGW2-6A基因的启动子不缺失114bpDNA片段的待测植物的粒型具体体现在如下(1)-(4)中至少一种:
(1)所述TaGW2-6A基因的启动子缺失114bpDNA片段的待测植物的粒长大于或候选大于所述TaGW2-6A基因的启动子不缺失114bpDNA片段的待测植物的粒长;
(2)所述TaGW2-6A基因的启动子缺失114bpDNA片段的待测植物的粒宽大于或候选大于所述TaGW2-6A基因的启动子不缺失114bpDNA片段的待测植物的粒宽;
(3)所述TaGW2-6A基因的启动子缺失114bpDNA片段的待测植物的籽粒周长大于或候选大于所述TaGW2-6A基因的启动子不缺失114bpDNA片段的待测植物的籽粒周长;
(4)所述TaGW2-6A基因的启动子缺失114bpDNA片段的待测植物的籽粒面积大于或候选大于所述TaGW2-6A基因的启动子不缺失114bpDNA片段的待测植物的籽粒面积;
所述TaGW2-6A基因的启动子的核苷酸序列为序列4;
所述植物为单子叶植物或双子叶植物,所述单子叶植物具体为小麦。
本发明的另一个目的是提供一种DNA片段。
本发明提供的DNA片段,其核苷酸序列为序列表中序列4第1812-1925位。
用于扩增上述DNA片段的引物也是本发明保护的范围,其由序列表中序列6所示的单链DNA分子和序列表中序列7所示的单链DNA分子组成。
上述的DNA片段、上述的引物在鉴定或辅助鉴定植物粒重和/或粒型性状中的应用也是本发明保护的范围;所述粒型性状包括粒长、粒宽、籽粒周长和/或籽粒面积;
本发明第三个目的是提供一种鉴定或辅助鉴定植物粒重和/或粒型性状的方法。
本发明提供的方法,包括如下步骤:检测待测植物的TaGW2-6A基因的启动子序列,TaGW2-6A基因的启动子序列长度小的待测植物的粒重大于或候选大于TaGW2-6A基因的启动子序列长度大的待测植物的粒重,和/或,TaGW2-6A基因的启动子序列长度小的待测植物的粒型性状优于或候选优于TaGW2-6A基因的启动子序列长度大的待测植物的粒型性状;
所述TaGW2-6A基因的启动子序列长度小的待测植物的粒型性状优于或候选优于TaGW2-6A基因的启动子序列长度大的待测植物的粒型性状包括如下(1)-(4)中至少一种:
(1)所述TaGW2-6A基因的启动子序列长度小的待测植物的粒长大于或候选大于TaGW2-6A基因的启动子序列长度大的待测植物的粒长;
(2)所述TaGW2-6A基因的启动子序列长度小的待测植物的粒宽大于或候选大于TaGW2-6A基因的启动子序列长度大的待测植物的粒宽;
(3)所述TaGW2-6A基因的启动子序列长度小的待测植物的籽粒周长大于或候选大于TaGW2-6A基因的启动子序列长度大的待测植物的籽粒周长;
(4)所述TaGW2-6A基因的启动子序列长度小的待测植物的籽粒面积大于或候选大于TaGW2-6A基因的启动子序列长度大的待测植物的籽粒面积。
上述方法中,所述TaGW2-6A基因的启动子序列长度小的待测植物的TaGW2-6A基因的启动子序列与所述TaGW2-6A基因的启动子序列长度大的待测植物的TaGW2-6A基因的启动子序列相比具有114bp的缺失序列;
所述TaGW2-6A基因的启动子序列长度大的待测植物的TaGW2-6A基因的启动子序列,其核苷酸序列为序列表中序列4。
上述方法中,所述TaGW2-6A基因的启动子序列长度小的待测植物和所述TaGW2-6A基因的启动子序列长度大的待测植物的鉴定方法如下:提取待测植物的基因组DNA,以用于扩增所述缺失序列的引物进行PCR扩增,得到PCR扩增产物,如果该PCR扩增产物含有所述缺失序列,则待测植物为TaGW2-6A基因的启动子序列长度小的待测植物,如果该PCR扩增产物不含所述缺失序列,则待测植物为TaGW2-6A基因的启动子序列长度大的待测植物;
所述114bp的缺失序列为序列表中序列4第1812-1925位核苷酸;
所述用于扩增所述缺失序列的引物具体由序列表中序列6所示的单链DNA分子和序列表中序列7所示的单链DNA分子组成;
所述TaGW2-6A基因的启动子序列长度小的待测植物和所述TaGW2-6A基因的启动子序列长度大的待测植物的鉴定方法具体如下:提取待测植物的基因组DNA,以所述用于扩增所述缺失序列的引物进行PCR扩增,得到PCR扩增产物,如果该PCR扩增产物大小为336bp,则待测植物为TaGW2-6A基因的启动子序列长度小的待测植物,如果该PCR扩增产物大小为222bp,则待测植物为TaGW2-6A基因的启动子序列长度大的待测植物。
上述的方法、上述的DNA片段、是述的引物在植物育种中的应用也是本发明保护的范围。
所述育种是利用上述任一所述的方法鉴定的粒重和/或粒型性状好的植物进行育种;
上述任一所述的方法、引物、分子标记或应用中,所述植物或待测植物可为双子叶植物或单子叶植物,具体可为禾本科植物,如小麦;
所述小麦为是以豫麦8679为母本,京411为父本,杂交得到杂交子代后,衍生的F2代分离群体。
本发明发现了小麦粒重基因TaGW2-6A的稀有等位变异,与小粒亲本京411相比,大粒亲本豫麦8679中TaGW2-6A基因的启动子序列存在114bp的缺失,从而导致启动子活性降低,114bp的目的片段可以作为检测粒重或粒型的标记。在此基础上,本发明开发了一个共显性的基因功能性标记TaGW2-6Atgw,该标记与已公布的SSR(Simple sequence repeat,简单重复序列)标记Xbarc118共分离,并将TaGW2-6A基因定位到6A染色体短臂的近着丝粒的区域。另外,本发明通过检测不同倍性的1114份小麦材料,共发现3份普通小麦具有豫麦8679基因型。综上所述,本发明所提供的TaGW2-6A基因的等位变异和分子标记TaGW2-6Atgw在小麦分子设计育种中具有较大的应用空间。
附图说明
图1为TaGW2-6A蛋白RING结构域同其他物种RING结构域的氨基酸序列比对结果。
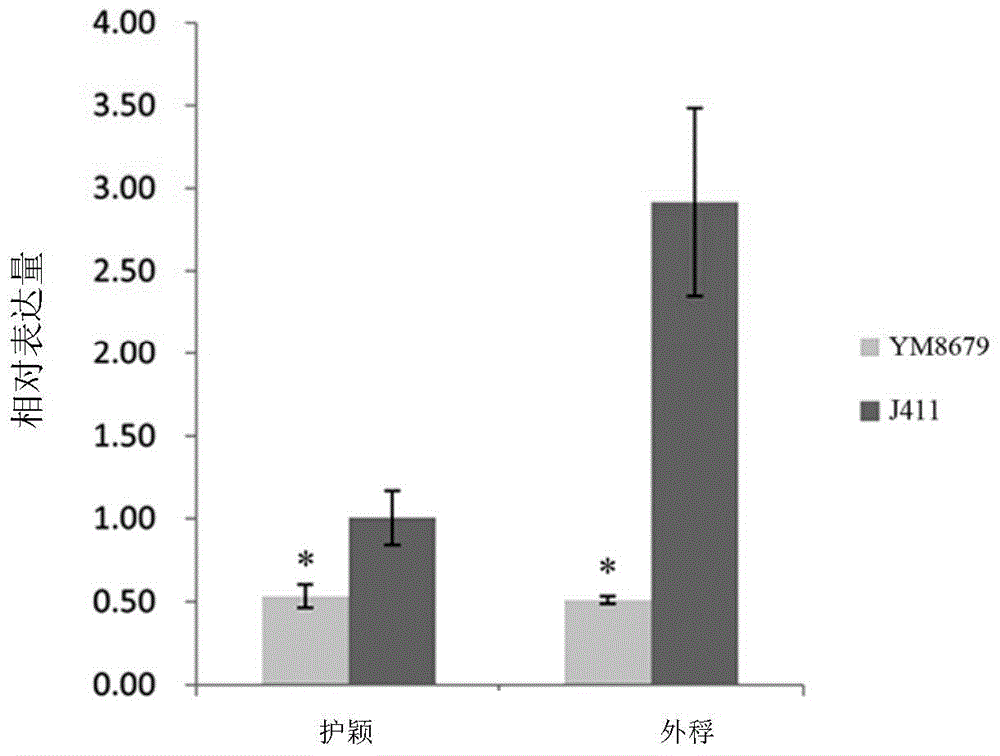
图2为豫麦8679和京411护颖和外稃组织中TaGW2-6A基因的相对表达量。
图3为豫麦8679与京411中TaGW2-6A基因的启动子序列比对。
图4为TaGW2-6A启动子区域114bp缺失序列的特异性扩增引物。
图5为应用豫麦8679/京411重组自交家系群体进行TaGW2-6A基因的定位。
图6为来自豫麦8679、京411的TaGW2-6A启动子活性分析。
图7为具有豫麦8679基因型的小麦材料的鉴定及TaGW2-6A启动子区域部分序列的比对结果。
图8为具有不同TaGW2-6A基因型的F2个体间的表型均值比较。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
小麦品种豫麦8679(YM8679)在文献“油菜素内酯代谢相关基因BAS1等位变异影响小麦籽粒密度及粒重表型”中公开过,公众可从中国农业大学获得。
董连生,潘艳秋,赵秋霞,常成,张海萍,司红起,卢杰,马传喜.油菜素内酯代谢相关基因BAS1等位变异影响小麦籽粒密度及粒重表型[J].分子植物育种,2012,01:92-96.
小麦品种京411(J411)在文献“小麦骨干亲本京411及衍生品种苗期根部性状的遗传”中公开过,公众可从中国农业大学获得。
肖永贵,路亚明,闻伟锷,陈新民,夏先春,王德森,李思敏,童依平,何中虎.小麦骨干亲本京411及衍生品种苗期根部性状的遗传[J].中国农业科学,2014,15:2916-2926.
烟草本氏烟(Nicotiana benthaminana),培养温度设为28℃恒温,光周期为16h光照(光强为30-40μmol/m2/s)、8h黑暗。
烟草本氏烟(Nicotiana benthaminana)记载在如下文献中:Tremblay R,Wang D,Jevnikar AM,Ma S.Tobacco,a highly efficient green bioreactor for production of therapeutic proteins.Biotechnol Adv,2010,28(2):214-221.
GUS反应缓冲液:10mmol/L磷酸钠(pH 7.0)、10mmol/L EDTA,0.1g/100ml Triton X-100、10mmol/Lβ-巯基乙醇和1mmol/L PNPG,余量为水。
GUS终止液:1mol/L的2-氨基-2-甲基-1,3-丙二醇溶液(2-amino-2-methyl-1,3-propanadiol)。
实施例1、与小麦粒重相关分子标记的获得
一、TaGW2-6A基因CDS序列的比对
豫麦8679(YM8679)和京411(J411)为常用小麦品种,但二者的粒重存在差异。因此,克隆豫麦8679(YM8679)和京411(J411)基因组中与粒重相关的TaGW2-6A基因,比较不同品种中二者的差异,结果豫麦8679(YM8679)和京411(J411)的TaGW2-6A基因的CDS序列完全相同,为序列表中序列1,序列长1278bp,编码一个具有425个氨基酸的蛋白TaGW2-6A,该蛋白的氨基酸序列为序列表中序列2。
将TaGW2-6A蛋白RING结构域同其他物种RING结构域的氨基酸序列比对,结果如图1所示。
图1中,横线为RING结构域,*为8个保守氨基酸位点。
图1表明,TaGW2-6A蛋白的RING型结构域结构完整,蛋白功能正常。
二、TaGW2-6A基因表达分析
分别提取豫麦8679(YM8679)的护颖和外稃组织、京411(J411)的护颖和外稃组织的RNA,并反转录为cDNA,分别以各小麦各组织的cDNA为模板,以GCAGAACAATCGCTCCAACA和GCCAAATCGCTTCCATAACC为引物,进行荧光定量PCR扩增,检测TaGW2-6A基因的相对表达量;
同时,以Ta_18SrRNA为内参基因,以CGAAACCCTCGTTTTGTGTT和CCTTGCTTCCCATTGTCATT为引物进行荧光定量PCR扩增。
结果如图2所示。图2中,*表示显著差异水平(p<0.05)。图2表明,与京411(J411)相比,豫麦8679(YM8679)护颖和外稃组织中TaGW2-6A基因的相对表达量显著降低。二者TaGW2-6A基因序列相同,但表达量差异较大,可能由于启动子不同引起的。
三、YM8679和J411中TaGW2-6A基因启动子的获得及等位变异
通过PCR的方法,分别克隆了豫麦8679(YM8679)和京411(J411)中TaGW2-6A基因起始密码子上游2041bp的启动子序列,并对可能的顺式作用元件进行了预测。
豫麦8679(YM8679)TaGW2-6A基因起始密码子上游2041bp的启动子8679P的核苷酸序列为序列3;
京411(J411)TaGW2-6A基因起始密码子上游2041bp的启动子411P的核苷酸序列为序列4;
将豫麦8679(YM8679)的TaGW2-6A基因的启动子序列(序列3)与京411(J411)的TaGW2-6A基因的启动子序列(序列4)进行比对,结果如图3所示。图3中,下划横线表示与京411的TaGW2-6A基因启动子相比,豫麦8679的TaGW2-6A基因启动子缺失114bp DNA 片段,箭头指示起始密码子ATG的位置。
TaGW2-6A基因启动子缺失114bp DNA片段为序列4第1812-1925位核苷酸,分析缺失的114bp DNA片段中共含有6个预测顺式作用元件,其中2个为根瘤形成相关元件,3个为光照响应元件,1个为大豆幼胚发育相关元件。
比对豫麦8679中TaGW2-6A启动子区域114bp的缺失序列中包含的顺式作用如表1所示。
表1 豫麦8679中TaGW2-6A启动子区域114bp的缺失序列中包含的顺式作用元件
四、TaGW2-6A基因的功能性标记开发与定位
(一)TaGW2-6Atgw的设计
基于步骤三发现的豫麦8679中TaGW2-6A基因的启动子区域缺失的114bp DNA片段,设计并合成上游引物CGTGTCACAAAACTAATTGGG和下游引物CCTCCCAGATCTAGCCTCCT,该引物命名为TaGW2-6Atgw,该引物的设计位置如图4所示。
(二)TaGW2-6Atgw的扩增
提取豫麦8679(YM8679)和京411(J411)的基因组DNA,分别以其为模板,以TaGW2-6Atgw为引物进行PCR扩增。
扩增产物进行电泳,结果如图5中的a所示,豫麦8679(YM8679)的PCR产物大小为222bp,其为序列3第1705-1926位核苷酸,其不含有上述114bp DNA片段;京411(J411)的PCR产物大小为336bp,其为序列4第1705-2040位核苷酸,其含有上述114bp DNA片段。
(三)定位
豫麦8679/京411的重组自交系(Recombinant Inbred Lines,RIL)群体,总计191个家系。为了避免可能的样品混杂,本发明对RIL群体进行了额外加代,并从每个RIL家系中选取1株F2:9代个体进行单株自交;收获种子后,从每个F2:10代RIL家系中选取20粒种子混合发芽并提取基因组DNA,用于TaGW2-6A基因的染色体定位。
借助已有的遗传连锁图谱,将TaGW2-6A基因定位到6A染色体短臂的近着丝粒的区域,同SSR标记Xbarc118共分离,如图5中b所示。
图5b中,图距单位为cM;着丝粒的大致位置用黑色椭圆表示。
五、YM8679和J411中TaGW2-6A基因启动子活性检测
(一)重组载体的构建
pBGWSF7.0载体的核苷酸序列为序列5(有GUS基因编码区及其启动子)。
表达豫麦8679的TaGW2-6A基因启动子的重组载体为将序列表中序列3所示的8679P启动子的第806-1927位核苷酸插入pBGWSF7.0载体的1601和1602位点间得到的载体,命名为8679-P-TaGW2-6A:GUS,且该载体中启动子位于GUS上游,驱动其表达;
表达京411的TaGW2-6A基因启动子的重组载体为将序列表中序列4所示的411P启动子的第806-2041位核苷酸插入pBGWSF7.0载体的1601和1602位点间得到的载体,命名为411-P-TaGW2-6A:GUS,且该载体中启动子位于GUS上游,驱动其表达。
(二)重组菌的构建
将重组载体8679-P-TaGW2-6A:GUS和重组载体411-P-TaGW2-6A:GUS分别转化根癌农杆菌GV3101,得到重组菌GV3101/8679-P-TaGW2-6A:GUS(提取质粒,送去测序为8679-P-TaGW2-6A:GUS,为阳性克隆)和重组菌GV3101/411-P-TaGW2-6A:GUS(提取质粒,送去测序为411-P-TaGW2-6A:GUS,为阳性克隆)。
将pBGWSF7.0转化根癌农杆菌GV3101,得到对照农杆菌。
(三)烟草瞬时表达
1、将10mL LB液体培养基(含50ug/mL壮观霉素)分别和5μL重组菌GV3101/8679-P-TaGW2-6A:GUS、重组菌GV3101/411-P-TaGW2-6A:GUS混合,得到两种混合液,将两种混合液分别加入到100mL的三角瓶中,于28℃摇菌12h,得到活化的豫麦8679-P-TaGW2-6A:GUS重组农杆菌和活化的京411-P-TaGW2-6A:GUS重组农杆菌。
2、将10mL LB液体培养基(含10mmol/L MES、15μmol/L乙酰丁香酮、50ug/mL壮观霉素)分别和50μL步骤1制备的活化的豫麦8679-P-TaGW2-6A:GUS重组农杆菌或活化的京411-P-TaGW2-6A:GUS重组农杆菌混合,得到各混合液,将各混合液分别加入到100mL的三角瓶中,于28℃摇菌12h,得到豫麦8679-P-TaGW2-6A:GUS重组农杆菌培养液和京411-P-TaGW2-6A:GUS重组农杆菌培养液。
3、分别取步骤2制备的10mL豫麦8679-P-TaGW2-6A:GUS重组农杆菌培养液或京411-P-TaGW2-6A:GUS重组农杆菌培养液于5000rpm离心5min,测定各菌液的OD值。使用Induction media(1mL 1mol/L MgCl2水溶液、2.5mL 0.4mol/L pH 5.6MES、100uL 0.1mol/L乙酰丁香酮水溶液,96.4mL ddH2O)将各菌液稀释至OD260等于1.0。使用注射器吸取2mL稀释后的豫麦8679-P-TaGW2-6A:GUS重组农杆菌培养液或京411-P-TaGW2-6A:GUS重组农杆菌培养液,在本氏烟背部主叶脉处划“+”型,进行侵染,得到豫麦8679-P-TaGW2-6A:GUS侵染后本氏烟和京411-P-TaGW2-6A:GUS侵染后本氏烟。
4、3天后取样,将豫麦8679-P-TaGW2-6A:GUS重组农杆菌或京411-P-TaGW2-6A:GUS重组农杆菌侵染的本氏烟叶片去除背部主叶脉,液氮速冻后-80℃保存、备用。
以对照农杆菌进行上述实验,得到对照本氏烟叶片。
(四)GUS酶活性定量分析
通过分光光度法检测GUS酶活性。
原理:GUS通过催化对硝基苯基-β-D-葡萄糖醛酸苷的水解,生成对硝基苯酚。在pH值为7.15时,对硝基苯酚的发色团吸收400nm-420nm波段的光后,呈现出黄色。GUS酶促反应在pH 7.0的条件下进行,随着产物逐渐增多,溶液碱化后显色。通过测定底物的浓度换算出GUS酶活。
1、分别提取步骤(三)得到的豫麦8679-P-TaGW2-6A:GUS重组农杆菌侵染的本氏烟叶片、京411-P-TaGW2-6A:GUS重组农杆菌侵染的本氏烟叶片和对照本氏烟叶片的总蛋白,分别命名为蛋白A、蛋白B和蛋白C,分别进行如下GUS酶活测定。
2、GUS酶活测定
取6支试管并编号,分别加入总蛋白含量为17.5mg的样品GUS提取液,再分别加入GUS 反应缓冲液至反应总体积为0.5ml,混匀;
立即向1号试管中加入200μL GUS终止液,作为GUS反应0min的样品;其余5个试管于37℃保温,分别于5min、10min、15min、30min和60min加入200μL GUS终止液,作为GUS反应不同时间后的样品;
酶促反应结束后,以0min样品为空白对照,于415nm波长测定GUS反应不同时间后的样品的吸光度,根据对硝基苯酚标准曲线计算出GUS反应不同时间后的样品中对硝基苯酚的含量;
对硝基苯酚标准曲线的建立方法为选择0-45μmol/L之间28个浓度的对硝基苯酚制作标准曲线。利用该标准曲线可以得出每个待测样品在不同反应时间生成的对硝基苯酚的含量,然后做出每个待测样品的GUS酶反应动力学曲线,进而根据酶活力定义求得每个待测样品的GUS酶活力。
酶活力计算时,先以GUS反应时间(min)为横坐标,以生成的对硝基苯酚的含量(mg)为纵坐标作图,得到曲线,取其直线部分的斜率作为酶促反应初始阶段的反应速率。酶活单位(U)定义为每分钟水解PNPG生成1mg对硝基苯酚所需的GUS酶量为1个酶活力单位计算得到蛋白A和蛋白B的GUS酶活力,单位为U或ml/mg*min。
蛋白A的GUS酶活力除以GUS酶活测定时蛋白A的含量,计算得到豫麦8679的TaGW2-6A基因的启动子启动下的GUS基因表达活性(即每毫克蛋白的GUS酶活力)。
蛋白B的GUS酶活力除以GUS酶活测定时蛋白B的含量,计算得到京411的TaGW2-6A基因的启动子启动下的GUS基因表达活性(即每毫克蛋白的GUS酶活力)。
蛋白C的GUS酶活力除以GUS酶活测定时蛋白C的含量,计算得到对照启动子启动下的GUS基因表达活性(即每毫克蛋白的GUS酶活力)。
结果如图6所示。
图6中,YM8679-P-TaGW2-6A为豫麦8679-P-TaGW2-6A:GUS侵染后本氏烟;J411-P-TaGW2-6A代表京411-P-TaGW2-6A:GUS侵染后本氏烟;CK代表对照本氏烟中。
图6表明,豫麦8679的TaGW2-6A基因的启动子8679P活性显著低于京411的TaGW2-6A基因的启动子411P活性(P<0.01)。
结果证明,豫麦8679中TaGW2-6A启动子存在的114bp的缺失导致与京411(J411)相比,豫麦8679(YM8679)护颖和外稃组织中TaGW2-6A基因的表达量显著降低。
通过前面的实验证明,豫麦8679(YM8679)和京411(J411)中的粒重相关的TaGW2-6A基因的序列相同,但表达量不同,是由于豫麦8679(YM8679)中TaGW2-6A基因启动子比京411(J411)中TaGW2-6A基因启动子缺失114bpDNA片段,因此缺失114bpDNA片段可作为粒重相关分子标记。
检测TaGW2-6A基因启动子中是否缺失114bpDNA片段的物质,如引物对TaGW2-6Atgw,可以作为辅助检测待测小麦是否为高粒重或者优粒型;根据检测待测小麦的TaGW2-6A基因启动子中是否缺失114bpDNA片段来确定待测小麦是否为高粒重或者优粒型:TaGW2-6A基因启动子中缺失114bpDNA片段的待测小麦的粒重大于TaGW2-6A基因启动子中不缺失114bpDNA片段的待测小麦的粒重;或TaGW2-6A基因启动子中缺失114bpDNA片段的待测小麦的粒型优于TaGW2-6A基因启动子中不缺失114bpDNA片段的待测小麦的粒型。
检测待测小麦的TaGW2-6A基因启动子中是否缺失114bpDNA片段可以通过直接测序或者如下方法检测:
提取待测小麦的基因组DNA,用引物对TaGW2-6Atgw进行PCR扩增,若待测小麦的PCR扩增产物仅含有大小为222bp的片段,则该小麦的TaGW2-6A基因启动子中缺失114bpDNA片段;若待测小麦的PCR扩增产物仅含有大小为336bp的片段,则该小麦的TaGW2-6A基因启动子中不缺失114bpDNA片段。
五、TaGW2-6A基因的等位变异频率
以664份我国小麦品系、162份小麦微核心种质、50份法国小麦品系及238份四倍体小麦为待测小麦材料,检测TaGW2-6A基因启动子,具体如下:
提取待测小麦的基因组DNA,以实施例1中设计的TaGW2-6Atgw引物进行PCR扩增,得到PCR扩增产物。
检测PCR产物大小,若待测小麦的PCR扩增产物仅含有大小为222bp的片段(序列3第1705-1926位核苷酸),则该小麦的TaGW2-6A基因启动子中缺失114bpDNA片段,具有豫麦8679基因型;若待测小麦的PCR扩增产物仅含有大小为336bp的片段(序列4第1705-2040位核苷酸),则该小麦的TaGW2-6A基因启动子中不缺失114bpDNA片段,具有京411基因型。
按照上述具有豫麦8679基因型的判定方法检测各待测小麦的基因型并根据具有TaGW2-6A等位变异基因型的小麦材料数/所检测的小麦材料总数计算TaGW2-6A基因的等位变异频率。
各待测小麦材料按照上述具有豫麦8679基因型的判定方法得到的PCR扩增产物的琼脂糖凝胶电泳结果如图7中a所示,A-29、A-383、A-887分别为济南13、京花9号、藁优0551。
将各待测小麦材料按照上述具有豫麦8679基因型的判定方法得到的PCR扩增产物进行测序并比对,结果如图7中b所示。
图7中,A-29、A-383、A-887为3个具有豫麦8679基因型的小麦材料。
不同小麦材料中TaGW2-6A基因的等位变异频率结果如表2所示。
表2 不同材料中TaGW2-6A基因的等位变异频率
结果表明,在876份小麦中共检测到3个小麦材料(A-29、A-383、A-887)的基因型同豫麦8679一致,基因型频率为0.34%;238份四倍体小麦中没有检测到与豫麦8679基因型相同的材料。测序结果表明,A-29、A-383和A-887中TaGW2-6A基因的启动子区域均具有114bp缺失,与豫麦8679启动子序列相似性为100%,由此推测这些材料的TaGW2-6A基因可能具有相同的来源。
实施例2、粒重相关分子标记的应用
一、待测样本的获得
以豫麦8679作为母本,京411作为父本,杂交得到杂交子代F1后,衍生得到的F2代分离群体。
二、粒重相关分子标记的PCR扩增
提取豫麦8679、京411及F2代分离群体中各单株的基因组DNA作为模板,用实施例1的 引物TaGW2-6Atgw引物进行PCR扩增,得到PCR扩增产物。
检测PCR产物大小。
F2代分离群体中有41株单株的PCR扩增产物仅含有大小为222bp的片段(序列3第1705-1926位核苷酸),则这些小麦的TaGW2-6A基因启动子中缺失114bpDNA片段,其基因型定义为AA基因型;
F2代分离群体中有38株单株的PCR扩增产物仅含有大小为336bp的片段(序列4第1705-2040位核苷酸),则这些小麦的TaGW2-6A基因启动子中不缺失114bpDNA片段,其基因型定义为BB基因型。
用实施例1中检测待测小麦的TaGW2-6A基因启动子中是否缺失114bpDNA片段来确定待测小麦是否为高粒重或者优粒型的标准:TaGW2-6A基因启动子中缺失114bpDNA片段的待测小麦的粒重大于TaGW2-6A基因启动子中不缺失114bpDNA片段的待测小麦的粒重;或TaGW2-6A基因启动子中缺失114bpDNA片段的待测小麦的粒型优于TaGW2-6A基因启动子中不缺失114bpDNA片段的待测小麦的粒型。
因此,TaGW2-6A基因启动子中缺失114bpDNA片段41株小麦的粒重大于TaGW2-6A基因启动子中不缺失114bpDNA片段38株小麦;TaGW2-6A基因启动子中缺失114bpDNA片段41株小麦的粒型优于TaGW2-6A基因启动子中不缺失114bpDNA片段38株小麦。
三、粒重及粒型验证
将F2代分离群体中TaGW2-6A基因启动子中缺失114bpDNA片段41株小麦和F2代分离群体中TaGW2-6A基因启动子中不缺失114bpDNA片段38株小麦于2013年秋季在中国农业大学上庄试验站播种,于2014年春季考察抽穗期,成熟后对各性状进行考察。其中,每小区取20个代表性主穗混合脱粒后,考察总粒数和总粒重,计算千粒重(Thousand grain weights,TGW)及粒型相关性状,包括粒宽(Grain width,GW)、粒长(Grain length,GL)、籽粒周长(Grain circle,GC)和籽粒面积(Grain area,GA)。
实验重复三次,结果取平均值。
结果如图8所示。
TaGW2-6A基因启动子中缺失114bpDNA片段41株小麦(AA基因型)千粒重为41.94±5.26g、粒宽为3.04±0.15cm、粒长为7.32±0.17cm、籽粒周长为17.77±0.44cm和籽粒面积为17.64±1.62cm2;
TaGW2-6A基因启动子中不缺失114bpDNA片段38株小麦(BB基因型)千粒重为37.50±3.26g、粒宽为2.89±0.10cm、粒长为7.10±0.13cm、籽粒周长为17.35±0.32cm和籽粒面积为16.51±0.82cm2;
另外,在图8中,比较两组个体在TGW、GA、GC、GL和GW性状的均值差异表明,TaGW2-6A基因启动子中缺失114bpDNA片段41株小麦(AA基因型)的各性状均值均显著高于TaGW2-6A基因启动子中不缺失114bpDNA片段38株小麦(BB基因型)的各性状均值(P<0.001);相比于TaGW2-6A基因启动子中不缺失114bpDNA片段38株小麦(BB基因型),TaGW2-6A基因启动子中缺失114bpDNA片段的41株小麦(AA基因型)的TGW、GA、GC、GL和GW分别提高11.84%、6.84%、2.42%、1.83%和5.19%。
从上述结果可以看出,TaGW2-6A基因启动子中缺失114bpDNA片段41株小麦的千粒重、粒宽、粒长、籽粒周长和籽粒面积均大于TaGW2-6A基因启动子中不缺失114bpDNA片段38株小麦。
这与本发明的方法上述二得出的结论一致。
因此,可以看出本发明的方法正确。
- 还没有人留言评论。精彩留言会获得点赞!