趋化素修饰胜肽的制作方法
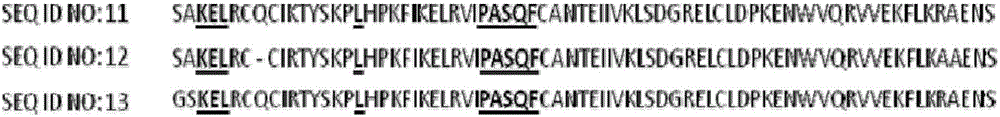
本发明是关于一种经修饰的趋化素,可作为一种治疗剂,尤其,本发明特别有关于一种用于治疗癌症与抑制肿瘤生长的经修饰趋化素。
背景技术:
:趋化素(Chemokine,又称趋化因子)是一群可被诱导,可被分泌而且结构类似的小分子(8-14kd)。趋化素可分为CXC、CC、CX3C及C四亚群;若以功能来分类,趋化素可分为恒定性趋化素(Homeostasischemokines)及发炎性趋化素(Inflammatorychemokines)。趋化素在其结构上通常具有三个β-褶板(β-sheet),且在C端具有一个α-螺旋(α-helix),在N端上会有4个保留的胱氨酸(cysteine)。按照N端所含前两个胱氨酸序列可分成四个族群:CXC、CC、C、CX3C,而以CC和CXC趋化激素为主。细胞上的趋化素与趋化素接受器结合之后才产生反应,而趋化素接受器具有7个跨细胞膜的G蛋白结合接受器,依其结合标的上的配体(ligand)种类不同而分别被命名为CXCR、CCR、CXR、CX3CR,若是再依 照数目顺序排列,如CXCR1、CXCR2、CCR4等。但在标的细胞上不只表现一种趋化素接受器,发炎细胞浸润的结合标的与趋化素接受器也并非一对一,部份趋化素接受器在不同细胞需一定刺激诱导才会表现。例如,含有谷氨酸(E)-亮氨酸(L)-精氨酸(R)特征序列(ELR特征序列)的ELR-CXC趋化素,该ELR-CXC是指在蛋白质N端具有氨基酸序列为ELR-CXC特征的蛋白,X可为极性且带有电性或不具电性的氨基酸,或者X并不存在,其可调控致癌基因的生长、IL-8、第二型嗜中性球活化胜肽(NAP-2),其接受器为CXCR1、CXCR2,主要作用细胞为嗜中性球,可促进嗜中性球的蓄积与活化作用,是以此类ELR-CXC趋化素与广范围的急性与慢性发炎病症的发生,素有重大关联并扮演着重大的角色,此等的发炎反应包含牛皮癣与风湿性关节炎。此外ELR-CXC趋化素还更与肿瘤发展时所伴随的血管新生有关,其诱发机制是为经由此类趋化素,尤指IL-8,与血管内皮细胞(Endothelialcell,EC)上的CXCR1以及CXCR2的结合所产生的活化作用。目前已证实有许多不同类型的肿瘤会产生ELR-CXC趋化素,且会表现此类型趋化素的肿瘤已被认为与肿瘤的不良预后发展有关。藉由拮抗CXCR1或CXCR2与ELR-CXC趋化素的结合,为一可行的策略,以便抑制由CXCR1或/及CXCR2受体 激活后所引发的异常讯号传递,进而治疗带有该两种受体的细胞活化所造成的相关疾病,因此科学家正致力于寻找及制备抑制CXC趋化素的受质蛋白相似物。本案发明人鉴于习知技术中的不足,经过悉心试验与研究,并一本锲而不舍的精神,终构思出本案发明,能够克服先前技术的不足,以下为本案之简要说明。技术实现要素:癌症为已开发国家的重要死因之一。尽管目前对于癌症的诊断及治疗方面已有进展,若能早期发现癌症则手术及放射性治疗可能治愈癌症,但大部分的药物不是有很大的副作用,就是效果不佳。因此,医学界亟需一种方法及组成物来治疗或防止癌症。有鉴于此,本发明开发一种经修饰趋化素胜肽(peptide,肽),以抑制肿瘤生长与治疗癌症。本发明提供一种经修饰趋化素胜肽,其包含一氨基酸序列,此氨基酸具有一N端(N’),此氨基酸序列带有:(a)N’-谷氨酸(E)-亮氨酸(L)-精氨酸(R)的特征序列,此特征序列位于所述趋化素胜肽N端;(b)N’-脯氨酸(P)-丙氨酸(A)-丝氨酸(S)-谷氨酰胺(Q)-苯基丙氨酸(F)-Cys3的特征序列,此特征序列位于趋化素胜肽N端算起第3个胱氨酸(Cys3);其中所述趋化素胜肽是包含该(a)、 (b)特征序列并具有一修饰位置,且此修饰位置位于所述趋化素胜肽上由N端算起第17,12,13个氨基酸。在一实施例中,其中此趋化素胜肽上第17个氨基酸由苯基丙氨酸(F)置换为亮氨酸(L)。在一实施例中,其中此经修饰趋化素胜肽的未经修饰的前身系来自于来源趋化素胜肽,所述来源趋化素胜肽N端的第1个胱氨酸及第2个胱氨酸之间可存在0-2个氨基酸,且当氨基酸为1-2个时,此氨基酸为具有电性或不具电性的极性氨基酸。在一实施例中,其中所述来源趋化素胜肽选自由SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:5、SEQIDNO:6、SEQIDNO:7、SEQIDNO:8和SEQIDNO:9及其组合所组成的群组其中之一。在一实施例中,本发明经修饰趋化素胜肽选自由SEQIDNO:10、SEQIDNO:11和SEQIDNO:12及其组合所组成的群组其中之一。本发明另提供一种医药组合物,包含本发明的经修饰趋化素胜肽及医药可接受性赋形剂。在一实施例中,其中经修饰趋化素胜肽的用途是用于治疗癌症或抑制肿瘤生长。本发明另提供一种治疗癌症及抑制肿瘤的医药组合物,包括本发明的经修饰趋化素胜肽及医药可接受性赋形剂。在一实施例中,其中癌症包括前列腺癌、乳癌、子宫癌、血癌、卵巢癌、子宫内膜癌、子宫颈癌、大肠直肠癌、睪丸癌、淋巴癌、横纹肌肉瘤、神经母细胞瘤、胰脏癌、肺癌、脑部肿瘤、皮肤癌、胃癌、口腔癌、肝癌、喉癌、胆癌、甲状腺癌、肝癌、肾脏癌以及鼻咽癌等。附图说明图1为本发明的来源趋化素胜肽序列(SEQIDNO:1-SEQIDNO:9),亦是对CXCR1或/及CXCR2具有高亲和力的ELR-CXC趋化素的氨基酸序列比对图。图2为本发明的经修饰趋化素胜肽的氨基酸序列比对图(SEQIDNO:10-12)。图3显示具有趋化素CXCL8的细胞迁移数量。图4分别显示黑色部分为具有化学激素刺激,灰色部分为具有化学激素刺激及CXCL8-IP10,白色部分为具有化学激素刺激及IL8-17LIP10之细胞迁移数量。图5显示实验组(IL8-17LIP10)与对照组(食盐水)的肿瘤体积。图6显示实验组(IL8-17LIP10)与对照组(食盐水)的肿瘤重量图7显示实验组(IL8-17LIP10)与对照组(食盐水)的微血管密度。图8为注射CXCL8-IP10、生理食盐水后肿瘤体积大小观察图,其中:A组:每个礼拜注射4次的CXCL8-IP10500ug/kg,B组:每个礼拜注射2次之CXCL8-IP10500ug/kg,C组:每个礼拜注射2次之CXCL8-IP10250ug/kg,D组:每天皮下注射100μl的食盐水并观察肿瘤体积大小。图9为牺牲后的小鼠肺脏肿瘤组织,其中,A为每个礼拜注射4次CXCL8-IP10500ug/kg的老鼠在第24天牺牲后,取出的肺脏;B为注射生理食盐水的老鼠肺脏,其中箭头所指的白色肿瘤部位为转移到肺部所产生病灶。图10显示肿瘤细胞中表达CXCR1或CXCL8的趋势。图11显示本发明拮抗剂对趋化反应的影响。具体实施方式本发明提供一种新颖的趋化素胜肽。本发明的新颖趋化素胜肽源自属于ELR-CXC趋化素或是对CXCR1或CXCR2具有高亲和力的受质,例如,CXCL1(SEQIDNO:3)、CXCL2(SEQIDNO:4)、CXCL3(SEQIDNO:5)、CXCL5(SEQIDNO:6)、CXCL6(SEQIDNO:7)、CXCL7(SEQIDNO:8)、CXCL8(SEQIDNO:2)、hG31P(SEQIDNO:1)。本发明系根据此一类型的趋化素进行修饰,主要在其30s-loop处插入一段PASQF特征序列(如图1),此 一PASQF原本是存在于趋化素CXCL10中,且该CXCL10为一种非ELR-CXC趋化素。本发明的经修饰趋化素,包括:(a)N’-谷氨酸(E)-亮氨酸(L)-精氨酸(R)的特征序列,此特征序列位于该趋化素胜肽N端;以及(b)N’-脯氨酸(P)-丙氨酸(A)-丝氨酸(S)-谷氨酰胺(Q)-苯基丙氨酸(F)-Cys3的特征序列,此特征序列是位于趋化素胜肽N端算起第3个胱氨酸(Cys3)。此外,应注意的是,本发明的趋化素胜肽更具有一突变位置(即修饰位置),其是位于由趋化素胜肽N端算起第17个氨基酸。在一实施例中,本发明趋化素胜肽的第17位氨基酸原本为苯基丙氨酸(F),并经突变置换后变为其它非苯基丙氨酸的氨基酸。在另一实施例中,本发明趋化素胜肽的第17位氨基酸可为丙氨酸(A)、半胱氨酸(C)、硒半胱氨酸(U)、天冬氨酸(D)、天冬酰胺(N)、谷氨酸(E)、谷氨酰胺(Q)、甘氨酸(G)、组氨酸(H)、亮氨酸(L)、异亮氨酸(I)、赖氨酸(K)、吡咯赖氨酸(O)、蛋氨酸(M)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、缬氨酸(V)、色氨酸(W)、酪氨酸(Y),较佳为亮氨酸(L)。与未置换的趋化素多胜肽相比较,第17位氨基酸在置换后的趋化素多胜肽具有较高亲和性并能够有效抑制癌细胞生长。在本发明一特定实施例中,本发明的经修饰的趋化素胜肽包括,但不限于,SEQIDNO:10、SEQIDNO:11及/或SEQIDNO:12(如图2)。以SEQIDNO:10为例,SEQIDNO:10除具有ELR-CQC的N端序列而符合ELR-CXnC的氨基酸特征序列之规则外,SEQIDNO:10还具有一由N端起算的Pro-Ala-Ser-Gln-Phe(脯氨酸-丙氨酸-丝氨酸-谷氨酰胺-苯丙氨酸,PASQF)的寡肽序列,此PASQF为一修饰序列,且被插入于N端起算的第3个半胱氨酸(Cysteine,C)的上游(10192),并且此第3个半胱氨酸紧接在PASQF寡肽序列的苯丙氨酸(F)之后。更重要的是,第17位的氨基酸不为苯丙氨酸,而为亮氨酸。由本发明所提供的序列表(如图2)可知,SEQIDNO:10至SEQIDNO:12的ELR-CXC趋化素类似物序列均具有由N端起算第3个半胱氨酸之前的PASQF修饰序列。另外,本发明趋化素胜肽的第17位氨基酸经突变为亮氨酸。本发明的经修饰趋化素胜肽、其类似物及/片断可抑制血管新生相关的疾病。血管新生相关的疾病包括,但不限于,发炎性疾病、慢性风湿性关节炎及牛皮癣、不正常血管侵犯有关的疾病、以及细胞增生性疾病,如与肿瘤或癌症有关的疾病(例如,前列腺癌、乳癌、子宫癌、血癌、卵巢 癌、子宫内膜癌、子宫颈癌、大肠直肠癌、睪丸癌、淋巴癌、横纹肌肉瘤、神经母细胞瘤、胰脏癌、肺癌、脑部肿瘤、皮肤癌、胃癌、口腔癌、肝癌、喉癌、胆癌、甲状腺癌、肝癌、肾脏癌以及鼻咽癌等)。本发明的趋化素修饰胜肽及/或包含此趋化素修饰胜肽的药学组成物可以口服,非肠胃、吸入、直肠、阴道、皮内、经皮或局部给予,一药剂单位可包括传统无毒的药学上可接受的载体、佐剂及载具。本发明的趋化素修饰胜肽及/或包含此趋化素修饰胜肽的药学组成物可一次给予,24小时内多次给予或连续给予。当注射的方式为连续给予时,可选用适合的习知方式,包括,但不限于,静脉注射点滴、静脉注射帮浦、埋植式注射泵或局部给予。治疗的时间可依不同的情况做适当的调整,例如,血管新生作用的病程及严重性。在以本发明经修饰的趋化素胜肽单独或合并本发明其他药剂直到治愈,或持续治疗终身。在另一实施例中,本发明提供一种治疗癌症及抑制肿瘤的医药组合物。此药学组成物包括一有效量的本发明趋化素修饰胜肽或其类似物,以及一药学上可接受的载体。药学上可接受的载体包括溶剂、分散剂、涂层、抗菌剂/抗真菌剂、等渗压、吸收延迟剂及其类似物。【实施例】1.细胞趋化利用Boydenchamberassay评估LMVECs的迁移状况,将LMVECs培养于含有2%FCS的HuMedia-EB28小时,之后将12X104cells/cm2的细胞推平于孔径大小5μm且涂布10μg/mlfibronectin的polycarbonate滤膜(Sigma-Aldrich)。分别将10ng/mLofCXCL8,CXCL6,CXCL1,CXCL5,及CXCL8-IP10或IL8-F17LIP10置入Boydenchamber的底部。LMVECs于Boydenchamber于37℃培养4小时,之后使用Diff-Quick(Harleco)将滤膜固定与染色,而迁移的细胞利用(HPFs)(X200)计算迁移的细胞数量。图3显示具有趋化素CXCL8的迁移数量最多。图4中黑色部分仅具有化学激素刺激,灰色部分为具有化学激素刺激及CXCL8-IP10,白色部分为具有化学激素刺激及IL8-17LIP10。由图4可知CXCL8-IP10及IL8-17LIP10同样具有抑制细胞迁移的效用,而IL8-17LIP10抑制细胞迁移的效用相对于CXCL8-IP10较好。2.裸鼠异种移植分析将无胸腺雄鼠(4-6周BALB/c)置于无菌操作房中。无菌操作房中具有充分的饮水与饲料,并每天监测小鼠。将GFP-标记PC-3细胞(PC-3-GFP)注射至3只裸鼠的右腹 部,每只裸鼠注射5x106的细胞。培养2-4周后,采取肿瘤以供移植。取出此3只裸鼠的肿瘤组织进行切片(1mm3的切片),并于麻醉及消毒的状态下移植至其它小鼠的前列腺中。移植后第5天,将动物分为2组(每组12只),每天皮下注射100μl的食盐水(对照组)或本发明的序列(IL8-17LIP10(SEQIDNO:13),0.5mg/kg)(实验组),持续24天。在第12、18、与24天,利用光学解剖显微镜与数字相机以515mm的滤光片摄影肿瘤生长影像。肿瘤体积的计算方式如下:肿瘤体积=(长度x宽2)/2。在第24天时,将所有小鼠牺牲,并取得肿瘤GFP荧光影像。微血管密度的计算方式如下:密度=微血管长度/肿瘤体积。肿瘤样本以4%甲醛固定后,包埋于石蜡中,以供后续的免疫组织化学分析。图5显示第12、18与24天时,实验组与对照组的肿瘤体积。由图5可知,本发明的序列(IL8-17LIP10)可显著地抑制肿瘤生长,可抑制肿瘤体积达5倍以上,且随着时间增加,抑制效果更明显。图6显示第24天时,实验组与对照组的肿瘤重量。由图6可知,本发明的序列(IL8-17LIP10)可显著地抑制肿瘤生长,可抑制肿瘤重量达2倍以上。3.免疫组织化学分析将包埋于石蜡中的肿瘤切片脱蜡并以PBS再水化。详细 地说,将切片经PBS润湿3次,并于10mM柠檬酸钠(pH6.0)热处理15分钟。之后,以3%的过氧化氢处理10分钟以去除内源性的过氧化酶活性,再以PBS清洗3次,于室温下以蛋白质封阻溶液(含5%马血清的PBS溶液)处理15分钟后,以PBS清洗3次,再以小鼠抗-VEGF单株抗体(1:50),兔子抗-NF-κB多株抗体或山羊抗-CD3多株抗体(1:50)于4℃下反应20小时。反应完成后,以PBS清洗3次,并以适当的二级抗体于37℃下反应40分钟。再以PBS清洗3次后,将切片以生物素标记的山羊抗小鼠或抗兔子的抗山羊IgG多株抗体于暗室反应30分钟。在呈色反应中,以PBS清洗3次,二氨基联苯胺溶液染色10分钟,再以苏木精染色1分钟(Kollmaretal,2007)。阴性对照组以PBS取代初级抗体。将影像转为灰阶(0-225),以积分光密度(IOD)表示,并利用Image-Pro6.0Microsoft软件测得密度。每组分析5只小鼠的移植肿瘤。每个肿瘤随机选择5个切片影像,以平均出每个肿瘤的灰阶值(Csilliketal,2005)。可使用CD31的免疫组织化学分析来鉴定微血管的密度,利用Image-Pro6.0Microsoft软件计数,并以平均值表示。图7显示对照组与实验组的微血管密度。由图7可知,本发明的序列(IL8-17LIP10)可有效地抑制小鼠体内前列腺癌的微血管新生。4.C57BL/6小鼠分析C57BL/6小鼠置于无菌操作房中。无菌操作房中具有充分的饮水与饲料,并每天监测小鼠。将LLW2细胞(Lewislungcarcinma)注射至3只裸鼠的右腹部,每只裸鼠注射5x106的细胞。培养2-4周后,采取肿瘤以供移植。总共有24只小鼠接受肿瘤的移植。移植后第5天,将动物分为4组(每组6只),A组每个礼拜注射4次IL8-IP10500ug/kg,B组每个礼拜注射2次IL8-IP10500ug/kg,C组每个礼拜注射2次IL8-IP10250ug/kg,D组每天皮下注射100μl的食盐水。肿瘤体积的计算方式如下:肿瘤体积=(长度x宽2)/2。长度及宽度利用Image-Pro6.0Microsoft测量。在第24天时,将所有小鼠牺牲(处死),并取得肿瘤GFP荧光影像。微血管密度的计算方式如下:密度=微血管长度/肿瘤体积。肿瘤样本以4%甲醛固定后,包埋于石蜡中,以供后续的免疫组织化学分析。图8显示A组抑制肿瘤体积的效果最佳。第24天时,将所有小鼠牺牲前,所量测的肿瘤大小,发现A组每个礼拜注射4次CXCL8-IP10500ug/kg的老鼠肿瘤体积比D组对照组间的肿瘤小了30%.结果显示CXCL8-IP10对控制肿瘤发展有显著的效果。图9为牺牲后的小鼠肺脏肿瘤组织,而由A图可得知肿 瘤的远程转移已被CXCL8-IP10明显抑制。图9中的A为每个礼拜注射4次CXCL8-IP10500ug/kg的老鼠在第24天牺牲后,取出的肺脏;图B为施打生理食盐水的老鼠肺脏,其中箭头所指的白色肿瘤部位为转移到肺部所产生病灶。经过CXCL8-IP10投药的老鼠肺部则非常干净,并没有肺部转移病灶的出现。5.嗜中性白血球趋化性分析嗜中性白血球趋化性是藉由改良后的Boydenchambermicrochemotaxisassays来评估。白血球是由人类外围血液经由一般浓度梯度分离而取得,而嗜中性白血球是由浓度低梯分离的底部取得并利用hypotoniclysis清除污染的红血球细胞。將纯化后的5x106/ml之嗜中性白血球悬浮于HBSS(400mg/L氯化钾(KCl),60mg/L磷酸氢钾(KH2PO4),8000mg/L氯化钠(NaCl),350mg/L碳酸氢钠(NaHCO3),90mg/L磷酸氢钠(NaH2PO4·7H2O),1000mg/L葡萄糖(glucose),以及0.5%pH7.4牛胎盘血清(fetalcalfserum;pH7.4),之后嗜中性白血球以CalceinAM(Invitrogen,Stockholm,Sweden)培养30分钟,培养温度为37℃。趋化因子(例如:CXCL820ng/mL)单独或与其他结抗剂结合(IL8-IP10F17L,etc.)放置于Boydenchamber的培养区底部而纯化后的嗜中性白血球置于培养槽上端,而培养槽的上端与底部是由孔径5μm的聚碳酸 酯滤膜(pore-sizepolycarbonatefilters)所隔开。于37℃及5%二氧化碳(CO2)中培养30分钟之后移除未移动的细胞及滤膜,并将移动的细胞打破并以VICTOR3(Perkin-Elmer,UK,excitation:485nm;emission:530nm)分析,移动的细胞百分比以趋化指数(ChemotaxisIndex(CI)value)表示:CI=(intensityantagonist-intensityHBSS)/(intensityCXCL8-intensityHBSS)X100%其中,intensityantagonist是指同时加入本发明所叙的具有拮抗作用的蛋白和CXCL8所产生细胞移动;intensityCXCL8是指细胞仅经由CXCL8刺激而移动,而intensityHBSS是指细胞的移动是由重力所造成。6.RT-PCR分析各肿瘤细胞中CXCR1/2及CXCL8的基因表现量。本实验的各癌症细胞株的RNA均藉由TRIzolreagent(Invitrogen,America)及其操作说明萃取而得,其中大部分的RNA的定量是使用ND-1000spectrophotometer。于逆转录反应过程,样本是使用cDNAreverse-transcriptionkit(PrimeScriptTMRTreagentkit,Takara,Japan)进行培养,并于基因表现分析前置于冰上。GAPDH为内部控制组。RT-PCR的反应是藉由SYBR (PremixExTaqTM,Takara,Japan)所完成,其CXCL引物为以下所述:5′-gagcactccataaggcacaaa-3′(forward)and5′-atggttccttccggtggt-3′(reverse)forCXCL8;5′-gaccaacatcgcagacacat-3′(forward)and5′-tgcttgtctcgttccacttg-3′(reverse)forCXCR1;5′-ggctaagcaaaatgtgatatgtacc-3′(forward)and5′-caaggttcgtccgtgttgta-3′(reverse)forCXCR2。基因表现的计算方法如算式所表现geneexpression=2-ΔΔCt表一、肿瘤细胞株HCC827lungadenocarcinomaHCC827GRHCC827gefitinib-resistantH1975lungadenocarcinomaH2170lungsquamouscellcarcinomaH157oralsquamouscellcarcinomaCT26coloncarcinomacellCL1-0lungadenocarcinomaCL1-5lungadenocarcinomaPC9lungadenocarcinomaH3255NonsmallcelllungcarcinomaA549lungadenocarcinomaH520lungsquamouscellcarcinomaH460Nonsmallcelllungcarcinoma图10显示利用RT-PCR侦测到部分肿瘤细胞对于趋化素受体CXCR1具有高度的表达,此外许多的肿瘤细胞会表达高量的CXCR1/2等两类受体的受质CXCL8,因此可以利用CXCR1/2受体拮抗剂来达到阻止肿瘤细胞生长和转移的目的。图11显示更多的结抗剂设计,在先前揭露的CXCL8–IP10中增加了第12号或/和第13号或/和第17号氨基酸的变异,可以增强对于其受体CXCR1/2所引发生理反应的结抗作用,有效达到降低因为肿瘤细胞所表达CXCR1/2受体,或是因为肿瘤细胞高量表达其受体对应受质细胞激素(CXCL1,2,3,5,6,7,8等)所伴随引发肿瘤增生,抗药性,转移和血管新生的抑制作用.由此可知,由于本发明趋化素胜肽可有效地抑制肿瘤生长、血管新生,以及治疗癌症。所有说明书中所揭示的发明技术特点可以任意方式组合。说明书中揭示的每一技术特点可以提供相同、等同或相似目的的其他方式替换。因此,除非另有特别说明,文中所有揭示的特点均只是等同或相似特点的一般系列的实例。由上述可知,熟习此技艺者能轻易地了解本发明的必要特征,在不脱离其精神与范围之下能就本发明做许多改变与调整以应用于不同用途与条件。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1