戊二酸生物改进合成方法与流程
本发明涉及的是一种新的戊二酸合成途径、即经过2‐羟基戊二酸脱氢酶、戊烯二酸辅酶A转移酶、2‐羟基戊二酰辅酶脱水酶、烯酰辅酶A还原酶及酰基辅酶A硫酯酶的催化,将细胞内三羧酸循环的中间物α‐酮戊二酸转化成戊二酸,从而实现利用葡萄糖或者其它碳源发酵生产戊二酸的目的。具体涉及到编码这几种酶的基因的克隆、协同表达,以及重组大肠杆菌利用这些酶的催化功能发酵生产戊二酸的应用。
背景技术:
戊二酸是一种重要的化工原料,它可与不同长度碳链的二胺聚合成聚酰胺。作为工程塑料,聚酰胺具有优良的性能,被广泛应用于各个行业及领域。戊二酸作为聚酰胺的单体,具有很大的市场需求。工业上戊二酸主要从石油中加工提炼得到,以裂解碳五馏分中的环戊二烯为原料,部分加氢制成环戊烯,然后催化氧化环戊烯制备戊二酸(陈慧等人,石油化工,2006,35(2):118‐121)。但是由于石油资源的日益紧缺,人们希望开发出更多的利用可再生资源生产戊二酸的方法。
Adkins等人报导了通过偶联赖氨酸合成及降解途径在大肠杆菌中利用葡萄糖生产戊二酸的方法,利用该途径,他们目前报道的产量及得率分别为0.82±0.03g/L、68±2mmol/mol(Adkins等人,Biotechnol Bioeng,2013,110(6):1726‐1734)。此外,Djurdjevic等人报道了通过α‐酮戊二酸的还原途径生产戊烯二酸的方法。这个途径首先通过α‐羟基戊二酸脱氢酶HgdH将α‐酮戊二酸转化为2‐羟基戊二酸;戊烯二酸辅酶A转移酶GctAB将2‐羟基戊二酸转化为2‐羟基戊二酰辅酶A;另外,从共生梭菌(Clostridium symbiosum)中得到2‐羟基戊二酰辅酶A脱水酶HgdAB,从发酵氨基酸球菌(Acidaminococcus fermentans)中得到该脱水酶的激活因子HgdC,HgdABC可以将2‐羟基戊二酰辅酶A转化为戊烯二酰辅酶A。最后再通过戊烯二酸辅酶A转移酶GctAB将戊烯二酰辅酶A催化成为戊烯二酸(Djurdjevic等人,Appl Environ Microbiol,2011,77(1):320‐322)。戊烯二酸在α和β位不饱和,在工业上可被进一步利用化学催化的方法还原成戊二酸,但目前尚未有在细胞内直接将戊烯二酸转化成戊二酸的方法。另一方面,利用赖氨酸作为底物合成戊二酸时,每摩尔底物会释放一摩尔的二氧化碳,这样损失了对碳(糖)得率,而当α-酮戊二酸作为底物时则不会放出二氧化碳。因此α-酮戊二酸途径在理论上对糖得率更具优势。
在之前的研究中发现,一种来源于眼虫藻Euglena gracilis的反‐2‐烯酰辅酶A还原酶Ter 可催化2,3‐烯己二酰辅酶A还原成己二酰辅酶A(Yu等人,Biotechnol Bioeng,2014,111(12):2580‐2586)。而戊二酸合成的前体2,3‐烯戊二酰辅酶A与2,3‐烯己二酰辅酶A结构类似,因此推测反‐2‐烯酰辅酶A还原酶Ter对其可能也具有催化活性。
技术实现要素:
本发明针对现有技术存在的上述不足,提出一种戊二酸生物改进合成方法,通过表达反‐2‐烯酰辅酶A还原酶Ter,可以实现从α‐酮戊二酸到戊二酸的转化。
本发明是通过以下技术方案实现的:
本发明涉及一种戊二酸生物改进合成方法,首先将编码α‐羟基戊二酸脱氢酶的hgdH、编码戊烯二酸辅酶A转移酶的gctAB、编码2‐羟基戊二酰辅酶A脱水酶的hgdABC、编码烯酰辅酶A还原酶的ter或编码酰基辅酶A硫酯酶中的至少一种或与其至少50%相似的同源序列中的至少一种在重组微生物内进行表达,然后将重组微生物培养并发酵得到戊二酸。
所述的表达,具体步骤包括:
1)将编码α‐羟基戊二酸脱氢酶的hgdH、编码戊烯二酸辅酶A转移酶的gctAB、编码2‐羟基戊二酰辅酶A脱水酶的hgdABC、编码烯酰辅酶A还原酶的ter或编码酰基辅酶A硫酯酶的tesB中的至少一种或与其至少50%相似的同源序列中的至少一种采用基于表达质粒的异源表达方式引入微生物宿主内实现自我复制,即设计引物序列,以相应菌株全基因组序列或全基因合成DNA为模板进行扩增,用内切酶酶切并连接到经同样内切酶酶切的表达质粒载体上;
2)给予对应的启动子使得外源基因启动转录过程。
所述的表达质粒为pTrc15C’及pZS*27MCS,其中:egter基因、hgdH基因、gctA基因和gctB基因在pTrc15C’质粒表达,hgdA基因、hgdB基因、hgdC基因和tesB基因在pZS*27MCS质粒表达。
所述的微生物宿主包括作为表达宿主的大肠杆菌E.coli MG1655和作为克隆宿主的大肠杆菌E.coli DH5α。
所述的重组微生物是指:E.coli MG1655重组大肠杆菌,其中同时带有pTrc15C’‐egTer‐HgdH‐GctAB质粒和pZS*27‐HgdABC‐TesB质粒。
所述的培养,首先经过LB培养基活化,然后以初始接种量为OD600=0.1接入到补充Stand I培养基中,待细胞37℃培养至OD约为1.0时,加入100μM IPTG于30℃继续培养数天。
所述的补充Stand I培养基,具体为pH 7.4的补充Stand I培养基,其组分及含量为:15g/L牛肉蛋白胨,3g/L酵母提取物,50mM 3‐(N‐吗啡啉)丙磺酸,3mM L‐半胱氨酸,10mM谷氨酸钠,0.2mM核黄素,2mM柠檬酸铁。
所述的培养,包括但不限于好氧、微氧以及厌氧培养。
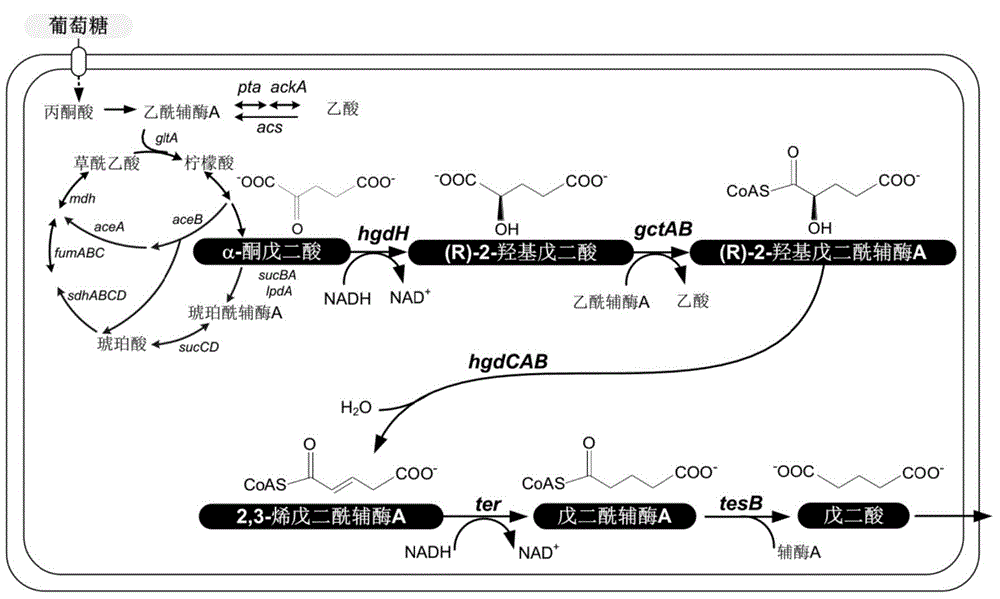
所述的发酵是指:当重组大肠杆菌在摄入营养物后,通过细胞内源的糖酵解途径以及部分三羧酸循环途径将营养物转化成α‐酮戊二酸,然后依次经:
①通过重组微生物内进行表达的α‐羟基戊二酸脱氢酶HgdH的催化作用下,α‐酮戊二酸转化为2‐羟基戊二酸;
②通过重组微生物进行表达的戊烯二酸辅酶A转移酶GctAB的催化作用下,2‐羟基戊二酸转化为2‐羟基戊二酰辅酶A;
③通过重组微生物进行表达的2‐羟基戊二酰辅酶A脱水酶HgdABC的催化作用下,2‐羟基戊二酰辅酶A转化为2,3‐烯戊二酰辅酶A;
④通过重组微生物进行表达的烯酰辅酶A还原酶Ter的催化作用下,一部分2,3‐烯戊二酰辅酶A转化为戊二酰辅酶A,其余2,3‐烯戊二酰辅酶A通过重组微生物进行表达的戊烯二酸辅酶A转移酶GctAB的催化作用下转化额外2,3‐烯‐戊二酸;
⑤戊二酰辅酶A通过重组微生物进行表达的酰基辅酶A硫酯酶的经过催化水解转化为戊二酸。
所述的营养物包括但不限于葡萄糖。
所述的酰基辅酶A硫酯酶包括:通过重组微生物进行表达的酰基辅酶A硫酯酶TesB、酰基辅酶A硫酯酶YciA、酰基辅酶A硫酯酶TesA、酰基辅酶A硫酯酶AcoT7,其氨基酸序列依次如Seq ID No.8~11所示。
技术效果
与现有技术相比,本发明本发明通过在大肠杆菌中以质粒的形式外源表达基于α‐酮戊二酸的戊二酸合成途径,包括2‐羟基戊二酸脱氢酶,戊烯二酸辅酶A转移酶,2‐羟基戊二酰辅酶脱水酶,脱水酶激活因子,反‐2‐烯酰辅酶A还原酶以及酰基辅酶A硫酯酶,使大肠杆菌成功发酵生产戊二酸。为利用可再生资源合成戊二酸提出了新的途径与方法。为今后进一步大规模生产戊二酸提供了潜力。
附图说明
图1为戊二酸合成途径示意图;
图中:hgdH表示2‐羟基戊二酸脱氢酶的编码基因,gctAB表示戊烯二酸辅酶A转移酶的编码基因,hgdCAB表示2‐羟基戊二酰辅酶脱水酶的编码基因,ter表示反‐2‐烯酰辅酶A还原酶的编码基因,tesB表示酰基辅酶A硫酯酶的编码基因。
图2为戊二酸合成途径中所涉及的质粒图谱;
其中:图2a为质粒pTrc15C’‐egTer‐HgdH‐GctAB的图谱,图2b为质粒 pZS*27‐HgdABC‐TesB的图谱。
图3为重组大肠杆菌发酵液上清中第48小时终产物以及中间代谢物的产量,其中每组样品均有3个平行样。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
本实施例中生物合成途径的构建是基于表达质粒的异源表达方式,所采用的菌株、质粒、酶与培养基等包括:表达质粒为pTrc15C’‐egTer‐HgdH‐GctAB及pZS*27‐HgdABC‐TesB;表达宿主为大肠杆菌E.coli MG1655;克隆宿主为大肠杆菌E.coli DH5α;基因操作工具包括:限制性内切酶、DNA聚合酶、T4DNA连接酶;LB培养基:每升含胰蛋白胨10g,酵母提取物5g,氯化钠10g,氯霉素浓度为50mg/L,卡那霉素浓度为50mg/L,其具体步骤包括:
1)PCR扩增及重组质粒的构建:设计引物序列,以相应菌株全基因组序列或全基因合成DNA为模板进行扩增,用内切酶酶切并连接到经同样内切酶酶切的表达质粒载体上,其中:egter,hgdH,gctA和gctB在pTrc15C’质粒表达,hgdA,hgdB,hgdC和tesB在pZS*27MCS质粒表达,分别如图2a和图2b所示。
2)将表达质粒载体转入大肠杆菌E.coli DH5α,筛选重组质粒,并进行测序验证,其中:hgdH是来源于Acidaminococcus Fermentans的2‐羟基戊二酸脱氢酶编码基因,hgdA和hgdB是来源于Clostridium symbiosum的2‐羟基戊二酰辅酶脱水酶的两个亚基编码基因,hgdC是来源于Acidaminococcus Fermentans的脱水酶激活因子编码基因,gctA和gctB是来源于Acidaminococcus Fermentans的戊烯二酸辅酶A转移酶的两个亚基编码基因,egter是来源于Euglena gracilis的反‐2‐烯酰辅酶A还原酶编码基因,tesB是来源于Escherichia coli MG1655的酰基辅酶A硫酯酶编码基因,其氨基酸序列依次如Seq ID No.1~8所示。
所述的引物序列如下:
egter‐上游引物,如Seq ID No.12所示,具体为:5’‐tctgccatggcgcatatggcgatgtttaccacgaccgc‐3’
egter‐下游引物,如Seq ID No.13所示,具体为:5’‐atctggtaccttattgctgcgcggcgctcg‐3’
hgdH‐上游引物,如Seq ID No.14所示,具体为:5’‐atctggtaccattacaggagaagcctgatgaaagtgctgtgctacgg‐3’
hgdH‐下游引物,如Seq ID No.15所示,具体为:5’‐cgtcggatccgtctgcggccgcttatttaattttattaggac‐3’
gctAB-上游引物,如Seq ID No.16所示,具体为: 5’‐actcggatccattacaggagaagcctgatgagcaaagttatgaccc‐3’
gctAB-下游引物,如Seq ID No.17所示,具体为:5’‐gtggaagcttttatttggcttctgtcggca‐3’
hgdAB-上游引物,如Seq ID No.18所示,具体为:5’‐attcggtaccatggccaaacaggtgagtcc‐3’
hgdAB-下游引物,如Seq ID No.19所示,具体为:5’‐gcgtgaattcttatttctgcatttccagca‐3’
hgdC‐上游引物,如Seq ID No.20所示,具体为:5’‐gtgagaattcattacaggagaagcctgatgagcatttataccctggg‐3’
hgdC‐下游引物,如Seq ID No.21所示,具体为:5’‐atgtggatccacgcgtattgtcgacttatttggcggcttttttgt‐3’
tesB‐上游引物,如Seq ID No.22所示,具体为:5’‐attagtcgacattacaggagaagcctgatgagtcaggcgctaaaaaa‐3’
tesB‐下游引物,如Seq ID No.23所示,具体为:5’‐ctcgctacgcgtttaattgtgattacgcatca‐3’
其中划线部分是相应的酶切位点。
质粒pTrc15C’‐egTer‐HgdH‐GctAB在egter基因上游带有Ptrc启动子,可通过加入IPTG诱导启动转录表达。质粒pZS*27‐HgdABC‐TesB在hgdABC基因上游带有lacIQ基因的启动子,该启动子无需诱导随时自发启动转录表达。
3)将上述构建的质粒pTrc15C’‐egTer‐HgdH‐GctAB连同pZS*27‐HgdABC‐TesB一同转化至E.coli MG1655感受态细胞,经过筛选和活化得到用于发酵生产的菌株,即同时带有上述这2种质粒的重组大肠杆菌,即E.coli MG1655重组大肠杆菌。
实施例2
利用重组菌株发酵生产戊二酸
菌株与培养条件:
所述的E.coli MG1655重组大肠杆菌采用的培养基为发酵培养基,具体为pH 7.4的补充Stand I培养基,其组分及含量为:15g/L牛肉蛋白胨,3g/L酵母提取物,50mM 3‐(N‐吗啡啉)丙磺酸,3mM L‐半胱氨酸,10mM谷氨酸钠,0.2mM核黄素,2mM柠檬酸铁。
所述的E.coli MG1655重组大肠杆菌首先经过LB培养基活化,然后以初始接种量为OD600=0.1接入到补充Stand I培养基中,待细胞37℃培养至OD600约为1.0时,加入100μM IPTG于30℃继续培养数天。
在上述培养过程中,针对氧气供应的差别,分为好氧,微氧以及厌氧培养。在好氧条件下,细胞在装液量为20ml的100ml摇瓶中培养,瓶口覆盖8层纱布,摇瓶中的细胞可以正常与空气交换。在微氧条件下,细胞在装液量为20ml的100ml特制摇瓶中培养,摇瓶在细胞接种后被完全密封,无法与外界空气发生交换细胞仅能利用瓶中原本存在的少量氧气。在厌氧条件下,细胞培养在严格的无氧环境下进行,即所有操作都在厌氧工作站中进行。
产物提取及定量测定
发酵液上清首先经过2M HCl(1%,v/v)酸化,然后通过5倍体积的乙酸乙酯萃取2次,经过浓缩,溶于1倍体积乙酸乙酯,加入1/2体积的BSTFA衍生化试剂,60℃反应30分钟后进行三重四极杆气质联用检测。其中:气相色谱的型号为Thermo ScientificTM TRACETM 1310,配备TR‐5MS气相色谱柱。质谱型号为TSQ8000。
通过对戊二酸标品作定量标准曲线,检测样品158/115(m/z)特征碎片离子的信号强度,最终可在重组大肠杆菌的发酵液中检测到最高1.39±0.44mg/L戊二酸,如图3所示,而未导入相应途径的野生大肠杆菌的发酵液中仅检测到0.07±0.01mg/L戊二酸。从结果可以看到,经过表达戊二酸合成途径上的多步酶,使得重组大肠杆菌获得了合成戊二酸的能力。同时发酵过程中供氧的因素会一定程度上影响该菌株戊二酸合成的能力。
另外,重组大肠杆菌在生产戊二酸的同时,也会积累所设计的途径中涉及到的中间代谢物,如图3所示。可以注意到,虽然戊二酸最终的产量仍比较低,但是2‐羟基戊二酸的大量积累已经暗示了这个途径目前的瓶颈所在以及进一步改进的潜力。
实施例3
不同硫酯酶对戊二酰辅酶A的水解催化能力。
在实施例2中,最后一步反应即戊二酰辅酶A水解成戊二酸是由大肠杆菌的硫酯酶TesB负责催化。TesB在大肠杆菌中原本催化的是中短链脂肪酰辅酶A的水解,但同时它也对一些其它的底物,包括戊二酰辅酶A具有活性。另一方面,生物体内具有多种不同的硫酯酶,它们的底物选择性以及活性各有差异。因此有必要筛选对戊二酰辅酶A水解具有更高活性的酶。
菌株与培养条件:
本实施例中的酶通过外源表达纯化得到。蛋白质外源表达宿主为E.coli BL21(DE3),表达载体为pET‐28a(+),需要表达的基因通过限制性内切酶酶切插入到表达载体中进行表达。具体分子生物学操作以及菌株培养同实施例1。
酶的表达、提取及纯化:
将带有相应表达载体的E.coli BL21(DE3)首先经过LB培养基活化,然后以初始接种量为OD600=0.1接入到新鲜LB培养基中,待细胞37℃培养至OD约为0.4时,加入400μM IPTG于30℃继续培养12h。
收集培养后的菌液,在4℃,10000g的条件下离心收集菌体沉淀。然后用1/5体积的重悬缓冲液(100mM Tris‐HCl,200mM NaCl,10mM咪唑,0.5mM二硫苏糖醇,pH 7.4)进行重悬。重悬液经过超声破碎裂解细胞,再由4℃,10000g离心收集上清粗酶液。
酶的纯化通过组氨酸标签镍柱亲和层析进行。将上述粗酶液上样结合HisTrap‐FF亲和 层析住,洗去杂蛋白后通过洗脱缓冲液(100mM Tris‐HCl,200mM NaCl,200mM咪唑,0.5mM二硫苏糖醇,pH7.4)洗脱。洗脱下来的蛋白再通过透析,超滤浓缩,最终保存在Tris缓冲液中(100mM Tris‐HCl,0.5mM二硫苏糖醇,pH7.4)。
硫酯酶酶活测定:
硫酯酶在催化酰基辅酶A水解后会释放出游离的辅酶A(CoA‐SH),游离的辅酶A由于含有游离巯基,会与5,5'‐二硫代双(2‐硝基苯甲酸)(DTNB)发生反应,生成的黄色物质在412nm波长下有明显的吸收,摩尔吸光系数为ε412=13600M‐1cm‐1.
首先将0.1mM DTNB,100mM磷酸钠缓冲液(pH 7.4)和一定量的酶溶液在30℃下孵育1.5分钟,之后加入底物戊二酰辅酶A在30℃下监测412nm波长吸收光的变化。根据吸收光的变化、摩尔吸光系数以及蛋白浓度计算出酶的最大反应速率。再通过不同底物浓度下的最大反应速率通过双倒数作图得到该酶对戊二酰辅酶A的米氏常数。
如表1所示,除了TesB可以催化戊二酰辅酶A的水解之外,一些其它的硫酯酶同样可以催化该反应,一些硫酯酶较TesB具有更高的活性。其中,TesA和YciA是来源于Escherichia coli K12的另外两种酰基辅酶A硫酯酶。AcoT7是来源于小鼠b16的硫酯酶。这些酶都可以应用于该戊二酸合成途径。
表1为不同硫酯酶对于戊二酰辅酶A的动力学参数。
戊二酰辅酶A
- 还没有人留言评论。精彩留言会获得点赞!