一种磷酸左奥硝唑酯二钠晶型及其制备方法和药用组合物的用途与流程
本发明属于化学药物结晶技术领域,特别涉及一种磷酸左奥硝唑酯二钠晶型及其制备方法。本发明还涉及一种磷酸左奥硝唑酯二钠的晶型在药物组合物中的应用以及该晶型和组合物在治疗厌氧菌感染、原虫感染和各种其他疾病中的应用。
背景技术:
奥硝唑为硝基咪唑类衍生物,是一种强力抗厌氧菌及抗原虫感染的药物,也是继甲硝唑后新研制制成的疗效更高、疗程更短、耐受性更好、体内分布更广的第三代硝基咪唑类衍生物。
在对奥硝唑的进一步研究中,人们发现,奥硝唑使用后,会产生一定程度的中枢毒性,而其单一的左旋对映体中枢毒性要远远低于其消旋体,这为奥硝唑的研究指引了一个新的方向。左旋奥硝唑及其衍生物的研究成为一个新的热点。
磷酸左奥硝唑酯二钠为左旋奥硝唑的前体药物,给药后在体内磷脂酶作用下可降解为左旋奥硝唑发挥药效。中国专利CN100451023C中提到了一种左旋奥硝唑磷酸酯及其制备方法和用途。专利CN101177433中提及了一种左旋奥硝唑磷酸二钠水合物及其制备方法和用途。对于磷酸左奥硝唑酯二钠的晶型没有相关文献报道,对于药品而言,不同的晶型可能存在不同的理化性质,如溶解度、熔点、稳定性等,这些性质直接会影响药物制剂的稳定性、溶解性,甚至影响最重的临床疗效。
因此,对磷酸左奥硝唑酯二钠的晶型制备和研究是非常有意义的,故我们对磷酸左奥硝唑酯二钠的晶型进行研究。
磷酸左奥硝唑酯二钠,中文化学名为-3-氯-1-(2-甲基-5-硝基-1H-咪唑-1-基) 丙烷-2-基磷酸酯钠,分子式为C7H9ClN3Na2O6P,分子量约为342.97,磷酸左奥硝唑酯二钠结构式如下:
n可代表1~7。
技术实现要素:
本发明的目的在于提供一种磷酸左奥硝唑酯二钠的晶型。
本发明提供了磷酸左奥硝唑酯二钠的晶型1,所述的晶型1的X射线粉末衍射图特征峰如下:
本发明提供了磷酸左奥硝唑酯二钠的晶型2,所述的晶型2的X射线粉末衍射图特征峰如下:
本发明提供了磷酸左奥硝唑酯二钠的晶型3,所述的晶型3的X射线粉末衍射图特征峰如下:
本发明提供了磷酸左奥硝唑酯二钠的晶型4,所述的晶型4的X射线粉末衍射图特征峰如下:
在有机化合物晶体领域,XRPD图谱分析是对晶体进行定性分析的常用方法,然而XRPD图谱中提供的信息量大,可能还会包括杂质峰等干扰信息。因此,为了准确鉴别晶体,本发明在XRPD图谱中选取了数个具有代表性的峰作为特征峰用以表征本发明的晶体结构。
本发明在选择特征峰时综合考虑了d值、低角度、强度、特征线及峰形完整等多方面因素。本发明最优选的特征峰不仅属于图谱中相对低角度的峰(2θ小于40°且涵盖了大部分特征峰),同时,本发明选择的吸收峰具有完整且明显的峰形、强度相对较高,非常易于作为特征峰被区别、鉴定。而X射线粉末衍射图中的其他峰,峰形不佳,峰强度极低,其中可能会包括杂质峰干扰信息,因此本发明中未将其作为本晶型的特征峰专名列出。
本发明X射线粉末衍射采用Cu Kα 辐射源。
本发明所述晶型1的X射线粉末衍射如图1所示。
本发明所述晶型2的X射线粉末衍射如图2所示。
本发明所述晶型3的X射线粉末衍射如图3所示。
本发明所述晶型4的X射线粉末衍射如图4所示。
本发明第二个方面,提供了磷酸左奥硝唑酯二钠的晶型的制备方法,它包括如下制备方法:
制备方法1:取磷酸左奥硝唑酯二钠,加入水溶解后,再加入活性炭脱色,过滤,滤液置-5~40℃,搅拌慢慢滴加乙醇至固体析出,过滤,20~40℃干燥,得左旋磷酸左奥硝唑酯二钠晶型1。
制备方法2:取磷酸左奥硝唑酯二钠,加入甲醇水体系溶液溶解后,再加入活性炭脱色,过滤,滤液置-5~40℃,搅拌慢慢滴加乙醇至固体析出,过滤,20~40℃干燥,得左旋磷酸左奥硝唑酯二钠晶型2。
制备方法3:取磷酸左奥硝唑酯二钠,加入醇/水体系溶剂,加热溶解后,再加入活性炭脱色,过滤,滤液搅拌或静置自然冷却至室温,再于-5~40℃条件下搅拌或静置,过滤,20~40℃干燥,得左旋磷酸左奥硝唑酯二钠晶型3。
制备方法4:取磷酸左奥硝唑酯二钠,加入水溶解后,再加入活性炭脱色,过滤,滤液搅置-5~40℃,拌慢慢滴加甲醇至固体析出,过滤,20~40℃干燥,得左旋磷酸左奥硝唑酯二钠晶型4。
其中制备方法1中,所述的水使用的倍量为磷酸左奥硝唑酯二钠0.1~20倍量;所述的乙醇使用的倍量为磷酸左奥硝唑酯二钠1~100倍量。
其中制备方法2中,所述的甲醇水溶液中甲醇所占的比例为0.1~95%,甲醇水溶液使用的倍量为磷酸左奥硝唑酯二钠1~100倍量;乙醇使用的倍量为磷酸左奥硝唑酯二钠1~500倍量。
其中制备方法3中,所述的醇/水体系中醇所占的比例为0.1~95%,醇/水体系使用的倍量为磷酸左奥硝唑酯二钠的1~100倍量, 加热溶解温度为20℃~80℃。
其中制备方法3中,所述的醇为甲醇、乙醇、正丙醇、异丙醇、正丁醇。
其中制备方法4中,所述的水使用的倍量为磷酸左奥硝唑酯二钠0.1~20倍量;甲醇使用的倍量为磷酸左奥硝唑酯二钠1~100倍量。
本发明提供的磷酸左奥硝唑酯二钠的晶型的制备方法简便,易于工业应用,并可用在磷酸左奥硝唑酯二钠原料药制备过程中严格控制多晶型的方法。
本发明得到的磷酸左奥硝唑酯二钠晶型1、2、3、4,纯度高,晶型稳定且重现性好,稳定性高。
本发明第三个方面,提供了一种药物组合物,包括根据本发明的前述任一方面的磷酸左奥硝唑酯二钠的晶型。该组合物进一步包括一种或多种药学上可接受的载体、赋形剂或稀释剂。
该组合物可用于口服或非肠胃给药,口服给药的组合物包括普通片剂、分散片、缓释片、控释片、胶囊。非肠胃给药的组合物包括无菌溶液或注射用无菌粉末形式、或适合用于制备非肠胃给药的无菌溶液或注射用无菌粉末形式的组合物。该组合物是包括含根据本发明的磷酸左奥硝唑酯二钠的单位剂量,其量为1mg到1000mg。
含磷酸左奥硝唑酯二钠晶型的药物组合物被应用于治疗由脆弱拟杆菌、狄氏拟杆菌、卵园拟杆菌、多形拟杆菌、普通拟杆菌、梭状芽胞杆菌、真杆菌、消化球菌和消化链球菌、幽门螺杆菌、黑色素拟杆菌、梭杆菌、CO2噬织维菌、牙龈类杆菌等敏感厌氧菌所引起的多种感染性疾病。
附图说明
附图1为本发明磷酸左奥硝唑酯二钠晶型1的X射线粉末衍射图谱;
附图2为本发明磷酸左奥硝唑酯二钠晶型2的X射线粉末衍射图谱;
附图3为本发明磷酸左奥硝唑酯二钠晶型3的X射线粉末衍射图谱;
附图4为本发明磷酸左奥硝唑酯二钠晶型4的X射线粉末衍射图谱;
附图5为左奥硝唑对拟杆菌的杀菌曲线;
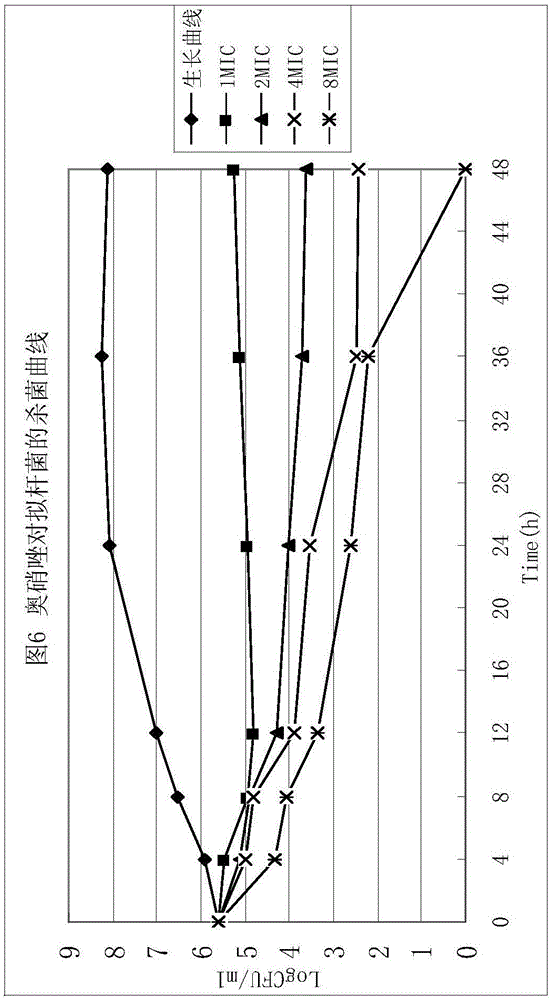
附图6为奥硝唑对拟杆菌的杀菌曲线;
附图7为左奥硝唑对消化链球菌的杀菌曲线;
附图8为奥硝唑对消化链球菌的杀菌曲线;
具体实施方式
下面结合实施例对本发明作进一步详细说明,但应理解本发明的范围非仅限于这些实施例的范围。
实施例1:磷酸左奥硝唑酯二钠晶型1的制备
取磷酸左奥硝唑酯二钠10g,加入水60ml,搅拌至溶解,再加入0.6g活性炭,搅拌30分钟过滤,滤液置10℃,搅拌慢慢滴加乙醇180ml至固体析出,过滤,30℃干燥,即得8.9g磷酸左奥硝唑酯二钠晶型1,收率为89.0%。
实施例2:磷酸左奥硝唑酯二钠晶型2的制备
取磷酸左奥硝唑酯二钠10g,加入50ml 90%甲醇溶解后,再加入1.0活性炭脱色,搅拌60分钟过滤,滤液置20℃,搅拌慢慢滴加乙醇500ml至固体析出,过滤,30℃干燥,得8.1g磷酸左奥硝唑酯二钠晶型2,收率为81.0%。
实施例3:磷酸左奥硝唑酯二钠晶型3的制备
取磷酸左奥硝唑酯二钠10g,加入90%乙醇水200ml,60℃加热搅拌至溶解,再加入0.5g活性炭,搅拌20分钟过滤,滤液静置析晶12小时,然后再放置0℃静置12小时,过滤,干燥,即得8.8g磷酸左奥硝唑酯二钠晶型3,收率为88.0%。
实施例4:磷酸左奥硝唑酯二钠晶型4的制备
取磷酸左奥硝唑酯二钠10g,加入水30ml,搅拌至溶解,再加入0.3g活性炭,搅拌10分钟过滤,滤液置15℃,搅拌慢慢滴加甲醇140ml至固体析出,过滤,30℃干燥,即得8.6g磷酸左奥硝唑酯二钠晶型4,收率为86.0%。
实施例5:磷酸左奥硝唑酯二钠晶型2的制备
取磷酸左奥硝唑酯二钠50g,加入50ml 50%甲醇溶解后,再加入0.5活性炭脱色,搅拌40分钟过滤,滤液置-5℃,搅拌慢慢滴加乙醇300ml至固体析出,过滤,30℃干燥,得9.2g磷酸左奥硝唑酯二钠晶型2,收率92.0%。
实施例6:磷酸左奥硝唑酯二钠晶型1的制备
取磷酸左奥硝唑酯二钠100g,加入水100ml,搅拌至溶解,再加入1g活性炭,搅拌60分钟过滤,滤液置-5℃,搅拌慢慢滴加乙醇3000ml至固体析出,过滤,20℃干燥,即得92.1g磷酸左奥硝唑酯二钠晶型1,收率为92.1%。
实施例7:磷酸左奥硝唑酯二钠晶型2的制备
取磷酸左奥硝唑酯二钠50g,加入300ml 90%甲醇溶解后,再加入5.0g活性炭脱色,搅拌60分钟过滤,滤液置40℃,搅拌慢慢滴加乙醇2500ml至固体析出,过滤,40℃干燥,得46.4g磷酸左奥硝唑酯二钠晶型2,收率为92.8%。
实施例8:磷酸左奥硝唑酯二钠晶型3的制备
取磷酸左奥硝唑酯二钠80g,加入90%乙醇水1200ml,80℃加热搅拌至溶解,再加入12g活性炭,搅拌10分钟过滤,滤液静置析晶12小时,然后再放置0℃静置12小时,过滤,干燥,即得67.9g磷酸左奥硝唑酯二钠晶型3,收率为84.8%。
实施例9:磷酸左奥硝唑酯二钠晶型4的制备
取磷酸左奥硝唑酯二钠50g,加入水50ml,搅拌至溶解,再加入1g活性炭,搅拌10分钟过滤,滤液置-5℃,搅拌慢慢滴加甲醇1000ml至固体析出,过滤,30℃干燥,即得45.2g磷酸左奥硝唑酯二钠晶型4,收率为90.4%。
实施例10:磷酸左奥硝唑酯二钠晶型2的制备
取磷酸左奥硝唑酯二钠100g,加入500ml 50%甲醇溶解后,再加入10g活性炭脱色,搅拌30分钟过滤,滤液置0℃,搅拌慢慢滴加乙醇4000ml至固体析出,过滤,30℃干燥,得93.2g磷酸左奥硝唑酯二钠晶型2,收率为93.2%。
实施例11:磷酸左奥硝唑酯二钠晶型1的制备
取磷酸左奥硝唑酯二钠50g,加入水200ml,搅拌至溶解,再加入3g活性炭,搅拌20分钟过滤,滤液置40℃,搅拌慢慢滴加乙醇5000ml至固体析出,过滤,30℃干燥,即得47.2g磷酸左奥硝唑酯二钠晶型1,收率为94.4%。
实施例12:磷酸左奥硝唑酯二钠晶型2的制备
取磷酸左奥硝唑酯二钠60g,加入1000ml 60%甲醇溶解后,再加入10g活性炭脱色,搅拌60分钟过滤,滤液置10℃,搅拌慢慢滴加乙醇4000ml至固体析出,过滤,20℃干燥,得51.3g磷酸左奥硝唑酯二钠晶型2,收率为85.5%。
实施例13:磷酸左奥硝唑酯二钠晶型3的制备
取磷酸左奥硝唑酯二钠50g,加入90%甲醇水1000ml,60℃加热搅拌至溶解,再加入8g活性炭,搅拌10分钟过滤,滤液静置析晶12小时,然后再放置0℃静置12小时,过滤,干燥,即得44.3g磷酸左奥硝唑酯二钠晶型3,收率为88.6%。
实施例14:左旋磷酸左奥硝唑酯二钠晶型4的制备
取磷酸左奥硝唑酯二钠50g,加入水120ml,搅拌至溶解,再加入3g活性炭,搅拌10分钟过滤,滤液置40℃,搅拌慢慢滴加甲醇1500ml至固体析出,过滤,20℃干燥,即得46.1g磷酸左奥硝唑酯二钠晶型4,收率为92.2%。
实施例15:磷酸左奥硝唑酯二钠晶型2的制备
取磷酸左奥硝唑酯二钠100g,加入800ml 80%甲醇溶解后,再加入15g活性炭脱色,搅拌30分钟过滤,滤液置10℃,搅拌慢慢滴加乙醇5000ml至固体析出,过滤,30℃干燥,得92.1g磷酸左奥硝唑酯二钠晶型2,收率为92.1%。
实施例16:磷酸左奥硝唑酯二钠晶型1、2、3、4与无定型磷酸左奥硝唑酯二钠稳定性比较
上述实施例制备的磷酸左奥硝唑酯二钠晶型1、2、3、4与无定型磷酸左奥硝唑酯二钠60℃放置10天稳定性比较结果如下:
色谱柱:C18柱 (250mm×4.6mm 5μm)
流动相:50mmol/l磷酸二氢钾(三乙胺调节pH=6.5):甲醇=75:25
柱温:25℃ 流速:0.5ml/min 检测波长:260
实施例17:磷酸左奥硝唑酯二钠晶型1、2、3、4体外药效试验与左旋奥硝唑、奥硝唑体外药效学试验对比结果
试验方法
一 最低抑菌浓度(MIC)的测定
采用琼脂平板稀释法测定最低抑菌浓度(MIC)。
1.含药平板的制备
1.1:精密称取试验药物适量,分别于无菌试管中用适量溶解后,无菌水稀释,各试管中药液的单位分别为1280、640、320、160、80、40、20、10、5、2.5、1.25、0.625、0.3125(mg/L)。放置于厌氧培养箱过夜备用。
1.2:厌氧培养箱系统内操作,取各浓度药液2ml,分别加入无菌平皿中,再加入融化并恒温于55℃的强化布氏琼脂培养基(临用前加5%脱纤维羊血)18ml,充分混匀,冷凝,放置于厌氧培养箱内24小时除氧后备用。各含药平板中药物的最终浓度依次为:128、64、32、16、8、4、2、1、0.5、0.25、0.125、0.0625、0.03125(mg/L)。
2.菌液制备及接种:
厌氧培养箱操作,取试验用厌氧菌株接种到强化布氏肉汤培养液(5ml)中,37℃厌氧培养36~48小时,再用预除氧的强化布氏肉汤适当稀释至约相当于0.5号麦氏比浊管浓度,菌液浓度约为108CFU/ml。加各菌悬液至96孔板相应位置,用多点接种仪点种各试验菌液于含药平板上,每点最终接种菌量约105CFU。37℃厌氧培养36~48小时,观察并记录各菌的MIC值,统计MIC50、MIC90,试验结果见表1。
二、最低杀菌浓度(MBC)的测定
1.采用试管稀释法测定MIC值
厌氧培养箱内操作,取各试验药物稀释液0.5ml与4.5ml强化布氏肉汤培养液混匀于无菌试管内,取上述制备的厌氧菌悬液稀释10倍后,吸取50μl加入,每管菌浓度约为105CFU/ml,37℃厌氧培养36小时。
2. 平板法测定MBC
将试管法测定MIC中无菌生长的各管培养物分别吸取0.1ml加入无菌平皿中,加入冷却至50℃左右的强化布氏琼脂培养基,迅速混匀。待凝固后,37℃厌氧培养36~48小时,取出观察结果。选择平板上生长菌落数小于5个的最小药物浓度记为MBC,结果见表2。
三、pH值变化对体外抗菌活性的影响
该试验方法与“体外测定MIC”的测定方法相同,但培养基选择三种不同的pH值(pH6、pH7、pH8)。目的是考察pH值的变化对左旋奥硝唑体外抗菌活性的影响,结果见表3。
四、接种量变化对体外抗菌活性的影响
采用“体外测定MIC”同样的方法进行试验,但接种量分别为103、105、107CFU/点,结果见表4。
五、血清结合蛋白试验
试验方法与MBC测定中试管双倍稀释法测定MIC相同,但培养基采用含不同浓度马血清的液体培养基进行测定,培养基中马血清浓度分别为25%、50%、75%。另设不含马血清的空白对照,试验结果见表5。
六、杀菌曲线(KCs)的测定
从MBC的测定菌中选择拟杆菌、消化链球菌各1株,进行杀菌效率测定。根据各试验菌株对磷酸左奥硝唑酯二钠的敏感性,选择1×MBC、2×MBC、4×MBC和8×MBC浓度,平行测定。分别于0、4、8、12、24、36、48小时取样进行平板活菌计数,用细菌菌数的对数与时间点绘制杀菌曲线,并以不含药组进行平行对照测定。结果见说明书附图5~8。
表1 222株厌氧菌的MIC(mg/L)测定结果
注:A:磷酸左奥硝唑酯二钠晶型1、2、3、4;
B:左旋奥硝唑;
C:奥硝唑;
表2 对30株临床分离菌的MBC(mg/L)测定结果
注:A:磷酸左奥硝唑酯二钠1、2、3、4;
B:左旋奥硝唑;
C:奥硝唑;
表3 细菌接种量变化对MIC(mg/L)影响测定结果
注:A:磷酸左奥硝唑酯二钠晶型1、2、3、4;
B:左旋奥硝唑;
C:奥硝唑;
表4 培养基pH变化变化对MIC(mg/L)影响测定结果
注:A:磷酸左奥硝唑酯二钠晶型1、2、3、4;
B:左旋奥硝唑;
C:奥硝唑;
表5 血清结合蛋白对MIC的影响结果(mg/L)
注:A:磷酸左奥硝唑酯二钠晶型1、2、3、4;
B:左旋奥硝唑;
C:奥硝唑。
- 还没有人留言评论。精彩留言会获得点赞!