一种用于蛋白质表达的信号肽的制作方法
本发明涉及生物
技术领域:
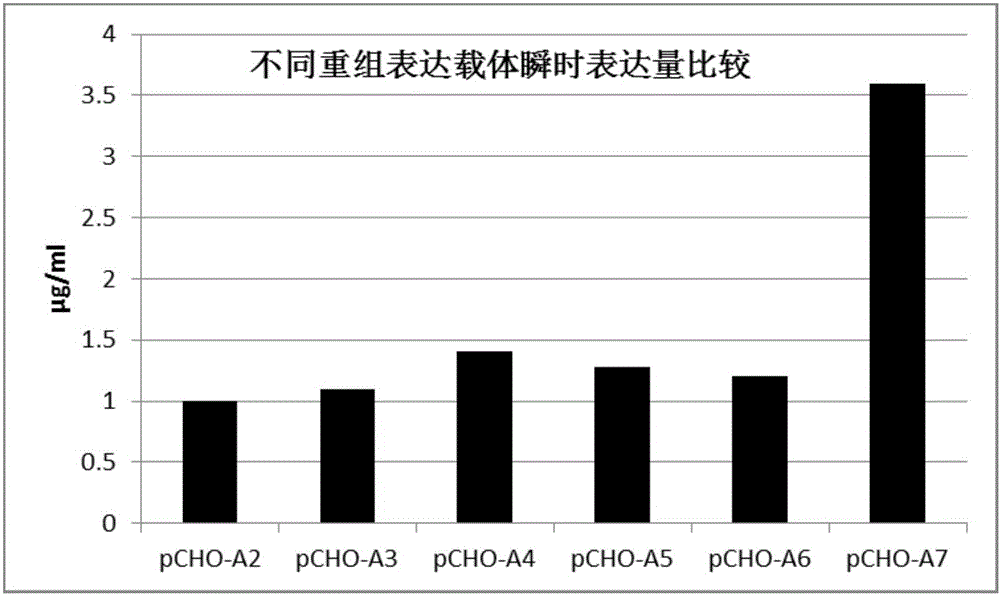
,具体涉及用于引导外源蛋白质(如抗体)在哺乳动物细胞中分泌表达的信号肽。技术背景2007年我国基因重组蛋白类药物取得较快发展,在基因组技术的上游阶段,利用大肠杆菌和毕赤酵母表达系统,结合新的融合蛋白载体的构建,有效的提高了现有重组蛋白药物的半衰期和可溶性等特性,为工业化制备提供了新的工艺,从而提高了重组蛋白的回收率;但在下游的分离纯化技术和哺乳细胞表达系统的表达和纯化能力方面仍存在较大不足。特别是现代生物医药的重要组成部分——抗体药物,由于抗体针对相应抗原具有高特异性和高亲和力的特性,使得其在疾病的诊断和治疗中显示出其他类型药物无可比拟的优势。抗体药物经历了鼠源抗体、嵌合抗体、人源化抗体和全人源抗体的发展历程,逐渐向低抗原性、高特异性方向发展。抗体制备方法经历了常规血清技术、杂交瘤技术、基因工程抗体技术及抗体库技术的不断发展,目前使用体外筛选技术与转基因动物筛选获得全人源抗体成为抗体研究的主要方向。利用哺乳动物细胞表达蛋白质(如抗体)成为蛋白类药物生产的主流,但哺乳动物细胞外源蛋白表达效率低,且成本高,因此提高哺乳动物细胞外源蛋白表达效率,降低生产成本是当前工作中的重中之重。工业上,蛋白质(如抗体)的表达水平受很多因素影响,如表达载体、宿主、培养基、培养工艺等。而表达载体的表达能力又受启动子、信号肽等因素影响,其中信号肽在蛋白质(如抗体)的分泌表达过程中扮演着至关重要的作用,直接影响分泌蛋白质的质量。信号肽位于分泌蛋白的N端。一般由15~30个氨基酸组成。包括三个区:一个带正电的N末端,称为碱性氨基末端;一个中间疏水序列,以中性氨基酸为主,能够形成一段α螺旋结构,它是信号肽的主要功能区;一个较长的带负电荷的C末端,含小分子氨基酸,是信号序列切割位点,也称加工区。当信号肽序列合成后,被信号识别颗粒(SRP)所识别,蛋白质合成暂停或减缓,信号识 别颗粒将核糖体携带至内质网上,蛋白质合成重新开始。在信号肽的引导下,新合成的蛋白质进入内质网腔,而信号肽序列则在信号肽酶的作用下被切除。信号肽分泌外源蛋白的作用如下:1)信号肽能够引导分泌蛋白或膜蛋白出胞。2)信号肽的疏水核心决定蛋白质的分泌效率。3)信号肽能够引导蛋白质在细胞内不同区域或不同细胞器进行正确的定位。4)信号肽能够分泌增强子增强外源蛋白的分泌。5)短的信号肽有利于减少表达载体的分子量,提高整合到宿主染色体上外源基因表达盒的稳定性和转录效率。信号肽没有严格的专一性,因而可利用宿主细胞本身的信号肽序列,也可以在表达载体的启动子后面加入一个编码信号肽的序列,分泌外源蛋白。应用信号肽序列来引导外源蛋白质的分泌不仅方便纯化操作,而且对于制备一些有特殊功用的基因工程产物(如抗体)来说,信号肽的应用更显示了其重要性。同一种蛋白在不同信号肽的作用下,即使都能分泌表达,其分泌效率也会相差甚远。适当改造信号肽结构可提高外源蛋白的分泌效率。对于外源蛋白(如抗体),选择合适的信号肽可以将其表达量成倍提高,无论对于工业生产还是科学研究,其意义都是非常深远的。技术实现要素:本发明的发明人在对信号肽的长期研究中,提供了一种可以引导外源蛋白质(如抗体)高效表达的信号肽,以降低外源蛋白的生产成本。因此,本发明的第一个目的在于提供一种用于蛋白质表达的信号肽。本发明的第二个目的在于提供所述信号肽的应用。本发明的第三个目的在于提供编码所述信号肽的多核苷酸。本发明的第四个目的在于提供包含编码所述信号肽的多核苷酸的哺乳动物细胞表达载体。本发明的第五个目的在于提供转染所述哺乳动物细胞表达载体的哺乳动物宿主细胞。本发明的第六个目的在于提供一种外源蛋白的生产方法。为了达到上述目的,本发明提供了如下技术方案:本发明的第一个方面提供了一种用于蛋白质表达的信号肽,所述信号肽的氨基酸序列如SEQIDNO:1所示。本发明的第二个方面提供了所述信号肽用于在哺乳动物宿主细胞中引导外源蛋白(如抗体)的分泌表达的应用。本发明的第三个方面提供了一种多核苷酸,所述多核苷酸编码如上所述的信号肽。进一步的,所述多核甘酸的核苷酸序列如SEQIDNO:7所示。本发明的第四个方面提供了一种哺乳动物细胞表达载体,所述哺乳动物细胞表达载体含有编码如上所述的信号肽的多核苷酸及编码外源蛋白的多核苷酸。进一步的,编码如上所述的信号肽的多核苷酸紧接在所述编码外源蛋白的多核苷酸前端。进一步的,所述哺乳动物细胞表达载体的启动子可以是EF-1α(humanelongationfactor-1α,人延伸因子-1α)启动子、hCMV(humancytomegalovirus,人巨细胞病毒)启动子、SV40(Simianvacuolatingvirus40,猴空泡病毒)晚期启动子、SV40早期启动子或者EF-1α与hCMV启动子的杂合启动子等。进一步的,所述外源蛋白可以为任意蛋白质,如抗体等。优选的,所述表达载体为pCHO1.0。本发明的第五个方面提供了一种哺乳动物宿主细胞,所述哺乳动物宿主细胞被如上所述的哺乳动物细胞表达载体所转染。进一步的,所述哺乳动物细胞可以是CHO(Chinesehamsterovary,中国仓鼠卵巢细胞)、BHK(babyhamsterkidney,幼年仓鼠肾细胞)、SP2/0(小鼠骨髓瘤细胞)、C127(小鼠乳腺肿瘤细胞)、HEK293(humanembryonickidney293,人胚肾293细胞)等。优选的,所述细胞为CHO细胞。本发明的第六个方面提供了一种外源蛋白的生产方法,包括以下步骤:在适合表达外源蛋白的条件下,培养如上所述的哺乳动物宿主细胞,然后从培养物中分离出所述的外源蛋白。有益效果:本发明提供了一种人工合成的新型信号肽,将其与天然抗体信号肽进行比较,外源蛋白表达量的测定结果表明,本发明的信号肽特别适用于CHO 细胞的外源蛋白表达,与现有信号肽相比,在哺乳动物细胞中的外源蛋白(如抗体)表达量获得大幅提升,表达水平提高了2.5倍以上,显著提高了外源蛋白的分泌表达量,其应用有利于筛选到高表达单克隆细胞株,并可以降低生产成本,具有广泛的工业应用前景。附图说明图1为FreedompCHO1.0表达载体图。图2为本发明信号肽与天然抗体信号肽引导的外源蛋白表达量对比图。图3为利用本发明信号肽制备的贝伐单抗的SEC-HPLC纯度检测结果图。图4为利用本发明信号肽制备的贝伐单抗的重链的完整分子量图谱。图5为利用本发明信号肽制备的贝伐单抗的轻链的完整分子量图谱。具体实施方式下述实施例详细说明本发明,但并不对其发明范围进行限制。利用本发明的信号肽在哺乳动物细胞中分泌表达蛋白质(如抗体)的方法为:将编码本发明信号肽的多核苷酸与编码表达蛋白质(如抗体)的多核苷酸连接后克隆入哺乳动物细胞表达载体,然后将该重组哺乳动物细胞表达载体转染哺乳动物细胞后表达目的蛋白。本发明的多核苷酸可通过常规的合成方法制备。本发明实施例所列举的表达载体为FreedompCHO1.0(购自Invitrogen)。实施例1信号肽的合成本发明设计了人工合成的新型信号肽1,同时引用了天然抗体信号肽2-6进行对比。信号肽1-6的氨基酸序列如下。信号肽1:MGKWVKVLFALICIAVAES(本发明设计,SEQIDNO:1)信号肽2:METPAQLLFLLLLWLP(GenBank:AAA36085.1,Homosapiens,SEQIDNO:2)信号肽3:MGWSCIILFLVATATGVHS(GenBank:CAA25967.1,Musmusculus,SEQIDNO:3)信号肽4:MGWSCIILFLVATATG(GenBank:AAA38605.1,Musmusculus,SEQIDNO:4)信号肽5:MSVPTQVLGLLLLWLTDARC(GenBank:CAB46315.1,Musmusculus,SEQIDNO:5)信号肽6:MDMRVPAQLLGLLLLWLPG(GenBank:AAA58934.1,Homosapiens,SEQIDNO:6)信号肽1-6的核苷酸序列如下。信号肽1:5’-ATGGGCAAGTGGGTGAAGGTGCTGTTCGCCCTGATCTGCATCGCCGTGGCCGAGAGC-3’(SEQIDNO:7)信号肽2:5’-ATGGAAACCCCTGCTCAGCTCCTCTTCCTGCTCCTCCTCTGGCTCCCA-3’(SEQIDNO:8)信号肽3:5’-ATGGGATGGTCCTGTATTATTCTGTTTCTCGTGGCTACTGCAACTGGCGTCCACAGC-3’(SEQIDNO:9)信号肽4:5’-ATGGGATGGTCCTGTATTATTCTGTTTCTCGTGGCTACTGCAACTGGA-3’(SEQIDNO:10)信号肽5:5’-ATGAGCGTCCCAACACAAGTGCTGGGTCTGCTGCTGCTGTGGCTGACTGACGCAAGGTGC-3’(SEQIDNO:11)信号肽6:5’-ATGGATATGAGGGTGCCCGCTCAACTGCTGGGACTGCTGCTGCTGTGGCTGCCAGGC-3’(SEQIDNO:12)因信号肽较短,将以上信号肽的核苷酸序列按引物合成方式合成。每条信号肽5’端都分别添加AvrII、EcoRV酶切位点,即同一条信号肽合成两条序列(一条含有AvrII,另一条含有EcoRV);每条信号肽3’端添加部分与目的基因序列相 同的片段,便于拼接。实施例2重组pCHO1.0表达载体的构建将经过密码子优化的贝伐单抗基因重链(WO2004/065417,SEQIDNO:25,3’端添加BstZ171酶切位点)分别与信号肽1-6(5’端含有AvrII)进行拼接,并分别经AvrII/BstZ171双酶切处理后,连接至AvrII/BstZ171双酶切后的质粒pCHO1.0(购自Invitrogen),所获得的重组质粒分别命名为pCHO-LC7、pCHO-LC2、pCHO-LC3、pCHO-LC4、pCHO-LC5、pCHO-LC6。将经过密码子优化的贝伐单抗基因轻链(WO2004/065417,SEQIDNO:25,3’端添加PacI酶切位点)分别与信号肽1-6(5’端含有EcoRV)进行拼接,并分别经EcoRV/PacI双酶切处理后,连接至分别经EcoRV/PacI双酶切后的质粒pCHO-LC7、pCHO-LC2、pCHO-LC3、pCHO-LC4、pCHO-LC5、pCHO-LC6,所获得的重组质粒分别命名为pCHO-A7、pCHO-A2、pCHO-A3、pCHO-A4、pCHO-A5、pCHO-A6。其中,重组质粒pCHO-A7采用本发明的信号肽1分泌表达贝伐单抗的轻、重链,重组质粒pCHO-A2、pCHO-A3、pCHO-A4、pCHO-A5、pCHO-A6分别采用天然信号肽2-6分泌表达贝伐单抗的轻、重链。实施例3重组表达载体瞬时转染表达研究采用脂质体法(freestyleMAX,购自Invitrogen)将质粒pCHO-A2、pCHO-A3、pCHO-A4、pCHO-A5、pCHO-A6、pCHO-A7分别转染至CHO-S细胞(购自Lifetechnologies)中,检测抗体瞬时表达水平。具体地说,按照freestyleMAX操作说明书,将5μgpCHO-A2、pCHO-A3、pCHO-A4、pCHO-A5、pCHO-A6、pCHO-A7质粒分别转染培养于6孔板(3ml/孔)的CHO-S细胞(约3×106个细胞)中。转染细胞在8%CO2,37℃的细胞震荡培养箱(品牌Infors)中摇动培养48小时后,收集培养液上清,使用ELISA法检测人贝伐单抗表达量。结果如图2和表1所示。表1、质粒编号信号肽抗体表达量(μg/ml)pCHO-A2SEQIDNO:21pCHO-A3SEQIDNO:31.1pCHO-A4SEQIDNO:41.41pCHO-A5SEQIDNO:51.28pCHO-A6SEQIDNO:61.2pCHO-A7SEQIDNO:13.6结果显示,本发明信号肽相对于天然抗体信号肽,在相同条件下,抗体分泌表达量提高了2.5倍以上,说明本发明的信号肽能够显著提高CHO细胞中外源蛋白的分泌表达量。实施例4小量抗体的制备按照FreedomCHO-SKit(购自Lifetechnologies)操作说明书,将50μgpCHO-A7质粒转染于摇瓶培养的30mlCHO-S细胞(1×106cells/ml)中。转染细胞在8%CO2,37℃的细胞震荡培养箱中摇动培养48小时后,加入甲氨蝶呤(MTX)和嘌呤霉素进行加压筛选。待细胞活力上升至90%,进行简单流加(SimpleFed-batch)(3×105细胞密度接种,第3天和第5天补入4g/L糖,第7天补入6g/L糖;37℃/130rpm/8%CO2)以生产小量抗体。培养14天后,收集简单流加培养上清,用ProteinA纯化柱(MabSelectSuRe,购自GEHealthcare)进行亲和纯化(结合缓冲液:NaCl0.5M,Na2HPO420mM,PH8.0;洗脱液:50mM柠檬酸缓冲液PH3.5),最终获得高纯度的贝伐单抗。实施例5表达抗体质量的鉴定将实施例4制备的贝伐单抗进行SEC-HPLC(DIONEX,UItimate3000-VWD1)纯度分析,结果如图3所示,纯度大于97%。利用Q-TOF(Waters,XEVOG2Q-TOF)对制备的贝伐单抗进行完整分子量分析,结果如图4和5所示,轻链和重链的分子量测定结果与原研药一致。根据以上检测结果表明本发明信号肽所引导分泌的抗体为目标抗体,可以用于引导外源蛋白(如抗体)的正确表达。按照上述方法,本发明的发明人还对依那西普、曲妥珠单抗、利妥昔单抗(Rituximab、MabThera)等等蛋白质进行类似实验,结果表明,本发明信号肽引导的蛋白质在哺乳动物细胞中的表达量均获得大幅提升。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1