一组胃癌腹膜转移标志物及其用途的制作方法
本发明属于生物医药技术领域,具体涉及一组胃癌腹膜转移标志物及其用途。
背景技术:
胃癌是严重威胁我国人民生命健康的消化道恶性肿瘤,胃癌患者主要死于肿瘤的复发与转移,大约20%-53.5%的患者术后3年内出现腹膜转移。有关胃癌发生腹膜转移的分子机制至今未明,导致目前缺少相应的诊断试剂盒和其药物筛选、药效评价及靶向治疗的药靶。
由于缺乏有效的早期筛查手段,绝大多数胃癌就诊时已达到中晚期,丧失了手术治疗最佳时期。因此,化疗成为中晚期胃癌、特别是无法进行手术治疗胃癌的不二选择。国内外胃癌的化疗基本上采用程式化治疗方案,即5-FU+铂类为主的治疗模式。故实际对化疗的应答率较低,只有20-40%的患者有效,而大部分患者接受了无谓的化疗毒副作用。如果不改善现有胃癌治疗模式,则很难切实提高胃癌的实际治疗效果。
技术实现要素:
本发明所要解决的技术问题是为胃癌或胃癌腹膜转移的诊断或药物筛选、药效评价及靶向治疗的药靶提供一种解决方法。
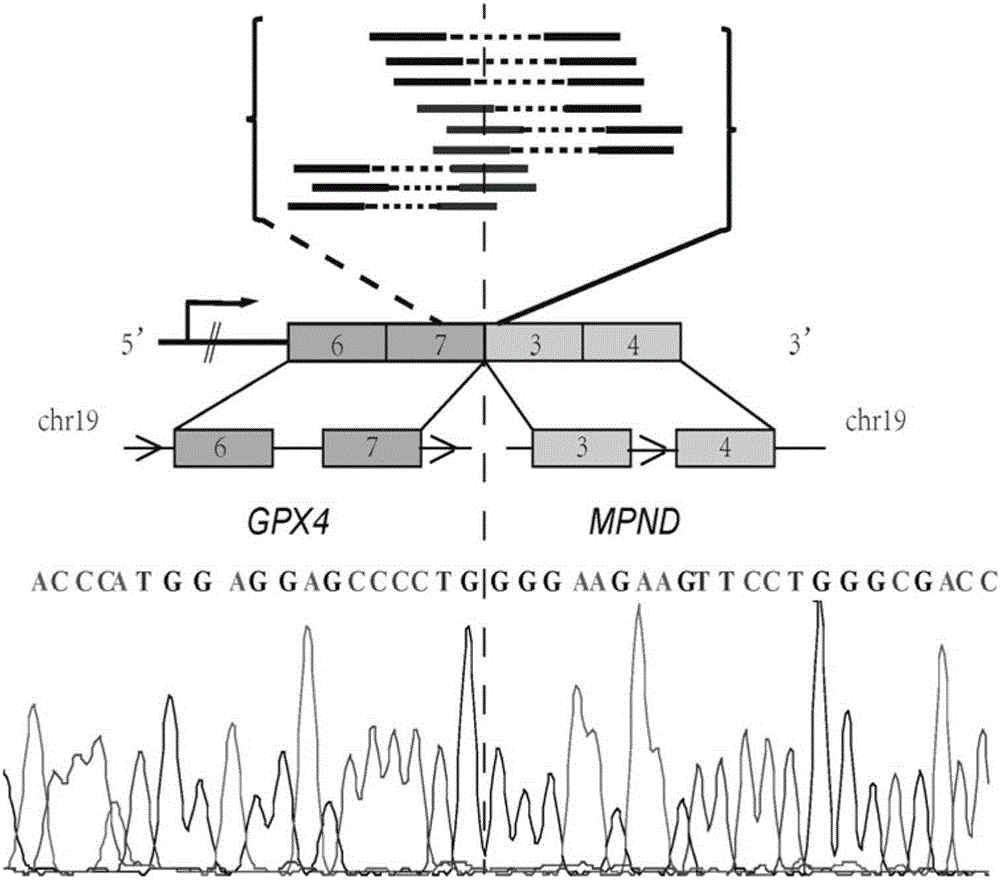
为此,本发明公开了一种胃癌腹膜转移标志物,其为GPX4-MPND融合基因,GPX4(chr19:1106458)-MPND(chr19:4345742),该基因的融合发生在GPX4的第7外显子与MPND的第3外显子之间。
同时,本发明还公开了一组胃癌腹膜转移标志物在制备诊断胃癌或胃癌腹膜转移的检测试剂盒中的用途,所述胃癌腹膜转移标志物为导致氨基酸改变的体细胞单核苷酸变异其为RP1L1,NCBI Gene ID:94137;和/或PRB1,NCBI Gene ID:5542;和/或HS6ST3,NCBI Gene ID:266722;和/或DCTN1,NCBI Gene ID:1639;和/或ARMC4,NCBI Gene ID:55130中之一或它们任何组合的单核苷酸变异。
在一些实施例中,所述RP1L1为8p23.1的10467547位点发生G>A变异;PRB1为12p13.2的11506869位点发生C>A变异;HS6ST3为13q32.1的97484796发生G>A变异;DCTN1为2p13.1的74593112发生G>A变异;ARMC4为10p12.1的28142179位点发生C>T变异。
本领域技术人员将能通过能够检测SNV位点的任何方法或技术在个体的核酸中进行在本文所公开的一个或几个SNV标记上存在的核苷酸的分析。例如,一个人能用本发明所述的方法通过进行Taqman法、质谱法、DNA微阵列法、测序法、微测序、杂交、限制性片段分析、寡核苷酸连接检测、等位基因特异性PCR-HRM或联合应用上述方法检测SNV生物标记。当然,这一列表仅是示例性的,并且绝不用于限制本发明。本领域技术人员可使用任何合适的方法来实现这种检测。
另一方面,本发明还公开了胃癌腹膜转移标志物在制备诊断胃癌或胃癌腹膜转移的检测试剂盒中的用途,胃癌腹膜转移标志物为SFRP4,NCBI Gene ID:6424;NOX4,NCBI Gene ID:50507;HOXA11,NCBI Gene ID:3207;NKX2-5,NCBI Gene ID:1482;CDH16,NCBI Gene ID:1014;RP1L1,NCBI Gene ID:94137;PRB1,NCBI Gene ID:5542;TUBB6,NCBI Gene ID:84617;LOC100505875,NCBI Gene ID:100505875;的表达产物中之一或它们任何组合。
在一些实施例中,所述胃癌腹膜转移标志物为RP1L1,NCBI Gene ID:94137;PRB1,NCBI Gene ID:5542;TUBB6,NCBI Gene ID:84617的表达产物中之一或它们任何组合。
本发明还公开了胃癌腹膜转移标志物在制备诊断胃癌或胃癌腹膜转移的检测试剂盒中的用途,胃癌腹膜转移标志物为LIPF,NCBI Gene ID:8513;NKX6-2,NCBI Gene ID:84504;MIXL1,NCBI Gene ID:83881;CWH43,NCBI Gene ID:80157;SULT1E1,NCBI Gene ID:6783;CXCL5,NCBI Gene ID:6374;REG1A,NCBI Gene ID:5967;GHRL,NCBI Gene ID:51738;NKX2-2,NCBI Gene ID:4821;HTR1E,NCBI Gene ID:3354;HPGD,NCBI Gene ID:3248; ESRRG,NCBI Gene ID:2014;CYP2C19,NCBI Gene ID:1557;ADH1C,NCBI Gene ID:126;PNLIPRP3,NCBI Gene ID:119548;和CEACAM5,NCBI Gene ID:1048的表达产物中之一或它们任何组合。
所述检测试剂盒在人类受试者中进行胃癌或胃癌腹膜转移的易感性评价和/或诊断和/或预测的体外方法中使用,其中所述试剂盒包含用于进行下列步骤的适当的工具:
a)评价至少一种与所述的人类受试者的胃癌或胃癌腹膜转移标志物类型和/或水平;和
b)将所述的人类受试者的在a)中评价的生物标记数据与健康的和/或患病的人的生物标记数据进行比较,来做出所述的人类受试者的胃癌或胃癌腹膜转移的风险评价和/或诊断和/或预测。
术语“检测试剂盒”和“试剂盒”是同义词并可互换使用。
在本发明的上下文中,当是指检测试剂盒时,术语“适当的工具”是指任何用于达到所指明的目的的任何技术手段。作为这种适当的工具的非限制性例子,能列举试剂和/或材料和/或流程和/或说明书和/或软件等。本发明所述的所有试剂盒可包含适当的包装和说明书用于在本文所公开的方法中使用。试剂盒可进一步包含适当的缓冲液和聚合酶,如耐热聚合酶,例如Taq聚合酶。这种试剂盒也包含对照引物和/或探针。
根据优选的具体实施方式,本发明所述的检测试剂盒为核酸检测试剂盒,包括基因组DNA抽提试剂、PCR反应体系试剂和HRM荧光染料试剂,所述PCR反应体系包括dNTP、MgCl2、Taq DNA聚合酶、PCR反应缓冲液和引物。在可检测出SNP位点的前提下,HRM荧光染料试剂可被Taqman法、质谱法、DNA微阵列法、测序法、微测序等试剂替换。
另一方面,本发明还公开了胃癌腹膜转移标志物在制备治疗胃癌或胃癌腹膜转移的药物筛选中的用途,所述胃癌腹膜转移标志物为SFRP4,NCBI Gene ID:6424;NOX4,NCBI Gene ID:50507;HOXA11,NCBI Gene ID:3207;NKX2-5,NCBI Gene ID:1482;CDH16,NCBI Gene ID:1014;RP1L1,NCBI Gene ID:94137;PRB1,NCBI Gene ID:5542;TUBB6,NCBI Gene ID:84617的表达产物中之一或它们任何组合。
另一方面,本发明还公开了胃癌腹膜转移标志物在制备治疗胃癌或胃癌腹膜转移的药物筛选中的用途,所述胃癌腹膜转移标志物为LIPF,NCBI Gene ID:8513;NKX6-2,NCBI Gene ID:84504;MIXL1,NCBI Gene ID:83881;CWH43,NCBI Gene ID:80157;SULT1E1,NCBI Gene ID:6783;CXCL5,NCBI Gene ID:6374;REG1A,NCBI Gene ID:5967;GHRL,NCBI Gene ID:51738;NKX2-2,NCBI Gene ID:4821;HTR1E,NCBI Gene ID:3354;HPGD,NCBI Gene ID:3248;ESRRG,NCBI Gene ID:2014;CYP2C19,NCBI Gene ID:1557;ADH1C,NCBI Gene ID:126;PNLIPRP3,NCBI Gene ID:119548;和CEACAM5,NCBI Gene ID:1048的表达产物中之一或它们任何组合。
筛选治疗胃癌或胃癌腹膜转移的药物(例如肿瘤治疗药物)的方法,所述方法包括:
(a)提供表达本发明所述胃癌腹膜转移标志物的肿瘤细胞系、肿瘤培养物或荷瘤动物;
(b)将候选药物与步骤(a)中提供的肿瘤细胞系、肿瘤培养物或荷瘤动物接触,作为给药组;
(c)检测比较给药组与未给予候选药物的对照肿瘤细胞系、肿瘤培养物或荷瘤动物的药物活性进行比较;如果检测结果显示,给药组的治疗效果显著高于对照组,则表明该候选药物是治疗胃癌或胃癌腹膜转移的药物。
本发明的方法可用于从化合物库中筛选出针对治疗胃癌或胃癌腹膜转移的药物,可作为化合物筛选评估的一个重要指标。本发明的方法也可用于临床中对肿瘤患者的个性化治疗的预测和诊断中,筛选出针对个体具有最佳肿瘤治疗效果的抗肿瘤药物。
本发明首次发现一系列的胃癌腹膜转移标志物,为研制相应的诊断试剂盒,对我国胃癌腹膜转移诊断现状必将是一次有力的推动,也为其药物筛选、药效评价及靶向治疗开辟了新的途径。
附图说明
图1样本的体细胞突变与基因表达的对应关系。
图2 GPX4-MPND融合基因示意图。
具体实施方式
以下结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
材料与方法
一、材料来源
经瑞金医院伦理委员会讨论通过、患者签署知情同意书后,收集患者非癌胃黏膜、胃癌原发灶、腹膜转移灶、外周血白细胞等材料,其中一患者,胃窦部肿瘤伴有幽门梗阻入院;影像学(CT)示胃窦部肿瘤,横结肠系膜疑有转移;手术方式:全胃切除术+腹膜转移灶切除术;随访:术后2月死亡。此例患者术前腹部CT以及手术中均发现为胃癌伴有腹膜转移,身体其他器官未发现转移灶。术前未接受过放疗或者化疗,对患者给予全胃切除术及腹膜转移灶切除术。手术标本肉眼检查见肿瘤位于胃窦部,直径约7cm,浸润溃疡型。显微镜检查发现肿瘤细胞呈弥漫性散布于胃壁呈浸润性生长,肿瘤向胃壁深部浸润穿透胃壁浆膜层。原发灶与腹膜转移灶肿瘤细胞均呈印戒型组织学外观,而非癌区胃黏膜呈现明显慢性胃炎伴有肠上皮化生的组织病理学改变。病理诊断:低分化胃癌,弥漫型,伴有腹膜转移。胃周围淋巴结(18/28)伴有转移。TNM分期Ⅳ期,患者术后2个月死亡。
全基因组测序样本:
非癌胃黏膜、胃癌原发灶、腹膜转移灶、外周血白细胞
全转录组测序:
非癌胃黏膜、胃癌原发灶、腹膜转移灶
二、DNA与RNA抽提、建库与测序
基因组DNA文库的构建按照TruSeq DNA LT Sample Preparation Kit V2(Illumina) 的标准流程进行。主要包括以下步骤,在使用NanoDrop测定DNA浓度,琼脂糖凝胶电泳检查DNA完整性,完成DNA质检后,使用Covaris S220将基因组DNA打断;片段化的DNA经过末端补平和3’末端加A,然后在片段两端各加上接头,其中一个接头上带有特异性的barcode序列以区分样本来源;使用切胶回收的方法从琼脂糖凝胶电泳上选择所需长度的目的片段;然后运用通用引物对(Illumina)进行10个循环的PCR扩增;PCR扩增产物经过纯化以及浓度测定后,使用IlluminaHiSeq2000系统,按照Illumina的标准流程进行深度测序。
分别提取各样本的总RNA。RNA文库构建使用Illumina公司生产的TruSeq RNA Sample Preparation Kit V2试剂盒,按照厂家的标准流程进行。主要步骤如下:在使用NanoDrop测定RNA浓度,琼脂糖凝胶电泳检查RNA的完整性,以及Agilent2100 Bioanalyzer测定RNA的RIN值,完成RNA样本的质检后,使用oligo-dT磁珠从总RNA里分离出带有poly-A尾巴的RNA,即mRNA。mRNA经过片段化后,逆转录合成cDNA第一链和第二链,逆转录产物的末端经过修补成平末端,然后在3’末端加A。此片段的两端分别与通用的接头相连接,其中一个接头带有特异性的barcode序列,用以区分样本的来源。连接产物经过纯化,去除连接不完整的产物以及空的接头自连产物后,运用与接头序列互补的通用引物对之进行15个循环的PCR扩增。PCR扩增产物经过纯化以及浓度测定后,RNA文库构建即告完成。待测RNA文库在cBot上完成cluster generation,然后将flowcell转移到HiSeq2000型测序系统上,按照Illumina的标准流程进行二代测序及数据分析。
三、测序数据的生物信息学分析
需要比较的样本:原发癌灶与癌旁黏膜(慢性胃癌);腹膜转移癌灶与癌旁黏膜(慢性胃炎);原发癌灶与腹膜转移癌灶。需要比较的主要指标:基因突变;小插入缺失;基因拷贝数变异;基因转录组变异;基因表达量改变;转录剪切变异;融合基因、信号通路分析等。通过生物信息分析识别到一组关键基因后设计相关突变分析引物、基因表达分析引物以及融合基因检测引物,通过Sanger测序方法以及定量PCR等方法在原全基因组和转录组测序分析样本上进行验证分析。
结果:
全基因组测序结果
对患者的外周血、慢性胃炎组织、胃癌原发灶组织以及腹膜转移癌组织进行了全基因组测序分析。测序产生了平均167.75Gb数据。将读取片段匹配到人类基因组参考序列hg19,获得了99.08%的匹配度。每份样本测序深度平均为57X(34-80×之间)。该例全基因组测序详细数据信息见表1.
以患者的外周血DNA测序作为正常参考序列,检查了每份样本全基因组的体细胞突变情况。我们检测到大量的单核苷酸变异(single nucleotide variants,SNVs),这些SNVs不仅出现在原发癌灶、转移癌灶,也出现于慢性胃炎病灶中(表2)。
总计检测到27个导致氨基酸改变的体细胞单核苷酸变异,这些变异均通过Sanger测序法得到了验证。其中10个单核苷酸变异出现在慢性胃炎样本(ATXN3,PLIN4,PDZD2,MUC4,MUC17,DMBT1,DAB1,ZNF208,FLG2和CRNN),23个单核苷酸变异出现在原发癌样本(ATXN3,PLIN4,PDZD2,MUC4,MUC17,DMBT1,DAB1,TUBB6,RP1L1,PRB1,PKLR,JAM2,ITGAD,IREB2,IQUB,HS6ST3,DCTN1,CORO1B,CCDC178,CCDC121,AKAP2,ACAN和ACADL),12个单核苷酸变异出现在腹膜转移癌样本(ATXN3,PLIN4,PDZD2,MUC4,DMBT1,DAB1,CRNN,RP1L1,PRB1,HS6ST3,DCTN1和ARMC4)。值得注意的是6个单核苷酸变异在慢性胃炎样本、胃原发癌样本与腹膜转移癌样本均存在(ATXN3,PLIN4,PDZD2,MUC4,DMBT1和DAB1),这些基因的突变贯穿于胃癌的启动、进展与转移的全程,是与胃癌的发生发展密切相关的驱动基因。有4个基因的单核苷酸变异同时出现在胃癌原发灶与腹膜转移灶当中(RP1L1,PRB1,HS6ST3和DCTN1),这些基因可能参与了胃癌的进展或者说促进了胃癌向腹膜的转移。我们发现1个基因的单核苷酸变异仅出现在腹膜转移灶中(ARMC4),表明该基因突变在胃癌腹膜转移过程中具有重要作用(图1A).单核苷酸变异在慢性胃炎、原发癌灶与转移癌灶的平均出现频率分别是58.8%,60.1%和57.0%。以A→G/T→C置换最常见,其次是G→A/C→T置换和A→C/T→G的置换(图1B)。上述碱基置换情况与TCGA数据库中报告的其他癌肿的碱基置换情况无明显不同。
图1A.展示三份配对样本的体细胞突变情况,蓝色代表单核苷酸变异,左侧柱代表每一个基因突变数字,百分比代表该基因突变占样本的比例。图1B.代表三份样本与对照血样比较的SNVs百分比。图1C.三份样本突变基因的 RNA-Seq测得的mRNA表达水平。
突变基因对mRNA表达的影响
图1C展示了基因单核苷酸变异对mRNA表达影响的热图。红色代表突变基因mRNA表达的升高,绿色代表表达下降。对于同时在胃癌原发灶与转移灶均出现的突变基因要特别关注,因为这些基因变异对基因表达的影响有助于预测将来是否容易出现腹膜转移。其中RP1L1和PRB1均属于激活性突变,导致基因的mRNA表达升高,这样的基因为胃癌腹膜转移的特征性分子靶点。此外,TUBB6在胃癌原发灶存在突变,但在原发灶与腹膜转移灶均mRNA表达明显增高(与慢性胃炎相比倍数增加>6),是胃药药物开发中新分子靶点和可用于相关检测试剂盒的开发。ARMC4是仅在腹膜转移灶出现的突变基因,该基因突变是失活性突变,导致mRNA表达下降,因此需要高度关注其在腹膜转移中的抑癌基因作用。
新型融合基因的发现
采用TopHat软件分析融合基因,首先剔除同一染色体内两个融合基因之间遗传学距离小于100kb的融合事件,这种情况可能为人为假象,筛选到的基因融合事件以及相关基因mRNA的表达水平变化列于表3。图2展示了融合基因与所在染色体位点,通过采用Sanger测序验证,证实了GPX4-MPND融合基因[GPX4(chr19:1106458)-MPND(chr19:4345742)]的存在,该基因的融合发生在GPX4的第7外显子与MPND的第3外显子之间。通过的RNA-seq的定量分析可知,GPX4-MPND融合导致GPX4基因mRNA表达升高了2.184倍,MPND的mRNA表达升高了1.3369倍。该基因融合是既往没有报道过的人类肿瘤细胞基因融合事件。
RNA-Seq中差异表达基因的信号通路
我们将差异表达基因的FDR设定为FDR<0.1,倍数变化>1.5,分别比较了胃癌原发灶vs慢性胃炎、腹膜转移灶vs慢性胃炎、腹膜转移灶vs胃癌原发灶的差异基因,我们注意到有6个基因(SFRP4,NOX4,HOXA11,NKX2-5,CDH16和LOC100505875)在原发癌灶与腹膜转移癌灶均表达升高(注意:这些基因并没有检测到突变,其表达变化可能受表观遗传学调控),这些基因均可作为预测胃癌发生腹膜转移标志物,即可用于相关检测试剂盒的开发,也可是胃药药物开发中新分子靶点;还有16个基因(LIPF,NKX6-2,MIXL1,CWH43,SULT1E1,CXCL5,REG1A,GHRL,NKX2-2,HTR1E,HPGD,ESRRG,CYP2C19,ADH1C,PNLIPRP3和CEACAM5)在胃癌原发灶与转移灶均表达下降(注意:这些基因并没有检测到突变,其表达变化可能受表观遗传学调控),这些基因可能是调控胃癌腹膜 转移的重要抑癌基因,它们可用于相关检测试剂盒的开发,也可是胃药药物开发中新分子靶点。通过Gene Ontology(GO)功能注释,我们获得了这些原发灶与转移灶共有差异基因涉及的信号通路图。这些表达明显上调的基因主要涉及对细菌、乙醇、刺激物、化学趋化因子的反应基因以及葡萄糖代谢相关基因;而这些表达明显下调的基因主要涉及上皮形态发生、上皮分泌功能、肌肉发育相关基因。
本发明的范围不受所述具体实施方案的限制,所述实施方案只作为阐明本发明各个方面的单个例子,本发明范围内还包括功能等同的方法和组分。实际上,除了本文所述的内容外,本领域技术人员参照上文的描述和附图可以容易地掌握对本发明的多种改进。所述改进也落入所附权利要求书的范围之内。上文提及的每篇参考文献皆全文列入本文作为参考。
- 还没有人留言评论。精彩留言会获得点赞!