一种利用甲基化酶的保护高效重组表达限制性内切酶的方法与流程
本发明属于生物工程领域,特别是一种利用甲基化酶的保护高效重组表达限制性内切酶的方法。
背景技术:
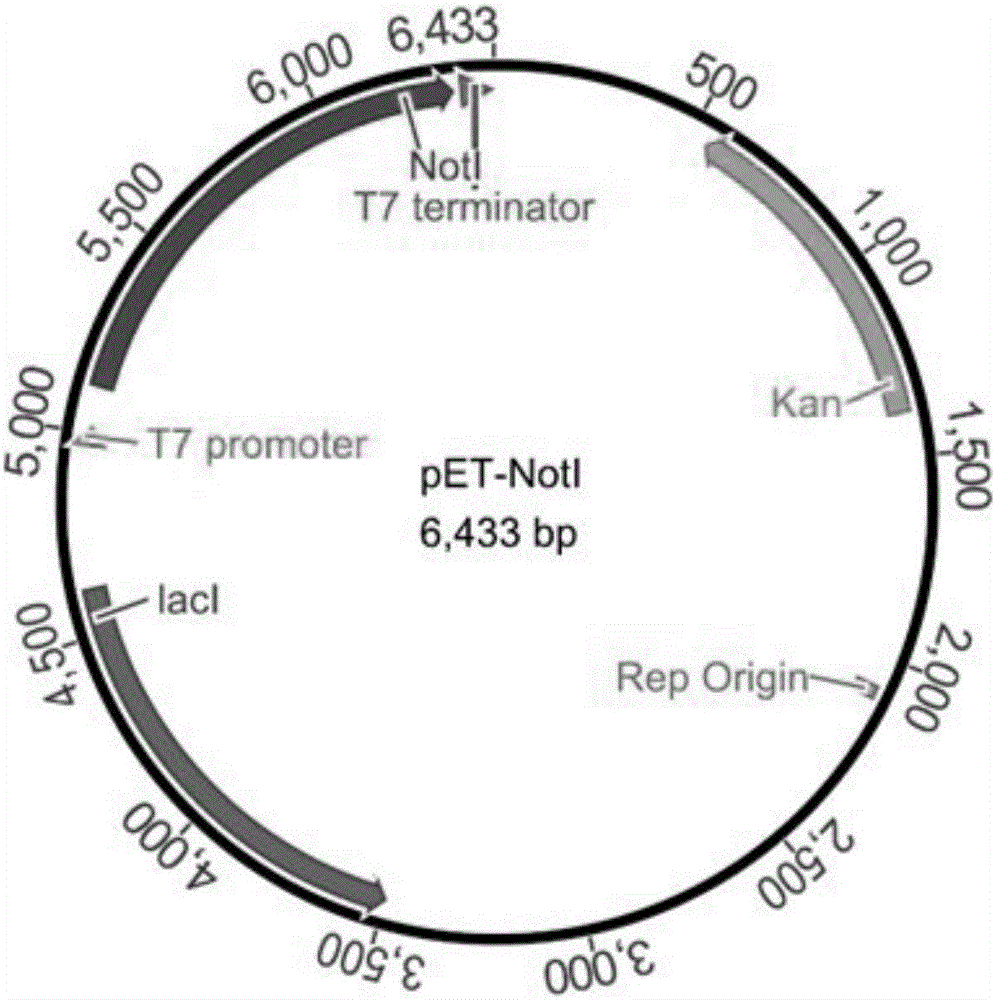
:限制性内切酶是当代基因工程研究不可缺少的重要工具,它们来源于不同的微生物,是细菌防御外来病毒入侵的武器。在20世纪60年代,科学家推测细菌中有限制-修饰系统(restriction-modificationsystem,R-Msystem),该系统包括两类酶,即限制性内切酶和DNA甲基化酶,前者负责降解进入原核细胞的外源DNA,后者则对细胞自身的DNA进行甲基化,从而保护细胞的DNA,使其不被细胞内的限制性核酸内切酶降解。现有技术中生产限制性内切酶的方法主要是将限制-修饰基因克隆入质粒,靠质粒的高拷贝数实现目的蛋白高表达,而且使用的是与限制性内切酶对应的特异性甲基化酶进行制备,这种方法的提纯程序繁琐、限制性内切酶得率低、生产成本高,获得的甲基化保护菌株只能特异性保护宿主DNA免于某一种限制性内切酶的切割,应用范围狭窄。技术实现要素:本发明要解决的技术问题是针对现有技术的不足,提出了一种利用甲基化酶的保护高效重组表达限制性内切酶的方法,可以应用于多种限制性内切酶的生产,降低了生产成本并且能够获得纯度高、活力好的限制性内切酶。本发明要解决的技术问题是通过以下技术方案来实现的,一种利用甲基化酶的保护高效重组表达限制性内切酶的方法,其特点是:所述的甲基化酶是M.SssI;所述限制性内切酶D选自:AatII、AciI、AclI、AfeI、AgeI、AscI、AsiSI、AvaI、BceAI、BmgBI、BsaAI、BsaHI、BsiEI、BsiWI、BsmBI、BspDI、BspEI、BsrFI、BssHII、BstBI、BstUI、BtgZI、ClaI、EagI、FauI、FseI、FspI、HaeII、HgaI、HhaI、HinP1I、HpaII、Hpy99I、HpyCH4IV、KasI、MluI、NaeI、NarI、NgoMIV、NotI、NruI、Nt.BsmAI、Nt.CviPII、PaeR7I、PluTI、PmlI、PvuI、RsrII、SacII、SalI、SfoI、SgrAI、SmaI、SnaBI、TliI、TspMI、XhoI、XmaI、ZraI。本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。以上所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法,包括:步骤(一):将M.SssI基因克隆至质粒载体pACYC184上,得到M.SssI组成型质粒,转化宿主菌,筛选获得被甲基化保护的阳性重组菌株;步骤(二):将所述限制性内切酶D的基因克隆至质粒载体pET-28b上,得到限制性内切酶D重组质粒,转化步骤(一)得到的已被甲基化保护的阳性重组菌,筛选稳定、可诱导、高表达的限制性内切酶D的重组表达菌株。本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。以上所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法中,所述的宿主菌为原核宿主细胞。进一步优选地,所述的宿主菌为大肠杆菌。本发明所要解决的技术问题还可以通过以下的技术方案来进一步实现。以上所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法中,所述的步骤(一)和步骤(二)分别包括:步骤(一):设计引物,根据设计的引物PCR扩增M.SssI基因,M.SssI的PCR产物经纯化、酶切后连接至质粒载体pACYC184上,连接产物转化至DH5α感受态细胞中,经细胞培养后提取质粒,经测序获得M.SssI的组成型质粒pACYC184-M.SssI,将pACYC184-M.SssI转化大肠杆菌ER2566感受态细胞后,涂布于含氯霉素的LB平板上筛选克隆,获得M.SssI组成型表达菌株ER2566-M.SssI;步骤(二):(1)限制性内切酶D重组表达菌株的构建设计引物,根据设计的引物PCR扩增限制性内切酶D基因,限制性内切酶D的PCR产物经纯化、酶切后连接至质粒载体pET-28b上,限制性内切酶D基因的插入部位处于T7启动子后,经测序获得限制性内切酶D的重组质粒pET-D,将pET-D转化至ER2566-M.SssI感受态细胞后,涂布于含氯霉素及卡那霉素的LB平板上筛选克隆,获得限制性内切酶D的重组表达菌株ER2566-M.SssI-D;(2)限制性内切酶D的诱导表达将ER2566-M.SssI-D涂布于含氯霉素及卡那霉素的LB平板上,培养并挑取单菌落接种于含氯霉素及卡那霉素的LB培养液中,摇动培养一段时间,加入IPTG诱导表达限制性内切酶D;(3)限制性内切酶D的纯化(a)取经IPTG诱导后的ER2566-M.SssI-D菌培养液,离心收集菌体;(b)菌体以Ni柱结合缓冲液重悬后破碎处理,离心取上清粗蛋白溶液过Ni亲和层析纯化柱,分步收集,将纯度和浓度较高的收集样混合、透析;(c)取步骤(b)中透析后的收集样过阴离子交换层析柱,梯度洗脱,分步收集,将纯度和浓度较高的收集样混合、透析、贮存。本发明所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法中,进一步优选的技术方案或者技术特征是:1、在步骤(一)中,设计引物时,根据NCBI数据库上螺原体属菌株MQ1(Spiroplasmasp.strainMQ1)的M.SssI基因序列设计一对引物,在上游引物5’端引入大肠杆菌组成型表达启动子E.colipltlpromoter序列,在下游引物5’端引入大肠杆菌终止子E.colirrnBT1terminator的反向互补序列,在上、下游引物的5’端还分别引入HindIII酶切识别序列和保护碱基。2、在步骤(一)中,所述的氯霉素的浓度为17.5-70μg/mL。3、在步骤(二)中,构建限制性内切酶D重组表达菌株时,所述的氯霉素和卡那霉素的浓度分别为17.5-70μg/mL、37.5-150μg/mL。4、在步骤(二)中,诱导表达限制性内切酶D时,将ER2566-M.SssI-D接种于含17.5-70μg/mL氯霉素和37.5-150μg/mL卡那霉素的LB培养基中培养并挑取单菌落,再按2-5%的接种量接种于含17.5-70μg/mL氯霉素和37.5-150μg/mL卡那霉素的LB培养液中,于37℃摇动培养,至菌密度达到3×108-4×108/mL时,加入IPTG至终浓度为0.2-0.5mM,并在15-18℃以200-250rpm摇动培养12-18h,诱导表达限制性内切酶D。5、在步骤(二)中,纯化限制性内切酶D时:(a)取经IPTG诱导后的ER2566-M.SssI-D培养液,以8000g离心10min收集菌体;(b)菌体由Ni柱结合缓冲液重悬后用细胞高压破碎仪破碎处理,43000g低温离心30min弃去沉淀,得到上清粗蛋白溶液,上清粗蛋白溶液过Ni亲和层析纯化柱,分步收集,将纯度和浓度较高的收集样混合、透析;所述的Ni柱结合缓冲液的组成如下:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,5mM咪唑;其中,在Ni亲和层析过程中使用的缓冲液及其组成分别为:平衡缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,5mM咪唑;漂洗缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,20mM咪唑;洗脱缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,400mM咪唑;(c)在阴离子交换层析过程中使用的缓冲液和梯度洗脱液分别为:平衡缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA,1mMDTT;梯度洗脱液包括:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,300mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,500mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,700mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,1MNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA。本发明与现有技术相比,重组工程菌的构建过程中直接使用广谱保护型甲基化酶M.SssI,M.SssI能够识别并特异性甲基化修饰CpG序列,M.SssI对宿主DNA进行甲基化修饰可以保护宿主DNA免于宿主细胞内酶切位点中含有CpG序列的限制性内切酶的切割,因此,可以应用于一系列酶切位点中含有CpG序列的限制性内切酶的生产,避免了对单个限制性内切酶进行繁琐的甲基化酶基因筛选,大大简化了重组表达过程,应用广泛。在纯化工艺中,由于载体pET-28b具有6×His纯化标签编码序列,最终表达的重组蛋白上含有6×His纯化标签,采用镍亲和层析柱进行蛋白纯化,极大地简化了目的蛋白的纯化工作。本发明方法在保证酶活的基础上提高了限制性内切酶得率,降低了生产成本,为大规模工业化生产限制性内切酶提供了有益的理论及实践依据。附图说明图1为本发明实施例12中M.SssI组成型质粒图谱;图2为本发明实施例12中NotI重组质粒图谱;图3为本发明实施例12中NotI重组表达的检测电泳图;其中:1-3:蛋白粗酶液特异性酶切条带;4:N85DNA(未酶切);M:DNAMarker。图4为本发明实施例12中NotI经镍亲和柱纯化后的电泳图;其中:1:上样流出液;2:5mM咪唑;3-8:400mM咪唑;M:蛋白Marker。图5为本发明实施例12中NotI经阴离子交换层析住纯化后的电泳图;其中:1:上样流出液;2:250mMNaCl;3:300mMNaCl;4:500mMNaCl;5:700mMNaCl;6:1MNaCl;M:蛋白Marker。图6为本发明实施例12中NotI酶活力检测电泳图;其中:1:NotI原液稀释120倍;2:NotI原液稀释240倍;3:NotI原液稀释480倍;4:NotI原液稀释960倍;5:NotI原液稀释1920倍;6:NotI原液稀释3840倍;7:DNAMarker。图7为本发明实施例12中NotI星号活性及非特异性DNA酶污染检测电泳图;其中:1-6为NotI酶切底物1h的电泳图,7-12为NotI酶切底物16h的电泳图;1、7:NotI原液稀释120倍;2、8:NotI原液稀释240倍;3、9:NotI原液稀释480倍;4、10:NotI原液稀释960倍;5、11:NotI原液稀释1920倍;6、12:NotI原液稀释3840倍;M:Marker。图8为本发明实施例12中酶切-连接-再酶切检测电泳图;其中:1:底物Commonfragment片段;2:NotI酶切Commonfragment;3:T4DNA连接酶连接后片段;4:NotI再次酶切连接片段;M:DNAMarker。具体实施方式以下参照附图,进一步描述本发明的具体技术方案,以便于本领域的技术人员进一步地理解本发明,而不构成对其权利的限制。实施例1,一种利用甲基化酶的保护高效重组表达限制性内切酶的方法,所述的甲基化酶是M.SssI,所述的限制性内切酶D选自:AatII、AciI、AclI、AfeI、AgeI、AscI、AsiSI、AvaI、BceAI、BmgBI、BsaAI、BsaHI、BsiEI、BsiWI、BsmBI、BspDI、BspEI、BsrFI、BssHII、BstBI、BstUI、BtgZI、ClaI、EagI、FauI、FseI、FspI、HaeII、HgaI、HhaI、HinP1I、HpaII、Hpy99I、HpyCH4IV、KasI、MluI、NaeI、NarI、NgoMIV、NotI、NruI、Nt.BsmAI、Nt.CviPII、PaeR7I、PluTI、PmlI、PvuI、RsrII、SacII、SalI、SfoI、SgrAI、SmaI、SnaBI、TliI、TspMI、XhoI、XmaI、ZraI。实施例2,实施例1所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法,包括:步骤(一):将M.SssI基因克隆至质粒载体pACYC184上,得到M.SssI组成型质粒,转化宿主菌,筛选获得被甲基化保护的阳性重组菌株;步骤(二):将所述限制性内切酶D的基因克隆至质粒载体pET-28b上,得到限制性内切酶D重组质粒,转化步骤(一)得到的已被甲基化保护的阳性重组菌,筛选稳定、可诱导、高表达的限制性内切酶D的重组表达菌株。实施例3,实施例2所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法中,所述的宿主菌为原核宿主细胞。实施例4,实施例2或3所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法中,所述的宿主菌为大肠杆菌。实施例5,实施例2所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法中,步骤(一)和步骤(二)分别包括:步骤(一):设计引物,根据设计的引物PCR扩增M.SssI基因,M.SssI的PCR产物经纯化、酶切后连接至质粒载体pACYC184上,连接产物转化至大肠杆菌DH5α感受态细胞中,经细胞培养后提取质粒,经测序获得M.SssI的组成型质粒pACYC184-M.SssI,将pACYC184-M.SssI转化大肠杆菌ER2566感受态细胞后,涂布于含氯霉素的LB平板上筛选克隆,获得M.SssI组成型表达菌株ER2566-M.SssI;步骤(二):(1)限制性内切酶D重组表达菌株的构建设计引物,根据设计的引物PCR扩增限制性内切酶D基因,限制性内切酶D的PCR产物经纯化、酶切后连接至质粒载体pET-28b上,限制性内切酶D基因的插入部位处于T7启动子后,经测序获得限制性内切酶D的重组质粒pET-D,将pET-D转化至ER2566-M.SssI感受态细胞后,涂布于含氯霉素及卡那霉素的LB平板上筛选克隆,获得限制性内切酶D的重组表达菌株ER2566-M.SssI-D;(2)限制性内切酶D的诱导表达将ER2566-M.SssI-D涂布于含氯霉素及卡那霉素的LB平板上,培养并挑取单菌落接种于含氯霉素及卡那霉素的LB培养液中,摇动培养一段时间,加入IPTG诱导表达限制性内切酶D;(3)限制性内切酶D的纯化(a)取经IPTG诱导后的ER2566-M.SssI-D菌培养液,离心收集菌体;(b)菌体以Ni柱结合缓冲液重悬后破碎处理,离心取上清粗蛋白溶液过Ni亲和层析纯化柱,分步收集,将纯度和浓度较高的收集样混合、透析;(c)取步骤(b)中透析后的收集样过阴离子交换层析柱,梯度洗脱,分步收集,将纯度和浓度较高的收集样混合、透析、贮存。实施例6,实施例5所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(一)中:设计引物时,根据NCBI数据库上螺原体属菌株MQ1的M.SssI基因序列设计一对引物,在上游引物5’端引入大肠杆菌组成型表达启动子E.colipltlpromoter序列,在下游引物5’端引入大肠杆菌终止子E.colirrnBT1terminator的反向互补序列,在上、下游引物的5’端还分别引入HindIII酶切识别序列和保护碱基。实施例7,实施例5或6所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(一)中:所述的氯霉素的浓度为17.5μg/mL。实施例8,实施例5或6所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(一)中:所述的氯霉素的浓度为35μg/mL。实施例9,实施例5或6所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(一)中:所述的氯霉素的浓度为70μg/mL。实施例10,实施例5—9任何一项所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(二)中,构建限制性内切酶D重组表达菌株时,所述的氯霉素和卡那霉素的浓度分别为17.5μg/mL、37.5μg/mL。实施例11,实施例5—9任何一项所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(二)中,构建限制性内切酶D重组表达菌株时,所述的氯霉素和卡那霉素的浓度分别为70μg/mL、150μg/mL。实施例12,实施例5—9任何一项所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(二)中,构建限制性内切酶D重组表达菌株时,所述的氯霉素和卡那霉素的浓度分别为35μg/mL、75μg/mL。实施例13,实施例5—12任何一项所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(二)中,诱导表达限制性内切酶D时,将ER2566-M.SssI-D接种于含17.5μg/mL氯霉素和150μg/mL卡那霉素的LB培养基中培养并挑取单菌落,再按5%的接种量接种于含17.5μg/mL氯霉素和37.5μg/mL卡那霉素的LB培养液中,于37℃摇动培养,至菌密度达到3×108/mL时,加入IPTG至终浓度为0.2mM,并在15℃以200rpm摇动培养12h,诱导表达限制性内切酶D。实施例14,实施例5—12任何一项所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(二)中,诱导表达限制性内切酶D时,将ER2566-M.SssI-D接种于含35μg/mL氯霉素和75μg/mL卡那霉素的LB培养基中培养并挑取单菌落,再按2%的接种量接种于含35μg/mL氯霉素和75μg/mL卡那霉素的LB培养液中,于37℃摇动培养,至菌密度达到3.5×108/mL时,加入IPTG至终浓度为0.5mM,并在16℃以250rpm摇动培养16h,诱导表达限制性内切酶D。实施例15,实施例5—12任何一项所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(二)中,诱导表达限制性内切酶D时,将ER2566-M.SssI-D接种于含70μg/mL氯霉素和150μg/mL卡那霉素的LB培养基中培养并挑取单菌落,再按3%的接种量接种于含70μg/mL氯霉素和150μg/mL卡那霉素的LB培养液中,于37℃摇动培养,至菌密度达到4×108/mL时,加入IPTG至终浓度为0.3mM,并在18℃以230rpm摇动培养18h,诱导表达限制性内切酶D。实施例16,实施例5—15任何一项所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法的步骤(二)中,纯化限制性内切酶D时:(a)取经IPTG诱导后的ER2566-M.SssI-D培养液,以8000g离心10min收集菌体;(b)菌体由Ni柱结合缓冲液重悬后用细胞高压破碎仪破碎处理,43000g低温离心30min弃去沉淀,得到上清粗蛋白溶液,上清粗蛋白溶液过Ni亲和层析纯化柱,分步收集,将纯度和浓度较高的收集样混合、透析;所述的Ni柱结合缓冲液的组成如下:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,5mM咪唑;其中,在Ni亲和层析过程中使用的缓冲液及其组成分别为:平衡缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,5mM咪唑;漂洗缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,20mM咪唑;洗脱缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,400mM咪唑;(c)在阴离子交换层析过程中使用的缓冲液和梯度洗脱液分别为:平衡缓冲液:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA,1mMDTT;梯度洗脱液包括:10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,300mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,500mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,700mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA;10mMTris-HClpH7.4,1MNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA。实施例17,实验例,本实施例以限制性内切酶NotI为例来描述本发明所述的利用甲基化酶的保护高效重组表达限制性内切酶的方法。1、材料1.1菌株与质粒螺原体属菌株MQ1(Spiroplasmasp.strainMQ1)、豚鼠耳炎诺卡菌(Nocardiaotitidiscaviarum)菌株和大肠杆菌ER2566:购自美国菌种保藏中心(ATCC);pET-28b、pACYC184和pUC19:购自武汉淼灵生物有限公司;活性测定底物N85质粒(其上有两个NotI酶切位点,相距860bp)和共同片段(Commonfragment)(大小为864bp的DNA片段,核苷酸序列见SEQIDNO.1):购自江苏愚公生命科技有限公司。1.2仪器与试剂细胞高压破碎仪:购自广州聚能纳米生物科技股份有限公司;蛋白分子量标准和核酸分子量标准:购自金斯瑞生物科技有限公司;限制性内切酶、KOD高保真DNA聚合酶、T4DNA连接酶和1×CutOneBuffer(51mM乙酸钾(PotassiumAcetate)、22mM三(羟甲基)氨基甲烷-乙酸(Tris-Acetate)、10mM镁离子(Magnesium)、0.1mg/mLBSA、pH8.0@25°C):购自江苏愚公生命科技有限公司;Ni亲和层析纯化柱(ToyopearlAF-Chelate-650M)和阴离子交换层析柱(ToyopearlGigaCapQ-650M):购自日本TosohCorporation;B-PER细菌蛋白提试剂:购自赛默飞世尔科技公司;其余试剂均为国产分析纯。2、M.SssI组成型质粒的构建2.1M.SssI目的基因的PCR扩增根据NCBI数据库上螺原体属菌株MQ1的M.SssI基因序列(GenBank:X17195.1)设计一对引物,在上游引物5’端引入大肠杆菌组成型表达启动子E.colipltlpromoter序列,在下游引物5’端引入大肠杆菌终止子E.colirrnBT1terminator的反向互补序列,在上、下游引物的5’端还分别引入HindIII酶切识别序列和保护碱基:M.SssI-F:5’-CGATAAGCTTTAATCATCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGACCATGAGTAAAGTTGAAAATAA-3’(下划线部分为HindIII识别序列);M.SssI-R:5’-ATTAAAGCTTGGCGGATTTGTCCTACTCAGGAGAGCGTTCACCGACAAACAACAGATAAAACGAAAGGCCCAGTCTTTCGACTGAGCCTTTCGTTTTATTTGATGCCTTTAACCGCCGATTTTATCGATGA-3’(下划线部分为HindIII识别序列)。将螺原体属菌株MQ1平板培养菌落,再以去离子水重悬后,95℃温育10min,作为PCR模板,用上述引物PCR扩增M.SssI基因,PCR扩增反应使用了KOD高保真DNA聚合酶。2.2构建M.SssI组成型表达质粒M.SssI的PCR产物纯化后经HindIII酶切,酶切产物用T4连接酶连接至由HindIII酶切后的pACYC184载体上,连接产物通过化学转化法转化进入大肠杆菌DH5α感受态细胞中,经细胞培养以及碱裂解法抽提质粒,测序得M.SssI组成型表达质粒pACYC184-M.SssI(见附图1)。3、M.SssI组成型表达菌株的构建将pACYC184-M.SssI以化学转化法转化至大肠杆菌ER2566感受态细胞中,涂布于含35μg/mL氯霉素的LB平板上筛选克隆,获得M.SssI组成型表达菌株ER2566-M.SssI。4、NotI重组表达菌株的构建4.1NotI基因的PCR扩增根据NCBI数据库上豚鼠耳炎诺卡菌菌株的NotI基因序列(GenBank:ABC87270.1)设计一对引物,在上游引物的5’端引入BamHI酶切识别序列和保护碱基,在下游引物的5’端引入XhoI酶切识别序列和保护碱基,上游引物设计为NotI基因的表达框与载体上的N-端6xHis纯化标签的表达框一致:NotI-F:5’-CCGCGGATCCATGCGTAGCGATACCAGCGT-3’(下划线部分为BamHI识别序列);NotI-R:5’-TATGCTCGAGTTATGCATCGAACAGGCCGCGTT-3’(下划线部分为XhoI识别序列)。将豚鼠耳炎诺卡菌菌株平板培养菌落以去离子水重悬后,95℃温育10min,作为PCR模板,用上述引物PCR扩增NotI基因,PCR扩增反应使用了KOD高保真DNA聚合酶。4.2表达NotI的重组菌的构建NotI的PCR产物纯化后用BamHI和XhoI双酶切,酶切产物用T4连接酶连接至由BamHI和XhoI双酶切后的pET-28b载体上,NotI基因DNA的插入部位处于T7启动子后,经测序获得NotI重组质粒pET-NotI(见附图2)。通过化学转化法将pET-NotI转化至ER2566-M.SssI感受态细胞后,涂布于含35μg/mL氯霉素和75μg/mL卡那霉素的LB平板上筛选克隆,获得NotI的重组表达菌株ER2566-M.SssI-NotI,ER2566-M.SssI-NotI中含有pACYC184-M.SssI和pET-NotI。5、NotI的诱导表达将ER2566-M.SssI-NotI接种于含35μg/mL氯霉素和75μg/mL卡那霉素的LB培养基中培养并挑取单菌落,再按2%的接种量接种于含35μg/mL氯霉素和75μg/mL卡那霉素的LB培养液中,于37℃摇动培养,至菌密度达到3.5×108/mL时,加入诱导剂IPTG至0.5mM终浓度,并在16℃下以250rpm摇动培养16h,诱导表达NotI,并进行琼脂糖凝胶电泳检测,检测过程如下:首先,对pET-28b进行修饰:在pET-28b原始质粒上插入一段带有NotI酶切位点的序列,形成带有两个NotI酶切位点的质粒,两个NotI酶切位点相距860bp,将经过修饰的pET-28b质粒命名为N85质粒,该质粒经过NotI完全酶切可以形成大小分别为860bp、5.5kb的2条特异性酶切条带;再取1mL诱导后的培养液,以12000g离心1min收集菌体,用B-PER细菌蛋白提取试剂对菌体总蛋白进行提取,取1-3μL细菌蛋白粗提液,在1×CutOneBuffer缓冲条件下、10μL反应体系中,与N85质粒在37℃温育15min,然后使用1%琼脂糖凝胶电泳检测N85质粒被细菌蛋白粗提液消化的情况(见附图3)。由结果可知,N85质粒被细菌蛋白粗提液消化后形成了限制酶NotI的特异性酶切条带,即大小分别为860bp和5467bp的片段,与理论值一致,表明细菌蛋白粗提液具有限制酶NotI的活性,限制酶NotI的重组表达成功。6、NotI的纯化取适量经IPTG诱导后的ER2566-M.SssI-NotI菌培养液,培养液以8000g离心10min收集菌体。菌体以Ni柱结合缓冲液(10mMTris-HClpH7.4,250mMNaCl,5%甘油,0.15%TritonX-100,5mM咪唑)充分重悬后,以细胞高压破碎仪破碎,再以43000g低温离心30min取上清可溶组分过Ni亲和层析纯化柱,分步收集,将单管收集的洗脱液进行SDS-PAGE电泳检测(见附图4)。其中,Ni亲和层析过程中使用的缓冲液包括:平衡缓冲液(10mMTris-HClpH7.4@25℃,250mMNaCl,5%甘油,0.15%TritonX-100,5mM咪唑)、漂洗缓冲液(10mMTris-HClpH7.4@25℃,250mMNacl,5%甘油,0.15%TritonX-100,20mM咪唑)和洗脱缓冲液(10mMTris-HClpH7.4@25℃,250mMNacl,5%甘油,0.15%TritonX-100,400mM咪唑)。结果表明,泳道4-8的蛋白量要普遍高于其他泳道,因此选取这几管混合、透析,过阴离子交换层析柱进行进一步纯化,梯度洗脱,分步收集,对不同浓度洗脱液洗脱到的样液进行SDS-PAGE电泳检测(见附图5)。其中,阴离子交换层析过程中使用的缓冲液包括:平衡缓冲液(10mMTris-HclPH7.4@25℃,250mMNaCl,5%甘油,0.15%TritonX-100,0.1mMEDTA,1mMDTT)和梯度洗脱液(10mMTris-HClpH7.4@25℃,5%甘油,0.15%TritonX-100,0.1mMEDTA,1mMDTT及NaCl,其中,NaCl的浓度自250mM→300mM→500mM→700mM→1M,呈梯度变化)。由结果可知,通过含250mMNaCl和300mMNaCl的洗脱液洗脱得到的样液中蛋白含量和纯度要高于其他浓度洗脱得到的样液,将这两种浓度的洗脱液洗脱下的样液合并后,透析至贮存缓冲液(10mMTris-HClpH7.4,250mMNaCl,50%甘油,0.15%TritonX-100,0.1mMEDTA,1mMDTT),并添加BSA至终浓度200μg/mL,保存于-20℃,得到NotI原液,同时,整个纯化过程在4℃或冰浴上进行。7、NotI的酶活性检测限制性内切酶NotI的酶活定义为:37℃下,在20μL反应体系中,1μL酶能够在15min内完全消化1μgN85DNA。对NotI原液进行梯度稀释后,在1×CutOneBuffer缓冲条件下、20μL反应体系中,与N85DNA在37℃温育15min,然后以1%琼脂糖凝胶电泳检测N85DNA的酶切情况(见附图6)。由检测结果可知,根据本发明方法纯化获得的限制性内切酶NotI具有良好的酶切活力,比活力为872000U/mg,产率为960000U/L诱导菌液。8、限制性内切酶NotI的质量检测8.1星号活性/非特异性DNA酶污染检测对NotI原液进行梯度稀释后,在1×CutOneBuffer缓冲条件下、10μL反应体系中,与N85DNA在37℃温育15min、60min及16h,然后以1%琼脂糖凝胶电泳检测N85DNA的酶切情况(见附图7)。结果显示,超过量(16U)酶切、超长时间(16h)酶切均未观察到N85DNA产生非特异性降解条带,说明测试的酶中不存在非特异性的DNA酶,表明根据本实施例生产的酶合格。8.2酶切-连接-再酶切检测20倍酶量的NotI在1×CutOneBuffer缓冲条件下、20μL反应体系中,与底物Commonfragment(见SEQIDNO.1)在37℃温育15min获得酶切片段,将这些片段用T4DNA连接酶连接,所得连接产物超过95%可以被限制性内切酶NotI再次切开,再酶切结果中无杂带、无拖尾,表明本实施例所提纯的NotI完全达到了限制性内切酶的分子生物学实验要求(见附图8),8.3蓝白斑筛选鉴定使用10倍酶量的NotI线性化pUC19载体后,连接并转化该载体进入表达LacZbetafragment的大肠杆菌感受态细胞中,并涂X-Gal/IPTG/Amp平板,结果见表1。在蓝白斑鉴定中,本发明实施例生产的限制性内切酶产生的白斑(白色菌落)比例仅为0.2%,结果合格。表1.蓝白斑筛选鉴定数据统计表酶量白斑数总斑数白斑比例蓝斑背景10U36187710.2%2250SEQUENCELISTING<110>淮海工学院<120>一种利用甲基化酶的保护高效重组表达限制性内切酶的方法<130>1<160>1<170>PatentInversion3.5<210>1<211>894<212>DNA<213>人工序列<400>1ggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgtt60atcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccg120cagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacg180caaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcc240cgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggc300accccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggata360acaatttcacacaggaaacagctatgaccatgattacgccaagcttgcatgcgcggccgc420tgcaggctagcgtcgactctagagatatcccatggggatccccgggtacccatatggagc480tcctcgaggaattctcactggccgtcgttttacaacgtcgtgactgggaaaaccctggcg540ttacccaacttaatcgccttgcagcacatccccctttcgccagctggcgtaatagcgaag600aggcccgcaccgatcgcccttcccaacagttgcgcagcctgaatggcgaatggcgcctga660tgcggtattttctccttacgcatctgtgcggtatttcacaccgcatttggtgcactctca720gtacaatctgctctgatgccgcatagttaagccagccccgacacccgccaacacccgctg780acgcgccctgaccaggtcgggcttgtctgctcccggcatccgcttacagacaagctgtga840ccgtctccgggagctgcatgtgtcagaggttttcaccgtcatcaccgaaacgcg894当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种新的多肽——dna甲基化酶13和编码这种多肽的多核苷酸的制作方法
- 具有治疗活性的环亚甲基-1,2-二羧酸酰胺,制备它们的方法和含它们的药物组合物的制作方法
- 组蛋白去乙酰化酶抑制剂的制作方法
- 基于dna聚合酶链反应的甲基化dna检测方法
- 检测Cre位点特异重组酶活性的转基因报告猪及培养方法
- 一种多肽——人含胞嘧啶特异性dna甲基化酶特征性序列片段的蛋白-9.35和编码这种 ...的制作方法
- 一种多肽——脱氧核糖核酸甲基化酶-9.35和编码这种多肽的多核苷酸的制作方法
- 利用酶活性的竞争性干扰和恢复检测被分析物的制作方法
- 一种基于化学发光反应的甲基化酶检测探针、检测试剂盒及检测方法
- 编码甲基化儿茶素生物合成酶的基因的制作方法