基因修饰的间充质干细胞及其用于生产BsAb抗体的方法与流程
本发明是关于一种基因修饰的间充质干细胞及其用于生产BsAb抗体的方法,具体而言,本发明涉及基因修饰的间充质干细胞、其制备方法、以及通过基因修饰间充质干细胞生产双特异性单链抗体的方法。
背景技术:
人体的免疫系统中,细胞毒性T淋巴细胞(Cytotoxic T Lymphocyte,CTL)和杀伤性T细胞(Cytokine induced killer)扮演着重要的角色,它们拥有T细胞受体(T cell receptor,TCR),能够对表达目标抗原的细胞进行特异识别与结合,并分泌穿孔素和颗粒酶,从而杀灭病原靶细胞。但是,癌细胞等病变区域常表现为抗原表达缺陷、缺少免疫粘附分子和共刺激分子等物质,使得机体免疫识别功能“丧失”。近年来,依照基因重组方法构建的双靶向抗体(Bispecificantibody,BsAb),能够同时与T细胞和癌细胞特异性抗原结合,并激活T细胞免疫机制,实现“双靶向抗体介导T细胞重新定向的抗癌效应作用”(Anticancer effectors of BsAb-Retargeting T cell)。这种BsAb抗体协助功能性T细胞重新定位病变靶点,恢复了自体免疫功能。
目前临床治疗中,所使用的BsAb抗体主要通过体外基因工程生产,经蛋白纯化后由人体静脉注射,最终只能依靠血液循环将BsAb抗体递送到靶区域。这种方法获取的BsAb抗体极易在温度变化下失活、并且该治疗方法费用昂贵;同时,BsAb抗体半衰期较短,因此降低了与靶细胞的接触概率,以至于无法形成理想的治疗效果。
另一方面,应用干细胞产生细胞因子和蛋白已有相关报道。目前,对干细胞的基因修饰方法中大部分都选用病毒载体,如慢病毒、腺病毒、逆转录病毒。病毒载体转染虽然能提高干细胞基因修饰的效率,但由于病毒的安全性问题,使得这种方法存在一定的局限性,如对操作环境的要求严格,如感染后病毒基因可能随机整合到细胞基因组,从而破坏细胞基因组,造成致癌风险,况且病毒载体应用于动物体内其转染效率是不高的,因为机体本身会启动沉默病毒功能的机制。此外,现有的应用干细胞进 行基因转染产生细胞因子和蛋白的研究方法所产生的蛋白和功能因子分子量相对较低,并且多见于应用核糖核酸类(RNA)如mRNA作为基因载体。
目前尚未见到应用干细胞生产分子量较大的双特异性单链抗体的类似报道。
技术实现要素:
本发明的主要目的是应用间充质干细胞创建生物活性载体,提供一种基因修饰的间充质干细胞及其制备方法与用于生产BsAb抗体的方法,从而进一步可利用间充质干细胞的生物学特性迁移至治疗区域,通过细胞自身分泌BsAb抗体进而提高免疫治疗效果。
间充质干细胞(Mesenchymal Stem Cell,MSC)来源于间质组织,具备多向分化、免疫调节和自我复制更新功能。并且,在外界因素作用下,表现出趋向损伤和癌变病变组织的定向迁移能力(归巢性能)。本发明通过对间充质干细胞进行基因修饰,将干细胞构建成BsAb抗体的“生产工厂”和靶向性递送系统,借助干细胞实现将抗体递送至病变区域,完成针对如癌症等疾病的干细胞介导的细胞免疫治疗(Stem-cell Driven Cancer-targeted Immunotherapy)。
一方面,本发明提供了一种基因修饰的间充质干细胞,其是利用携带BsAb抗体基因的非病毒载体转染间充质干细胞而得到的。该基因修饰的间充质干细胞能够有效分泌双特异性单链抗体。
根据本发明的具体实施方案,本发明中,所述间充质干细胞可以来源于脂肪、脐带、胎盘、骨髓、子宫内膜或牙髓等。
根据本发明的具体实施方案,本发明中,是利用非病毒类基因载体承载BsAb抗体基因,这些非病毒载体可以选自质粒DNA(Plasmid DNA,下文缩写为DNA)或微环质粒DNA(Minicircle Plasmid DNA,下文缩写为MCDNA)等。
根据本发明的具体实施方案,本发明中,所述BsAb抗体可以选自antiCD19×antiCD3、antiCD20×antiCD3、antiEGFR×antiCD3、antiGPC3×antiCD3、antiEpCAM×antiCD3、anticMet×antiCD3、antiEGFRvIII×antiCD3、antiIGF1R×antiCD3、antiCD44v6×antiCD3或antiPDL-1×antiCD3等。不限于以上所述的序列模式,同样适用于antiCD3×anti“靶点”的序列模式。
另一方面,本发明还提供了所述的基因修饰的间充质干细胞的制备方法,该方法包括:
将携带BsAb抗体基因的非病毒载体转染至间充质干细胞,完成对间充质干细胞的基因修饰,得到基因修饰的间充质干细胞。
根据本发明的具体实施方案,本发明中,是利用化学转染试剂的化学转染方法、或电穿孔转染方法实现针对干细胞的基因修饰。具体而言,所述化学转染试剂可以包括:脂质体转染试剂(如Invitrogen公司的Lipofectamine2000转染试剂),聚阳离子转染试剂(如聚乙烯亚胺、聚氨基酯、壳聚糖等),或是无机纳米颗粒转染试剂、有机纳米颗粒转染试剂、或无机有机杂化纳米颗粒转染试剂(如磁性纳米颗粒、磷酸盐纳米颗粒等)。所述电穿孔转染方法可以为常规电转仪操作方法。
另一方面,本发明还提供了所述的基因修饰的间充质干细胞用于生产BsAb抗体中的应用。
另一方面,本发明还提供了一种生产BsAb抗体的方法,该方法包括:
培养本发明所述的基因修饰的间充质干细胞以分泌表达双特异性单链抗体。具体地,所述培养条件为37℃、5%CO2静置培养。其中优选的培养基为含10%胎牛血清的DMEM/F12培养基。采用本发明的方法,通常在培养72-96小时或更长的时间内可持续表达双特异性单链抗体,在一定程度上实现了BsAb的持续供给。
根据本发明的具体实施方案,本发明的生产BsAb抗体的方法还包括将携带BsAb抗体基因的非病毒载体转染至间充质干细胞完成对间充质干细胞的基因修饰的过程。如前所述,可以是利用化学转染试剂的化学转染方法、或电穿孔转染方法实现针对干细胞的基因修饰。所述化学转染试剂可以包括:脂质体转染试剂(如Invitrogen公司的Lipofectamine2000转染试剂),聚阳离子转染试剂(如聚乙烯亚胺、聚氨基酯、壳聚糖等),或是无机纳米颗粒转染试剂、有机纳米颗粒转染试剂、或无机有机杂化纳米颗粒转染试剂(如磁性纳米颗粒、磷酸盐纳米颗粒等)。所述电穿孔转染方法可以为常规电转仪操作方法。
根据本发明的更具体实施方案,本发明的生产BsAb抗体的方法可以按照下述方法中的任意一种进行:
方法一:将具有抗体表达基因的质粒DNA或微环MCDNA 4μg加入至适量的opti-MEM培养基中,终体积为100μl,静置5min;同时Lipofectamine2000基因转染试剂 (Invitrogen公司)10μl加入至适量的opti-MEM培养基中,终体积为100μl,静置5min后,用移液器将质粒溶液和转染试剂溶液轻柔上下吹吸混合,室温放置30min,制成Lipofectamine2000基因载体复合物。将间充质干细胞以每孔5×105个/ml的密度接种于6孔板中(每孔5×105个细胞),用含10%胎牛血清的DMEM/F12培养基常规培养,细胞融合至70%,更换opti-MEM培养基800ul/孔,然后每孔加入200μl基因载体复合物。在37℃、5%CO2条件下孵育4小时后,用含10%胎牛血清的DMEM/F12培养基换液,继续培养。
方法二:将具有抗体表达基因的质粒DNA或微环MCDNA 4μg加入至适量的opti-MEM培养基中,终体积为100μl,静置5min;同时取适量的聚阳离子纳米颗粒,如ε-己内酯修饰的改性聚乙烯亚胺(专利申请号201310390436.1),溶解于opti-MEM培养基中,终体积为100μl配制成转染剂溶液,静置5min后,用移液器将质粒溶液和转染试剂溶液轻柔上下吹吸混合,室温放置30min,制成纳米复合物。将人脐带来源的间充质干细胞以每孔5×105个/ml的密度接种于6孔板中(每孔5×105个细胞),用含10%胎牛血清的DMEM/F12培养基培养,细胞融合至70%,更换为opti-MEM培养基800μl/孔,然后每孔加入200μl纳米复合物。在37℃、5%CO2条件下孵育4小时后,用含10%胎牛血清的DMEM/F12培养基换液,继续培养。
方法三:将18μl Supplement溶液[P3Primary Cell 4D-NucleofectorTM X Kit,Lonza公司]与82μl NucleofectorTM溶液[P3Primary Cell 4D-NucleofectorTM X Kit,Lonza公司]充分混匀,构成电转液(100μl体系/电转杯);用胰酶消化间充质干细胞,使其从培养皿壁上脱落下来,离心(1000rpm,5min),弃去上清,用100μl电转液将间充质干细胞重新悬浮,使其密度达到1×107个/ml;向100ul间充质干细胞重悬液中加入6μg具有抗体表达基因的质粒DNA或微环MCDNA,用移液枪轻轻混匀,使细胞同质粒充分混匀;将混合液加入到电转杯中,使用Lonza公司生产的AmaxaTM4D-NucleofectorTM细胞核转染仪,选取转染仪U-023程序进行电转;电转结束后,将提前预热的细胞培养液加入电转杯中,静置5min,用吸管轻轻吸出,加入到6孔盘培养皿中于37℃、5%CO2培养箱中静置培养,24小时后用含10%胎牛血清的DMEM/F12培养基更换,继续培养。
采用本发明的方法,应用干细胞作为BsAb抗体生产工厂,可在较长时期内持续分泌表达BsAb抗体。
综上所述,本发明中,主要是利用携带BsAb抗体基因的非病毒载体,借助化学转染试剂及电转染方法,完成对间充质干细胞的基因修饰,将干细胞构建成BsAb抗体的“生产工厂”和递送系统与分泌系统,本发明与现有BsAb的临床应用技术相比,其有益效果主要表现为:
(1)现有临床应用中BsAb抗体主要通过基因工程生产,为防止免疫热源等有毒物质的危害必须经蛋白纯化后注入体内,并且BsAb抗体极易在温度变化下失活因此增加了保存难度。而本发明应用干细胞作为BsAb抗体生产工厂,可以将被转染干细胞注射,减少了纯化环节;
(2)临床应用中BsAb抗体只能依靠血液循环将BsAb抗体递送到靶区域,然而现有研究表明肿瘤等病灶的微环境十分复杂,如实体肿瘤常表现出瘤内的内部高压,这使得体液中的抗体难以进入病灶区域。而本发明将干细胞作为BsAb抗体生产工厂,利用间充质干细胞对肿瘤等病灶的主动趋化归巢迁移行为,到达目标区域,实现BsAb抗体的递送;
(3)BsAb抗体体内半衰期较短(小于12小时),因此降低了与靶细胞的接触概率,以至于无法形成理想的治疗效果;而本发明应用干细胞作为BsAb抗体生产工厂,可以在一定时期内(试验检测72-96小时)持续表达,在一定程度上实现了BsAb的持续供给;
(4)本发明摒弃了常规的病毒载体,选用了非病毒基因载体来完成干细胞基因修饰,解决了体内应用可行性的问题;
(5)本发明中创新地使用了质粒DNA和微环MCDNA作为BsAb的基因载体对干细胞进行基因修饰,DNA质粒和微环MCDNA性质稳定,且微环MCDNA生物安全性高并且能持续稳定表达;
(6)本发明中借助干细胞实现抗体分泌,干细胞作为“生产工厂”产生分子量较大的双特异性单链抗体,生物效应持久,动员大量的免疫细胞完成对靶标的免疫攻击,并且干细胞能够归巢至肿瘤或病灶部位,从而可形成干细胞介导的细胞免疫治疗(Stem-cell Driven Cancer-targeted Immunotherapy)。
附图说明
图1为本发明的技术方案的流程示意图。
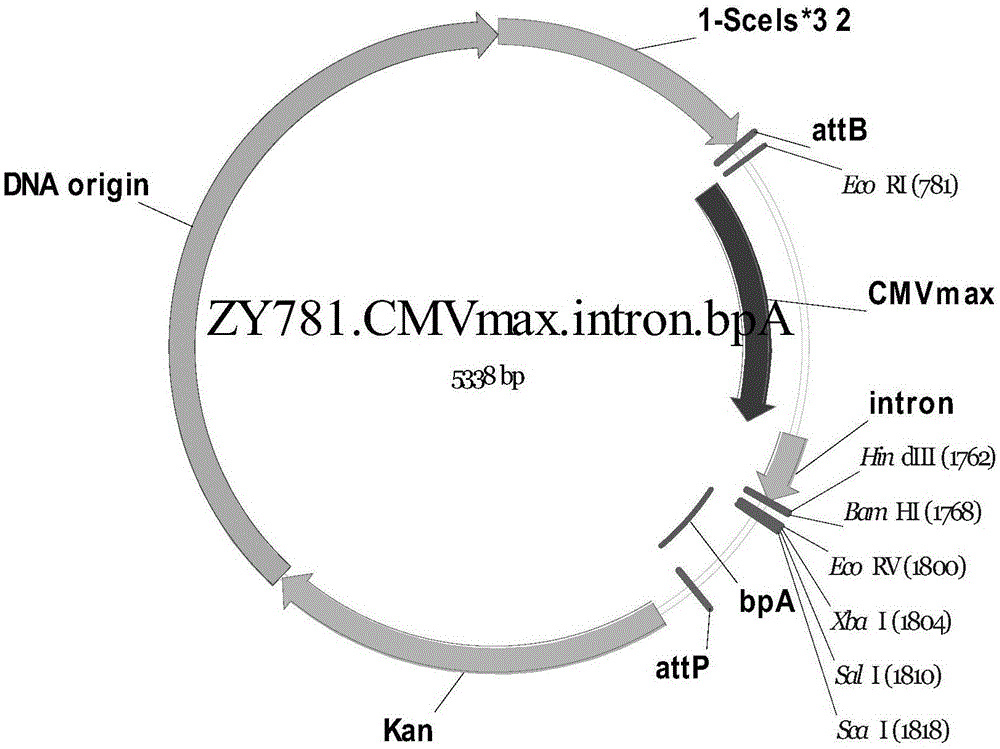
图2为本发明实施例1中所用载体SZ63.pMC.ZY781.CMVmax.intron.bpA基因图谱。
图3为本发明实施例1中改造后得到重组质粒SZ66.pMC.ZY781.CMVmax.intron.CD20Bite.bpA基因图谱。
图4为Lipofectamine2000/质粒DNA对人源脐带间充质干细胞转染96小时后,上清培养基中antiCD20×antiCD3 BsAb抗体的western blot检测结果。
图5为针对脐带间充质干细胞、骨髓间充质干细胞,应用Lipofectamine2000介导质粒DNA和微环MCDNA进行基因转染,转染96小时后,对上清培养基中antiCD20×antiCD3 BsAb抗体的western blot检测结果。
具体实施方式
为了更清楚地理解本发明的实质,下面通过具体实施例并配合附图进一步详细说明本发明,但本发明并不因此而受到任何限制。下列实施例中未注明具体条件的实验方法,通常按照所属领域的常规操作或按照制造厂商所建议的条件进行。
请参见图1所示,本发明的技术方案中,主要是利用化学试剂-基因转染方法、或是电穿孔转染方法,将携带BsAb抗体基因的非病毒载体转染至间充质干细胞,得到基因修饰的间充质干细胞,然后培养所述的基因修饰的间充质干细胞以分泌表达双特异性单链抗体。
实施例1、针对人脐带来源的间充质干细胞进行化学试剂转染
(1)制备Lipofectamine2000/DNA转染复合物
a、含有antiCD20×antiCD3抗体表达基因的质粒DNA的制备
本实施例中,先利用分子生物学方法将antiCD20×antiCD3基因序列(SEQ ID No.1,该序列是在人源化单抗anti-CD20序列的基础上改造而成双特异性单链抗体序列。antiCD20序列来源于:GA101(Obinutuzumab,罗氏Roche),antiCD3部分来源于专利US008076459)克隆到载体SZ63.pMC.ZY781.CMVmax.intron.bpA.(由中国科学院深圳先进技术研究院医药所基因与细胞治疗研究室提供,其详细谱图如图2所示,序列如SEQ ID No.2(人工序列)所示,其中药物筛选标记为卡那霉素Kanamycin),改造后得到重组质粒SZ66.pMC.ZY781.CMVmax.intron.CD20Bite.bpA(6880bp)如图3,该重组质粒即为含有antiCD20×antiCD3抗体表达基因质粒DNA antiCD20×antiCD3序列。具体制备过程如下:
利用上下游引物,其中PCR引物序列:(5’-3’)正向: GAGCTAGCGCTACCGGTCGCCACCATGGGATGGAGCTGTATC(SEQ ID No.3);反向:TGAGTCGACCTAATGATGATGGTGATGA(SEQ ID No.4)和含有目的基因序列模板(antiCD20×antiCD3序列:SEQ ID No.1)使用PCR(聚合酶链式反应)技术大量扩增该基因序列,而后利用TaKaRa胶回收试剂盒纯化回收得到较高纯度的目的基因;利用双酶切方法对载体SZ63.pMC.ZY781.CMVmax.intron.bpA及目的基因进行处理,在37℃条件下进行酶切,酶切位点为Nhe I和Sal I,酶切后利用TaKaRa胶回收试剂盒经过胶回收得到纯度较高的载体片段及目的基因片段;酶切后载体片段和目的基因序列,载体片段与目的基因片段按物质的量比1:3混匀,在16℃条件下借助TAKARA T4连接酶连接载体片段和目的基因;获得得到克隆重组质粒DNA;将连接得到克隆重组质粒DNA进行转化,10ul重组质粒轻轻加入到大肠杆菌感受态细胞,轻柔混匀,在冰上放置30分钟而后置于42℃条件下90秒钟,再置于冰上5分钟,加入500ul LB培养基混匀,置于37℃,220rpm条件下扩增1小时,最后涂在含有卡那霉素的LB培养板上,置于37℃培养箱中培养时间不超过16小时;而后,在LB培养板上挑取单克隆,按照质粒提取试剂盒方法,摇菌扩增并提取质粒,得到含有antiCD20×antiCD3抗体表达基因的质粒DNA,即图3所示重组质粒SZ66.pMC.ZY781.CMVmax.intron.CD20Bite.bpA(6880bp);
b、制备Lipofectamine2000/DNA转染复合物的制备
将具有antiCD20×antiCD3抗体表达基因的质粒DNA4μg加入至适量的opti-MEM培养基中,终体积为100μl,静置5min;同时Lipofectamine2000基因转染试剂(Invitrogen公司)10μl加入至适量的opti-MEM培养基中,终体积为100μl,静置5min后,用移液器将质粒溶液和转染试剂溶液轻柔上下吹吸混合,室温放置30min,制成Lipofectamine2000/质粒DNA复合物。
(2)针对人脐带来源的间充质干细胞的化学试剂转染
人脐带来源的间充质干细胞(深圳南山医院提供)以每孔5×105个/ml的密度接种于6孔板中(每孔5×105个细胞),用含10%胎牛血清的DMEM/F12培养基常规培养,细胞融合至70%,更换opti-MEM培养基800ul/孔,然后每孔加入200μl含有Lipofectamine2000/质粒DNA复合物。在37℃、5%CO2条件下孵育4小时后,用含10%胎牛血清的DMEM/F12培养基换液,继续培养96小时收集细胞上清培养液,4℃,10000rpm离心5min,取上清液保存于-80℃备用。
同时按照上述方法设定阴性对照组,应用含有eGFP(绿色荧光蛋白)表达基因的PMAX质粒(编号PMAX-eGFP,购置于Lonza公司)构建Lipofectamine2000/DNA转染复合物,对干细胞进行转染,96小时后采集的细胞的上清培养液成分,进行蛋白鉴定。
(3)对针对人脐带来源的间充质干细胞转染BsAb,对细胞的上清培养液中蛋白进行western blot检测。其步骤如下:
(A)SDS-PAGE凝胶配制,先制备分离胶,待胶凝固后,配制浓缩胶,按照下述
配方配制:
10%分离胶:
浓缩胶:
(B)制样及电泳
从-80℃冰箱取出细胞上清样品,4℃融化后,取100μl上清,加入25μl 5×SDS-loading buffer,混匀后100℃煮10min。冷却至室温,上样至加样孔内。80-120V电泳90min。
(C)转膜后封闭孵育抗体
PVDF用甲醇活化5min后,将胶和膜固定在bio-Rad的标准湿法转膜装置内,转膜电流为300mA,转膜时间1h。转膜完毕,将膜取出在TBST洗涤液中洗涤1min,加入至5%的脱脂奶粉中封闭1h。封闭完成后,用TBST洗涤3次,每次5min后,加入MonoclonalM2antibody(1:500,sigma-aldrich)一抗于4℃孵育过夜。次日,用TBST洗涤一抗3次,每次5min,加入Goat anti-mouse-HRP(1:3000,Abcam)二抗溶液,室温孵育1h,用TBST洗涤一抗5次,每次5min。
(D)ECL法检测蛋白
500μl Thermo Pierce ECL Western Blotting Substrate显影底物加至膜上,用凝胶成像仪捕捉化学发光条带,成像30s-2min。
检测结果如图4所示。应用ANTI-FLAG抗体(购置于Sigma-Aldrich公司)对蛋白进行识别。阳性对照组(Psitive control)为antiCD20×antiCD3 BsAb抗体标准品;阴性对照组(PMAX-eGFP),其为应用携带含有eGFP(绿色荧光蛋白)表达基因的PMAX质粒(购置于Lonza公司),构建Lipofectamine2000/DNA复合物针对干细胞转染,细胞培养上清液的蛋白鉴定。其中转染步骤与实施例1相同;实验组为将具有antiCD20×antiCD3表达基因的质粒DNA构建成Lipofectamine2000/DNA转染复合物针对间充质干细胞转染,细胞培养上清液的蛋白鉴定。结果显示干细胞表达的antiCD20×antiCD3 BsAb抗体与标准品出现在同一个条带位置,证实转染成功,干细胞可以分泌抗体。
实施例2、针对人脐带来源的间充质干细胞进行电转染
将18μl Supplement溶液[P3Primary Cell 4D-NucleofectorTM X Kit,Lonza公司]与82μl NucleofectorTM溶液[P3Primary Cell 4D-NucleofectorTM X Kit,Lonza公司]充分混匀,构成电转液(100μl体系/电转杯);用胰酶消化间充质干细胞(深圳南山医院提供),使其从培养皿壁上脱落下来,离心(1000rpm,5min),弃去上清,用100μl电转液将间充质干细胞重新悬浮,使其密度达到1×107个/ml;向100μl间充质干细胞重悬液中加入6μg具有antiCD20×antiCD3-BsAb抗体表达基因的质粒DNA质粒(质粒制备参见实施例1),用移液枪轻轻混匀,使细胞同质粒充分混匀;将混合液加入到电转杯中,使用Lonza公司生产的AmaxaTM4D-NucleofectorTM细胞核转染仪,选取转染仪U-023程序进行电转;电转结束后,将提前预热的细胞培养液加入电转杯中,静置5min,用吸管轻轻吸出,加入到6孔盘培养皿中于37℃、5%CO2培养箱中静置培养,24小时后用含10% 胎牛血清的DMEM/F12培养基更换,而后加入10%胎牛血清的DMEM/F12培养基,在37℃、5%CO2条件下继续培养96小时(期间不进行换液),而后收集细胞上清培养液,4℃,10000rpm离心5min,收集上清培养液进行蛋白鉴定。检测结果参见图5。
实施例3、针对人脐带来源的间充质干细胞进行纳米复合物介导转染
将具有antiCD20×antiCD3抗体表达基因的质粒DNA质粒(质粒制备参见实施例1)4μg加入至适量的opti-MEM培养基中,终体积为100μl,静置5min;同时取适量的ε-己内酯修饰的改性聚乙烯亚胺(专利申请号201310390436.1)溶解于opti-MEM培养基中,终体积为100μl配制成转染剂溶液,静置5min后,用移液器将质粒溶液和转染试剂溶液轻柔上下吹吸混合,室温放置30min,制成质粒DNA纳米复合物。
人脐带来源的间充质干细胞以每孔5×105个/ml的密度接种于6孔板中(每孔5×105个细胞),用含10%胎牛血清的DMEM/F12培养基培养,细胞融合至70%,更换weiopti-MEM培养基800ul/孔,然后每孔加入200μl含有质粒DNA纳米复合物。在37℃、5%CO2条件下孵育4小时后,用含10%胎牛血清的DMEM/F12培养基换液,而后在37℃、5%CO2、含10%胎牛血清的DMEM/F12培养基继续培养96小时(期间不进行换液),而后收集细胞上清培养液,4℃,10000rpm离心5min,收集上清培养液进行蛋白鉴定。检测结果参见图5。
实施例4、针对骨髓间充质干细胞进行微环DNA(MCDNA)和质粒DNA介导的基因转染
(1)制备Lipofectamine2000/MCDNA转染复合物
a、含有antiCD20×antiCD3抗体表达基因的MCDNA的制备
本实施例中所用的含有antiCD20×antiCD3抗体表达基因的MCDNA,为针对含有antiCD20×antiCD3抗体表达基因的质粒DNA经过诱导得到携有antiCD20×antiCD3抗体表达基因的MCDNA。其具体制备过程如下:
将常规方法成功构建的antiCD20×antiCD3抗体表达基因的质粒DNA的大肠杆菌(菌株名称DH5α,全式金公司)种加入2ml的TB培养基(含有卡那霉素50μg/ml),在37℃,250rpm条件下震荡培养,5小时后对其中1ml菌液按照质粒提取试剂盒方法进行质粒提取;
将上述质粒DNA的剩余大肠杆菌液100ul加入到400ml的TB培养基中(含有卡 那霉素50μg/ml),于37℃,250rpm条件下震荡培养过夜不超过16小时;
而后向400ml携带有上述质粒DNA的大肠杆菌液中加入微环诱导混合试剂(400ml LB培养基中含有1N NaOH,20%Arabinose,具体参见表1),再置于32℃,250rpm条件下振荡摇菌5-8小时;将菌液置于6000-rpm,4℃,离心10分钟,而后利用Qiagen质粒提取大提试剂盒进行质粒提取,最后获得含有antiCD20×antiCD3抗体表达基因的MCDNA。
表1、微环诱导混合试剂(ml)
b、Lipofectamine2000/MCDNA转染复合物的制备
将具有antiCD20×antiCD3抗体表达基因的质粒MCDNA4μg加入至适量的opti-MEM培养基中,终体积为100μl,静置5min;同时Lipofectamine2000基因转染试剂(Invitrogen公司)10μl加入至适量的opti-MEM培养基中,终体积为100μl,静置5min后,用移液器将质粒溶液和转染试剂溶液轻柔上下吹吸混合,室温放置30min,制成Lipofectamine2000/MCDNA转染复合物。
(2)针对人源骨髓间充质干细胞的化学试剂转染
人源骨髓间充质干细胞(深圳南山医院提供)以每孔5×105个/ml的密度接种于6孔板中(每孔5×105个细胞),用含10%胎牛血清的DMEM/F12培养基培养,细胞融合至70%,换opti-MEM培养基800ul/孔,然后,每孔加入200μl含有Lipofectamine2000/MCDNA的复合物。在37℃、5%CO2条件下孵育4小时后,用含10%胎牛血清的DMEM/F12培养基换液,继续培养96小时(期间不进行换液),而后收集细胞上清培养液,4℃,10000rpm离心5min,收集上清培养液进行western blot检测实验,检测结果参见图5。
参见图5所示,western blot检测结果,应用ANTI-FLAG抗体对蛋白进行识别。Western条带检测,从左至右分别为①阳性对照组antiCD20×antiCD3 BsAb抗体标准品;②应用Lipofectamine2000/DNA转染复合物,针对脐带间充质干细胞转染具有antiCD20×antiCD3抗体表达基因的质粒DNA,antiCD20×antiCD3 BsAb蛋白表达结果;③应用Lipofectamine2000/MCDNA转染复合物针对骨髓间充质干细胞转染具有 antiCD20×antiCD3抗体表达基因的质粒DNA,antiCD20×antiCD3 BsAb蛋白表达结果;④应用Lipofectamine2000/DNA转染复合物针对骨髓间充质干细胞转染具有antiCD20×antiCD3抗体表达基因的质粒DNA,96小时检测的细胞上清培养液中antiCD20×antiCD3 BsAb蛋白表达结果;⑤应用纳米DNA转染复合物针对骨髓间充质干细胞转染具有antiCD20×antiCD3抗体表达基因的质粒DNA,96小时检测的细胞上清培养液中antiCD20×antiCD3 BsAb蛋白表达结果。结果表明干细胞表达的antiCD20×antiCD3 BsAb抗体与标准品出现在同一个条带位置,证DNA和MCDNA在转染试剂和纳米粒子体系下转染成功,干细胞可以分泌抗体。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!