一种组合物、含有该组合物的诱导制剂及诱导方法与流程
本发明涉及细胞领域,特别涉及一种组合物、含有该组合物的诱导制剂及诱导方法。
背景技术:
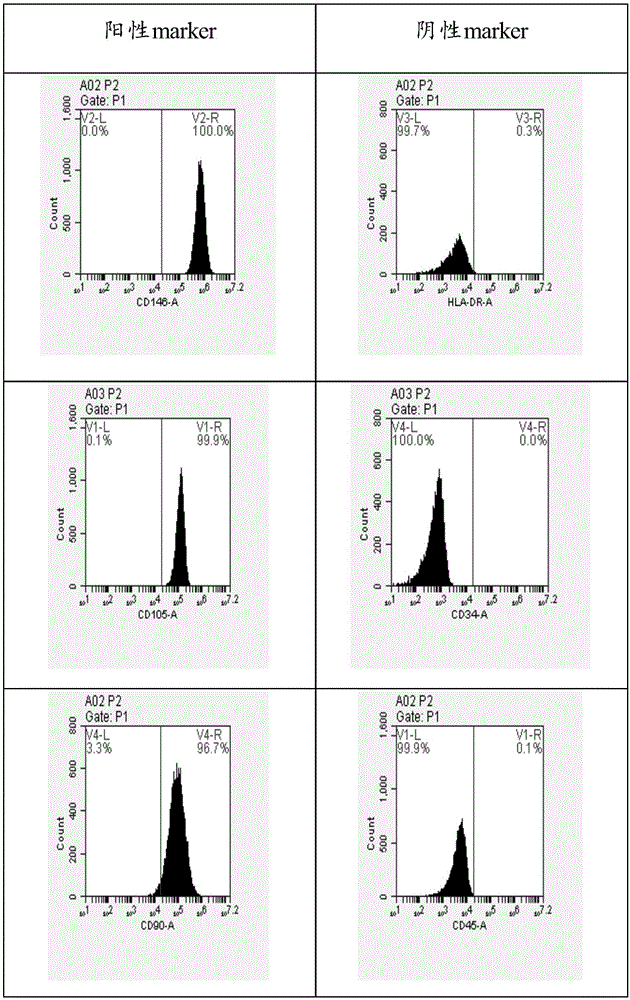
:心肌梗死是由于冠状动脉循环改变引起冠脉血流和心肌需求之间不平衡而导致的心肌损坏,是临床上一种严重的缺血性心脏病。坏死后的心肌细胞逐渐被瘫痕组织所取代,由于瘫痕组织缺乏弹性,难以满足心脏收舒功能的要求,为代偿损失心肌细胞的功能,心脏逐渐发生退行性左心室重塑,心功能下降,最终导致充血性心力衰竭,甚至猝死。临床药物和介入治疗虽可以改善症状,但却不能挽回受损的心肌细胞。心脏移植虽可以从根本上解决心室重构问题,但因为其供体受限,医疗费用太高而难以广泛应用。近年来的研究表明,心肌细胞也具有再生能力,在心肌梗死后,心肌细胞也可以发生分裂和增值,但是,由于其增值能力较弱,不能满足弥补丧失心肌细胞数量的要求而逆转心室重构过程。近年来随着干细胞技术和组织工程学研究的不断深入,干细胞移植治疗心肌梗死成为临床研究的热点。干细胞的多向分化潜能及可塑性使心肌梗死心肌细胞再生成为可能,在人体的微环境作用下,干细胞定向归巢至损伤处,可以多项分化成各种组织细胞及血管。目前用于心肌梗死治疗研究的干细胞主要有骨髓间充质干细胞、胚胎干细胞、脐带间充质干细胞、脂肪干细胞等。牙龈属于牙周组织,是附于牙齿周围的分隔下方牙周组织和外部空间的粘膜屏障。牙龈包括上皮和固有层两部分,从发育来源上,上皮来自原始口腔上皮,与口腔粘膜上皮相延续;固有层则发育自早期神经嵴细胞迁移形成的间充质,上皮与间充质不断相互作用,最终形成牙龈组织。牙龈组织的一个典型特点是具有较强的创伤愈合能力,表现为切除、损伤后能够无疤愈合,恢复牙龈外形。牙龈间充质干细胞(gingivalmesenchymalstemcells,GMSCs)是组成牙龈结缔组织的主要间充质细胞,来源于中胚层的纤维母细胞,不仅具有活跃的自我更新的能力,并且还具有合成和降解胶原等细胞外基质的功能:I型和Ⅲ型胶原、纤维粘连蛋白等。牙龈间充质干细胞取材方便、牙龈组织中细胞含量大、增值速度快,作为成体间充质干细胞中的一员,在体外使用合适的诱导剂同样具有分化为心肌样细胞的能力。牙龈间充质干细胞这种功能特性极大地吸引了来自基础医学和临床医学的研究者,给基础科学的研究者们提供了一种研究发展生物学的模式,牙龈间充质干细胞所具有的修复、替代和再生能力也为临床医学提供了一个发展新疗法的机会。目前对于GMSCs向心肌样细胞分化诱导的研究报道尚少。由于生物体是一个复杂的存在多诱导因素的有机体,因此在心肌组织再生的复杂微环境中,多种诱导因子在心肌组织再生的过程中可能会起到相互协同或拮抗的作用。因此,提供一种由两种诱导因子联合应用作用于GMSCs,有效的诱导GMSCs向心肌样细胞分化具有重要的现实意义。技术实现要素:有鉴于此,本发明提供一种组合物、含有该组合物的诱导制剂及诱导方法。该组合物能够有效地诱导GMSCs向心肌样细胞分化为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种组合物,包括5-氮杂胞苷、骨成形蛋白和血管紧张素II。5-氮杂胞苷(5-azacytidine,5-aza)是一种可改变基因的去甲基化药物,作为一种诱导剂常用于体外实验研究。5-aza是胞苷类似物,为DNA甲基转移酶抑制剂,当其作用于MSC时能整合进入DNA中,通过抑制DNA甲基转移酶使低DNA甲基化,而DNA的甲基化程度和基因调节密切相关。5-aza诱导MSC心肌化,可能是它和控制向心肌分化的特异启动子基因上阻遏蛋白结合,使其去甲基化而发生构型改变,从而启动细胞向心肌分化,使转变成心肌细胞。骨成形蛋白(BMP)是一个至少包括20个成员的家族,属于TGF-β超家族的一员。骨形态发生蛋白具有多种生物学功能,参与胚胎时期骨组织的发育,成年骨缺损修复及机体某些骨疾病的发生过程,并且在脂肪、肾脏、骨骼、肝脏及神经系统发育中起一定作用。近年来的研究发现,骨形态发生蛋白参与调节某些心脏转录因子的表达,对心肌干细胞的定向分化起重要作用。尤其是BMP-2,在胚胎心脏的发生以及干细胞向心肌分化方面发挥重要作用。血管紧张素II(AngiontensinII,Ang-II)是人体内正常存在的一种多肽类激素类物质,在心血管疾病的发生发展以及血管重塑中起到一定的作用。有研究显示人类脂肪来源间充质干细胞经Ang-II诱导之后表达平滑肌特异性基因增加,其向平滑肌样细胞分化,而且还可以诱导间充质干细胞血管内皮生长因子合成增加,也可诱导多能干细胞向中胚层前体细胞分化和增殖。Ang-II单独可以促使间充质干细胞向心肌样细胞分化,同时使用5-aza可以进一步提高增殖和分化的效率。本发明还提供了所述组合物在诱导牙龈间充质干细胞向心肌样细胞分化中的应用。本发明还提供了一种诱导制剂,包括本发明提供的组合物。在本发明的一些具体实施方案中,所述诱导制剂中所述5-氮杂胞苷的终浓度为5~15μmol/L。在本发明的一些具体实施方案中,所述诱导制剂中所述骨成形蛋白的终浓度为5~15μg/L。在本发明的一些具体实施方案中,所述诱导制剂中所述血管紧张素II的终浓度为1~10μmol/L。在本发明的一些具体实施方案中,所述诱导制剂还包括细胞培养基。在本发明的一些具体实施方案中,所述诱导制剂还包括血清。此外,本发明还提供了所述的诱导制剂在诱导牙龈间充质干细胞向心肌样细胞分化中的应用。本发明还提供了一种牙龈间充质干细胞分化为心肌样细胞的诱导方法,取牙龈间充质干细胞与本发明提供的诱导制剂混合后培养。在本发明的一些具体实施方案中,所述牙龈间充质干细胞的制备方法包括如下步骤:1、GMSCs原代分离培养:1)原材料来源:取临床上正畸导萌术切下的牙龈或阻生拔牙需要而切除包绕在恒牙周围的牙龈组织。要求患者没有牙龈增生、炎症及使用过导致牙龈增生的药物。切取的牙龈组织快速浸入含3倍双抗的4℃预冷的PBS中。其中,3倍双抗浓度为300u/mL青霉素、300u/mL链霉素。2)漂洗:用含3倍双抗的PBS冲洗3次,再将牙龈置于间充质干细胞无血清培养基中浸泡5min;其中,3倍双抗浓度为300u/mL青霉素、300u/mL链霉素。其中,间充质干细胞无血清培养基中含有100u/mL青霉素、100u/mL链霉素。3)第一次消化:将牙龈组织剪成1cm3大小,加入适量Ⅰ型胶原酶-Dispase酶混合消化液,置37℃,200R恒温摇床中消化45min。消化结束后,1000r/min离心5min,弃上清。加入适量PBS重悬,100um细胞滤网过滤悬液,过滤后的细胞悬液1000r/min离心5min,弃上清。其中,Ⅰ型胶原酶-Dispase酶的比例为1:1,胶原酶浓度为胶原酶3g/L,Dispase酶浓度为Dispase酶4g/L。其中,消化环境为为37℃,200R恒温摇床中,消化时间为45min;其中,所用细胞滤网孔径为100um;其中,离心速度为1000r/min,离心时间为5min。4)第二次消化:把步骤3)中过滤下下来未消化的组织加入等体积的0.125%的胰蛋白酶,置37℃,200R恒温摇床中继续消化15min。消化结束后,1000r/min离心5min,弃上清。加入适量PBS重悬,70um细胞滤网过滤悬液,过滤后的细胞悬液1000r/min离心5min,弃上清。其中,胰蛋白酶与牙龈组织的比例为体积比1:1,胰蛋白酶的浓度为0.125%;其中,所用细胞滤网孔径为70um;其中,离心速度为1000r/min,离心时间为5min。5)接种:步骤3)与步骤4)中收集的细胞用含10ng/mLEGF(表皮生长因子)的间充质干细胞无血清培养基重悬细胞,接种于六孔板,5%CO2培养箱37℃培养。其中,基础培养基为间充质干细胞无血清培养基,可市场购买或自制。其中,完全培养基中EGF(表皮生长因子)的浓度为10ng/mL;6)纯化:待细胞长满80~90%,收集细胞,用磁珠分选法纯化细胞。将收集的细胞与STRO-1单抗4℃孵育1h,与磁珠30min4℃孵育,在磁力设备作用下筛选出STRO-1+GMSCs,接种于新的六孔板中,5%CO2培养箱37℃培养。2、GMSCs传代:待细胞长满80~90%,用吸管吸弃旧培养液,加入2~3mL0.25%胰蛋白酶,消化1~3分钟,镜下观察细胞收缩变圆时,立即加入5~10mL间充质干细胞无血清培养基终止消化,收集细胞,1000r/min离心5min,弃上清。加入5~10mL含10ng/mLEGF的间充质干细胞无血清培养基,进行细胞计数,按5×104cell/mL密度接种于培养皿中进行传代培养,5%CO2培养箱37℃培养,每隔2~3天换液一次。培养过程中观察细胞形态,结果如图1所示。细胞接种约4h后开始贴壁,3~4d进入对数生长期,6-8d进入平台期。细胞生长速度平稳,呈单层贴壁生长。大部分细胞呈长梭形,形态不规则。3、GMSCs表面标志物鉴定:待细胞长满80-90%,收集细胞(约1×106个),加入3g/LTriton浸泡20min,PBS洗3遍,10%山羊血清室温封闭2h,分别滴加1:200稀释的CD146、CD105、CD90、CD34、CD45、HLA-DR抗体各50μL,同时对照组滴加单纯PBS50μL,4℃处理16h。次日室温放置30min,PBS漂洗3遍,各组分别滴加1:500稀释的FITC标记二抗IgG,常温避光孵育1h,PBS漂洗2遍,10%福尔马林固定细胞,流式细胞仪测定抗原的阳性率。检测结果显示,克隆细胞表面抗原CD146、CD105、CD90阳性表达,而CD34、CD45、HLA-DR阴性表达,说明本发明中得到的GMSCs属来源于中胚层的间充质干细胞。在本发明的一些具体实施方案中,牙龈间充质干细胞分化为心肌样细胞的诱导方法具体为:选取第3代GMSCs,按1×104cells/mL密度接种于放有多聚赖氨酸处理的无菌盖玻片的六孔板中,每孔加入2mL含10%FBS的DMEM/F12培养基。24h后更换本发明提供的诱导制剂,在37℃、5%CO2、饱和湿度静置培养,每隔2~3天更换新的培养液。本发明提供了一种组合物,包括5-氮杂胞苷、骨成形蛋白和血管紧张素II。还提供了一种诱导制剂,所述诱导制剂中所述5-氮杂胞苷的终浓度为5~15μmol/L,所述骨成形蛋白的终浓度为5~15μg/L,所述血管紧张素II的终浓度为1~10μmol/L。本发明提供一种有效的GMSCs成心肌样细胞的诱导方法。其中诱导分化培养液成分包括10%FBS、10μmol/L5-aza、10μg/LBMP-2、5μmol/LAng-II的DMEM/F12培养基。该方法能够有效地诱导GMSCs向心肌样细胞分化。GMSCs自体取材方便、易于体外扩增,可以用于自体移植,从而避免了免疫排斥反应。本发明提供一种由多种诱导因子联合应用作用于GMSCs,能有效的诱导GMSCs向心肌样细胞分化。表明GMSCs保留了跨胚层分化为非间充质细胞的能力,可跨胚层分化为心肌样细胞,有望成为心肌梗死替代治疗的种子细胞。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示GMSCs形态图;其中,图1(A)示40×,图1(B)示100×;图2示GMSCs细胞表面标志物流式检测结果图;图3示各组诱导分化率比较。具体实施方式本发明公开了一种组合物、含有该组合物的诱导制剂及诱导方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明提供的组合物、含有该组合物的诱导制剂及诱导方法中所用原料及试剂均可由市场购得。下面结合实施例,进一步阐述本发明:实施例11、GMSCs原代分离培养1)原材料来源:取临床上正畸导萌术切下的牙龈或阻生拔牙需要而切除包绕在恒牙周围的牙龈组织。要求患者没有牙龈增生、炎症及使用过导致牙龈增生的药物。切取的牙龈组织快速浸入含3倍双抗的4℃预冷的PBS中。其中,3倍双抗浓度为300u/mL青霉素、300u/mL链霉素。2)漂洗:用含3倍双抗的PBS冲洗3次,再将牙龈置于间充质干细胞无血清培养基中浸泡5min;其中,3倍双抗浓度为300u/mL青霉素、300u/mL链霉素。其中,间充质干细胞无血清培养基中含有100u/mL青霉素、100u/mL链霉素。3)第一次消化:将牙龈组织剪成1cm3大小,加入适量Ⅰ型胶原酶-Dispase酶混合消化液,置37℃,200R恒温摇床中消化45min。消化结束后,1000r/min离心5min,弃上清。加入适量PBS重悬,100um细胞滤网过滤悬液,过滤后的细胞悬液1000r/min离心5min,弃上清。其中,Ⅰ型胶原酶-Dispase酶的比例为1:1,胶原酶浓度为胶原酶3g/L,Dispase酶浓度为Dispase酶4g/L。其中,消化环境为为37℃,200R恒温摇床中,消化时间为45min;其中,所用细胞滤网孔径为100um;其中,离心速度为1000r/min,离心时间为5min。4)第二次消化:把步骤3)中过滤下下来未消化的组织加入等体积的0.125%的胰蛋白酶,置37℃,200R恒温摇床中继续消化15min。消化结束后,1000r/min离心5min,弃上清。加入适量PBS重悬,70um细胞滤网过滤悬液,过滤后的细胞悬液1000r/min离心5min,弃上清。其中,胰蛋白酶与牙龈组织的比例为体积比1:1,胰蛋白酶的浓度为0.125%;其中,所用细胞滤网孔径为70um;其中,离心速度为1000r/min,离心时间为5min。5)接种:步骤3)与步骤4)中收集的细胞用含10ng/mLEGF(表皮生长因子)的间充质干细胞无血清培养基重悬细胞,接种于六孔板,5%CO2培养箱37℃培养。其中,基础培养基为间充质干细胞无血清培养基,可市场购买或自制。其中,完全培养基中EGF(表皮生长因子)的浓度为10ng/mL;6)纯化:待细胞长满80-90%,收集细胞,用磁珠分选法纯化细胞。将收集的细胞与STRO-1单抗4℃孵育1h,与磁珠30min4℃孵育,在磁力设备作用下筛选出STRO-1+GMSCs,接种于新的六孔板中,5%CO2培养箱37℃培养。2、GMSCs传代待细胞长满80~90%,用吸管吸弃旧培养液,加入2~3mL0.25%胰蛋白酶,消化1~3分钟,镜下观察细胞收缩变圆时,立即加入5~10mL间充质干细胞无血清培养基终止消化,收集细胞,1000r/min离心5min,弃上清。加入5~10mL含10ng/mLEGF的间充质干细胞无血清培养基,进行细胞计数,按5×104cells/mL密度接种于培养皿中进行传代培养,5%CO2培养箱37℃培养,每隔2~3天换液一次。培养过程中观察细胞形态,结果如图1所示。细胞接种约4h后开始贴壁,3~4d进入对数生长期,6~8d进入平台期。细胞生长速度平稳,呈单层贴壁生长。大部分细胞呈长梭形,形态不规则。3、GMSCs表面标志物鉴定:待细胞长满80-90%,收集细胞(约1×106个),加入3g/LTriton浸泡20min,PBS洗3遍,10%山羊血清室温封闭2h,分别滴加1:200稀释的CD146、CD105、CD90、CD34、CD45、HLA-DR抗体各50μL,同时对照组滴加单纯PBS50μL,4℃处理16h。次日室温放置30min,PBS漂洗3遍,各组分别滴加1:500稀释的FITC标记二抗IgG,常温避光孵育1h,PBS漂洗2遍,10%福尔马林固定细胞,流式细胞仪测定抗原的阳性率。检测结果显示,克隆细胞表面抗原CD146、CD105、CD90阳性表达,而CD34、CD45、HLA-DR阴性表达,说明本发明中得到的GMSCs属来源于中胚层的间充质干细胞。表1GMSCs细胞表面标志物表达率结果细胞表型CD146CD105CD90HLA-DRCD34CD45阳性表达率(%)100.0099.9096.700.300.000.10实施例2GMSCs分化为了验证本发明分化诱导的效果,同时设置4组对照组和4组实验组,选取第3代GMSCs,按1×104cells/mL密度接种于放有多聚赖氨酸处理的无菌盖玻片的六孔板中,每孔加入2mL含10%FBS的DMEM/F12培养基。24h后更换各组对应的培养液,在37℃、5%CO2、饱和湿度静置培养,每隔2~3天更换新的培养液。对照组1为阴性对照组,为常规培养组,使用的培养液为:含体积分数10%FBS的DMEM/F12培养液。对照组2为阳性对照组,使用的诱导液为:10%FBS、10μmol/L5-aza的DMEM/F12培养液。对照组3为阳性对照组,使用的诱导液为:10%FBS、10μg/LBMP-2的DMEM/F12培养液。对照组4为阳性对照组,使用的诱导液为:10%FBS、5μmol/LAng-II的DMEM/F12培养液。实验组1中使用的诱导液为:10%FBS、5μmol/L5-aza、5μg/LBMP-2、1μmol/LAng-II的DMEM/F12培养液。实验组2中使用的诱导液为:10%FBS、5μmol/L5-aza、5μg/LBMP-2、5μmol/LAng-II的DMEM/F12培养液。实验组3中使用的诱导液为:10%FBS、10μmol/L5-aza、10μg/LBMP-2、5μmol/LAng-II的DMEM/F12培养液。实验组4中使用的诱导液为:10%FBS、10μmol/L5-aza、5μg/LBMP-2、10μmol/LAng-II的DMEM/F12培养液。实验组5中使用的诱导液为:10%FBS、5μmol/L5-aza、10μg/LBMP-2、5μmol/LAng-II的DMEM/F12培养液。实验组6中使用的诱导液为:10%FBS、15μmol/L5-aza、15μg/LBMP-2、10μmol/LAng-II的DMEM/F12培养液。各组培养液的配方如表2表2各组分化诱导液配方GMSCs诱导分化后细胞形态观察对照组1为阴性对照组,细胞形态无变化,实验组6细胞增殖缓慢,部分细胞脱壁死亡,细胞数量逐渐减少,3-4周偶见部分细胞呈不规则外形、长梭形或椭圆形;其余各组细胞形态出现明显变化,诱导2周左右,细胞多紧密平行排列生长,细胞体积变大,纺锤形细胞比例下降,多数细胞呈杆状,少部分细胞呈不规则外形、长梭形或椭圆形;3-4周,细胞增殖减慢,部分细胞脱壁死亡,细胞数量较对照组1明显减少,相邻细胞间胞膜有接触,逐渐相连呈肌管状,细胞核质比例明显降低,胞质内有细小的颗粒样结构,且颗粒样结构多聚集于细胞核周围,部分细胞胞质内可见细丝样结构。免疫组化:培养4周后取出细胞爬片,按照免疫组化染色试剂盒的说明书进行肌间线蛋白(desmin)、心肌肌钙蛋白I(troponinI)和心肌肌钙蛋白T(troponinT)的免疫组化染色,DAB显色。将各组放有盖玻片6孔培养板内培养液吸出,PBS缓冲液漂洗细胞铺片5分钟,重复3次。用4%多聚甲醛固定15分钟,PBS缓冲液漂洗后甩干,中性树胶粘附于载玻片上,4℃冰箱过夜。滴加3%过氧化氢孵育15分钟,消除内源性过氧化物酶的活性,PBS缓冲液漂洗5分钟,重复3次。分别滴加适量一抗(desmin、troponinI、troponinT),37℃湿盒内孵育1小时,4℃过夜。次日取出后PBS缓冲液漂洗5分钟,滴加二抗,37℃湿盒内孵育40分钟,PBS缓冲液漂洗5分钟,重复3次,滴加新鲜配制的DAB溶液显色5~10分钟,在光镜下观察,用自来水进行冲洗终止显色。将甩干片子后,苏木素复染1分钟,分化返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片。对各组所得细胞经免疫组化检测后,对desmin、troponinI、troponinT染色的细胞按公式:诱导分化率=染色阳性细胞数/细胞总数×100%进行计数,计算出各组的分化率进行比较。每组取样3次,分别检测后统计数据。统计结果如表3。表3各组细胞分化率(*表示p<0.05,,**表示p<0.01)表3、图3结果显示,对照组1为阴性对照组,细胞无着色;其余各组中,三种蛋白均有细胞着色,表明desmin、troponinI、troponinT均表达阳性。其中实验组2、实验3、实验组4和实验组5与对照组2、对照组3、对照组4之间分化率有极显著性差异(**,p<0.01);而实验组1中可能由于Ang-II浓度过低,并未体现其联合5-aza、BMP-2诱导分化的效果;实验组4虽有细胞少量着色,但由于5-aza浓度过高,对细胞毒性较大,细胞活性受到较大影响,分化效率也为最差;实验组3与实验组2、实验组4、实验组5均有显著性差异(*,p<0.05),实验组3中细胞着色最多,诱导分化率为42.01±1.63%,显著高于其他各组,,说明本发明所用分化培养基能有效的诱导GMSCs向心肌样细胞分化。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1