一种神经干细胞增殖和诱导其分化为多巴胺能神经元的培养基以及应用和增殖诱导方法与流程
本发明涉及医学领域,具体的说是涉及一种神经干细胞增殖和诱导其分化为多巴胺能神经元的培养基以及应用和增殖诱导方法。
背景技术:
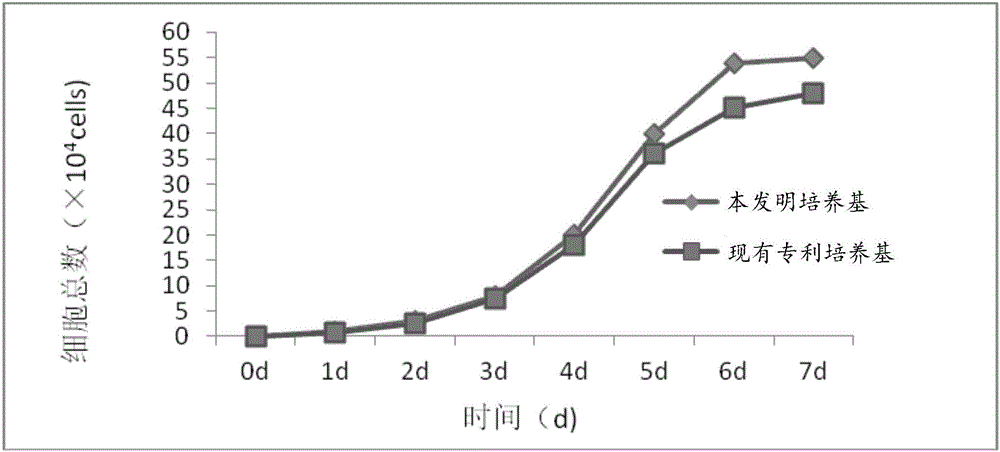
:神经干细胞(neuralstemcell,NSCs)具有分化为神经元、星形胶质细胞和少突胶质细胞的能力,能自我更新,并足以提供大量脑组织细胞的细胞群。现已发现,多种类型的中枢神经系统损伤后,NSCs被激活并有利于组织的损伤修复和功能恢复。神经干细胞成为了生物医学工程以及体外模型研究中所必须的种子细胞。因此,研究NSCs的生物学对于神经系统损伤修复和退行性病变的治疗具有重要意义。神经元是神经系统的结构和功能单位。神经元有接受、整合和传递信息的功能。一般就长轴突神经元而言,树突和胞体接受从其他神经元传来的信息,并进行整合,然后通过轴突将信息传递给另一些神经元或效应器。神经干细胞定向分化为的神经元在神经发育和修复受损神经组织中发挥重要作用。因此,寻求一种可以使NSCs定向分化为经元的方法是国内外学者的研究热点。现有专利中公开了多种将神经干细胞诱导分化为多巴胺能神经元的方法,例如专利CN103045538A中公开了将神经干细胞先后在DMEM/F12+B27+抗坏血酸、DMEM/F12+B27+30%脑脊液两种培养基中诱导分化,多巴胺能神经元比例达到14.73%;专利CN105296429A公开了在含有诱导剂aFGF100ng/mL,TPA100nM,毛喉素25uM,普拉克索10uM,BMP-750ng/ml的诱导培养基中对神经干细胞进行诱导分化,多巴胺能神经元比例达到30%;专利CN104031882A公开了将神经干细胞先进行多巴胺能神经元前体细胞的诱导,而后再进行多巴胺能神经元定向诱导,前者培养基由无血清培养基添加细胞因子音猥因子(SHH)、成纤维细胞生长因子8b(FGFBb)、糖原合成酶激酶-3(GSK-3)抑制剂CHIR99021组成,后者培养基由神经细胞培养基(NeurobasalMedium)添加B27、脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)、转化生长因子-β3(TGFβ3)、抗坏血酸(ascorbicacid),环腺苷酸(cAMP)、佛司可林(forskolin)组成,多巴胺能神经元的分化率可达到70%左右;专利CN104031882A的分化比例虽然较高,但是其需要进行两个阶段的诱导分化,步骤繁琐,而且培养基中采用了多种价格昂贵的国外商业产品,其中的B27作为血清替代物需要单独分开进行低温冻存,给运输带来诸多不便。此外,现有的神经干细胞增殖培养基一般为DMEM/F12加上GIBICO的B27添加剂和生长因子,或者GIBICO的含2%B27的Neurobasal培养基中添加生长因子,如专利CN103045538A、专利CN105296429A和专利CN1536073A,但是这类培养基对于神经干细胞的增殖速度较低,而且Neurobasal培养基成分复杂不明确,B27运输不便等等对神经干细胞的培养增殖带来诸多不便。技术实现要素:有鉴于此,本发明的目的在于提供一种神经干细胞增殖培养基及其应用和增殖方法,使得所述培养基能够加快神经干细胞的增殖速度,应用于神经干细胞的增殖培养过程中。本发明的另外一个目的是提供一种神经干细胞诱导分化为多巴胺能神经元的培养基及其应用和诱导方法,使得所述培养基能够定向诱导神经干细胞分化为多巴胺能神经元,并显著提高其分化比例,且培养基成分来源广泛、成本低廉,应用于神经干细胞的诱导分化过程中。为了实现上述目的,本发明提供如下技术方案:一种神经干细胞增殖培养基,以DMEM/F12为基础培养基,包括如下组分:人胰岛素、孕酮、氢化可的松、地塞米松、雌二醇、转铁蛋白、EGF、FGF、CTGF、B-NGF、VEGF、大豆胰酶抑制剂、L-谷胱甘肽、油酸、吐温80、磷脂酸、亚硒酸钠、三七总皂苷、白藜芦醇、氯化锂、胆固醇、WNT3a、谷氨酰胺。针对现有增殖培养基在培养神经干细胞时增殖速度不高的主要问题,本发明选择多种适宜的组分组成一种新的增殖培养基,提高了神经干细胞的增殖速度。其中,组为优选,所述培养基以DMEM/F12为基础培养基,包括如下组分:0~100ng/mL人胰岛素、2nM~200nM孕酮、0.05μg/mL~0.5μg/mL氢化可的松、50nM~100nM地塞米松、0.1nM~1M雌二醇、0.1ng/mL~1μg/mL转铁蛋白、1~20ng/mLEGF、1~20ng/mLFGF、1~100ng/mLCTGF、20~200ng/mLB-NGF、1~100ng/mLVEGF、0.01~10%大豆胰酶抑制剂(质量百分比)、0.1~10μg/mLL-谷胱甘肽、0.1~100μg/mL油酸、0.005%~0.5%吐温80(体积百分比)、10~600μg/mL磷脂酸、2~100nM亚硒酸钠、1~100ng/mL三七总皂苷、1~100ng/mL白藜芦醇、0.1mM~100mM氯化锂、0.01~10mg/mL胆固醇、0.1~100ng/mLWNT3a、1mM~10mM谷氨酰胺。更优选地,以DMEM/F12为基础培养基,包括如下组分:10μg/mL人胰岛素、20nM孕酮、0.4μg/mL氢化可的松、100nM地塞米松、10nM雌二醇、100ng/mL转铁蛋白、10ng/mLEGF、10ng/mLFGF、20ng/mLCTGF、20ng/mLB-NGF、10ng/mLVEGF、0.1%大豆胰酶抑制剂、2μg/mLL-谷胱甘肽、5μg/mL油酸、0.01%吐温80、50μg/mL磷脂酸、30nM亚硒酸钠、100ng/mL三七总皂苷、100ng/mL白藜芦醇、1mM氯化锂、5mg/mL胆固醇、25ng/mLWNT3a、2mM谷氨酰胺。采用本发明所述培养基与专利CN103045538A中DMEM/F12+B27+EGF+bFGF的培养基进行神经干细胞的增殖培养,结果显示本发明培养基中神经干细胞增殖速度较快。因此,本发明提供了所述培养基在培养神经干细胞中或制备神经干细胞增殖培养基中的应用。同时,本发明还提供了一种神经干细胞增殖方法,将神经干细胞单细胞悬液用本发明所述培养基培养,至细胞生长至80%以上汇合度。此外,针对现有培养基在诱导神经干细胞分化为多巴胺能神经元时分化比例较低的主要问题,本发明在增殖培养基基础上增加其他多种适宜成分,提供了一种全新的诱导培养基,即以DMEM/F12为基础培养基,包括如下组分:人胰岛素、孕酮、氢化可的松、地塞米松、雌二醇、转铁蛋白、EGF、FGF、CTGF、B-NGF、VEGF、大豆胰酶抑制剂、L-谷胱甘肽、油酸、吐温80、磷脂酸、亚硒酸钠、三七总皂苷、白藜芦醇、氯化锂、胆固醇、WNT3a、谷氨酰胺、层粘连蛋白、纤连蛋白、玻尿酸、α2巨球蛋白、血管紧张素Ⅱ、促红细胞生成素,其能够显著提高多巴胺能神经元的分化比例。作为优选,以DMEM/F12为基础培养基,包括如下组分:0~100ng/mL人胰岛素、2nM~200nM孕酮、0.05μg/mL~0.5μg/mL氢化可的松、50nM~100nM地塞米松、0.1nM~1M雌二醇、0.1ng/mL~1μg/mL转铁蛋白、1~20ng/mLEGF、1~20ng/mLFGF、1~100ng/mLCTGF、20~200ng/mLB-NGF、1~100ng/mLVEGF、0.01~10%大豆胰酶抑制剂(质量百分比)、0.1~10μg/mLL-谷胱甘肽、0.1~100μg/mL油酸、0.005%~0.5%吐温80(体积百分比)、10~600μg/mL磷脂酸、2~100nM亚硒酸钠、1~100ng/mL三七总皂苷、1~100ng/mL白藜芦醇、0.1mM~100mM氯化锂、0.01~10mg/mL胆固醇、0.1~100ng/mLWNT3a、1mM~10mM谷氨酰胺、50ng/mL~500ng/mL层粘连蛋白、1~100ng/mL纤连蛋白、0.1%~50%玻尿酸(质量百分比)、1~100μg/mLα2巨球蛋白、100~700nmol/L血管紧张素Ⅱ、0.001~0.01U/L促红细胞生成素。更优选地,以DMEM/F12为基础培养基,包括如下组分:10μg/mL人胰岛素、20nM孕酮、0.4μg/mL氢化可的松、100nM地塞米松、10nM雌二醇、100ng/mL转铁蛋白、10ng/mLEGF、10ng/mLFGF、20ng/mLCTGF、20ng/mLB-NGF、10ng/mLVEGF、0.1%大豆胰酶抑制剂、2μg/mLL-谷胱甘肽、5μg/mL油酸、0.01%吐温80、50μg/mL磷脂酸、30nM亚硒酸钠、100ng/mL三七总皂苷、100ng/mL白藜芦醇、1mM氯化锂、5mg/mL胆固醇、25ng/mLWNT3a、2mM谷氨酰胺、100ng/mL层粘连蛋白、40ng/mL纤连蛋白、0.1%玻尿酸、2μg/mLα2巨球蛋白、200nmol/L血管紧张素Ⅱ、0.005U/L促红细胞生成素。将神经干细胞在本发明诱导培养基中进行多巴胺能神经元的诱导分化,其最终能够达到85%以上比例,相比现有较高的70%分化比例还要高出15%以上。因此,本发明提供了所述诱导培养基在制备诱导神经干细胞分化为多巴胺能神经元的产品或诱导神经干细胞分化为多巴胺能神经元中的应用。同时,本发明也对应提供了一种诱导神经干细胞分化为多巴胺能神经元的方法,将神经干细胞在本发明所述诱导培养基中诱导分化6-14天。由以上技术方案可知,本发明采用多种适宜、成本低廉、来源广泛的组分组成一种新的神经干细胞培养基,其能够显著提高神经干细胞的增殖速度,同时在其基础上添加其他多种诱导分化组分,可见神经干细胞诱导分化为多巴胺能神经元,并显著提高其分化比例。附图说明图1所示为神经干细胞标志蛋白nestin细胞免疫荧光图;图2所示为神经干细胞生长曲线;图3所示为多巴胺能神经元特异性标记物酪氨酸羟化酶(TH)免疫组化鉴定图;图4所示为多巴胺能神经元特异性标记物酪氨酸羟化酶(TH)免疫组化鉴定图;图5所示为多巴胺能神经元特异性标记物酪氨酸羟化酶(TH)免疫组化鉴定图;图6所示为多巴胺能神经元特异性标记物酪氨酸羟化酶(TH)免疫组化鉴定图。具体实施方式本发明实施例公开了一种神经干细胞增殖和诱导其分化为多巴胺能神经元的培养基以及应用和增殖诱导方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。本发明产品和应用已通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。在具体实施方式中,本发明所述神经干细胞为胎鼠脑来源的神经干细胞,相关内容也可参照专利CN1536073A实施例1,但是本发明给出了更加优选的获得方案,参见本发明实施例1。以下就本发明所提供的一种神经干细胞增殖和诱导其分化为多巴胺能神经元的培养基以及应用和增殖诱导方法做进一步说明。实施例1:原代神经干细胞的分离培养和传代方法1、原代神经干细胞分离和培养将孕12.5d的C57BL/6J孕鼠断颈处死,用酒精消毒之后,沿腹正中线打开腹腔,暴露两侧子宫,用眼科镊钳住子宫头端,顺子宫分离至子宫角处剪下,放入有冰PBS溶液培养皿中,依次去除子宫壁和胎膜,仔细分离得到脑组织,手动法得到胎鼠脑细胞。冰的DMEM/F12洗涤1遍,加入0.01%的胰蛋白酶,在恒温培养摇床上37℃消化30min,DMEM/F12终止消化。用100目筛子过滤,收集于离心管中,1000r/min,离心3min,去上清,加入已配制好的增殖培养基制成单细胞悬液,细胞计数之后,加入6孔板中原代培养。每3天换1次液。直到细胞生长到80%以上汇合度。增殖培养基可选择如下任意一种:(1)以DMEM/F12为基础培养基,包括如下组分:10μg/mL人胰岛素、20nM孕酮、0.4μg/mL氢化可的松、100nM地塞米松、10nM雌二醇、100ng/mL转铁蛋白、10ng/mLEGF、10ng/mLFGF、20ng/mLCTGF、20ng/mLB-NGF、10ng/mLVEGF、0.1%大豆胰酶抑制剂、2μg/mLL-谷胱甘肽、5μg/mL油酸、0.01%吐温80、50μg/mL磷脂酸、30nM亚硒酸钠、100ng/mL三七总皂苷、100ng/mL白藜芦醇、1mM氯化锂、5mg/mL胆固醇、25ng/mLWNT3a、2mM谷氨酰胺。(2)以DMEM/F12为基础培养基,包括如下组分:200nM孕酮、0.05μg/mL氢化可的松、65nM地塞米松、0.001M雌二醇、600ng/mL转铁蛋白、20ng/mLEGF、1ng/mLFGF、100ng/mLCTGF、200ng/mLB-NGF、1ng/mLVEGF、10%大豆胰酶抑制剂(质量百分比)、0.1μg/mLL-谷胱甘肽、100μg/mL油酸、0.005%吐温80(体积百分比)、600μg/mL磷脂酸、2nM亚硒酸钠、80ng/mL三七总皂苷、1ng/mL白藜芦醇、100mM氯化锂、0.01mg/mL胆固醇、100ng/mLWNT3a、1mM谷氨酰胺。(3)以DMEM/F12为基础培养基,包括如下组分:60ng/mL人胰岛素、120nM孕酮、0.1μg/mL氢化可的松、85nM地塞米松、100nM雌二醇、0.1ng/mL转铁蛋白、15ng/mLEGF、15ng/mLFGF、1ng/mLCTGF、80ng/mLB-NGF、100ng/mLVEGF、0.01%大豆胰酶抑制剂(质量百分比)、10μg/mLL-谷胱甘肽、0.1μg/mL油酸、0.5%吐温80(体积百分比)、10μg/mL磷脂酸、100nM亚硒酸钠、40ng/mL三七总皂苷、45ng/mL白藜芦醇、0.1mM氯化锂、1mg/mL胆固醇、80ng/mLWNT3a、7mM谷氨酰胺。(4)以DMEM/F12为基础培养基,包括如下组分:100ng/mL人胰岛素、2nM孕酮、0.5μg/mL氢化可的松、50nM地塞米松、1M雌二醇、1μg/mL转铁蛋白、1ng/mLEGF、20ng/mLFGF、60ng/mLCTGF、140ng/mLB-NGF、60ng/mLVEGF、5%大豆胰酶抑制剂(质量百分比)、6μg/mLL-谷胱甘肽、55μg/mL油酸、0.1%吐温80(体积百分比)、400μg/mL磷脂酸、70nM亚硒酸钠、1ng/mL三七总皂苷、75ng/mL白藜芦醇、55mM氯化锂、5mg/mL胆固醇、0.1ng/mLWNT3a、10mM谷氨酰胺。2、神经干细胞传代当细胞汇合度至90%,倾去旧培养基,用PBS漂洗2次后,加入0.25%胰蛋白酶孵育1-2min,在倒置显微镜下观察,80%细胞皱缩、变圆漂浮后,加入含10%FBS低糖DMEM培养基,终止消化,以环吹形式进行吹打,直至全部细胞脱落。离心清洗细胞后传代,加入新的增殖培养基,于5%CO2、37℃、饱和湿度为95%的CO2培养箱中培养。3、原代神经干细胞鉴定用细胞免疫荧光检测NSCs标志蛋白nestin的表达,结果见图1,由图1可知,原代神经干细胞可表达NSCs标志蛋白nestin,符合神经干细胞的特征。实施例2:神经干细胞增殖培养试验以实施例1中相同来源的胎鼠脑来源神经干细胞单细胞悬液为起始,分别接种至实施例1中(1)培养基和专利CN103045538A中DMEM/F12+B27+EGF+bFGF培养基,在相同条件下进行培养增殖,结果见图2。由图2可以看出,在本发明培养基培养下,神经干细胞增殖速度要明显快于对照的现有专利培养基。此外,以实施例1中(2)、(3)、(4)培养基为试验对象,神经干细胞增殖速度同样明显快于对照现有专利。实施例3:本发明所述诱导培养基以DMEM/F12为基础培养基,包括如下组分:10μg/mL人胰岛素、20nM孕酮、0.4μg/mL氢化可的松、100nM地塞米松、10nM雌二醇、100ng/mL转铁蛋白、10ng/mLEGF、10ng/mLFGF、20ng/mLCTGF、20ng/mLB-NGF、10ng/mLVEGF、0.1%大豆胰酶抑制剂、2μg/mLL-谷胱甘肽、5μg/mL油酸、0.01%吐温80、50μg/mL磷脂酸、30nM亚硒酸钠、100ng/mL三七总皂苷、100ng/mL白藜芦醇、1mM氯化锂、5mg/mL胆固醇、25ng/mLWNT3a、2mM谷氨酰胺、100ng/mL层粘连蛋白、40ng/mL纤连蛋白、0.1%玻尿酸、2μg/mLα2巨球蛋白、200nmol/L血管紧张素Ⅱ、0.005U/L促红细胞生成素。实施例4:本发明所述诱导培养基以DMEM/F12为基础培养基,包括如下组分:200nM孕酮、0.05μg/mL氢化可的松、65nM地塞米松、0.001M雌二醇、600ng/mL转铁蛋白、20ng/mLEGF、1ng/mLFGF、100ng/mLCTGF、200ng/mLB-NGF、1ng/mLVEGF、10%大豆胰酶抑制剂(质量百分比)、0.1μg/mLL-谷胱甘肽、100μg/mL油酸、0.005%吐温80(体积百分比)、600μg/mL磷脂酸、2nM亚硒酸钠、80ng/mL三七总皂苷、1ng/mL白藜芦醇、100mM氯化锂、0.01mg/mL胆固醇、100ng/mLWNT3a、1mM谷氨酰胺、500ng/mL层粘连蛋白、1ng/mL纤连蛋白、50%玻尿酸(质量百分比)、100μg/mLα2巨球蛋白、100nmol/L血管紧张素Ⅱ、0.001U/L促红细胞生成素。实施例5:本发明所述诱导培养基以DMEM/F12为基础培养基,包括如下组分:60ng/mL人胰岛素、120nM孕酮、0.1μg/mL氢化可的松、85nM地塞米松、100nM雌二醇、0.1ng/mL转铁蛋白、15ng/mLEGF、15ng/mLFGF、1ng/mLCTGF、80ng/mLB-NGF、100ng/mLVEGF、0.01%大豆胰酶抑制剂(质量百分比)、10μg/mLL-谷胱甘肽、0.1μg/mL油酸、0.5%吐温80(体积百分比)、10μg/mL磷脂酸、100nM亚硒酸钠、40ng/mL三七总皂苷、45ng/mL白藜芦醇、0.1mM氯化锂、1mg/mL胆固醇、80ng/mLWNT3a、7mM谷氨酰胺、300ng/mL层粘连蛋白、80ng/mL纤连蛋白、35%玻尿酸(质量百分比)、80μg/mLα2巨球蛋白、700nmol/L血管紧张素Ⅱ、0.01U/L促红细胞生成素。实施例6:本发明所述诱导培养基以DMEM/F12为基础培养基,包括如下组分:100ng/mL人胰岛素、2nM孕酮、0.5μg/mL氢化可的松、50nM地塞米松、1M雌二醇、1μg/mL转铁蛋白、1ng/mLEGF、20ng/mLFGF、60ng/mLCTGF、140ng/mLB-NGF、60ng/mLVEGF、5%大豆胰酶抑制剂(质量百分比)、6μg/mLL-谷胱甘肽、55μg/mL油酸、0.1%吐温80(体积百分比)、400μg/mL磷脂酸、70nM亚硒酸钠、1ng/mL三七总皂苷、75ng/mL白藜芦醇、55mM氯化锂、5mg/mL胆固醇、0.1ng/mLWNT3a、10mM谷氨酰胺、50ng/mL层粘连蛋白、100ng/mL纤连蛋白、10%玻尿酸(质量百分比)、40μg/mLα2巨球蛋白、500nmol/L血管紧张素Ⅱ、0.007U/L促红细胞生成素。实施例7:诱导神经干细胞分化为多巴胺能神经元1、诱导分化将按照实施例1方法传代至第6代的神经干细胞以5×104/mL浓度分别接种至实施例3-6的诱导培养基中,所用的培养板底部放置有盖玻片,且盖玻片用L-多聚赖氨酸包被,置于37℃,5%CO2培养箱中培养10天,DAPI只对细胞核进行染色,故在免疫荧光显微镜下随机在每一张盖玻片内取20个视野(占盖玻片总面积的3%),计数每一个视野内的DAPI阳性细胞核数目及酪氨酸羟化酶(TH)阳性细胞数目,分化比例=TH+/DAPI+,统计各培养基条件下分化比例,结果见表1。表1多巴胺能神经元分化比例分化比例实施例3培养基87%实施例4培养基90%实施例5培养基92%实施例6培养基88%2、多巴胺能神经元检测将经过四个培养基诱导分化的多巴胺能神经元对其特异性标记物酪氨酸羟化酶(TH)进行免疫组化鉴定,结果如图3-6所示,四个培养基诱导分化的多巴胺能神经元均大量表达出TH。以上所述只是用于理解本发明的方法及其核心思想,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1