防治南方根结线虫相关基因Misp12及其应用的制作方法
本发明属于微生物基因工程技术领域,具体涉及一个与南方根结线虫生长发育相关的基因Misp12的分离克隆、功能验证和应用。
背景技术:
南方根结线虫(Meloidogyne incognita)是一类严重为害农业生产的植物寄生线虫,适应性强,传播途径多样,可寄生5000多种植物,危害植物根部形成根结,可导致全球作物的重大经济损失(Blok et al.,2008)。据统计,每年仅对果树和蔬菜产业造成的损失高达700亿美元(Caboni P et al.,2012)。同时,根结线虫的为害又加重了枯萎病、根腐病等土传性真菌病害和部分细菌病害的发生,增加和扩大了病毒病的发生。在我国各地区的温室内,南方根线虫是当前经济型蔬菜生产,特别是番茄、辣椒、黄瓜、茄子等主要蔬菜上的重大危害之一(李林等,2004)。传统的防治方法包括农业防治、化学防治、生物防治和物理防治,但均有其各自的弊端(Abawi GS,Widmer T L,2010)。近年来,利用RNA干扰(RNA interfer ence,RNAi)技术对植物进行遗传改良提高抗病虫害能力在生产上已经有所应用,如防治番木瓜环斑病毒病。RNAi现象于1995年首次在秀丽隐杆线虫(Caenorhabditis elegans)中发现(Guo S et al.,1995),双链RNA(double-stranded RNA,dsRNA)导入细胞后被切割成21~23个核苷酸长度的短核苷酸双链,在其他作用因子的参与下能够特异的与其同源的mRNA结合并导致该同源mRNA降解,从而使得内源基因沉默。
RNAi技术同时被证明是一种比较具有潜力的植物病原线虫防治方法,但在实际生产应用中还未见报道。分离和鉴定线虫中适合作为RNAi的靶标基因,是实现线虫基因有效沉默,进而实现线虫病害防治的关键之一。同时,在RNAi过程中为避免脱靶效应,导致非靶标基因如植物基因的沉默,选择的靶标基因需要高度保守。较为理想的靶标基应为在其它物种中无同源基因。此外,选择的靶标基因应为重要的功能基因,即将其沉默后对线虫的生长发育寄生等能造成显著影响。南方根结线虫(M.incognita)线虫基因组数据库的公布,为利用RNAi技术提供植物抗线虫能力的研究创建了平台。
本发明通过生物信息学方法筛选到候选基因Misp12,该基因在南方根结线虫成熟时期在食道腺细胞中高量表达,采用RACE PCR和基因组PCR技术克隆了该基因。该基因通过病毒诱导基因沉默(Virus Induce Gene Slice,VIGS)的方法转入本氏烟草中(Nicotia na benthamiana),发现沉默该基因后线虫的总侵染量相对与病毒空白对照明显下降,而且成熟的雌虫数相比与其他龄期线虫下降的数量尤其明显。
申请者在现有的专利和非专利文献中检索,结果表明Misp12尚为功能未知的基因,并且在其它物种中没有检索到其相关同源基因。即该基因为南方根结线虫中特异存在的重要功能基因,因此为一个理想的基因沉默靶标位点。因而详细研究基因Misp12,不仅可以作为RNAi技术控制南方根结线虫的一个理想的安全靶标位点,同时也可为研究线虫与寄主植物寄生关系的研究提供参考。
技术实现要素:
本发明的目的在于提供一个南方根结线虫(Meloidogyne incognita)生长发育相关重要功能基因Misp12,其序列为SEQ ID NO.1所示,编码的蛋白质为SEQ ID NO.2所示。
本发明的目的在于提供一个南方根结线虫(Meloidogyne incognita)生长发育相关重要功能基因Misp12的应用,利用该基因在可提高植物抗南方根结线虫能力中的应用。
为了达到上述目的,本发明采取以下技术措施:
申请人通过基因克隆技术,从南方根结线虫(Meloidogyne incognita)中分离克隆获得一个可能与生长发育和寄生相关的特异基因及其编码的蛋白,申请人将该基因命名为Misp12。
所述的Misp12基因,它的核苷酸序列如序列表SEQ ID NO:1所示,它的编码区域(C DS)编码区位于SEQ ID NO:1的5’端第74位至523为碱基之间,它编码的氨基酸序列如序列表SEQ ID NO:2所示。
南方根结线虫(Meloidogyne incognita)生长发育相关重要功能基因Misp12在提高植物抗南方根结线虫中的应用,
包括将基因Misp12通过病毒诱导基因沉默(Virus Induce Gene Slice,VIGS)方法,沉默该基因后线虫的总侵染量相对与空白对照明显下降,而且成熟的雌虫数相比与其它龄期线虫下降的数量尤其明显。
包括利用沉默Misp12,减少线虫入侵量并能控制雌虫成熟数量,从而达到减少下一次入侵的作用;
包括利用沉默Misp12,在分子水平探讨南方根结线虫与寄主植物之间的互作关系和模式;
包括利用Misp12为线索,在南方根结线虫中鉴定其参与的信号途径,从而鉴定出更多的候选线虫基因沉默靶标;
还包括利用Misp12为开发新型的防治线虫药剂提供参考依据。即利用Misp12作为靶标 蛋白研制针对该靶标的药剂从而控制线虫数量。
更详细的技术方案见《具体实施方式》所述。
与现有技术相比,本发明具有以下优点:
Misp12基因作为靶基因,能直接减少线虫的雌虫数量,达到减少下一次入侵数量,达到防治目的;靶标基因Misp12高度保守,无其它同源基因,环保安全且避免脱靶效应。
附图说明
图1本发明鉴定和分离克隆南方根结线虫发育致病相关基因Misp12及验证Misp12基因功能的流程图。
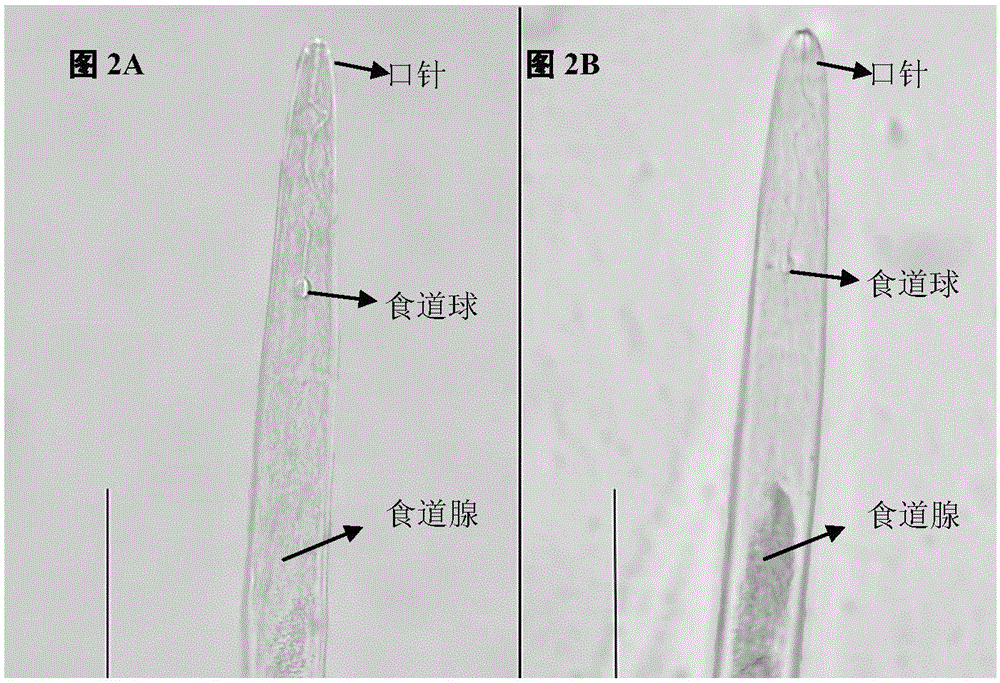
图2为通过原位杂交方法Misp12在南方根结线虫的表达定位示意图。
其中图2A为正向引物探针;图2B为反向引物探针。
图3通过pEGAD载体转化Misp12基因在洋葱表皮细胞中的定位。
其中图3A为Misp12带有信号肽序列(Misp12::sp)的明场和暗场;图3B为Misp12去除信号肽序列(Misp12::Δsp)的明场和暗场
图4Misp12蛋白在相关数据库中的生物信息学分析。
图5基因Misp12在各龄期线虫中的动态表达。
图6基因Misp12沉默不同天数后线虫中Misp12的表达量。
图7通过VIGS方法将线虫基因Misp12沉默后植物线虫的入侵量。
其中图7A为每株处理的入侵线虫总数。图7B为每株处理的各龄期线虫的数量。
具体实施方式
以下通过实施例予以进一步说明,但并非对本发明的限制。
以下具体实施例,除非特别说明,所有培养基及无菌试验用品均采用常规的高压蒸汽法灭菌(121℃,高压灭菌30min),并于室温存放。除非特别说明,所有限制性内切酶及聚合酶均购自宝生物工程(大连)有限公司。
实施例1:
南方根结线虫发育致病相关基因Misp12的克隆
申请人通过生物信息技术分析对比南方根结线虫基因组数据和蛋白组数据得到候选分泌蛋白序列,通过分子生物学技术分离克隆到基因Misp12。通过基因组数据库和蛋白质组数据库序列对比,发现Misp12在南方根结线虫高度特异和保守,在其它动植物及真菌细菌中都无相关同源基因;经基因表达动态和VIGS方法沉默分析基因Misp12与南方根结线虫的生长发育和致病过程可能相关,并具有重要作用(图1)。
1.1南方根结线虫基因组和蛋白组数据的生物信息学分析
通过NCBI下载南方根结线虫基因组和蛋白组数据(http://meloidogyne.toulouse.inra.fr)。利用SignalP 3.0和THMM2.0分析其蛋白组的信号肽结构和跨膜结构得到分泌组蛋白质,再利用各个数据库(包括Genebank和Swissprot等数据库)筛选其中南方根结线虫所特有的基因和蛋白质,从而得到候选分泌蛋白。
1.2候选基因Misp12的克隆
1.2.1RACE技术和基因组PCR获得Misp12基因全长cDNA序列
将实验室培养的含有南方根结线虫的番茄根系清洗干净后,通过搅拌机搅拌30s后,分别通过100目,200目,375目和500目线虫筛,收集375目和500目线虫筛上的根结线虫。采用TRIzol试剂盒(购自Invitrogen公司)提取南方根结线虫的RNA。具体步骤如下:大约10000条虫体加入1ml TRIzol试剂的比例加入提取液,混匀后放置于液氨冷冻30s,然后37℃中溶解1min,反复冻融4次后混匀。加入200μl氯仿,剧烈摇动15s,在冰中放置10min;然后4℃12000r/min离心15min,取上清液移至一新的DEPC处理过的Eppendorf管中,加入等体积的预冷异丙醇,混匀后于-20℃放置30min以上;4℃12000r/min离心15min,沉淀RNA;移去上清液后,加入1ml 70%乙醇洗涤RNA沉淀2次,洗涤时充分悬浮RNA沉淀,4℃12000r/min离心5min;弃上清后,RNA沉淀于空气中自然干燥1min;以DEPC-H2O于室温溶解RNA沉淀;分光光度计检测RNA的浓度和纯度;然后以DNAase I除去南方根结线虫RNA样品中的DNA,进行反转录。
采用蛋白酶K法提取线虫DNA。具体步骤如下:将10000条线虫放入离心管中液氮速冻30s后用少量SiO2研磨后加入700μl的10X PCR buffer和5μl的20mg/ml蛋白酶K混匀后65℃水浴1h,95℃水浴10min;加入等体积的PCI(酚:氯仿:异戊醇=25:24:1)轻轻混匀,4℃12000r/min离心10min;取上清液移至新的灭菌Eppendorf管中加入等量的CI(氯仿:异戊醇=24:1)轻轻混匀,4℃12000r/min离心10min;取上清液移至新的灭菌Eppendorf管中加入1/10体积的3M NaAc(pH 5.2)和2.5倍体积的无水乙醇混匀后于-20℃放置2h以上;12000r/min离心10min,沉淀DNA;移去上清,加入1ml 70%乙醇洗涤DNA沉淀2次;弃上清后,DNA沉淀于空气中自然干燥后用灭菌ddH2O于室温溶解沉淀。
采用RACE策略,以QT引物(5’-CCAGTGAGCAGAGTGACGAGGACTCGAGCTCAAGCTTTTTTTTTTTTTTTTTT-3’)进行反转录得到cDNA第一链,根据预测的候选基因Misp12的序列设计的2个特异引物(SP1:5’-CGGATACCAAGGAAAATAAC-3’;SP2:5’-CGGTGATGAGGTGTTATGTATGG-3’)和2个接头引物(RACE1:5’-CCAGTGAGCAGAGT GACG-3’;RACE2:5’-ACTCACTATAGGAAGCTGCG-3’)进行巢式PCR扩增,获得了420bp的DNA片段,对克隆到的DNA片段进行测序。利用得到的出cDNA片段和候选基因的序列设计特异性引物(FullMisp12F:5’CATCAAACAATCTCCTCAAC3’;FullMisp12R:5’GGAGACAGATATTGTGAAGC3’)扩增南方根结线虫基因组全长片段进行测序。
利用DNAMAN软件进行序列拼接,并利用GenScan软件进行了阅读框(ORF)预测。结果显示,位于拼接后获得的序列第74nt的ATG为起始密码子,该DNA片段含有一个完整的开放性阅读框架(核苷酸的位置在74-523),中间没有内含子,编码149氨基酸(SEQ ID NO:2所示)。
实施例2:
Misp12蛋白及其在其它真菌中同源蛋白的生物信息学分析
通过NCBI BLAST数据库和Swissprot数据库对Misp12基因推定编码的氨基酸序列进行分析,发现该序列仅在南方根结线虫中存在,在其它动植物和真菌细菌中未见相应的同源序列及同源蛋白质。利用MotifScan对该蛋白质进行Motif分析可知其含有2个预测的N-糖基化位点,2个预测的蛋白激酶C磷酸化位点,1个依赖cAMP和cGMP磷酸化位点和1个N-豆蔻酰化位点(图4)。
实施例3:
Misp12基因在南方根结线虫中的定位及其蛋白在植物细胞中的定位
通过原位杂交的方法来检测Misp12基因在南方根结线虫中的表达位置,并将Misp12基因融合gfp基因后转入洋葱表皮细胞中观察其在植物细胞中的定位。
3.1原位杂交试验
3.1.1溶液配制
(1)M9Buffer:22mM KH2PO4、42.3mM NaHPO4、85.6mM NaCl、1mM MgSO4.7H2O
(2)固定液:3%多聚甲醛,用1×M9Buffer配制
(3)蛋白酶K:2mg/ml,用10mM Tris-HCl(PH 7.5)配制
(4)其它杂交试剂的配制参照地高辛标记试剂盒说明书(购置于罗氏公司)
3.1.2地高辛标记的DNA单链探针合成
利用地高辛标记试剂盒,采用单链引物PCR法分别合成目的基因单链正义探针和反义探针。设计引物为(Misp12HS:5’-CGGTGATGAGGTGTTATGTATGG-3’和Misp12HA:5’-CTGGCTGTGTTCGCTATGTTTT-3’)
(1)常规PCR扩增靶标序列。
体系:2.0μl 10×PCR buffer;2.0μl dNTP;1.0μl正向引物;1.0μl反向引物;0.5μl c
DNA模板;0.5μl rTaq酶;14μl水。
扩增程序:94℃5min;94℃30sec,55℃45sec,72℃1min,共35cycles;72℃10min
(2)将PCR产物进行胶纯化,电泳检测。
(3)不对称PCR分别合成地高辛标记的正链探针和反链探针。
体系:2.0μl 10×PCR buffer;2.0μl地高辛标记的dNTP mix(含Dig-dUTP);2.0μl正向引物或反向引物;2.0μl PCR产物(上步骤纯化回收获得);0.5μl rTaq酶;11.5μl水。
扩增程序:94℃5min;94℃30sec,55℃45sec,72℃1min,共35cycles;72℃10min。
3.1.3线虫固定
以下步骤除特殊说明外,均在1.5ml离心管中进行,离心转速取8000rpm,时间为1min,所用各试剂为1ml。
(1)将收集的线虫在1×M9Buffer缓冲液中清洗三次;
(2)在3%的多聚甲醛固定液中4℃固定16h后,室温放置4至5h;
(3)用手术刀来回切割线虫,显微镜下观察直至90%的虫体都被切断;
(4)用1×M9Buffer缓冲液清洗三次;
(5)室温下,蛋白酶K处理虫体1h;
(6)用1×M9Buffer缓冲液清洗一次;
(7)除去1×M9Buffer缓冲液,并将线虫在-20℃处理20min;
(8)加入1ml预冷(-20℃)的甲醇悬浮虫体,-80℃处理30s;
(9)13000rpm,30s沉淀虫体;
(10)加入1ml预冷(-20℃)的丙酮悬浮虫体,-80℃处理1min;
(11)13000rpm,1min沉淀虫体,如果沉淀效果不好,可重复一次;
(12)除去丙酮,留大约100μl在管中,13000rpm,1min沉淀虫体;
(13)滴加水至总体积200μl;
(14)除去上清液后,用1ml杂交液重悬线虫清洗一次,然后再加入1ml杂交液。
3.1.4杂交与显色
以下反应除特殊要求外,均在室温条件下进行:
(1)1ml杂交液中,47℃预杂交15min;
(2)将探针在PCR仪中94℃变性5min;
(3)加入10μl探针至500μl杂交液中,47℃杂交16h;
(4)在4×SSC中55℃清洗3次,每次15min;
(5)在0.1×SSC/0.1%SDS中55℃清洗3次,每次10min;
(6)在马来酸缓冲液中转动清洗一次,5min;
(7)在1×blocking solution中转动处理30min;
(8)在Antibody solution中处理30min;
(9)在washing buffer中清洗3次,每次15min;
(10)在1ml detection buffer中平衡5min;
(11)在1ml新鲜配制的color substrate solution中黑暗静置反应过夜;
(12)加入双蒸水,清洗2次停止显色,显微镜下观察
原位杂交分别用正向引物和反向引物合成了Misp12的正义单链探针和反义探针,其中反义探针信号特异的出现在南方根结线虫的腹食道腺细胞(图2B),而对照正义探针无杂交信号(图2A),说明Misp12在亚腹食道腺细胞特异表达。
3.2洋葱表皮细胞定位试验
3.2.1pEGFP表达载体的构建
构建Misp12基因的绿色荧光蛋白GFP融合表达载体,分别设计加有EcoR I和Hind III酶切位点的带有信号肽序列和去除信号肽序列的基因特异性引物(12spEHF:5’-GCGAATTCATGTCCATCTTCCTTACTTCTGC-3’;12spEHR:5’-GCAAGCTTTTACTTCCGGGGCAACATGA-3’和12nospEHF:5’-ATGAATTCGAGGGTGCAGGCGATC-3’;12nospEHR:ATAAGCTTTTACTTCCGGGGCAACAT),以cDNA为模板扩增Misp12基因的ORF序列,PCR扩增产物使用AxyPrep DNA凝胶回收试剂盒(购自爱思进生物技术(杭州)有限公司)进行纯化,回收PCR产物与载体pUMT18进行连接。连接产物转化大肠杆菌DH5a感受态细胞,待转化子长出后,挑取单克隆,液体培养基培养10h后PCR检测。选取有目的片段插入的克隆送样测序,测序正确的克隆命名为Misp12-sp和Misp12-nosp。
提取质粒pEGAD、Misp12-sp和Misp12-nosp,用限制性内切酶EcoR I和Hind III双酶切,回收相应的目标片段,将回收的含有相同粘性末端的Misp12-sp和Misp12-nosp的ORF片段和pEGAD用T4连接酶16℃进行连接过夜。取连接产物2μl转化大肠杆菌DH5a感受 态细胞。带转化子长出后,挑取单克隆小量制备质粒DNA,用EcoR I和Hind III进行双酶切鉴定,并用ORF特异性引物扩增检测,筛选重组子,命名为G-Misp12-sp和G-Misp12-n osp。
3.2.2农杆菌转化洋葱表皮
3.2.2.1洋葱表皮的预培养
选取新鲜、生长良好的洋葱表皮,除去外面3-4层鳞片,用刀片在其内表皮划出面积为lcm2的小方块,用镊子将小方块撕下,贴近叶肉的一面朝下,平铺于高渗培养基上(MS+蔗糖30g/L+甘露醇0.4mol/L+琼脂5.5g/L,pH 5.8),28℃预培养过夜。
3.2.2.2侵染液的制备
将质粒pEGAD、G-DFR-X和G-SRR-X通过电转化转入农杆菌EHA105,28℃恒温培养2d,筛选转化子。将鉴定后的转化子接种于20mlYEB液体培养基(含有卡那霉素50ug/mL和利福平霉素20ug/mL),28℃200r/min培养过夜,培养物于7000×g离心8min,收集菌体,并重悬于MS悬浮培养基(含10mmol/L MgCl2、150mmol/L乙酰丁香酮、10mmol/L MES)中,调节OD600为0.6-0.8,28℃200r/min培养3h。
3.2.2.3农杆菌侵染和显微观察
将预培养后的洋葱表皮置于100ml的三角瓶中,倒入调制好的农杆菌菌液。浸染20min,期间摇动数次。倒去菌液,用无菌水清洗3遍,洗去表面的农杆菌,灭菌滤纸上吸干表面的水,接入MS固体培养基,20℃暗培养48小时后,用30%的蔗糖质壁分离,荧光显微镜下进行观察并采集照片。
结果观察到带有信号肽序列的Misp12定位在洋葱表皮细胞的质外体空间,而不带有信号肽的Misp12则定位在洋葱表皮细胞的细胞质中(图3)。这说明Misp12基因具有分泌性并从线虫体内分泌后定位到植物细胞质中。
实施例4:
Misp12基因在防治南方根结线虫中的应用:
通过构建Misp12基因的VIGS沉默载体,利用农杆菌介导转化本氏烟草,接种线虫后观察线虫入侵量变化及发育变化来验证该基因是否其作用。VIGS沉默载体是指将Misp12的基因中最特异的片段连接到pTRV2载体中,将构建好的载体和pTRV1分别转入农杆菌菌株GV3101中,注射转入烟草后接种南方根结线虫,观察线虫入侵数量。
4.1 VIGS沉默载体的构建
沉默载体构建主要通过PCR分段扩增Misp12基因中特异性249bp片段Umisp12(其序 列为SEQ ID NO.3所示),转入载体pTRV2,包括以下步骤:
(1)Misp12基因特异片段的扩增:根据Misp12核苷酸序列,设计了特异性引物(Umis p12S:5’CCTGTCACTAACATACCATC3’;Umisp12:5’AATTAGAGACTGCTCCTGTT3’),以南方根结线虫基因组DNA模板进行扩增(如图6所示),将扩增片段Umisp12通过Axy Prep DNA凝胶回收试剂盒(购自爱思进生物技术(杭州)有限公司)回收片段,连接到p MD18-T载体(购自宝生物工程(大连)有限公司)进行测序验证。保存回收片段得到特异性片段UMisp12。
(2)对载体pTRV2EX(Xueqiong Xiao et.al)质粒利用Xcm I进行单酶切,得到的质粒片段两端各突出一个T碱基。利用AxyPrep DNA凝胶回收试剂盒回收质粒片段,将回收的质粒片段和特异性片段UMisp12(PCR扩增后两端各带一个A碱基)利用T4连接酶16℃连接过夜,获得沉默载体pTRV2::UMisp12。
4.2本氏烟草的转化
通过电转化方法将上步得到pTRV2::UMisp12和辅助载体pTRV1载体分别转入农杆菌GV3101,并在LB液体培养基上培养至OD值约为0.5后,8000r/min离心10min收集菌体,用等体积MMA缓冲液(10mmol/L MgCl2、150mmol/L乙酰丁香酮、10mmol/L MES)再次悬浮,25℃震荡培养2h后1∶1混合。选取4~5叶龄的烟草苗(本氏烟),用不带针头的1mL注射器将混合菌液从背面注射渗入烟草叶片,使菌液充满整个叶片,每棵苗注射2~3片叶子。同时以空载体pTRV2和pTRV1注射处理的烟草植株作为对照组。每个处理接种100株烟草苗。
注射完毕后,烟草在温度25℃、光照16h/8h、RH 50%的环境内培养5d,取烟草根部组织提取RNA,方法同1.2.1,利用SuperScriptTM IIIFirst-Strand Synthesis System for RT-PCR合成试剂盒(购自上海英骏生物技术有限公司)合成第一链cDNA,用TRV特异引物(TRVF:5'-GCTGCTAGTTCATCTGCAC-3';TRVR:5'-GCACGGATCTACTTAAAGAAC-3')检测TRV的转化情况,并用上步中的Umisp12S和Umisp12A进行定量PCR检测Misp12的沉默效果。对TRV阳性植株接种南方根结线虫200条/株。接种线虫后的5d,10d,15d,28d,利用酸性品红-次氯酸钠染色法染色计数各处理的线虫入侵数量和各龄期线虫数量,每个处理10次重复,试验进行3次。
具体染色方法:
(1)配制5%次氯酸钠液及酸性品红液。酸性品红的配制方法,将3.5克酸性品红溶于250毫升醋酸,待溶解后,用蒸馏水定容止1000毫升;
(2)洗净烟草幼根组织,在烧杯中加入50ml蒸馏水,再加10ml的5%次氯酸钠液,将烟草根部放入烧杯中浸泡5min,并用玻璃棒轻轻搅拌;
(3)取出根组织,用流水冲洗45后,将根组织放入蒸馏水内10min(除去次氯酸钠);
(4)倒去蒸馏水,将根组织移入另一个盛有30—40ml的蒸馏水的烧杯,在烧杯内注入1ml酸性品红液,在100℃水根组织染液水浴30s;
(5)冷却后,用流水漂洗根组织,将根组织放入20—30ml酸性甘油液(在纯甘油中滴入2-3滴HCl)中煮沸,使根组织褪色,取出根组织在显微镜下观察计数。
沉默实验证明:通过VIGS的烟草感染南方根结线虫后,南方根结线虫中的Misp12基因的表达量明显下降,能下降约70%(图6);相对于对照组,VIGS组烟草植株中各天数的线虫入侵总量都有显著的下降,下降了40%到50%左右(图7A)。而各个龄期的线虫数目比对照组也都有不同程度的下降,并且可以观察到在28d的雌虫总数下降幅度是最多,到达60%以上(图7B)。
实施例5:
Misp12基因在南方根结线虫不同发育龄期的表达情况
将实验室培养的含有南方根结线虫的番茄根系清洗干净后,通过搅拌机搅拌30s后,分别通过100目、200目、375目和500目线虫筛,收集200目、375目和500目筛上的线虫分别在体视显微镜下挑取各龄期的线虫:包括侵染性2龄幼虫(par-J2)、3龄4龄幼虫(J3/4),成熟的雌虫(mature female);非侵染性2龄幼虫(pre-J2)直接由卵块孵化得到,各个龄期的线虫各收集300条。采用TRIzol试剂盒(购自Invitrogen公司)提取RNA并除去所含的DNA,具体方法参考步骤1.2.2。对所提取根结线虫总RNA进行反转录,设计特异性引物(Umisp12S:5’CCTGTCACTAACATACCATC3’;Umisp12:5’AATTAGAGACTGCTCCTGTT3’)进行Real-time PCR分析基因Misp12在南方根结线虫不同发育阶段的表达情况。
结果表明本发明克隆的Misp12基因在南方根结线虫的初期表达量较低,随着入侵后生长发育过程而逐渐表达量升高,并且在线虫成熟过程中有明显的激增(见图5)。
该结果与实施例4结果相吻合:沉默该基因后成熟的雌虫数相比与其它龄期线虫下降的数量尤其明显,说明该基因在线虫的生长发育过程中有重要的作用。因此在生产实践中,可以利用该基因对南方根结线虫进行防治,使得线虫入侵量下降,并控制雌虫数量减少卵块数量,从而降低下一次线虫入侵数量。
SEQUENCE LISTING
<110> 华中农业大学
<120> 防治南方根结线虫相关基因Misp12及其应用
<130> 防治南方根结线虫相关基因Misp12及其应用
<160> 3
<170> PatentIn version 3.1
<210> 1
<211> 1202
<212> DNA
<213> 人工序列
<400> 1
catcaaacaa tctcctcaac aactaataaa ctcaaaaaac accccaaaac aaccctaaaa 60
acaacccaaa aatgtccatc ttccttactt ctgctcttct aatcatttca ataatcgcta 120
tgaccgaggg tgcaggcgat cgaagcgctt caacctctac tggttgtaca acctattttg 180
gcatgcttga tcatgcggat accaaggaaa ataacaaaag aaaaactttc aaacccaacg 240
ataaaaccaa atccaacacc ttgcaagtga ctggtggggc aatgttcagc aatacctcgg 300
tggcgttggt tgtcggtgat aaggcgttat gtatggctaa gacaggaagt tcagacgatt 360
ggggaatgcg ctacgatgct ttgactggaa caatgaaatt tatcatttct gataatatta 420
ctgttgaagt gggtgtgggt ttatataatt ggtgccagac aaatggaaag gcccctgtca 480
ctaacatacc atccggagcg ttcatgttgc cccggaagta actggtggcc cacaaaaggg 540
caatcactat tgattacaac ccaaatatct ataggatttt gacattttct ggcataattt 600
aggtattttc tgacattttt ctgacatttt taactagaat taattcaatt gaaaacaaaa 660
taataggatt gacctaaatg agcgtttctt ggatatcctt ttaacaggag cagtctctaa 720
ttttgtaaga gctcctaatg tttgccctcc tccatctccc tccccctcta tgctcctacc 780
aatgactgat taagttaaaa atcgtacata aaatggagag tgtataaatc tgggtgtata 840
tacaatcagg attcgacttt ataacatttg aaggttccat ttgaagacgt ttttttcttc 900
accgacaaca agtgtgtcat ccagcttgta agctacgata ataaaactaa tgaaactctt 960
ctcaaaatta atgatgtcga cttcaaaatt atccctactg ataagaaaat ttccccgaag 1020
gcttgtacta tgaaaatgtg agcttgtact atgaaaatgt gagggaaaaa agtaaagaaa 1080
agaataacaa aaagtgtaaa tatggaagga taaaaacgaa acaaaaatga atgtgaagta 1140
aaaaataaaa agaaattcaa gtagatttaa aaaaaatgtt aagcttcaca atatctgtct 1200
cc 1202
<210> 2
<211> 149
<212> PRT
<213> 人工序列
<400> 2
Met Ser Ile Phe Leu Thr Ser Ala Leu Leu Ile Ile Ser Ile Ile Ala
1 5 10 15
Met Thr Glu Gly Ala Gly Asp Arg Ser Ala Ser Thr Ser Thr Gly Cys
20 25 30
Thr Thr Tyr Phe Gly Met Leu Asp His Ala Asp Thr Lys Glu Asn Asn
35 40 45
Lys Arg Lys Thr Phe Lys Pro Asn Asp Lys Thr Lys Ser Asn Thr Leu
50 55 60
Gln Val Thr Gly Gly Ala Met Phe Ser Asn Thr Ser Val Ala Leu Val
65 70 75 80
Val Gly Asp Lys Ala Leu Cys Met Ala Lys Thr Gly Ser Ser Asp Asp
85 90 95
Trp Gly Met Arg Tyr Asp Ala Leu Thr Gly Thr Met Lys Phe Ile Ile
100 105 110
Ser Asp Asn Ile Thr Val Glu Val Gly Val Gly Leu Tyr Asn Trp Cys
115 120 125
Gln Thr Asn Gly Lys Ala Pro Val Thr Asn Ile Pro Ser Gly Ala Phe
130 135 140
Met Leu Pro Arg Lys
145
<210> 3
<211> 249
<212> DNA
<213> 人工序列
<400> 3
cctgtcacta acataccatc cggagcgttc atgttgcccc ggaagtaact ggtggcccac 60
aaaagggcaa tcactattga ttacaaccca aatatctata ggattttgac attttctggc 120
ataatttagg tattttctga catttttctg acatttttaa ctagaattaa ttcaattgaa 180
aacaaaataa taggattgac ctaaatgagc gtttcttgga tatcctttta acaggagcag 240
tctctaatt 249
- 还没有人留言评论。精彩留言会获得点赞!