一种中和促细胞程序性坏死抗体的蛋白及其应用的制作方法
本发明涉及生物医药领域;具体地说,本发明涉及一种能够中和促细胞程序性坏死抗体的蛋白及其在炎症治疗中的应用。
背景技术:
肿瘤坏死因子α(TNF)是由各种细胞,主要是巨噬细胞和T细胞分泌的多功能细胞因子。TNF通过TNF受体1和2(TNFR1和TNFR2)行使多种生物学功能(1-3)。
许多TNF功能主要涉及三种胞内事件:1)刺激转录因子核因子kappa B(NF-κB),从而导致细胞激活和细胞因子产生;2)诱导细胞凋亡的外部途径;和3)诱导坏死。这些活性的胞内信号传导途径共有一些组分但导致不同的结果:NF-κB激活导致促炎细胞因子分泌和细胞存活及激活;凋亡是细胞死亡的状态,特征在于胱冬酶-3激活、核断裂、在早期含有完整的细胞膜、炎性反应很少或没有;然而,坏死是细胞死亡的另一机制,其中没有胱冬酶-3的激活,细胞膜的完整性受损。坏死导致刺激强烈免疫和炎性反应的胞内物质释放(4,5)。在凋亡条件下,抑制胱冬酶可导致一种程序性细胞死亡形式,其发生时具备坏死的特征,称为“程序性坏死”(6-11)。由于此类程序性坏死是炎性过程,因此在临床上可能与诸如类风湿性关节炎、克罗恩病和银屑病等疾病相关。然而,迄今为止,尚未鉴定到触发这些疾病中程序性坏死的因子。
通过直接靶向TNF分子(单克隆抗体)或用作假受体的拮抗剂来中和TNF使得炎性疾病的治疗得到根本性变革(12),但完全阻断TNF功能可能导致威胁生命的副作用,例如感染和肿瘤(13)。TNF在很多炎症性疾病(例如风湿性关节炎、炎性肠炎、牛皮癣等等)中都起很重要的病理作用。临床上用抗TNF治疗炎症性疾病非常有效。抗TNF的生物制剂包括:能够中和TNF的抗TNF的单克隆抗体,游离的TNF受体等等。抗TNF制剂的市场是每年150亿美元。
虽然有以上成果,但炎性疾病中细胞和组织破坏的机制仍未知:诱导NF-κB是促生存的,不直接导致细胞死亡-实际上,发现NF-κB信号在炎性肠病中阻止 凋亡(14)。据信,凋亡是抑制炎症的(15)。程序性坏死可能是炎症和细胞/组织破坏的可能机制,但缺乏人临床相关性的证据。例如,在非病毒炎性致病机理中,不知道靶细胞外的何种因子触发程序性坏死(14,16)。显然,鉴定这些因子为诊断和治疗许多炎性疾病提供了生物标志物。
在脓毒症病人中,TNF显著升高并且与病情严重程度呈正相关。然而传统的TNF阻断型抗体和游离的受体均不能有效治疗脓毒症,暗示有其他因素或因子在致病过程中协同TNF起关键作用。
因此,本领域急需调控、甚至逆转细胞坏死的物质手段,从而能治疗炎性疾病。
技术实现要素:
本发明的目的在于提供调控、甚至逆转细胞坏死的物质手段,从而能治疗炎性疾病。
在第一方面,本发明提供一种抑制细胞坏死的多肽,所述多肽衍生自野生型TNFα,并且包含10-200个氨基酸残基和序列QLVVPSE,其中,所述多肽不结合TNFR1但与TNF竞争结合促细胞坏死抗体。
在具体的实施方式中,所述野生型TNFα是氨基酸序列如SEQ ID NO:1所示的人源TNFα。
在具体的实施方式中,所述促细胞坏死抗体具有:SEQ ID NO:9所示的轻链;和/或SEQ ID NO:10所示的重链。
在具体的实施方式中,所述多肽的氨基酸序列选自下组:SEQ ID NO:2-8。
在优选的实施方式中,所述多肽是可溶性多肽。
在具体的实施方式中,所述多肽的氨基酸序列如SEQ ID NO:2、3或4所示。
在第二方面,本发明提供本发明第一方面所述的多肽的用途,所述多肽用于制备抑制细胞坏死或治疗细胞坏死相关疾病的药物。
在具体的实施方式中,所述细胞坏死相关疾病是炎性疾病。
在具体的实施方式中,所述炎性疾病包括但不限于类风湿性关节炎、克罗恩病、银屑病、脓毒症。
在第三方面,本发明提供一种抑制细胞坏死的药物组合物,所述药物组合物包含治疗有效量的本发明第一方面所述的多肽和药学上可接受的载体。
在优选的实施方式中,所述多肽的氨基酸序列选自下组:SEQ ID NO:2-8。
在优选的实施方式中,所述多肽是可溶性多肽。
在优选的实施方式中,所述多肽的氨基酸序列如SEQ ID NO:2、3或4所示。
在具体的实施方式中,所述药物组合物是静脉内给药的注射剂。
在第四方面,本发明提供一种处理患者血液的透析装置,所述透析装置包含本发明第一方面所述的多肽。
在优选的实施方式中,所述透析装置用于去除或中和所述患者血液中的促细胞坏死抗体。
在优选的实施方式中,所述促细胞坏死抗体具有:SEQ ID NO:9所示的轻链;和/或SEQ ID NO:10所示的重链。
在优选的实施方式中,所述透析装置是透析柱。
在第五方面,本发明提供一种抑制或中和患者血液中的促细胞坏死抗体的方法,包括利用本发明第一方面所述的多肽抑制或中和所述患者血液中的促细胞坏死抗体。
在优选的实施方式中,所述促细胞坏死抗体具有:SEQ ID NO:9所示的轻链;和/或SEQ ID NO:10所示的重链。
在优选的实施方式中,所述方法包括将本发明第一方面所述的多肽给予,例如通过注射给予有此需要的患者以抑制或中和患者血液中的促细胞坏死抗体。
在优选的实施方式中,所述方法包括利用本发明第一方面所述的多肽进行透析来抑制或中和所述患者血液中的促细胞坏死抗体。
在优选的实施方式中,所述方法包括利用包含本发明第一方面所述的多肽的透析装置来抑制或中和所述患者血液中的促细胞坏死抗体。
在优选的实施方式中,所述透析装置是透析柱。
在优选的实施方式中,所述方法用于治疗细胞坏死相关疾病。
在优选的实施方式中,所述治疗细胞坏死相关疾病是炎性疾病。
在优选的实施方式中,所述炎性疾病包括但不限于类风湿性关节炎、克罗恩病、银屑病、脓毒症。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示从33株单克隆抗体中筛选能够结合TNF的单抗,其中ELISA试验证明244-12结合TNF最强;
图2显示抗体244-12与TNF结合不影响TNF与细胞表面受体结合,其中“Merge”表示合并,“alone”表示仅有抗体244-12;
图3显示抗体244-12在两个细胞株都阻断TNF引起的细胞凋亡(即活性胱冬酶-3表达)。其中,上图是L929细胞(小鼠成纤维细胞瘤细胞);下图是C28I2细胞(软骨细胞);
图4显示抗体244-12与TNF引起L929细胞坏死。图中纵坐标表示细胞凋亡(活性胱冬酶-3);横坐标表示细胞坏死(细胞膜完整性破坏)。其中,TNF引起细胞凋亡(上图右);加入对照抗体M26(阻断TNF结合受体),L929细胞存活(中图右);加入244-12与TNF,L929细胞坏死(下图右);
图5显示抗体244-12+TNF引起的坏死可以被Nec-1抑制。其中,244-12+TNF加入Nec-1后(上图右),细胞坏死又转变成细胞凋亡。说明细胞坏死是通过信号传导,即程序性坏死。
图6显示类风湿性关节炎患者滑液中的自身抗体触发程序性坏死;
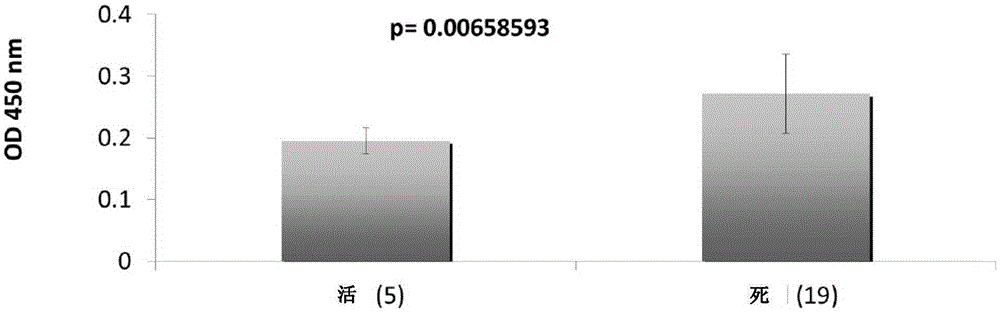
图7显示脓毒症病愈患者(5人)与死亡患者(19人)中与本发明抗体244-12竞争抗原结合位点的抗体平均水平。二者相差非常显著。P<0.01;
图8是pNIC28Bsa4载体的示意图,其中显示了与克隆可表达相关的重要组成部分。
图9显示本发明的多肽P11-17既能够结合纯化的促细胞坏死抗体(244-12),又能够结合有促细胞坏死抗体关节炎病人关节液中的自身抗体(SF024,SF045)。但与不含促细胞坏死抗体的对照病人关节液反应为阴性(SF010)。酶标板用2μg/ml的P11-17包被,BSA封闭后分别与244-12、SF024、 SF045、SF010在室温下孵育1小时,然后用辣根过氧化物歧化酶标记的抗鼠或人IgG的二抗进行识别。
图10显示本发明的多肽P11-17及SEQ ID NO:2所示多肽都可以有效抑制细胞坏死。不论细胞坏死是由纯化的促细胞坏死抗体(244-12)引起的,还是由病人关节液中(SF002,SF045)促细胞坏死抗体引起的。
图11显示本发明的多肽P12-10、P13-1、P13-2及P13-3能够竞争抑制TNF与单抗244-12的结合。
具体实施方式
发明人经过广泛而深入的研究,出乎意料地发现自身抗体244-12在TNF存在下可以将TNF-诱导的凋亡转为程序性坏死,继而发现部分炎症病人如关节炎、脓毒症病人体内存在类似的引起程序性坏死的自身抗体,且这部分病人病情明显加剧。进一步地,发明人制备了能够阻断患者的自身抗体的多肽,进而可以治疗炎症但不产生严重的副作用。在此基础上完成了本发明。
本文所述的凋亡或细胞凋亡是指细胞程序性死亡,即,细胞通过信号传导的死亡。其特征在于细胞萎缩、细胞核断裂、但细胞膜完整。由于细胞膜完整而且凋亡的细胞很快被巨噬细胞吞噬,因此细胞凋亡不引起炎症。
本文所述的坏死或细胞坏死是指细胞受外力破坏而死亡,其特征在于细胞破碎,胞膜破坏而不完整。坏死时细胞释放出很多炎性物质比如核酸、尿酸、HMGB1等等,因此会引起炎症反应。
本文所述的程序性坏死或细胞程序性坏死是指细胞通过信号传导的死亡。其特征在于细胞破碎,细胞膜破坏而不完整。同上述细胞坏死一样,在程序性坏死过程中,坏死细胞释放出很多炎性物质,例如核酸、尿酸、HMGB1等等,因此会引起炎症反应。
TNF及其功能
TNF是主要由巨噬细胞和T细胞分泌的多功能细胞因子。其通过TNF受体1和2(TNFR1和TNFR2)行使多种生物学功能,包括刺激转录因子核因子kappa B(NF-κB);诱导细胞凋亡的外部途径;和诱导坏死。
在大多数情况中,TNF刺激细胞主要激活NF-κB以供细胞存活。凋亡和坏死仅在NF-κB途径受抑制时触发(24)。有人提出TNF刺激膜结合复合物I(25),其启动NF-κB激活但不启动凋亡/坏死。然而,如果NF-κB激活受阻止,TNF刺激其靶细胞在胞质中形成第二复合物(复合物II),其将信号途径导向细胞死亡。
目前的所有研究强调TNF-TNFR1结合后的下游结果。然而,没有在可能导致观察到不同细胞功能的TNF-TNFR1相互作用的水平上研究过微妙的分子基础。常规的概念一般是,TNF-TNFR1结合足以启动所有的TNF功能,包括刺激NF-κB和诱导细胞死亡。现有技术还研究了衍生自人TNFα的短肽,有的明显引起细胞凋亡,有的明显引起细胞坏死。并且各种短肽的溶解性可能有显著不同,从而会影响短肽的成药性能。
抗体
在本文中,“抗体”、“单克隆抗体”、“244-12”或“自身抗体”具备相同的含义,是指能够结合TNF,特别是能够特异性结合序列QLVVPSE,即,结合表位为QLVVPSE的抗体。所述抗体能引起细胞的程序性坏死。
在本文中,所述抗体不仅包括完整的单克隆抗体,还包括具有免疫活性的抗体片段,如Fab或(Fab’)2片段;抗体重链;抗体轻链。在具体的实施方式中,所述抗体具有:SEQ ID NO:9所示的轻链;和/或SEQ ID NO:10所示的重链。
本发明的多肽
为提供一种调控、甚至逆转细胞坏死的物质手段,本发明提供了这样一种多肽,所述多肽能够结合能引起细胞程序性坏死的上述自身抗体而不结合TNFR1,从而能抑制细胞的坏死,进而能治疗或减轻炎症。
在具体的实施方式中,本发明提供一种衍生自野生型TNFα的抑制细胞坏死的多肽,所述多肽包含10-200个氨基酸残基(优选10-180个、更优选10-160个氨基酸残基)和序列QLVVPSE。在具体的实施方式中,所述野生型TNFα是氨基酸序列如SEQ ID NO:1所示的人源TNFα。
在优选的实施方式中,所述多肽的氨基酸序列选自下组:SEQ ID NO:2-8。在进一步优选的实施方式中,本发明的多肽是可溶性多肽,从而能够提供优异的成药 性能。
在具体的实施方式中,所述多肽的氨基酸序列如SEQ ID NO:2、3或4所示。
药物组合物
在本发明的多肽的基础上,本发明进一步提供一种抑制细胞坏死的药物组合物,所述药物组合物包含治疗有效量的本发明多肽和药学上可接受的载体。
本文所用的术语“有效量”或“治疗有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的用量。
本文所用的术语“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
本发明的药物组合物含有安全有效量的本发明多肽作为活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物的剂型可以为固体形式或溶液形式,优选溶液形式,例如注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。
本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。根据治疗状况的要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
本发明所述的药学上可接受的载体、活性成分的有效量以及给药方式都是本领域的普通技术人员所熟知的。
鉴于其功能,本领域技术人员知晓本发明的多肽以及药物组合物能够抑制细胞坏死,进而治疗细胞坏死相关的疾病,包括但不限于炎性疾病。在具体的实施方式中,所述炎性疾病包括但不限于类风湿性关节炎、克罗恩病、银屑病、脓毒症。
基于本发明的多肽以及药物组合物,本发明还提供了抑制细胞坏死或治疗细胞坏死相关疾病,例如炎性疾病的方法,包括给予有此需要的对象本发明的多肽或包含本发明多肽的药物组合物。
本发明的主要优点在于:
1.本发明首次发现能够中和引起细胞的程序性坏死的自身抗体的多肽;
2.本发明的成果具备显著的临床意义;
3.本发明的多肽能够治疗、缓解或减轻炎症反应。
4.本发明的多肽不与TNF受体结合,所以不影响TNF的正常功能;不像目前临床用的抗TNF单抗或TNF游离受体的抗炎症疗法因抑制TNF功能而引起结核感染及肿瘤发生等副作用。
下面结合具体实施例,进一步详述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。本发明实施例中所用的实验材料如无特殊说明均可从市售渠道获得。
材料与方法
患者
患者由风湿病诊所或ICU病房募集,所有样品保存在-80℃直至分析。作为治疗性关节穿刺术的一部分,滑液从炎性疾病患者的膝关节吸取。根据1987美国风湿病学院或2010ACR/EULAR分类标准定义类风湿性关节炎;其它炎性关节病基于临床和X光照相标准诊断。所有风湿病患者呈风湿病因子血清反应阳性,具有中等疾病活性。脓毒症患者按照1992年美国胸科医师协会确立标准诊断。在捐献者知情同意下,完全按照国家和制度伦理要求收集获得的样品和/或数据。
细胞系、TNF和多肽
小鼠纤维肉瘤L929细胞和人淋巴细胞Jurkat A3细胞购自美国模式培养物保藏所(ATCC,Manassas,VA)。人C28I2软骨细胞由Mary B.Goldring博士提供。.人SaOs-2成骨细胞购自Sigma。TNF购自Immunotools(德国)。
凋亡和坏死试验
在含或不含20μM z-VAD-FMK(R&D Systems,明尼阿波利斯,明尼苏达州)或20μM Necrotatin-1(PeproTech,Rocky Hill,新泽西州)的TNF(Immunotools,Friesoythe,德国)或TNF肽存在下,温育细胞过夜(或温育图中所示的时间)。在一些实验中,TNF与细胞和所示浓度的单克隆抗体或滑液共培养。根据生产商手册的指导,利用活/死细胞染色试剂盒(Invitrogen,Paisley,英国)染色细胞,利用cytofix/cytoperm固定/透化溶液试剂盒(BD Pharmingen,牛津,英国)固定。然后利用FITC-偶联的抗-胱冬酶-3抗体(Cell Signaling Technology,Danvers,马萨诸塞州,美国)作胞内染色。用CyAn流式细胞仪(Beckman Coulter,Fullerton,加利福尼亚州)获取细胞,利用Flowjo(Tree Star Inc.Ashland,俄勒冈州)分析数据。
ELISA
筛选单克隆抗体/抑制试验
4℃,用2μg/ml TNF包被ELISA平板过夜,或在37℃包被2小时,然后在37℃与单克隆抗体温育1小时。与HRP偶联的第二抗体用于检测反应。对于抑制试验,将TNFR1或滑液与单克隆抗体一起加入。
TNF结合TNFR1
如下所示通过ELISA测试TNFR1与TNF的结合:4℃,用1.5μg/ml TNF或mTNF-HA包被ELISA平板过夜,或在37℃包被2小时。37℃与TNFR1(1μg/ml)温育2小时后,与抗-TNFR1或抗-HA抗体再温育两小时,加入与HRP偶联的第二抗-小鼠IgG抗体,30分钟,然后加入其底物以供检测。显色,并利用Wallace Victor2 1420多标记计数器(PerkinElmer,Massachusetts,马萨诸塞州,美国)在OD 450nm下检测。
L929细胞免疫荧光显微术
室温下,将20ng/ml的TNF与2μg/ml的mAb M26或244-12温育1小时。TNF/M26或TNF/244-12的混合物在冰上与生长在盖玻片上的L929细胞再温育 15分钟。用4%低聚甲醛(PBS配制)固定细胞10分钟,用含0.5%BSA和0.1%冷水鱼明胶的磷酸盐缓冲液阻断15分钟,然后再与家兔抗-TNFR1抗体(Abcam)温育1小时。用PBS洗涤细胞,然后与偶联于Alexa Fluor 488或Alexa Fluor 568(Invitrogen)的相关第二抗体温育。然后用Gelvatol/DABCO(Sigma-Aldrich)安装PBS-洗涤的样本。用DAPI(Sigma-Aldrich)复染DNA。利用Nikon Eclipse 80i,以60x通过荧光显微术分析所有样品。利用Hamamatsu照相机,以NIS-Elements AR3.0软件获取图像。
多肽及蛋白合成及检测方法:
采用常规方法,合成SEQ ID NO:2-4所示氨基酸序列相应的编码核苷酸序列,然后利用大肠杆菌表达并纯化。纯化的产物经SDS电泳及质谱仪(Bruker Daltonics Ultraflex TOF/TOF mass spectrometer)确认。
SEQ ID NO:5-8所示氨基酸序列及其修饰序列,例如N端或C端生物素化(如果需要的话)是根据Fmoc策略在APEX396自动多肽合成仪上合成。用质谱仪(Bruker Daltonics Ultraflex TOF/TOF mass spectrometer)确认合成的多肽。
实施例
实施例1.单克隆抗体244-12的制备及其结合表位的鉴定
发明人通过常规方法制备了33株单克隆抗体,并检验所制得的单克隆抗体与TNF的结合情况,其中,ELISA试验证明单克隆抗体244-12结合TNF最强。
随后,发明人鉴定了单克隆抗体244-12的结合表位,为QLVVPSE。
实施例2.单克隆抗体244-12将TNF相关凋亡转为程序性坏死
发明人研究了单克隆抗体(mAb)244-12对TNF功能的影响。
首先,图2中的共聚焦显微镜照片显示单克隆抗体244-12结合TNF并不影响TNF结合TNF受体。在共聚焦显微镜下,TNF受体染红色,244-12染绿色。其中,上图显示当有TNF存在时,绿色与红色重叠(黄色),说明244-12与TNF及TNF受体重叠;下图显示没有TNF时,只有红色,说明244-12不能直接结合到细胞表面。
随后,发明人观察到TNF刺激L929细胞引起细胞凋亡(活性胱冬酶-3表达),而当加入单抗244-12时,细胞凋亡受到抑制(活性胱冬酶-3抑制)。图3显示单克隆抗体244-12在两个细胞株,L929细胞(小鼠成纤维细胞瘤细胞,上图) 和C28I2细胞(软骨细胞,下图)都阻断TNF引起的细胞凋亡(即,活性胱冬酶-3表达)。
然而,出乎意料的是,当单克隆抗体244-12加入TNF与L929细胞中时,虽然凋亡被抑制,但是细胞却发生了坏死。图4显示抗体244-12与TNF引起L929细胞坏死。其中,TNF引起细胞凋亡(上图右);加入对照抗体M26(阻断TNF结合受体),L929细胞存活(中图右);加入244-12与TNF,L929细胞坏死(下图右)。
发明人经过进一步研究证明,244-12+TNF引起的坏死是通过信号传导的。图5显示本发明的抗体244-12+TNF引起的坏死可以被Nec-1抑制。其中,244-12+TNF加入Nec-1后,细胞坏死又转变成细胞凋亡(上图右)。说明细胞坏死是通过信号传导,即程序性坏死。
实施例3.类风湿性关节炎患者滑液中的自身抗体触发程序性坏死
我们意外的发现,在一些未经治疗的风湿性关节炎或骨关节病的患者关节液中存在着很高的抗体(图6A)。这些抗体可以与244-12竞争抗原结合位点(图6B)。这些含有抗体的关节液能够引起细胞程序性坏死(图6C)。
其中,图6A显示在一些关节炎病人的关节液存在抗TNF的自身抗体。患者SF8的关节液含有很高的自身抗体。6B显示自身抗体与244-12竞争TNF结合点。在244-12与TNF结合试验(ELISA)中加入SF8关节液,则244-12与TNF结合被抑制。6C显示SF8关节液在TNF存在下引起程序性坏死。TNF引起L929细胞凋亡(上图右),当加入SF8关节液,细胞转变成程序性坏死(中图右)。而对照关节液SF4则不引起坏死(下图右)。
发明人又观察了24位脓毒症患者,14位患者检测出与244-12竞争抗原结合位点的抗体,另外10位患者不含类似的抗体。14位含有与244-12竞争抗原结合位点的抗体的患者虽经精心护理和治疗,仍然全部死亡。而其它10位患者有5位死亡,另外5位在2-3周后痊愈出院。死亡患者中抗体水平非常显著地高于病愈组(p<0.01)(图7)。
实施例4.
本发明人进一步研究了特异性结合其它TNF分子及片段的抗体,并没有发现这些抗体具有将TNF相关凋亡转为程序性坏死的效果;
此外,本发明人以全长TNF进行筛选,发现仅特异性结合QLVVPSE的抗体 具有将TNF相关凋亡转为程序性坏死的效果。
实施例5.本发明多肽的制备
如“材料与方法”中“多肽及蛋白合成及检测方法”所述制备如下所示的本发明多肽并检测、确认:
SEQ ID NO:2:VRSS SRTPSDKPVA HVVANPQAEG QLQWLNRRAN ALLANGVELR DNQLVVPSEG LYLIYSQVLF KGQGCPSTHV LLTHTISRIA VFHQTKVNLL SAIKSPCQRE TPEGAEAKPW YEPIYLGGVF QLEKGDRLSA EINRPDYLDF AESGQVYFGI IAL;
P11-17:QLQWLNRRAN ALLANGVELR DNQLVVPSEG LYLIYSQVLF KGQGCPSTHV LLTHTISRIA VSYQTKVNLL SAIKSPCQRE(SEQ ID NO:3);
P11-17(突变型,SY突变):QLQWLNRRAN ALLANGVELR DNQLVVPSEG LYLIYSQVLF KGQGCPSTHV LLTHTISRIA VFHQTKVNLL SAIKSPCQRE(SEQ ID NO:4);
P12-10:RDNQLVVPSE(SEQ ID NO:5);
P13-1:DNQLVVPSEG(SEQ ID NO:6);
P13-2:NQLVVPSEGL(SEQ ID NO:7);
P13-3:QLVVPSEGLY(SEQ ID NO:8)。
实施例6.本发明多肽中和促细胞坏死抗体的活性
本发明人进一步研究了本发明多肽与促细胞坏死抗体的结合,进而竞争抑制TNF与促细胞坏死抗体结合的能力以及本发明多肽抑制细胞坏死的能力。
如图9所示,本发明多肽P11-17(SEQ ID NO:3)既能够结合纯化的促细胞坏死抗体(244-12),又能够结合存在于关节炎病人关节液中的促细胞坏死抗体(样品SF024、样品SF045)。但与不含自身抗体的对照病人关节液反应为阴性(SF010)。酶标板用2μg/ml P11-17包被,BSA封闭后,分别与244-12、SF024、SF045、SF010室温孵育1小时,然后用辣根过氧化物歧化酶标记的抗鼠或人IgG的二抗进行识别。
图10显示,本发明的多肽P11-17和SEQ ID NO:2都可以有效抑制细胞坏死。不论细胞坏死是由纯化的促细胞坏死抗体(244-12)引起的,还是由病人关节液中(SF002、SF045)的促细胞坏死抗体引起的。
图11显示,本发明的多肽P12-10、P13-1、P13-2及P13-3能够竞争抑制TNF 与单抗244-12的结合。P12-10、P13-1、P13-2及P13-3显著抑制TNF与单抗244-12的结合。方法:TNF包被酶联板,每孔分别加入所示多肽,然后加入单抗244-12。如果多肽与244-12结合,则抑制244-12与TNF结合。
本发明的多肽与促细胞坏死抗体的结合能力以及本发明多肽抑制细胞坏死的能力总结于下表。
讨论
基于本发明的发现,本发明人提出炎症的新治疗策略。程序性坏死的机制涉及自身抗体和TNF。程序性坏死是炎症的原因之一。目前炎性疾病的治疗策略之一是通过抑制TNF来阻断TNF。该策略对于抑制炎症有效,但可能导致危及生命的副作用,例如TB或淋巴瘤。本发明人提出通过本发明多肽阻断自身抗体(不结合TNFR1)的替代方法。该策略的结果可能是在降低炎性负荷的同时抑制程序性坏死,但将TNF维持在原位,从而阻止肿瘤和严重的感染,例如TB。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
参考文献
1.Chan,K.F.,Siegel,M.R.,and Lenardo,J.M.2000.Signaling by the TNF receptor superfamily and T cell homeostasis.Immunity 13:419-422.
2.Thoma,B.,Grell,M.,Pfizenmaier,K.,and Scheurich,P.1990.Identification of a 60-kD tumor necrosis factor(TNF)receptor as the major signal transducing component in TNF responses.J Exp Med 172:1019-1023.
3.Idriss,H.T.,and Naismith,J.H.2000.TNF alpha and the TNF receptor superfamily:structure-function relationship(s).Microsc Res Tech 50:184-195.
4.Van Herreweghe,F.,Festjens,N.,Declercq,W.,and Vandenabeele,P.2010.Tumor necrosis factor-mediated cell death:to break or to burst,that's the question.Cell Mol Life Sci 67:1567-1579.
5.Kono,H.,and Rock,K.L.2008.How dying cells alert the immune system to danger.Nat Rev Immunol 8:279-289.
6.Declercq,W.,Vanden Berghe,T.,and Vandenabeele,P.2009.RIP kinases at the crossroads of cell death and survival.Cell 138:229-232.
7.Hitomi,J.,Christofferson,D.E.,Ng,A.,Yao,J.,Degterev,A.,Xavier,R.J.,and Yuan,J.2008.Identification of a molecular signaling network that regulates a cellular necrotic cell death pathway.Cell 135:1311-1323.
8.Galluzzi,L.,and Kroemer,G.2008.Necroptosis:a specialized pathway of programmed necrosis.Cell 135:1161-1163.
9.Vandenabeele,P.,Galluzzi,L.,Vanden Berghe,T.,and Kroemer,G.2010.Molecular mechanisms of necroptosis:an ordered cellular explosion.Nature Reviews Molecular Cell Biology 11:700-714.
10.Berghe,T.V.,Vanlangenakker,N.,Parthoens,E.,Deckers,W.,Devos,M.,Festjens,N.,Guerin,C.J.,Brunk,U.T.,Declercq,W.,and Vandenabeele,P.2010.Necroptosis,necrosis and secondary necrosis converge on similar cellular disintegration features.Cell Death Differ 17:922-930.
11.Chan,F.K.,Shisler,J.,Bixby,J.G.,Felices,M.,Zheng,L.,Appel,M.,Orenstein,J.,Moss,B.,and Lenardo,M.J.2003.A role for tumor necrosis factor receptor-2and receptor-interacting protein in programmed necrosis and antiviral responses.J Biol Chem 278:51613-51621.
12.Feldmann,M.2009.Translating molecular insights in autoimmunity into effective therapy.Annu Rev Immunol 27:1-27.
13.Scheinfeld,N.2004.A comprehensive review and evaluation of the side effects of the tumor necrosis factor alpha blockers etanercept,infliximab and adalimumab.J Dermatolog Treat 15:280-294.
14.Gunther,C.,Neumann,H.,Neurath,M.F.,and Becker,C.2013.Apoptosis,necrosis and necroptosis:cell death regulation in the intestinal epithelium.Gut 62:1062-1071.
15.Rock,K.L.,and Kono,H.2008.The inflammatory response to cell death.Annu Rev Pathol 3:99-126.
16.Linkermann,A.,and Green,D.R.2014.Necroptosis.N Engl J Med 370:455-465。
- 还没有人留言评论。精彩留言会获得点赞!