细胞或组织的玻璃化冷冻保存用夹具的制作方法
本发明涉及将生物的细胞或组织等冷冻保存时使用的玻璃化冷冻保存用夹具。
背景技术:
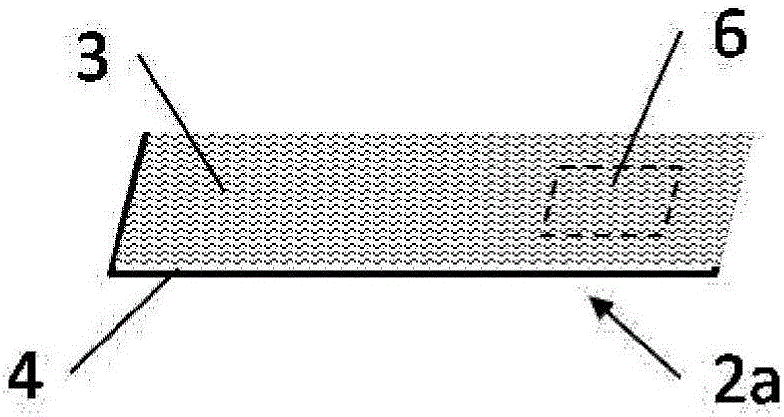
:在各种各样的产业领域中需要生物的细胞或组织的优异的保存技术。例如,在牛的胚胎移植技术中使用的胚胎是配合受胎牛的发情周期进行移植的,为了配合发情周期进行胚胎的移植,将胚胎冷冻保存,配合发情周期地将胚胎融解而进行移植。而且,在人的不孕治疗中,在从母体采集卵子或卵巢后,为了配合适于移植的时机而冷冻保存,在移植时融解使用。一般而言,从活体内采集的细胞或组织例如即使是在培养液中,也会逐渐失去活性,因此,在活体外的细胞或组织的长期培养是不可取的。为此,用于不丧失生物活性地长期保存的技术是重要的。借助优异的保存技术,可以更加准确地分析所采集的细胞或组织。另外,借助优异的保存技术,可以在保持更高的生物活性的状态下将细胞或组织用于移植,有望提高移植后的成活率。此外,也可以将在活体外培养的培养皮肤和在活体外构筑的所谓细胞片之类的移植用的人工组织依次生产保存,在必要时使用,不仅在医疗方面,在产业方面也可以期待很大的优势。作为细胞或组织的保存方法,例如已知有缓慢冷冻法。在该方法中,首先,在通过使例如磷酸缓冲生理盐水等生理溶液中含有冷冻保护剂而得的保存液中浸渍细胞或组织。作为该冷冻保护剂,使用甘油、乙二醇等化合物。将细胞或组织浸渍在该保存液中后,通过以比较慢的冷却速度(例如0.3~0.5℃/分钟的速度)冷却至-30~-35℃,而将细胞内外或组织内外的溶液充分冷却,粘度变高。在此种状态下,如果将该保存液中的细胞或组织进一步冷却至液氮的温度(-196℃),则细胞内或组织内以及其外面的周围的少许溶液均会在保持非晶的状态下发生变为固体的玻璃化。可以认为,当由于玻璃化而使细胞内外或组织内外固化时,分子的运动就会真正消失,因此通过将经过玻璃化的细胞或组织在液氮中保存,可以半永久地保存。然而,在所述缓慢冷冻法中,由于需要以比较慢的冷却速度冷却,因此在用于冷冻保存的操作中需要时间。另外,还存在有需要用于进行温度控制的装置或夹具的问题。此外,在所述缓慢冷冻法中,由于在细胞外或组织外的保存液中形成冰晶,因此细胞或组织有可能遭受该冰晶造成的物理性损害。作为用于解决所述缓慢冷冻法中的问题的方法,提议过玻璃化保存法。所谓玻璃化保存法,是利用了如下原理的方法,即,由于大量含有甘油、乙二醇、DMSO(二甲亚砜)等冷冻保护剂的水溶液的凝固点降低,使得即使在冰点下也难以形成冰晶。当使该水溶液在液氮中急速冷却时,就可以在不产生冰晶的状态下直接固体化。将这样的固体化称作玻璃化冷冻。另外,将大量含有冷冻保护剂的水溶液称作玻璃化液。作为所述玻璃化法的具体操作,是在玻璃化液中浸渍细胞或组织,其后,在液氮的温度(-196℃)进行冷却。由于玻璃化法是此种简便且迅速的工序,因此具有如下的优点,即,在用于冷冻保存的操作中不需要很长时间,此外,不需要用于温度控制的装置或夹具。如果使用玻璃化保存法,则细胞内外均不产生冰晶,因此可以避免冷冻时和融解时对细胞的物理性伤害(冻害),然而玻璃化液中含有的高浓度的冷冻保护剂具有化学性毒性。因此,在细胞或组织的冷冻保存时,优选存在于细胞或组织周围的玻璃化液少,且优选细胞在玻璃化液中暴露的时间、也就是冷冻之前的时间短。此外,解冻后需要立即将玻璃化液稀释。关于使用玻璃化保存法的细胞或组织的冷冻保存,给出过利用各种方法、使用了各种细胞或组织的例子。例如,专利文献1显示,从冷冻保存及融解后的生存率的方面考虑,玻璃化保存法在动物或人的生殖细胞或体细胞中的应用极为有用。玻璃化保存法主要是使用人的生殖细胞发展起来的技术,然而最近也广泛地研究在iPS细胞和ES细胞上的应用。另外,非专利文献1显示,在果蝇胚胎的保存中玻璃化保存法是有效的。此外,专利文献2显示,在植物培养细胞和组织的保存中,玻璃化保存法是有效的。如此所述,已知玻璃化保存法可以广泛地用于各种各样的细胞及组织的保存。作为用于更加有效地进行玻璃化保存法的夹具和操作方法,专利文献3等进行过如下的尝试,即,在细管中充满玻璃化液的过程中,将卵子或胚胎进行玻璃化冷冻保存,解冻时尽快与稀释液接触而提高再生率。专利文献4提出如下的方法,即,将卵子或胚胎与玻璃化液一起放在玻璃化保存用除去材料上,通过从下部抽吸而除去附着在卵子或胚胎的周围的多余的玻璃化液,以优异的生存率冷冻保存。而且,作为玻璃化保存用除去材料,还记载过金属丝网、由纸等天然物质或合成树脂制成的膜状物且具有贯通孔的材料。专利文献5提出如下的方法,即,通过将附着于卵子或胚胎的周围的多余的玻璃化液利用滤纸等吸收体吸收,而以优异的生存率进行冷冻保存。专利文献6、专利文献7提出如下的方法,即,在人的不孕治疗领域中使用的所谓的被称作Cryotop法的方法中,使用作为卵子附着保持用带使用了长方形的挠曲性且无色透明的膜的卵子冷冻保存用具,在显微镜下使卵子或胚胎与极少量玻璃化液一起附着在该膜上,进行冷冻保存。专利文献8提出利用玻璃化法的冷冻细胞片的制造方法,记载有如下的方法,即,将细胞片与运送辅助膜(作为材质主要由纤维素构成的片的Cellseed公司制CellShifter或PVDF膜)一起放在由网眼状的网等制成的台座上,在吸取或去掉多余的玻璃化液后,将细胞片冷冻保存。现有技术文献专利文献专利文献1:日本专利第3044323号公报专利文献2:日本特开2008-5846号公报专利文献3:日本特开平10-248860号公报专利文献4:国际公开第2011/070973号小册子专利文献5:日本特开2005-40073号公报专利文献6:日本特开2002-315573号公报专利文献7:日本特开2006-271395号公报专利文献8:日本特开2013-111017号公报非专利文献非专利文献1:Steponkusetal.,Nature345:170-172(1990)技术实现要素:发明所要解决的问题专利文献3中提出的方法由于使细管中充满玻璃化液,因此存在有达到冷冻的时间长的问题。另外,由于可以冷冻保存的细胞或组织的大小受细管的内径限制,因此很难保存多个细胞或细胞片之类的片状的组织。专利文献4提出的方法是通过除去附着在卵子或胚胎的周围的多余的玻璃化液而以优异的生存率将这些生殖细胞冷冻保存的方法。然而,上述公报记载的方法由于在除去多余的玻璃化液时需要从下部进行抽吸操作,因此导致烦杂的操作,不适于在短时间内进行玻璃化冷冻保存操作的情况。此外,如果从下部的抽吸不充分,则会有残留多余的玻璃化液的问题。专利文献5提出通过将附着在卵子或胚胎的周围的多余的玻璃化液吸收至滤纸等吸收体中而以优异的生存性冷冻保存这些生殖细胞的方法。然而,在用于细胞之间重叠的细胞的集团或组织的玻璃化保存的情况下,由于使用比较大量的玻璃化液,因此吸收体的强度不足,缺乏自立性,会有操作性明显降低的问题。专利文献6、专利文献7提出的方法中,记载有通过限制载放卵子或胚胎的膜的宽度而将卵子或胚胎与少量的玻璃化液一起冷冻保存的方法。该方法中,利用操作者的操作,将卵子或胚胎与极少量的玻璃化液一起放在膜上,然而存在有操作的难度高的问题。以该方法为基础的Cryotop法中,为了将卵子或胚胎与更少量的玻璃化液一起冷冻保存,有时也要进行如下的烦杂的操作,即,在先将卵子或胚胎与玻璃化液一起放在膜上后,抽吸多余的玻璃化液而将其从膜上除去。另外,例如不适于应用于细胞片之类的片状且具有大面积的组织的冷冻保存。专利文献8中记载有如下的方法,即,将细胞片与运送辅助膜(Cellseed公司制CellShifter或聚偏二氟乙烯(PVDF)膜)一起放在例如玻璃板、金属板、网眼状的网、无纺布等台座上,吸取或去掉多余的玻璃化液后,进行冷冻保存,然而在与细胞或组织一起滴下的玻璃化液的量多的情况下,由于玻璃化液的吸收速度不够充分,因此会有残留多余的玻璃化液的问题。此外,由于通常CellShifter或PVDF膜是膜状的结构体,缺乏自立性,因此难以使得冷冻操作、融解操作容易。本发明的主要目的在于,提供可以容易并且可靠地进行细胞或组织的冷冻保存操作的玻璃化冷冻保存用夹具。更具体而言,第一目的在于,提供一种玻璃化冷冻保存用夹具,其在将细胞或组织浸渍于玻璃化液中、将细胞或组织与玻璃化液一起载放于该玻璃化冷冻保存用夹具中时,具备用于吸收多余的玻璃化液的优异的吸收性能。另外,第二目的在于,提供一种玻璃化冷冻保存用夹具,其除了所述的玻璃化液的优异的吸收性能以外,还具有可以利用透射型的显微镜观察与玻璃化液一起载放于该玻璃化冷冻保存用夹具的细胞或组织的优异的观察性。用于解决问题的方法本发明人等为了解决上述问题进行了深入研究,结果发现,利用具有以下的构成的细胞或组织的玻璃化冷冻保存用夹具(本说明书中,也将“细胞或组织的玻璃化冷冻保存用夹具”简称为“玻璃化冷冻保存用夹具”),可以解决上述问题。(1)一种细胞或组织的玻璃化冷冻保存用夹具,其特征在于,具有在支撑体上至少依次具有胶粘层和玻璃化液吸收层的玻璃化液吸收体,在该玻璃化液吸收层的载放细胞或组织的部分与支撑体之间,具有不存在胶粘层的部分。(2)根据(1)中记载的细胞或组织的玻璃化冷冻保存用夹具,其特征在于,该支撑体为透光性支撑体,该玻璃化液吸收层为选自多孔性树脂片、多孔性金属氧化物片、以及密度为0.12~0.3g/cm3且单位面积重量为10~100g/m2的纸或无纺布中的任意一种。发明效果根据上述(1)的发明,在将浸渍于玻璃化液中的细胞或组织与玻璃化液一起载放于玻璃化液吸收体上时,由于玻璃化液吸收体将附着于细胞或组织的外周的多余的玻璃化液吸收,因此可以提供如下的细胞或组织的玻璃化冷冻保存用夹具,即,不必特别需要用于除去多余的玻璃化液的其他操作(例如从玻璃化液吸收体下部的抽吸除去操作、使用了微量移液器等的从细胞或组织周围的直接的抽吸除去操作),而能够容易并且简便地进行细胞或组织的冷冻保存操作。另外,根据上述(2)的发明,除了上述的效果以外,还可以提供细胞或组织的观察性优异的玻璃化冷冻保存用夹具。因而,如果使用本发明的玻璃化冷冻保存用夹具,则可以有效地进行细胞或组织的玻璃化冷冻操作及融解操作。附图说明图1是表示本发明的细胞或组织的玻璃化冷冻保存用夹具的一例的整体图。图2是图1中的除去握持部以外的玻璃化液吸收体的放大图。图3是图2所示的玻璃化液吸收体的在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6的剖面结构示意图。图4是表示包括载放细胞或组织的部分在内的玻璃化液吸收体的结构的示意图。图5是表示本发明的玻璃化液吸收体的另一例的示意图。图6是表示本发明的玻璃化液吸收体的另一例的示意图。图7是表示本发明的玻璃化液吸收体的另一例的示意图。具体实施方式本发明的玻璃化冷冻保存用夹具是在冷冻保存生物的细胞或组织时所用的夹具。本说明书中所谓细胞,不仅包括单一的细胞,也包括包含多个细胞的细胞集团。所谓包含多个细胞的细胞集团,可以是由单一种类的细胞构成的细胞集团,也可以是由多种细胞构成的细胞集团。另外,所谓组织,可以是由单一种类的细胞构成的组织,也可以是由多种细胞构成的组织,还可以是在细胞以外还包含细胞外基质之类的非细胞性的物质的组织。本发明的玻璃化冷冻保存用夹具优选用于将细胞或组织与玻璃化液一起载放于玻璃化液吸收体上,将载放有细胞或组织的夹具浸渍于液氮等冷却溶剂中并使之冷冻。通过具有上述玻璃化液吸收体,可以将细胞或组织与玻璃化液一起容易地保持,此外即使在冷冻时或解冻时也可以可靠地保持细胞及组织,因此可以容易地进行细胞或组织向液氮中的浸渍操作。另外,根据本发明的玻璃化冷冻保存用夹具,可以获得细胞或组织的优异的观察性,因此可以容易地观察载放于玻璃化液吸收体上的细胞或组织。由此,如果使用本发明的玻璃化冷冻保存用夹具,可以容易并且可靠地进行用于细胞或组织的冷冻保存的操作。可以将本发明的玻璃化冷冻保存用夹具改称为细胞或组织的冷冻保存用夹具、细胞或组织的玻璃化保存用夹具、细胞或组织的冷冻保存用器具、细胞或组织的玻璃化保存用器具。由于本发明的玻璃化冷冻保存用夹具具有玻璃化液吸收体,该玻璃化液吸收体将多余的玻璃化液吸收,因此在将浸渍于玻璃化液中的细胞或组织与玻璃化液一起载放于该玻璃化液吸收体上时,即使附着于细胞或组织的玻璃化液的量多也有望实现稳定化的细胞或组织的生存率。此外,经过如此操作的细胞或组织由极少量的玻璃化液覆盖,即使在进行冷冻操作的情况下,也可以迅速变成冷冻状态。此外可以在将冷冻保存的细胞或组织解冻后立即稀释玻璃化液。以下,对本发明的玻璃化冷冻保存用夹具的构成进行说明。本发明的玻璃化冷冻保存用夹具的特征在于,是具有在支撑体上至少依次具有胶粘层和玻璃化液吸收层的玻璃化液吸收体的细胞或组织的玻璃化冷冻保存用夹具,在该玻璃化液吸收层的载放细胞或组织的部分与支撑体之间,具有不存在胶粘层的部分。而且,本说明书中,所谓玻璃化液吸收层的载放细胞或组织的部分,是指在玻璃化液吸收层中,将细胞或组织与玻璃化液一起向玻璃化液吸收层滴加附着时,细胞或组织与玻璃化液吸收层接触的部分。本发明的玻璃化冷冻保存用夹具最优选在玻璃化液吸收层的载放细胞或组织的部分,在玻璃化液吸收层与支撑体之间不具有胶粘层,然而如果胶粘层的面积在载放细胞或组织的部分的面积中所占的比例是不高于20%的范围,更优选胶粘层的面积的比例是不高于10%的范围,则即使是载放细胞或组织的部分,也可以具有胶粘层。本发明的玻璃化冷冻保存用夹具可以仅由玻璃化液吸收体构成,只要不损害本发明的效果,也可以与玻璃化液吸收体一起还具有后述的握持部等。作为本发明的玻璃化液吸收体所具有的玻璃化液吸收层,可以举出包含纤维的片、多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等各种片。本发明的所谓“多孔性”,是指上述的片是在表面具有气孔(微孔)的结构体,更优选为在片表面及内部具有连续的气孔的结构体。另外,玻璃化液吸收层(上述的各种片)的厚度优选为10μm~5mm,更优选为20μm~2.5mm。在冷冻保存细胞或组织时,为了将细胞或组织迅速并且容易地浸渍于极低温的冷却溶剂(例如-196℃的液氮)中,期望玻璃化液吸收体具有支撑体。由此就可以提高玻璃化液吸收体的自立性或强度,提高操作性。但是,对于在支撑体上夹隔着胶粘层设有玻璃化液吸收层的玻璃化冷冻保存用夹具,胶粘层的一部分会进入玻璃化液吸收层的空隙中,存在有玻璃化液的吸收性能降低的问题。本发明利用在玻璃化液吸收层的载放细胞或组织的部分与支撑体之间具有不存在胶粘层的部分的玻璃化冷冻保存用夹具,来解决此种问题。本发明中,作为用作玻璃化液吸收层的包含纤维的片,可以例示出纸或无纺布。纸优选粘结剂等结着剂成分在纸整体中所占的比例为10质量%以下的纸,更优选比例为5质量%以下、进一步优选比例为3质量%以下的纸。由此可以获得优异的玻璃化液的吸收性。另外,该玻璃化液吸收层中所含的制纸用药品在纸整体中所占的比例优选为1质量%以下。通常在纸中所含的制纸用药品当中,例如荧光增白剂或染料、阳离子系的施胶剂等有时可能对细胞产生影响。在包含纤维的片为纸的情况下,优选为密度为0.1~0.6g/cm3、单位面积重量为10~130g/m2的纸。特别是密度为0.12~0.3g/cm3、单位面积重量为10~100g/m2的纸由于能够提供玻璃化液的吸收性优异、而且细胞或组织的观察性优异的玻璃化冷冻保存用夹具,因此优选。在包含纤维的片为无纺布的情况下,作为该无纺布所含有的纤维,可以举出纤维素纤维、作为包含纤维素纤维的再生纤维的人造丝纤维或铜氨纤维、以及作为来自纤维素纤维的半合成纤维的醋酸纤维、聚酯纤维、尼龙纤维、丙烯酸类纤维、聚丙烯纤维、聚乙烯纤维、聚氯乙烯纤维、乙烯纤维、聚氨酯纤维、维尼纶纤维、玻璃纤维、丝纤维等,也可以使用混合了各种的这些纤维而得的无纺布。其中优选纤维素纤维、属于来自纤维素纤维的纤维且作为纤维素再生纤维的人造丝纤维或铜氨纤维、以及作为来自纤维素纤维的半合成纤维的醋酸纤维。在包含纤维的片为无纺布的情况下,优选为密度为0.1~0.4g/cm3、单位面积重量为10~130g/m2的无纺布。特别是密度为0.12~0.3g/cm3、单位面积重量为10~100g/m2的无纺布由于能够提供玻璃化液的吸收性优异、而且细胞或组织的观察性优异的玻璃化冷冻保存用夹具,因此优选。在作为玻璃化液吸收层使用的无纺布中也与纸相同,优选粘结剂等结着剂成分在无纺布中所占的比例为10质量%以下的无纺布,更优选比例为5质量%以下、进一步优选比例为3质量%以下的无纺布。特别优选不含有结着剂的无纺布。无纺布与纸不同,有各种制造方法,然而作为减少了上述的结着剂成分的无纺布,可以合适地使用以纺粘法、熔喷法制造的无纺布;以及在以湿式法或干式法排列纤维后、以水流交叉法或针刺法制造的无纺布。另外如上所述,本发明中作为无纺布所含有的优选的纤维,可以举出纤维素纤维、属于来自纤维素纤维的纤维且作为纤维素再生纤维的人造丝纤维或铜氨纤维、以及作为来自纤维素纤维的半合成纤维的醋酸纤维,在使用这些纤维制造时,无论是湿式法、干式法,优选利用水流交叉法或针刺法的制造方法。本发明中,作为用作玻璃化液吸收层的多孔性树脂片,例如可以举出如下的树脂片等,即,日本特公昭42-13560号公报、日本特开平08-283447号公报中记载的树脂片,其为沿至少一轴方向拉伸,加热到树脂的熔点以上而进行烧结,利用由此得到的微细纤维状结构形成多孔质结构而成;日本特开2009-235417号公报中记载的树脂片,其为将利用乳液聚合或粉碎等方法得到的热塑性树脂的固体粉末填充到模具中,进行加热、烧结而使粉末粒子表面熔融并冷却,由此形成多孔结构而成。在将多孔性树脂片作为玻璃化液吸收层使用时,能够提供玻璃化液的吸收性优异、而且细胞或组织的观察性优异的玻璃化冷冻保存用夹具,因此优选。作为形成上述的多孔性树脂片的树脂,可以举出低密度聚乙烯、高密度聚乙烯、超高分子聚乙烯等各种聚乙烯或聚丙烯、聚甲基丙烯酸甲酯、聚苯乙烯、聚四氟乙烯或聚偏二氟乙烯等氟树脂、乙烯-醋酸乙烯酯共聚物、聚酰胺、苯乙烯-丙烯腈共聚物、苯乙烯-丁二烯-丙烯腈三元共聚物、聚碳酸酯、聚氯乙烯等。其中聚四氟乙烯、聚偏二氟乙烯等氟树脂能够提供细胞或组织的观察性尤其优异的玻璃化冷冻保存用夹具,因此是适合的。另外作为多孔性树脂片,也可以使用作为物理化学实验用途或研究用途销售的过滤用的膜滤器。本发明中,作为用作玻璃化液吸收层的多孔性金属片,可以举出由铜、铜合金、铝、铝合金、金、金合金、银、银合金、锡、锌、铅、钛、镍、不锈钢等金属构成的多孔性金属片。另外,作为多孔性金属氧化物片,可以优选利用由二氧化硅、氧化铝、锆、石英玻璃等金属氧化物构成的多孔性金属氧化物片。另外多孔性金属片及多孔性金属氧化物片也可以是分别含有2种以上的上述金属及金属氧化物的多孔性片。其中多孔性金属氧化物片能够提供细胞或组织的观察性优异的玻璃化冷冻保存用夹具,因此优选。本发明中,作为用作玻璃化液吸收层的多孔性金属片、以及多孔性金属氧化物片的制造方法,可以使用通常所知的方法。在玻璃化液吸收层为多孔性金属片的情况下,可以使用粉末冶金法、隔离件法等方法。另外,也可以优选使用组合树脂注射成型和粉末冶金法而得的所谓粉末造孔剂法。例如可以使用国际公开第2006/041118号小册子或日本专利第4578062号公报中记载的方法等。更具体而言,在将金属粉末与成为隔离件的树脂混合后,施加压力而成型,然后在高温环境下进行烧成,由此将金属粉末烧至坚固,使成为隔离件的树脂气化,就可以得到多孔性金属片。在使用粉末造孔剂法等的情况下,除了金属粉末和成为隔离件的树脂以外,还可以混合树脂的粘结剂。另外,也可以使用在将金属粉末在高温下加热后、注入气体而形成空隙的发泡熔融法、气体膨胀法等金属多孔体的制造方法。此外,也可以使用利用发泡剂来制造金属多孔体的浆料发泡法之类的制造方法。在玻璃化液吸收层为多孔性金属氧化物片的情况下,例如可以使用日本特开2009-29692号公报或日本特开2002-160930号公报中记载的方法等。对于上述的多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等多孔体的表面,为了提高玻璃化液吸收性能,也可以进行亲水化处理。作为亲水化处理的方法,可以使用接枝改性法、使用了亲水性高分子化合物等的涂布法、电晕放电、等离子体处理、使用了准分子激光等各种能量的通常的表面改性方法。在本发明的玻璃化液吸收层为上述的多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等多孔体的情况下,该多孔体的微孔直径优选为0.02~130μm,更优选为0.05~60μm。如果微孔直径是小于0.02μm的范围,则在玻璃化液的滴下时会有玻璃化液的吸收性能不够充分的情况。另外,会有难以制造多孔性片的问题。另一方面,如果微孔直径是大于130μm的范围,则细胞或组织被捕获在微孔中,在融解操作时,会有细胞难以从玻璃化液吸收体上游离的情况。另外,会有玻璃化液的吸收性能不够充分的情况。而且,对于多孔体的微孔直径,在多孔性树脂片的情况下,是利用泡点试验测定的最大的微孔的直径。另外在多孔性金属片及多孔性金属氧化物片的情况下,是根据该多孔体的表面及剖面的图像观察测定出的平均微孔直径。玻璃化液吸收层的空隙率优选为20容量%以上,更优选为30容量%以上。另外,在玻璃化液吸收层为上述的多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等多孔体的情况下,多孔体的内部的气孔优选为不仅在厚度方向上、而且在垂直于厚度方向的方向上也连续的结构。如果具有此种结构,则可以有效地使用多孔体内部的气孔,因此可以获得玻璃化液的高吸收性能。玻璃化液吸收层的厚度、多孔体的空隙率可以根据所用的细胞或组织的种类、与细胞或组织一起滴下的玻璃化液的滴下量等适当地选择。上述的所谓空隙率由下式定义。此处空隙容量V可以使用水银压入法测定。P=(V/T)×100(%)P:空隙率(%)V:空隙容量(ml/m2)T:厚度(μm)本发明的玻璃化冷冻保存用夹具所具有的玻璃化液吸收体的面积只要根据与细胞或组织一起滴下的玻璃化液的滴下量等适当地设定即可,没有特别限定,然而例如对于所滴下的每1μL玻璃化液优选设为1mm2以上,更优选设为2~400mm2。另外,在玻璃化液吸收体具有多个玻璃化液吸收层部分的情况下,优选连续的1个玻璃化液吸收层部分为所述的面积。在本发明的玻璃化冷冻保存用夹具所具有的玻璃化液吸收体中,在玻璃化液吸收层与支撑体之间不存在胶粘层的部分的面积只要根据细胞或组织的大小、与细胞或组织一起滴下的玻璃化液的滴下量等适当地设定即可,没有特别限定,然而在玻璃化液吸收层与支撑体之间不存在胶粘层的部分的面积与连续的1个玻璃化液吸收层的面积的比例优选为2~70%。本发明中,作为玻璃化液吸收体所具有的支撑体,可以使用通常所知的各种支撑体。作为此种支撑体,可以举出各种树脂膜、金属、玻璃、橡胶等。只要能发挥本发明的效果,也可以组合使用2种以上的支撑体。其中,从细胞或组织的观察性的观点考虑,可以优选使用透光性支撑体,更优选总透光率为80%以上的透光性支撑体。另外,透光性支撑体的雾度值优选为10%以下。作为此种透光性支撑体,例如可以举出由聚对苯二甲酸乙二醇酯(PET)、聚萘二甲酸乙二醇酯(PEN)等聚酯树脂、丙烯酸类树脂、环氧树脂、硅树脂、聚碳酸酯树脂、二醋酸酯树脂、三醋酸酯树脂、聚芳酯树脂、聚氯乙烯树脂、聚砜树脂、聚醚砜树脂、聚酰亚胺树脂、聚酰胺树脂、聚烯烃树脂、环状聚烯烃树脂等制成的树脂膜。另外,从温度传导性优异、能够实现急速的冷冻的观点考虑,可以合适地使用金属支撑体。作为金属支撑体的具体例,可以举出铜、铜合金、铝、铝合金、金、金合金、银、银合金、铁、不锈钢等。上述的支撑体的厚度优选为10μm~10mm。另外,为了提高与胶粘层的胶粘强度,也可以利用电晕放电处理对支撑体的表面实施易胶粘处理。本发明中,玻璃化液吸收体所具有的胶粘层可以含有以湿气固化性的胶粘物质为代表的瞬间胶粘组合物、热熔胶粘组合物、光固化性胶粘组合物等,例如可以优选利用含有聚乙烯醇、羟基纤维素、聚乙烯基吡咯烷酮、淀粉糊之类的水溶性高分子化合物、醋酸乙烯酯系树脂、丙烯酸类树脂、环氧系树脂、聚氨酯系树脂、弹性体系树脂、氰基丙烯酸酯系树脂、氟系树脂、硅系树脂、硝基纤维素系树脂、丁腈橡胶系树脂、苯乙烯―丁二烯系树脂、脲醛系树脂、苯乙烯系树脂、酚醛系树脂、聚酰亚胺系树脂、聚酰胺系树脂、聚酯系树脂、双马来酰亚胺系树脂、烯烃系树脂、EVA系树脂等非水溶性树脂的组合物。该胶粘层可以含有一种树脂,也可以含有多种树脂。胶粘层的固体成分量优选为0.01~100g/m2的范围,更优选为0.1~50g/m2的范围。本发明中玻璃化液吸收体在该玻璃化液吸收层的载放细胞或组织的部分与支撑体之间具有不存在胶粘层的部分。具有此种部分的玻璃化液吸收体可以通过如下操作获得,即,在形成胶粘层时,在支撑体上的成为载放细胞或组织的部分的位置,设置不涂布所述的胶粘组合物的无涂布部(例如在胶粘组合物的涂布时,对支撑体上的成为载放细胞或组织的部分的位置进行遮蔽而涂布),其后,在胶粘组合物干燥之前的期间叠加包含纤维的片、多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等各种片后进行干燥而获得。以上,对本发明的玻璃化冷冻保存用夹具所具有的玻璃化液吸收体进行了说明。本发明的玻璃化冷冻保存用夹具只要如上所述,具有如下的结构,即,在支撑体上具有依次具有胶粘层和玻璃化液吸收层的玻璃化液吸收体,且在玻璃化液吸收层的载放细胞或组织的部分与支撑体之间具有不存在胶粘层的部分,就没有特别限定,例如也可以与该玻璃化液吸收体一起还具有握持部。如果具有握持部,则冷冻保存操作时及融解操作时的操作性变得良好,因此优选。图1是表示本发明的细胞或组织的玻璃化冷冻保存用夹具的一例的整体图。图1中玻璃化冷冻保存用夹具9由握持部1和玻璃化液吸收体2构成。图2是图1中的除去握持部以外的玻璃化液吸收体的放大图。图2中,玻璃化液吸收体2a是在支撑体4上具有玻璃化液吸收层3的结构(胶粘层未图示),且具有在图中以虚线包围的、在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6。在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6成为载放细胞或组织的部位。图1所示的握持部1优选为耐液氮材料。作为此种材料,例如可以合适地使用铝、铁、铜、不锈钢合金等各种金属、ABS树脂、聚丙烯树脂、聚乙烯树脂、氟系树脂或各种工序塑料、以及玻璃等。图1中,握持部1为圆柱形,然而其形状是任意的。另外,如后所述,出于不使细胞或组织直接接触液氮的目的,有时在冷冻前在附着细胞或组织的玻璃化液吸收体上盖上盖子,该情况下,也可以将握持部1制成从不具有玻璃化液吸收体2的一侧朝向具有玻璃化液吸收体2的一侧圆柱的直径连续地变小的形状,由此提高盖上盖子时的操作性。从处置性考虑,玻璃化液吸收体2的形状优选为长方形或片状。对图1的握持部1与玻璃化液吸收体2的连接方法进行说明。在握持部1为树脂的情况下,例如可以在成形加工时利用嵌件成形将玻璃化液吸收体2与握持部1连接。此外,可以在握持部1中制作未图示的结构体插入部而利用胶粘剂连接玻璃化液吸收体2。胶粘剂可以使用各种胶粘剂,然而可以合适地使用耐低温强的硅系或氟系的胶粘剂。图3是图2所示的玻璃化液吸收体的在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6的剖面结构示意图。图3中玻璃化液吸收层3具有在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6、和在玻璃化液吸收层与支撑体之间存在胶粘层的部分7。图3中,在支撑体4上的玻璃化液吸收层与支撑体之间不存在胶粘层的部分6中,不存在空间,支撑体4与玻璃化液吸收层3直接接触。如前所述,在玻璃化液吸收层与支撑体之间形成不存在胶粘层的部分6时,在支撑体4上,设置不涂布胶粘组合物的无涂布部,其后,在该胶粘组合物干燥之前的期间叠加包含纤维的片、多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等各种片。此时,如果是在所涂布的胶粘组合物的干燥有进展之前,即如果是该胶粘组合物的流动性得到充分地确保的状态,则上述的各种片会快速地吸收该胶粘组合物,因此如图3所示,在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6,不存在空间,可以获得支撑体与4玻璃化液吸收层3直接接触的玻璃化液吸收体。即,由于以将干燥有进展前的胶粘组合物导入玻璃化液吸收层3内的形式形成胶粘层5,因此在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6中,在支撑体4与玻璃化液吸收层3之间不会产生空间。另一方面,在所涂布的胶粘组合物的干燥已经推进、无法充分地确保胶粘组合物的流动性的状态下,包含纤维的片、多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等各种片难以快速地吸收该胶粘组合物,因此在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6中,会有在支撑体4与玻璃化液吸收层3之间产生空间的情况。在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6中,无论是支撑体4与玻璃化液吸收层3直接接触的玻璃化液吸收体、还是在支撑体4与玻璃化液吸收层3之间产生了空间的玻璃化液吸收体的哪一种,都可以充分地吸收附着于细胞或组织的外周的多余的玻璃化液。但是另一方面,如果在支撑体4与玻璃化液吸收层3之间产生空间,在将冷冻保存的细胞或组织融解时,会有细胞或组织的观察性(显微镜观察下的观察性)降低的情况。在融解操作时,细胞或组织从玻璃化液吸收体上游离,一边利用透射型光学显微镜观察细胞或组织被回收到另外准备的融解液中的样子,一边实施。此时,如果在支撑体4与玻璃化液吸收层3之间存在空间,就会在融解液中在玻璃化液吸收层3产生波动,焦点不能保持恒定,由此使得观察性降低。因而,在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6中,优选支撑体4与玻璃化液吸收层3接触。图4是表示包括载放细胞或组织的部分在内的玻璃化液吸收体的结构的示意图。图4中,(4-1)是载放细胞或组织的部分8全都是在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6的玻璃化液吸收体2的一例。(4-2)是在载放细胞或组织的部分8的一部分以条纹状具有胶粘层的玻璃化液吸收体2的一例。(4-3)是在载放细胞或组织的部分8的一部分以点状具有胶粘层的玻璃化液吸收体2的一例。另外,上述的(4-1)~(4-3)是将载放细胞或组织的部分8全都收容于在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6中的玻璃化液吸收体2的一例。另一方面,图4中(4-4)是载放细胞或组织的部分8与在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6相比露出的玻璃化液吸收体2的一例。在利用本发明的细胞或组织的玻璃化冷冻保存用夹具长期冷冻保存细胞或组织的情况下,为了将细胞或组织与外界隔断,也可以盖上盖子,或者将该玻璃化冷冻保存用夹具放入任意形状的容器中密闭。此外,通常液氮是未经杀菌的,在使细胞或组织直接与液氮接触而冷冻的情况下,即使玻璃化冷冻保存用夹具被杀菌也会有无法保证杀菌状态的情况。因此在冷冻前有时在附着有细胞或组织的玻璃化液吸收体上盖上盖子,或者将玻璃化冷冻保存用夹具密闭在容器中,使细胞或组织不直接接触液氮地冷冻。另外,在欧洲等海外先进国家如前所述那样不直接接触液氮的冷冻方法是主流。基于此种理由,盖子及容器优选由作为具有耐液氮性的材料的各种金属、各种树脂、玻璃、陶瓷等制作。作为形状,没有特别限定,例如盖子如果是铅笔用的帽之类的半纺锤状或圆屋顶状等盖子、圆柱状的吸管帽等不与玻璃化液吸收体接触、可以将细胞或组织与外界隔断的形状,作为无论是何种形状都可以。容器只要是不与玻璃化液吸收体上的细胞或组织接触、可以将玻璃化冷冻保存用夹具覆盖或收纳而密闭的容器即可,其形状没有特别限定。本发明中,只要不损害本发明的效果,可以将玻璃化冷冻保存用夹具与此种可以将玻璃化液吸收体上的细胞或组织与外界隔断的盖子或容器组合使用。另外,此种与盖子或容器组合使用的玻璃化冷冻保存用夹具也包含于本发明中。图5~图7是表示本发明的玻璃化液吸收体的另一例的示意图。在前面的图1所示的玻璃化冷冻保存用夹具9中,也可以将玻璃化液吸收体2设为图5~7所示的玻璃化液吸收体2b~2d。图5中,玻璃化液吸收体2b在支撑体4上具有玻璃化液吸收层3,该玻璃化液吸收层3由未图示的胶粘层固定于支撑体4上,所述胶粘层存在于在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6的图中左右的2个方向(相面对的2个方向)。图6中,玻璃化液吸收体2c在支撑体4上具有玻璃化液吸收层3,该玻璃化液吸收层3由未图示的胶粘层固定于支撑体4上,所述胶粘层存在于在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6的图中左侧方向。图7中,玻璃化液吸收体2d在支撑体4上具有玻璃化液吸收层3,该玻璃化液吸收层3具有在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6,由未图示的胶粘层固定于支撑体4上,所述胶粘层存在于在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6以外的场所(部分6的周围的所有方向)。本发明中玻璃化液吸收层3优选由存在于在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6的周围的至少2个方向以上(优选为相面对的2个方向)的胶粘层固定于支撑体4上。由此可以在融解液中改善玻璃化液吸收层3的波动,可以获得将冷冻保存了的细胞或组织融解时的细胞或组织的观察性优异的玻璃化冷冻保存用夹具。另外,图7所示的玻璃化液吸收体2d是在连续的玻璃化液吸收层3中具有多个在玻璃化液吸收层与支撑体之间不存在胶粘层的部分6的玻璃化液吸收体的结构的一例。本发明的玻璃化冷冻保存用夹具是例如适用于Cryotop法中的夹具。另外,以往的Cryotop法通常用于单一细胞或少于10个的少数细胞的保存,而本发明的玻璃化冷冻保存用夹具也可以适用于更多细胞的保存(例如10~1000000个细胞的保存)。此外,还可以适用于包含多个细胞的片状的细胞(所谓的细胞片)的保存。如果使用本发明的玻璃化冷冻保存用夹具,则在细胞或组织的冷冻时及融解时很难受到由细胞外的玻璃化液造成的损伤,可以以优异的生存率冷冻保存细胞或组织。作为使用本发明的玻璃化冷冻保存用夹具冷冻保存细胞或组织的方法,至少具备:将细胞或组织浸渍于玻璃化液中的工序;将浸渍于玻璃化液中的细胞或组织与玻璃化液一起向玻璃化液吸收层上滴下,使附着于该细胞或该组织的周围的玻璃化液吸收在玻璃化液吸收层上,并且使细胞或组织担载在玻璃化液吸收层上的工序;以及将保持有所述的细胞或组织的玻璃化冷冻保存用夹具浸渍于液氮等中,由此将细胞或组织急速冷冻的工序。另外,也可以在所述的将细胞或组织浸渍于玻璃化液中的工序之前,例如设置平衡化处理工序,即,将细胞或组织浸渍于含有浓度低于该玻璃化液的耐冻剂的前处理液中,也可以在将细胞或组织急速冷冻的工序之前,设置将可以使玻璃化液吸收层上的细胞或组织与外界隔断的盖子安装于玻璃化液吸收体的工序、或将玻璃化冷冻保存用夹具密闭于所述的容器中的工序。本说明书中的所谓急速冷冻,与以较慢的冷却速度(例如0.3~0.5℃/min的速度)进行冷冻的所谓缓慢冷冻法不同,是指使用极低温的制冷剂(例如液氮)以快速的冷却速度在抑制冰晶形成的同时使之冷冻的方法。对于急速冷冻时的冷却速度,例如使用CHINO公司制铠装型(シース型)热电偶(前端外径0.3mm)测定的0℃到-150℃的冷却速度优选为200℃/min以上。另外,玻璃化液可以使用通常用于卵子、胚胎等细胞的冷冻的玻璃化液,例如可以使用含有上述的丙三醇或乙二醇、DMSO(二甲亚砜)等各种耐冻剂的水溶液。玻璃化液中的耐冻剂的浓度如前述的专利文献2中记载所示,一般设为20~60%。在冷冻保存后、将细胞或组织融解时,优选通过将载放有经过冷冻的细胞或组织的玻璃化液吸收体浸渍于融解液中而使细胞融解,并且稀释玻璃化液。通过此种操作,可以缓解再次的冰晶形成、玻璃化液的毒性。作为可以使用本发明的玻璃化冷冻保存用夹具冷冻保存的细胞,例如可以举出:哺乳类(例如人(人类)、牛、猪、马、兔、大鼠、小鼠等)的卵子、胚胎、精子等生殖细胞;人工诱导多功能干细胞(iPS细胞)、胚胎干细胞(ES细胞)等多功能干细胞。另外,可以举出初代培养细胞、继代培养细胞、以及细胞株细胞等培养细胞。另外,在一个或多个实施方式中,作为细胞可以举出贴壁性细胞,例如:成纤维细胞、来自于胰腺癌、肝癌细胞等癌的细胞、上皮细胞、血管内皮细胞、淋巴管内皮细胞、神经细胞、软骨细胞、组织干细胞、以及免疫细胞等。此外,作为可以冷冻保存的组织,可以举出由同种或异种细胞组成的组织,例如:卵巢、皮肤、角膜上皮、牙周膜、心肌等组织。本发明特别适于具有片状结构的组织(例如细胞片、皮肤组织等)的玻璃化冷冻保存。本发明的玻璃化冷冻保存用夹具不仅可以适用于直接从活体采集的组织,也适用于例如在活体外培养增殖的培养皮肤、在活体外构筑的所谓的细胞片、日本特开2012-205516号公报中提出的具有三维结构的组织模型之类的人工组织的玻璃化冷冻保存。本发明的玻璃化冷冻保存用夹具可以作为如上所述的细胞或组织的玻璃化冷冻保存用夹具合适地使用。[实施例]以下利用实施例更详细地明示本发明,对本发明进行具体的说明,然而本发明并不限定于以下的实施例。(实施例1)对纤度为0.06dtex(纤维直径约2μm)、切割长度为3mm的拉伸结晶化聚对苯二甲酸乙二醇酯短纤维40质量份、纤度为0.1dtex(纤维直径约3μm)、切割长度为3mm的拉伸结晶化聚对苯二甲酸乙二醇酯短纤维20质量份及纤度为0.2dtex(纤维直径约4μm)、切割长度为3mm的非拉伸聚对苯二甲酸乙二醇酯短纤维40质量份进行湿式抄造,继而,利用表面温度200℃的热轧机一边使纤维间熔融一边进行厚度调整,得到平均纤维直径为3.0μm、单位面积重量25g/m2、密度0.5g/cm3的无纺布(玻璃化液吸收层)。在经过易胶粘处理的透明PET膜支撑体(总透光率91%、雾度值5.5%)上,作为胶粘层,以使干燥时的固体成分量为30g/m2的方式涂布Kuraray公司制PVA235的5质量%水溶液。在所涂布的胶粘层干燥之前,快速地将上述的玻璃化液吸收层重叠于该胶粘层并在70℃充分地干燥。而且,在涂布该胶粘层时,对透明PET膜支撑体上的一部分进行遮蔽,形成胶粘层的未涂布部,由此制作出图5所示的形态的玻璃化液吸收体。使该玻璃化液吸收体与ABS树脂制的握持部接合,以图1所示的形态制作出实施例1的玻璃化冷冻保存用夹具。而且,实施例1的玻璃化冷冻保存用夹具的玻璃化液吸收体的大小为40mm2(2mm×20mm),在玻璃化液吸收层与支撑体之间不存在胶粘层的部分的大小为10mm2(2mm×5mm)。实施例1的玻璃化冷冻保存用夹具是特意地设想为将多个细胞或组织与较多的玻璃化液量一起滴加附着、并进行冷冻保存·融解操作的形态。(实施例2)在实施例1的玻璃化冷冻保存用夹具的制作中,在经过易胶粘处理的透明PET膜支撑体上,作为胶粘层,以使干燥时的固体成分量为30g/m2的方式涂布HenkelJapan公司制的热熔聚氨酯树脂PurmeltQR170-7141P,除此以外,同样地制作出实施例2的玻璃化冷冻保存用夹具。(实施例3)在实施例2的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在用干燥器加热的同时,作为玻璃化液吸收层,将Advantec公司制的滤纸No.5C(单位面积重量120g/m2、密度0.57g/cm3、厚210μm)重叠于该胶粘层,除此以外,同样地制作出实施例3的玻璃化冷冻保存用夹具。(比较例1)在实施例2的玻璃化冷冻保存用夹具的制作中,没有设置胶粘层的未涂布部分,在涂布于透明PET膜支撑体上的全面的胶粘层干燥之前,重叠玻璃化液吸收层,除此以外,同样地制作出比较例1的玻璃化冷冻保存用夹具。(比较例2)在实施例3的玻璃化冷冻保存用夹具的制作中,没有设置胶粘层的未涂布部分,在涂布于透明PET膜支撑体上的全面的胶粘层干燥之前,重叠玻璃化液吸收层,除此以外,同样地制作出比较例2的玻璃化冷冻保存用夹具。<玻璃化液的吸收性的评价>向实施例1~3、以及比较例1~2的各玻璃化冷冻保存用夹具的在玻璃化液吸收层与支撑体之间不存在胶粘层的部分(2mm×5mm)的玻璃化液吸收层上,滴下含有多个玻璃珠(直径100μm)作为模拟细胞的玻璃化液1μL并使之附着。另外,向比较例1~2的各玻璃化冷冻保存用夹具的玻璃化液吸收层上,同样地滴加含有多个玻璃珠(直径100μm)作为模拟细胞的玻璃化液1μL并使之附着。而且,玻璃化液使用了SigmaAldrich公司制的在改良TCM199培养基中含有20容积%血清、15容积%DMSO、15容积%乙二醇、0.2容积%蔗糖的组成的玻璃化液。滴加附着后,利用落射型正立光学显微镜(OMRON(株)制、VC4500-S1),观察载放于玻璃化液吸收层上的模拟细胞周边的玻璃化液被吸收的样子,利用以下的基准评价了玻璃化液的吸收性。将其结果表示于表1中。○:在玻璃化液滴加附着后10秒以内,完全看不到模拟细胞周边的多余的玻璃化液的残留。或者基本上看不到。×:在玻璃化液滴加附着后,即使经过时间大于10秒,也可以确认到模拟细胞周边的多余的玻璃化液的残留。[表1]吸收性的评价实施例1○实施例2○实施例3○比较例1×比较例2×(实施例4)在实施例2的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在利用干燥器加热的同时,作为玻璃化液吸收层,使作为由铜氨纤维制成的无纺布的旭化成纤维公司制Bemliese(注册商标)SE14G(单位面积重量14g/m2、密度0.19g/cm3、厚70μm)重叠于该胶粘层,除此以外,同样地制作出实施例4的玻璃化冷冻保存用夹具。(实施例5)在实施例2的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在利用干燥器加热的同时,作为玻璃化液吸收层,使作为纸的大王制纸(株)制Elleair(注册商标)Pro-WipeSoftmicrowiperS220(单位面积重量22g/m2、密度0.21g/cm3)重叠于该胶粘层,除此以外,同样地制作出实施例5的玻璃化冷冻保存用夹具。(实施例6)在实施例2的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在利用干燥器加热的同时,作为玻璃化液吸收层,使作为由聚乙烯树脂制成的多孔性树脂片的旭化成公司制的SunfineAQ800(微孔直径35μm、空隙率43%、厚500μm)重叠于该胶粘层,除此以外,同样地制作出实施例6的玻璃化冷冻保存用夹具。(实施例7)在实施例2的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在利用干燥器加热的同时,作为玻璃化液吸收层,使作为多孔性金属氧化物片的CovalentMaterial制的石英玻璃多孔体(微孔直径3.5μm、空隙率33%、厚2mm)重叠于该胶粘层以外,同样地制作出实施例7的玻璃化冷冻保存用夹具。(实施例8)在实施例2的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在利用干燥器加热的同时,作为玻璃化液吸收层,使作为由聚四氟乙烯树脂制成的多孔性树脂片的MerckMilipore公司制的经过亲水化处理的聚四氟乙烯多孔体(微孔直径10μm、空隙率80%、厚85μm)重叠于该胶粘层,除此以外,同样地制作出实施例8的玻璃化冷冻保存用夹具。(实施例9)在实施例1的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在利用干燥器加热的同时,作为玻璃化液吸收层,使作为由聚四氟乙烯树脂制成的多孔性树脂片的MerckMilipore公司制的经过亲水化处理的聚四氟乙烯多孔体(微孔直径10μm、空隙率80%、厚85μm)重叠于该胶粘层,除此以外,同样地制作出实施例9的玻璃化冷冻保存用夹具。(实施例10)在实施例2的玻璃化冷冻保存用夹具的制作中,在涂布胶粘层后,在利用干燥器加热的同时,作为玻璃化液吸收层,使作为由聚偏二氟乙烯树脂制成的多孔性树脂片的MerckMilipore公司制的聚偏二氟乙烯多孔体(微孔直径0.5μm、空隙率70%、厚125μm)重叠于该胶粘层,除此以外,同样地制作出实施例10的玻璃化冷冻保存用夹具。<玻璃化液的吸收性的评价>利用与前面的实施例1~3及比较例1~2的各玻璃化冷冻保存用夹具相同的方法,进行了如上所述地得到的实施例4~10的各玻璃化冷冻保存用夹具的、玻璃化液的吸收性的评价。将其结果表示于表2中。<模拟细胞的观察性的评价>对实施例4~10的各玻璃化冷冻保存用夹具,利用前面的“玻璃化液的吸收性的评价”中记载的方法,向在玻璃化液吸收层与支撑体之间不存在胶粘层的部分(2mm×5mm)的玻璃化液吸收层上,与玻璃化液一起滴加模拟细胞并使之附着。滴加附着后,依照以下的基准评价了是否可以利用透射型光学显微镜(Olympas(株)制、SZH-121)观察到载放于玻璃化液吸收层上的模拟细胞。将其结果表示于表2中。◎:可以清楚地观察到模拟细胞的形态。○:可以观察到模拟细胞的形态。△:虽然可以确认模拟细胞的存在,然而无法观察形态。×:难以确认模拟细胞的存在。[表2]吸收性的评价观察性的评价实施例4○△实施例5○△实施例6○△实施例7○△实施例8○◎实施例9○◎实施例10○◎根据表2的结果可以判明,利用本发明的玻璃化冷冻保存用夹具,除了可以获得玻璃化液的优异的吸收性能以外,还可以获得优异的观察性。产业上的可利用性本发明除了可以用于牛等家畜、动物的胚胎移植和人工授精、对人的人工授精等以外,还可用于iPS细胞、ES细胞、一般使用的培养细胞、从活体采集的检查用或移植用的细胞或组织、在活体外培养的细胞或组织等的冷冻保存。符号的说明1握持部,2、2a~2d玻璃化液吸收体,3玻璃化液吸收层,4支撑体,5胶粘层,6在玻璃化液吸收层与支撑体之间不存在胶粘层的部分,7在玻璃化液吸收层与支撑体之存在胶粘层的部分,8载放细胞或组织的部分,9玻璃化冷冻保存用夹具。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1