分离细胞的微流体装置的制作方法
本申请要求2014年5月1日提交的美国临时申请号61/987,459的优先权,该申请的全部内容以引用的方式并入本文。
技术领域
本发明的特征在于用于分离细胞的装置和方法。
发明背景
分离生物流体和组织的组分通常对于临床诊断程序、科学研究和偶尔治疗患者是必要的。在临床诊断领域中,例如,需要允许快速分开某种类型的纯化的血细胞以用于测试和程序的装置和方法。基础研究还需要来自血液的纯化的细胞类型。分离和纯化可能以不同的方式实现。
技术实现要素:
在一个方面,一种用于分选细胞的包括微流体装置的装置可以包括:包括入口和出口的顶层、包括入口和出口的底层以及在顶层与底层之间的膜,其中第一室在顶层与膜之间,其中第二室在膜与底层之间,其中膜将第一室与第二室隔开,并且其中膜具有允许细胞从第一室传送到第二室的过滤器。
在某些实施方案中,膜可包括抗体。膜可以包括聚(甲基丙烯酸甲酯)、聚碳酸酯、含氟聚合物、topas(环烯烃共聚物-COC)、硅树脂、聚苯乙烯或其组合。
在某些实施方案中,顶层和底层中的至少一个可以包括聚碳酸酯、含氟聚合物、topas(环烯烃共聚物-COC)、硅树脂、聚苯乙烯或其组合。
在某些实施方案中,过滤器可包括多个矩形开口。过滤器可以包括多个圆形开口。过滤器可以包括多个十字形开口。
在某些实施方案中,膜可以具有在2微米与100微米之间的厚度。装置可以具有0.2毫米至2毫米之间的厚度。
在某些实施方案中,细胞可以包括肿瘤细胞、白细胞或红细胞中的至少一种。
在另一个方面中,分离样品中多种类别的细胞的方法可包括:将包括多种类别的细胞的样品添加到微流体装置的入口,使一些而非所有细胞通过微流体装置中的膜,并且从来自微流体装置的至少两个出口收集两个输出流,每个输出流包括不同类别的细胞。添加细胞可包括将细胞注入或将细胞泵入入口。
其它方面、实施方案和特征将由以下描述、附图和权利要求书而显而易见。
附图简述
图1是微流体装置的工作原理的示意图。
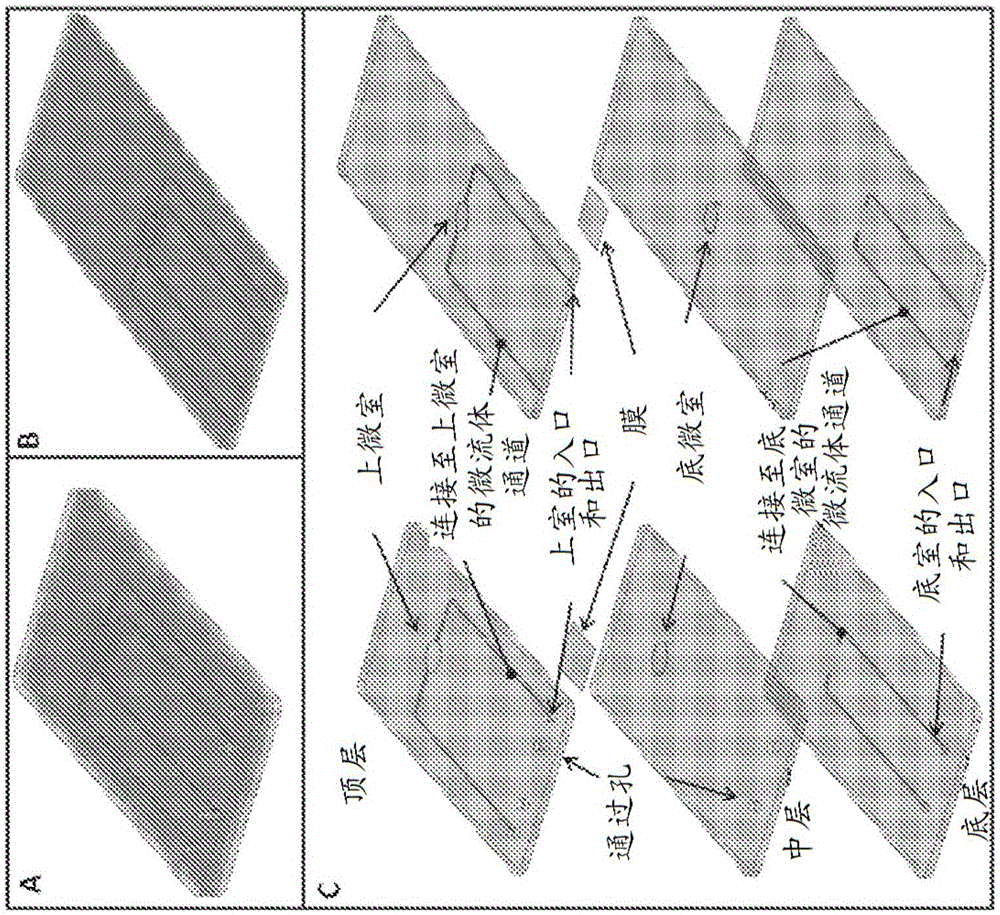
图2A和图2B示出了两种不同构造的微流体装置的等距视图:来自顶部(A)的入口和出口,来自侧面(B)的入口和出口;图2C是微流体装置的两种构造的分解图。其它构造可以在两侧具有入口和出口。
图3示出了过滤膜的示意图。
图4示出了用于过滤膜的不同图案。
图5示出了PMMA过滤膜的制造步骤。
图6示出了具有矩形形状的孔的PMMA膜。
图7示出了具有圆形孔的膜。
图8A示出了微流体装置的层;图8B示出了过滤膜(边长5mm);图8C示出了组装的微流体装置的等距视图;图8D示出了组装的微流体装置的顶视图;图8E是微流体装置的布局图,其在同一侧上具有入口和出口并且通过聚合物框架集成垫圈连接到外部管;图8F示出了具有从侧面的入口和出口的装置的另一种构造。
图9A-B示出了用于胺化PMMA的生物功能化方案的示意图。
图10是用于共价结合胺化PMMA表面上的生物素化抗体的官能化方案的示意图。
图11示出了过滤生物样品的自动化方案的示意图。
详述
微流体装置可用于生物样品的超纯化。样品可以包括多个类别的细胞。具体地,微流体装置可以用于通过形态和或生物亲和性差异对细胞类别进行分选。在一些实施方案中,一个类别的细胞从微流体装置的顶层传送到微流体装置的底层。在一些实施方案中,除一个类别之外的所有细胞从顶层传送到底层。样品制备和分离可以是对生物和环境样品的许多遗传、生物化学和生物分析的必要步骤。参见例如,美国专利申请13/122,169;T.Xu等人,Cancer Res.2010,70(16),6420-6;W.Chen等人,Adv.Healthc.Mater.2013,其各自的全部内容通过引用并入本文。
微流体装置可由聚(甲基丙烯酸甲酯)(PMMA)、聚碳酸酯、聚四氟乙烯,topas(环烯烃共聚物-COC)、硅树脂、聚苯乙烯、它们的组合以及其它聚合物制成。微流体装置可以通过使用微铣削、光刻或另选通过热压花或注射成型和溶剂或UV辅助粘合来制备。它可存在于由工程过滤膜隔开并且连接到入口和出口的上室和底室。膜可以整合特定形状的微孔(矩形、圆形、十字形、三角形)。一旦含有不同类别的细胞的生物样品注入芯片中,则可以利用细胞的不同尺寸分选细胞,因为只有一些类型的细胞可以通过膜的微孔。通过重力和/或通过特定的微流体方案迫使细胞朝向膜的孔。可以通过外部移液管和/或外部泵和阀来执行将样品注入和处理到装置中。
此外,借助生物功能化方案,能够将特异性抗体结合到膜表面,从而通过细胞(例如肿瘤细胞)的生物亲和性特异性类别进行分选。装置可用于从血液中分选红细胞、白细胞、肿瘤细胞、血浆以及碎片。图1是装置工作原理的示意图。
实施例
装置制造
由微流体室、通道和膜组成的微流体装置可以借助微铣削、光刻和选择性结合技术以PMMA制造。装置制造可以包括以下阶段:1)膜制造;2)构成微流体装置的PMMA层的制造;3)组装不同件和选择性粘合;4)装置生物功能化。图2示出了微流体装置的构造。
膜制造
膜可以整合用于通过形态学变化过滤细胞的工程孔。具体地,膜可以设计有矩形孔。图3示出了具有特定尺寸的孔的膜的设计。膜孔可以具有不同的形状,如同图4中示出的那些形状。
当整合在微流体装置中时,5mm×5mm的膜尺寸可以确保机械稳定性。整合孔的膜的部分在3mm×3mm的面积内。孔之间的距离可以在0.01-0.04mm的范围内,具有在垂直方向上具有在0-0.03mm范围内的偏移的连续列。膜厚度为0.01mm,这允许孔的正确制造。膜以聚甲基丙烯酸甲酯(PMMA)制造。膜的厚度可以在2微米与100微米之间;膜的厚度可以在10微米与50微米之间;膜的厚度可以为10微米。
膜可以通过光学光刻制造。液体PMMA沉积在硅(Si)晶片上,并且在热板上加热。之后在PMMA的顶部上溅射金层(Au)。在其上沉积光致抗蚀剂层(S1813)。借助光刻技术和使用铬玻璃光学掩模,将孔图案转印在光致抗蚀剂层上。之后,选择性地蚀刻金和PMMA以在PMMA膜上实现微孔。
图5示出了制备步骤:步骤1)Si晶片清洗;步骤2)将固体PMMA(30重量%)颗粒溶解在Anisole中以制备液体PMMA;步骤3)PMMA以2000rpm在硅晶片上旋涂60秒,从而获得0.01mm厚的PMMA层并且在180℃烘烤2分钟;步骤4)S1813以4000rpm在PMMA上旋涂60秒,从而获得0.001mm厚的光致抗蚀剂层;步骤5)Au溅射8分钟以获得0.0005-0.001mm厚的金;步骤6)S1813以4000rpm在PMMA上旋涂60秒,从而获得0.001mm厚的光致抗蚀剂层;步骤7)将样品在95℃下烘烤5分钟并且在光掩模下UV曝光12秒;步骤8)S1813在显影剂MF322或MF319中显影1分钟并且在去离子水中漂洗1分钟;步骤9)在KI:I2:H2O(100g:25g:500g)中Au蚀刻1分钟,并且在去离子水中漂洗1分钟;步骤10)通过深反应离子蚀刻(DRIE)仪器(参数:气体:O2,流量=15sccm;Ar,流量=30sccm,线圈功率=200W,压板功率=50W)进行PMMA选择性蚀刻;步骤11)通过将样品浸入KI:I2:H2O(100g:25g:500g)中1分钟并在去离子水中漂洗1分钟来除去Au;步骤12)PMMA膜通过将其浸入异丙醇中1小时从硅晶片上剥离。
图6示出了具有矩形形状的孔(宽度0.055mm)的PMMA膜。在图7中,膜具有圆形孔。
PMMA层
该装置可以包括3层PMMA,每个层的厚度可以在0.5-1mm的范围内。这些可以通过微铣削加工以获得边长为3mm×3mm的微型腔室(此尺寸受膜尺寸限制,如果膜将被制造得更大,则此腔室的尺寸必须相应地调整),并且具有0.1mm深的圆锥形入口和出口,连接到与外部连接的微通道(0.25-0.5mm宽且0.1-0.25mm深)。还制造了在1-3mm范围内的这些层中的两个孔,这两个孔在组装期间用作对准孔。
使用具有直径为0.25mm、0.5mm和1mm的直径和8000rpm和10000rpm的转速的工具通过微铣削制造不同的层。它可使用80mm/分钟的进给速率和0.1mm和0.25mm的切割深度。
微流体腔室组件
PMMA层和膜可以粘合在一起以形成整合微流体腔室的单个部件。
粘合工艺可以是UV或溶剂辅助粘合。这两个工艺可以包括将PMMA层置于UV下(达70-140秒)或乙醇中(达15-20分钟)。之后,可以将PMMA层与膜组装在一起,在使用乙醇的情况下在45℃或者在使用UV的情况下在85℃的温度下压制(5-15kN)1至2小时。
图8示出了不同装置构造的实际图片。
微流体装置生物功能化
借助生物功能化,能够在膜表面结合特异性抗体以通过生物亲和性分开特定的细胞类型。例如,可以通过结合抗EPCAM生物素化抗体来分开肿瘤细胞。可以通过在上部微流体室中注射不同的试剂和生物分子,在组装的微流体装置上进行生物功能化。
生物功能化可以包括在其过程中PMMA表面被胺化的工艺。此后,此微流体装置可以通过生物素化抗体被生物功能化。可以使用两种不同的方案来胺化PMMA,这在图9A和9B中示意性地表示。
在图9A的第一步骤中,首先通过在室温下向其内注入异丙醇(99%)来洗涤PMMA,然后在去离子水中洗涤。接着,在装置中注入含10%“己二胺”的100mM“硼酸盐缓冲液”(pH 11.5),并且温育2小时,随后为去离子水洗涤步骤,每次10分钟。最后将装置在30℃下静置过夜以使其干燥。
在图9B的第二程序中,通过向内部依次注入10%(w/v)NaOH和50%(v/v)乙醇来洗涤装置。然后在室温下在装置中注入1g/l的二聚乙烯醇溶液,历时10分钟,然后注入1%的二NaIO4溶液,历时1小时。随后,注射含10%“己二胺”的100mM“硼酸盐缓冲液”(pH 11.5)并且温育2小时。最后,用pH 11.5和8.2的“硼酸盐缓冲液”溶液洗涤装置,每次15分钟。
在胺化后,将装置与生物素(2mg/ml)、EDC(10mg/ml)和NHS(15mg/ml)在去离子水中在4℃下一起温育2小时。随后,通过在上室中在4℃下温育1小时,将含于“磷酸盐缓冲溶液”(PBS)中的链霉亲和素(2mg/ml)固定在装置的生物素化表面上。对于此操作,使用含于500μlPBS和1.63μl叠氮化钠中的1mg链霉亲和素。此后,在具有0.2mg/ml的Tris的PBS溶液(pH 7.3,含有0.1%白蛋白)中制备生物素化抗体,并且温育过夜。在每个功能化步骤后,用PBS洗涤装置。下面的图片示出了生物功能化过程的示意图。
装置的工作原理
该装置能够处理含有不同种类的细胞的生物样品。也能够使用全血或稀释或预处理的血液从白细胞和肿瘤细胞中消耗红细胞。建议在血液中使用抗凝剂以避免团簇形成。生物样品可以在血液中稀释。
可以通过使用移液管直接注射生物样品或通过将其连接到注射器泵来使用装置。第一种方法不需要外部设置,但允许处理小体积的样品(最大10微升)。第二种方法需要外部设置来管理装置,但它允许处理更大体积,最高达1ml的样品。
为了处理更大的体积,可以并联连接若干个装置。
第一种方案在于通过使用移液管用生物样品填充微流体装置。移液管装有生物样品,其连接到装置的上室的入口,并且样品被注入微流体装置。以下步骤是等待10秒以允许小细胞和碎片通过重力穿过膜。10秒后,样品需要通过移液管吸入并且再次交替注入数次。此步骤允许在装置中摇动样品。然后,将细胞再次静置10秒以通过重力通过膜。应重复这些操作,直到未达到所需的样品纯度。然后过滤的样品可通过使用高流速(在1ml/分钟的范围内)连接到其的注射器冲洗并且堵塞底室的入口和出口来从上室中回收。
当微流体装置连接到外部流体设置和注射器泵时,可以使用第二种方案。方案可以在以下步骤中描述:
1)用缓冲液通过以1ml/分钟的流速填充样品入口(图11-1a:Ouc和Obc的阀关闭,样品入口的阀打开)、上室(图11-1b:Obc和样品入口的阀关闭,Ouc的阀打开)和底室(图11-1c:Ouc和样品入口的阀关闭,Obc的阀打开)对装置预填充(primed);
2)使用注射器并且缓慢推动样品通过样品入口端口注射生物样品(图11-2a:样品入口和Obc的阀打开,Ouc的阀关闭);
3)注射1微升体积的缓冲液,将生物样品从上室推到底室,以1-10μl/分钟的流速过滤相同的样品(图11-2b:Ouc和样品入口的阀关闭,Obc的阀打开);
4)注射1微升体积的缓冲液,并且以100-1000μl/分钟的流速交替抽回5-10次以摇动生物样品(图11c-2c:Ouc和样品入口的阀关闭,Obc的阀打开);
5)重复操作3和4,直到生物样品的全部体积被过滤;
6)通过以100-1000μl/分钟的流速冲洗1ml缓冲液来回收上室中的过滤样品(图11-3a:Obc和样品入口的阀关闭,Ouc的阀打开);
7)通过以100-1000μl/分钟的流速冲洗1ml缓冲液来回收底室中的过滤样品(图11-3c:Ouc和样品入口的阀关闭,Obc的阀打开);
利用此类方案能够使用手动方案获得95%的纯度并且通过使用自动化方案获得97%的纯度。事实上,通过使用由在0.5ml PBS中稀释的150.000个红细胞/μl和2.500个肿瘤细胞/μl构成的样品,能够从肿瘤细胞中消耗上述百分比的红细胞。
其它实施方案在以下权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!