流体增强介电泳单细胞排列与控制芯片及其制作方法与流程
本发明属于生物微流控芯片技术领域,具体涉及一种流体增强介电泳单细胞排列与控制芯片及其制作方法。
背景技术:
细胞是组成和维持生命的最基本单元,近年来针对细胞的研究极大地推动了医学诊断、生命科学等领域的发展。研究表明,处于相同外部环境中的群体细胞存在个体差异且混合液中的细胞会相互影响,对群体细胞的研究只能得到统计结果,会忽略个体差异,造成稀有异常细胞信号(稀有细胞自身的结构信息和对外界刺激的反应)的淹没,进而无法得到可靠的相关信息。因此,对单细胞的研究具有非常重要的意义。细胞研究的前提是对细胞的精确操作。近年来,伴随微机电系统的发展,微流控芯片技术也得到了长足的进步,已经可以实现细胞分离、聚焦、富集及旋转等操作,但是这些操作都主要针对群体细胞,而单细胞排列与控制技术则针对个体细胞,仅需要一次实验就可同时大规模捕获排列单细胞并赋予单细胞位置信息,达到聚焦、分析及控制单细胞的目的。为了实现大规模单细胞的同时监测、降低实验成本、简化实验过程、提高实验数据可靠性,必须开发高通量、高可靠性、低成本的单细胞排列与控制芯片。
目前,能够用于单细胞排列的方法主要包括微吸管、光镊、二维介电泳、光诱导介电泳、磁捕获、声表面波捕获与流体动力学捕获。其中,微吸管操作单细胞与细胞膜直接接触,可能造成细胞的损伤影响实验数据的准确性、释放细胞操作难度较高且通量低、自动化程度低;光镊装置成本高、对细胞的作用力小、通量低;二维介电泳芯片电极产生的电场强度在通道高度方向呈指数下降,导致位于上层液面的细胞无法被捕获而效率较低且很难控制单细胞的释放;光诱导介电泳芯片制作复杂对工艺要求较高、产生的光介电泳力也不够大而且使用的激光器价格高不便于集成;磁单细胞捕获需要对细胞进行磁性标记,标记会对细胞造成损伤导致实验数据不准确,而且无法进行单细胞释放操作、芯片体积较大不利于系统集成;声表面波操作生物细胞的原理仍不成熟,芯片的效率还很低,也不能进行单细胞的控制;流体动力学单细胞排列技术属于被动式细胞捕获技术,利用制作的阵列化微结构实现单细胞捕获与排列,但是结构比较固定、不能实现单细胞的释放。总体来说,已经开发的单细胞排列与控制芯片所利用的原理单一,导致精度高的成本高,效率高的不能重复利用且不能实现单细胞的释放,甚至会对细胞产生不可逆损伤。
技术实现要素:
本发明为解决现有的单细胞分析用芯片可靠性低、成本高及不易释放单细胞的技术问题,提供了一种流体增强介电泳单细胞排列与控制芯片及其制作方法。
本发明采用的技术方案如下:
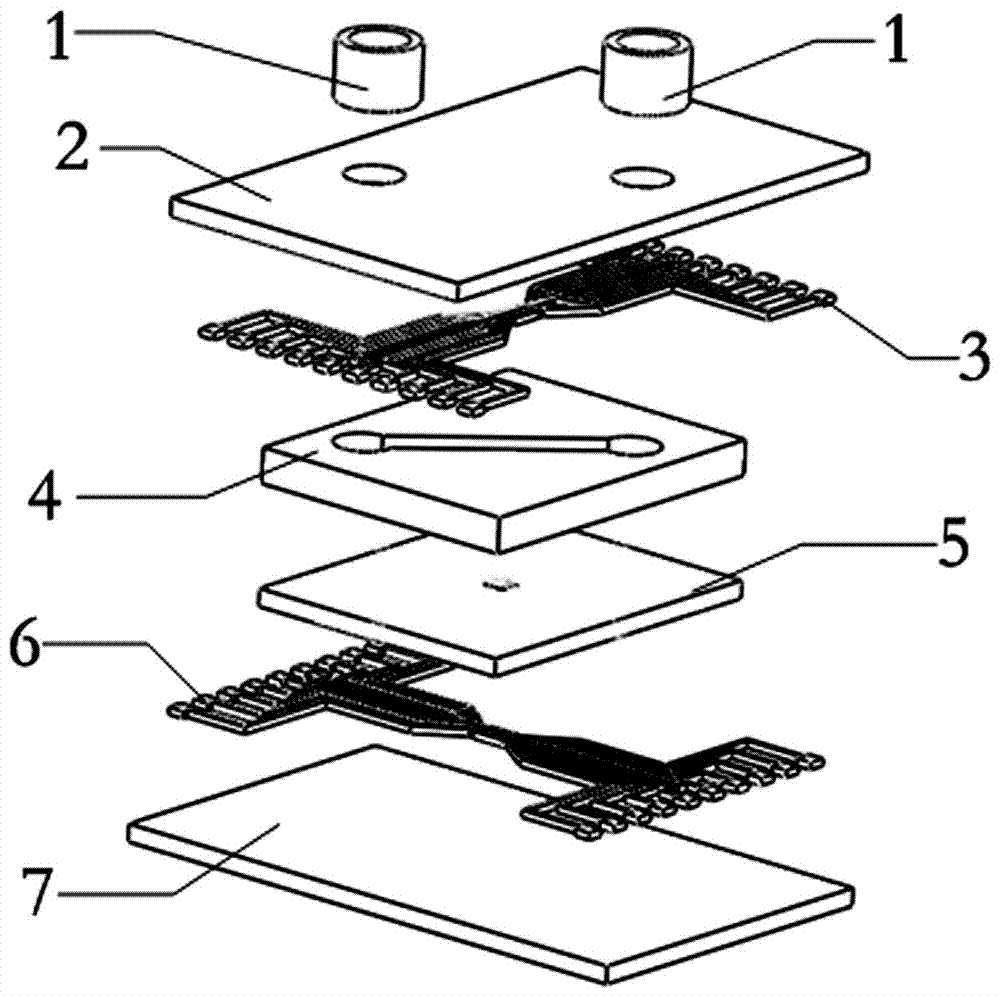
一种流体增强介电泳单细胞排列与控制芯片,整体为三明治式结构,从上至下依次为导管接头、上基底、上层微电极、微通道、微墙阵列、下层微电极和下基底,所述上基底上设置有两个便于实验缓冲液进样与出样的通孔,所述导管接头固定在上基底上表面的通孔处,所述上基底的下表面设置上层微电极,所述下基底的上表面设置下层微电极,上层微电极和下层微电极均为ito金属制成的叉指电极,上层微电极与下层微电极垂直相交设置,所述微墙阵列为微米级的圆形深孔,每个圆形深孔内仅能容纳一个单细胞,微墙阵列位于微通道的下方,且每个微墙位于上层微电极与下层微电极交叉处的中心。
所述上基底与下基底均为1.1mm厚的透明玻璃,所述上层微电极与下层微电极的厚度均为185nm。
所述微墙阵列采用负光刻胶su-8经过光刻显影制作而成,所述微墙直径15μm、高6μm。
所述微通道采用pdms薄膜制作,所述微通道厚20μm。
一种流体增强介电泳单细胞排列与控制芯片的制作方法,包括以下步骤:
(1)微电极的制作:将沉积有ito薄膜的玻璃依次置于丙酮、乙醇、去离子水中分别超声清洗10min,烘干后进行hmds处理,并在ito面均匀涂厚2μm的正光刻胶;前烘后利用掩膜版进行曝光;后烘后显影去除被曝光部分的胶;坚膜后置于ito刻蚀液中去除多余金属,剥离去除多余光刻胶,形成设计的微电极结构;
(2)微墙阵列的制作:取一片制备的微电极置于等离子键合机内使表面改性为亲水;使用匀胶机旋涂厚6μm的su-8负光刻胶,置于热板上前烘,起始温度设置为65℃、每过5min增加5℃、温度到达95℃时停留15min;利用微墙掩膜版与下层微电极对准后曝光;同样的温度后烘,置于pgmea中显影并于135℃的热板上坚膜形成微墙阵列;
(3)微通道的制作:使用1h,1h,2h,2h-全氟辛基三氯硅烷对硅片表面进行硅烷化处理使其变为疏水表面;按照10:1的比例均匀混合pdms预聚物与固化剂,去除气泡;在硅烷化处理的硅片上旋涂厚20μm的薄膜并加热固化得到pdms薄膜微通道;
(4)芯片的组合与封装:利用手持电钻在上基底上分别打出直径1mm的两个孔作为实验缓冲液进出口,清洗烘干后经过氧等离子体对pdms薄膜的上表面和ito微电极面进行表面改性后,贴紧加热键合;再次置于氧等离子体中处理后置于硅烷化试剂中5min;取出吹干后迅速贴于下层su-8微墙上,并置于烘箱中每分钟升温2℃、温度到达150℃保持1h后自然降温取出;最后将打孔的pdms导管接头键合于芯片玻璃上基底上表面的实验缓冲液的进出口处,使用ab胶密封加固接缝处,得到最终的三明治式芯片。
本发明的有益效果:
1.本发明设计的三明治式流体增强介电泳单细胞排列与控制芯片将介电泳的非侵入、免标记、易控制与流体动力学的高效率、低成本结合,克服了现有芯片原理单一产生的效率低、可靠性低、成本高且不易释放单细胞的问题。
2.本发明使用三明治式芯片结构,微墙位于带有ito微电极的上层玻璃基底和带有ito微电极的下层玻璃基底之间,一方面可以将流体动力学与介电泳结合增加捕获力度后实现单细胞捕获和单细胞的控制释放,另一方面本三明治式芯片中的微电极排布可以类似于三维电极,相对二维的芯片结构,可以克服电场在通道高度方向的衰减,提高芯片捕获效率,相对三维的芯片结构,又避免了三维电极复杂的制作工艺,使电极结构更加灵活多样。
3.使用的玻璃基底和ito金属微电极透光性能良好,便于实验的观察,生物兼容性良好、成本特别低廉、特别是ito金属导电性能良好、在免疫分析中不会产生额外的背景噪音且容易腐蚀成形,因此,整个芯片的成本特别低廉。
4.使用su-8制作微墙阵列,相对现有的微墙制作技术避免了干法刻蚀玻璃或者硅片,仅使用光刻显影就可以成型,工艺简单且可靠,su-8生物可兼容且是疏水材料又避免了细胞的黏附。
5.微墙阵列和相对应微电极的数量可以根据需要扩展。
6.使用氧等离子与硅烷化处理方法进行芯片的键合封装,更加简单、牢固、可靠。
7.将制作的芯片与设计的pcb转接板连接后,通过控制pcb板上的拨码开关可以实现单个微墙中电信号的通断达到单细胞的释放,从而可以实现非目标单细胞的鉴定与筛查。
附图说明
图1为本发明的芯片整体效果图;
图2为本发明的芯片结构分体示意图;
图3为本发明的芯片侧视图;
图4为本发明的单层微电极版图;
图5为图4中虚线部分的放大图;
图6为本发明的双层微电极俯视示意图;
图7为本发明的微墙阵列示意图;
图8为本发明的微通道示意图;
图9为本发明的芯片的内部流场仿真结果;
图10为本发明的芯片的电极全部接通时芯片内的电场分布仿真结果一
图11为本发明的芯片的电极全部接通时芯片内的电场分布仿真结果二
图12为本发明的芯片的电极断开b行(2)列电极后的电场分布仿真结果一
图13为本发明的芯片的电极断开b行(2)列电极后的电场分布仿真结果二
图14为本发明的芯片工作原理示意图;
图15为本发明芯片没有施加外部交流电信号时的俯视图;
图16为本发明芯片接通所有电极时的示意图;
图17为本发明芯片断开b行(2)列对应电极的示意图;
图18为本发明的芯片外部信号转接板示意图;
图19为本发明的芯片捕获的2×3阵列细胞的实验结果;
图20为图19对应的荧光图;
图21为本发明的芯片释放第二行第一列单细胞后的结果;
图22为图21对应的荧光图;
图中:1-导管接头,2-上基底,3-上层微电极,4-微通道,5-微墙阵列,6-下层微电极,7-下基底,8-单细胞,9-八位拨码开关,10-连接芯片的焊盘,11-连接函数信号发生器的焊盘,12-方形通孔。
具体实施方式
如图1、2、3所示,一种流体增强介电泳单细胞排列与控制芯片,整体为三明治式结构,由七部分组成,由上至下依次为导管接头1、上基底2、上层微电极3、微通道4、微墙阵列5、下层微电极6及下基底7;其中,导管接头1是使用聚二甲基硅氧烷pdms制作的块状结构,用于实验缓冲液的进样与出样;上基底2使用厚1.1mm透明的玻璃,作为上层微电极3的基底材料;如图4、5所示,上层微电极3采用ito金属制作成集成叉指电极;微通道4采用pdms薄膜,并使用刀片切出包含有全部阵列微墙的通道结构(如图8所示);如图6、7所示,微墙阵列5是微米级的圆形深孔,采用负光刻胶su-8经过光刻显影制得,每个微墙位于上下层微电极交叉处的中心,用以产生流体水动力增强介电泳对细胞的捕获效率;下层微电极6仍为ito金属叉指电极(如图4所示);下层微电极6与上层微电极3在空间上垂直相交设置(如图6所示),下基底7同样使用厚1.1mm透明的玻璃制作,作为下层微电极6和微墙阵列5的基底材料,本发明中的微墙阵列5和相对应微电极的数量可以根据需要扩展。
根据仿真优化结果,所述的ito微电极厚185nm,pdms微通道厚20μm,su-8微墙直径15μm、高6μm。
三明治式流体增强介电泳单细胞排列与控制芯片的制作工艺为:首先做出上下层微电极基底;然后在下层微电极上制作微墙阵列;利用氧等离子键合法将pdms导管接头与打了孔的上层电极键合;硅烷化处理硅片后制作出pdms薄膜,同样用氧等离子法键合于上层微电极面;结合氧等离子键合与硅烷化溶液浸泡将上下基底键合,得到芯片成品。其具体的制作步骤为:
(1)微电极的制作:将沉积有ito薄膜的玻璃依次置于丙酮、乙醇、去离子水中分别超声清洗10min,烘干后进行hmds处理增强光刻胶与ito的粘附性并在ito面均匀涂厚2μm的正光刻胶;前烘后利用设计的掩膜版进行曝光;后烘后显影去除被曝光部分的胶;坚膜后置于ito刻蚀液中去除多余金属,剥离去除多余光刻胶,形成设计的微电极结构。
(2)微墙阵列的制作:取一片制备的微电极置于等离子键合机内使表面改性为亲水;使用匀胶机旋涂厚6μm的su-8负光刻胶,置于热板上前烘,起始温度设置为65℃、每过5min增加5℃、温度到达95℃时停留15min;利用设计的微墙掩膜版与下层微电极对准后曝光;同样的温度后烘(起始温度设置为65℃、每过5min增加5℃、温度到达95℃时停留15min),置于pgmea中显影并于135℃的热板上坚膜形成微墙阵列。
(3)微通道的制作:使用1h,1h,2h,2h-全氟辛基三氯硅烷对硅片表面进行硅烷化处理使其变为疏水表面;按照10:1的比例均匀混合pdms预聚物与固化剂,去除气泡;在硅烷化处理的硅片上旋涂厚20μm的薄膜并加热固化得到pdms薄膜微通道。
(4)芯片的组合与封装:利用手持电钻在上层微电极基底上分别打出直径1mm的两个孔作为实验缓冲液进出口,清洗烘干后经过氧等离子体对pdms薄膜的上表面和ito微电极面进行表面改性后,贴紧加热键合;再次置于氧等离子体中处理后置于硅烷化试剂中5min;取出吹干后迅速贴于下层su-8微墙上,并置于烘箱中每分钟升温2℃、温度到达150℃保持1h后自然降温取出;最后将打孔的pdms导管接头键合于芯片玻璃上基底上表面的实验缓冲液的进出口处,使用ab胶密封加固接缝处得到最终的三明治式芯片。
图9是芯片内部一个微墙处的流场仿真,可以看出流体会流入微墙,因此细胞会受流体力作用流入微墙,从而增强介电泳芯片捕获细胞的效率;图10和图11是电极全部接通时芯片内的电场分布,可以看出在电极交叉处的电场强度最大,在正介电泳力和流体力的作用下可以捕获单细胞如图14所示,图12和图13是断开b行(2)列电极后的电场分布,可以看出此处电场变为负,在负介电泳力和流体力作用下,可以释放对应微墙中的单细胞。综合图9、10、11、12、13、14,以4×4阵列为例得到芯片两种工作模式,图15是没有施加外部交流电信号时的俯视图,图16为接通所有电极,每个微墙处会捕获一个单细胞,此时为阵列化捕获模式;图17为断开b行(2)列对应电极的信号后,b(2)处的单细胞被释放,此时为选择性释放模式。
图18是设计制作的含有4个8位拨码开关的pcb信号转接板,将芯片的焊盘分别连接至对应的引线,通过拨码开关的通断可以实现单细胞的独立控制。图19是捕获的2×3阵列细胞的实验结果,图20是对应的荧光图;图21是释放第二行第一列单细胞后的结果,图22是对应的荧光图。
本发明突破传统原理单一的微流控芯片,结合了介电泳的非侵入、免标记、易控制与流体动力学的高效率、低成本,克服了现有芯片的缺点,制作了高通量、高可靠性、高效率、易控制单细胞的单细胞排列与控制芯片,对单细胞的分析检测具有十分重要的意义和实际应用价值。
- 还没有人留言评论。精彩留言会获得点赞!