适于高密度栽植的植物体及其利用的制作方法
本发明涉及适于高密度栽植的植物体及其利用。
背景技术:
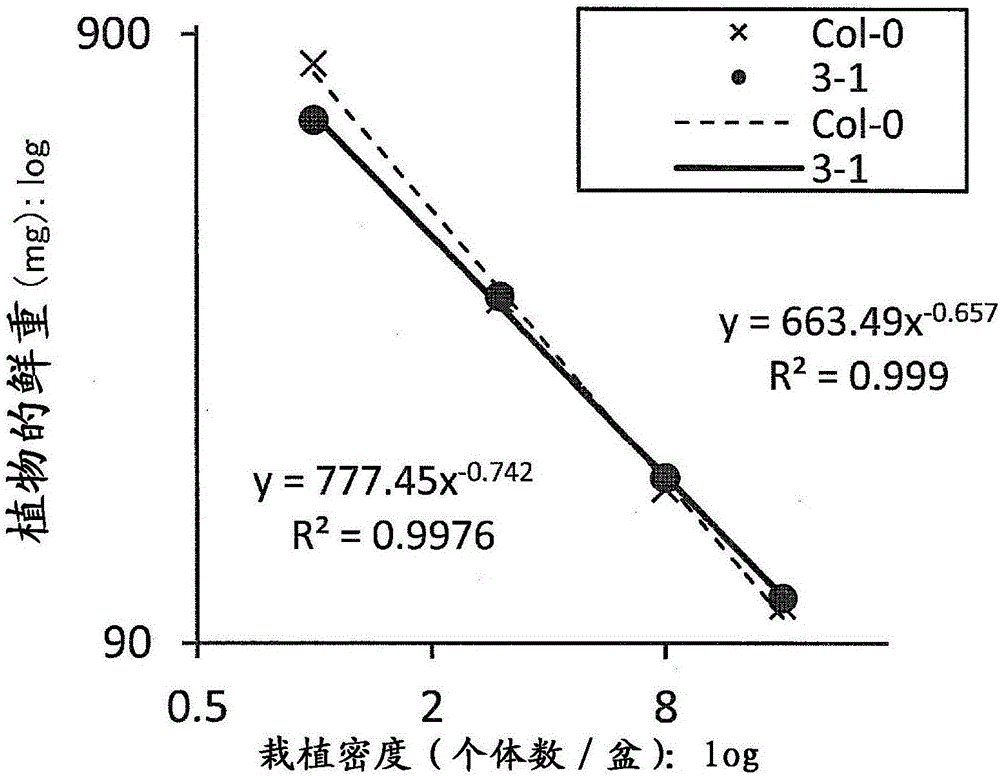
:通常来说,已知如果植物每单位面积栽植的个体数(以下称为栽植密度)增加,则植物个体的重量减少。另一方面,也还已知如果使栽植密度增加,则每单位面积的收获量和生物质(biomass)的总量增加。例如大豆以高栽植密度的栽培来提高收获量是有效的,这样的方法在农业领域普及。以收获量提高为目的,进行以高栽植密度的栽培,由此每单位面积的生物质的量提高。但是,由于从生长的初期阶段加速个体间的竞争,因此由于过度繁茂而会收获量达到顶点。也就是,与栽植密度增加相伴地,植物个体平均的生物质的量减少,因此,每单位面积的生物质的量不久达到顶点。在非专利文献1中,记载了如果提高栽植密度,则个体重量减少,个体重量“W”与每个面积的植物数(栽植密度)“N”的关系以下式表示(所谓“-3/2幂法则”)。这样,在非专利文献1中,记述有表示栽植密度与植物个体重量的关系的对数图的斜率是一定的主旨。[化1]logW=-3/2logN另外,目前为止已知使收获物的生物质的量相对于植物的全部生物质的量的比例增加的技术(专利文献1)、使植物的每单位面积的生物质的量充分提高的技术(专利文献2)。现有技术文献专利文献专利文献1:国际公开WO2008/072602小册子(2008年6月19日国际公开)专利文献2:国际公开WO2008/087932小册子(2008年7月24日国际公开)非专利文献非专利文献1:Lack和Evans(2001)PlantBiology175-179,BIOSScientificPublishersLimited发明概述发明欲解决的课题这样,植物有每单位面积的生物质生产性最适合的栽植密度,即使以超过其的密度栽植,每单位面积的生物质生产性也不会提高。因此,为了使每单位面积的生物质生产性提高,必须提高在以高栽植密度栽培时收获量的限界。另外,也已知要由以高栽植密度栽培带来收获量提高,在品种间存在差异,要求创造出适于以作为收获量提高的手段的高栽植密度栽培的植物品种。用于解决课题的手段本发明提供利用以高栽植密度栽培的植物生物质的生产方法及其工具以及它们的利用。本发明提供使非专利文献1中记载的图的斜率变化而实现在以高栽植密度栽培时从来不可能的收获量提高用的技术。本发明所涉及的生产植物生物质的方法的特征在于,包括将MYB30信号传导通路活化了的植物体在高密度栽植条件下栽培的工序。在本发明所涉及的方法中,上述植物体优选为利用包含MYB30相关基因的外源性基因而转化的转化体植物。在一个实施方式中,上述MYB30相关基因可以与控制表达时期的启动子可操作地连接,这种情况下,上述启动子优选在非转化体植物的花芽形成期之前开始上述MYB30相关基因的表达。本发明所涉及的方法优选在上述植物体栽培后进一步包括回收生物质的工序,也可以进一步包括在栽培的上述植物体结果实后回收生物质的工序,也可以进一步包括在花芽形成期之前回收生物质的工序。在本发明所涉及的方法中,上述MYB30相关基因优选编码与选自AtMYB30、BAK1和PLA2α中的蛋白质功能上等价的蛋白质的基因。本发明所涉及的试剂盒的特征在于,为了使植物在高密度栽植条件下的每单位面积的生产性提高,具备包含MYB30相关基因的外源性基因。本发明所涉及的试剂盒也可以进一步具备调查有无由MYB30信号传导通路的活化引起的抗病害性用的试剂。在上述外源性基因中,上述MYB30相关基因可以与控制蛋白质表达时期的启动子可操作地连接,优选为编码与选自AtMYB30、BAK1和PLA2α中的蛋白质功能上等价的蛋白质的基因。本发明所涉及的转化体植物的制作方法的特征在于,包括利用上述试剂盒筛选出的基因的外源性基因来转化植物体的工序。本发明所涉及的转化体植物的制作方法可以进一步包括对由MYB30信号传导通路的活化引起的抗病害性提高的个体进行选拔的工序。本发明所涉及的筛选方法的特征在于,为了筛选在高密度栽植条件下的每单位面积的生产性提高的植物体,包括:将MYB30相关基因的表达量或MYB30相关基因编码的蛋白质的表达量与基准值进行比较的工序;及选择上述表达量比基准值高或低(与基准值之间具有显著性差异)的个体的工序。另外,本发明所涉及的筛选方法的特征在于,为了筛选在高密度栽植条件下的每单位面积的生产性提高的植物体,包括将MYB30相关基因编码的蛋白质的活性与基准值进行比较的工序;及选择上述活性比基准值高或低(与基准值之间具有显著性差异)的个体的工序。本发明所涉及的筛选方法可以进一步包括对由MYB30信号传导通路的活化引起的抗病害性提高的个体进行选拔的工序。发明效果使用本发明,能够获得适合高密度栽植的植物体,能够使植物生物质的收获量提高。附图简述图1:是表示播种4周后植物中的转化体植物(18-1,15-1,3-1)中的MYB30基因的表达量相对于野生型(Col-0)中的MYB30基因的表达量的图。图2:是表示野生型(Col-0)及MYB30转化体植物(3-1)的地上部的鲜重与栽植密度的关系的两对数图。图3:是将野生株及转化体植物的地上部的鲜重与栽植密度的关系和表示两对数图的斜率的幂指数a进行比较的图。图4:是表示经实时PCR测定的MYB30基因的表达量、与表示植物的鲜重和栽植密度的关系的两对数图的斜率a的相关的图。图5:是表示将野生型(Col-0)及MYB30转化体植物((a)18-1、(b)15-1、(c)3-1)中每盆的生物质收获量(地上部鲜重)与栽植密度的关系比较的结果的图。图6:是表示野生型(Col-0)及GmMYB74转化体植物(#3-2株)的地上部的干燥重量与栽植密度的关系的两对数图。图7:是表示将野生型稻子及转化体稻子中每盆的生物质收获量(地上部鲜重)与栽植密度的关系比较的结果的图。用于实施发明的实施方式〔1:MYB30相关基因〕myb基因是在真核生物中广泛存在的基因群,在植物中也大量存在。已知myb基因编码的MYB蛋白质是具有MYB结构域的转录因子,在植物中大量存在,于是认为进行各种基因的表达调节而涉及细胞内的各种调节/控制。拟南芥的MYB蛋白质(MYB转录因子)之一的AtMYB30(At3g28910)是基于C末端区域重复序列的样式而分类为R2R3型的转录因子。例如拟南芥中存在125个R2R3型转录因子,AtMYB30分类为亚类型1。已知AtMYB30确定为与植物的过敏反应和其细胞死亡有关的转录因子,有助于植物与病原体的相互作用、具体而言对于病原性细菌(野油菜黄单胞菌(Xanthomonascampestris)、丁香假单胞菌(Pseudomonassyringe)等)感染的抵抗性(过敏反应),已知对于其应答,与AtMYB30活化相伴的超长链脂肪酸(VLCFA)的合成参与(参照例如Daniel等人(1999)ThePlantJournal20(1):57-66;Raffaele等人(2008)ThePlantCell20:752-767;Reina-Pinto等人(2009)ThePlantcell21:1252-1272等),已知与该过敏反应相伴放出过氧化氢(参照例如Breusegem等人(2006)PlantPhysiology141:381-390;Reina-Pinto等人(见前述))。另外,已知AtMYB30在BES1这个转录因子的下游起作用,报道了参与作为植物激素的油菜素类固醇的信号传导体系。然后,在Li等人(2009)ThePlantJournal58:275-28中记载了作为油菜素类固醇感受性突变体的bri-1显示成侏儒,通过敲除AtMYB30而bri-1的侏儒被加强。并且,在Daniel等人(前述)中暗示了MYB30在植物发育早期担当重要的作用。另外,已知内源性MYB30的量通过作为遍在蛋白E3连接酶的MIEL1来调节(Marino等人(2013)NatureCommunications4:1476)。但是,AtMYB30与栽植密度相关的见解目前为止完全没有报道。本说明书中使用的情况下,“栽植密度”是指每单位面积栽植的个体数。通常在培育植物的情况下,以适当的间隔将幼苗、苗木栽植、或间拔。这是由于如果个体的栽植密度增高,则个体平均的生物质生产性降低,每单位面积的生物质生产性会达到顶点。这样,任何植物均有每单位面积的生物质生产性最适合的栽植密度,以超过其的密度的栽植会导致种子和/或幼苗的收获物量相对于购买费用降低,因而不优选。将甘蔗、玉米等淀粉糖进行乙醇发酵而得的生物质乙醇是与二氧化碳排出削减有关的、极其重要的低级醇燃料。另外,木本等木质体系生物质的利用受到关注,由来自木本的葡萄糖制造乙醇的技术、由纤维素及木质素构成的木质纤维素制造单糖或低聚糖的技术的开发正在发展。生物质是可再生的来自生物的有机性资源,意指除去化石资源的资源。在燃烧生物质时排出的二氧化碳来自在植物的生长过程中通过光合成从大气中吸收的二氧化碳,因此认为即使燃烧生物质也不会使大气中的二氧化碳量增加。所以生物质生产性的提高对于由化石资源转换是非常有用的。本说明书中使用的情况下,“高密度栽植”是意指以超过每单位面积的生物质生产性最适合的栽植密度的密度栽植、使每单位面积的生物质的量充分提高的栽植密度。所谓“使每单位面积的生物质的量充分提高的栽植密度”,意思是各品种中的最适合栽植密度(即,每单位面积的生物质生产性成为最大的最适合栽植密度)。此外,最适合栽植密度对每个植物种类是不同的,但本领域技术人员能够根据使用的植物容易得知最适合栽植密度。此外,在本说明书中,将每单位面积的生物质生产性最适合栽植密度称为“最适密度栽植”,将以低于最适密度的密度栽植称为“低密度栽植”。本说明书中使用的情况下,“生物质的量”意指植物个体的干燥重量或生产量。生物质的量增加,由此获得由于能够将二氧化碳作为碳水化合物固定因而快速地减少大气中CO2量的效果、蔬菜时其可食用部也增大而成为粮食增产的效果、树木等时能够将纸等原料增产的效果等各种利益。本说明书中使用的情况下,术语“MYB30相关基因”意指编码MYB30相关蛋白质的基因,术语“MYB30相关蛋白质”意指AtMYB30样蛋白(与AtMYB30或AtMYB30功能上等价的蛋白质)、或者可以正向调控AtMYB30样蛋白的表达或功能的蛋白质、或者在AtMYB30样蛋白的信号传导通路(以下也称为MYB30信号传导通路)中在AtMYB30样蛋白的下游起作用的蛋白质。本说明书中使用的情况下,术语“蛋白质”与“肽”或“多肽”可交换地使用。另外,本说明书中使用的情况下,术语“基因”与“多核苷酸”、“核酸”或“核酸分子”可交换地使用,意指核苷酸的聚合物。如后述的实施例所示,由利用拟南芥的激活标记株的筛选结果可确认,AtMYB30被活化的植物体对高密度栽植是有利的,由此教导了能够正向调控AtMYB30的表达或功能的基因产物(例如BAK1、BR11、BES1、MIEL1等)、或者MYB30信号传导通路中在AtMYB30的下游起作用的基因产物(例如PLA2α、KCS1、FDH等)对于高密度栽植显示出与AtMYB30同样的功能。在拟南芥中,已知PLA2α与AtMYB30在体内(invivo)相互作用,已知AtMYB30参与PLA2α从细胞质小泡向核转移。另外,示出PLA2α在磷脂与酰基CoA库之间进行超长链脂肪酸(VLCFAs)的置换,参与过敏感细胞死亡(Raffaele等人(见前述);Reina-Pinto等人(见前述))。已知BAK1与作为富含亮氨酸重复序列受体激酶(leucine-richrepeatreceptorkinase)之一的BRI1结合。已知BRI1诱导作为转录因子的BES1的表达,已知该BES1与MYB30的功能有关(Li等人(前述))。这些报道支持对于高密度栽植PLA2α和BAK1可显示出与AtMYB30同样的效果。确实如后述的实施例所示,在使用拟南芥的激活标记株的筛选结果中,BAK1和PLA2α在增强子附近发现。由此认为,使用编码PLA2α或BAK1的基因可获得对高密度栽植有利的植物体。在一个实施方式中,“MYB30相关基因”意指编码调控MYB30信号传导通路的蛋白质的基因,意指编码活化MYB30信号传导通路的蛋白质的基因、即编码AtMYB30样蛋白的基因和编码其上游或下游中正向调控(上调)上述通路的蛋白质的基因。作为能正向调控AtMYB30的表达或功能的蛋白质,可以举出BES1和BAK1,作为在AtMYB30的下游起作用的蛋白质,可以举出PLA2α,但不限定于此。在一个实施方式中,MYB30相关基因可以是编码AtMYB30样蛋白、PLA2α样蛋白(PLA2α或与PLA2α功能上等价的蛋白质)或BAK1样蛋白(BAK1或与BAK1功能上等价的蛋白质)的基因。拟南芥的AtMYB30、BAK1和PLA2α的蛋白质分别包含序列号11、13和21所示的氨基酸序列,编码它们的基因分别包含序列号12、14和22所示的碱基序列。与这些基因功能上等价的基因能够参照公知的文献及数据库获取,这些也优选用于本发明。如Dubos等人(2010)TRENDSinPlantScience15(10):573-581所示,已知MYB转录因子的亚类型发挥类似的功能,如上所述,AtMYB30分类为亚类型1。所以,属于拟南芥的亚类型1的AtMYB31(At1g74650)、AtMYB60(At1g08810)、AtMYB94(At3g47660)、AtMYB96(At5g62470)能够作为MYB30相关蛋白质,与AtMYB30同样地优选用于本发明。另外,与AtMYB30功能上等价的转录因子不限定于它们,也包含在除拟南芥以外的植物中具有同样功能的转录因子(以下称为同源转录因子)。作为与AtMYB30功能上等价的转录因子(AtMYB30样蛋白),例如可以举出稻子(Oryzasativa)中作为同源转录因子的Os03g0378500、Os09g0414300、Os08g0437200、Os11g0558200、Os07g0629000、高粱(Sorghumbicolor)中作为同源转录因子的Sb07021430、Sb02g024640、Sb07g021420、Sb02g040160、Sb05g021820、Sb05g001730、Sb08g001800、葡萄(VitisVinifera)中作为同源转录因子的GSVIVP00016337001、GSVIVP00020968001、GSVIVP00033681001、白杨(Populustrichocarpa)中作为同源转录因子的POPTR_0017s11880g、大豆(Glycinemax)中作为同源转录因子的大豆MYB74、柑橘(Citrusclementina)中作为同源转录因子的CICLE_v10012152mg等。在本发明中,也可由以下得知可以利用与AtMYB30功能上等价的这些转录因子(同源转录因子):大豆(Glycinemax)中作为同源转录因子的、编码大豆MYB74的基因与AtMYB30基因同样带来在高密度栽植条件下的每单位面积的生物质生产性提高的转化体植物。对于同源转录因子,只要得知植物基因组信息,则能够基于基因的碱基序列由检索对象的基因组信息检索。对于同源转录因子,检索为其氨基酸序列相对于目标转录因子的氨基酸序列具有例如50%以上、优选70%以上、更优选90%以上、最优选95%以上的序列同源性的氨基酸序列。于是,包含相对于目标转录因子的功能结构域(例如MYB蛋白质的MYB结构域)的氨基酸序列具有例如85%以上、优选90%以上、更优选95%以上、最优选98%以上的序列同源性的氨基酸序列的转录因子检索为同源转录因子。序列同源性的值意思是利用安装了blast算法的计算机程序及收纳有基因序列信息的数据库在默认设定下求出的值。除拟南芥的PLA2α基因(At2g06925)以外,作为来自植物的PLA2α基因,已知稻子的Os11g0546600、Os03g0261100、Os03g0708000、高粱的Sb05g021000、Sb01g040430、Sb01g010640、葡萄的GSVIVP00001547001等,这些基因产物也优选作为PLA2α样蛋白用于本发明。另外,作为BAK1基因(At4g33430)的直向同源物,已知At2g13790、At2g13800、At1g34210、At1g71830等,作为来自除拟南芥以外的植物的BAK1基因,例如已知稻子的Os04g0457800、Os08g0174700、高粱的Sb07g004750、Sb06g018760、Sb04g023810、葡萄的GSVIVP00009544001、GSVIVP00001777001、GSVIVP00019412001、小立碗藓(Physcomitrellapatens)的Pp135268、Pp186598、卷柏(Selaginellamoellendorffii)的Sm268032、Sm444590、Sm268158等,这些基因产物也优选作为BAK1样蛋白用于本发明。上述基因及对应的蛋白质序列示于序列表,其序列号如下。[化2]另外,如上所述,AtMYB30的活化使植物对于病原性细菌感染的过敏反应(以下也称为由MYB30信号传导通路的活化引起的抗病害性)提高。所以,即使是AtMYB30、BAK1和PLA2α的蛋白质的突变体,只要具有使由MYB30信号传导通路的活化引起的抗病害性提高的功能,就是MYB30相关基因编码的蛋白质。在一个实施方式中,包含在序列号11、13或21所示的氨基酸序列中,缺失、置换或添加了1个或数个氨基酸的氨基酸序列、且使由MYB30信号传导通路的活化引起的抗病害性提高的多肽也优选用于本发明。此外,赋予植物抗病害性、环境胁迫耐受性不一定与植物生产性的提高相关。例如报道了在使与抗病害性和/或环境胁迫耐受性有关的基因在植物体组成型表达的情况下不损害植物体生长(例如参照Nakashima等人(2007)ThePlantJournal51:617-630)。为了不损害这样的植物生长,必需某些办法,但对这些办法中使用的每个基因要求不同的技术,因此,不存在任何确立为不损害植物生长用的技术,这样的技术绝不是技术常识或技术标准。多肽(氨基酸)的观点中使用的情况下,“1个或数个”意指本领域技术人员不进行过度实验、可通过部位特异的诱导突变法等公知的变异肽制作法而缺失、置换或添加的程度的数字,优选为1~30个的范围内,更优选为20个以下,进一步优选为1、2、3、4、5、6、7、8、9或10个(即10个以下),更进一步优选为1、2、3、4或5个(即5个以下)。此外,本领域技术人员可以根据目标多肽的长度容易地理解通过术语“1个或数个”表示的氨基酸数的范围是什么程度,并且可不进行过度实验制作“缺失、置换或添加了1个或数个氨基酸的多肽”。另外,这样的多肽不限定于具有人为导入的变异的多肽,也可以是分离纯化的天然存在多肽。于是,本领域技术人员能够根据本说明书中记载的步骤,没有试验错误地确认上述多肽是否具有所希望的活性。在本说明书中使用的情况下,关于目标多肽的同一性优选为80%以上,更优选为85%以上,进一步优选为90%以上,更进一步优选为95%以上,最优选为99%以上。在该领域众所周知的是,蛋白质的氨基酸序列中的一些氨基酸可不显著影响该蛋白质的结构或功能、容易地改变。并且,不仅人为改变,还众所周知在天然蛋白质中也存在不使该蛋白质的结构或功能显著变化的突变体。优选的突变体具有保守性或非保守性氨基酸置换、缺失、或添加。优选为沉默置换、添加、及缺失,特别优选为保守性置换。这些不使本发明所涉及的多肽活性变化。表现为代表的保守性置换的是脂肪族氨基酸Ala、Val、Leu、及Ile中的一个氨基酸向其它氨基酸的置换、羟基残基Ser和Thr的交换、酸性残基Asp和Glu的交换、酰氨基残基Asn和Gln间的置换、碱性残基Lys和Arg的交换、以及芳香族残基Phe、Tyr间的置换。另外,在本发明中,只要能够编码由MYB30信号传导通路的活化引起抗病害性提高的多肽,也能够使用与包含序列号12、14或22所示的碱基序列的多核苷酸在严格条件下杂交的多核苷酸。这样的多核苷酸包含例如编码包含在序列号11、13或21所示的氨基酸序列中缺失、置换或添加了1个或数个氨基酸的氨基酸序列的多肽的多核苷酸;包含在序列号12、14或22所示的碱基序列中缺失、置换或添加了1个或数个碱基的碱基序列的多核苷酸。多核苷酸(碱基)的观点中使用的情况下,“1个或数个”优选为1~100个的范围内,更优选为1~50个的范围内,进一步优选为1~30个的范围内,更进一步优选为1~15个的范围内。此外,本领域技术人员可以根据目标多核苷酸的长度容易地理解通过术语“1个或数个”表示的碱基数的范围是什么程度。本说明书中使用的情况下,对于目标多核苷酸的同一性优选为80%以上,更优选为85%以上,进一步优选为90%以上,更进一步优选为95%以上,最优选为97%以上。在本发明中,所谓“严格条件”,意思是仅在至少90%的同一性、优选至少95%的同一性、最优选至少97%的同一性在序列间存在时发生杂交。具体而言,例如可以举出在杂交溶液(包含50%甲酰胺、5×SSC(150mM的NaCl、15mM的柠檬酸三钠)、50mM的磷酸钠(pH7.6)、5×Denhardt's溶液、10%硫酸葡聚糖、和20μg/ml的变性剪切的鲑鱼精子DNA)中42℃温育一夜后在约65℃0.1×SSC中洗涤过滤器的条件。杂交能够由Sambrook等、MolecularCloning,ALaboratoryManual,3rdEd.,ColdSpringHarborLaboratory(2001)中记载的方法这样众所周知的方法进行。通常温度越高,盐浓度越低,严格性越高(难以杂交),从而能够获取同源性更高的多核苷酸。氨基酸序列、碱基序列的同一性能够利用由Karlin和Altschul得到的算法BLAST(KarlinS和AltschulSF(1990)Proc.Natl.Acad.Sci.USA,87:2264-2268;(1993)Proc.Natl.AcadSci.USA,90:5873-5877)来确定。开发出了被称为基于BLAST算法的BLASTN、BLASTX的程序(AltschulSF等人(1990)J.Mol.Biol.215:403)。本发明中使用的MYB30相关基因可以来自基因组DNA,也可以来自cDNA,也可以是化学合成DNA。另外,也可以为RNA。作为获取本发明中使用的MYB30相关基因的方法,可以举出根据公知的技术分离出对MYB30相关基因的蛋白质编码的DNA片段、并克隆的方法。例如可以制备与对拟南芥的MYB30、PLA2α或BAK1的蛋白质编码的DNA的一部分碱基序列特异性杂交的探针,筛选基因组DNA库、cDNA库。或者作为获取本发明中使用的MYB30相关基因的方法,可以举出使用PCR等扩增手段的方法。例如从拟南芥的MYB30相关基因的cDNA内、5’侧和3’侧的序列(或其互补序列)之中分别制备引物,利用这些引物以基因组DNA(或cDNA)为模板进行PCR等,将夹在两引物间的DNA区域扩增,由此能够大量获取包含本发明中使用的MYB30相关基因的可读框的DNA片段。本发明中使用的MYB30相关基因能够以任意植物组织或细胞作为供给源获取。全部植物具有MYB30相关基因,因此,可以以所希望的植物为供给源获取MYB30相关基因。〔2:高密度栽植优选的植物体和其利用〕植物不仅作为粮食,还作为鉴赏用、纸、药品等工业材料、燃料在各种局面中与人类息息相关。另外,近年来作为替代化石燃料的生物质能量也受到注目。但是,对于植物的发芽、生长、开花等机制尚未明确的方面也较多。因此,植物通过经验、感觉栽培为主,由气候等自然影响而导致收获大幅被左右。因此,阐明植物发芽、生长、开花的机制对这些进行调整·控制不仅在鉴赏用花草、谷物·蔬菜等粮食的收获量增加中是重要的,而且关于森林中木材的培育、进而生物质能量也是极其重要的。如后述的实施例所示,在导入了MYB30相关基因的转化体中,确认了与亲本植物或野生型植物比较高密度栽植时每单位面积的生物质的量增加。另外,如后述的实施例所示,在MYB30相关基因的活性水平增加的植物体中,确认了与亲本植物或野生型植物比较高密度栽植时每单位面积的生物质的量增加。即,本发明提供MYB30信号传导通路活化、使高密度栽植时每单位面积的生物质的量增加的植物体和其制造方法。在专利文献2中,公开了在植物内源性的γ-谷氨酰半胱氨酸合成酶(GSH1)中使其表达水平或活性水平增加发生变异的植物、导入了来自植物的GSH1基因的转化体植物中,高密度栽植时每单位面积的生物质的量增加。但是,GSH1基因不是MYB30相关基因。这点由以下可知:尽管在GSH1转化体中,不仅高密度栽植时每单位面积的生物质的量,种子收获量也增加,但在MYB30转化体中,种子收获量减少。在一个实施方式中,本发明提供使MYB30相关基因活性水平增加的植物体。本实施方式所涉及的植物体可以是由人工诱变或天然变异而导致内源性MYB30相关基因的表达量增加的植物或者内源性MYB30相关基因被活化的植物。即,本实施方式所涉及的植物体的制造方法包括对内源性MYB30相关基因诱导人工变异的工序。在另一个实施方式中,本发明提供利用包含MYB30相关基因的外源性基因转化的、与亲本植物比较高密度栽植时每单位面积的生物质的量增加的转化体植物。即,本实施方式所涉及的植物体的制造方法包括利用包含MYB30相关基因的外源性基因转化植物体的工序。对于植物体转化中使用的外源性基因,将植物细胞中起作用的启动子与MYB30相关基因的上游连接,将植物细胞中起作用的终止子与下游连接。通过将这样的外源性基因导入植物体,能够转化目标植物体。作为植物细胞中起作用的终止子,可以举出来自胭脂氨酸合成酶(NOS)基因的终止子、来自花椰菜花叶病毒的终止子等。作为植物细胞中起作用的启动子,多使用组成型表达的花椰菜花叶病毒35S启动子,但不限定于此。作为除花椰菜花叶病毒35S启动子以外的组成型启动子,可以举出稻子的肌动蛋白启动子、玉米的遍在蛋白启动子等,这些启动子也能够优选用于本发明。作为除组成型启动子以外的启动子,可以举出rbcS启动子、Cab启动子等绿叶组织特异性启动子、HSP70启动子等诱导性启动子,但不限定于此。另外,直接插入叶绿体基因组的情况下的启动子可以举出rbcL启动子等,但只要是在叶绿体内起作用的启动子即可,并不限于此。对于作为本发明中使用的外源性基因的一个实施方式的重组表达载体,只要是可在植物细胞内使MYB30相关基因表达,就没有特别限定。特别地,当向植物体中的载体导入法是使用农杆菌的方法的情况下,优选使用pBI系等双元载体。作为双元载体,例如可以举出pBIG、pBIN19、pBI101、pBI121、pBI221、pMAT137等。在本发明中成为转化对象的植物体也意指植物体全体、植物器官(例如叶、花瓣、茎、根、种子等)、植物组织(例如表皮、韧皮部、软组织、木质部、维管束、栅栏组织、海绵组织等)或植物培养细胞、或各种形态的植物细胞(例如悬浮培养细胞)、原生质体、叶的切片、愈伤组织等中的任一个。作为转化中使用的植物体,没有特别限定,可以适当选择使用的MYB30相关基因可表达的植物。在此,使用拟南芥的MYB30相关基因的情况下,成为转化对象的植物优选是与拟南芥近缘的十字花科植物,但不限定于此,报道了在各种植物中,可使用自身基因或来自其它植物的基因来制作出所希望的转化体植物(参照FrankeR等人(2000)PlantJ.22:223-234;Yamaguchi和Blumwald(2005)TRENDSinPlantScience10(12):615-620)。同样地只要将拟南芥的MYB30相关基因导入到上述这样的植物中,就能够容易地制作出适合高密度栽植的转化体植物,即在高密度栽植条件下每单位面积的生物质生产性提高的转化体植物。本发明可对于各种植物适用可由以下明确:通过对表达AtMYB30基因的同源转录因子的稻子导入AtMYB30基因,可以制作出在高密度栽植条件下每单位面积的生物质生产性提高的转化体稻子。使用本领域技术人员公知的转化方法(例如农杆菌法、粒子枪法、聚乙二醇法、电穿孔法等)向植物细胞中导入重组表达载体。例如使用农杆菌法的情况下,能够将构建的植物用表达载体导入到适当的农杆菌(例如根癌农杆菌(Agrobacteriumtumefaciens))中,按照叶盘法(内宫博文著,植物基因操作手册,1990,27-31pp,讲谈社科学,东京)等使该株感染无菌培养叶片,从而获得转化体植物。另外,使用粒子枪法的情况下,可以直接使用植物体、植物器官、植物组织自身,也可以在制备切片后使用,也可以制备原生质体使用。能够使用基因导入装置(例如PDS-1000(BIO-RAD公司)等)处理这样制备的试样。处理条件根据植物或试样而异,但通常以450~2000psi左右的压力、4~12cm左右的距离进行。导入了目标基因的细胞或植物组织首先经卡那霉素耐性、潮霉素耐性等药剂耐性标记选择,接着通过规定方法再生成植物体。由转化细胞再生植物体可以根据植物细胞的种类采用本领域技术人员公知方法进行。目标基因是否导入到植物中的确认能够通过PCR法、Southern杂交法、Northern杂交法等进行。例如由转化体植物制备DNA,以导入的DNA设计特异性引物进行PCR。其后,对于扩增产物进行琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳或毛细管电泳等,通过溴化乙锭等染色,检测目标扩增产物,能够由此确认转化。一旦获得在基因组内导入了MYB30相关基因的转化体植物体,就能够由该植物体通过有性生殖或无性生殖获得子孙。另外,也可以由该植物体、其子孙或克隆获得繁殖材料(例如种子、原生质体等),以这些为基础大量生产目标植物体。本发明所涉及的植物体即使在以比使每单位面积的生物质的量充分提高的栽植密度高的栽植密度栽培的情况下,与亲本植物/野生型植物比较每单位面积的生物质的量也会进一步增加。即,本发明所涉及的植物体能够通过高密度栽植来提供亲本植物/野生型植物不能提供的生物质的量。但是栽培本发明所涉及的植物体时的栽植密度不必限定于比上述最适合栽植密度高的情况,优选为各品种中最适合栽植密度的30%以上,更优选为60%以上,还优选为100%以上。对于本发明所涉及的植物体,与野生型植物或亲本植物比较,在高密度栽植时得到的生物质的量增加。因此,通过确认在进行高密度栽植时生物质的量与野生型植物或亲本植物相比是否增加,能够得知是否是本发明所涉及的植物体。即,本发明所涉及的植物体的制造方法可以进一步包括确认在进行高密度栽植时生物质的量与野生型植物或亲本植物相比是否增加的工序。另外,对于本发明所涉及的植物体,由于MYB30信号传导通路活化,因此,由MYB30信号传导通路的活化引起的抗病害性提高。所以,通过确认由MYB30信号传导通路的活化引起的抗病害性是否提高,具体而言,通过确认对病原性细菌(例如野油菜黄单胞菌(Xanthomonascampestris)、丁香假单胞菌(Pseudomonassyringe)等)的抵抗性是否提高,能够得知是否是本发明所涉及的植物体。即,本发明所涉及的植物体的制造方法可以进一步包括确认由MYB30信号传导通路的活化引起的抗病害性是否提高的工序。对于根据上述步骤而得的植物体(即本发明所涉及的植物体),以与使每单位面积的生物质的量充分提高的栽植密度相比更高的栽植密度栽培,由此与亲本植物(或者转化中使用的植物)相比较,得到的生物质的量增加。即,本发明提供使用上述植物体的植物生物质生产方法。本发明所涉及的生产方法的特征在于,包括在高密度栽植条件下栽培本发明所涉及的植物体的工序。在一个实施方式中,上述植物体可以是通过人工诱变或天然变异而内源性MYB30相关基因的表达量增加的植物或者内源性的MYB30相关基因被活化的植物。即,本实施方式所涉及的生产方法可进一步包括对内源性MYB30相关基因诱导人工变异的工序。在另一个实施方式中,上述植物体可以是用包含MYB30相关基因的外源性基因转化的植物。即,本实施方式所涉及的生产方法可进一步包括用包含MYB30相关基因的外源性基因转化植物体的工序。在本实施方式所涉及的生产方法中使用的外源性基因中,上述MYB30相关基因优选与控制表达时期和/或表达器官的启动子(诱导性启动子)可操作地连接。在一个局面中,上述启动子可在非转化体植物花芽形成期即刻前开始上述MYB30相关基因的表达。在另一局面中,上述启动子可叶器官特异性地使MYB30相关基因表达。转化的植物体只要是具有与MYB30相关基因的基因产物功能上等价的内源性转录因子的植物,就没有特别限定。在NCBI(NationalCenterforBiotechnologyInformation)等公开的公知数据库中能够确认与MYB30相关基因功能上等价的转录因子,它们以从单子叶植物到双子叶植物的广泛范围存在。即,作为转化的植物体,可以广泛使用单子叶植物及双子叶植物,作为单子叶植物,例如可以例示包含浮萍属植物(浮萍)及青萍属植物(青萍,品藻)的浮萍科植物;包含洋兰属植物、建兰属植物、吊兰属植物、蝴蝶兰属植物、万代兰属植物、兜兰属植物、文心兰属植物等兰科植物、宽叶香蒲科植物、黑三棱科植物、眼子菜科植物、茨藻科植物、冰沼草科植物、慈姑科植物、水鳖科植物、霉草科植物、稻科植物(甜玉米等的玉米等)、莎草科植物、椰子科植物、芋头科植物、干草科植物、鸭跖草科植物、雨久花科植物、蔺草科植物、百部科植物、百合科植物、石蒜科植物、薯蓣科植物、菖蒲科植物、芭蕉科植物、姜科植物、美人蕉科植物、水玉簪科植物等。另外,作为双子叶植物,例如优选选自包含牵牛花属植物(牵牛花)、旋花属植物(旋花,打碗花,海铃)、番薯属植物(厚藤、红薯)、菟丝子属植物(菟丝子、南方菟丝子)的旋花科植物;包含石竹属植物(康乃馨等)、繁缕属植物、高山漆姑草属植物、卷耳属植物、漆姑草属植物、鹅不食属植物、种阜草属植物、孩儿参属植物、治疝草属植物、大爪草属植物、三叶草属植物、蝇子草属植物、剪秋罗属植物、蝇子草属植物、狗筋蔓属植物的石兰科植物;木麻黄科植物、三白草科植物、胡椒科植物、金粟兰科植物、杨柳科植物、杨梅科植物、胡桃科植物、桦木科植物、壳斗科植物、榆科植物、桑科植物、荨麻科植物、川苔草科植物、山龙眼科植物、青皮木科植物、檀香科植物、槲寄生科植物、马兜铃科植物、帽蕊草科植物、蛇菰科植物、蓼科植物、藜科植物、苋科植物、紫茉莉科植物、日本假繁缕科植物、商陆科植物、番杏科植物、马齿苋科植物、木兰科植物、昆栏树科植物、连香树科植物、睡莲科植物、金鱼藻科植物、毛茛科植物、木通科植物、小檗科植物、防己科植物、蜡梅科植物、樟科植物、罂粟科植物、山柑科植物、十字花科植物、茅膏菜科植物、猪笼草科植物、景天科植物、虎耳草科植物、海桐花科植物、金缕梅科植物、悬铃木科植物、蔷薇科植物、豆科植物、酢浆草科植物、牻牛儿苗科植物、亚麻科植物、蒺藜科植物、柑橘科植物、苦木科植物、楝科植物、远志科植物、大戟科植物、水马齿科植物、黄杨科植物、岩高兰科植物、马桑科科植物、漆树科植物、冬青科植物、卫矛科植物、省沽油科植物、茶茱萸科植物、槭树科植物、七叶树科植物、无患子科植物、清风藤科植物、凤仙花科植物、鼠李科植物、葡萄科植物、杜英科植物、椴树科植物、锦葵科植物、梧桐科植物、猕猴桃科植物、山茶科植物、金丝桃科植物、沟繁缕科植物、柽柳科植物、堇菜科植物、大风子科植物、旌节花科植物、西番莲科植物、秋海棠科植物、仙人掌科植物、瑞香科植物、胡颓子科植物、千屈菜科植物、石榴科植物、红树科植物、八角枫科植物、野牡丹科植物、菱科植物、柳叶菜科植物、小二仙草科植物、杉叶藻科植物、五加科植物、伞形科植物、山茱萸科植物、岩梅科植物、山柳科植物、鹿蹄草科植物、杜鹃花科植物、紫金牛科植物、报春花科植物、白花丹科植物、柿科植物、山矾科植物、安息香科植物、木犀科植物、醉鱼草科植物、龙胆科植物、夹竹桃科植物、萝藦科植物、花荵科植物、紫草科植物、马鞭草科植物、唇形科植物、茄科植物(番茄等)、玄参科植物、紫葳科植物、胡麻科植物、列当科植物、苦苣苔科植物、狸藻科植物、爵床科植物、苦槛蓝科植物、透骨草科植物、车前草科植物、茜草科植物、忍冬科植物、五福花科植物、败酱科植物、川续断科植物、葫芦科植物、桔梗科植物、菊科植物等,更优选选为自十字花科植物、茄科植物、豆科植物、稻子科植物、桃金娘科植物、杨柳科植物、柑橘科植物、葫芦科植物、梧桐科植物、锦葵科植物、大戟科植物、蔷薇科植物、睡莲科植物、唇形科植物、龙胆科植物、葡萄科植物的植物。此外,成为本发明对象的植物不仅是上述例示的植物的野生型,也可以是突变体、转化体。本发明可以对于从单子叶植物到双子叶植物广泛的各种植物应用也可以由以下明确:通过将来自作为双子叶植物的拟南芥的AtMYB30基因,对于作为单子叶植物的稻子导入AtMYB30基因,可以制作出在高密度栽植条件下每单位面积的生物质生产性提高的转化体稻子。另外,在本实施方式所涉及的生产方法中,优选在花芽形成期之前回收生物质的情况下,也可以不使用诱导性启动子。这种情况下,转化的植物体可以是上述植物。〔3:植物生物质生产用工具及其利用〕本发明还提供使植物在高密度栽植条件下的每单位面积的生物质生产性提高用的试剂盒。本发明所涉及的试剂盒的特征在于,为了使植物在高密度栽植条件下的每单位面积的生产性提高,具备包含MYB30相关基因的外源性基因。在上述外源性基因中,上述MYB30相关基因可以与控制蛋白质表达时期的启动子可操作地连接,优选为编码选自AtMYB30、BAK1和PLA2α中的蛋白质的基因。本发明所涉及的试剂盒可以用于制造在高密度栽植条件下的每单位面积的生物质生产性提高的转化体植物。即,本发明提供了转化体植物的制作方法,包括利用上述试剂盒转化植物体的工序的。这种情况下,本发明所涉及的试剂盒也可以进一步具备调查有无由MYB30信号传导通路的活化引起的抗病害性的试剂。然后,本发明所涉及的制作方法可以进一步包括对由MYB30信号传导通路的活化引起的抗病害性提高的个体进行选拔的工序。由此,能够容易地得知在得到的转化体植物中MYB30信号传导通路是否活化,其结果,能够容易地得知得到的转化体植物是否具有使在高密度栽植条件下的每单位面积的生物质生产性提高这个所希望的性状。此外,作为调查有无由MYB30信号传导通路的活化引起的抗病害性的试剂,可以举出检测与过敏感细胞死亡相伴地叶内放出的过氧化氢的2,7-二氯二氢荧光黄二乙酸酯(DCFH-DA)、羟苯基荧光黄、BES-H2O2-Ac等过氧化氢特异性荧光探针,但不限定于此。另外,在调查有无由MYB30信号传导通路的活化引起的抗病害性时,优选使用病原性细菌作为病原体,作为病原性细菌,可以举出野油菜黄单胞菌(Xanthomonascampestris)、丁香假单胞菌(Pseudomonassyringe)等,但不限定于此。这样的病原性细菌也还可以是用于调查有无由MYB30信号传导通路的活化引起的抗病害性的试剂。本发明所涉及的试剂盒也可以具备除这些物质以外的其它成分。包含MYB30相关基因的外源性基因、及上述其它成分可以放入到以适当的容量和/或形态含有的一个容器(例如瓶、板、管、盘等)中提供,也可以分别放入到另外的容器中提供。另外,本发明所涉及的试剂盒可以进一步具备使植物生长用的器具、培养基等。并且,为了实现使植物在高密度栽植条件下每单位面积的生产性提高的用途,本发明所涉及的试剂盒优选具备记载有使植物在高密度栽植条件下每单位面积的生产性提高用的使用步骤的指示书、或者记载有制造植物在高密度栽植条件下每单位面积的生产性提高的植物用的使用步骤的指示书。“指示书”可以以纸或其它媒介写出印刷,或者也可以附在磁带、计算机可读取的盘或带、CD-ROM等这样的电子媒介中。本发明所涉及的试剂盒可以用于构成上述组成物,可以分别具备上述组成物含有的物质,也可以分别具备上述组成物和其它成分。〔4:适合高密度栽植的植物体的标志物〕如上所述,MYB30相关基因在植物体中的表达量或活性的提高是得知该植物体在高密度栽植条件下的每单位面积的生产性提高的植物体的指标。即,MYB30相关基因是可用于筛选在高密度栽植条件下的每单位面积的生产性提高的植物体的标志物。即,本发明提供使用MYB30相关基因作为标志物来筛选在高密度栽植条件下的每单位面积的生产性提高的植物体的方法。在一个实施方式中,本发明所涉及的筛选方法的特征在于,为了筛选在高密度栽植条件下的每单位面积的生产性提高的植物体,包括将MYB30相关基因的表达量或MYB30相关基因编码的蛋白质的表达量与基准值比较的工序;及选择上述表达量比基准值高的个体的工序。在另一实施方式中,本发明所涉及的筛选方法的特征在于,为了筛选在高密度栽植条件下的每单位面积的生产性提高的植物体,包括将MYB30相关基因编码的蛋白质的活性与基准值比较的工序;及选择上述活性比基准值高的个体的工序。上述基准值可以是预先取得的上述表达量或上述活性的值,也可以是筛选中使用的群组中的平均值。如上所述,认为MYB30相关基因在植物体中的表达量或活性的提高与由MYB30信号传导通路的活化引起的抗病害性提高相关。所以,通过选拔由MYB30信号传导通路的活化引起的抗病害性提高的个体,能够得知是否是本发明所涉及的植物体。即,本发明所涉及的植物体的制造方法可以进一步包括确认由MYB30信号传导通路的活化引起的抗病害性是否提高的工序。对于本发明所涉及的植物体,由于MYB30信号传导通路活化,因此,由MYB30信号传导通路的活化引起的抗病害性提高。所以,通过确认由MYB30信号传导通路的活化引起的抗病害性是否提高,能够筛选在高密度栽植条件下的每单位面积的生产性提高的植物体。即,本发明所涉及的筛选方法可以进一步包括选拔由MYB30信号传导通路的活化引起的抗病害性提高的个体的工序。〔5:进一步的利用〕如后述的实施例所示,(a)栽培T-DNA插入突变体植物的种子库获得第一世代种子;(b)栽培第一世代种子获得第二世代种子;(c)栽培第二世代种子获得第三世代种子;(d)确定来自种子的基因组DNA中的T-DNA插入部位;(e)由上述T-DNA插入部位确定在10kb以下的范围内具有可读框的目标基因,由此能够筛选使植物在高密度栽植条件下的每单位面积的生产性提高的基因,这种情况下,上述a~c中至少之一的种子可以是自高密度栽植条件下栽培且栽培时的生长状态良好的个体获得的其种子。利用包含按照这样的步骤筛选出的基因的外源性基因,将植物体转化,由此能够制作本发明所涉及的转化体植物,在此时,可以进一步进行选拔由MYB30信号传导通路的活化引起的抗病害性提高的个体。这样,本发明是筛选使植物在高密度栽植条件下的每单位面积的生产性提高的基因的方法,提供了包括上述a~e的工序的方法、且上述a~c中至少之一的种子是自高密度栽植条件下栽培且栽培时的生长状态良好的个体获得的其种子。本发明所涉及的基因筛选方法可以进一步进行(f)选拔由MYB30信号传导通路的活化引起的抗病害性提高的个体。此外,作为实施发明用的最好形式示出的具体实施方式及以下实施例只不过是阐明本发明的技术内容,不应该仅限定于这样的具体例狭义地解释,本领域技术人员能够在本发明的精神及附带的权利要求的范围内变更实施。另外,本说明书中记载的学术文献及专利文献全部在本说明书中作为参考援引。实施例下面,对于本发明,利用实施例进一步详细说明,但本发明不限定于这些实施例。〔实施例1〕〔1〕MYB30基因的取得为了扩增含有编码AtMYB30的基因(AtMYB30基因:At3g28910)的ORF区域的片段,基于TAIR(http://www.arabidopsis.org/home.html)中公布的序列信息设计且合成PCR用引物(ATMYB30_F(HindIII)及ATMYB30_R(XbaI))。此外,在这些引物的末端,添加有在表达载体中导入时必需的限制酶位点(HindIII或XbaI)。[化3]ATMYB30_F(HindIII):5’-AAGCTTATGGTGAGGCCTCCTTGTTGTG-3’(序列号1)ATMYB30_R(XbaI):5’-TCTAGACCGGATATGAGCGAGCATTTTTTGGTC-3′(序列号2)栽培野生型拟南芥Col-0生态型,将采取的幼叶在液氮冻结下粉碎。用QIAGEN公司制DNA制备试剂盒(DNeasyPlantMiniKit),按照试剂盒附带的标准方案制备DNA。以制备的DNA为模板,用酶KOD-Plus(TOYOBO公司制)、引物ATMYB30_F(HindIII)及ATMYB30_R(XbaI)进行PCR反应。将反应液组成及反应条件分别示于表1及表2。[表1]模板(基因组DNA)60ng用于KOD-Plus的10×PCR缓冲液(TOYOBO公司制)5μl2mMdNTPs(TOYOBO公司制)5μl25mMMgSO42μl各引物20pmolKOD-Plus1.0单位总容量50μl[表2]#1:94℃(2分钟)#2:94℃(15秒)/63℃(30秒)/68℃(1分钟),进行25个循环对于PCR扩增产物,用2%琼脂糖凝胶(TAE缓冲液)进行电泳,通过溴化乙锭将片段染色。切下含有目标片段的凝胶,用QIAquickGelExtractionKit(QIAGEN公司制)洗脱且纯化目标DNA片段。对得到的DNA片段用A-AdditionKit(QIAGEN公司制)添加腺嘌呤。将添加有腺嘌呤的扩增DNA与TA克隆载体连接,用连接反应后的载体根据试剂盒附带的方案进行感受态细胞(DH5α,NipponGene)的转化。上述步骤中使用pGEM-TEasyVectorSystem(Promega公司制)。将在涂布了转化反应液的LB培养基板(含有50μg/mL的氨苄青霉素)呈现的集落在LB培养基中液体培养,用PlasmidMiniKit(QIAGEN公司制),由得到的菌体制备质粒DNA。进行碱基序列确定及序列解析,克隆含有AtMYB30基因的ORF的载体。〔2〕植物表达用载体的制作制作在含有来自花椰菜花叶病毒的35S启动子的植物表达用载体pMAT137上插入了含有AtMYB30基因的ORF的片段的构建体。首先,将克隆的含AtMYB30基因的载体用限制酶HindⅢ及SacⅠ消化。接着,将pMAT137用限制酶HindⅢ及SacⅠ消化。将这些限制酶消化产物用0.8%琼脂糖凝胶进行电泳,利用QIAquickGelExtractionKit(QIAGEN公司制),分别由凝胶纯化含有约1.4kbpAtMYB30基因的ORF的片段和pMAT137。将pMAT137片段作为载体,与含有AtMYB30基因的ORF的片段以载体:插入物之比为1:10的方式混合,用等量的TaKaRaLigationkitver.2(TaKaRaBio公司制)在16℃进行一夜连接反应。用连接反应后的载体,根据试剂盒附带的方案进行感受态细胞(DH5α,NipponGene)的转化。将涂布了转化反应液的LB琼脂培养基(含有12.5μg/mL卡那霉素)培养一夜,将呈现的集落用LB培养基进行液体培养,利用PlasmidMiniKit(QIAGEN公司制)由得到的菌体制备质粒DNA。进行碱基序列确定及序列解析,获得具有包含AtMYB30基因的ORF的片段的植物表达用载体。〔3〕利用农杆菌法向拟南芥中导入基因通过电穿孔法(PlantMolecularBiologyMannal,第二版,B.G.Stanton和A.S.Robbert,KluwerAcdemicPublishers(1994)),将制作的植物表达用载体导入到根癌农杆菌(Agrobacteriumtumefaciens)LBA4404株中。接着,根据Clough等记载的浸润法(StevenJ.Clough和AndrewF.Bent(1998)ThePlantJournal16:735-743),将导入了植物表达用载体的根癌农杆菌导入到野生型拟南芥生态型Col-0中。利用含有卡那霉素的培养基选拔多个转化体植物。栽培转化体植物重复自体授粉,获得3种T3种子或T4种子,分别命名为18-1、15-1、3-1。〔4〕转化体植物基因表达量的确认将加入了蛭石混合土的26cm×19.5cm浅箱分成8个区域,将得到的T3种子每1个区域成一条道,以种子勺取计各播种100粒。以22℃、100μmol/m2/sec、16小时明期/8小时暗期的条件栽培4周。从栽培的植物个体中回收约10片莲座叶,用实时PCR法分别测定AtMYB30基因在转化体植物及野生型植物(Col-0)中的表达量。将认为在细胞内组成型表达的18SrRNA基因的表达量作为内标使用。使用RNeasyPlantMiniKit(QIAGEN公司制),由回收的莲座叶制备总RNA。利用PrimeScript(注册商标)RTreagentKit(PerfectRealTime)(TaKaRaBio公司制),由1μg总RNA制作cDNA。分别将反应液组成及反应条件示于表3及表4。[表3]总RNA1μg5×PrimeScript缓冲液4μlOligodT引物50pmol随机6聚体(Randam6mers)100pmolPrimeScriptRT酶混合物I1μl总容量20μl[表4]步骤137℃(15分钟)步骤285℃(5秒)步骤34℃使用PowerSYBRGreenPCRMasterMix(AppliedBiosystems公司制)和7500RealTimePCRSystem(AppliedBiosystems公司制),根据下面的反应循环实行实时PCR。此外,用作模板的cDNA在检测AtMYB30时以5倍稀释、在检测18SrRNA时以500倍稀释使用。另外,作为对照,使用野生型拟南芥Col-0的基因组,以0.0001~10ng的浓度范围制作各10倍的稀释系列。将反应液组成及反应条件分别示于表5及表6。[表5]模板1μl正向引物10pmol反向引物10pmol2×PowerSYBRGreenPCRMasterMix12μl总容量24μl[表6]步骤150℃(2分钟)步骤295℃(10分钟)步骤395℃(15秒)/60℃(1分钟),进行40个循环步骤495℃(15秒)/60℃(1分钟)→95℃(15秒)/60℃(15秒)在AtMYB30基因及18srRNA基因扩增中使用的引物的序列如下。[化4]myb30At3g28910F:5′-GTGAAAAACTCGCCGAAGAC-3’(序列号3)At3g28910R:5’-GCACACTCCTTCCCATCATC-3’(序列号4)18SrRNAAt18SF:5-TCCTAGTAAGCGCGAGTCATC-3’(序列号5)At18SR:5’-CGAACACTTCACCGGATCAT-3’(序列号6)由测定结果计算出AtMYB30基因的表达量,进行野生型(Col-0)与转化体植物(3-1,15-1,18-1)中表达量的比较。〔5〕转化体植物的表型的确认将制作的T4种子分别以1个体、3个体、8个体、16个体的形式播种在加入了蛭石混合土的38.44cm2的4个盆中,在22℃、100μmol/m2/sec、16小时明期/8小时暗期的条件下栽培4周。各盆放入浅箱中管理,每一个浅箱配置35个盆(7行×5列),测量使用群落中央周边的15个盆。除转化体植物以外,使用野生型拟南芥(Col-0)作为对照的非重组体植物。在栽培4周后,用电子天平称量植物体地上部的鲜重(生物质的量)。〔6〕转化体植物中基因表达量的确认图1表示以播种4周后植物中的野生型(Col-0)中AtMYB30基因的表达量为1时转化体植物(18-1,15-1,3-1)中的AtMYB30基因的表达量。确认转化体植物中AtMYB30基因比野生型植物多表达。另外,其表达量按Col-0<18-1<15-1<3-1的顺序。〔7〕转化体植物的表型图2中以两对数图表示野生型(Col-0)及导入了含有AtMYB30基因的ORF的片段的转化体植物(3-1)的地上部的鲜重与栽植密度的关系。虚线及实线分别表示野生株(Col-0)与转化体植物(3-1)的近似线。植物的个体重量伴随着栽植密度的上升而减少。已知栽植密度与植物个体的关系根据被称为-3/2幂法则的法则,已知根据该法则,图的斜率是一定的。然而,可知在转化体植物(3-1)中,近似线的斜率变缓。对于低密度栽植或最适密度栽植下的个体重量,野生型植物大,而高密度栽植条件下的个体重量,转化体植物大。该结果显示出在转化体植物中与栽植密度上升相伴的个体重量减少减轻。以栽植密度为X、鲜重为Y、将该图表示成Y=bXa时,近似曲线的数学式变成下面的结果。[化5]野生型(Col-0):Y=777.45X-0.742(R2=0.9976)转化体植物(18-1):Y=770.30X-0.722(R2=0.9973)转化体植物(15-1):Y=706.53X-0.678(R2=0.9948)转化体植物(3-1):Y=663.49X-0.657(R2=0.999)图3是将表示野生株及转化体植物中图的斜率的幂指数a比较的图,可知以野生型(Col-0)>18-1>15-1>3-1的顺序斜率变小。图4表示经实时PCR测定的AtMYB30基因的表达量与斜率a的相关。由该结果可知,具有AtMYB30基因的表达量越增多,图的斜率越变缓的倾向,AtMYB30转化体是对高密度栽植有利的个体。另外,图5表示将野生型(Col-0)及转化体植物((a)18-1、(b)15-1、(c)3-1)中每盆的生物质收获量(地上部鲜重)与栽植密度的关系比较的结果。绘图表示各自的测定平均值,虚线及实线表示近似线。对于在高密度栽植条件下每盆生物质的量,在全部转化体植物中比野生型植物增加。这表示通过使AtMYB30基因在植物中过量表达,可使每单位面积的生产性提高。〔8〕高密度栽植时使每单位面积的植物生物质的量提高的基因从NottinghamArabidopsisStockCentre(NASC)购买拟南芥突变体(激活标记T-DNA株:WeigelT-DNA株,共20072系统)的种子。对于使用的种子,参照Weigel,D.等人(2000)PlantPhysiol.122:1003-1013。使用WeigelT-DNA株选拔适于高密度栽植的株。首先,在加入了蛭石混合土的26cm×19.5cm浅箱中各播种20粒种子(共约2000粒种子)。栽培使用CO2箱(LOWTEMPERATUREO2/CO2INCUBATORMODEL-9200:WAKENYAKU),在CO2浓度1%(10000ppm)、22℃、200μmol/m2/sec的照明下(16小时明期/8小时暗期的循环)培养4周,选拔生长良好的个体(一次选拔)。将得到的个体栽培,获得各自的种子。进一步进行二次选拔。将加入了蛭石混合土的26cm×19.5cm浅箱分割成8个区域,将一次选拔得到的植物种子每1个区域成一条线,以种子勺取计每个播种100粒。使用CO2箱(LOWTEMPERATUREO2/CO2INCUBATORMODEL-9200:WAKENYAKU),在CO2浓度1%(10000ppm)、22℃、200μmol/m2/sec的照明下(16小时明期/8小时暗期的循环)培养4周,选拔生长良好的个体。将得到的个体栽培,获得各自的种子。从栽培了取得的种子的个体采取幼叶,在液氮冻结下粉碎。用QIAGEN公司制DNA制备试剂盒(DNeasyPlantMiniKit),根据试剂盒附带的标准方案制备基因组DNA。通过TAIL-PCR法确定得到的基因组DNA中的T-DNA插入部位。首先,使其与WeigelT-DNAlines中使用的激活标签用载体(pSKI015:GenBank登录号AF187951)的T-DNA序列(T-DNA左边界)附近对应,设计3种特异性引物TL1、TL2及TL3。将这些与任意引物P1一起使用,利用以下PCR反应液组成及反应条件,进行TAIL-PCR(岛本功、佐佐木卓治监修,新版,植物的PCR实验方案,1997,第83~89页,秀润社,东京;Liu,Y.G.等人(1995)ThePlantJournal8:457-463),扩增与T-DNA邻接的基因组DNA。引物TL1、TL2、TL3及P1的具体序列如下。[化6]TL1:5’-TGCTTTCGGCCATTAAATAGCGACGG-3’(序列号7)TL2:5’-CGCTGCGGACATCTACATTTTTG-3’(序列号8)TL3:5’-TCCCGGACATGAAGCCATTTAC-3’(序列号9)P1:5’-NGTCGASWGANAWGAA-3’(序列号10)此外,在P1的序列中,n表示a、g、c或t(存在位置:1及11),s表示g或c(存在位置:7),w表示a或t(存在位置:8及13)。将第1次PCR反应液组成及反应条件分别示于表7及表8。[表7][表8]#1:94℃(30秒)/95℃(30秒)#2:94℃(30秒)/65℃(30秒)/72℃(1分钟),进行5个循环#3:94℃(30秒)/25℃(1分钟)→在3分钟期间到72℃/72℃(3分钟)#4:94℃(15秒)/65℃(30秒)/72℃(1分钟)94℃(15秒)/68℃(30秒)/72℃(1分钟)94℃(15秒)/44℃(30秒)/72℃(1分钟),进行15个循环#5:72℃(3分钟)将第2次PCR反应液的组成及反应条件分别示于表9及表10。[表9]模板(第1次PCR产物50倍稀释)1μl10×PCR缓冲液(TaKaRaBio公司制)2μl2.5mMdNTPs(TaKaRaBio公司制)1.5μl第2个特异性引物(TL2)5pmol任意引物1(P1)100pmolTaKaRaExTaq(TaKaRaBio公司制)0.8单位总容量20μl[表10]#6:94℃(15秒)/64℃(30秒)/72℃(1分钟)94℃(15秒)/64℃(30秒)/72℃(1分钟)94℃(15秒)/44℃(30秒)/72℃(1分钟),进行12个循环#5:72℃(5分钟)将第3次PCR反应液的组成及反应条件分别示于表11及表12。[表11]模板(第2次PCR产物50倍稀释)1μl10×PCR缓冲液(TaKaRaBio公司制)5μl2.5mMdNTPs(TaKaRaBio公司制)0.5μl第3个特异性引物(TL3)10pmol任意引物1(P1)100pmolTaKaRaExTaq(TaKaRaBio公司制)1.5单位总容量50μl[表12]#7:94℃(30秒)/44℃(30秒)/72℃(1分钟),进行20个循环#5:72℃(5分钟)接着,将第2次PCR反应及第3次PCR反应中的反应液用琼脂糖凝胶电泳后,确认有无扩增和反应特异性。另外,用特异性引物TL3、及BigDyeTerminatorCycleSequencingKitVer.3.1(AppliedBiosystems公司制)通过ABIPRISM3100GeneticAnalyzer(AppliedBiosystems公司制)进行第3次PCR反应中扩增产物的碱基序列确定。其结果,选拔后从3个植物体获得3个序列信息(序列号12、14、22)。将得到的序列信息在TheArabidopsisInformationResource(TAIR:http://www.arabidopsis.org/)的BLAST中检索,结果可知在全部3个序列信息中,在T-DNA插入部位附近10kb以内存在拟南芥3号染色体的At3g28910的可读框(ORF)基因。并且,对于筛选得到的、不同的若干植物体株系也进行同样的解析,结果可知,在这些T-DNA插入部位的附近10kb以内存在BAK1基因(At4g33430)及PLA2α基因(At2g06925)。〔9〕结果可知在对高密度栽植有利的AtMYB30转化体中,AtMYB30基因的表达越高,每单位面积的生产性越提高。这表示通过确定AtMYB30的表达量,可筛选对高密度栽植有利的植物体、及每单位面积的生产性提高的植物体。也就是,AtMYB30可用作对于在高密度栽植中适当性、每单位面积的生产性的标志物。另外教导了由使用拟南芥的激活标记株(Activation-tagT-DNAlines)的筛选结果可确认,AtMYB30被活化的植物体对高密度栽植有利,由此、在通过AtMYB30控制的信号传导通路中,能正向调控AtMYB30的功能或表达量的分子BAK1、及AtMYB30下游存在的分子(MYB30相关基因)PLA2α对于高密度栽植而言,显示出与AtMYB30同样的功能。〔实施例2〕为了确认AtMYB30基因的直向同源物的效果,通过NCBI的蛋白质Blast检索,发现许多与AtMYB30的氨基酸序列具有高同源性的序列的转录因子。从这些之中选择来自作为豆科植物重要作物的大豆的GmMYB74基因作为AtMYB30基因的同源转录因子,进行其效果的确认。此外,GmMYB74与AtMYB30的氨基酸序列同源性(sequenceidentity)为53%。AtMYB30基因及GmMYB74基因均是含有MYB结构域(R2R3型)的转录因子。AtMYB30的MYB结构域的氨基酸序列(序列号123)与GmMYB74的MYB结构域的氨基酸序列(序列号124)的同源性(sequenceidentity)为92.3%,两者的同源性极其高。使用GenScript公司的人工基因合成信托服务,人工地合成含有编码GmMYB74的基因(GmMYB74基因;序列号68)全长的序列(序列号119)。如果使用实施例1中使用的pMAT载体,则载体大小变大,从而不适合导入基因序列的解析,因此,本实施例中,在含有来自花椰菜花叶病毒的35S启动子的植物表达用载体pGreenⅡ载体(JohnInnesCenter公司,英国)中,插入将在上述基因合成时添加的NotⅠ位点(起始密码子侧)及HpaⅠ位点(终止密码子侧)平滑末端化而得的片段(序列号120)。pGreenⅡ载体是已知可优选用于油菜属、小麦、大麦等植物的转化的通用载体。使用T4DNA聚合酶(TaKaRaBio)平滑末端化,使用RapidDNADophos&Ligationkit(Roche)进行目标连接反应。在使连接反应后经载体转化的感受态细胞(DH5α,NipponGene)在LB琼脂培养基(含有12.5μg/mL的卡那霉素)中增殖后,用QIAprepSpinMiniprepKit(QIAGEN公司制)由得到的菌体制备质粒DNA,获得含有GmMYB74基因的ORF(序列号68)的植物表达用载体。另外,确认得到的载体中插入基因的序列。将具有GmMYB74基因的植物表达用载体连同作为辅助质粒的pSoup采用与实施例1同样的方法导入到农杆菌(GV3101株)中,将其与实施例1同样地导入到野生型拟南芥生态型Col-0中。重复利用潮霉素的选拔和自体授粉,获得高表达GmMYB74基因的株(#3-2株)的T3种子。另外,确认在该T3种子中GmMYB74基因同源插入。将#3-2株的种子分别以1个体、3个体、8个体、16个体的形式播种在加入了蛭石混合土的38.44cm2的4个盆中,分别在22℃、100μmol/m2/sec、16小时明期/8小时暗期的条件下栽培4周。各盆放入浅箱中管理,每一个浅箱配置25个盆(5行×5列),测量使用群落中央周边的6~9个盆。除转化体植物以外,使用野生型拟南芥(Col-0)作为对照的非重组植物。在栽培4周后,用电子天平称量植物体地上部的鲜重(生物质的量)。图6中以两对数图示出了野生型(Col-0)及导入了GmMYB74基因的转化体植物(#3-2株)的地上部的干燥重量与栽植密度的关系。虚线及实线分别表示野生株(Col-0)与转化体植物(#3-2株)的近似线。如上所述,植物的个体重量伴随着栽植密度的上升而减少。已知栽植密度与植物个体的关系根据被称为-3/2幂法则的法则,已知根据该法则,图的斜率是一定的。然而,与实施例1同样可知在转化体植物(#3-2株)中,近似线的斜率变缓。对于低密度栽植或最适密度栽植下的个体重量,野生型植物大,而高密度栽植条件下的个体重量,转化体植物大。由这些结果,对作为大豆(Glycinemax)中的AtMYB30同源转录因子的编码大豆MYB74的基因与AtMYB30基因同样地使与栽植密度上升相伴的个体重量减少减轻。即可知,AtMYB30的同源转录因子可用于本发明。〔实施例3〕将实施例1中得到的AtMYB30基因插入到植物表达用pGreenII载体中。为了与pGreenII载体连接,用引物SalI-AtMYB30_f及NotI-AtMYB30_r在AtMYB30基因的末端添加SalI位点及NotI位点。引物SalI-AtMYB30_f及NotI-AtMYB30_r的具体序列如下。[化7]SalI-AtMYB30_f:5’-ATTAGTCGACATGGTGAGGCCTCCTTG-3’(序列号121)NotI-AtMYB30_r:5’-TTATGCGGCCGCTCAGAAGAAATTAGTGTT-3’(序列号122)将用上述引物得到的PCR产物及pGreenII用限制酶(SalI、NotI)处理,将这些限制酶消化产物分别用琼脂糖凝胶电泳,用QIAquickGelExtractionKit(QIAGEN公司制)将含有AtMYB30基因的ORF的片段及pGreenII的片段分别自凝胶纯化。混合含有AtMYB30基因的ORF的片段及pGreenII的片段,用RapidDNADophos&Ligationkit(Roche)在16℃进行基于规定容量的连接反应30分钟以上。用连接反应后的载体根据试剂盒附带的方案进行感受态细胞(DH5α,NipponGene)的转化。将涂布了转化反应液的LB琼脂培养基(含有12.5μg/mL卡那霉素)培养一夜,将呈现的集落用LB培养基进行液体培养,利用QIAprepSpinMiniprepKit(QIAGEN公司制)由得到的菌体制备质粒DNA,获得包含AtMYB30基因的ORF的植物表达用载体。并且确认该载体的序列。用得到的植物表达用载体进行野生型稻子(日本晴)愈伤组织的转化。使用含有潮霉素的培养基选拔多个转化体植物,将通过再分化得到的转化体稻子(T0)栽培,获得T1种子。将直径9cm的4个盆分割成4个区域,将5粒或15粒的T1种子播种于各区域,在25℃、200μmol/m2/sec、14小时明期/10小时暗期的条件下栽培2周。使用野生型的稻子(日本晴)作为对照区的非转化体植物。在栽培4周后,用电子天平称量植物体地上部的鲜重(生物质的量)。图7中示出了将野生型稻子及转化体稻子中每盆的生物质收获量(地上部鲜重)与栽植密度的关系比较的结果。对于野生型植物(WT),与5粒播种相比,15粒播种个体平均的鲜重小。即,对于15粒播种的条件,可知引起生长竞争。另一方面,对于使AtMYB30高表达的转化稻子(AtMYB30#1、AtMYB30#2、AtMYB30#4、AtMYB30#12),与5粒播种相比,15粒播种个体平均的鲜重大。即使在野生型植物(WT)发生生长竞争的15粒播种的条件下,使AtMYB30高表达的转化稻子也会增加个体鲜重。这显示在转化稻子中没有引起生长竞争,使AtMYB30高表达的转化稻子与野生型植物相比,能够在密栽植培条件下有利生长。这样,通过在表达AtMYB30同源转录因子的稻子中导入AtMYB30基因可制作出在高密度栽植条件下每单位面积的生物质生产性提高的转化体稻子,在单子叶植物中确认了来自双子叶植物的基因带来的功能,证实了广泛的各种植物可在本发明中利用。产业上的可利用性根据本发明,能够使植物生物质的收获量增加。因此,不仅农林业,还可用于食品产业、能量产业等广泛的产业。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1