基质金属蛋白酶7(MMP‑7)聚集体的单体化方法与流程
本发明涉及使基质金属蛋白酶7(以下也称为“MMP-7”)的聚集体单体化的方法。具体地,本发明涉及MMP-7聚集体的单体化方法,其包括用包含低浓度的单价阳离子化合物的溶液或不包含所述化合物的该溶液处理MMP-7聚集体;MMP-7的制备方法,其包括所述MMP-7聚集体的单体化方法;和在上述溶液中包含MMP-7的(药物)组合物,在所述溶液中还溶解有糖醇或糖。
背景技术:
MMP-7是属于在活性位点具有锌分子的锌金属蛋白酶家族的基质金属蛋白酶(以下也称为“MMP”)之一(参见例如非专利文献1)。MMP作为前体产生,其信号序列在细胞外分泌后被加工,然后加工前序列以产生活性形式。细胞外分泌的MMP控制细胞外基质的代谢。另一方面,据报道MMP-7主要从癌细胞分泌并参与侵袭和转移(参见例如非专利文献2)。与其他MMP相比,MMP-7缺乏在许多其它MMP中共有的铰链区和血红素蛋白样结构域,由最小分子单位组成。MMP-7的底物是构成胶原或细胞外基质(纤连蛋白、玻连蛋白、层粘连蛋白、聚集蛋白聚糖)的组分。
MMP-7被认为参与存在于(脊柱)硬膜外腔中的髓核的自发性缓解,因为MMP-7的底物是作为软骨组织的主要成分的聚集蛋白聚糖,且来自椎间盘移位手术的标本的巨噬细胞表达MMP-7(参见例如非专利文献3)。此后,Haro等人将MMP-7施用于疝狗的椎间盘,并观察到椎间盘内的髓核体积的减少,从而显示MMP-7作为治疗椎间盘移位的药物的可能性(参见例如非专利文献4)。需要开发MMP-7作为药物。然而,MMP-7仅以痕量存在于活体中,因此从活体中分离和纯化MMP-7是极其困难的。此外,当使用来自活体的组分时,考虑到安全性,例如潜在的病毒感染,存在担心。尽管MMP-7可以从癌细胞获得,但是不优选使用癌细胞作为生产来源(参见例如非专利文献5)。
为了解决这些问题,已经尝试通过重组DNA技术获得MMP-7。Barnett等人报道了MMP-7在CHO细胞中表达(参见例如非专利文献6);据报道,通过使用通过将碱性磷酸酶的信号序列的核苷酸序列与基质金属蛋白酶7原(以下也称为“proMMP-7”)的基因序列连接而产生的对于大肠杆菌的密码子使用优化的核酸片段,可溶性proMMP-7在34℃下表达,不溶性proMMP-7在42℃下表达(参见例如专利文献1);和据报道,通过使用通过将修饰的信号肽连接至proMMP-7的基因片段而产生的核酸片段,proMMP-7作为包涵体大量表达(参见例如专利文献2)。
为了将proMMP-7转化为活性MMP-7,据报道在1mM(4-氨基苯基)乙酸汞(APMA)或0.2μM胰蛋白酶的存在下在37℃加热proMMP-7,或在53℃加热含有前MMP的溶液(参见例如非专利文献7)。他们揭示,在低浓度(小于1mg/ml)的活化的MMP-7(也称为基质溶解素(Matrilysin))在-20℃下储存6个月和在室温下储存28天后,在其活性和电泳行为方面没有变化。虽然没有关于变化的确定描述,但是他们似乎暗示从电泳结果没有观察到基质溶解素的分解。除此之外,有关于proMMP-7和MMP-7的纯化的各种报告,例如Kihira和Oneda等人(参见例如专利文献1、非专利文献8),因此在实验水平上已经建立了一定程度的MMP-7的纯化方法。通常,在实验水平上纯化MMP-7的方法被放大用于大规模生产。然而,还没有建立大量制备MMP-7的方法。几乎没有关于在大量制备MMP-7中的问题及其解决方案的报道。
对于包含MMP-7的组合物,报道了包含三(羟甲基)氨基甲烷盐酸盐(Tris盐酸盐)、氯化钙和氯化钠的组合物(参见例如专利文献3至5,非专利文献7、9)。已知在溶液组合物的状态下,金属蛋白酶如MMP-7在氯化钙和氯化钠共存下稳定(参见例如专利文献6)。特别是,考虑到安全性,药物通常需要具有大约体液的渗透压。氯化钠通常用作液体组合物的渗透压调节剂。作为实际情况,在这些文献中公开的大多数组合物包含单价阳离子化合物,例如氯化钠,其浓度与体液的浓度等渗或大于体液的浓度。此外,这些文献中公开的组合物不包含糖醇或糖。
专利文献
专利文献1:日本专利2938352
专利文献2:WO 2010/047347A1
专利文献3:JP 2000-344672
专利文献4:JP 2000-226329
专利文献5:JP 2002-173424
专利文献6:JP 2005-6509
非专利文献
非专利文献1: Soler等, Biochem Biophys Res Commun, 1994, vol.201, p.917-923
非专利文献2: Ii等, Exp Biol Med (Maywood), 2006, vol.231, p.20-27
非专利文献3: Haro等, J Spinal Disord, 1999, vol.13, p.245-249
非专利文献4: Haro等, J Orthop Res, 2005, vol.23, p.412-419
非专利文献5: Miyazaki等, Cancer Research, 1990, vol.50, p.7758-7764
非专利文献6: Barnett等, Protein Exp Purif, 1994, vol.5, p.27-36
非专利文献7: Crabbe等, Biochemistry, 1992, vol.31, p.8500-8507
非专利文献8: Oneda等, J Biochem, 1999, vol.126, p.905-911
非专利文献9: Browner等, Biochemistry, 1995, vol.34, p.6602-6610。
技术实现要素:
(发明要解决的技术问题)
在开发包含MMP-7的药物的过程中,本发明人已发现,在单价阳离子化合物例如氯化钠为150mM或更高(其与体液等渗)的情况下,如在常规药物产品、特别是如上所述的金属蛋白酶的液体组合物的情况下,MMP-7形成聚集体,并且MMP-7被吸附至在通常用于制备蛋白质或其制剂的装置中的凝胶,或通常用于储存制剂的容器,例如小瓶。因此,问题在于提供一种MMP-7聚集体的单体化方法,其中在制备MMP-7时抑制MMP-7至制备装置的吸附;一种MMP-7的制备方法,其包括所述MMP-7聚集体的单体化方法;和包含MMP-7的(药物)组合物,其中MMP-7的聚集体形成和吸附被抑制。
(解决问题的手段)
本发明人为了解决上述问题进行了认真的研究,结果发现了以下(1)至(4)以完成本发明。
(1)通过用包含低浓度的单价阳离子氯化物(氯化钠和氯化钾)的溶液例如Tris缓冲液(pH 6至8)处理,使MMP-7聚集体解离以形成单体。此外,当用不包含单价阳离子氯化物的该溶液处理MMP-7聚集体时,它们同样形成单体。
(2)通过将用上述处理MMP-7聚集体的单体化方法(以下也简称为“单体化方法”)引入到MMP-7的制备过程中,可以提高生产MMP-7的效率。特别地,通过在将proMMP-7通过自活化转化为MMP-7后立即将单体化方法引入用超滤膜处理的过程中,可以获得更显著的效果。
(3)MMP-7单体维持高酶活性。
(4)通过向如上所述的Tris缓冲液中添加糖或糖醇,如甘露糖醇和蔗糖,不仅抑制MMP-7聚集体的形成,而且抑制MMP-7至凝胶和小瓶壁的吸附。即,通过制备包含当制成水溶液时浓度为约150mM (其与体液等渗)或更低的单价阳离子氯化物和糖醇或糖的组合物,所得溶液变成药物制剂,其中MMP-7聚集体的形成和MMP-7的吸附被抑制。
因此,本发明包括MMP-7聚集体的单体化方法(单体化方法);MMP-7的制备方法,其包括所述单体化方法;和通过使用上述缓冲液制备的包含MMP-7的(药物)组合物,并涉及以下内容:
[1] 基质金属蛋白酶7 (MMP-7)聚集体的单体化方法,所述方法包括用包含130 mM或更低的单价阳离子化合物的溶液或不包含单价阳离子化合物的溶液处理MMP-7聚集体。
[2] 根据[1]的单体化方法,其中用包含130 mM或更低的单价阳离子化合物的溶液处理MMP-7聚集体。
[3] 根据[1]的单体化方法,其中用不包含单价阳离子化合物的溶液处理MMP-7聚集体。
[4] 根据[1]或[2]的单体化方法,其中单价阳离子化合物是100 mM或更低。
[5] 根据[1]、[2]或[4]的单体化方法,其中单价阳离子化合物是80 mM或更低。
[6] 根据[1]、[2]、[4]或[5]的单体化方法,其中单价阳离子化合物是40 mM或更低。
[7] 根据[1]、[2]、[4]、[5]或[6]的单体化方法,其中单价阳离子化合物选自氯化钠、氯化钾、硫酸钠、硫酸钾、碳酸钠、碳酸钾、磷酸钠和磷酸钾。
[8] 根据[1]、[2]、[4]、[5]或[6]的单体化方法,其中单价阳离子化合物来自单价阳离子氯化物。
[9] 根据[8]的单体化方法,其中单价阳离子化合物选自氯化钠和氯化钾。
[10] 根据[1]-[9]中任一项的单体化方法,其中所述溶液还包含氯化钙。
[11] 根据[10]的单体化方法,其中氯化钙是30 mM或更低。
[12] 根据[1]-[11]中任一项的单体化方法,其中所述溶液是缓冲溶液。
[13] 根据[12]的单体化方法,其中缓冲溶液是5-25 mM Tris缓冲液。
[14] 根据[1]-[13]中任一项的单体化方法,其中MMP-7是20 mg/ml或更低。
[15] 根据[13]或[14]的单体化方法,其中所述溶液是包含30-40 mM氯化钠和5-30 mM氯化钙的5-25 mM Tris缓冲液(pH 6-8)。
[16] 根据[1]-[15]中任一项的单体化方法,其中所述溶液还包含糖醇和/或糖。
[17] 根据[16]的单体化方法,其中糖醇和/或糖选自蔗糖、乳糖、麦芽糖、木糖、海藻糖、甘露糖醇、山梨糖醇、木糖醇、麦芽糖醇、拉克替醇和寡糖醇。
[18] 根据[16]或[17]的单体化方法,其中糖醇和/或糖是2%或更高。
[19] 根据[18]的单体化方法,其中糖醇和/或糖是2-7%。
[20] 根据[17]-[19]中任一项的单体化方法,其中糖醇和/或糖是甘露糖醇或蔗糖。
[21] 根据[20]的单体化方法,其中甘露糖醇是2-5%和蔗糖是2-7%。
[22] MMP-7的制备方法,其包括由如[1]-[21]中任一项所示的单体化方法组成的步骤。
[23] 根据[22]的制备方法,其中所述步骤在使用包含130 mM或更高的单价阳离子化合物的溶液处理的步骤后进行。
[24] 根据[22]或[23]的制备方法,其中所述方法包括以下步骤(1)-(5):
(1) 破裂产生proMMP-7包涵体的细胞的步骤;
(2) 溶解/重折叠处理proMMP-7包涵体的步骤;
(3) 纯化proMMP-7的步骤;
(4) proMMP-7自活化为MMP-7的步骤;和
(5) 由[1]-[21]中任一项所示的单体化方法组成的步骤。
[25] 根据[24]的制备方法,其中步骤(5)是使用超滤膜浓缩的步骤。
[26] 包含基质金属蛋白酶7 (MMP-7)的(药物)组合物,其在包含130 mM或更低的单价阳离子化合物的溶液中或在不包含单价阳离子化合物的溶液中包含MMP-7作为活性成分。
[27] 根据[26]的包含MMP-7的(药物)组合物,其中所述组合物在包含130 mM或更低的单价阳离子化合物的溶液中包含MMP-7作为活性成分。
[28] 根据[26]的包含MMP-7的(药物)组合物,其中所述组合物在不包含单价阳离子化合物的溶液中包含MMP-7作为活性成分。
[29] 根据[26]或[27]的包含MMP-7的(药物)组合物,其中所述单价阳离子化合物选自氯化钠、氯化钾、硫酸钠、硫酸钾、碳酸钠、碳酸钾、磷酸钠和磷酸钾。
[30] 根据[26]或[27]的包含MMP-7的(药物)组合物,其中所述单价阳离子化合物来自单价阳离子氯化物。
[31] 根据[30]的包含MMP-7的(药物)组合物,其中所述单价阳离子化合物选自氯化钠和氯化钾。
[32] 根据[26]-[31]中任一项的包含MMP-7的(药物)组合物,其中所述组合物还包含氯化钙。
[33] 根据[32]的包含MMP-7的(药物)组合物,其中所述氯化钙是30 mM或更低。
[34] 根据[26]-[33]中任一项的包含MMP-7的(药物)组合物,其中所述溶液是缓冲溶液。
[35] 根据[34]的包含MMP-7的(药物)组合物,其中所述缓冲溶液是5-25 mM Tris缓冲液。
[36] 根据[26]-[35]中任一项的包含MMP-7的(药物)组合物,其中MMP-7是20 mg/ml或更低。
[37] 根据[36]的包含MMP-7的(药物)组合物,其中MMP-7是1 μg/ml-1 mg/ml。
[38] 根据[35]、[36]或[37]的包含MMP-7的(药物)组合物,其中所述溶液是包含30-40 mM氯化钠和5-30 mM氯化钙的5-25 mM Tris缓冲液(pH 6-8)。
[39] 根据[26]-[38]中任一项的包含MMP-7的(药物)组合物,其中所述溶液还包含糖醇和/或糖。
[40] 根据[39]的包含MMP-7的(药物)组合物,其中糖醇和/或糖选自蔗糖、乳糖、麦芽糖、木糖、海藻糖、甘露糖醇、山梨糖醇、木糖醇、麦芽糖醇、拉克替醇和寡糖醇。
[41] 根据[39]或[40]的包含MMP-7的(药物)组合物,其中糖醇和/或糖是2%或更高。
[42] 根据[41]的包含MMP-7的(药物)组合物,其中糖醇和/或糖是2-7%。
[43] 根据[40]-[42]中任一项的包含MMP-7的(药物)组合物,其中糖醇和/或糖是甘露糖醇或蔗糖。
[44] 根据[43]的包含MMP-7的(药物)组合物,其中甘露糖醇是2-5%和蔗糖是2-7%。
[45] 包含MMP-7的固体(药物)组合物,其中所述组合物可在溶剂中溶解,和所述组合物在溶解时是[26]-[44]中任一项所示的组合物。
[46] 治疗椎间盘移位的药剂,其包含[26]-[45]中任一项所示的包含MMP-7的(药物)组合物。
发明效果
根据本发明,提供了容易地MMP-7聚集体的单体化方法。因此,通过将该方法结合到MMP-7的制备过程中,可以提高MMP-7的生产率和回收效率。
此外,通过该方法单体化的MMP-7与MMP-7聚集体相比具有更高的酶特异性活性,因此可以是用于提供高质量的MMP-7制剂的合适材料。
此外,作为本发明的一个实施方案,通过将MMP-7储存在包含低浓度的氯化钠和糖醇或糖的缓冲液中,MMP-7不仅保持其单体形式,而且保持高的酶活性,并且也可抑制MMP-7至储存容器的吸附。因此,在本发明的单体化方法中使用的缓冲剂可用作MMP-7制剂的保存溶液。本发明的MMP-7组合物,其含有制备成水溶液时低浓度的氯化钠和糖醇或糖,可用作医药用液体组合物和制备其的组合物,其中MMP-7聚集体的形成被抑制,并且MMP-7至容器的吸附被抑制。
附图说明
图1显示基于通过动态光散射测量的MMP-7的分子量的分析,氯化钠(NaCl)和氯化钾(KCl)对MMP-7聚集体形成的抑制作用。
图2显示基于通过动态光散射测量的MMP-7的分子量的分析,氯化钙(CaCl2)对抑制MMP-7聚集体形成的影响。
图3显示基于通过尺寸排阻色谱法测量的MMP-7的分子量的分析,MMP-7的浓度对MMP-7聚集体形成的影响。
图4显示当用含有150mM NaCl或40mM NaCl的Tris缓冲液稀释0.1mg/ml、2mg/ml或20mg/ml的MMP-7时,氯化钠(NaCl)对MMP-7的酶活性的影响。
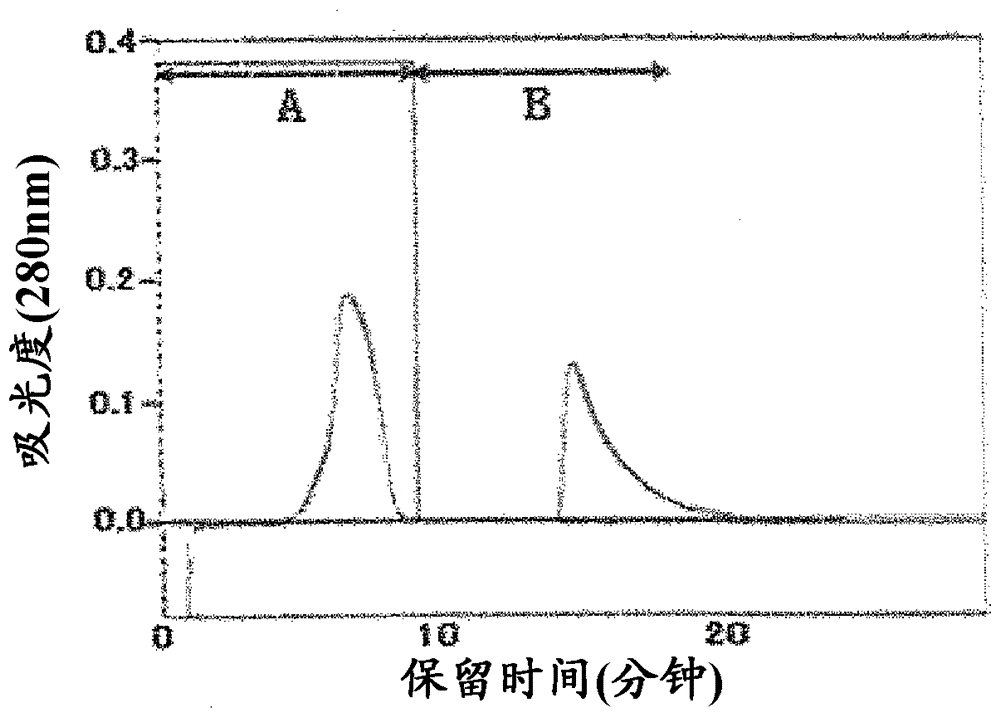
图5显示了甘露糖醇对MMP-7吸附到凝胶的抑制效果。A:5mM Tris缓冲液(pH7)/10mM CaCl2 / 40mM NaCl; B:5mM Tris缓冲液(pH7)/ 10mM CaCl2 / 40mM NaCl / 3.5%甘露糖醇。
图6显示甘露糖醇和蔗糖对MMP-7吸附到小瓶壁的抑制作用。
图7显示在各浓度下甘露糖醇和蔗糖对MMP-7吸附到小瓶壁的抑制效果。
图8显示了各浓度的甘露糖醇和蔗糖对MMP-7的酶活性的影响。
图9显示了甘露糖醇对抑制MMP-7聚集体形成的作用。
具体实施方式
本发明提供了MMP-7聚集体的单体化方法;包括所述单体化方法的MMP-7的制备方法;和包含MMP-7的(药物)组合物。本发明的特征在于,用含有低浓度的单价阳离子化合物并进一步包含糖醇或糖的溶液(以下也称为“单体化溶液”)处理MMP-7聚集体,MMP-7储存在所述溶液中,并且当制成水溶液时,MMP-7组合物包含低浓度的单价阳离子化合物和糖醇或糖。
通过动态光散射、尺寸排阻色谱、超离心等测量MMP-7的分子量,并将测量的重量与根据氨基酸序列计算的单体MMP-7的分子量(约19kDa)相比较来进行MMP-7聚集体的检测。对于本发明,在样品中MMP-7的分子量介于19kDa至38kDa的范围内的情况下确定MMP-7是单体的,而在其为38kDa或更高的情况下MMP-7被确定为形成聚集体。上述确定标准通过考虑通过动态光散射的测量的真实性来进行,使得当分子量大于二聚体的分子量时,MMP-7明显形成聚集体,而当其小于二聚体的分子量时,MMP-7是单体的。
MMP-7的单体化通过用单体化溶液处理MMP-7聚集体来进行。如本文所用,“用单体化溶液处理MMP-7聚集体”是指MMP-7聚集体暴露于单体化溶液中,并且包括溶解在所述溶液中,并且包括当MMP-7聚集体溶解在含有130mM或更高的高浓度的单价阳离子化合物的溶液中时,使用单体化溶液,用超滤膜或透析膜进行缓冲液的交换。对于用于保持单体化溶液的pH稳定的缓冲液,可以使用Tris缓冲液、磷酸盐缓冲液、甘氨酸缓冲液和碳酸缓冲液,其中可以根据单体化处理时的pH选择合适的缓冲液。缓冲液的浓度可以为5-25mM,优选为5-20mM。pH可以在5至9,优选6至8的范围内。更优选地,选择对金属蛋白酶的稳定性的改善发挥作用的Tris缓冲液,其中Tris缓冲液具有5-10mM的浓度和6-8的pH (参见JP 2011-521906)。
本文所用的“单价阳离子化合物”是指由单价阳离子和对应的阴离子组成的化合物,包括氯化钠、氯化钾、硫酸钠、硫酸钾、碳酸钠、碳酸钾、磷酸钠、磷酸钾等。此外,本文所用的“单价阳离子氯化物”是指由单价阳离子和氯离子组成的化合物。对于本文使用的单价阳离子化合物,可以使用任何单价阳离子化合物,但优选使用单价阳离子氯化物。具体地,使用氯化钠和氯化钾,优选氯化钠。
为了将MMP-7聚集体解离成单体MMP-7,使用低浓度的单价阳离子化合物。解离为单体的MMP-7作为单体保持在包含低浓度的单价阳离子化合物的单体化溶液中。通过使用不包含单价阳离子化合物的单体化溶液或水,可以获得相同的效果。因此,本发明包括使用单体化溶液的MMP-7聚集体的单体化方法,所述溶液包括根据本发明的不包含单价阳离子化合物的液体,例如水。在下文中,包含低浓度的单价阳离子化合物的溶液和不包含单价阳离子化合物的溶液也简单地统称为“单体化溶液”。
通过在单体化溶液中添加多价阳离子化合物,可以扩大处理的单价阳离子化合物的浓度范围。多价阳离子化合物优选为二价阳离子化合物,更优选为二价钙离子化合物,最优选为氯化钙。类似于单价阳离子化合物,“多价阳离子化合物”是指由多价阳离子和对应的阴离子组成的化合物。
具体地,在使用水作为单体化溶液的情况下,使用40mM或更低的单价阳离子化合物,并且通过向单体化溶液中加入氯化钙,用包含多于40mM的单价阳离子化合物的单体化溶液处理变得可能。更具体地,可使用当包含5mM至10mM氯化钙时包含80mM或更低的单价阳离子化合物的单体化溶液,当包含10mM至30mM氯化钙时包含100mM或更低的单价阳离子化合物的溶液,和当包含30mM氯化钙时包含130mM或更低的单价阳离子化合物的溶液。该结果表明,通过添加氯化钙,MMP-7聚集体解离成单体的作用和对MMP-7聚集体形成的抑制作用得到增强。此外,从实施例2(图2)的结果可以看出,该效果与氯化钙的浓度成比例。也就是说,通过使用较高浓度的氯化钙,可以预期更高的MMP-7单体化和MMP-7单体维持的效果。根据上述,在水溶液的情况下,单价阳离子化合物的浓度为130mM或更低,优选为100mM或更低,更优选为80mM或更低,最优选为40mM或更低。尽管单体化溶液可以不包含单价阳离子化合物,但是考虑到药物组合物的品质,包含单价阳离子化合物的溶液是优选的。
根据本发明,可以优选使用由包含30至40mM氯化钠和5至30mM氯化钙的5至25mM Tris缓冲液(pH 6至8)组成的单体化溶液或不含氯化钠的该单体化溶液。
本发明的MMP-7聚集体的单体化方法可以引入MMP-7的制备过程中,以有效地产生高质量的MMP-7单体。通过重组DNA技术产生MMP-7的一般方法通过以下步骤进行:细胞的培养,包涵体的释放,包涵体的溶解和重折叠,proMMP-7的纯化,proMMP-7通过自活化转化成MMP-7,MMP-7的纯化和浓缩。
更具体地,本发明的MMP-7聚集体的单体化方法用于如下所述的MMP-7的制备过程。首先,制备产生proMMP-7的大肠杆菌。通常,可以通过常规方法将插入表达载体中的proMMP-7基因导入大肠杆菌中来制备。然而,因为proMMP-7对大肠杆菌具有强烈的毒性,所以生产力可能显著降低。为了解决这个问题,设计了在proMMP-7的N末端添加信号肽。然而,在proMMP-7的情况下,观察到下述现象:proMMP-7的表达水平不会因为单纯地添加信号肽而增加,并且所表达的proMMP-7的一部分被分解。这种现象可能阻碍建立有效生产MMP-7的方法。因此,作为制备MMP-7的起始材料,优选使用产生proMMP-7的大肠杆菌,其具有增加的proMMP-7表达水平和增加的对蛋白酶分解proMMP-7的抑制。这样的产生proMMP-7的大肠杆菌可以通过WO2010/047347(更具体地,参见其中的制备)中描述的方法制备。
将如此获得的产生proMMP-7的大肠杆菌在通过重复克隆纯化后保存为工作细胞库,并用作用于制备MMP-7制剂的大规模培养的种菌。工作细胞库可以在通常用于保存重组大肠杆菌的条件下,例如,在含有7-10%二甲基亚砜或10-50%甘油的溶液中在-80℃至-20℃的冰箱中或在液氮中保存,或在安瓿中冻干以在2-10℃冰箱中保存。
以生产规模培养生产proMMP-7的大肠杆菌以两个阶段进行,即小规模预培养和大规模的主培养。对于预培养,通常用于重组大肠杆菌、任选补充有抗生素(例如用于保留质粒的氨苄青霉素)的LB培养基可用于繁殖产生proMMP-7的大肠杆菌。然而,对于主培养,优选使用尽可能多地除去引起副作用的物质的培养基。这种培养基包括例如含有各种痕量金属如镁、钙、铜和钠的葡萄糖培养基,LB培养基,M9培养基等。培养条件可以是适于大肠杆菌繁殖的条件,例如pH (pH6至8)、温度(30至45℃)、时间(4至16小时)的培养条件。这些培养条件可以根据培养规模和诱导表达的处理进行适当调整。表达诱导剂用于proMMP-7的有效表达,并且包括异丙基-β-硫代吡喃半乳糖苷(IPTG)、乳糖等。
为了在主培养后从大量培养并繁殖的生产proMMP-7的大肠杆菌中回收MMP-7,进行下述步骤。首先,培养产生proMMP-7的大肠杆菌,并通过合适的措施破坏繁殖的细胞,以从细胞中释放由proMMP-7组成的包涵体。对于细胞的破裂,可以使用化学物质(例如EDTA作为螯合剂)、表面活性剂(例如Triton X100)和酶(例如溶菌酶)裂解或用弗氏压碎器(French press)进行物理处理,超声处理等。通过组合这些程序中的几个,可以更有效地破坏细胞。破碎包含包涵体的细胞后获得的溶液用超滤膜或离心机分级,以重复浓缩和洗涤以除去大部分细胞组分。对于洗涤,可以使用通常使用的缓冲液,例如Tris缓冲液、磷酸盐缓冲液、甘氨酸缓冲液、碳酸缓冲液。对于超滤膜的孔径和离心机的条件,有许多报道可以参考。在大量处理的情况下,优选通过用超滤膜分级来回收包涵体。
回收的包涵体暂时溶解在含有还原剂和变性剂的溶液中。对于这样的还原剂,可以使用半胱氨酸、谷胱甘肽、二硫苏糖醇、2-巯基乙醇等。这些中的几种可以组合使用。还原剂的浓度可以取决于要溶解的包涵体的量,并且可以在10至200mM的范围内。对于变性剂,可以使用尿素、盐酸胍等。尿素和盐酸胍可以分别以4至8M和2至6M的浓度使用。对于缓冲液,可以使用用于回收包涵体的缓冲液,例如磷酸盐缓冲液和Tris缓冲液(pH 7.0至9)。溶解时的温度只要为40℃或更低即可,没有特别限制。溶解时间可以根据包涵体的溶解条件来设定。通常,将溶液搅拌30分钟至1小时。
接下来,通过向包涵体溶液中加入含有表面活性剂和金属离子的重折叠缓冲液,进行proMMP-7的重折叠,即构建正常的空间结构。使用Brij 35作为表面活性剂,浓度分别为0.5至2%和0.05mM至0.2mM的乙酸锌或氯化钴作为金属离子。用于重折叠的缓冲液的种类和浓度可以与溶解包涵体时使用的缓冲液的种类和浓度相同。通过使溶液静置一天或更长时间进行重折叠处理。
为了从重折叠溶液中纯化proMMP-7,通常用于蛋白质化学的纯化程序,例如离心、盐析、超滤、等电沉淀、电泳、离子交换色谱、凝胶过滤色谱、亲和色谱、疏水色谱、羟基磷灰石色谱等等可以组合使用。本发明中的proMMP-7可以通过由离子交换色谱、疏水色谱和超滤膜处理组成的步骤进行纯化。两种色谱可以以常规方式进行。获得的蛋白质和多肽的量可以使用用于测量蛋白质的试剂例如BCA蛋白质测定试剂盒(Pierce Biotechnology,Inc)和蛋白质测定试剂盒(BIO-RAD,Inc)来测量。
接着,进行proMMP-7向MMP-7的转化。转化方法包括在1mM (4-氨基苯基)乙酸汞(APMA)或0.2μM胰蛋白酶的存在下在37℃下加热含有proMMP-7的溶液,或在53℃下加热含proMMP-7的溶液(Crabbe等,Biochemistry,1992,vol.31, 8500-8507),可以使用这些方法中的任何一种。此时,可以任选地添加30至200mM氯化钠(Crabbe等,Biochemistry,1992,vol.31, 8500-8507,WO 2010/047347 A1)。加热时间为1至5小时,根据试剂和proMMP-7的处理浓度和处理量适当调整。对于胰蛋白酶,可以使用用N-甲苯磺酰基-L-苯丙氨酸氯甲基酮(TPCK)处理的胰蛋白酶。
为了测量MMP-7的酶活性,可以用荧光测量装置测量MMP-7对荧光底物(Dnp-Pro-Leu-Gly-Leu-Trp-Ala-D-Arg-NH2; SEQ ID NO:7)的切割(Crabbe等,Biochemistry,1992,第31卷,8500-8507)。实际上,基于上述原理的用于测量MMP-7活性的试剂盒(ANASPEC)是可商购的。因此,可以使用该试剂盒根据其附带的方案测量活性。对于从proMMP-7转化的MMP-7的分离和纯化,可以使用如上所述的蛋白质纯化程序。
转化的MMP-7在含有高浓度盐的溶液中形成聚集体。这在溶液中MMP-7的浓度为1mg / ml或更高的情况下更可能发生。MMP-7聚集体的存在导致当生产MMP-7并且将MMP-7制成MMP-7制剂时的生产率和质量降低。如上所述,在氯化钙存在下,在含有130mM或更低的单价阳离子化合物的单体化溶液中,MMP-7聚集体被单体化,并且MMP-7单体被保持。然而,在含有浓度大于130mM的单价阳离子化合物的溶液中,提示形成MMP-7聚集体的可能性高。因此,在用130mM或更高的单价阳离子化合物处理后,引入本发明的单体化方法。更具体地,在proMMP-7通过自活化转化成MMP-7后立即引入。
通过本发明的单体化方法的处理优选对20mg/ml或更低的MMP-7进行。然而,当处理20mg/ml或更高的MMP-7时,如上所述,通过调节氯化钙的浓度,可以预期对MMP-7聚集体形成的相同抑制效果。
在根据需要通过超滤膜纯化和浓缩MMP-7的步骤之后,使用含有由此制备的MMP-7单体的溶液作为用于制备MMP-7制剂的起始材料。在这些步骤中,也可以使用本发明的单体化溶液。一旦MMP-7单体化,就保持MMP-7单体,只要它们存在于单体化溶液中,并且长时间没有观察到酶活性的降低。因此,本发明的单体化溶液可用于在制备MMP-7制剂之前保存MMP-7,以及用于制备包含MMP-7作为活性成分的(药物)组合物,从而允许维持高质量的MMP-7。
在包括本发明的所述单体化方法的MMP-7聚集体的单体化方法和MMP-7的制备方法中,糖醇和糖对于MMP-7至在制备MMP-7中广泛使用的凝胶的吸附发挥抑制作用,和对于MMP-7至用于制备MMP-7制剂的小瓶壁的吸附发挥抑制作用。这种糖醇和糖包括蔗糖、乳糖、麦芽糖、木糖、海藻糖、甘露糖醇、山梨糖醇、木糖醇、麦芽糖醇、拉克替醇、寡糖醇等,优选甘露糖醇和蔗糖,最优选甘露糖醇。
在将低浓度(例如1μg/ml至1mg/ml)的MMP-7制备成MMP-7制剂的情况下,设想由于其吸附到小瓶壁上造成的MMP-7的损失,因此特别有效的是单体化溶液含有如上所述的糖醇和糖。在MMP-7的情况下,糖醇或糖以2%或更高加入,此时发挥对吸附至小瓶壁的抑制作用,或者以2-7%加入,此时可以调节体内的渗透压。根据本发明,使用含有2至5%甘露糖醇或2至7%蔗糖的单体化溶液,此时可维持MMP-7的活性。更优选地,使用单体化溶液,其由5至25mM含有2至5%甘露糖醇、30至40mM氯化钠和5至30mM氯化钙的Tris缓冲液(pH 6至8)组成。
溶解在所述单体化溶液中的MMP-7可以直接用作本发明的包含MMP-7的(药物)组合物。考虑到抑制MMP-7聚集体形成、维持MMP-7的活性、抑制MMP-7至容器的吸附以及确保作为水性药物组合物的品质,包含MMP-7的(药物)组合物优选包含2%或更高的糖醇和/或糖和30至40mM的单价阳离子化合物(氯化钠或氯化钙)。更具体地,在MMP-7的浓度为20mg/ml或更低的情况下,本发明的包含MMP-7的(药物)组合物优选包含2至5%的甘露糖醇或2至7%的蔗糖、30至40 mM氯化钠和5至30mM氯化钙。本发明的包含MMP-7的(药物)组合物可以以液体、冻干或冷冻形式储存。在这样做时,为了保持作为药物的安全性和等渗性,向包含MMP-7的(药物)组合物中进一步加入允许给予人和其它动物的化合物,例如稳定剂、等渗剂和防腐剂。本发明的包含MMP-7的(药物)组合物可以包括可以溶解在溶剂中的固体组合物,并且该组合物在溶解时是如上所述的本发明的包含MMP-7的液体(药物)组合物。通过冻干从本发明的包含MMP-7的液体(药物)组合物中除去溶剂,获得固体组合物。溶剂是在Dictionary of Pharmaceutical Excipients中定义为溶剂的溶剂,包括水、乙醇等。
由此获得的本发明的包含MMP-7的(药物)组合物具有MMP-7的特异性酶活性,并抑制MMP-7聚集体形成和抑制吸附,并且可以用作治疗或诊断椎间盘移位的药物。
通过以下实施例进一步更详细地解释本发明,但不应解释为限于此。
制备实施例
(1)构建具有APSP的proMMP-7表达载体(pETMMP7)
使用引物P1 (SEQ ID NO:1)和P2 (SEQ ID NO:2),通过PCR扩增肾cDNA文库(HumanMTC Panel I,目录号:K1420-1BD)中的proMMP-7基因。将扩增的DNA插入克隆载体(pCRII-TOPO,Invitrogen)中,并测定所获得的DNA的核苷酸序列。用DNA测序仪进行核苷酸序列的测定。进行所确定的核苷酸序列和登记在数据库(登录号:NM002423)中的proMMP-7的核苷酸序列之间的同源性搜索,得到插入了proMMP-7基因的质粒(pCRproMMP-7)。
接下来,使用pCRproMMP-7作为模板和由限制酶NdeI识别序列、编码PhoA碱性磷酸酶信号肽(APSP)序列的核苷酸序列和proMMP-7的N末端序列组成的引物P3 (SEQ ID NO:3)和由限制酶BamHI识别序列和proMMP-7的C末端序列组成的引物P4 (SEQ ID NO:4),进行PCR。将以与上述相同方式扩增的DNA插入克隆载体中,并测定所获得的DNA的核苷酸序列。确认核苷酸序列没有变化后,用限制酶NdeI和BamHI切割获得的质粒,将获得的片段插入预先用相同的限制酶切割的表达载体pET22b (Merck,产品号: 69744-3),得到插入了proMMP-7基因的质粒(pETMMP7)。
(2)具有修饰的APSP的表达载体pETMMP7 (L13P-A21E)的构建和表达
使用GeneTailor定点诱变系统(Invitrogen),根据所附的方案将突变引入在上述(1)中获得的pETMMP7中的APSP序列(Met-Lys-Gln-Ser-Thr-Ile-Ala-Leu-Ala-Leu-Leu-Pro-Leu-Leu-Phe-Thr-Pro-Val-Thr-Lys-Ala; SEQ ID NO:8)的信号肽酶识别序列[APSP的氨基酸序列的13位的亮氨酸(Leu)被脯氨酸(Pro)置换,21位的丙氨酸(Ala)被谷氨酸(Glu)置换]。对于APSP的修饰,使用作为5'引物的M2 (SEQ ID NO:5)和作为3'引物的P6 (SEQ ID NO:6)的序列。用获得的具有修饰的APSP的pETMMP7 (L13P-A21E)转化大肠杆菌,得到表达proMMP-7的重组大肠杆菌(MMP7L13P-A21E)。
用Overnight Express Autoinduction System 1(Merck;产品号71300-3),根据所附方案进行表达诱导。简言之,将每个菌落悬浮在125mL锥形瓶的含有50μg/mL氨苄青霉素(Wako Pure Chemical Industries,Ltd)的50mL LB培养基中,加入Kit试剂,将烧瓶在37℃下孵育16小时。测量细胞悬浮液的OD 600nm,通过离心收集对应于OD 600nm = 20、1mL的细胞的沉淀物。用200μL BugBuster破碎沉淀物并离心得到沉淀物。使用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)的样品缓冲液溶解沉淀物,进行15%丙烯酰胺凝胶SDS-PAGE,并进行CBB染色。结果,证实了proMMP-7的表达水平增加和对分解的抑制作用增强。
在该制备实施例中,使用具有以下序列的引物。
P1: ccataggtcc aagaacaatt gtctctg (SEQ ID NO: 1)
P2: caatccaatg aatgaatgaa tggatg (SEQ ID NO: 2)
P3: catatgaaac aaagcactat tgcactggca ctcttaccgt tactgtttac ccctgtgacc aaggccctgc cgctgcctca g (SEQ ID NO: 3)
P4: ggatccctat ttctttcttg aattac (SEQ ID NO: 4)
M2: ctgtttaccc ctgtgaccaa ggaactgccg ctgcc (SEQ ID NO: 5)
P6: cttggtcaca ggggtaaaca gtggcggtaa gag (SEQ ID NO: 6)。
实施例1
单价阳离子氯化物对MMP-7聚集体形成的抑制作用
(1) MMP-7的制备
将通过制备实施例中所述的方法获得的表达proMMP-7的大肠杆菌(MMP7L13P-A21E)作为种菌在葡萄糖培养基中培养并繁殖,并用异丙基-β-硫代吡喃半乳糖苷(IPTG)进行proMMP-7表达的诱导。从培养溶液中回收细胞并用弗氏压碎器破碎。将破碎细胞后获得的溶液离心,并在沉淀中回收包涵体。接下来,将包涵体溶解在含有0.1M Tris-HCl (pH7.5)和0.1M二硫苏糖醇的6M盐酸胍中,并用含有0.1mM乙酸锌、10mM氯化钙、0.2M氯化钠和1.0% Brij 35的50mM HEPES缓冲液(pH7.5)重折叠。然后,用常规方法通过离子交换色谱和疏水色谱纯化proMMP-7。将获得的proMMP-7在47℃至48℃加热以进行自活化,得到MMP-7。使用含有40mM NaCl、10mM CaCl2和3.5%甘露糖醇的5mM Tris缓冲液(pH 7),对所获得的MMP-7进行重复的用超滤膜稀释和浓缩,并储存在-80℃。
(2) MMP-7聚集体的测定
将上述(1)中得到的含有高浓度MMP-7的溶液用溶解有氯化钠(NaCl)或氯化钾(KCl)的含有5mM氯化钙(CaCl2)的水溶液稀释,以制备样品1和样品2。
样品1:1mg/ml MMP-7/5mM CaCl2/各浓度的NaCl (10至160mM)
样品2:1mg/ml MMP-7/5mM CaCl2/各浓度的KCl (10至160mM)
使用各100μl的上述样品,通过动态光散射(装置: Wyatt Technology DynaPro (Protein Solutions) Titan,皿:Wyatt Technology 12uL皿 8.5mm中心高度,温度: 20℃)研究氯化钠和氯化钾对MMP-7聚集体形成的影响。测量和分析各样品中MMP-7的分子量。基于MMP-7单体的分子量(约19kDa),分子量为38kDa或更小的MMP-7被确定为单体。结果,10mM至80mM NaCl溶液中的MMP-7的分子量为20至29 kDa,显示MMP-7作为单体存在。同样,当使用氯化钾时,获得了MMP-7作为单体存在于10mM至80mM KCl溶液中的结果(图1)。图中的虚线显示38kDa的分子量。
实施例2
氯化钙对抑制MMP-7聚集体形成的作用
将实施例1-(1)中得到的MMP-7溶液用溶解有氯化钙和氯化钠的水溶液稀释,制备样品3。
样品3:1mg/ml MMP-7/各浓度的CaCl2 (0至30mM)/各浓度的NaCl (0至160mM)
如实施例1-(2)中所述,研究了各浓度的氯化钙的存在对抑制MMP-7聚集体形成的影响。
结果显示,在0mM CaCl2情况下用40mM或更低的NaCl形成MMP-7单体,在5mM CaCl2情况下用80mM或更低的NaCl形成MMP-7单体,在10mM CaCl2的情况下用100mM或更低的NaCl形成MMP-7单体,在20mM CaCl2的情况下用120mM或更低的NaCl形成MMP-7单体,在30mM CaCl2的情况下用130mM或更低的NaCl形成MMP-7单体。此外,在仅用水稀释的情况下,也观察到MMP-7单体的形成。因此,揭示了在130mM或更高的NaCl的存在下形成MMP-7聚集体,但是30mM或更低(最高30mM)的CaCl2共存抑制MMP-7聚集体的形成。即,该浓度的氯化钙具有更有效地维持和稳定MMP-7单体的作用(图2)。
实施例3
MMP-7浓度对MMP-7聚集体形成的影响
将实施例1-(1)中得到的MMP-7溶液用含有10mM CaCl2和各浓度的氯化钠的溶液稀释,制备含有各浓度的MMP-7的样品4。
样品4:各浓度的MMP-7 (10、15、20mg/ml)/10mM CaCl2/各浓度的NaCl (50至250mM)
通过尺寸排阻色谱法(HPLC装置: HEWLETT PACKED 1100系列,载体: TOYOPARL HW50S,温度: 25℃,流速0.5mL/min,波长280nm)研究MMP-7浓度关于对MMP-7聚集体形成的抑制作用的影响。柱尺寸为5mm直径和150mm长度,并且用含有5mM Tis-HCl (pH 7)、10mM CaCl2、3.5%甘露糖醇和40至500mM NaCl的溶液进行柱的平衡。
在这些条件下,分子量为60kDa至80kDa的蛋白质在无效体积中出现(在色谱开始后1.8分钟)。因此,色谱开始后2分钟附近的峰(或前导峰)被认为是MMP-7聚集体,并且使用峰的面积作为指标,计算了形成MMP-7聚集体的氯化钠浓度。
结果发现,尽管氯化钠对MMP-7聚集体形成的抑制作用取决于MMP-7的浓度而变弱,但是在20mg/ml或更低的MMP-7的情况下,由于0至80mM NaCl (图3),MMP-7作为单体存在。从实施例2 (图2)的结果可以看出,维持MMP-7单体的氯化钠浓度随氯化钙浓度的增加成比例地增加。在本实施例中,如果使用30mM CaCl2,则认为即使在100mM NaCl的存在下,20mg/ml的MMP-7也作为单体存在。此外,当使用大于20mg/ml的MMP-7时,认为可以通过增加氯化钙的浓度来维持MMP-7作为单体。
在4℃下静置过夜后,对样品4进行与上述相同的实验,得到与图3相同的结果。
实施例4
MMP-7聚集体形成对酶活性的影响
将实施例1-(1)中得到的MMP-7溶液用含有40mM NaCl和10mM CaCl2的5mM Tris缓冲液(pH7)稀释,制备含有各浓度的MMP-7的样品5。
样品5:各浓度的MMP-7 (0.1、2、20mg/ml)/10mM CaCl2/40mM NaCl/5mM Tris缓冲液(pH7)
将含有各浓度的MMP-7的溶液用含有150mM NaCl和10mM CaCl2的50mM Tris缓冲液(pH7)或含有40mM NaCl和10mM CaCl2的10mM Tris缓冲液(pH7)稀释至0.1mg/ml (一次稀释),并用含有150mM NaCl和10mM CaCl2的50mM Tris缓冲液(pH7)进一步稀释至5ng/ml (二次稀释)。对于所得的稀释液,使用用于测量MMP-7活性的试剂盒(ANASPEC),按照所附的方案测量对荧光底物(Dnp-Pro-Leu-Gly-Leu-Trp-Ala-D-Arg-NH2; SEQ ID NO:7)的切割活性。
结果,在一次稀释中用含有150mM NaCl的Tris缓冲液(pH7)稀释的2mg/ml或更高的MMP-7的酶活性降低(图4)。这种酶活性的降低与MMP-7聚集体形成一致。另一方面,在0.1mg/ml或更低的浓度下,未观察到酶活性的降低,这表明在该MMP-7浓度下不发生由150mM NaCl引起的聚集体形成。
实施例5
氯化钠浓度对通过超滤膜的MMP-7浓缩步骤的影响
将实施例1-(1)中得到的MMP-7溶液用含有10mM CaCl2的5mM Tris缓冲液(pH7)稀释,制备含有各浓度氯化钠的样品6。
样品6:4mg/ml MMP-7/10mM CaCl2/各浓度的NaCl (40mM、80mM、200mM、500mM)/5mM Tris缓冲液(pH7)
使用超滤膜(Amicon Ultra-4 10K)离心(2500g)浓缩各4ml的样品6,并以恒定时间间隔测定滤液体积和浓缩物吸光度。
结果,当使用较低浓度的氯化钠时,MMP-7可以在较短时间内浓缩,而当使用较高浓度的氯化钠时,需要较长时间进行浓缩(表1)。在表1中,符号(-)表示浓缩终止。
表1
实施例6
甘露糖醇对MMP-7吸附的抑制作用
(1)抑制MMP-7至凝胶的吸附
将实施例1-(1)中得到的MMP-7溶液用含有10mM CaCl2和40mM NaCl的5mM Tris缓冲液(pH7)稀释,制备样品7。
样品7:5.5mg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl
将样品7 (1ml)加到预先用含有10mM CaCl2和40mM NaCl的5mM Tris缓冲液(pH7)平衡的柱(HW40F,26×6cm,Tosoh Corporation)上,用Tris缓冲液洗涤后,用含有3.5%甘露糖醇的Tris缓冲液洗脱(流速:5ml/min)。
结果,吸附到凝胶上的MMP-7被甘露糖醇洗脱(图5)。该结果表明甘露糖醇对MMP-7至凝胶的吸附具有抑制作用。
(2)抑制MMP-7至容器壁的吸附
将实施例1-(1)中得到的MMP-7溶液用含有10mM CaCl2、40mM NaCl和甘露糖醇或蔗糖的5mM Tris缓冲液(pH7)稀释,在小瓶中制备样品8至10的溶液(1ml)。调节浓度,使得每个样品具有相同的渗透压。对照是用不含甘露糖醇和蔗糖的Tris缓冲液稀释的MMP-7溶液(样品10)。
样品8:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)/3.5%甘露糖醇
样品9:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)/6.6%蔗糖
样品10:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)
在室温下静置3小时后,将小瓶中的每种溶液在两个步骤中稀释。对于一次稀释,使用含有10mM CaCl2和40mM NaCl的5mM Tris缓冲液(pH 7)。对于二次稀释,使用1% Block Ace(Block Ace粉末:DS Pharma Biomedical)/ TBS-T(0.05%Tween20 / 50mM Tris / 150mM NaCl)。通过ELISA定量溶液中的MMP-7。对于ELISA,使用:通过用MMP-7免疫兔获得的兔抗MMP-7抗体;生物素标记的兔抗MMP-7抗体,其中兔抗MMP-7抗体用生物素标记试剂(Biotin(Long Arm) NHS-Water Soluble:Vector Laboratories)标记;辣根过氧化物酶(HRP)-标记的链霉亲和素(辣根过氧化物酶链霉亲和素浓缩物:Vector Laboratories)和HRP底物溶液(过氧化物酶底物溶液B:KPL)。作为ELISA反应的对照,使用具有固定浓度的MMP-7的用于ELISA的MMP-7标准品。通过测量吸光度计算MMP-7的浓度。
结果,与未添加(样品10)相比,当添加甘露糖醇(样品8)或蔗糖(样品9)时,显示出更高的MMP-7回收率,证实了其抑制效果(图6)。
接下来,研究抑制MMP-7吸附到容器壁的甘露糖醇或蔗糖的有效浓度以及甘露糖醇或蔗糖对MMP-7的酶活性的影响。将实施例1-(1)中得到的MMP-7溶液用含有10mM CaCl2、40mM NaCl和甘露糖醇或蔗糖的5mM Tris缓冲液(pH7)稀释,在小瓶中制备样品12至16的溶液(1ml)。对照是用不含甘露糖醇和蔗糖的Tris缓冲液稀释的MMP-7溶液(样品11)。
样品11:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)
样品12:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)/ 1%甘露糖醇
样品13:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)/ 2%甘露糖醇
样品14:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)/ 2%蔗糖
样品15:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)/ 5%甘露糖醇
样品16:50μg/ml MMP-7 / 10mM CaCl2 / 40mM NaCl / 5mM Tris缓冲液(pH7)/ 7%蔗糖
在室温下静置3小时后,将小瓶中的每种溶液在两个步骤中稀释。将小瓶中的每种溶液用含有0.01%Briji 35、0.01%BSA、150mM NaCl和10mM CaCl2的50mM Tris缓冲液(pH7)的一次稀释溶液稀释至5ng/ml,并且按实施例4测量对荧光底物的切割活性(MMP-7的酶活性)。在该实验中,使用获自PEPTIDE INSTITUTE,INC的荧光底物(MOCAc-Pro-Leu-Gly-Leu-A2pr(Dnp)-Ala-Arg-NH2; (7-甲氧基香豆素-4-基)乙酰基-L-脯氨酰基-L-亮氨酰基甘氨酰基-L-亮氨酰基-[Nβ-(2,4-二硝基苯基)-L-2,3-二氨基丙酰基]-L-丙氨酰基-L-精氨酸酰胺; SEQ ID NO:9)。对于二次稀释,使用1%Block Ace (Block Ace粉末:DS Pharma Biomedical)/ TBS-T(0.05%Tween20 / 50mM Tris / 150mM NaCl),并通过如上所述的ELISA测量溶液中MMP-7的浓度。
结果,与未添加(样品11)相比,当添加2至5%的甘露糖醇(样品13、15)或2至7%的蔗糖(样品14、15)时显示更高的MMP-7回收率,证实了其对于吸附到容器壁上的抑制效果(图7)。在添加甘露糖醇或蔗糖后,没有观察到MMP-7的酶活性的降低(图8)。
实施例7
甘露糖醇对抑制MMP-7聚集体形成的作用
使用旋转过滤器对实施例1-(1)中获得的MMP-7溶液进行缓冲液交换,交换为含有各浓度的NaCl、5mM CaCl2和3.5%甘露糖醇的5mM Tris缓冲液(pH 7),然后用Tris缓冲液稀释以制备样品17至22。对照是用不含甘露糖醇的Tris缓冲液处理的MMP-7溶液(样品17)。
样品17:10mM NaCl / 1mg/ml MMP-7 / 5mM CaCl2
样品18:10mM NaCl / 1mg/ml MMP-7 / 5mM CaCl2 / 3.5%甘露糖醇
样品19:40mM NaCl / 1mg/ml MMP-7 / 5mM CaCl2 / 3.5%甘露糖醇
样品20:80mM NaCl / 1mg/ml MMP-7 / 5mM CaCl2 / 3.5%甘露糖醇
样品21:120mM NaCl / 1mg/ml MMP-7 / 5mM CaCl2 / 3.5%甘露糖醇
样品22:180mM NaCl / 1mg/ml MMP-7 / 5mM CaCl2 / 3.5%甘露糖醇
如实施例1-(2)所述,通过动态光散射测量每个样品中MMP-7的分子量。结果显示,由于40mM或更高的氯化钠,MMP-7形成聚集体(图9)。
工业实用性
本发明的MMP-7聚集体的单体化方法可用于制备MMP-7和制备MMP-7制剂。
- 还没有人留言评论。精彩留言会获得点赞!