胰芽细胞的制造方法及含有胰芽细胞的胰疾病治疗剂与流程
本发明涉及胰芽细胞的制造方法、及通过该方法制造的含有胰芽细胞的胰疾病治疗剂。本申请进一步涉及使用该胰芽细胞的胰疾病治疗方法。
背景技术:
胰脏发挥着分泌胰脂肪酶、胰蛋白酶、弹性蛋白酶、胰淀粉酶等消化酶的外分泌腺作用以及分泌胰高血糖素、胰岛素、生长抑素(Somatostatin)、胰多肽(PP)等胰激素的内分泌腺作用。近年有报道指出,作为胃分泌激素的饥饿素(Ghrelin)也是由胰脏的内分泌细胞分泌的。该胰激素由胰脏中的包含α细胞、β细胞、δ细胞及PP细胞这4种细胞的被称为胰岛的细胞团块产生。
其中,胰岛素发挥促进葡萄糖的利用、蛋白的合成、中性脂肪的形成及储藏而降低血糖值,使血糖保持正常浓度的重要作用。胰高血糖素作为介导肝糖原分解、糖新生作用等的血糖上升激素,与胰岛素一起在糖代谢调节机制中承担着重要作用。生长抑素通过与生长抑素受体结合而显示出作用,抑制胰脏中的胰高血糖素、胰岛素等各种激素的分泌。PP是相应于食物摄取而由朗格汉斯岛的细胞分泌的激素,已知为一种饱食因子,有抑制食物摄取、减少体重的增加的作用。已知的是,饥饿素通过刺激食物的摄取、降低脂肪氧化而使体重增加。
糖尿病是由于胰岛素不足、或其功能丧失而罹患的疾病,是一种一旦罹患则难以根治的疾病。糖尿病可以大致分为1型糖尿病(胰岛素依赖性糖尿病)和2型糖尿病(胰岛素非依赖性糖尿病)2种类型。
2型糖尿病是由于获得对胰岛素的抵抗性而罹患的慢性疾病,是通常认为发病机制为过食、运动不足所致的肥胖、压力等生活习惯的糖尿病。2型糖尿病在中老年中多发,糖尿病患者大多罹患有2型糖尿病。
另一方面,1型糖尿病是由于自身免疫疾病、病毒感染等导致β细胞(产胰岛素细胞)被破坏、体内不分泌胰岛素而引起的疾病。主要进行的是施予胰岛素的对症疗法,作为对体内时常变化的血糖值进行自动控制而能够减轻患者负担的治疗方法,也在进行胰脏移植或胰岛移植。通过该治疗方法能够实现正常的血糖值,但现状是可移植的胰脏或胰岛不足。此外,为了避免对移植片的免疫排斥反应,患者需要终生持续服用免疫抑制剂,留下了感染症危险性、免疫抑制剂所致的副作用等问题。
作为1型糖尿病的治疗方法,正在研究如下方法:在体外,由来自患者的细胞诱导产胰岛素细胞本身,将所诱导的产胰岛素细胞移植到患者的体内。产胰岛素细胞例如可以通过如下方法等获得:将患者的来自胰管上皮的细胞取出到体外并使其分化。
作为获得产胰岛素细胞的方法,可例示如下方法:使用活化素(Activin)、视黄酸(RA),对胚胎干(ES)细胞、人工多能性干(iPS)细胞等多能性干细胞进行分化诱导(专利文献1、非专利文献1~5)。进而还已知如下方法:向多能性干细胞导入PDX1并培养的方法(专利文献2及专利文献3)、将低分子化合物适当组合并使其作用于多能性干细胞而制造产胰岛素细胞的方法(专利文献4及非专利文献6)。但是,尚无如上所述地将在体外获得的产胰岛素细胞施予到生体内并获得葡萄糖应答能力的报告。另一方面,报道了:在制造胰前体细胞并施予到生体内时,由所施予的细胞根据葡萄糖浓度而分泌胰岛素(非专利文献7及非专利文献8)。
现有技术文献
专利文献
专利文献1:日本特开2009-225661号公报
专利文献2:美国专利7534608号公报
专利文献3:日本特开2006-075022号公报
专利文献4:WO2011/081222
非专利文献
非专利文献1:E.Kroon et al.,Nature Biotechnology(2008)Vol.26,No.4:443-452
非专利文献2:K.A.D’Amour et al.,Nature Biotechnology(2006)Vol.24,No.11:1392-1401
非专利文献3:W.Jiang,Cell Research(2007)17:333-344
非专利文献4:J.H.Shim et al.,Diabetologia(2007)50:1228-1238
非专利文献5:R.Maehr et al.,PNAS(2009),vol.106,No.37:15768-15773
非专利文献6:Kunisada Y et al.,Stem Cell Res.(2012)vol.8,No.2:274-284.
非专利文献7:Kroon E et al.,Nat Biotechnol.(2008)vol.26,No.4:443-452.
非专利文献8:Rezania A et al.,Diabetes.(2012)vol.61,No.8:2016-2029.
技术实现要素:
发明所要解决的课题
一个实施方式中,本申请的目的在于,提供由PDX1阳性NKX6.1阴性细胞分化诱导胰芽细胞的方法。更具体而言,目的在于,提供一种包括使由多能性干细胞诱导的PDX1阳性NKX6.1阴性细胞进一步进行分化的工序,且对胰芽细胞进行分化诱导的方法。
在其它实施方式中,目的在于提供胰脏疾病治疗剂、以及胰脏疾病治疗方法。
用于解决课题的手段
本发明人们为了解决上述课题进行了深入研究,结果首次发现,通过在生成细胞聚集块的条件下在含有KGF、EGF及BMP抑制剂的培养基中培养PDX1阳性NKX6.1阴性细胞,从而能够对胰芽细胞进行分化诱导。本发明是基于这样的见解完成的。
即,本发明具有以下特征:
[1]一种胰芽细胞的制造方法,其包含下述工序:将PDX1阳性NKX6.1阴性细胞用含有KGF、EGF及BMP抑制剂的培养基培养。
[2]根据[1]所述的方法,其中,上述培养基为还含有ROCK抑制剂或非肌肉肌球蛋白II抑制剂的培养基。
[3]根据[2]所述的方法,其中,上述ROCK抑制剂或非肌肉肌球蛋白II抑制剂为选自Y-27632、法舒地尔(Fasudil)、SR3677、GSK269962、H-1152及Blebbistatin中的任一种化合物。
[4]根据[2]或[3]中任一项所述的方法,其中,上述培养在粘附培养条件下进行。
[5]根据[1]所述的方法,其中,上述培养在生成细胞聚集块的条件下进行。
[6]根据[1]~[5]中任一项所述的方法,其中,上述PDX1阳性NKX6.1阴性细胞为通过包括下述2个工序的方法由多能性干细胞制造的细胞,
(1)用含有活化素的培养基培养多能性干细胞的工序、及
(2)将通过工序(1)获得的细胞用含有KGF的培养基培养的工序。
[7]根据[6]所述的方法,其中,上述工序(1)中,含有活化素的培养基还含有GSK3抑制剂。
[8]根据[6]或[7]中任一项所述的方法,其中,上述工序(2)中,含有KGF的培养基还含有BMP抑制剂、视黄酸衍生物及Hedgehog通路抑制剂。
[9]根据[1]~[8]中任一项所述的方法,其中,上述BMP抑制剂为头蛋白(Noggin)。
[10]根据[7]~[9]中任一项所述的方法,其中,上述GSK3抑制剂为CHIR99021。
[11]根据[8]~[10]中任一项所述的方法,其中,上述视黄酸衍生物为TTNPB。
[12]根据[8]~[11]中任一项所述的方法,其中,上述Hedgehog通路抑制剂为KAAD-环杷明(KAAD-cyclopamine)。
[13]根据[1]~[12]中任一项所述的方法,其中,上述胰芽细胞为PDX1阳性及NKX6.1阳性。
[14]根据[1]~[13]中任一项所述的方法,其中,上述胰芽细胞为人细胞。
[15]一种由多能性干细胞制造胰芽细胞的方法,包含以下工序(i)~(iii):
(i)用含有活化素的培养基培养多能性干细胞的工序、
(ii)将通过工序(i)获得的细胞用含有KGF的培养基培养的工序、
(iii)将通过工序(ii)获得的细胞分离成单个细胞,用含有KGF、EGF及BMP抑制剂的培养基培养的工序。
[16]根据[15]所述的方法,其中,上述工序(iii)中使用的含有KGF、EGF及BMP抑制剂的培养基为还含有ROCK抑制剂或非肌肉肌球蛋白II抑制剂的培养基。
[17]根据[16]所述的方法,其中,上述ROCK抑制剂或非肌肉肌球蛋白II抑制剂为选自Y-27632、法舒地尔、SR3677、GSK269962、H-1152及Blebbistatin中的任一种化合物。
[18]根据[16]或[17]中任一项所述的方法,其中,上述工序(iii)为下述工序:分离成单个细胞并用含有KGF、BMP抑制剂、视黄酸衍生物及Hedgehog通路抑制剂的培养基培养后,用含有KGF、EGF及BMP抑制剂的培养基培养。
[19]根据[16]~[18]中任一项所述的方法,其中,上述工序(iii)中的培养在粘附培养条件下进行。
[20]根据[15]所述的方法,其中,上述工序(iii)中的培养在悬浮培养条件下进行。
[21]根据[15]~[20]中任一项所述的方法,其中,上述工序(i)中,含有活化素的培养基还含有GSK3抑制剂。
[22]根据[15]~[21]中任一项所述的方法,其中,上述工序(ii)中,含有KGF的培养基还含有BMP抑制剂、视黄酸衍生物及Hedgehog通路抑制剂。
[23]根据[15]~[22]中任一项所述的方法,其中,上述BMP抑制剂为头蛋白。
[24]根据[21]~[23]中任一项所述的方法,其中,上述GSK3抑制剂为CHIR99021。
[25]根据[18]或[22]~[24]中任一项所述的方法,其中,上述视黄酸衍生物为TTNPB。
[26]根据[18]或[22]~[26]中任一项所述的方法,其中,上述Hedgehog通路抑制剂为KAAD-环杷明。
[27]根据[15]~[26]中任一项所述的方法,其中,上述胰芽细胞为PDX1阳性及NKX6.1阳性。
[28]根据[15]~[27]中任一项所述的方法,其中,上述胰芽细胞为人细胞。
[29]一种胰疾病的治疗剂,其含有通过[1]~[28]中任一项所述的方法制造的胰芽细胞。
[30]根据[29]所述的治疗剂,其中,上述胰疾病为糖尿病。
[31]根据[30]所述的治疗剂,其中,上述糖尿病为1型糖尿病。
[32]通过[1]~[28]中任一项所述的方法制造的胰芽细胞的、用于制造胰疾病的治疗剂的用途。
[33]一种通过[1]~[28]中任一项所述的方法制造的胰芽细胞,其用于胰疾病治疗。
[34]一种胰疾病的治疗方法,其包括:将通过[1]~[28]中任一项所述的方法制造的胰芽细胞向需要治疗胰疾病的对象中移植。
发明效果
本发明人们首次发现,能够由PDX1阳性NKX6.1阴性细胞诱导胰芽细胞,该胰芽细胞在体内向葡萄糖应答性的产胰岛素细胞转变。通过本申请所提供的方法制造的胰芽细胞能够用于糖尿病等胰脏疾病的再生医疗中。
附图说明
图1:图1示出由多能性干细胞制造胰芽细胞的方案的简要图。
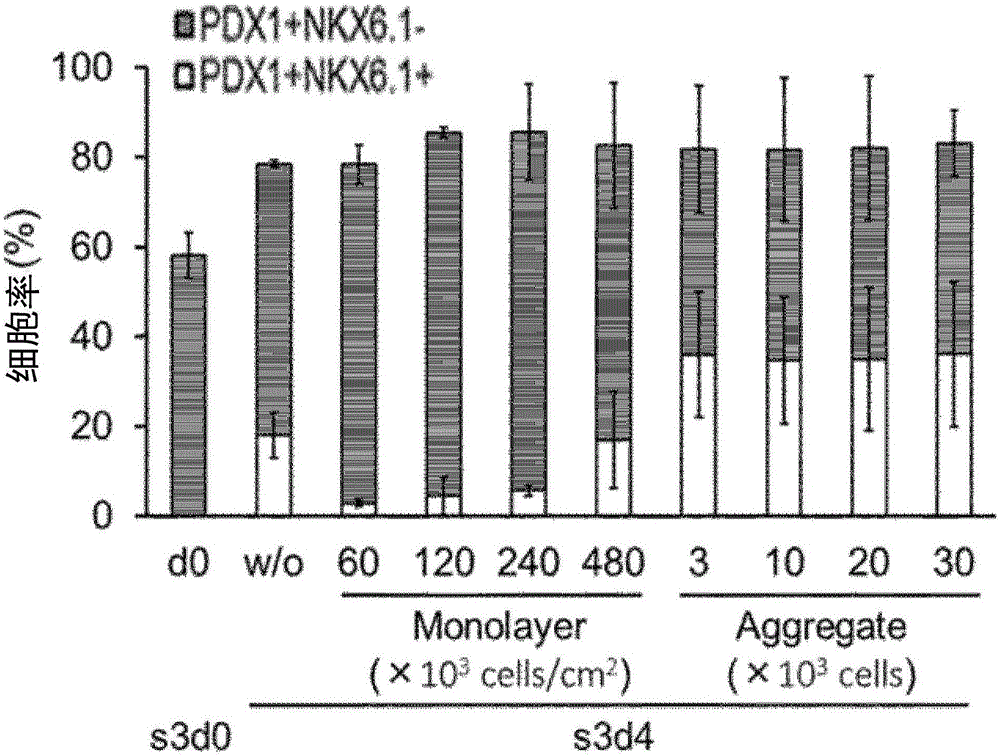
图2:图2示出通过各诱导方法获得的细胞的PDX1阳性NKX6.1阴性细胞及PDX1阳性NKX6.1阳性细胞的含有率。图中,d0表示第2工序结束后的细胞,W/O表示第3工序中不进行细胞的解离而仅进行培养基交换的第4天的细胞、Monolayer表示第3工序中进行粘附培养的第4天的细胞、Aggregate表示第3工序中进行悬浮培养的第4天的细胞。(N=3~4)
图3:图3示出由各多能性干细胞株(KhES3、585A1、604B1、692D2、648B1及409B2)获得的PDX1阳性NKX6.1阳性细胞的含有率。图中,2D表示第3工序中进行粘附培养的情况、Agg表示第3工序中进行悬浮培养的情况。(Mean±S.D.,n=3)
图4:图4A示出使用流式细胞仪测定第3工序的各经过天数后的细胞中PDX1及NKX6.1的表达强度的结果。图4B示出第3工序的各经过天数后的PDX1阳性NKX6.1阳性细胞的含有率。(Mean±S.D.,n=3)
图5-1:图5A示出第3工序第4天的细胞聚集块中的胰芽细胞标志物(PDX1、NKX6.1、SOX9及GATA4)的免疫染色像。
图5-2:图5B示出第3工序第4天的细胞聚集块中的内分泌细胞标志物(INS、GCG、Somatostatin及Ghrelin)的免疫染色像。
图6-1:图6A示出第3工序第12天的细胞聚集块中的胰芽细胞标志物(PDX1、NKX6.1、SOX9及GATA4)的免疫染色像。
图6-2:图6B示出第3工序第12天的细胞聚集块中的内分泌细胞标志物(INS、GCG、Somatostatin及Ghrelin)的免疫染色像。
图7:图7A示出用于研究第3工序中的培养条件的方案的简要图。图中,黑箭头表示在培养液中添加Noggin(NOG)、KGF及EGF的条件,白箭头表示培养液中不添加Noggin(NOG)、或不添加Noggin(NOG)、KGF及EGF的条件。图7B示出通过各条件获得的细胞的PDX1阳性NKX6.1阴性细胞及PDX1阳性NKX6.1阳性细胞的含有率。
图8:图8A示出用于研究第3工序中的ALK5抑制剂II的效果的方案的简要图。图中,箭头表示添加ALK5抑制剂II的期间。图8B示出未添加ALK5抑制剂II的条件(左图)及添加了ALK5抑制剂II的条件(右图)下用流式细胞仪测定PDX1(纵轴)及NKX6.1(横轴)的表达而得的结果。图中,数字表示PDX1阳性及NKX6.1阳性的细胞的含有率。
图9:图9示出移植到免疫缺陷小鼠(NOD.CB17-Prkdcscid/J)的附睾周围脂肪组织的、30天后的移植部位的PDX1及胰岛素的免疫染色像。
图10:图10A示出将所诱导的胰芽细胞移植到免疫缺陷小鼠的肾筋膜下的、相对于移植后的天数的小鼠血浆中的人C肽量。图10B示出由葡萄糖负荷(+)引起的胰芽细胞移植小鼠的血浆中的人C肽的变化量。
图11-1:图11A示出由多能性干细胞制造胰芽细胞的粘附条件方案的简要图。
图11-2:图11B示出第3工序中使用50μM的Y-27632时(右图)的胰芽细胞标志物(PDX1(下图)及NKX6.1(上图))的免疫染色像。图中水(左图)表示阴性对照。图11C表示第3工序中使用各浓度的Y-27632时的PDX1阳性NKX6.1阳性细胞及PDX1阳性NKX6.1阴性细胞的含有率。
图12-1:图12A示出由多能性干细胞制造胰芽细胞的粘附条件的改进方案的简要图。
图12-2:图12B示出改进方案的第3工序中使用50μM的法舒地尔时(右图)的胰芽细胞标志物(PDX1(下图)及NKX6.1(上图))的免疫染色像。图中,水(左图)表示阴性对照。图12C示出第3工序中使用各浓度的法舒地尔时的PDX1阳性NKX6.1阳性细胞及PDX1阳性NKX6.1阴性细胞的含有率。图中,Y50表示作为阳性对照的、使用50μM的Y-27632时的结果。
图13-1:图13A示出改进方案的第3工序中使用5μM的SR3677时(右图)的NKX6.1的免疫染色像。图中,DMSO(左图)表示阴性对照。图13B示出改进方案的第3工序中使用各浓度的SR3677时的NKX6.1阳性细胞的含有率。图中,Y50表示作为阳性对照的、使用50μM的Y-27632时的结果。
图13-2:图13C示出改进方案的第3工序中使用0.1μM的GSK269962时(右图)的NKX6.1的免疫染色像。图中,DMSO(左图)表示阴性对照。图13D示出改进方案的第3工序中使用各浓度的GSK269962时的NKX6.1阳性细胞的含有率。图中,Y50表示作为阳性对照的、使用50μM的Y-27632时的结果。
图14-1:图14A示出改进方案的第3工序中使用50μM的H-1152时(右图)的NKX6.1的免疫染色像。图中,DMSO(左图)表示阴性对照。图14B示出改进方案的第3工序中使用各浓度的H-1152时的NKX6.1阳性细胞的含有率。图中,Y50表示作为阳性对照的、使用50μM的Y-27632时的结果。
图14-2:图14C示出改进方案的第3工序中使用5μM的Blebbistatin时(右图)的胰芽细胞标志物(PDX1(下图)及NKX6.1(上图))的免疫染色像。图中,DMSO(左图)表示阴性对照。图14D示出改进方案的第3工序中使用各浓度的Blebbistatin时的PDX1阳性NKX6.1阳性细胞的含有率。图中,Y50表示作为阳性对照的、使用50μM的Y-27632时的结果。
具体实施方式
作为本申请的一个实施方式,提供一种制造胰芽细胞的方法,其包含下述工序:将PDX1阳性NKX6.1阴性细胞用含有KGF、EGF及BMP抑制剂的培养基培养。
胰芽细胞是指可以分化诱导为内分泌细胞、胰管细胞及外分泌细胞等形成胰脏的细胞的细胞,可例示至少表达了PDX1及NKX6.1的细胞。此外,还可以是表达了SOX9、或GATA4等基因标志物的细胞。
根据本方式制造的胰芽细胞可以以含有其它细胞种类的细胞团的形式来提供,也可以是进行了纯化的团块。优选为含有30%以上、40%以上、50%以上、60%以上、70%以上或80%以上的胰芽细胞的细胞团。
在由PDX1阳性NKX6.1阴性细胞制造胰芽细胞时,该PDX1阳性NKX6.1阴性细胞可以用含有KGF、EGF及BMP抑制剂的培养基在生成细胞聚集块的条件下进行培养。对“生成细胞聚集块的条件下”不作特别限定,只要可以在培养基中获得细胞聚集块即可。例如,可以通过任意的方法实质上分离(或解离)成单个细胞的状态而进行悬浮培养,或者以细胞彼此预先粘附成细胞聚集块的状态进行培养。优选分离成单个细胞的状态而进行悬浮培养的方法。通过对分离了的单个细胞进行悬浮培养,从而细胞彼此粘附而生成细胞聚集块。或者,也可以通过对分离了的细胞进行离心而制作细胞聚集块。作为分离的方法,可以列举例如:力学方法分离,使用具有蛋白酶活性和胶原酶活性的分离溶液(可以列举例如:胰蛋白酶,含有胰蛋白酶和胶原酶的溶液Accutase(TM)及Accumax(TM)(Innovative Cell Technologies,Inc))或仅具有胶原酶活性的分离溶液的分离。
悬浮培养是指对细胞以不粘附于培养皿的状态进行培养。虽无特别限定,但可以使用一些方式进行:不进行目的在于提高与细胞的粘附性的人工处理(例如利用胞外基质等进行的包被处理),或者进行人工抑制粘附的处理(例如利用聚甲基丙烯酸羟乙酯(poly-HEMA)或2-甲基丙烯酰氧基乙基磷脂酰胆碱的聚合物(Lipidure)进行的包被处理)。
对细胞聚集块的大小不作特别限定,可以由至少3×103个以上的细胞形成细胞聚集块,作为构成细胞聚集块的细胞数,可以列举例如1×104个以上、2×104个以上、3×104个以上、4×104个以上、5×104个以上。
作为其它方式,PDX1阳性NKX6.1阴性细胞被分离为单个细胞的状态而进行粘附培养。或者,在分离成单个细胞的状态后,在后述(工序2)中使用的培养基中进行粘附培养。对在该(工序2)中使用的培养基中进行粘附培养的期间不作特别限定,可以列举例如1天以上、2天以上或3天以上,更优选1天。为了抑制将多能性干细胞分离成单个细胞的状态时的细胞凋亡,在该(工序2)中使用的培养基中期望使用ROCK抑制剂,该ROCK抑制剂可以使用与后述ROCK抑制剂同样的物质,优选Y-27632。
在本申请说明书及权利要求书中,粘附培养是指用经包被处理的培养皿进行培养。作为包被剂,可以列举例如基质胶(BD Biosciences)、Synthemax(Coming)、明胶、胞外蛋白(例如胶原、层粘连蛋白(例如层粘连蛋白111、411或511)、硫酸乙酰肝素蛋白多糖、及巢蛋白等)、或该胞外蛋白的片段、及这些的组合。
由PDX1阳性NKX6.1阴性细胞培养胰芽细胞的培养工序中使用的培养基可以在动物细胞的培养中所使用的基础培养基中适当添加KGF、EGF及BMP抑制剂而制备。作为基础培养基,包括例如:MEM Zinc Option培养基、IMEM Zinc Option培养基、IMDM培养基、Medium 199培养基、Eagle′s最低需求(EMEM)培养基、αMEM培养基、Dulbecco′s改良伊戈尔(DMEM)培养基、Ham′s F12培养基、RPMI 1640培养基、Fischer′s培养基、及这些的混合培养基等。基础培养基可以含有血清(例如胎牛血清(FBS)),或者也可以无血清。根据需要,还可以含有例如白蛋白、转铁蛋白、KnockOut Serum Replacement(KSR)(ES细胞培养时的血清代替物)(Invitrogen)、N2补充剂(Invitrogen)、B27补充剂(Invitrogen)、脂肪酸、胰岛素、胶原前体、微量元素、2-巯基乙醇、3′-巯基甘油等1种以上的血清代替物,还可以含有脂质、氨基酸、L-谷氨酰胺、GlutaMAX(Invitrogen)、非必需氨基酸(NEAA)、维生素、增殖因子、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类、及这些的类似物等中的1种以上物质。在1个实施方式中,基础培养基为含有B27补充剂的IMEM Zinc Option培养基。
KGF是被称为角质形成细胞生长因子(Keratinocyte Growth Factor)的蛋白质,有时也被称为FGF-7。KGF可以使用R&D systems公司等销售的产品。KGF的浓度为1ng/ml~1μg/ml、优选5ng/ml~500ng/ml、更优选10ng/ml~200ng/ml。
EGF是被称为上皮生长因子或Epidermal Growth Factor的蛋白质。EGF可以使用R&D systems公司等销售的产品。EGF的浓度为1ng/ml~1μg/ml、优选5ng/ml~500ng/ml、更优选10ng/ml~100ng/ml。
BMP抑制剂可以例示:脊索蛋白(Chordin)、头蛋白、卵泡抑素等蛋白质性抑制剂;Dorsomorphin(即,6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)吡唑并[1,5-a]嘧啶)、其衍生物(P.B.Yu et al.(2007),Circulation,116:II_60;P.B.Yu et al.(2008),Nat.Chem.Biol.,4:33-41;J.Hao et al.(2008),PLoS ONE,3(8):e2904)及LDN-193189(即,4-[6-(4-(哌嗪-1-基)苯基]吡唑并[1,5-a]嘧啶-3-基)喹啉)。优选头蛋白。头蛋白可以使用Peprotech公司等销售的产品。
使用头蛋白作为BMP抑制剂时,其浓度为1ng/ml~1μg/ml、优选5ng/ml~500ng/ml、更优选50ng/ml~200ng/ml。
由PDX1阳性NKX6.1阴性细胞培养胰芽细胞的培养工序中使用的培养基还可以含有ROCK抑制剂或非肌肉肌球蛋白II抑制剂。对上述PDX1阳性NKX6.1阴性细胞进行粘附培养时,优选向培养基中进一步添加ROCK抑制剂或非肌肉肌球蛋白II抑制剂。
ROCK抑制剂只要可抑制Rho激酶(ROCK)的功能则没有特别限定,可以列举例如Y-27632(参照例如Ishizaki et al.,Mol.Pharmacol.57,976-983(2000);Narumiya et al.,Methods Enzymol.325,273-284(2000))、法舒地尔/HA1077(参照例如Uenata et al.,Nature 389:990-994(1997))、SR3677(参照例如Feng Y et al.,J Med Chem.51:6642-6645(2008))、GSK269962(参照例如Stavenger RA et al.,J Med Chem.50:2-5(2007)或WO2005/037197)、H-1152(参照例如Sasaki et al.,Phannacol.Ther.93:225-232(2002))、Wf-536(参照例如Nakajima et al.,Cancer Chemother Pharmacol.52(4):319-324(2003))及这些的衍生物、以及针对ROCK的反义核酸、RNA干扰诱导性核酸(例如siRNA)、显性失活突变体、及这些的表达载体。此外,还可以使用其它公知的低分子化合物作为ROCK抑制剂(参照例如美国专利申请公开第2005/0209261号、美国专利申请公开第2005/0192304号、美国专利申请公开第2004/0014755号、美国专利申请公开第2004/0002508号、美国专利申请公开第2004/0002507号、美国专利申请公开第2003/0125344号、美国专利申请公开第2003/0087919号、及国际公开第2003/062227号、国际公开第2003/059913号、国际公开第2003/062225号、国际公开第2002/076976号、国际公开第2004/039796号)。本发明中,可以使用1种或2种以上的ROCK抑制剂。作为本工序中使用的优选的ROCK抑制剂,可以列举Y-27632、法舒地尔/HA1077、SR3677、GSK269962及H-1152。
使用Y-27632作为ROCK抑制剂时的培养基中的浓度为0.1μM~100μM、优选1μM~500μM、进一步优选10μM~200μM。
本发明中,使用法舒地尔/HA1077作为ROCK抑制剂时的培养基中的浓度为1μM~100μM、优选10μM~100μM。
本发明中,使用SR3677作为ROCK抑制剂时的培养基中的浓度为0.1μM~50μM、优选0.5μM~50μM。
本发明中,使用GSK269962作为ROCK抑制剂时的培养基中的浓度为0.001μM~100μM、优选0.005μM~50μM、进一步优选0.05μM~120μM。
本发明中,使用H-1152作为ROCK抑制剂时的培养基中的浓度为5μM~100μM、优选10μM~50μM。
非肌肉肌球蛋白II抑制剂可以例示:作为非肌肉肌球蛋白II的重链同种异型之一的非肌肉肌球蛋白IIA或非肌肉肌球蛋白IIB的重链亚单位的ATPase活性的抑制剂、肌球蛋白轻链激酶的抑制剂。作为这样的药剂,可以列举例如Blebbistatin A3、钙感光蛋白C、Goe6976、Goe7874、法舒地尔/HA1077、金丝桃素(Hypericin)、K-252a、KT5823、ML-7、ML-9、白皮杉醇(Piceatannol)、十字孢碱、W-5、W-7、W-12、W-13、渥曼青霉素等,但并非仅限于这些。作为本工序中使用的优选的非肌肉肌球蛋白II抑制剂,可以列举Blebbistatin及法舒地尔/HA1077。
本发明中,使用Blebbistatin作为非肌肉肌球蛋白II抑制剂时的培养基中的浓度为1μM~200μM、优选10μM~100μM。
本发明的由PDX1阳性NKX6.1阴性细胞培养胰芽细胞的培养工序中使用的培养基可以还含有TGFβ抑制剂。其为阻遏TGFβ的与受体的结合起直至向SMAD持续的信号传导的物质,只要是阻遏与作为受体的ALK家族的结合的物质、或抑制由ALK家族导致的SMAD的磷酸化的物质则没有特别限定,可以例示例如:Lefty-1(作为NCBI登录号,可以例示小鼠:NM_010094、人:NM_020997)、SB431542、SB202190(以上,R.K.Lindemann et al.,Mol.Cancer,2003,2:20)、SB505124(GlaxoSmithKline)、NPC30345、SD093、SD908、SD208(Scios)、LY2109761、LY364947、LY580276(Lilly Research Laboratories)、A-83-01(WO2009146408)、ALK5抑制剂II(2-[3-[6-甲基吡啶-2-基]-1H-吡唑-4-基]-1,5-萘啶)、TGFβRI激酶抑制剂VIII(6-[2-叔丁基-5-[6-甲基-吡啶-2-基]-1H-咪唑-4-基]-喹喔啉)及这些的衍生物等。可优选ALK5抑制剂II。
使用ALK5抑制剂II作为TGFβ抑制剂时的培养基中的浓度为0.01μM~100μM、优选0.1~50μM、进一步优选1μM~20μM。
添加TGFβ抑制剂时,期望在PDX1阳性NKX6.1阴性细胞开始培养后经过2天后添加。对添加期间不作特别限定,可以例示1天以上、2天以上、3天以上或4天以上。
就由PDX1阳性NKX6.1阴性细胞培养胰芽细胞的培养工序的天数而言,由于长期培养对胰芽细胞的制造效率没有特别的影响,因此没有上限,可以列举例如:4天以上、5天以上、6天以上、7天以上、8天以上、9天以上、10天以上、11天以上、12天以上、13天以上或14天以上。更优选4天以上且20天以下。
由PDX1阳性NKX6.1阴性细胞培养胰芽细胞的培养工序中,培养温度不受以下温度限定,为约30~40℃、优选约37℃,且在含CO2的空气气氛中进行培养,CO2浓度优选约2~5%。
PDX1阳性NKX6.1阴性细胞只要是表达PDX1但不表达NKX6.1的细胞,就没有特别限定。表达PDX1是指可以通过公知方法检测到PDX1基因或基因产物,不表达NKX6.1是指检测不到NKX6.1基因或基因产物,作为该检测方法,可以例示例如免疫染色法等。
PDX1阳性NKX6.1阴性细胞既可以从生物体内分离,也可以通过已知方法由多能性干细胞等其它细胞品种制造。某些实施方式中,PDX1阳性NKX6.1阴性细胞可以是通过包括以下工序的方法由多能性干细胞制造的细胞:
(工序1)用含有活化素的培养基培养多能性干细胞的工序、及
(工序2)将通过工序1获得的细胞用含有KGF的培养基培养的工序。
因此,通过将上述由PDX1阳性NKX6.1阴性细胞诱导胰芽细胞的方法作为工序3使用,作为某一实施方式,还提供一种包括以下工序的、由多能性干细胞制造胰芽细胞的方法:
(工序1)用含有活化素的培养基培养多能性干细胞的工序、
(工序2)将通过工序1获得的细胞用含有KGF的培养基培养的工序、
(工序3)将通过工序2获得的细胞(PDX1阳性NKX6.1阴性细胞)分离成单个细胞后,用含有KGF、EGF及BMP抑制剂的培养基培养的工序。
这些实施方式中的、用含有活化素的培养基培养多能性干细胞的工序(工序1)中使用的培养基可以通过在动物细胞的培养中使用的基础培养基中适当添加活化素而制备。作为基础培养基,包括例如:MEM Zinc Option培养基、IMEM Zinc Option培养基、IMDM培养基、Medium 199培养基、Eagle′s最低需求(EMEM)培养基、αMEM培养基、Dulbecco′s改良伊戈尔(DMEM)培养基、Ham′s F12培养基、RPMI 1640培养基、Fischer′s培养基、及这些的混合培养基等。基础培养基中可以含有血清(例如胎牛血清(FBS)),或者也可以无血清。根据需要,还可以含有例如白蛋白、转铁蛋白、KnockOut Serum Replacement(KSR)(ES细胞培养时的血清代替物)(Invitrogen)、N2补充剂(Invitrogen)、B27补充剂(Invitrogen)、脂肪酸、胰岛素、胶原前体、微量元素、2-巯基乙醇、3’-巯基甘油等1种以上的血清代替物,还可以含有脂质、氨基酸、L-谷氨酰胺、GlutaMAX(Invitrogen)、非必需氨基酸(NEAA)、维生素、增殖因子、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类、及这些的类似物等中的1种以上的物质。在1个实施方式中,基础培养基为含有B27补充剂的RPMI 1640培养基。
本实施方式的工序1中,多能性干细胞可以通过任意的方法实质上分离(或解离)成单个细胞的状态而进行培养,或者,也可以以细胞彼此粘附成细胞聚集块的状态进行培养。更优选分离成单个细胞的状态而进行培养。作为分离方法,可以列举例如:力学方法分离、使用具有蛋白酶活性和胶原酶活性的分离溶液(可以列举例如含有胰蛋白酶和胶原酶的溶液Accutase(TM)及Accumax(TM)(Innovative Cell Technologies,Inc))或仅具有胶原酶活性的分离溶液的分离。多能性干细胞可以使用经包被处理的培养皿来进行粘附培养。
本实施方式的工序1中的粘附培养可以通过与前述条件相同的方法来进行。
活化素可以是活化素A、B、C、D、AB中的任意种活化素,特别优选使用活化素A。此外,作为活化素,还可以使用来自人、小鼠等任一种哺乳动物的活化素。作为本发明中使用的活化素,优选使用来自与分化中使用的多能性干细胞同一物种的活化素,例如,以来自人的多能性干细胞为起始原料时,优选使用来自人的活化素。这些活化素可以通过商业渠道获得。
使用活化素时,培养基中的浓度通常为0.1~200ng/ml、优选5~150ng/ml、特别优选10~100ng/ml。
工序1中使用的培养基可以还含有GSK3抑制剂和/或ROCK抑制剂。GSK3抑制剂被定义为抑制GSK-3β蛋白的激酶活性(例如对β连环蛋白的磷酸化能力)的物质,已经获知有多种物质,可以列举例如作为靛玉红衍生物的BIO(别名GSK-3β抑制剂IX;6-溴靛玉红3′-肟)、作为马来酰亚胺衍生物的SB216763(3-(2,4-二氯苯基)-4-(1-甲基-1H-吲哚-3-基)-1H-吡咯-2,5-二酮)、SB415286(3-[(3-氯-4-羟基苯基)氨基]-4-(2-硝基苯基)-1H-吡咯-2,5-二酮)、作为苯基α溴甲基酮化合物的GSK-3β抑制剂VII(4-二溴苯乙酮)、作为细胞膜透过型的磷酸化肽的L803-mts(别名GSK-3β肽抑制剂;Myr-N-GKEAPPAPPQSpP-NH2)及具有高选择性的CHIR99021(6-[2-[4-(2,4-二氯苯基)-5-(4-甲基-1H-咪唑-2-基)嘧啶-2-基氨基]乙基氨基]吡啶-3-腈)。这些化合物由例如Calbiochem公司、Biomol公司等销售,可以容易地利用。也可以从其它厂商获得,或者还可以自己制作。本发明中使用的GSK-3β抑制剂可以优选为CHIR99021。
使用CHIR99021时,培养基中的浓度通常为0.01μM~100μM、优选0.1μM~10μM、特别优选1μM~5μM。
添加GSK3抑制剂时,期望在多能性干细胞培养开始时进行添加。对添加期间不作特别限定,可以例示1天以上、2天以上或3天以上,优选1天~3天。
工序1中使用的ROCK抑制剂可以使用与上述相同的物质,优选Y-27632。本发明中,添加ROCK抑制剂时,可以是为了抑制将多能性干细胞分离成单个细胞的状态时的细胞凋亡而使用的,对添加期间不作特别限定,可以例示1天以上、或2天以上,优选1天。
就工序1的天数而言,长期培养对胰芽细胞的制造效率没有特别影响,因此没有上限,可以列举例如3天以上、4天以上、5天以上、6天以上、或7天以上。更优选4天。
将通过工序1获得的细胞用含有KGF的培养基培养的工序(工序2)中使用的培养基可以在动物细胞的培养中使用的基础培养基中适当添加KGF而制备。作为基础培养基,包含例如:MEM Zinc Option培养基、IMEM Zinc Option培养基、IMDM培养基、Medium 199培养基、Eagle′s最低需求(EMEM)培养基、αMEM培养基、Dulbecco′s改良伊戈尔(DMEM)培养基、Ham′s F12培养基、RPMI 1640培养基、Fischer′s培养基、及这些的混合培养基等。基础培养基中可以含有血清(例如胎牛血清(FBS)),或者也可以无血清。根据需要,可以含有例如白蛋白、转铁蛋白、KnockOut Serum Replacement(KSR)(ES细胞培养时的血清代替物)(Invitrogen)、N2补充剂(Invitrogen)、B27补充剂(Invitrogen)、脂肪酸、胰岛素、胶原前体、微量元素、2-巯基乙醇、3′-巯基甘油等1种以上的血清代替物,还可以含有脂质、氨基酸、L-谷氨酰胺、GlutaMAX(Invitrogen)、非必需氨基酸(NEAA)、维生素、增殖因子、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类、及这些的类似物等中的1种以上的物质。1个实施方式中,基础培养基为含有B27补充剂的IMEM Zinc Option培养基。
工序2中使用的KGF可以使用与上述相同的物质,KGF的浓度优选使用比上述低的浓度,例如1ng/ml~500ng/ml、优选10ng/ml~100ng/ml。
工序2中使用的培养基可以还含有BMP抑制剂、视黄酸衍生物及Hedgehog通路抑制剂。
工序2中使用的BMP抑制剂可以在与上述同样的条件下使用。
工序2中使用的视黄酸衍生物是指保持了天然视黄酸所具有的功能的、进行了人工修饰的视黄酸,可以列举例如4-[[(5,6,7,8-四氢-5,5,8,8-四甲基-2-萘基)羰基]氨基]-苯甲酸(AM580)(Tamura K,et al.,Cell Differ.Dev.32:17-26(1990))、4-[(1E)-2-(5,6,7,8-四氢-5,5,8,8-四甲基-2-萘基)-1-丙烯-1-基]-苯甲酸(TTNPB)(Strickland S,et al.,Cancer Res.43:5268-5272(1983))、棕榈酸视黄醇酯、视黄醇、视黄醛、3一脱氢视黄酸、3-脱氢视黄醇、3-脱氢视黄醛、或Abe,E.,et al.,Proc.Natl.Acad.Sci.(USA)78:4990-4994(1981)、Schwartz,E.L.et al.,Proc.Am.Assoc.Cancer Res.24:18(1983)、及Tanenaga,K.et al.,Cancer Res.40:914-919(1980)记载的化合物。作为本工序中使用的优选的视黄酸衍生物,可以列举TTNPB。本工序中使用的视黄酸衍生物的浓度可以根据所使用的视黄酸衍生物由本领域技术人员适当选择,例如使用TTNPB作为视黄酸衍生物时,为1nM~100nM,优选5nM~50nM,进一步优选5nM~10nM。
工序2中使用的Hedgehog通路抑制剂是指抑制Sonic hedgehog、Indian Hedgehog和Desert Hedgehog中的任一者与膜受体Patched结合而引起的信号、例如Smoothened的活性的化合物,只要抑制Hedgehog结合到受体上而引起的信号,则没有特别限定,可以列举例如环杷明、介芬胺(jervine)、3-酮-N-氨基乙基氨基己酰二氢肉桂酰(KAAD)-环杷明、CUR-61414、SANT-1、SANT-2、SANT-3、SANT-4、IPI-926、IPI-269609、GDC-0449及NVP-LDE-225。优选KAAD-环杷明。工序2中使用的Hedgehog通路抑制剂的浓度可以根据所使用的Hedgehog通路抑制剂由本领域技术人员适当选择,例如使用KAAD-环杷明作为Hedgehog通路抑制剂时,为0.1nM~1μM、优选1nM~500nM。
本申请说明书及权利要求书中,多能性干细胞是指:具有能够分化为生物体中存在的全部细胞的多能性、且同时兼具增殖能力的干细胞,其中包括例如:胚胎干(ES)细胞(J.A.Thomson et al.(1998),Science 282:1145-1147;J.A.Thomson et al.(1995),Proc.Natl.Acad.Sci.USA,92:7844-7848;J.A.Thomson et al.(1996),Biol.Reprod.,55:254-259;J.A.Thomson and V.S.Marshall(1998),Curr.Top.Dev.Biol.,38:133-165)、来自通过核移植获得的克隆胚的胚胎干(ntES)细胞(T.Wakayama et al.(2001),Science,292:740-743;S.Wakayama et al.(2005),Biol.Reprod.,72:932-936;J.Byrne et al.(2007),Nature,450:497-502)、精子干细胞(“GS细胞”)(M.Kanatsu-Shinohara et al.(2003)Biol.Reprod.,69:612-616;K.Shinohara et al.(2004),Cell,119:1001-1012)、胚胎生殖干细胞(“EG细胞”)(Y.Matsui et al.(1992),Cell,70:841-847;J.L.Resnick et al.(1992),Nature,359:550-551)、人工多能性干(iPS)细胞(K.Takahashi and S.Yamanaka(2006)Cell,126:663-676;K.Takahashi et al.(2007),Cell,131:861-872;J.Yu et al.(2007),Science,318:1917-1920;Nakagawa,M.等,Nat.Biotechnol.26:101-106(2008);WO2007/069666)、来自培养成纤维细胞、骨髓干细胞的多能性细胞(Muse细胞)(WO2011/007900)等。更优选多能性干细胞为人多能性干细胞。
特别优选使用iPS细胞作为移植用胰芽细胞的材料。将获得的胰芽细胞作为药物使用时,从不引起排斥反应的观点出发,期望使用由与移植目标个体的HLA基因型相同或实质相同的体细胞获得的iPS细胞。这里,“实质相同”是指HLA基因型一致到如下程度:对于所移植的细胞,能通过免疫抑制剂抑制免疫反应的程度,例如具有HLA-A、HLA-B及HLA-DR这3个基因座或再加上HLA-C共4个基因座一致的HLA型的体细胞。
其它实施方式中,可以将使用上述工序获得的胰芽细胞作为药物(特别是用于细胞医疗的药物)来利用。就该细胞而言,可以在施予前照射放射线、或通过丝裂霉素C等抑制细胞增殖的药剂进行处理。
将获得的胰芽细胞悬浮于生理盐水等,将细胞悬浮液作为药物使用,对患者的胰脏、肠系膜、脾脏、肝脏及肾脏(特别是肾筋膜下)直接施予,或用聚乙烯醇(PVA)(Qi Z et al.,Cell Transplant.21:525-534(2012))或藻酸(Dufrane D,et al.,Transplantation 90:1054-1062(2010))进行胶囊化而施予,从而可以进行。施予时,该细胞可以与聚乙二醇、明胶、或胶原等支架材料(scaffolding material)一起施予。施予的细胞数可以根据躯体的大小适当增减而使用,例如为1×108~1×1010细胞/个体、优选5×108~1×1010细胞/个体、进一步优选1×109~1×1010细胞/个体。
该含有胰芽细胞的药物可以用于胰疾病的治疗,胰疾病可以例示急性胰炎、慢性胰炎、糖尿病、胰癌、朗格汉斯岛肿瘤等。本发明的胰芽细胞由于在体内被诱导为根据葡萄糖浓度而分泌胰岛素的产胰岛素细胞,因此对糖尿病有效。特别是对产胰岛素细胞死亡的1型糖尿病有效。
本说明书中记载的“细胞”的来源为人及非人动物(例如小鼠、大鼠、牛、马、猪、绵羊、猴子、狗、猫、鸟等),没有特别限定,特别优选来自人的细胞。
以下示出实施例进一步详细说明,但本发明不受实施例任何限定。
实施例1
胰芽细胞分化诱导
人ES细胞株KhES3由京都大学分让,通过现有的方法进行培养(H.Suemori et al.(2006),Biochem.Biophys.Res.Commun.,345:926-932)。(或使用Corning的Synthemax在无饲养层条件下在Essential8中培养。)将KhES3按照图1所述方案向胰芽细胞诱导。详细而言,将相对于培养皿增殖至约70%汇合的人ES细胞株KhES3用CTK溶液(ReproCELL Inc.)剥离,然后用Accutase(Innovative Cell Technologies)分离为一个一个的细胞,在包被有Matrigel(BD)的24孔板或6孔板(Greiner)中按照2.0×105/孔~3.0×105/孔进行播种后,通过以下工序进行向胰芽细胞的分化诱导。
(第1工序)
在含有2%的B27(Life Technologies)的RPMI1640培养基(Nacalai Tesque,Inc.)(0.4ml/孔)中添加100ng/ml活化素A(R&D systems)、3μM CHIR99021(Axon Medchem)及10μMY-27632(Wako Pure Chemical Industries,Ltd.),培养1天。将培养基交换成含有100ng/ml活化素A及2%的B27(Life Technologies)的RPMI1640培养基(0.8ml/孔),培养2天。进一步地,将培养基交换成含有100ng/ml活化素A及2%的B27(Life Technologies)的RPMI1640培养基(0.4ml/孔),培养1天。
(第2工序)
交换成含有50ng/ml KGF(R&D systems)及1%的B-27(Life Technologies)的Improved MEM Zinc Option培养基(Invitrogen公司)(0.8ml/孔),培养3天。然后,交换成含有0-50ng/ml KGF、100ng/ml头蛋白(Peprotech)、5或10nM TTNPB(Santa Cruz Biotechnology)、0.5μM 3-酮-N-氨基乙基-N′-氨基己酰二氢肉桂酰环杷明(KAAD-环杷明或K-CYC)(Toronto Research Chemicals)及1%的B-27的Improved MEM Zinc Option培养基(0.8ml/孔),培养3天。
(第3工序)
将通过第2工序获得的细胞用胰蛋白酶分离为单个细胞,在低粘附96孔板(Lipidure Coat、NOF)中按照3.0×103~3.0×104/孔进行播种。添加含有100ng/ml KGF、100ng/ml头蛋白、50ng/ml EGF(R&D systems)、10μM Y-27632及1%的B-27的Improved MEM Zinc Option培养基(15×104/ml),进一步培养4天至20天。此时,用相同培养基每隔4天进行培养基交换。此外,作为对照,将通过第2工序获得的细胞用胰蛋白酶分离为单个细胞,在包被了Matrigel的24孔板(Greiner)中按照6.0×104~4.8×105/cm2进行播种,通过同样的培养基进行4天粘附培养。同样地,作为对照,对通过第2工序获得的细胞不进行分离,交换为同样的培养基进行培养4天。
在第3工序4天后,将获得的细胞(S3d4)用BD Cytofix/CytopermTM Kit处理后,用抗PDX1抗体(R&D systems)及抗NKX6.1抗体(University of Iowa)染色,利用流式细胞仪检测PDX1阳性细胞率或PDX1及NKX6.1两阳性细胞率,结果确认:第3工序中对细胞进行分离而制作细胞聚集块时,PDX1及NKX6.1两阳性细胞率增加(图2)。此外确认:细胞聚集块由3.0×103个以上构成,从而是足够的。
实施例2
用各种iPS细胞株的研究
4种来自末梢血单核细胞的iPS细胞株(585A1、604B1、692D2及648B1(均为Okita K,et al,Stem Cells.2013 31:458-466))以及1种来自成纤维细胞的iPS细胞株(409B2(Okita K,et al,Nat Methods.2011 8:409-412)均可从京都大学iPS细胞研究所获得。使用由京都大学获得的这些iPS细胞株,通过与上述同样的工序进行向胰芽细胞的分化诱导。
其结果是,确认了:在由5种iPS细胞株中的任一种起始的情况下,通过(第3工序)形成了细胞聚集块(Agg)的方式与粘附培养(2D)相比,PDX1及NKX6.1两阳性细胞率均增加(图3)。
实施例3
培养期间研究
使用人ES细胞株KhES3,将(第3工序)的期间进行0天(S3d0)、1天(S3d1)、2天(S3d2)、4天(S3d4)、8天(S3d8)、12天(S3d12)、16天(S3d16)及20天(S3d20),其结果,进行8天以上时,PDX1及NKX6.1两阳性细胞率变高。此时,在进行12天时达到最大,以后继续进行培养,由此并未确认到效率的特别降低(图4A及B)。
进一步地,使用人ES细胞株KhES3,按照3.0×104/孔使(第3工序)中的细胞聚集块形成,用针对胰芽细胞标志物(PDX1、NKX6.1、SOX9及GATA4)及内分泌细胞标志物(INS、GCG、Somatostatin及Ghrelin)的抗体将培养4天(S3d4)或12天(S3d12)后的细胞聚集进行免疫染色(图5及图6)。确认了:在从细胞聚集块形成起12天(S3d12)时,表达胰芽细胞标志物的细胞增加,出现了较多的表达内分泌细胞标志物的细胞。
将第3工序进行4天后,用含有1%的B-27的Improved MEM Zinc Option培养基(15×104/ml)培养,或用含有100ng/ml KGF、50ng/ml EGF(R&D systems)、1%的B-27的Improved MEM Zinc Option培养基(15×104/ml)培养,与4天后相比,PDX1及NKX6.1两阳性细胞率在12天后均增加(图7B),因此认为:通过将第3工序进行4天以上,可决定细胞的命运。由此,优选第3工序进行至少4天。
ALK5抑制剂II的添加研究
就ALK5抑制剂II(Santa Cruz)的处理而言,通过在第3工序的第2天以后进行1-2天的处理(图8A),从而使PDX1及NKX6.1两阳性细胞率增加(图8B)。
实施例4
胰芽细胞的评价
回收第3工序第12天的细胞聚集块,移植到免疫缺陷小鼠(NOD.CB17-Prkdcscid/J)(Charles river)的附睾周围脂肪组织,30天后回收移植部位,结果生成了与呈管结构的PDX1阳性细胞相邻的胰岛素阳性细胞块,由此确认:所诱导的胰芽细胞在体内形成胰上皮样结构(图9)。
实施例5
诱导胰芽细胞的治疗效果
回收第3工序第4天、第5天、或第12天的细胞聚集块,将培养后的细胞用生理盐水洗涤,制备除去了培养基的细胞聚集块的浓缩物、或除去了培养上清的细胞聚集块的浓缩物。
此外,还回收第3工序第4天的细胞聚集块,在添加了5μM ALK5抑制剂II(Santa Cruz)的含有1%的B-27的Improved MEM Zinc Option培养基(15×104/ml)中培养1天,将培养后的细胞用生理盐水洗涤,制备除去了培养基的细胞聚集块的浓缩物、或除去了培养上清的细胞聚集块的浓缩物。
将获得的细胞聚集块的浓缩物移植到免疫缺陷小鼠(NOD.CB17-Prkdcscid/J)的肾脏筋膜下。
在胰芽细胞向肾筋膜下移植后第150天时,由同一小鼠采集末梢血,用ELISA试剂盒(Mercodia)测定血浆中的人C肽的量,结果14只中的13只确认到了人C肽。此外,在通过任一方法制备的细胞聚集块的浓缩物的移植中,在150天后均能够从血浆中检测到人C肽。进而还确认:随着从移植后30天到150天的时间推移,C肽的量也增加(图10A)。
然后,对于移植后第150天的小鼠,在断食5小时以上后腹腔内施予葡萄糖3g/kg,测定此时的人C肽的增加量,结果在葡萄糖施予组中确认到C肽的量显著增加(图10B)。9只中的5只可确认到该结果。
由以上可确认:所施予的诱导胰芽细胞在生物体内成活后,具有根据血中葡萄糖量而产生胰岛素的功能。由此表明,该诱导胰芽细胞可以作为胰岛素分泌不足的治疗剂。
实施例6
利用粘附培养的方案(图11A)的研究
(第1工序)
将iPS细胞株(585A1)按照2.0×105/孔播种到包被有Matrigel的24孔板中,在含有2%的B27(Life Technologies)的RPMI1640培养基(Nacalai Tesque,Inc.)中添加100ng/ml活化素A(R&D systems)、3μM CHIR99021(Axon Medchem)及10μM Y-27632(Wako Pure Chemical Industries,Ltd.),培养1天。将培养基交换成含有100ng/ml活化素A、1μM CHIR99021及2%的B27(Life Technologies)的RPMI1640培养基,培养2天。进一步地,将培养基交换成含有100ng/ml活化素A及2%的B27(Life Technologies)的RPMI1640培养基,培养1天。
(第2工序)
将通过第1工序获得的培养物的培养基交换成含有50ng/ml KGF(R&D systems)及1%的B-27(Life Technologies)的Improved MEM Zinc Option培养基(Invitrogen公司),培养3天。然后,交换成含有50ng/ml KGF、100ng/ml头蛋白(Peprotech)、10nM TTNPB(Santa Cruz Biotechnology)、0.5μM 3-酮-N-氨基乙基-N′-氨基己酰二氢肉桂酰环杷明(KAAD-环杷明或K-CYC)(Toronto Research Chemicals)及1%的B-27的Improved MEM Zinc Option培养基,培养3天。
(第3工序)
将通过第2工序获得的细胞用胰蛋白酶分离为单个细胞,按照1.6×105~2.4×105/cm2播种在包被有Matrigel的24孔板中。添加含有100ng/ml KGF、100ng/ml头蛋白、50ng/ml EGF(R&D systems)、各浓度的Y-27632及1%的B-27的Improved MEM Zinc Option培养基(15×104/ml),培养4天。
将获得的细胞用BD Cytofix/CytopermTM Kit处理后,用抗PDX1抗体(R&D systems)及抗NKX6.1抗体(University of Iowa)染色,利用流式细胞仪检测PDX1及NKX6.1两阳性细胞率。
第3工序中使用Y-27632时,PDX1及NKX6.1两阳性细胞的含有率呈浓度依赖性地上升,100μM时其效果最高(图11B及C)。
如上所述,可以确认:在第3工序中,将细胞解离后,使用ROCK抑制剂并进行粘附培养,从而产生PDX1及NKX6.1两阳性细胞。
实施例7
利用粘附培养的方案(图12A)和第3工序中的添加剂的研究
(第1工序)
将iPS细胞株(585A1)按照2.0×105/孔播种到包被有Matrigel的24孔板中,在含有2%的B27(Life Technologies)的RPMI1640培养基(Nacalai Tesque,Inc.)中添加100ng/ml活化素A(R&D systems)、3μM CHIR99021(Axon Medchem)及10μM Y-27632(Wako Pure Chemical Industries,Ltd.),培养1天。将培养基交换成含有100ng/ml活化素A、1μM CHIR99021及2%的B27(Life Technologies)的RPMI1640培养基,培养2天。进一步地,将培养基交换成含有100ng/ml活化素A及2%的B27(Life Technologies)的RPMI1640培养基,培养1天。
(第2工序)
交换成含有50ng/ml KGF(R&D systems)及1%的B-27(Life Technologies)的Improved MEM Zinc Option培养基(Invitrogen公司),培养3或4天。然后,交换成含有50ng/ml KGF、100ng/ml头蛋白(Peprotech)、10nM TTNPB(Santa Cruz Biotechnology)、0.5μM 3-酮-N-氨基乙基-N′-氨基己酰二氢肉桂酰环杷明(KAAD-环杷明或K-CYC)(Toronto Research Chemicals)及1%的B-27的Improved MEM Zinc Option培养基,培养2或3天。
(第3工序)
将通过第2工序获得的细胞用胰蛋白酶分离为单个细胞,按照1.6×105~2.4×105/cm2播种在包被有Matrigel的24孔板中。加入含有50ng/ml KGF、100ng/ml头蛋白、10nM TTNPB、0.5μM KAAD-环杷明、10μM Y-27632及1%的B-27的Improved MEM Zinc Option培养基,培养1天。然后,对培养基添加含有100ng/ml KGF、100ng/ml头蛋白、50ng/ml EGF(R&D systems)、各化合物(Y-27632、法舒地尔(HA-1077)、SR3677、GSK269962、H-1152及Blebbistatin)及1%的B-27的Improved MEM Zinc Option培养基(15×104/ml),进一步培养4天。
将获得的细胞用BD Cytofix/CytopermTM Kit处理后,用抗PDX1抗体(R&D systems)及抗NKX6.1抗体(University of Iowa)染色,利用流式细胞仪或图像分析仪检测NKX6.1阳性细胞率或PDX1及NKX6.1两阳性细胞率。
第3工序中使用法舒地尔时,PDX1及NKX6.1两阳性细胞的含有率呈浓度依赖性地上升,50μM时其效果最高(图12B及C)。
第3工序中使用SR3677时,NKX6.1阳性细胞的含有率呈浓度依赖性地上升,5μM时其效果最高(图13A及B)。
第3工序中使用GSK269962时,NKX6.1阳性细胞的含有率呈浓度依赖性地上升,1μM时其效果最高(图13C及D)。
第3工序中使用H-1152时,NKX6.1阳性细胞的含有率呈浓度依赖性地上升,50μM时其效果最高(图14A及B)。
第3工序中使用Blebbistatin时,5μM时PDX1及NKX6.1两阳性细胞的含有率上升,其效果高至20μM为止(图14C及D)。
如上所述,可确认:将细胞解离,在第3工序中使用与第2工序同样的培养基并对细胞进行粘附培养,进而在第3工序中添加ROCK抑制剂或非肌肉肌球蛋白II抑制剂,从而PDX1及NKX6.1两阳性细胞率增加。
- 还没有人留言评论。精彩留言会获得点赞!