催化剂的制作方法
介绍
本发明涉及催化剂。更具体地,本发明涉及特定的金属茂催化剂以及此类催化剂在聚烯烃聚合反应中的用途。还更具体地,本发明涉及不对称金属茂催化剂以及此类催化剂在乙烯聚合反应中的用途。
发明背景
熟知的是,乙烯(以及通常地α-烯烃类)在低压或中压下在某些过渡金属催化剂的存在下可以容易地聚合。这些催化剂通常被称为齐格勒-纳塔型催化剂(ziegler-nattatypecatalyst)。
催化乙烯(以及通常地α-烯烃类)的聚合的这些齐格勒-纳塔型催化剂中的特定的组包括铝氧烷活化剂和金属茂过渡金属催化剂。金属茂包括在两个η5-环戊二烯基型配体之间结合的金属。通常,η5-环戊二烯基型配体选自η5-环戊二烯基、η5-茚基以及η5-芴基。
还熟知的是,这些η5-环戊二烯基型配体可以以无数种方式被改性。一种特定的改性包括在两个环戊二烯基环之间引入连接基以形成柄型金属茂(ansa-metallocene)。
过渡金属的许多柄型金属茂是本领域中已知的。然而,仍存在对于在聚烯烃聚合反应中使用的改进的柄型金属茂催化剂的需求。特别地,仍存在对于具有高聚合活性/效率的新的金属茂催化剂的需求。
还存在对于可以生产具有特定特性的聚乙烯的催化剂的需求。例如,能够产生在聚合物链长上具有相对窄的分散度的线型高密度聚乙烯(lhdpe)的催化剂是合意的。此外,存在对于可以生产具有良好的共聚单体并入和良好的聚合物分子间均匀性性质的聚乙烯共聚物的催化剂的需求。
wo2011/051705公开了基于通过亚乙基基团连接的两个η5-茚基配体的柄型金属茂催化剂。
仍然存在对于具有改进的聚合活性的柄型金属茂催化剂的需求。此外,由于工业寄予此类材料的高价值,还存在对于能够将α-烯烃聚合成高分子量而不损害多分散性的柄型金属茂催化剂的需求。还更合意的是此类催化剂可以容易地合成。
本发明是考虑到前述内容而设计的。
发明概述
根据本发明的第一方面,提供了包含固体甲基铝氧烷支持物材料和本文定义的式(i)的化合物的组合物。
根据本发明的第二方面,提供了如本文定义的组合物作为用于制备聚乙烯均聚物或包含聚乙烯的共聚物的聚合催化剂的用途。
根据本发明的第三方面,提供了用于形成聚乙烯均聚物或聚乙烯共聚物的方法,该方法包括在如本文所定义的组合物的存在下使烯烃单体反应。
发明详述
定义
如本文所使用的术语“烷基”包括提到的典型地具有1个、2个、3个、4个、5个或6个碳原子的直链的或支链的烷基部分。此术语包括提到的诸如甲基、乙基、丙基(正丙基或异丙基)、丁基(正丁基、仲丁基或叔丁基)、戊基(包括新戊基)、己基及类似基团的基团。特别地,烷基可以具有1个、2个、3个或4个碳原子。
如本文所使用的术语“烯基”包括提到的典型地具有2个、3个、4个、5个或6个碳原子的直链的或支链的烯基部分。该术语包括提到的包含1个、2个或3个碳碳双键(c=c)的烯基部分。此术语包括提到的诸如乙烯基(ethenyl)(乙烯基(vinyl))、丙烯基(propenyl)(烯丙基(allyl))、丁烯基、戊烯基以及己烯基的基团,以及其顺式异构体和反式异构体两者。
如本文所使用的术语“炔基”包括提到的典型地具有2个、3个、4个、5个或6个碳原子的直链的或支链的炔基部分。该术语包括提到的包含1个、2个或3个碳碳三键(c≡c)的炔基部分。此术语包括提到的诸如乙炔基、丙炔基、丁炔基、戊炔基以及己炔基的基团。
如本文所使用的术语“烷氧基”包括提到的-o-烷基,其中烷基是直链的或支链的并且包含1个、2个、3个、4个、5个或6个碳原子。在一类实施方案中,烷氧基具有1个、2个、3个或4个碳原子。此术语包括提到的诸如甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、叔丁氧基、戊氧基、己氧基及类似基团的基团。
如本文所使用的术语“芳基”包括提到的包含6个、7个、8个、9个或10个环碳原子的芳香族环体系。芳基常常是苯基,但可以是具有两个或更多个环的多环的环体系,所述两个或更多个环中的至少一个是芳香族的。此术语包括提到的诸如苯基、萘基及类似基团的基团。
如本文所使用的术语“碳环基”包括提到的具有3个、4个、5个、6个、7个或8个碳原子的脂环部分。该基团可以是桥连的或多环的环体系。更经常地,环烷基基团是单环的。此术语包括提到的诸如环丙基、环丁基、环戊基、环己基、降冰片基(norbornyl)、双环[2.2.2]辛基及类似基团的基团。
如本文所使用的术语“杂环基”包括提到的具有从3个、4个、5个、6个、7个、8个、9个或10个环原子的饱和的(例如杂环烷基)或不饱和的(例如杂芳基)杂环部分,所述环原子中的至少一个选自氮、氧、磷、硅和硫。特别地,杂环基包括3元至10元的环或环体系,并且更特别地是5元或6元的环,其可以是饱和或不饱和的。
杂环部分例如选自氧杂环丙基(oxiranyl)、氮杂环丙基(azirinyl)、1,2-氧硫杂环戊烷基(1,2-oxathiolanyl)、咪唑基、噻吩基、呋喃基、四氢呋喃基、吡喃基、噻喃基(thiopyranyl)、噻蒽基(thianthrenyl)、异苯并呋喃基、苯并呋喃基、色烯基(chromenyl)、2h-吡咯基、吡咯基、吡咯啉基、吡咯烷基、咪唑基、咪唑烷基、苯并咪唑基、吡唑基、吡嗪基、吡唑烷基、噻唑基、异噻唑基、二噻唑基、噁唑基、异噁唑基、吡啶基、吡嗪基、嘧啶基、哌啶基、哌嗪基、哒嗪基、吗啉基、硫代吗啉基(thiomorpholinyl)尤其是硫代吗啉代(thiomorpholino)、吲嗪基、异吲哚基、3h-吲哚基、吲哚基、苯并咪唑基、香豆酰基(cumaryl)、吲唑基、三唑基、四唑基、嘌呤基、4h-喹嗪基(quinolizinyl)、异喹啉基、喹啉基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、八氢异喹啉基、苯并呋喃基、二苯并呋喃基、苯并噻吩基、二苯并噻吩基、酞嗪基(phthalazinyl)、萘啶基、喹喔啉基、喹唑啉基、喹唑啉基、噌啉基、蝶啶基、咔唑基、β-咔啉基(β-carbolinyl)、菲啶基、吖啶基、
如本文所使用的术语“杂芳基”包括提到的具有5个、6个、7个、8个、9个或10个环原子的芳香族杂环体系,所述环原子中的至少一个选自氮、氧和硫。该基团可以是具有其中至少一个是芳香族的两个或更多个环的多环的环体系,但更经常是单环的。该术语包括提到的诸如以下的基团:嘧啶基、呋喃基、苯并[b]噻吩基、噻吩基、吡咯基、咪唑基、吡咯烷基、吡啶基、苯并[b]呋喃基、吡嗪基、嘌呤基、吲哚基、苯并咪唑基、喹啉基、吩噻嗪基、三嗪基、酞嗪基、2h-色烯基、噁唑基、异噁唑基、噻唑基、异吲哚基、吲唑基、嘌呤基、异喹啉基、喹唑啉基、蝶啶基及类似基团。
如本文所使用的术语“卤素(halogen)”或“卤素(halo)”包括提到的f、cl、br或i。特别地,卤素可以是f或cl,其中cl是更常见的。
如本文所使用的关于部分的术语“被取代的”意指在所述部分中的氢原子中的一个或更多个,特别地多达5个,更特别地1个、2个或3个,彼此独立地被对应数目的所描述的取代基替代。如本文所使用的术语“任选地被取代的”意指被取代的或未被取代的。
当然,将理解的是,取代基仅仅在它们在化学上是可能的位置处,本领域技术人员能够判断(实验地或理论地)特定的取代是否是可能的,而不需要过多的努力。例如,如果结合至具有不饱和(例如烯属)键的碳原子,那么具有游离氢的氨基或羟基基团可能是不稳定的。另外,当然将理解的是,本文描述的取代基可以自身被任何取代基取代,服从如技术人员所认可的前面提及的对合适的取代的限制。
催化组合物
如上文讨论的,本发明提供了包含固体甲基铝氧烷支持物材料和以下示出的式(i)的化合物的组合物:
其中:
r1和r2各自独立地为(1-2c)烷基;
r3和r4各自独立地为氢或(1-4c)烷基,或者r3和r4连接,使得当与它们所附接的原子组合时,它们形成6元稠合芳香族环,所述6元稠合芳香族环任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、卤素、氨基、硝基、氰基、(1-6c)烷基氨基、[(1-6c)烷基]2氨基和-s(o)2(1-6c)烷基的一个或更多个基团取代;
r5和r6各自独立地为氢或(1-4c)烷基,或者r5和r6连接,使得当与它们所附接的原子组合时,它们形成6元稠合芳香族环,所述6元稠合芳香族环任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、卤素、氨基、硝基、氰基、(1-6c)烷基氨基、[(1-6c)烷基]2氨基和-s(o)2(1-6c)烷基的一个或更多个基团取代;
q是包含1个、2个或3个选自c、n、o、s、ge、sn、p、b或si或其组合的桥连原子的桥连基,并且任选地被选自羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基的一个或更多个基团取代;
x选自锆、钛或铪;并且
每个y基团独立地选自卤素、氢负离子(hydride)、膦酸化、磺酸化或硼酸化的阴离子、或任选地被选自(1-6c)烷基、卤素、硝基、氨基、苯基、(1-6c)烷氧基、-c(o)nrxry或si[(1-4c)烷基]3的一个或更多个基团取代的(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基或芳氧基基团;
其中rx和ry独立地为(1-4c)烷基;
条件是:
i)当r3和r4为氢或(1-4c)烷基时,r5和r6不连接形成被四个甲基基团取代的稠合6元芳香族环;和
ii)当r5和r6为氢或(1-4c)烷基时,r3和r4不连接形成被四个甲基基团取代的稠合6元芳香族环。
在实施方案中,化合物具有根据式(i)的结构,其中
r1和r2各自独立地为(1-2c)烷基;
r3和r4各自独立地为氢或(1-4c)烷基,或者r3和r4连接,使得当与它们所附接的原子组合时,它们形成6元稠合芳香族环,所述6元稠合芳香族环任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、卤素、氨基、硝基、氰基、(1-6c)烷基氨基、[(1-6c)烷基]2氨基和-s(o)2(1-6c)烷基的一个或更多个基团取代;
r5和r6各自独立地为氢或(1-4c)烷基,或者r5和r6连接,使得当与它们所附接的原子组合时,它们形成6元稠合芳香族环,所述6元稠合芳香族环任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、卤素、氨基、硝基、氰基、(1-6c)烷基氨基、[(1-6c)烷基]2氨基和-s(o)2(1-6c)烷基的一个或更多个基团取代;
q是包含1个、2个或3个选自c、n、o、s、ge、sn、p、b或si或其组合的桥连原子的桥连基,并且任选地被选自羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基的一个或更多个基团取代;
x选自锆、钛或铪;并且
每个y基团独立地选自卤素、氢负离子、膦酸化、磺酸化或硼酸化的阴离子、或任选地被卤素、硝基、氨基、苯基、-c(o)nrxry、(1-6c)烷氧基或si[(1-4c)烷基]3取代的(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基或芳氧基基团;
其中rx和ry独立地为(1-4c)烷基;
条件是:
i)当r3和r4为氢或(1-4c)烷基时,r5和r6不连接形成被四个甲基基团取代的稠合6元芳香族环;和
ii)当r5和r6为氢或(1-4c)烷基时,r3和r4不连接形成被四个甲基基团取代的稠合6元芳香族环。
在另一个实施方案中,化合物具有根据式(i)的结构,其中
r1和r2各自独立地为(1-2c)烷基;
r3和r4各自独立地为氢或(1-4c)烷基,或者r3和r4连接,使得当与它们所附接的原子组合时,它们形成6元稠合芳香族环,所述6元稠合芳香族环任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、卤素、氨基、硝基、氰基、(1-6c)烷基氨基、[(1-6c)烷基]2氨基和-s(o)2(1-6c)烷基的一个或更多个基团取代;
r5和r6各自独立地为氢或(1-4c)烷基,或者r5和r6连接,使得当与它们所附接的原子组合时,它们形成6元稠合芳香族环,所述6元稠合芳香族环任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、卤素、氨基、硝基、氰基、(1-6c)烷基氨基、[(1-6c)烷基]2氨基和-s(o)2(1-6c)烷基的一个或更多个基团取代;
q是包含1个、2个或3个选自c、n、o、s、ge、sn、p、b或si或其组合的桥连原子的桥连基,并且任选地被选自羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基的一个或更多个基团取代;
x选自锆、钛或铪;并且
至少一个y基团是任选地被选自(1-6c)烷基的一个或更多个基团取代的芳氧基,并且另一个y基团独立地选自卤素、氢负离子、膦酸化、磺酸化或硼酸化的阴离子、或任选地被选自(1-6c)烷基、卤素、硝基、氨基、苯基、-c(o)nrxry、(1-6c)烷氧基或si[(1-4c)烷基]3的一个或更多个基团取代的(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基或芳氧基基团;
其中rx和ry独立地为(1-4c)烷基;
条件是:
i)当r3和r4为氢或(1-4c)烷基时,r5和r6不连接形成被四个甲基基团取代的稠合6元芳香族环;和
ii)当r5和r6为氢或(1-4c)烷基时,r3和r4不连接形成被四个甲基基团取代的稠合6元芳香族环。
已经考虑到上述条件,将理解的是,未被所附权利要求的范围所涵盖的特定主题(motif)如下:
将理解的是,上文呈现的结构式(i)旨在以清楚的方式显示取代基。下面的可选择的表示中示出了基团的空间排列的更具代表性的图示:
还将理解的是,当取代基r3和r4分别不同于取代基r5和r6时,本发明的化合物可以作为内消旋异构体或外消旋异构体存在,并且本发明包括这两种异构体形式。本领域的技术人员将理解,式(i)的化合物的异构体的混合物可以被用于催化应用,或者异构体可以被分离并被单独地使用(使用本领域公知的技术,诸如例如分级结晶)。
当与α-烯烃的聚合中使用的当前金属茂化合物/组合物相比时,本发明的组合物呈现优良的催化性能。特别地,当与类似的二氧化硅负载的甲基铝氧烷(ssmao)和层状双氢氧化物负载的甲基铝氧烷(layereddoublehydroxide-supportedmethylaluminoxane)(ldhmao)催化剂组合物相比时,本发明的固体mao组合物在α-烯烃的均聚和共聚中表现出显著增加的催化活性。此外,通过在本发明的组合物的存在下的α-烯烃聚合产生的聚合物典型地具有比使用其他催化剂制备的聚合物更高的分子量,而没有伴随的多分散性的增加。此类材料被工业高度重视(highlyvaluedbyindustry)。此外,通过在本发明的组合物存在下的α-烯烃聚合产生的聚乙烯共聚物在聚乙烯中表现出良好的共聚单体并入,具有良好的分子间均匀性。
固体甲基铝氧烷(mao)(通常被称为聚甲基铝氧烷)与其他甲基铝氧烷(mao)不同,因为它不溶于烃类溶剂并且因此充当非均相支持物系统(heterogeneoussupportsystem)。可以使用任何合适的固体mao支持物。
在实施方案中,固体mao支持物不溶于甲苯和己烷。
在另一个实施方案中,固体mao支持物呈颗粒形式。合适地,固体mao支持物的颗粒的形状是球形的或基本上是球形的。
在特别合适的实施方案中,固体mao支持物是如us2013/0059990中所描述的并且从tosohfinechemcorporation,japan可获得。
在实施方案中,固体mao支持物根据以下方案制备:
固体mao支持物的性质可以通过改变在其合成期间使用的一个或更多个加工变量(processingvariable)来调节。例如,在上文概述的方案中,固体mao支持物的性质可以通过经由固定alme3的量并且改变苯甲酸的量而改变al:o比例来调节。示例性的al:o比例为1:1、1.1:1、1.2:1、1.3:1、1.4:1和1.6:1。合适地,al:o比例为1.2:1或1.3:1。可选择地,固体mao支持物的性质可以通过固定苯甲酸的量并且改变alme3的量来调节。
在另一个实施方案中,固体mao支持物根据以下方案制备:
在上述方案中,步骤1和2可以保持不变,并且步骤2被改变。步骤2的温度可以为70℃-100℃(例如70℃、80℃、90℃或100℃)。步骤2的持续时间可以为从12小时至28小时(例如12小时、20小时或28小时)。
式(i)的化合物可以通过一种或更多种离子相互作用或共价相互作用固定在固体mao支持物上。
在实施方案中,组合物还包含一种或更多种合适的活化剂。合适的活化剂是本领域公知的并且包括有机铝化合物(例如烷基铝化合物)。特别合适的活化剂包括铝氧烷(例如甲基铝氧烷(mao))、三异丁基铝(tiba)、二乙基铝(deac)和三乙基铝(tea)。
在另一个实施方案中,固体mao支持物包含选自m(c6f5)3的另外的化合物,其中m为铝或硼或m’r2,其中m’为锆或镁并且r为(1-10c)烷基(例如甲基或辛基)。
在实施方案中,r3和r4各自独立地为氢或(1-4c)烷基,或者r3和r4连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基、硝基、氰基、(1-4c)烷基氨基、[(1-4c)烷基]2氨基和-s(o)2(1-4c)烷基的一个或更多个基团取代;并且
r5和r6各自独立地为氢或(1-4c)烷基,或者r5和r6连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基、硝基、氰基、(1-4c)烷基氨基、[(1-4c)烷基]2氨基和-s(o)2(1-4c)烷基的一个或更多个基团取代。
在另一个实施方案中,r3和r4各自独立地为氢或(1-4c)烷基,或者r3和r4连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;并且
r5和r6各自独立地为氢或(1-4c)烷基,或者r5和r6连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基、芳基、杂芳基、碳环和杂环的一个或更多个基团取代,其中每个芳基、杂芳基、碳环和杂环基团任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代。
在另一个实施方案中,r3和r4各自独立地为氢或(1-4c)烷基,或者r3和r4连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基、芳基和杂芳基的一个或更多个基团取代,其中每个芳基和杂芳基基团任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;并且
r5和r6各自独立地为氢或(1-4c)烷基,或者r5和r6连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基、芳基和杂芳基的一个或更多个基团取代,其中每个芳基和杂芳基基团任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代。
在另一个实施方案中,r3和r4各自独立地为氢或(1-4c)烷基,或者r3和r4连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基和苯基的一个或更多个基团取代,其中每个苯基基团任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;并且
r5和r6各自独立地为氢或(1-4c)烷基,或者r5和r6连接,使得当与它们所附接的原子组合时,它们形成稠合6元芳香族环,所述稠合6元芳香族环任选地被选自(1-4c)烷基和苯基的一个或更多基团取代,其中每个苯基基团任选被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代。
在另一个实施方案中:
i)当r3和r4为氢或(1-4c)烷基并且r5和r6连接形成稠合6元芳香族环时,所述环任选地被如本文所定义的一个或两个取代基取代;或者
ii)当r5和r6为氢或(1-4c)烷基并且r3和r4连接形成稠合6元芳香族环时,所述环任选地被如本文所定义的一个或两个取代基取代。
在另一个实施方案中,r1是甲基且r2是甲基或乙基。
在另一个实施方案中,q是包含1个、2个或3个选自c、b或si或其组合的桥连原子的桥连基,并且任选地被选自羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基的一个或更多个基团取代;
在另一个实施方案中,q是包含1个、2个或3个选自c、si或其组合的桥连原子的桥连基,并且任选地被选自羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基的一个或更多个基团取代。
在另一个实施方案中,q是选自-[c(ra)(rb)-c(rc)(rd)]-和-[si(re)(rf)]-的桥连基,其中ra、rb、rc、rd、re和rf独立地选自氢、羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基。合适地,ra、rb、rc和rd各自为氢,且re和rf各自独立地为(1-6c)烷基、(2-6c)烯基或苯基。更合适地,ra、rb、rc和rd各自为氢,并且re和rf各自独立地为(1-4c)烷基、(2-4c)烯基或苯基。
在实施方案中,q是具有式-[si(re)(rf)]-的桥连基,其中re和rf各自独立地选自甲基、乙基、丙基、烯丙基或苯基。合适地,q是具有式-[si(re)(rf)]-的桥连基,其中re和rf各自独立地选自甲基、乙基、丙基和烯丙基。更合适地,re和rf各自为甲基。
在另一个实施方案中,每个y基团独立地选自卤素、氢负离子、膦酸化、磺酸化或硼酸化的阴离子、或任选地被选自(1-6c)烷基、卤素、硝基、氨基、苯基、(1-6c)烷氧基、-c(o)nrxry或si[(1-4c)烷基]3的一个或更多个基团取代的(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基、芳基或芳氧基基团,其中rx和ry独立地为(1-4c)烷基;
在另一个实施方案中,每个y独立地选自卤素或(1-2c)烷基或芳氧基基团,所述(1-2c)烷基或芳氧基基团任选地被选自(1-6c)烷基、卤素、苯基或si[(1-4c)烷基]3的一个或更多个取代基取代。合适地,每个y是卤素。更合适地,每个y是cl。
在另一个实施方案中,一个y基团是任选地被1个、2个或3个独立地选自(1-3c)烷基的基团取代的苯氧基基团,且另一个y基团是卤素。
在另一个实施方案中,每个y独立地选自卤素或(1-2c)烷基基团,所述(1-2c)烷基基团任选地被卤素、苯基或si[(1-4c)烷基]3取代。合适地,每个y是卤素。更合适地,每个y是cl。
在另一个实施方案中,x是锆或铪。合适地,x是锆。
在另一个实施方案中,式(i)的化合物具有以下示出的式(ii)、式(iii)或式(iv)中的任一种:
其中:
r1、r2、r3、r4、r5、r6、q、x和y各自独立地如上文任一段中所定义;
每个r7、r8和r9独立地选自上文任一段中所定义的任何环取代基(例如当(i)r3和r4、及(ii)r5和r6之一或二者连接时形成的6元芳香族环上存在的任何取代基);
n、m和o独立地为0、1、2、3或4。
合适地,n、m和o独立地为0、1或2。更合适地,n、m和o独立地为0、1或2。
在另一个实施方案中,在式(ii)、式(iii)或式(iv)中,每个r7、r8和r9独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代。
合适地,在式(ii)、式(iii)或式(iv)中,每个r7、r8和r9独立地选自氢、甲基、正丁基、叔丁基和未被取代的苯基。
在另一个实施方案中,在式(ii)、式(iii)或式(iv)中,r1是甲基且r2是甲基或乙基。
在另一个实施方案中,在式(ii)、式(iii)或式(iv)中,q是选自-[c(ra)(rb)-c(rc)(rd)]-和-[si(re)(rf)]-的桥连基,其中ra、rb、rc、rd、re和rf独立地选自氢、羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基。合适地,q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自氢、羟基和(1-6c)烷基。更合适地,q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自(1-6c)烷基(例如甲基、乙基、丙基或烯丙基)。
在特定实施方案中,式(i)的化合物具有式(ii)、式(iii)或式(iv)中的任一种,其中
r1和r2各自独立地为(1-2c)烷基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;
n、m和o各自独立地为1或2;
q是选自-[c(ra)(rb)-c(rc)(rd)]-和-[si(re)(rf)]-的桥连基,其中ra、rb、rc、rd、re和rf独立地选自氢、羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基;
每个y独立地选自卤素或(1-2c)烷基基团,所述(1-2c)烷基基团任选地被卤素、苯基或si[(1-4c)烷基]3取代;并且
x是锆或铪。
在另一个特定实施方案中,化合物具有式(ii)、式(iii)或式(iv)中的任一种,其中
r1和r2各自独立地为(1-2c)烷基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;
n、m和o各自独立地为1或2;
q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自氢、羟基和(1-6c)烷基;
每个y独立地选自卤素、(1-2c)烷基或任选地被选自(1-4c)烷基、卤素、苯基或si[(1-4c)烷基]3的一个或更多个取代基取代的芳氧基基团;并且
x是锆或铪。
在另一个特定实施方案中,化合物具有式(ii)、式(iii)或式(iv)中的任一种,其中
r1是甲基且r2是甲基或乙基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;
n、m和o各自独立地为1或2;
q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自氢、羟基和(1-6c)烷基;
每个y独立地选自卤素、(1-2c)烷基或任选地被选自(1-4c)烷基、卤素、苯基或si[(1-4c)烷基]3的一个或更多个取代基取代的芳氧基基团;并且
x是锆或铪。
在另一个特定实施方案中,化合物具有式(ii)、式(iii)或式(iv)中的任一种,其中
r1是甲基且r2是甲基或乙基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;
n、m和o各自独立地为1或2;
q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自(1-6c)烷基;
每个y独立地选自卤素、(1-2c)烷基或任选地被选自(1-4c)烷基、卤素、苯基或si[(1-4c)烷基]3的一个或更多个取代基取代的芳氧基基团;并且
x是锆或铪。
在另一个实施方案中,式(i)的化合物具有以下示出的式(v)、式(vi)或式(vii)中的任一种:
其中
r1、r2、r3、r5、r6、q、x和y各自独立地如上文任一段中所定义;
r7、r8和r9各自独立地如上文任一段中所定义;并且
r4如上文任一段中所定义。合适地,r4是氢。
合适地,式(v)、式(vi)或式(vii)中的每个r7、r8和r9独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代。
合适地,式(v)、式(vi)或式(vii)中的每个r7、r8和r9独立地选自氢、甲基、正丁基、叔丁基和未被取代的苯基。
在另一个实施方案中,在式(v)、式(vi)或式(vii)中,q是选自-[c(ra)(rb)-c(rc)(rd)]-和-[si(re)(rf)]-的桥连基,其中ra、rb、rc、rd、re和rf独立地选自氢、羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基。合适地,q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自氢、羟基和(1-6c)烷基。更合适地,q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自(1-6c)烷基(例如甲基、乙基、丙基或烯丙基)。
在另一个实施方案中,在式(v)、式(vi)或式(vii)中,r1是甲基且r2是甲基或乙基。
在特定实施方案中,式(i)的化合物具有式(v)、式(vi)或式(vii)中的任一种,其中
r1和r2各自独立地为(1-2c)烷基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;
q是选自-[c(ra)(rb)-c(rc)(rd)]-和-[si(re)(rf)]-的桥连基,其中ra、rb、rc、rd、re和rf独立地选自氢、羟基、(1-6c)烷基、(2-6c)烯基、(2-6c)炔基、(1-6c)烷氧基和芳基;
每个y独立地选自卤素或任选地被卤素、苯基或si[(1-4c)烷基]3取代的(1-2c)烷基基团;并且
x是锆或铪。
在另一个特定实施方案中,式(i)的化合物具有式(v)、式(vi)或式(vii)中的任一种,其中
r1和r2各自独立地为(1-2c)烷基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、甲基、正丁基、叔丁基和未被取代的苯基;
q是选自-[c(ra)(rb)-c(rc)(rd)]-和-[si(re)(rf)]-的桥连基,其中ra、rb、rc和rd各自为氢,且re和rf各自独立地为(1-6c)烷基、(2-6c)烯基或苯基;
每个y独立地选自卤素或任选地被卤素、苯基或si[(1-4c)烷基]3取代的(1-2c)烷基基团;并且
x是锆或铪。
在另一个特定实施方案中,化合物具有式(v)、式(vi)或式(vii)中的任一种,其中
r1和r2各自独立地为(1-2c)烷基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、甲基、正丁基、叔丁基和未被取代的苯基;
q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自氢、羟基和(1-6c)烷基;
每个y独立地选自卤素、(1-2c)烷基或任选地被选自(1-4c)烷基、卤素、苯基或si[(1-4c)烷基]3的一个或更多个取代基取代的芳氧基基团;并且
x是锆或铪。
在另一个特定实施方案中,化合物具有式(v)、式(vi)或式(vii)中的任一种,其中
r1是甲基且r2是甲基或乙基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、甲基、正丁基、叔丁基和未被取代的苯基;
q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自氢、羟基和(1-6c)烷基;
每个y独立地选自卤素、(1-2c)烷基或任选地被选自(1-4c)烷基、卤素、苯基或si[(1-4c)烷基]3的一个或更多个取代基取代的芳氧基基团;并且
x是锆或铪。
在另一个特定实施方案中,化合物具有式(v)、式(vi)或式(vii)中的任一种,其中
r1是甲基且r2是甲基或乙基;
r3、r4、r5和r6各自独立地为氢或(1-4c)烷基;
r7、r8和r9各自独立地选自氢、(1-4c)烷基和苯基,所述苯基任选地被选自(1-4c)烷基、(2-4c)烯基、(2-4c)炔基、(1-4c)烷氧基、卤素、氨基和硝基的一个或更多个基团取代;
n、m和o各自独立地为1或2;
q是桥连基-[si(re)(rf)]-,其中re和rf独立地选自(1-6c)烷基;
每个y独立地选自卤素、(1-2c)烷基或任选地被选自(1-4c)烷基、卤素、苯基或si[(1-4c)烷基]3的一个或更多个取代基取代的芳氧基基团;并且
x是锆或铪。
在另一个实施方案中,式(i)的化合物具有任何以下结构:
在另一个实施方案中,式(i)的化合物具有以下结构:
在另一方面中,本发明提供如上文所定义的式(i)的化合物。
合成
构成本发明的一部分的化合物可以通过本领域已知的任何合适的方法合成。用于制备构成本发明的一部分的化合物的方法的特定实例在所附实施例中列出。
合适地,本发明的化合物通过以下来制备:
(i)使式a的化合物:
(其中r1、r2、r3、r4、r5、r6和q各自如上文所定义,并且m是li、na或k)
与式b的化合物:
x(y’)4
b
(其中x如上文所定义且y’是卤素(特别是氯或溴))
在合适的溶剂的存在下反应以形成式(ia)的化合物:
并任选地在此之后:
(ii)在合适的溶剂的存在下,使上述式ia的化合物与my”(其中m如上文所定义且y”是如本文所定义的除卤素以外的基团y)反应以形成以下示出的式(ib)的化合物
合适地,在上文定义的方法的步骤(i)中,m是li。
合适地,式b的化合物作为溶剂化物提供。特别地,式b的化合物可以作为x(y’)4.thfp提供,其中p为整数(例如2)。
任何合适的溶剂可以被用于上文定义的方法的步骤(i)。特别合适的溶剂是甲苯或thf。
如果需要其中y不是卤素的式(i)的化合物,则上述式(ia)的化合物可以以步骤(ii)中所定义的方式进一步反应,以提供式(ib)的化合物。
任何合适的溶剂可以被用于上文定义的方法的步骤(ii)。合适的溶剂可以是例如乙醚、甲苯、thf、二氯甲烷、氯仿、己烷、dmf、苯等。
其中q为-[si(re)(rf)]-的式a的化合物通常可以通过以下来制备:
(i)使式d的化合物
(其中m是锂、钠或钾;并且r1和r2如上文所定义)与1当量的具有以下示出的式e的化合物反应
si(re)(rf)(cl)2
e
(其中re和rf如上文所定义)
以形成以下示出的式f的化合物:
(ii)使式f的化合物与以下示出的式g的化合物反应:
(其中r3、r4、r5和r6如上文所定义,且m是锂、钠或钾)。
式d和式g的化合物可以通过本领域公知的技术容易地合成。
任何合适的溶剂可以被用于以上方法的步骤(i)。特别合适的溶剂是thf。
类似地,任何合适的溶剂可以被用于以上方法的步骤(ii)。合适的溶剂可以是例如甲苯、thf、dmf等。
本领域技术人员将能够选择用于此类合成的合适的反应条件(例如温度、压力、反应时间、搅拌等)。
其中q为-ch2-ch2-的式a的化合物通常可通过以下来制备:
(i)使式d的化合物
(其中m是锂、钠或钾;并且r1和r2如上文所定义)与过量的brch2ch2br反应以形成以下示出的式h的化合物:
(其中r1和r2如上文所定义);和
(ii)使式h的化合物与以下示出的式g的化合物反应:
(其中r3、r4、r5和r6如上文所定义,且m是锂、钠或钾)。
式d和式g的化合物可以通过本领域公知的技术容易地合成。
任何合适的溶剂可以被用于以上方法的步骤(i)。特别合适的溶剂是thf。
类似地,任何合适的溶剂可以被用于以上方法的步骤(ii)。合适的溶剂可以是例如甲苯、thf、dmf等。
本领域技术人员将能够选择用于此类合成的合适的反应条件(例如温度、压力、反应时间、搅拌等)。
应用
如前所述,本发明的组合物作为聚乙烯均聚反应和共聚反应的催化剂是非常有效的。
如上文讨论的,当与α-烯烃的聚合中使用的当前金属茂化合物相比时,本发明的组合物呈现优良的催化性能。特别地,当与类似的二氧化硅负载的甲基铝氧烷(ssmao)和层状双氢氧化物负载的甲基铝氧烷(ldhmao)催化剂组合物相比时,本发明的固体mao组合物在α-烯烃的均聚和共聚中呈现显著增加的催化活性。此外,通过在本发明的组合物的存在下的α-烯烃聚合产生的聚合物典型地具有比使用其他催化剂制备的聚合物更高的分子量,而没有伴随的多分散性的增加。此类材料被工业高度重视。此外,在本发明的组合物存在下通过α-烯烃聚合产生的聚乙烯共聚物在聚乙烯中表现出良好的共聚单体并入,具有良好的分子间均匀性。
因此,如上文讨论的,本发明还提供了本文定义的组合物作为聚合催化剂,特别是在聚乙烯的制备中的用途。
在一个实施方案中,聚乙烯是由聚合的乙烯单体制成的均聚物。
在另一个实施方案中,聚乙烯是由聚合的乙烯单体制成的共聚物,其包含1重量%-10重量%的(4-8c)α-烯烃(以单体的总重量计)。合适地,(4-8c)α-烯烃为1-丁烯、1-己烯、1-辛烯或其混合物。
在另一个实施方案中,聚乙烯是聚乙烯蜡。聚乙烯蜡将被本领域技术人员理解为低分子量聚乙烯,其通常具有1000da-15,000da的平均分子量。合适地,聚乙烯蜡具有1000da-6000da的平均分子量。
如上文讨论的,本发明还提供了用于形成聚烯烃(例如聚乙烯)的方法,该方法包括在本文定义的组合物的存在下使烯烃单体反应。
在另一个实施方案中,烯烃单体是乙烯单体。
在另一个实施方案中,烯烃单体是乙烯单体,其包含1重量%-10重量%的(4-8c)α-烯烃(以单体的总重量计)。合适地,(4-8c)α-烯烃为1-丁烯、1-己烯、1-辛烯或其混合物。
在另一个实施方案中,聚烯烃是聚乙烯蜡,其通过在如本文定义的组合物的存在下使乙烯单体和h2反应形成。任选地,一定量的1-丁烯可以与乙烯单体和h2一起被包含。
烯烃聚合的领域技术人员将能够选择用于此类聚合反应的合适的反应条件(例如温度、压力、反应时间等)。本领域技术人员还将能够操纵工艺参数以便生产具有特定性质的聚烯烃。
在特定实施方案中,聚烯烃是聚乙烯。
实施例
仅出于参考和说明的目的,现将参照附图描述本发明的实施例,在附图中:
图1示出了前配体(pro-ligand)[eb(tbu2flu,i*)h2]的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图2示出了前配体[me2si(ind*)cl]的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图3示出了前配体[ipr2si(ind*)cl]的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图4示出了前配体[me,丙基si(ind*)cl]的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图5示出了前配体[sb(flu,i*)h2]的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图6示出了[sb(tbu2flu,i*)h2]的分子结构,50%椭圆体,为清楚起见省略了氢原子;黑色:碳,粉红色:硅。选择的键长
图7示出了[sb(tbu2flu,i*)zrcl2]的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图8示出了[sb(tbu2flu,i*)hfcl2]的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图9示出了[sb(tbu2flu,i*)zrcl2]的分子结构。
图10示出了[sb(tbu2flu,i*)hfcl2]的分子结构。
图11示出了对于使用以下的固体mao负载的催化体系进行乙烯的均聚的聚合生产率(polymerizationproductivity)(kg(pe)g(催化剂)-1h-1)对时间(秒):(a)外消旋-[(ebi*)zrcl2]、(b)内消旋-[(ebi*)zrcl2]、(c)外消旋-[(sbi*)zrcl2]和(d)[sb(tbu2flu,i*)zrcl2]。聚合条件:5ml庚烷,p乙烯=120psi,t=70℃且n(tea)=10μmol。
图12示出了对于使用以下的固体mao负载的催化体系进行乙烯的均聚的聚合生产率(kg(pe)g(催化剂)-1h-1)对时间(秒):(a)外消旋-[(ebi*)zrcl2]、(b)内消旋-[(ebi*)zrcl2]、(c)外消旋-[(sbi*)zrcl2]和(d)[sb(tbu2flu,i*)zrcl2]。聚合条件:5ml庚烷,p乙烯=120psi,t=80℃且n(tea)=10μmol。
图13示出了对于使用以下的固体mao负载的催化体系进行乙烯和1-己烯的共聚的活性对时间:(a)外消旋-[(ebi*)zrcl2]、(b)内消旋-[(ebi*)zrcl2]、(c)外消旋-[(sbi*)zrcl2]、(d)[sb(tbu2flu,i*)zrcl2]。聚合条件:5ml庚烷,p乙烯=120psi,t=70℃,[己烯]进料=5体积%,且n(tea)=15μmol。
图14示出了对于使用固体mao负载的催化体系、在改变1-己烯进料的情况下进行乙烯和1-己烯的共聚的活性对时间。聚合条件:5ml庚烷,p乙烯=120psi,t=70℃,且n(tea)=15μmol。
图15示出了对于使用固体mao负载的催化体系、在改变1-己烯进料的情况下进行乙烯和1-己烯的共聚的活性对时间。聚合条件:5ml庚烷,p乙烯=80psi,t=70℃,且n(tea)=15μmol。
图16示出了et2sb(tbu2flu,i*)zrcl2的分子结构。
图17示出了me,propsb(tbu2flu,i*)zrcl2的分子结构。
图18示出了sb(tbu2flu,i*,3-乙基)zrcl2的分子结构。
图19示出了sb(cp,i*)zrcl2的分子结构。图20示出了
图20示出了sb(cp,i*)hfcl2的分子结构。
图21示出了sb(cp,i*)zrcl(o-2,6-me2-c6h3)的分子结构。
图22示出了et2sb(tbu2flu,i*)zrcl2的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图23示出了me,propsb(tbu2flu,i*)zrcl2的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图24示出了sb(tbu2flu,i*,3-乙基)zrcl2的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图25示出了sb(cp,i*)zrcl2的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图26示出了sb(cp,i*)hfcl2的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图27示出了sb(cp,i*)zrcl(o-2,6-me2-c6h3)的1hnmr光谱分析(氯仿-d1,298k,400mhz)。
图28示出了使用固体mao负载的/sb(tbu2flu,i*)zrcl2(正方形)、固体mao负载的/sb(tbu2flu,i*,3-乙基)zrcl2(圆形)、固体mao负载的/et2sb(tbu2flu,i*)zrcl2(三角形)、固体mao负载的/sb(cp,i*)zrcl2(倒三角形)和固体mao负载的/me,propsb(tbu2flu,i*)zrcl2(菱形)进行乙烯的聚合的活性对时间。聚合条件:10mg催化剂,50ml己烷,2巴,70℃和[tiba]0/[zr]0=1000。
图29示出了使用固体mao负载的/sb(tbu2flu,i*)zrcl2(正方形)、固体mao负载的/sb(tbu2flu,i*,3-乙基)zrcl2(圆形)、固体mao负载的/et2sb(tbu2flu,i*)zrcl2(三角形)、固体mao负载的/sb(cp,i*)zrcl2(倒三角形)和固体mao负载的/me,propsb(tbu2flu,i*)zrcl2(菱形)进行乙烯的聚合的活性对温度。聚合条件:10mg催化剂,50ml己烷,2巴,0.5小时和[tiba]0/[zr]0=1000。
图30示出了使用固体mao负载的/sb(tbu2flu,i*)zrcl2(正方形)和固体mao负载的/sb(cp,i*)zrcl2(圆形)进行乙烯的聚合的活性对时间。聚合条件:10mg催化剂,50ml己烷,2巴,70℃和[tiba]0/[zr]0=1000。
图31示出了a)固体mao负载的/et2sb(tbu2flu,i*)zrcl2、b)固体mao负载的/me,propsb(tbu2flu,i*)zrcl2、c)固体mao负载的sb(tbu2flu,i*)zrcl2、d)固体mao负载的sb(tbu2flu,i*)hfcl2、e)固体mao负载的/sb(cp,i*)zrcl2和f)固体mao负载的/sb(tbu2flu,i*,3-乙基)zrcl2的sem照片。聚合条件:10mg催化剂,50ml己烷,2巴,0.5小时和[tiba]0/[zr]0=1000。
图32示出了使用3%h2作为共进料(co-feed)、使用固体mao负载的/sb(cp,i*)zrcl2、固体mao负载的/(nbucp)2zrcl2和固体mao负载的/(ind)2zrcl2进行乙烯的聚合的活性对时间。聚合条件:25mg催化剂,1000ml己烷,8巴,80℃和[tea]0/[zr]0=300。
图33示出了使用固体mao负载的/sb(cp,i*)zrcl2的活性和分子量对用作共进料的h2含量。聚合条件:0.05mg催化剂,5ml庚烷,8巴和80℃。
图34示出了使用固体mao负载的/sb(cp,i*)zrcl2的活性和分子量对用作共进料的h2含量。聚合条件:25mg催化剂,1000ml己烷,8巴,80℃和[tea]0/[zr]0=300。
图35示出了使用固体mao负载的/et2sb(tbu2flu,i*)zrcl2、固体mao负载的/sb(cp,i*)zrcl2、固体mao负载的/me,propsb(tbu2flu,i*)zrcl2、固体mao负载的sb(tbu2flu,i*)zrcl2、固体mao负载的/sb(tbu2flu,i*,3-乙基)zrcl2、固体mao负载的sb(tbu2flu,i*)hfcl2和固体mao负载的/sb(cp,i*)hfcl2的、乙烯的均聚和乙烯与1-己烯的共聚的活性。聚合条件:0.05mg催化剂,5ml庚烷,8巴和80℃。
命名法
本文中使用的命名法将被技术人员参考相关结构式容易地理解。以下阐述了在全文所用的各种缩写:
sb表示(me)2si桥连的。类似地,et2sb表示(et)2si桥连的
eb表示亚乙基桥连的
ind*或i*表示全甲基茚基(per-methylindenyl)
flu表示芴基
tbu表示叔丁基
me表示甲基
pr表示丙基
ipr表示异丙基
ph表示苯基
一般方法
除非另有说明,否则所有有机金属操作均使用标准舒伦克线技术(schlenklinetechnique)或mbraununilab手套箱在n2气氛下进行。除非另有说明,否则所有有机反应均在空气下进行。使用的溶剂通过经钠-二苯甲酮二羰游基(sodium-benzophenonediketyl)(thf)的回流或使用mbraunsps-800溶剂体系穿过活性氧化铝(己烷、et2o、甲苯、ch2cl2)来干燥。将溶剂保存在干燥的玻璃安瓿中,并在使用前通过使n2气流穿过该液体来彻底脱气并用标准的钠-二苯甲酮-thf溶液来测试。用于氧敏感材料或水分敏感材料的nmr光谱分析的氘代溶剂被如下处理:将c6d6冷冻-泵-解冻脱气并经k镜(kmirror)干燥;d5-吡啶和cdcl3通过经氢化钙的回流被干燥并用阱至阱蒸馏(trap-to-trapdistillation)纯化;并经
除非另有说明,否则使用varian300mhz光谱仪进行1h和13cnmr光谱分析,并在300k下记录。1h和13cnmr光谱经由残余质子溶剂峰被参考。在手套箱中,在惰性气氛下,使用干燥并且脱气的溶剂制备氧敏感或水分敏感的样品,并将其密封于装有young型同心旋塞的wilmad5mm505-ps-7管中。
质谱使用brukerft-icr-msapexiii光谱仪。
对于每种情况下的单晶x射线衍射,使用采用全氟聚醚油的油滴技术将典型的晶体安装在玻璃纤维上,并使用oxfordcryosystemscryostream在n2的流中快速冷却至150k1。衍射数据使用enraf-noniuskappaccd衍射仪(石墨单色mokα辐射,
使用polymerlaboratoriesgpc220仪器、使用一个plgelolexis防护罩(plgelolexisguard)加两个olexis30cm×13μm柱进行高温凝胶渗透色谱法。使用的溶剂是具有抗氧化剂的1,2,4-三氯苯,标称流量为1.0mlmin-1且标称温度为160℃。使用折射率和viscotek差压式检测器。采集数据并使用polymerlaboratories“cirrus”软件分析。通过向15mg样品中加入15ml溶剂并在摇动下、在190℃下加热20分钟以溶解来制备每个样品的单一溶液。使样品溶液滤过玻璃纤维过滤器,然后将一部分经过滤的溶液转移到玻璃样品瓶中。在加热的样品室中初始延迟30分钟以使样品热平衡后,每个小瓶的部分内容物的注射自动进行。样品呈现完全溶解,并且不存在关于溶液的过滤或层析的问题。gpc系统用polymerlaboratories聚苯乙烯校准品校准。以这样的方式进行校准,使得组合的gpc-粘度可以被用于提供“真实的”分子量数据,并且还可以应用常规gpc。对于常规gpc结果,系统用线型聚乙烯或线型聚丙烯校准。以前已经示出,此校正给出对于线型聚合物的真实分子量的良好估计。
不对称的前配体的合成
亚乙基-桥连的[eb(tbu2flu,i*)h2]的合成
考虑以下示出的方案1,1当量的[(ind#)h]与过量的1,2-二溴乙烷的反应得到[(ind*)ch2ch2br],[(ind*)ch2ch2br]与1当量的[(tbu2flu)li]反应以良好收率得到作为无色固体的新的亚乙基桥连的前配体[eb(tbu2flu,i*)h2]。图1提供了eb(tbu2flu,i*)h2]的1hnmr光谱。
方案1-[eb(tbu2flu,i*)h2]亚乙基桥连的前配体的合成
硅-桥连的[sb(tbu2flu,i*)h2]、[sb(flu,i*)h2]和[sb(me,phind,i*)h2]的合成
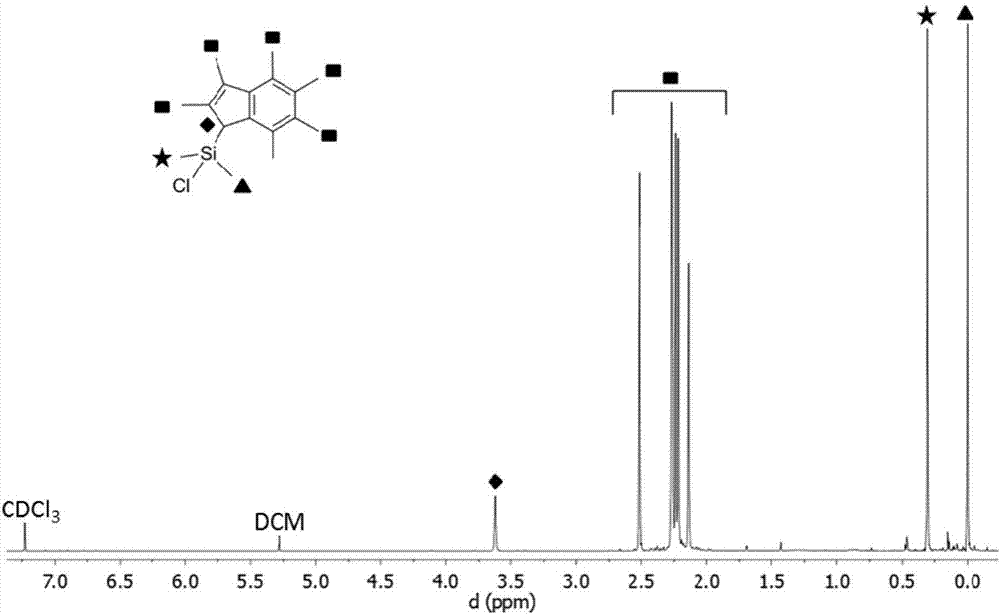
考虑以下示出的方案2,使用硅烷合成子[r,r’si(ind*)cl]来得到各种硅桥连的不对称的前配体。图2、图3和图4分别示出了[me2si(ind*)cl]、[ipr2si(ind*)cl]和[me,prsi(ind*)cl]的1hnmr光谱。
方案2-[r,r'si(ind*)cl]的合成
考虑以下示出的方案3,将合成的硅烷合成子[me2si(ind*)cl]单独地与1当量的[(tbu2flu)li]、[(flu)li]和[(me,phind)li]反应以分别以很好的收率得到作为无色固体的新的si桥连的前配体[sb(tbu2flu,i*)h2]、[sb(flu,i*)h2]和[sb(me,phind,i*)h2]。图5示出了[sb(flu,i*)h2]的1hnmr光谱。图6示出了[sb(tbu2flu,i*)h2]的x射线晶体结构。
方案3-[sb(tbu2flu,i*)h2]、[sb(flu,i*)h2]和[sb(me,phind,i*)h2]si-桥连的前配体的合成
不对称的前催化剂的合成
[sb(tbu2flu,i*)zrcl2]和[sb(tbu2flu,i*)hfcl2]的合成
考虑以下示出的方案4,在室温下、在苯中进行[sb(tbu2flu,i*)li2]与mcl4(m=zr和hf)的化学计量反应过夜,以良好收率得到作为亮橙色固体的[sb(tbu2flu,i*)mcl2]。图7和图8分别示出了[sb(tbu2flu,i*)zrcl2]和[sb(tbu2flu,i*)hfcl2]的1hnmr光谱。通过在-30℃的正己烷溶液中结晶来获得适用于x射线晶体学的[sb(tbu2flu,i*)zrcl2]和[sb(tbu2flu,i*)hfcl2]的单晶。图9和图10分别示出了[sb(tbu2flu,i*)zrcl2]和[sb(tbu2flu,i*)hfcl2]的x射线晶体结构。
方案4-[sb(tbu2flu,i*)zrcl2]和[sb(tbu2flu,i*)hfcl2]si-桥连的前催化剂的合成
et2sb(tbu2flu,i*)zrcl2和me,propsb(tbu2flu,i*)zrcl2的合成
考虑下文概述的方案5,分别以18%和41%的收率制备et2sb(tbu2flu,i*)zrcl2和me,propsb(tbu2flu,i*)zrcl2si-桥连的zr前催化剂。
方案5-et2sb(tbu2flu,i*)zrcl2和me,propsb(tbu2flu,i*)zrcl2si-桥连的前催化剂的合成
sb(tbu2flu,i*,3-乙基)zrcl2的合成
考虑下文概述的方案6,制备了sb(tbu2flu,i*,3-乙基)zrcl2si-桥连的zr前催化剂。
方案6-sb(tbu2flu,i*,3-乙基)zrcl2si-桥连的前催化剂的合成
sb(cp,i*)zrcl2的合成
考虑下文的方案7,将甲苯(40ml)加至在舒伦克管中的licp(246mg,3.41mmol)和ind*sime2cl(1g,3.41mmol),溶于-5℃thf(50ml)中并允许搅拌持续2小时。在30分钟内逐滴加入nbuli(4.7ml,1.6m于己烷中,7.51mmol),并允许反应搅拌持续12小时。在真空下除去溶剂,并将残余物用戊烷(3×40ml)洗涤并干燥以得到灰色粉末。加入1当量的zrcl4(796mg,3.41mmol),并将混合物溶于苯中并允许搅拌持续60小时。溶液的颜色从绿色变为橙色,并最终变成红色/棕色。在真空下除去溶剂,并将产物用戊烷(3×40ml)萃取并通过硅藻土(celite)过滤。将滤液在真空下浓缩并储存在-34℃。这产生了作为橙色/棕色沉淀物的sb(cp,i*)zrcl2,收率23%(365mg,0.76mmol)。适用于单晶x射线衍射的橙色晶体在-34℃下从在己烷中的浓溶液中生长。
1hnmr(d6-苯):δ6.59(2h,dm,cph),5.60(2h,dm,cph),2.52(3h,s,arme),2.48(3h,s,arme),2.26(3h,s,arme),2.15(3h,s,arme),2.05(3h,s,arme),1.97(3h,s,arme),0.72(3h,s,sime),0.64(3h,s,sime)。
13c{1h}nmr(d6-苯):δ135.65(ar),135.13(ar),134.86(ar),131.11(ar),131.50(ar),131.15(ar),129.16(ar),126.35(ar),125.92(arsi),,115.87(cph),106.49(cph),84.01(cpsi),21.69(arme),17.91(arme),17.64(arme),17.16(arme),16.92(arme),15.97(arme),5.59(sime),3.26(sime)。
ms(ei):预期值:m/z482.0372。观测值:m/z482.0371。ir(kbr)(cm-1):2961,2925,1543,1260,1029,809,668。
chn分析(%):预期值:c54.74,h5.85,实测值:c54.85,h5.94。
方案7-sb(cp,i*)zrcl2si-桥连的前催化剂的合成
sb(cp,i*)hfcl2的合成
考虑下文的方案8,将sb(cp,i*)li2(1g,2.99mmol)和hfcl4(958mg,2.99mmol)加至舒伦克管中。添加苯(100ml)并允许反应搅拌持续60小时。溶液的颜色从棕色变为黄色。在真空下除去溶剂,并将产物用戊烷(3×40ml)萃取并通过硅藻土过滤。将滤液在真空下浓缩并储存在-34℃,以24%收率(360mg,0.632mmol)得到作为适合于单晶x射线衍射的黄色晶体的sb(cp,i*)hfcl2。
1hnmr(d6-苯):δ6.54(3h,dm,cph),5.53(3h,dm,cph),2.57(3h,s,arme),2.56(3h,s,arme),2.25(3h,s,arme),2.20(3h,s,arme),2.09(3h,s,arme),2.03(3h,s,arme),0.65(3h,s,sime),0.57(3h,s,sime)。
13c{1h}nmr(d6-苯):δ134.55(ar),134.18(ar),133.51(ar),131.73(ar),131.05(ar),129.64(ar),126.23(ar),125.18(ar),124.38(ar),113.33(cph),107.32(cph),82.33(cpsi),21.53(arme),17.68(arme),17.37(arme),16.77(arme),16.64(arme),15.51(arme),5.00(sime),3.00(sime)。
ms(ei):预期值:m/z570.0785。观测值:m/z570.0701。ir(kbr)(cm--1):2960,2923,1542,1262,1028,812,670。
chn分析(%):预期值:c46.36,h4.95,实测值:c46.52,h5.04。
方案8-sb(cp,i*)hfcl2si-桥连的前催化剂的合成
sb(cp,i*)zrcl(o-me2-c6h3)的合成
考虑下文的方案9,将sb(cp,i*)zrcl2(100mg,0.207mmol)和2,6-二甲基苯酚钾(66mg,0.414mmol)加至舒伦克管中,溶于苯(20ml)中,并允许搅拌持续16小时。在真空下除去溶剂并将产物用戊烷(2×20ml)萃取。1hnmr光谱示出了对应于两种异构体的混合物的共振。当将溶液浓缩并储存在-34℃冷冻器中时,获得适用于单晶x射线衍射的异构体(a)的薄的、黄色晶体。通过1hnmr光谱分析,纯度为94%,并且以15%收率得到晶体(16mg,0.028mmol)。
异构体(a):
1hnmr(d6-苯):δ7.06(2h,dd,arphenh),6.82(1h,t,arphenh),6.26(1h,m,cph),6.13(1h,m,cph),5.93(1h,m,cph),5.61(1h,m,cph),2.34(3h,s,arme),2.24(3h,s,arme),2.22(6h,s,arphenme),2.19(3h,s,arme),2.18(3h,s,arme),2.15(3h,s,arme),1.99(3h,s,arme),0.81(3h,s,sime),0.75(3h,s,sime)。
异构体(b):
1hnmr(d6-苯):δ6.88(2h,dd,arphenh),6.69(1h,t,arphenh),6.51(1h,m,cph),6.02(1h,m,cph),5.88(1h,m,cph),5.80(1h,m,cph),2.61(3h,s,arme),2.42(6h,s,arphenme),2.40(3h,s,arme),2.08(3h,s,arme),1.99(3h,s,arme),1.64(3h,s,arme),1.48(3h,s,arme),0.64(3h,s,sime),0.61(3h,s,sime)。
方案9-sb(cp,i*)zrcl(o-2,6-me2-c6h3)si-桥连的前催化剂的合成
负载的催化剂体系的合成
固体mao/[sb(tbu2flu,i*)zrcl2]催化剂体系的合成
在室温下,将甲苯(40ml)加至容纳固体铝氧烷(固体mao)(由tosoh制造,批号ty130408)(400mg)和[sb(tbu2flu,i*)zrcl2](下文示出的)(13.6mg)的舒伦克管中。将淤浆加热至60℃并允许在偶尔涡旋下持续一小时,在此期间溶液变成无色且固体着色为深绿色。然后允许所得悬浮液冷却至室温并将甲苯溶剂小心地过滤并在真空中除去,以85%收率(352mg)得到作为灰色、自由流动的粉末的固体mao/[sb(tbu2flu,i*)zrcl2]催化剂。
固体mao/外消旋-[(ebi*)zrcl2]催化剂体系的合成(比较实施例)
在室温下,将甲苯(40ml)加至容纳固体mao(由tosoh制造;批号ty130408)(400mg)和外消旋-[(ebi*)zrcl2](下文示出的)(8.6mg)的舒伦克管中。将淤浆加热至60℃并允许在偶尔涡旋下持续一小时,在此期间溶液变成无色且固体着色为深绿色。然后允许所得悬浮液冷却至室温并将甲苯溶剂小心地过滤并在真空中除去,以85%收率(352mg)得到作为灰色、自由流动的粉末的固体mao/[sb(tbu2flu,i*)zrcl2]催化剂。
固体mao/内消旋-[(ebi*)zrcl2]催化剂体系的合成(比较实施例)
在室温下,将甲苯(40ml)加至容纳固体mao(由tosoh制造;批号ty130408)(400mg)和内消旋-[(ebi*)zrcl2](下文示出的)(8.6mg)的舒伦克管中。将淤浆加热至60℃并允许在偶尔涡旋下持续一小时,在此期间溶液变成无色且固体着色为深绿色。然后允许所得悬浮液冷却至室温并将甲苯溶剂小心地过滤并在真空中除去,以85%收率(352mg)得到作为灰色、自由流动的粉末的固体mao/[sb(tbu2flu,i*)zrcl2]催化剂。
固体mao/外消旋-[(sbi*)zrcl2催化剂体系的合成(比较实施例)
在室温下,将甲苯(40ml)加至容纳固体mao(由tosoh制造;批号ty130408)(400mg)和外消旋-[(sbi*)zrcl2(下文示出的)(9.1mg)的舒伦克管中。将淤浆加热至60℃并允许在偶尔涡旋下持续一小时,在此期间溶液变成无色且固体着色为深绿色。然后允许所得悬浮液冷却至室温并将甲苯溶剂小心地过滤并在真空中除去,以85%收率(352mg)得到作为灰色、自由流动的粉末的固体mao/[sb(tbu2flu,i*)zrcl2]催化剂。
乙烯聚合研究
乙烯的均聚
在淤浆条件下,在基于铝的清除剂三(异丁基)铝(tiba)的存在下,固体mao/[zr-络合物]催化剂(zr-络合物=外消旋-[(ebi*)zrcl2]、内消旋-[(ebi*)zrcl2]、外消旋-[(sbi*)zrcl2]、[sb(tbu2flu,i*)zrcl2])被测试它们的乙烯均聚活性。反应在2巴乙烯下、在200ml安瓿中进行,其中10mg催化剂悬浮于50ml己烷中。反应在由油浴中的加热控制下运行持续60分钟。所得的聚乙烯立刻在真空下通过干燥的烧结玻璃料被过滤。然后将聚乙烯产物用戊烷(2×25ml)洗涤并然后在所述玻璃料上干燥至少1小时。对于每个单独的组的聚合条件,至少进行两次测试。
图11示出了对于在70℃下使用固体mao基催化剂进行乙烯的聚合的聚合生产率(kg(pe)g(催化剂)-1h–1)对时间(秒)。图12示出了对于在80℃下使用固体mao基催化剂进行乙烯的聚合的聚合生产率(kg(pe)g(催化剂)-1h–1)对时间(秒)。数据表明,当与比较实施例的固体mao/外消旋-[(ebi*)zrcl2]、固体mao/内消旋-[(ebi*)zrcl2]和固体mao/外消旋-[(sbi*)zrcl2]相比时,本发明的固体mao/[sb(tbu2flu,i*)zrcl2]催化剂体系具有显著优异的活性。
下表1示出了对于使用固体mao/[络合物](络合物=外消旋-[(ebi*)zrcl2]、内消旋-[(ebi*)zrcl2]、外消旋-[(sbi*)zrcl2]、[sb(tbu2flu,i*)zrcl2])进行乙烯的均聚的gpc结果。
表1.对于使用固体mao/[络合物]进行乙烯的均聚的gpc结果。聚合条件:5ml庚烷,p乙烯=120psi,且n(tea)=10μmol。
考虑到表1中呈现的数据,看到不对称络合物[sb(tbu2flu,i*)zrcl2]提供的聚乙烯具有比由比较物催化剂体系提供的聚乙烯的分子量显著更高的分子量。此外,分子量的增加不伴随着多分散性的增加。具有低多分散性的高分子量材料在特定应用中受到工业界的青睐。
乙烯与1-己烯的共聚
在淤浆条件下,在三(异丁基)铝(tiba)(基于铝的清除剂)的存在下,固体mao/[zr-络合物]催化剂(zr-络合物=外消旋-[(ebi*)zrcl2]、内消旋-[(ebi*)zrcl2]、外消旋-[(sbi*)zrcl2]、[sb(tbu2flu,i*)zrcl2])被测试它们的乙烯/1-己烯共聚活性。反应在2巴乙烯下、在200ml安瓿中进行,其中10mg催化剂悬浮于50ml己烷中。反应在由油浴中的加热控制下运行持续60分钟。所得的聚乙烯立刻在真空下通过干燥的烧结玻璃料被过滤。然后将聚乙烯产物用戊烷(2×25ml)洗涤并然后在所述玻璃料上干燥至少1小时。对于每个单独的组的聚合条件,至少进行两次测试。
图13示出了对于使用固体mao基催化剂进行乙烯和1-己烯的共聚的活性对时间。图14示出了当p乙烯=120psi时,使用固体mao基催化剂、在改变1-己烯进料的情况下进行乙烯和1-己烯的共聚的活性对时间。图15示出了对于当p乙烯=80psi时,使用固体mao基催化剂、在改变1-己烯进料的情况下进行乙烯和1-己烯的共聚的活性对时间。数据表明,当与比较实施例的固体mao/外消旋-[(ebi*)zrcl2]、固体mao/内消旋-[(ebi*)zrcl2]和固体mao/外消旋-[(sbi*)zrcl2]相比时,本发明的固体mao/[sb(tbu2flu,i*)zrcl2]催化剂体系具有优异的共聚活性。
下表2总结了对于使用固体mao/[络合物]进行乙烯和1-己烯的共聚的活性结果。
表2-对于使用固体mao/[络合物]进行乙烯和1-己烯的共聚的活性结果。聚合条件:5ml庚烷,t=70℃,p乙烯=120psi,且n(tea)=15μmol。
表2中呈现的结果表明,当与比较物催化络合物相比时,本发明的固体mao/[sb(tbu2flu,i*)zrcl2]催化络合物在己烷浓度范围内显示出显著优异的活性。
下表3和4示出了对于使用固体mao/[络合物](络合物=外消旋-[(ebi*)zrcl2]、内消旋-[(ebi*)zrcl2]、外消旋-[(sbi*)zrcl2]、[sb(tbu2flu,i*)zrcl2])进行乙烯和1-己烯的共聚的gpc结果。
表3-对于使用固体mao/[络合物]进行乙烯和1-己烯的共聚的gpc结果。聚合条件:5ml庚烷,t=70℃,p乙烯=120psi,且n(tea)=15μmol。
表4-对于使用固体mao/[络合物]进行乙烯和1-己烯的共聚的gpc结果。聚合条件:5ml庚烷,t=70℃,p乙烯=80psi,且n(tea)=15μmol。
下表5通过13c{1h}nmr光谱分析和结晶洗脱分级分析(crystallizationelutionfractionationanalysis)说明了1-己烯在乙烯和1-己烯的共聚中的并入。
表5-1-己烯在使用固体mao/[络合物]进行乙烯和1-己烯的共聚中的并入的13c{1h}nmr光谱分析和cef结果。聚合条件:5ml庚烷,t=70℃,p乙烯=120psi,且n(tea)=15μmol。
表3-5中概述的结果指出了具有如通过gpc和cef分析的窄分子间共聚单体分布的表现良好的共聚方法。
进一步的聚合研究
下表6呈现了对于使用负载于固体mao上的sb(cp,i*)zrcl2进行淤浆中乙烯的聚合的活性结果(kgpe/g催化剂/h)。将此络合物的活性与不包括在本发明内的当负载于固体mao时的(nbucp)2zrcl2和(ind)2zrcl2的活性进行比较。
表6.对于在淤浆中乙烯的聚合的活性结果(kgpe/gcat/h),络合物负载于固体mao上
下表7呈现了对于使用负载于固体mao/sb(cp,i*)zrcl2上进行淤浆中乙烯的聚合的活性结果(kgpe/g催化剂/h)和分子量(g/mol)作为h2进料量的函数。
表7.对于使用负载于固体mao/sb(cp,i*)zrcl2上进行淤浆中乙烯的聚合的活性结果(kgpe/g催化剂/h)和分子量(g/mol)作为h2进料量的函数。
下表8呈现了对于使用本发明的各种组合物(负载于固体mao上)进行淤浆中乙烯的聚合和乙烯与1-己烯的共聚的活性结果(kgpe/g催化剂/h/巴)、分子量(g/mol)和cef值。
表8.对于使用负载于固体mao上的络合物进行淤浆中乙烯的聚合和乙烯与1-己烯的共聚的活性结果(kgpe/g催化剂/h/巴)、分子量(g/mol)和cef值。
聚合条件:80℃,8巴,5ml庚烷
图28和29表明固体mao负载的sb(tbu2flu,i*)zrcl2和固体mao负载的sb(cp,i*)zrcl2催化剂具有最高的活性。将桥连改为二-乙基和甲基-丙基产生相似的活性。
图30示出了固体mao负载的sb(tbu2flu,i*)hfcl2比固体mao负载的sb(cp,i*)hfcl2快3倍,但比其锆类似物慢25%(图26)。
图31示出了当使用固体mao负载的/et2sb(tbu2flu,i*)zrcl2和固体mao负载的/sb(cp,i*)zrcl2作为催化剂时,获得了良好的聚乙烯形态,其表现出单分散pe。
图32示出了在相似条件下,固体mao负载的/sb(cp,i*)zrcl2比已知的工业催化剂被更好地控制并且提供更高的活性(3.2kgpe/g催化剂/h/巴)(固体mao负载的(nbucp)2zrcl2和固体负载的(ind)2zrcl2分别具有1.2kgpe/g催化剂/h/巴和1.6kgpe/g催化剂/h/巴的活性)。这表明固体mao负载的/sb(cp,i*)zrcl2被用作用于形成pe蜡的催化剂的巨大潜力。
图33和34示出了当h2被用作共进料时,活性和分子量随着h2含量的增加而降低。
图35示出了大多数催化剂为乙烯和1-己烯的共聚提供了比仅用于乙烯的均聚更高的活性。
固体mao的合成
根据以下合成方案制备各种固体mao的样品:
研究了改变al:o比例对bet表面积和乙烯聚合活性的影响。结果在下表9中提供:
表9.改变al:o比例对负载于固体mao上的me2sb(tbu2flu,i*)zrcl2的bet表面积和乙烯聚合活性的影响
tma的量保持不变。苯甲酸的量变化。
虽然为了参考和说明的目的,在本文中描述了本发明的具体实施方案,但是在不脱离由所附权利要求限定的本发明的范围的情况下,各种修改对于本领域技术人员将是明显的。
参考文献
1j.cosier,a.m.glazer,j.appl.cryst.19(1986)105
2z.otwinowski,w.minor,methodsenzymol.276(1997)307
3l.palatinus,g.chapuis,j.appl.cryst.40(2007)786
4p.w.betteridge,j.r.carruthers,r.i.cooper,k.prout,d.j.watkin,j.appl.cryst.36(2003)1487
5r.i.cooper,a.l.thompson,d.j.watkin,j.appl.cryst.43(2010)1100。
- 还没有人留言评论。精彩留言会获得点赞!