生物基二元醇的CO2介导的醚化的制作方法
优先权要求
本申请要求2014年12月18日提交的美国临时申请号62/093,730的优先权权益,该临时申请的内容通过引用结合在此。
本披露涉及一种用于使用可再生试剂选择性醚化多元醇的方法。具体地,该方法涉及产生生物基二醇和其他二元醇的单烷基醚和二烷基醚。
背景技术:
二醇醚在各种工业应用中用作溶剂、涂料、油墨、和家用清洁剂的组分。用于大工业规模制备二醇醚的目前的惯例起因于石油基烯烃环氧化,之后用醇催化溶剂分解以产生单醚和二醚产物(通过分馏分离)。然而,对“绿色”可再生资源的兴趣近年来已经激励开发可替代的、更可持续的手段的努力以供应对于二醇醚的大量需求。
用于将二醇转化为醚的目前的常规方法涉及使用强酸催化剂诸如硫酸(h2so4)的与醇的反应。该反应由二醇产生所希望的醚以及可能是爆炸性的副产物(诸如二甲醚)。工业通常烧掉这种副产物,这不幸地有助于额外的大气co2。
由于其作为来自化石燃料燃烧的主要产物的性质以及作为气候变化“温室气体”的估算责任,co2已经作为有待减少的副产物吸引了很多媒体关注。通过各种监管措施抑制co2排放的努力已经取得了有限的成功,部分是由于丰富的高能石油和煤炭急剧驱动的一些发展中国家的经济快速增长。在深的地下储层中封存或捕获并且储存co2为抑制日益增加的大气co2水平提供了临时解决方案。然而,存在若干缺点,包括对于高毒性化学品(具有对广泛的地下水污染的可能性)的需要、以及有时不确定的长期地震效应。
co2研究的另一个分支集中于将该气体也作为一种碳添加剂(c1单元)进行捕获和利用。最后,新兴的兴趣是使用加压的co2来催化水溶液中的过程(碳酸催化剂)。此领域出于若干原因具有巨大的潜力,这些原因包括:a)排除催化剂去除(碳酸在减压时自发分解为水和co2);b)利用co2和水作为驱动化学转化的主要组分的“绿色”方面;以及c)源于这些丰富、廉价的材料的合适的工艺经济。co2催化转化具有若干先例。例如,shirai等人(greenchemistry[绿色化学]2009,48-52)指出,在高温水性基质中,部署co2以促使多种多元醇脱水环化成相应的环状醚。在另一个实例中,savage等人(ind.eng.chem.res.[工业与工程化学研究]2003,290-294),部署co2以促进在高温水中用叔丁醇的对苯甲酚的醚化。在另一个实例中,zhu和同事披露了借助于部署碳酸二甲酯和氢氧化钠或氢氧化钾制备丙二醇二甲醚(famingzhuanlishenqinggongkaishuomingshu,publishedchinesepatentapplicationno.1554632(15dec.2004)[发明专利申请公开说明书,公开的中国专利申请号1554632(2004年12月15日)])。
鉴于上述需要和技术发展,可以平衡co2的捕获和利用来开发用于生成二醇或二元醇醚的“绿色”合成方法的方式将是工业和制造用途的受欢迎的创新。
技术实现要素:
本披露部分地描述了一种用于制备单烷基或二烷基醚的方法。该方法涉及在醇溶剂中在原位生成弱酸的催化剂存在下在一定温度下使二元醇与烷基化剂接触足够的时间以便将该二元醇转化为相应的烷基醚。该二元醇可以是至少异己糖醇(即,异山梨醇、异甘露糖醇、以及异艾杜糖醇)、5-羟甲基糠醛(hmf)的还原产物(即,呋喃-2,5-二基二甲醇(fdm)、((2r,5s)-四氢呋喃-2,5-二基)二甲醇和((2s,5s)-四氢呋喃-2,5-二基)二甲醇(bhmthf))、乙二醇(eg)、丙二醇(pg)、2,3丁二醇(bdo)或1,6己二醇。该烷基化剂是碳酸烷基酯。该弱酸是由水合的二氧化碳(co2)催化剂原位形成的碳酸。该反应的减压后该碳酸消失。
在另一方面,本披露还描述了一种用于由根据以上前述方法制备的一些单烷基或二烷基醚制造聚醚或环氧化物的方法。此第二种方法涉及由原位生成的弱酸催化的使二元醇与烷基化剂在醇溶剂中反应,产生烯丙醚,并且至少使该烯丙醚聚合或环氧化。像在该基础醚化方法中,该单烷基醚或二烷基醚衍生自选自下组的二元醇,该组由以下各项组成:乙二醇(eg)、丙二醇(pg)、2,3丁二醇(bdo)、1,6己二醇、异山梨醇、异甘露糖醇、异艾杜糖醇、呋喃-2,5-二基二甲醇(fdm)、((2r,5s)-四氢呋喃-2,5-二基)二甲醇和((2s,5s)-四氢呋喃-2,5-二基)二甲醇(bhmthf),并且可以充当各种工业应用的重要前体或可再生原料。
本发明方法的另外的特征和优点将披露于以下详细说明中。应理解的是上述概述以及以下详细说明和实例都仅代表本发明,并且旨在提供用于理解如所要求保护的本发明的综述。
附图说明
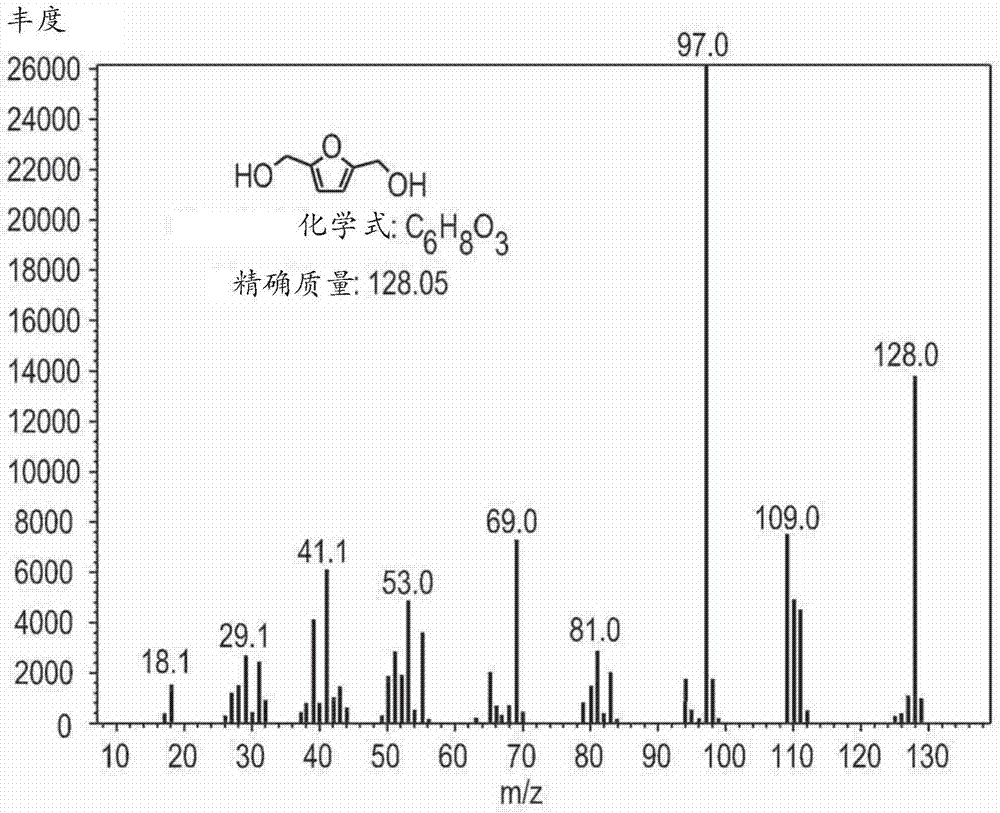
图1a和1b对应地是溶解在甲醇(meoh)中的fdm的气相色谱/质谱(gc/ms)色谱图和质谱图。
图2是根据本发明方法的实施例产生的产物的质谱图,显示出大多数fdm已经转化为其单醚类似物和显著量的二醚类似物。
图3a、3b、和3c对应地是gc色谱图和使用fdm的另一实施例的两个质谱图,其显示了与图2的实施例相似的产物分布。在gc/ms色谱图中,衰减的fdm信号(10.999min.)证实更大的转化率,并且二醚类似物(9.765min.)和单醚类似物(10.337min.)的更强的信号表明成为这些物种的更大的转化率。
图4是其中co2不存在或以不充足的量存在的对比反应的gc/ms色谱图,显示出由未反应的fdm组成的单个突出峰以及对应于单醚类似物的在10.334min.处的更小的峰。
图5是其中醇溶剂(meoh)不存在或以不充足的量存在的对比实例的gc/ms色谱图,显示出在11.044min.处的未反应fdm的单一信号。
图6a是其中碳酸烷基酯(dmc)不存在或以不充足的量存在的对比实例的gc/ms色谱图,显示出fdm转化为单醚和二醚类似物。
图6b和6c对应地是来自图6a的单醚和二醚类似物的质谱图。
图7a是根据使用bhmthf的实施例的产物的gc/ms色谱图,显示出作为主要产物的顺式二醚类似物(13.8)和作为次要产物的反式二醚类似物(14.0)。
图7b和7c对应地是该顺式二甲醚和反式二甲醚类似物的质谱图。
图8是其中co2不存在或以不充足的量存在的对比实例的gc/ms色谱图,显示出在meoh中呈9:1顺式:反式非对映体比率的未反应的bhmthf。
图9是其中醇溶剂(meoh)不存在或以不充足的量存在的对比实例的gc/ms色谱图,显示出未反应的bhmthf和几乎没有醚产物。
图10是其中碳酸烷基酯(dmc)不存在或以不充足的量存在的对比实例的gc/ms色谱图,显示出未反应的bhmthf和几乎没有醚产物。
图11a和11b对应地是gc/ms色谱图和质谱图,显示作为起始材料的在meoh中的丙二醇(pg)。
图12a是两个峰中的丙二醇(pg)-单甲醚的异构体a和b以及未反应的pg的气相色谱图。
图12b和12c是在图12a中详述的气相色谱图中对应地在2.126min.和2.178min.处的pg-单甲醚信号的异构体a和b的两个质谱图。
图13a是根据本发明方法的实施例的pg醚化的混合的单甲醚和二甲醚产物的气相色谱图。
图13b、13c和13d是与图13a中详述的气相色谱图中的信号相对应的质谱图,并且对应地表示未反应的pg、pg二甲醚(1,2-二甲氧基丙烷)和pg单甲醚的异构体(1-甲氧基丙-2-醇和2-甲氧基丙-1-醇)。
图14a是根据另一个实施例的异山梨醇烯丙基化产物的气相色谱图。
图14b是质谱图,显示出在11.465min.处的信号,其为未反应的异山梨醇。
图14c是质谱图,显示出在12.961min.处的信号,其与异山梨醇单烯丙基醚异构体相一致。
具体实施方式
部分i.-说明
衍生自植物或生物基原料的二醇和其他二元醇具体为增值类的化合物,其在范围例如从聚合物结构单元至预表面活性剂底物的许多应用中具有潜力和通用性。研究人员已经努力实现有成本效益的方法,这些方法选择性地将单糖及其相应的还原类似物转化为环状和线性二醇(就其本身而言(inandofthemselves)或者作为氧化或还原的变体具有广泛实用性的前体)。
本披露描述了一种用于部署在醇溶剂中的可再生的、环境无害的碳酸烷基酯和无痕催化剂将生物基二元醇高效转化为单烷基醚和二烷基醚的方法。如在此使用的,术语“无痕催化剂”是指在加压化学反应期间原位生成并且在反应被减压之后消散的物种。这种醚化途径允许在相对温和的条件下迄今尚未见到的二元醇的高转化率。驱动该醚化的水合的二氧化碳(可以充当原位生成的酸催化剂(即,碳酸)的来源的成分)的存在加强了这种方法。
根据实施例,该二元醇可以是糖醇的环状脱水衍生物,在此被称为异己糖醇。该异己糖醇可以是异山梨醇、异甘露糖醇、以及异艾杜糖醇中的至少一种。在另一个实施例中,该二元醇可以是呋喃-2,5-二甲醇(fdm),通过部分还原果糖衍生的5-羟甲基糠醛(hmf)制成的化合物。在还另一个实施例中,该二元醇可以是((2r,5s)-四氢呋喃-2,5-二基)二甲醇和((2s,5s)-四氢呋喃-2,5-二基)二甲醇(bhmthf),其为由上述hmf产生的还原产物。在其他实施例中,将乙二醇(eg)或丙二醇(pg)(甘油脱水的产物)转化为其相应的单甲醚和二甲醚。在还其他实施例中,该二元醇可以是2,3丁二醇(bdo)或1,6己二醇。
所有这些化合物可以以起始二元醇的大于50wt.%的相对高的转化率转化成相应的单烷基醚和二烷基醚。该转化率可以为约60wt.%或更高、典型地约70wt.%或75wt.%至约95wt.%或100wt.%。在某些优选的实施例中,该二元醇以约80wt.%或85wt.%至约98wt.%或100wt.%的产率转化为单烷基醚或二烷基醚。
该烷基化剂是碳酸烷基酯,诸如碳酸二甲酯(dmc)、碳酸二乙酯(dec)、或碳酸二丙酯(dpc)。显著过量的碳酸烷基酯有助于形成醚。因此,相对于二元醇试剂存在的碳酸烷基酯的量是最低限度地化学计量过量约2x或更高。在某些实施例中,碳酸烷基酯的量可以在从约4x、5x或6x至约10x或12x更大的范围内。
该醇溶剂至少是伯醇。实例可以包括烯丙醇,诸如甲醇(meoh)、乙醇(etoh)、丙醇、和丁醇。此外,存在的醇溶剂的量相比二元醇试剂的量最低限度地过量约2x或更多。在一些实施例中希望地,存在从约4x、5x或6x至约8x、10x或12x更大的醇溶剂。
在某些实施例中,该碳酸烷基酯和醇溶剂可以是相同或不同的烷烃r-基团物种。然而,优选地它们是相同的烷烃r基团。
在方案a中描绘了根据实施例的本发明方法的说明性反应,其示出了在co2饱和的甲醇中的用碳酸二甲酯的二醇甲基醚化(pg实例)。
方案a.
碳酸二甲酯(dmc)的吸引人的特点是以下事实:它是无毒的并且仅仅产生co2和甲醇(是可回收的)作为副产物。dmc作为“绿色”试剂在酸催化或碱催化的甲基化或者甲氧羰基化苯胺、酚、活性亚甲基化合物和羧酸中已经成果卓著。使用碳酸烷基酯像dmc的目前的醚化是生物基二元醇更广泛使用的新途径。例如,在某些实施例中,例如,fdm或bhmthf的烷基醚可以在随后的氧化步骤中容易地转化成其相应的单酯或二酯。
用于获得二醇转化成互补醚的高程度的本发明方法特别是反应中三种组分(即二氧化碳、碳酸烷基酯、和醇溶剂)的组合。据信,co2气氛、有机碳酸酯和羟基溶剂的相互影响增强了二元醇的醚的形成。在反应过程中,气氛中的co2在水的存在下形成碳酸。如以下实例部分的对比实例中所证实的,这三种组分中任何一种的不存在或不充足的量将导致二元醇成为其相应的醚的可忽略的转化或不转化。甚至更,当这三种组分中的至少两种不存在或以不充足的量存在时,没有醚产物由二元醇产生。
例如,图3a和图6a对应地是gc色谱图,其汇总了实例2和对比实例3的结果,这些实例都涉及根据本发明方法的fdm的醚化。在实例2中,所有三种组分(co2、醇溶剂、碳酸烷基酯)以充足的量存在。在对比实例2中,碳酸烷基酯不存在或不以充足的量存在。gc色谱图的比较表明,在对比实例3中即使反应由fdm产生小量的单醚和二醚产物,显著量的未反应的fdm剩余。相比之下,实例2的反应具有显著更少的未反应的fdm并且产生更多的单醚和二醚二者。在产物和未反应的起始材料的量上的差异,我们认为是由于组合的组分的相互作用的协同效应。在另一个说明中,在对应地涉及fdm、bhmthf、和pg的对比实例1、4、和7中,在co2不存在下进行反应,不产生醚产物。
目前的醚化在富co2环境中进行。也就是说,反应在具有至少5%的co2、并且优选约50%的co2或更大的气氛中进行。co2气氛可以在加热前处于约100psi或200psi的初始压力下。总体上,对于令人满意的二醇转化率,co2压力是在加热前处于约400psi,并且一旦达到所希望的反应温度为约2000psi。在一些实施例中,co2可以处于约700psi或800psi的初始压力下。约100psi或200psi的较低的初始co2压力(在反应温度下约1000psi)似乎足以诱发醚化过程的碳酸催化。超过1000psi的压力(在反应温度下约4000psi)似乎没有进一步增强过程动力学。
反应温度可以是在约150℃,在一些实施例中是在约250℃或260℃。反应的典型温度是约200℃至约230℃,这提供了伴随减轻的副产物形成的令人满意的二醇醚化。在从150℃至190℃或195℃的较低温度下进行的反应产生较少的副产物,但相对于较高温度下的反应显示较低的产率。在约260℃或更高的较高温度下的反应提供更大的醚产率,但倾向于还显示较大浓度的未鉴定副产物,这可能妨碍容易的产物分离,容易的产物分离是本发明方法的另一个优点。
反应可以进行数小时、例如从约3小时至约8或12小时的持续时间。反应时间典型地是约5或6小时。人们预期单醚和二醚产率与反应的持续时间成比例;在更短的时间间隔可忽略,并且在更长的间隔更大增大的量。
部分ii.-实例
以下实例和所附的气相色谱图和质谱图呈现根据本发明方法产生的一些醚产物。在其中一种或多种试剂物种缺少或以不充足的量存在的“对照”或对比实例中,数据说明这些反应的三组分(即醇、碳酸烷基酯和co2)的性质。换言之,当组分试剂不存在或不呈合适的比例时,该反应将倾向于不能获得醚产物的令人满意的产率。
a.呋喃-2,5-二基二甲醇(fdm)的单-和二-甲醚
作为比较的基础,图1a和1b对应地示出溶解在甲醇(meoh)中的fdm的气相色谱(gc)和质谱作为该起始材料的基线标准。
方案1示出了根据实例1中描述的实施例的fdm的醚化。
方案1.
实例1.
实验条件(meoh,dmc,co2,3h)。向250cc的哈氏合金(hastelloy)压力容器中装入10g的2,5-呋喃二甲醇(fdm,78mmol)、50g的碳酸二甲酯(dmc,555mmol,7.11eq.)和50g的meoh。然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在300psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续3h;在该温度下达到的最大压力为1650psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直到300℃,保持10min)分析所得棕色溶液,其表明大多数fdm已经转化为单醚类似物和显著量的二醚类似物,如图2中所示。
实例2.
实验条件(meoh,dmc,co2,5h)。向250cc的哈氏合金压力容器中装入10g的2,5-呋喃二甲醇(fdm,78mmol)、50g的碳酸二甲酯(dmc,555mmol,7.11eq.)和50g的甲醇。然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在400psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续5h;在该温度下达到的最大压力为1650psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms分析所得到的微红色透明溶液,其显示出与实例1中类似的产物分布,但是具有衰减的fdm信号(10.999min),证实更大的转化率和更强的二醚类似物(9.765min)和单醚类似物(10.337min),如图3a、3b、和3c所示。
对比实例1.
实验条件(无co2)。向250cc的哈氏合金压力容器中装入10g的2,5-呋喃二甲醇(fdm,78mmol)、50g的碳酸二甲酯(dmc,555mmol,7.11eq.)和50g的甲醇(meoh)。然后将该容器紧密密封并且附接到反应器装置上,并且在700rpm的顶部搅拌速率下加热至200℃持续5h。该时间之后,将溶液冷却至环境温度并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直到300℃,保持10min)分析所得棕色溶液,披露了由未反应的fdm组成的单个突出峰和对应于单醚类似物的在10.334min处的更小的峰,如图4中所示。
对比实例2.
实验条件(无meoh)。向250cc的哈氏合金压力容器中装入10g的2,5-呋喃二甲醇(fdm,78mmol)、100g的碳酸二甲酯(dmc,1.10mol,约15eq.)和1g的水。然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在400psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续5h;在该温度下达到的最大压力为1605psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms使用上述分析方法分析所得到的黄色透明溶液,展示出在11.044min处的单独的信号,主要是未反应的fdm,如图5中所示。
对比实例3
实验条件(无dmc)。向250cc的哈氏合金压力容器中装入10g的2,5-呋喃二甲醇(fdm,78mmol)、100g的meoh和1g的水。然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在400psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续5h;在该温度下达到的最大压力为1605psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms使用上述分析方法分析所得的微红色透明溶液,并且显示在10.998min(残余fdm)和10.3343(单醚)和9.764min(二醚)处的三个显著信号,如在图6a、6b、和6c中所示。
b.((2r,5s)-四氢呋喃-2,5-二基)二甲醇和非对映体(bhmthf)的单-和二-
甲醚
方案2示出了根据实例3的bhmthf醚化的实施例。
方案2.
实例3.
实验条件(meoh,dmc,co2)。向250cc的哈氏合金压力容器中装入10g的bhmthf(76mmol)、50g的碳酸二甲酯(dmc,555mmol,7.11eq.)和50g的甲醇。然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在400psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续5h;在该温度下达到的最大压力为1740psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直至300℃,保持10min)分析所得棕色溶液,其显示出两组显著的峰;a)对应地在10.21和10.35min处的第一组,被指定为未反应的thf-二元醇;b)在13.88min(顺式)和14.02min处的第二组展示出159.0的m/z,与目标二甲氧基甲基醚一致,如图7a中所示。图7b和7c对应地显示了顺式和反式二醚类似物的质谱图。
对比实例4.
实验条件(无co2)。向250cc的哈氏合金压力容器中装入10g的2,5-双羟甲基四氢呋喃(thf-二元醇,76mmol)、50g的碳酸二甲酯(dmc,555mmol,7.11eq.)和50g的meoh。然后将该容器紧密密封并且附接到反应器装置上,并且在700rpm的顶部搅拌速率下加热至200℃持续5h。该时间之后,将溶液冷却至环境温度并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直到300℃,保持10min)分析所得棕色溶液,披露了由未反应的bhmthf组成的单个突出峰和并列的更小的峰,如图8中所示。
对比实例5.
实验条件(无meoh)。向250cc的哈氏合金压力容器中装入10g的2,5-双羟甲基四氢呋喃(thf-二元醇,76mmol)、100g的碳酸二甲酯(dmc,1.10mol,约14.3eq.)。然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在400psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续5h;在该温度下达到的最大压力为1725psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直到300℃,保持10min)分析所得棕色溶液,显示了在10.21和10.35min处的显著的峰(未反应的顺式和反式bhmthf),如图9中所示。
对比实例6.
实验条件(无dmc)。向250cc的哈氏合金压力容器中装入10g的2,5-双羟甲基四氢呋喃(bhmthf,76mmol)、100g的甲醇然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在400psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续5h;在该温度下达到的最高压力为1775psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直至300℃,保持10min)分析所得棕色溶液,其仅披露了关于未反应的bhmthf的信号,如图10中所呈现。
c.丙二醇(pg)的单-和二-甲醚
图11a和11b对应地是丙二醇(pg)起始材料的gc色谱图和质谱图。代表涉及pg和eg的反应,方案3显示根据实例4进行的pg醚化。
方案3.
实例4.
实验条件(meoh,dmc,co2)。向250cc的哈氏合金压力容器中装入10g的丙二醇(pg,131mmol)、50g的碳酸二甲酯(dmc,550mol,约4.2eq.)和50g的meoh。然后将该容器紧密密封并且附接到反应器装置上,用400psi的co2吹扫3次,然后用co2饱和,直到压力在400psi保持稳定(甲醇吸收相当大量的co2)。在700rpm下搅拌时,将该容器加热至200℃,其中反应持续5h;在该温度下达到的最大压力为1890psi。该时间之后,将溶液冷却至环境温度,释放气体,并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直至300℃,保持10min)分析所得棕色溶液。所得到的色谱图(图12a)显示出具有76.0的m/z的在2.72min处的小信号(未反应的pg)、以及都具有90.0的m/z的在2.126、2.159min处的两个突出信号,与pg的单甲醚异构体一致。图12b和12c显示出pg-单乙醚异构体a或b的质谱图。
使用hpinnowax柱和以下入口和烘箱温度升温(ramp)的gc/ms分析:入口-60℃初始,保持1min,每min升温5℃直到100℃,不保持,每min升温60℃直到250℃;烘箱-70℃初始,保持5min,每min升温10℃直到150℃,不保持,每分钟升温20℃直到240min,不保持。结果呈现在图13a-13d中。
图13a是根据本发明方法的实施例的pg醚化的混合的单甲醚和二甲醚产物的气相色谱图。图13b是对应于在图13a中详述的气相色谱图中13.52分钟处的信号的质谱图,并且说明未反应的丙二醇。图13c是对应于在图13a中详述的气相色谱图中2.502分钟处的信号的质谱图,并且表示pg二甲醚(1,2-二甲氧基丙烷)。图13d是对应于在图13a中详述的气相色谱图中3.158分钟处的信号的质谱图,并且表示pg单甲醚的异构体(1-甲氧基丙-2-醇和2-甲氧基丙-1-醇)。
色谱图和相应的谱图二者清楚地显示了pg成为占优势的不分离的单甲醚以及显著量的二甲醚的高转化率。对照实验(无co2)仅显示未反应的pg。
对比实例7.
实验条件(无co2)。向250cc的哈氏合金压力容器中装入10g的丙二醇(pg,131mmol)、50g的碳酸二甲酯(dmc,550mol,约4.2eq.)和50g的meoh。然后将该容器紧密密封并且附接到反应器装置上,并且在700rpm的顶部搅拌速率下加热至200℃持续5h。该时间之后,将溶液冷却至环境温度并且停止搅拌。然后通过gc/ms(70℃初始温度,保持4min,然后每分钟10℃直至300℃,保持10min)分析所得棕色溶液。所得的色谱图仅显示具有76.0的m/z的2.72min处的信号,对应于如图11a中未反应的pg。
d.异山梨醇烯丙基化
代表糖醇,使山梨醇经受环状脱水以形成异山梨醇。在方案4中,将异山梨醇转化为相应的单烯丙基立体异构体。
方案4.
实例5.
实验条件(dmc,co2,烯丙醇)。向300cc的不锈钢压力容器中装入10g的异山梨醇和70g的烯丙醇。将该容器密封后,用600psi的co2吹扫顶部空间3次,然后加压至700psi的co2。以600rpm顶部搅拌时,将该容器加热至225℃,在该温度下反应进行5h。在此温度下,压力读数为1662psi。在冷却至室温之后减压后,将产物转移至100ml的玻璃储存容器中并且通过gc/ms分析内容物。
图14a是显示出根据实例5的异山梨醇烯丙基化产物的分析的气相色谱图。两个峰表示11.465min.处的残余异山梨醇和12.961min.处的异山梨醇单烯丙基醚。图14b显示了未反应的异山梨醇信号的质谱图,并且图14c显示了异山梨醇单烯丙基醚异构体信号的质谱图。
通过过程优化,二醚物种也可以以显著的量生成。我们设想,这可以是生成烯丙醚的途径。然后可以使烯丙醚经受复分解(聚合)和/或环氧化以得到一系列通用的衍生化合物。来自这些反应的产物可以用于例如增塑剂、环氧胶、聚碳酸酯、或油墨调色剂中。
已总体地并借助于实例详细地描述了本发明。本领域的普通技术人员应理解,本发明不必然限于特定披露的实施例,而是在不脱离如由以下权利要求或其等效物(包括目前已知或有待开发的其他等效组分,它们可以在本发明的范围内使用)所定义的本发明的范围的情况下可以作出修改和变化。因此,除非变化另外脱离本发明的范围,否则这些变化应被解释为被包括在此。
- 还没有人留言评论。精彩留言会获得点赞!