声学灌注装置的制作方法
相关申请的交叉引用
本申请要求2015年11月18日提交的美国临时专利申请no.62/256,952的优先权、2015年10月19日提交的美国临时专利申请no.62/243,211的优先权、2015年8月28日提交的美国临时专利申请no.62/211,057的优先权以及2014年12月18日提交的美国临时专利申请no.62/093,491的优先权。这些申请的全部内容通过引用并入本文。
背景技术:
生物技术领域在过去20年中有极大增长。这种增长是由于许多因素造成的,其中一些因素包括可用于生物反应器的设备的改进,对生物系统的了解程度的增加以及关于材料(如单克隆抗体和重组蛋白)与人体各系统的相互作用的知识的增加。
设备的改进允许如重组蛋白等生物衍生材料的更大量和更低成本的生产。这在药物领域尤其普遍,其中许多类型的新药治疗的成功直接归因于通过基于蛋白质的制造方法大量生产这些材料的能力。
在新的基于生物学的药物的制造过程中使用的关键组件之一是生物反应器和与之相关联的辅助工艺。生物反应器领域的增长领域一直伴随灌注过程。灌注过程与补料分批(fed-batch)过程的区别在于其较低的资本成本和连续(而不是分批)操作。
在补料分批过程中,将培养物在生物反应器中接种。在生长周期中逐渐添加另外量的选定营养物质用于提高产量和生长。在收获培养物后回收产物。不连续的补料分批生物反应器工艺由于其简单性以及还由于接续已知的发酵工艺而具有吸引力。然而,补料分批生物反应器具有高的启动成本,并且通常具有大的体积以便在生长周期结束时获得的产物的量具有成本效益。批次完成后,必须对生物反应器清洁和消毒,导致非生产性停工时间。
灌注生物反应器对供应到生物反应器中的连续供应的新鲜培养基进行处理,同时不断地除去生长抑制副产物。灌注生物反应器工艺可以减少或消除非生产性停工时间。在灌注培养物(3000万到1亿个细胞/ml)中获得的细胞密度通常高于补料分批模式(500万到2500万个细胞/ml)下的细胞密度。这些改进导致收获物的污染较少,产量较高,而成本却没有显著增加。然而,灌注生物反应器需要细胞保留装置以防止在副产物被除去时培养物逸出。这些细胞保留系统为灌注过程增加了一定程度的复杂性,需要管理、控制和维护以实现成功的操作。之前,诸如细胞保留设备的失灵或故障等操作问题一直是灌注生物反应器的问题,这在过去限制了它们的吸引力。
技术实现要素:
在各种实施例中,本公开涉及用于灌注生物制造的声学装置。更具体地,该装置联接到相关联的生物反应器。在生物反应器内生产生物分子,如重组蛋白或单克隆抗体。然后,使用声学装置连续地将这些期望产物与细胞分离,并且将细胞连续返回到生物反应器。通常,含有细胞和期望产品的流体培养基通过或流过声学装置并且借助多维驻波(一个或多个)来分离。流体培养基可以连续地流入装置,其中期望的产品被连续地移除。声学灌注装置将健康的能活的细胞返回生物反应器,同时收获期望产物并使期望产物向下游流动以进行进一步处理,例如额外的过滤、层析等。另外,生物反应器中的细胞培养基被澄清,因为细胞碎片也被允许进入收获物流,从而流出待循环至生物反应器的流体培养基。这导致细胞培养基的总体使用量降低,相当于大型生物反应器每天可预期节省高达20,000美元的成本。
在各种实施例中公开的是一种声学灌注装置,包括:声学腔室;入口端口,入口流路从所述入口端口通往所述声学腔室;出口端口,其用于将流过装置的流体再循环回其源头(例如生物反应器);至少一个收集端口,其用于收集离开所述声学腔室的流体的产物流;以及在所述至少一个收获端口下方的所述声学腔室中的至少一个超声换能器,所述至少一个超声换能器包括压电材料,压电材料由电压信号驱动以横跨从所述声学腔室通往至少一个收集或收获端口的收集或收获流路产生声驻波。声驻波可以是平面的或多维的,或者这些波的组合可以存在于声学腔室中(通常来自多个换能器)。声驻波可以被认为是如下“力场”:其阻止全部的细胞但允许例如期望的生物分子(例如重组蛋白和/或单克隆抗体)和细胞碎片等较小的材料通过并从返回到生物反应器的流体中移除。
出口端口通常在入口端口下方,并且通常位于装置的底端。
如上所述,装置可以在装置的顶部具有一个或多个收集或收获端口。在一些更具体的实施例中,装置可以具有在装置的顶端上彼此间隔开的总共两个收获端口。
在特定实施例中,入口端口在装置的第一端处位于第一高度处,所述至少一个超声换能器处于高于第一高度的第二高度,并且底壁从入口端口延伸到出口端口。出口端口可以位于装置的与第一端相反的第二端处。相对于入口端口和出口端口之间的连线,底壁可以是凹形的。该装置可以包括在入口流路上方的上壁。入口端口、出口端口和至少一个收获端口有时都位于装置的前壁上。前壁本身可以是平面的(即平坦的)。
该装置还可以包括位于所述声学腔室中的与所述至少一个超声换能器相对的反射器。可替代地,装置可以具有位于收获流路的相反两侧的、处于相同高度且相互面对的总共两个超声换能器,或者附加的超声换能器可以位于收集/收获流路的多侧。反射器可以位于两个超声换能器之间。还可以存在适当地定位以形成平面的、多维的或这种声驻波(一个或多个)的组合的多个换能器/反射器对。
在特定实施例中,声驻波产生具有相同数量级的轴向力分量和横向力分量的声辐射力。
在本文公开的装置的其他实施例中,入口流路从入口端口向下通向装置的底端并且经过出口端口,然后向上通往声学腔室。有时,入口端口和至少一个收获端口都位于装置的顶壁上,并且出口端口位于装置的前壁上。至少一个超声换能器可以安装在装置的后壁或前壁中。该声学腔室的底壁可以是倾斜的平坦表面。反射器可以由透明材料制成。
入口流路可以被成形为在由声驻波产生的声场下方产生切向流路。在这里看到的另外的版本中,入口流路进入装置第一侧的声学腔室,并且出口端口位于(i)装置的第一侧,或者(ii)相反的第二侧。入口端口可以位于装置的前侧,并且至少一个收获端口可以位于装置的顶壁上。至少一个换能器可以位于装置的前侧或后侧。在更具体的实施例中,可以有两个换能器,一个在前侧,一个在后侧。在另外其它的具体实施例中,在前侧或后侧设有超声换能器以及与换能器相对的、位于相应的后侧或前侧的反射器。
该装置可以附接到具有用于附接的孔的安装件。
还公开了用于从含有细胞的流体培养基中分离细胞的方法。流体培养基流过上述结构的具有至少一个超声换能器的声学灌注装置。驱动至少一个超声换能器以产生声驻波。可以从出口端口收集富含细胞的流体,并且可以从至少一个收获端口收集耗尽细胞的澄清流体。
在特定实施例中,通过收集/收获流路的流量比通过入口流路的流量小至少一个数量级。在具体的实施例中,通过入口端口进入装置的流体培养基的流量为约1升/分钟,并且通过至少一个收集/收获端口离开装置的耗尽细胞的流体的流量为约10毫升/分钟。可替代地,通过入口端口进入的流量与通过至少一个收集/收获端口离开的流量的比率设定为使得声驻波不被细胞的主体克服,或者换句话说使得大量的细胞不会通过收集/收获端口(一个或多个)开始离开装置。
所述方法还可以包括使用附接到装置的至少一个收获端口处的第一泵和附接到装置的出口端口处的第二泵来拉动流体培养基通过装置。
本文还公开了一种流动装置,其适于(i)接收含有初级流体和细胞的流动混合物;和(ii)使用第一声驻波从流动混合物中连续地抽取耗尽细胞的收获流体流,从而改变流动混合物的细胞浓度。可以在声驻波的边缘处产生压力上升以及声辐射力。这种“边缘效应”用作声驻波边缘处的屏障。可以修改声驻波的频率,使得可以阻止或允许不同的对比度因子材料穿过声驻波。
装置还可以包括二次流动腔室,在二次流动腔室中,耗尽细胞的收集流体流穿过频率高于第一声驻波的频率的第二声驻波。
本文还公开了一种流动装置,包括:至少一个入口,其用于接收初级流体和细胞的流动混合物;超声换能器,其产生第一超声波声驻波并使用产生于第一超声波声驻波的边缘处的压力上升和声辐射力,以将流动混合物分离成初级高细胞浓度流体流和次级收获流体流;出口端口,其用于初级高细胞浓度流体流;以及至少一个收集端口,其用于次级收获流体流。还可以存在用于提取浓缩的流体/细胞混合物的排出端口。
装置还可以包括二次流动腔室,在二次流动腔室中次级收获流体流穿过频率高于第一超声波声驻波的频率的第二声驻波。
下面更具体地描述这些和其它非限制性特征。
附图说明
以下是出于说明本文公开的示例性实施例的目的而不是出于对其进行限制的目的而呈现的附图的简要描述。
图1示出了由超声换能器和反射器产生的单个声驻波。
图2是将补料分批生物反应器系统与灌注生物反应器系统进行比较的图示。
图3是显示搅拌釜生物反应器的各种组件的剖视图。
图4是本公开的声学灌注装置的一个示例性实施例的透视图,其具有两个收集或收获端口和单个超声换能器。
图5示出了本公开的声学灌注装置的第二示例性实施例,其中单个反射器位于两个超声换能器之间。
图6是示出与本公开的声学灌注装置联接的灌注生物反应器和再循环路径的示意图。
图7是本公开的声学灌注装置的第三示例性实施例的正剖视图。
图8是图7的声学灌注装置的外部透视图。
图9是本公开的声学灌注装置的第四示例性实施例的正剖视图。
图10是图9的声学灌注装置的透视图。
图11是常规超声换能器的纵截面图。
图12是本公开的超声换能器的纵截面图;换能器内存在气隙,不存在背衬层或耐磨板。
图13是本公开的超声换能器的纵截面图;在换能器内存在气隙,并且存在背衬层和耐磨板。
图14是在不同频率下驱动的方形换能器的电阻抗幅值对频率的曲线图。
图15示出了从与流体流动正交的方向观看到的图14的七个共振频率(电阻抗幅值的最小值)的俘获线配置。
图16是声压幅值(右侧标尺,以pa为单位)和换能器平面外位移(左侧标尺,以米为单位)的计算机模拟;左侧标尺顶部的文字为“×10-7”;向上指向的三角形所示的左侧标尺顶部的文字为“1.473×10-6”;向下指向的三角形所示的左侧标尺底部的文字为“1.4612×10-10”;右侧标尺顶部的文字为“×106”;向上指向的三角形所示的右侧标尺顶部的文字为“1.1129×106”;向下指向的三角形所示的右侧标尺底部的文字为“7.357”,三角形显示对于给定标尺在该图中所示的最大值和最小值,横轴是沿着x轴的腔室内的位置,以英寸为单位,纵轴是沿着y轴的腔室内的位置,以英寸为单位。
图17示出了存在有复合波的晶体的平面内位移和平面外位移。
图18是与相关联的生物反应器进行流体连接的本公开的第一声学灌注装置的视图,示出了将装置的各个端口流体连接到相关联的生物反应器的多个软管和将装置的出口端口流体连接到相关联的生物反应器的出流泵。
图19是图5的另一种声学灌注装置的视图,示出了在第一换能器和第二换能器之间的声学室中的反射器;流体培养基也存在于装置中,并且除了显示出指示反射器与第一换能器和第二换能器之间的声场的波之外,示出的箭头还指示流动方向。
图20是显示以两种不同的灌注液/进料速率从一个实验中的流体培养基中除去细胞的效率的曲线图。
图21是显示实验的收获物流(也称为灌注液)浊度降低的曲线图。
图22是显示对于图20-21的曲线图进行的实验的不同流量而言细胞活力的曲线图。
图23是显示用于另一实验的不同流量和流动方法的总细胞密度和细胞保留的曲线图。
图24是显示对于图23的曲线图进行的实验的不同流量的细胞活力的曲线图。
图25是显示用于另一实验的不同数量的超声换能器的总细胞密度和细胞保留(cellretention)的曲线图。
图26是显示针对图25的曲线图进行的实验的不同数量的超声换能器而言细胞活力的曲线图。
图27是被测试的另一种声学灌注装置的照片。
图28是显示灌注流量或换能器电压对细胞保留的影响的曲线图。
图29a是来自vicell细胞分析仪的进入装置的进料流中的粒子的显微图像;进料流是含有cho细胞、蛋白质和细胞碎片的生物反应器流体。图29b是进料的粒径分布的曲线图,示出了双峰分布;在图29b中,y轴是以10为间隔从0到200的粒子计数,x轴是以2为间隔从6到50的以微米为单位的粒径;粒子的总数是5539,平均粒度为16.78微米,标准偏差为6.76微米,模式(mode)粒度为10.56微米。
图30a是离开装置的灌注液(或澄清的收获物流)的显微图像。图30b是灌注液的粒径分布的曲线图,其显示出在低得多的尺寸下的单模式分布;在图30b中,y轴是以20为间隔从0到300的粒子计数,x轴是以2为间隔从6到50的以微米为单位的粒径,粒子的总数是2919,平均粒度为10.08微米,标准偏差为3.75微米,模式粒度为8.99微米。
图31是示出了图27的装置内的速度分布的cfd模型;标尺顶部的文字为“×10-2”,向上指向的三角形所示的标尺顶部的文字为“0.678”,向下指向的三角形所示的标尺底部的文字为“0”,三角形显示对于给定标尺在该图中所示的最大值和最小值,标尺以0.5为间隔从0延伸到5m/s,黑色表示标尺顶部为5,白色表示标尺底部为零。
图32是图27的装置的正视图,示出了流路、声场和声学边缘效应。
图33是显示两种操作模式的图27的声学灌注装置的复合照片;在左侧,装置处于启动或细胞沉降模式,在右侧,装置处于稳定的细胞保留模式。
图34示出了用于细胞保留的声学装置的模型模拟的几何形状;该模型包含两种流体,一种是声场内的澄清流体,另一种是声场、压电换能器、钢反射器和铝外壳左侧的高细胞密度流体;第一种流体是声场内的水,第二种流体是声场外(左侧)水溶液中的cho细胞的15%浓度;模型中的蓝色实线表示两种流体之间的分离线。
图35a、35b和35c是示出在几种操作频率下图34的模型模拟的压电材料、铝外壳和钢反射器的位移(左侧标尺)以及两种流体中的声压(右侧标尺)的曲线图;图35a处于2.218mhz的频率,图35b处于2.2465mhz的频率,图35c处于2.3055mhz的频率;对于所有三个曲线图,左侧标尺顶部的文字指示读数为“×10-6”或“×10-7”,以英寸为单位;右侧标尺顶部的文字指示读数为“×106”,以帕斯卡为单位;y轴以0.2的间隔从-0.8延伸到1.6,x轴以0.5的间隔从-0.5延伸到1.5。
图36是示出在几个操作频率下作用在悬浮的cho细胞上的平均横向力(n)和由功率归一化的平均横向力(n/w)的曲线图。
图37是本公开的声学灌注装置的照片(俯视图),箭头表示流入入口端口;流出出口端口;澄清的流体从装置的顶部流出,并且浓缩液从装置的底部流出。
图38是图37的声学灌注装置的照片(侧视图)。
图39是图37的装置的细胞保留与灌注液流量的曲线图。
图40是示出直接流过滤(dff)和切向流过滤(tff)的现有技术图示。
图41是示出灌注期间的第一种操作模式的图,其中细胞被俘获、聚集并与收获物流分离,装置竖直操作,箭头指示重力方向。
图42是示出灌注期间的第二操作模式的图,其中防止细胞进入声驻波场,同时允许较小的离子通过该场并进入收获物流,装置竖直操作,箭头指示重力方向。
具体实施方式
通过参考以下优选实施例的详细描述及本文包括的实例,可以更容易地理解本发明。在以下说明书和随后的权利要求书中,将参考定义为具有下述含义的大量术语。
尽管为了清楚起见在以下描述中使用了特定术语,但是这些术语旨在仅旨在指示用于图示说明而选择的实施例的特定结构,并且不旨在限定或限制本公开的范围。在以下的附图和下面的描述中,应当理解,相似的数字标号指代相似功能的组件。
除非上下文另有明确说明,否则单数形式的“一”、“一个”和“该”也包括多个指示物。
术语“包含”在本文中用于要求存在所指明的组分并允许存在其它组分。术语“包括”应被解释为包括术语“由……组成”,其允许仅存在指明的组分以及可能由指明的组分的制造而产生的任何杂质。
数值应当被理解为包括在被约简成相同有效数字时相同的数值以及与设定值之差比用于确定该值的本申请描述的常规测量技术类型的实验误差小的数值。
本文公开的所有范围包括所述端值并且是可独立组合的(例如范围“从2克到10克”包括端值2克和10克以及所有中间值)。本文公开的范围的端点和任何值不限于精确的范围或值;它们足够不准确以包括近似这些范围和/或值的值。
结合数量使用的修饰语“约”包括所述值,并具有上下文规定的含义。当在范围的上下文中使用时,修饰语“约”也应被视为公开由两个端点的绝对值定义的范围。例如,“约2至约10”的范围也公开了“从2到10”的范围。术语“约”可以指所表示的数的加或减10%。例如,“约10%”可表示9%至11%的范围,“约1”可指0.9-1.1。
应注意的是,本文所使用的许多术语是相对性的术语。例如术语“上”和“下”是在位置中相对于彼此而言的,即沿给定取向,上部件位于比下部件高的位置,但是如果该设备被翻转,则这些术语会发生改变。术语“入口”和“出口”针对相对于给定结构而言从中流动通过的流体,例如流体流动通过入口而进入该结构,并且流体通过出口而从该结构流出。术语“上游”和“下游”相对于流体流动通过各种部件的方向而言,即流体在流动通过下游部件之前流动通过上游部件。应注意的是,在一个环路中,第一组件可以被描述为同时位于第二组件的上游和下游。
术语“水平”和“竖直”用于表示相对于绝对基准(即地面)的方向。然而,这些术语不应当被解释为要求结构彼此绝对平行或绝对垂直。例如第一竖直结构和第二竖直结构彼此不必平行。术语“顶部”以及“底部”或“基部”是相对于绝对基准(即地球的表面)而言的,用来指顶部总是高于底部/基部的表面。术语“向上”和“向下”同样相对于绝对基准而言;向上始终克服地球的重力。
本发明提到“相同的数量级”。如果较大数字除以较小数字得到的商为小于10的值,则这两个数字具有相同的数量级。
生物反应器可用于制备如重组蛋白或单克隆抗体等生物分子。极其常见的是,将细胞在具有培养基的生物反应器容器中培养以产生期望产物,然后通过在声学灌注装置(例如本公开的装置)中从细胞和培养基中进行分离来获得期望产物。声学过滤装置允许提取出一些期望产物、培养基的一小部分和小于细胞的细胞碎片/碎屑,其余的被再循环回生物反应器(特别是细胞)。使用包括中国仓鼠卵巢(cho)、ns0杂交瘤细胞、幼仓鼠肾(bhk)细胞、昆虫细胞和人细胞(例如t细胞、b细胞、干细胞、血红细胞)在内的哺乳动物细胞培养物以及活/生物细胞通常被证明是生产/表达用于如药物或疫苗等各种应用的重组蛋白和单克隆抗体的非常有效的方式。存在两种一般类型的生物反应器过程:补料分批和灌注。
虽然补料分批反应器目前是规范,主要是由于许多科学家和技术人员对该过程的熟悉程度,灌注技术的发展速度非常快。许多因素有利于使用灌注生物反应器过程,主要是因为它有利于连续生产。灌注生物反应器的资本和启动成本较低,需要较小的上游和下游容量,产量可以更高,过程是持续的,并且该过程与补料分批方法相比使用更小的体积和更少的种子步骤。灌注生物反应器过程也更适合开发、扩大规模、优化、参数敏感性研究和验证。
灌注生物反应器也可用于产生将被用于细胞治疗过程的细胞。在这种灌注生物反应器中,如cart细胞、jurkatt细胞等生物细胞在灌注生物反应器中进行培养。在本公开的灌注装置中使用的声驻波可以用于在转染过程之后分离能活的细胞和不能活的细胞。这允许用这种t细胞疗法接种患者的疗效得到改善,因为仅使用能活的细胞。通过灌注过程将不能活的细胞和细胞碎片分离出来,这些物质进入二次流并离开生物反应器。
灌注生物反应器技术的最新发展也有利于其使用。控制技术和一般支持设备正在改善灌注生物反应器,增加灌注过程的稳定性。灌注过程现在可以扩大到具有高达1000升(l)的体积的生物反应器。用于灌注生物反应器的更好的细胞保留系统产生比以前所见更低的细胞损失和更大的细胞密度。与约2000万个细胞/ml的补料分批细胞密度相比,现在可以实现大于5000万个细胞/ml的细胞密度。较低的污染和感染率提高了灌注生物反应器的产量。因此,灌注过程导致收获物中产物浓度更高、产量更高而成本未显著增加。
因为来自表达细胞培养物的生物分子的连续生产以及在该过程中所述生物分子在收获前的更短停留时间,灌注生物反应器是特别有吸引力的。靶细胞因过滤过程(例如切向流过滤(tff)或交替切向流过滤(atf))被阻止,同时从灌注生物反应器中提取表达的生物分子。然后将细胞返回生物反应器以确保它们接收营养和氧气以维持整个细胞培养物的产生。在灌注反应器过程中,细胞继续繁殖,因此在整个灌注生产过程中还需要排出一些细胞培养物群。
tff过滤过程和atf过滤过程具有几个问题,例如生物分子产物的堵塞/结垢和损失(特别是在高细胞密度下),这些都与过滤中使用的中空纤维膜的性质直接相关。因此,期望找到不堵塞并最小化期望生物分子产物的损失的新过滤工艺。此外,tff和atf将保留生物反应器内的所有细胞碎片和细粒,这是不希望的。因此,能够区分细胞保留同时允许细胞碎片和细粒通过的工艺可能是有利的。
简而言之,本公开涉及能够从一个或多个压电换能器产生多维声驻波的声学灌注装置,其中换能器电气地使得它们以多模式位移模式移动,而不是以“活塞”振动模式移动。通过这种声驻波产生方式,产生比以仅产生一个大驻波的“活塞”模式激发压电换能器的情况下更高的横向俘获力。因此,以与压电换能器相同的输入功率,多维声驻波与平面声驻波相比可具有更高的横向俘获力。输入功率可调节为受控流量。这可以用于促进来自生物反应器的流体流的蛋白质流体纯化。可替代地,声驻波也可以是平面驻波,其中压电换能器在活塞模式下被激发,产生平面波。声驻波也可以是平面声驻波和多维声驻波的组合。所有这些驻波产生“边缘效应”,使得来自生物反应器的细胞被阻止,并且允许从细胞、细胞碎片和小碎屑表达的生物分子产物通过。
声泳(acoustophoresis)是从流体分散物中分离粒子的低功率、无压降、无堵塞的固态方法(即,其用于实现更典型地用多孔过滤器进行的分离,但是它没有过滤器的缺点)。特别地,本公开的声学灌注装置适于与用于具有高流量的流动系统中的分离的大尺度生物反应器一起使用。声学灌注装置被设计成产生高强度的多维超声波驻波,多维超声波驻波产生能够在低流量下克服流体阻力以及浮力或重力的组合作用的声辐射力。结果,辐射力用作防止目标粒子(例如,生物细胞)与驻波平面交叉的过滤器。如上所述,驻波的俘获能力可以根据需要改变,例如通过改变流体的流量、声辐射力和声学过滤装置的形状,以通过俘获和沉降使细胞保留最大。该技术为分离二次相提供了绿色和可持续的替代方案,而且大大降低了能源成本。对于小至1微米的粒度,已经证明了优异的粒子分离效率。
通常,声场在粒子上的散射导致作为三维俘获场的三维声辐射力。当粒子相对于波长较小时,声辐射力与粒子体积(例如,半径的立方)成比例。它与频率和声学对比因子(acousticcontrastfactor)成比例。它还与声能(例如,声压幅值的平方)成比例。对于谐波激发,力的正弦空间变化将粒子驱动到驻波内的稳定位置。当施加在粒子上的声辐射力比流体阻力和浮力/重力的组合作用更强时,粒子被俘获在声驻波场内。横向和轴向声力对俘获的粒子的作用导致因增强的重力(比宿主流体(hostfluid)重的粒子)或浮力(比宿主流体轻的粒子)沉降的粒子的浓缩、附聚和/或聚结而形成紧密堆积的簇。另外,二次粒子间力,如bjerkness力,有助于粒子附聚。
大多数生物细胞类型具有比悬浮着这些生物细胞的培养基更高的密度和更低的可压缩性,使得细胞和培养基之间的声学对比因子具有正值。结果,轴向声辐射力(arf)将细胞向驻波压力波节驱动。声辐射力的轴向分量将具有正对比因子的细胞驱动到压力节面(nodalplane),而具有负对比因子的细胞或其它粒子被驱动到压力波腹面(anti-nodalplane)。声辐射力的径向或横向分量是俘获细胞的力。arf的径向或横向分量大于流体阻力和重力的组合作用。对于小细胞或乳剂,阻力fd可表示为:
其中uf和up是流体和细胞速度,rp是粒径,μf和μp是流体和细胞的动态粘度,并且
对于要被俘获在多维超声波驻波中的细胞,细胞上的力平衡必须为零,因此可以找到用于横向声辐射力flrf的表达式,其由下式给出:
flrf=fd+fb。
对于已知尺寸和材料性质的细胞,并且对于给定的流量,该等式可用于估计横向声辐射力的大小。
用于计算声辐射力的理论模型是基于由戈尔科夫(gor'kov)开发的公式。主声辐射力fa被定义为场势u的函数,
其中场势u被定义为
f1和f2是单极子和偶极子贡献,由下式定义
其中p是声压,u是流体粒子速度,λ是细胞密度ρp与流体密度ρf的比率,σ是细胞声速cp与流体声速cf的比率,vo是细胞的体积,而<>表示波周期的时间平均。
戈尔科夫的理论被限制在相对于流体和粒子中的声场的波长而言为小的粒度,并且也没有考虑到流体和粒子的粘度对辐射力的影响。已经开发了用于计算粒子的声辐射力的附加数值模型,对于相对于波长的粒度没有任何限制。这些模型还包括流体和粒子粘度的影响,因此更准确地计算声辐射力。实施的模型基于yuriiilinskii和evgeniazabolotskaya的理论操作,如aipconferenceproceedings,vol.1474-1,pp.255-258(2012)中所描述的。
期望地,超声换能器(一个或多个)在流体中产生多维驻波,其在悬浮粒子上施加横向力以伴随轴向力。在文献中公布的典型结果表明,横向力比轴向力小两个数量级。相比之下,本申请中公开的技术提供了与轴向力相同数量级的横向力。然而,在本文进一步描述的某些实施例中,该装置使用产生多维声驻波的换能器和产生平面声驻波的换能器。为了本公开的目的,横向力与轴向力数量级不同的驻波被认为是“平面声驻波”。由本公开的超声换能器(一个或多个)产生的总声辐射力(arf)的横向力分量是显著的,并且足以克服高达1cm/s的线性速度下的流体阻力,并且产生紧密堆积的簇,并且与总声辐射力的轴向力分量具有相同的数量级。
将本公开的技术与现有的过滤技术进行对比可能是有帮助的。图40显示了两种现有技术的过滤方法。图40的左侧示出了直接流过滤(dff)。在dff中,流体和粒子的整个进料流4005被引向过滤器。过滤器4010阻止大于过滤器孔径的粒子4020,而较小粒子4030和流体通过过滤器。图40的右侧示出了切向流过滤(tff)。在tff中,进料流不朝向过滤器。相反,进料流切向地朝向过滤器,使得大部分进料流在过滤器表面上切向地通过。通常,该进料流被再循环以多于一次通过过滤器。更小的滤液流4006被拉动穿过含有较小粒子4030的过滤膜。tff相比于dff的一个优点是切向流减少了过滤器的堵塞和结垢以及位于过滤器顶部的凝胶层的形成。
在本公开的装置中,在启动期间,通过俘获细胞并将其生长成紧密堆积的簇的过程来澄清由声驻波声透射的流体,使得发生细胞簇的连续重力分离。由于有限量的新细胞流入该体积,这导致经受声驻波的流体的快速澄清。当达到该状态时,该系统可以被描述为包括两种流体:含有期望产物和小细胞碎片/碎屑的第一流体(已经通过声驻波),以及含有生物反应器流体和所有细胞的第二流体(被声驻波阻止)。两种流体可能具有不同的有效声学特性,例如声密度和声速,这两种流体之间具有良好限定的界面。界面通常位于声驻波场的下边缘附近,产生“声学边缘效应”。第一流体(即,已经被澄清并包含产物、一些细胞和细胞碎片的流体)在界面的下游,并且代表收获物流并且占据由声驻波场所声透射的流体的体积。第二流体(即含有生物反应器流体和大部分细胞的流体)在界面的上游。这两种不同的流体可以在图33中看到。
声驻波场在两个流体之间的界面上施加声辐射压力(即压力上升)和声场的声学边缘处的力,从而阻止上游细胞进入声场。界面上出现的辐射压力和该力允许包含产物的第一流体通过界面,同时将细胞保留在上游流体中。借助在两种流体之间的界面处的声辐射力的作用阻止的细胞可以连续地返回到生物反应器,以确保它们接收营养和氧气以维持整个细胞培养物的产生。
界面下方的流场的循环运动把由声场保留的细胞传送回生物反应器。循环流动由初级再循环流驱动,并可通过声学腔室几何变化进行优化,以实现最大的系统效率。这将在下面参考图33进一步讨论。
在灌注期间,本公开的声学灌注装置具有多种可能的操作模式。这些模式之一可能在装置中占主导,或者它们可以同时发生,这取决于装置内的细胞和流体的分布。在图41所示的第一操作模式(模式1)中,含有细胞的流体4020(亮色)进入声驻波场4040,声驻波场4040在此产生于换能器4008与反射器4009之间。多维声驻波在特定点俘获细胞,将细胞打包成紧密堆积的簇4022,并通过增强的重力沉降来连续地分离簇。细胞簇沉降,进入切向流路(由箭头4001指示),并通过再循环流重导向到生物反应器。较小的粒子4030(较暗的颜色)不被声驻波所俘获并穿过声驻波,以便被收获。收获物流动方向由箭头4002表示。该装置的取向是重要的,并且也示出了重力方向。
在图42中示出了第二种操作模式(模式2),其中声泳系统为细胞产生强的屏障并且防止细胞进入声场。这里,通过声驻波的边缘效应,在两种流体之间建立了细胞的屏障。第一澄清流体流4050包含收获物流以及在声驻波场内的较小粒子/期望副产物4030。第二流体流4055在声驻波场的上游包含保留的细胞4020。收获物流动方向由箭头4002表示。在这种操作模式中,实现了声学边缘效应(由虚线4007表示)。非常典型地,声学边缘效应阻止细胞并防止它们进入声场,而包含产生的生物分子和细胞碎片的流体流的一部分被允许穿过由声学边缘产生的屏障。在声学边缘下方的切向流路(箭头4001)收集保留的细胞并使它们流回到主再循环流中并返回到生物反应器。这也将在下面参考图32进一步讨论。此外,示出了重力方向。
在灌注应用中,声泳装置的设置类似于tff的设置。含有细胞、细胞碎片、细粒和产物(即蛋白质)的进料流从生物反应器流入灌注系统。流的一部分沿着声驻波的下边缘以切向方式流动并且再循环回到生物反应器。较小部分的进料流被收获,即转向并流动穿过声驻波。这里,声驻波功能与tff中的过滤器非常相似,防止细胞进入声场。收获物流含有较小的粒子,例如细胞碎屑和细粒以及期望的生物分子产物。由声驻波保留的细胞通过再循环流输送回生物反应器。在本文中进一步讨论的图32还示出了使用切向流动流的灌注装置。
与细胞澄清或油/水应用相反,灌注应用通常需要高细胞密度,例如>5000万个细胞/ml以及较低的收获速度。两种流体流也具有不同的有效声学特性,即声速和培养基/细胞混合物的密度。随着细胞密度增加,两种流体流的声学特性差异也将更加显著。声驻波场现在将在富含细胞的第二流体流上施加声辐射压力,即压力上升,并在悬浮在流体中的细胞上施加声辐射力。该辐射压力和辐射力作用在两种流体之间的与声场的上游边缘重合的界面处。当声辐射力的这种“声学边缘”效应足够强时,它将防止细胞进入声场。同样重要的是收集保留的细胞并将其运送回生物反应器的切向流路。
声学边缘效应也可以被称为声壁效应,并且由声场的边缘对悬浮的粒子施加强的横向力而产生,即在收获物流的方向上并且垂直于声驻波的轴线,从而阻止相对较大尺寸的粒子进入声场并且仅允许澄清的流体(即含有较小尺寸的产物的流体)进入声场,从而产生声学灌注细胞保留装置。以这种方式,只有澄清的流体才能逸出,细胞被辐射力保持。这个力从来不是正的,这意味着它总是将细胞保持在界面处,即,力作用在上游流动方向上,不允许它们逃逸声学边缘。功率曲线中的多个峰值(参见下面的图37的讨论)示出了存在多种操作模式,包括平面共振模式和多维操作模式,表明这种类型的操作同样可以通过利用平面驻波和多重驻波来产生。在具有1”×1”尺寸的系统中,每30khz存在平面共振。图37显示了表明存在多维模式的额外峰值的证据。每单位功率,这些模式可以与平面共振模式同等有效或甚至更有效。如上所述,然后可以通过流场的擦洗运动(即,在界面下方的再循环流)来拾取由声辐射力阻挡的细胞,并且这些细胞连续地返回到生物反应器,以确保它们接收营养和氧气来保持整个细胞培养物的产生。
澄清的流体含有期望产物和细胞碎片,所有这些都小于全部能活的细胞。以这种方式,返回到生物反应器的培养基澄清细胞碎片。细胞碎片在不产生期望产物的情况下吸收培养基,使灌注过程效率降低。因此,通过使用本公开的声学灌注装置去除这些细胞碎片而获得了效率增益和成本节省。可以使用包含以更高频率操作的另一换能器-反射器对的第二装置或二次流动腔室在下游实现澄清流体的进一步澄清。以与上述相同的方式,这样俘获并附聚尺寸约为10微米或更小的可能意外通过原始声驻波的粒子。可以使用在3mhz至20mhz的更高频率下操作的另一个换能器-反射器对来俘获、附聚和脱离出已经通过初始声驻波和“边缘效应”的小细胞碎片和碎屑。含有期望生物分子的这种三重澄清流体可以随后直接进入无菌过滤器。例如,原始声学灌注装置可以在高达约4mhz的频率下操作。可以想到,该第二和第三声驻波场的频率将为约6mhz至约20mhz,并且可能更高,以俘获较小尺寸的细胞碎片。
在低细胞密度(例如200万个细胞/ml)的生物反应器启动期间,所描述的第一操作模式占主导地位(图33,左图)。当生物反应器中的细胞密度随时间而增加时,操作模式逐渐从模式1切换到模式2,并且两种模式可以同时共存。
当使用声驻波在具有已经高的细胞密度(例如,5000万个细胞/ml)的生物反应器中灌注时,该装置通常以第一操作模式(图33,左图)开始,直到澄清声驻波内的流体体积,此时操作逐渐切换到所描述的第二操作模式(图33,右图)。有时,在操作中,通常表现为两种流体之间的界面的扰动或振荡的不稳定性可能增长得足够强,使得细胞进入声驻波内的流体体积,此时在短时间内,装置以组合的操作模式起作用,其中两种模式都是有效的(即,如上所述,边缘效应防止细胞进入声场,而声场澄清已经进入声驻波场内的流体体积的细胞)。一旦紧密堆积的细胞簇已经沉降(即,一旦声驻波中的流体体积已被充分地澄清),操作模式于是再次是包括声学边缘效应的所描述的第二操作模式。重要的是要注意,如上所述,装置可以在两种/任一种操作模式下操作,而无需进行外部切换。换句话说,流体流的性质(例如流中的细胞浓度)和声场决定了哪个模式占主导地位。
与先前在文献中描述的现有的声学过滤器的使用相比,本公开的声驻波灌注装置的操作方式不同。以前,操作声泳,使得产生蛋白质的材料,如中国仓鼠卵巢细胞(cho细胞)(重组蛋白治疗剂工业生产中最常用的宿主),被俘获在超声驻波内(即保留在静止位置)。通过使各个细胞向平面声驻波的压力节面迁移而将细胞保留在声场中。在那里,由于细胞被保留在驻波中,所以还对流过的细胞培养基进行物理擦洗,由此当它们与已经保持在驻波内的细胞接触时,更多的细胞被俘获。然后间歇地关闭驻波,以使细胞从驻波中脱离出来并返回生物反应器。
相反,在本公开中,超声波驻波被用作毯子(blanket)或选择器或“力场”。流体流过灌注装置,使得重力首先用作在生物细胞上,导致它们下沉,而不是将生物细胞俘获在驻波之内。在过滤装置的顶部附近产生驻波,并且起到过滤器的作用,以防止细胞进入声场并通过过滤装置的顶部离开(即,作用类似于阻止细胞进入声场的力场)。因此,产生两个输出流,一个输出流保留细胞并通过装置底部的端口排出,另一个输出流在细胞中耗尽,并通过装置顶部的端口排出(将两个输出流中的细胞浓度彼此进行比较)。这几乎不依赖于声场内的细胞的附聚,从而在某些应用中特别有利,这是因为不需要声学过滤装置中的细胞的保留时间。
换句话说,声学灌注装置具有以不同流速流动的两个流体流。携带表达细胞培养物、培养基、产物和其他生物反应器成分的主要流体流进入该装置并部分转入次级的较低体积的较低流量的流体流。该次级流体流穿过多维声驻波,其中多维声驻波(或通常为声驻波)阻止主要细胞培养物,并允许表达的生物分子、单克隆抗体和重组蛋白连同其他小粒子如亚微米和微米尺寸的细胞碎屑一起通过并在生物反应器外部/下游进一步被收集和处理。然后将含有主要细胞培养物的主要流体流再循环回生物反应器。
在另一个应用中,声学灌注装置可以用作用于细胞治疗应用的保留装置和细胞清洗装置。在连续的细胞培养应用中,例如自体和同种异体细胞治疗,有必要纯化、隔离、然后增殖最初以非常低的细胞密度收获的细胞。相对较少的细胞在生物反应器中接种,其中细胞数必须增加。对于各种应用,都需要诸如浓缩、清洗和培养基交换的进一步处理步骤。所有这些应用中的共同点是需要连续地循环、添加和/或移除培养基,同时将细胞保留在生物反应器(可能是传统型的或单次使用型的)中,而不影响其生存力。本文所述的声学细胞保留系统在一定范围的细胞再循环速率下操作,在一定范围的灌注(或培养基移除速率)下高效地保留细胞,并且可被调整以通过功率或频率操纵完全保留或选择性地传递一定百分比的细胞。功率和流量都可以被监控并用作自动化控制系统中的反馈。还可以使用特定的流路,使得主要流体流的小体积被“啜饮(sipoff)”并且表达的生物分子与主要细胞培养物分离。
声泳的一个优点是声辐射力不会伤害或有害地影响生物细胞或期望的生物分子产物。此外,灌注是连续的,使得细胞培养物保持能活且可以从其中连续回收期望的产物。
在灌注生物反应器系统中,期望能够将能活的生物细胞从流体流中的表达材料(即细胞培养基)和细胞碎屑中过滤和分离出来。如前所述,这样的生物细胞可以包括中国仓鼠卵巢(cho)细胞,其细胞基因组被操纵以表达大的生物分子。这样的生物分子可以包括重组蛋白或单克隆抗体,并且是要回收的期望产物。
本公开的声学灌注装置被设计成保持可以充当过滤器的高强度多维声驻波,从而允许更小的粒子(例如重组蛋白质或细胞碎屑)通过,同时排除较大的粒子(如能活的细胞)。通常,装置由振荡器和放大器(未示出)驱动,并且装置性能由计算机(未示出)监视和控制。有时由于声流可能需要调制驻波的频率或电压幅值。这可以通过幅度调制和/或通过频率调制来完成。也可以利用驻波传播的占空比来获得某些结果(即声波束可以在不同的时间段或以不同的速率接通和关断)。
图1示出了由设置为共振以形成驻波102的反射器板101和超声换能器103组成的单驻波系统100。通常由换能器103施加在100khz至100mhz的范围内的激发频率。在换能器103和反射器101之间产生一个或多个多维驻波。理想的驻波是频率和强度相等并且在相反方向上(即从换能器到反射器以及返回)行进的两个传播波的总和。传播波相互相长干涉,从而产生驻波。虚线105用于表示波的零幅值。波节是波具有最小幅值的点,并且用附图标记107表示。波腹点是波具有最大幅值的点,并且用附图标记109表示。
图2是将补料分批生物反应器系统201(左侧)与灌注生物反应器系统202(右侧)进行比较的示意图。从左侧的补料分批生物反应器开始描述,生物反应器210包括反应容器220。细胞培养基通过进料入口222馈送到反应容器中。搅拌器225用于使培养基在整个细胞培养物中循环。这里,将搅拌器描绘为一组旋转叶片,但是可以考虑引起循环的任何类型的系统。生物反应器允许种子培养物通过生长/生产周期生长,在此期间,碎屑、废物和不可用的细胞将在生物反应器中积聚,并且也将会产生期望产物(例如生物分子,如单克隆抗体、重组蛋白质、激素等)。由于这种积聚,补料分批过程的反应容器通常比灌注过程中的反应容器大得多。然后在生产周期结束时收获期望产物。反应容器220还包括用于去除材料的出口224。
现在转而描述右侧的灌注生物反应器202,同样,生物反应器包括具有用于细胞培养基的进料入口222的反应容器220。搅拌器225用于使培养基在整个细胞培养物中循环。反应容器的出口224流体连接到本公开的声学灌注装置230的入口232,并将生物反应器内容物(包含细胞和期望产物)连续地供给到过滤装置。灌注装置位于反应容器的下游,并将期望产物与细胞分离。声学灌注装置230具有两个单独的出口:产物出口234和再循环物出口236。产物出口234将声学灌注装置230流体地连接到灌注装置下游的容纳容器240,容纳容器240从灌注装置接收期望产物(加上培养基)的流动。从此处,可进一步进行处理/纯化以隔离/回收期望产物。例如,在该声学灌注装置的更下游,可以设置附加的过滤器,例如atf、tff、深度过滤器、离心机等。再循环物出口236将声学灌注装置230向回流体地连接到反应容器220的再循环物入口226,并用于将细胞和细胞培养基送回反应容器中以继续生长/生产。换句话说,在反应容器和灌注装置之间存在流体回路。灌注生物反应器系统202中的反应容器220具有连续的产物生产能力,因此可以变得更小。过滤过程对灌注生物反应器的生产能力至关重要。较差的过滤过程将仅允许低生产能力并导致期望产物的低产量。
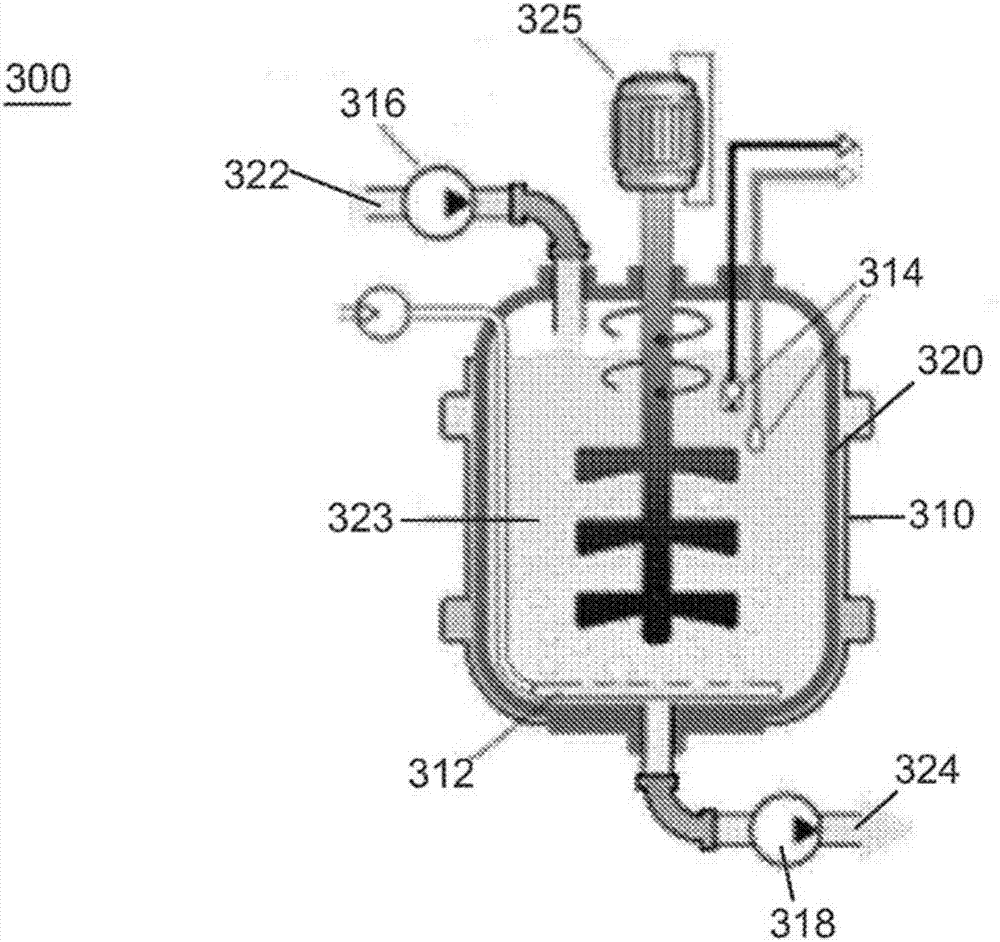
图3是可用于本公开的系统的通用生物反应器300的纵截面图。如图所示,生物反应器包括具有内部体积323的反应容器320。容器顶部的进料入口322用于将细胞培养基馈送到容器中。存在搅拌器325。出口324显示为处于容器的底部。热护套310围绕反应容器,并用于调节细胞/培养基的温度。通气装置312位于容器的底部,用于向内部容积提供气体。传感器314显示为处于容器的右上部。示出了用于将细胞培养基馈送到容器中的泵316以及从容器中除去细胞培养基的另一个泵318。
上述灌注系统使用本公开的声学灌注装置。生物反应器的内容物连续地流过声学灌注装置以俘获期望产物。
图4是可以与前述系统一起使用的声学灌注装置400的第一实施例。该装置包括入口端口410、出口端口430、第一收集端口470、底壁420和声学腔室450。声学腔室450也可以称为流体单元(fluidcell)。
入口端口410位于上述装置的第一端412处。通常,入口端口410流体连接到相关联的生物反应器并且用作入口,含有细胞、细粒和产物的流体培养基通过该入口被引入到上述装置中。入口流路451从入口端口410通往包含内部容积的声学腔室450。上壁411可以位于从入口端口通向声学腔室的入口流路上方,上壁具有基本水平的取向。入口流路具有横截面面积452(由虚线绘制的矩形示出)。
入口端口410位于出口端口430上方的第一高度402处,出口端口430限定装置的底端。换句话说,出口端口430位于声学腔室450下方或者在入口端口410下方,或位于装置的底端416处。出口端口430设置在入口端口410下方确保流过装置的流体因重力被动地受到朝向出口端口430的推动,并且在装置内产生液压头。出口端口430也可以被称为流体循环端口,这是因为宿主流体通过出口端口430从装置再循环或返回到相关联的生物反应器。如这里所示,出口端口430也位于装置的与第一端412相反的第二端414。第一端412和第二端414可以被认为是x轴上的相反两端,而底端416和顶端418可以被认为是z轴上的相反两端。
第一收集端口470在装置的顶端418处位于声学腔室450上方,并且流体地连接到声学腔室。装置可以包括与第一收集端口470间隔开的额外的收集端口,例如第二收集端口472。第一收集端口470和第二收集端口472通常用于从装置收获和回收期望的生物分子副产物的一部分。收集流路或收获流路453从声学腔室通往收集端口470,472。收集流路具有横截面积454(由虚线绘制的矩形示出)。在一些特定实施例中,收集流路的横截面积454大于入口流路的横截面面积452。这是使通过收集端口470,472的流体流量可以比进入的流体流量低得多的一种方法。当用于灌注生物制造时,收集端口也可以称为灌注端口或收获端口。因为收获了耗尽细胞但富含有期望的生物分子产物、细胞碎屑和其他细粒的流体,收集端口也可以被称为收获端口,而收集流路也可以称为收获流路。
在该实施例中,底壁420从装置的入口端口410延伸到出口端口430。可以改变底壁420的确切形状以获得期望的流体流动。如图所示,底壁420从装置的入口端口410向出口端口430弯曲。相对于入口端口410和出口端口430之间的线,如虚线401所示,底壁420具有凹曲线。出口流路432从声学腔室450通往出口端口430。
如这里所示,第一超声换能器460位于装置的侧壁440上的第二高度404处,第二高度404位于第一高度402上方(即,更接近装置的顶端418)并且在收集端口470,472下方。位于声学腔室450上方和收集端口470,472下方的该体积在此被识别为收获区域或收集区域456。第一超声换能器460包括压电材料,压电材料可由电压信号驱动以跨越收集流路453在声学腔室450中产生多维驻波。因此,声辐射力场将声学腔室450与收集端口470,472分离。
在图4的实施例中,该装置包括位于与第一超声换能器460相反的壁上的反射器480。反射器也位于第二高度(即,与换能器相同的高度)处。换能器460和反射器480一起产生如图1所示的多维声驻波。
在所示该实施例中,入口端口410、出口端口430和收集端口470,472均位于装置的前壁475上。还可以想到,根据需要,这些端口可以面向任何其他方向。前壁475在这里被示出为具有平坦或平面的表面,并且具有恒定的厚度。然而,如果需要,例如前壁的形状也可以改变,以改变横截面面积452,454。最后,装置的后壁附接到安装件490,安装件490包含孔492以用于将灌注装置附接到表面来进行操作。
在使用中,含有生物细胞和较小分子的流体培养基通过入口端口410进入声学腔室450。在声学腔室内部,重力用于将生物细胞朝向出口端口430向下拖动。在声学腔室中发生被动沉降过程,在装置的底端416处产生具有相对较高浓度的生物细胞的流体,并且在装置的顶端418处产生具有相对较低浓度的生物细胞的流体。绝大多数进入的流体,以及绝大多数的细胞群不会穿过声驻波(一个或多个)。具有高浓度生物细胞的流体被泵送回生物反应器,并且通过收集端口(一个或多个)470,472抽出并收集具有相对低浓度的生物细胞的流体(并且还含有期望的生物分子)。该装置的声驻波(一个或多个)用于防止大量生物细胞通过收集端口(一个或多个)470,472离开。
在各种实施例中,通过收集流路或收获流路453的流量与通过入口流路451的流量相比小至少一个数量级。在更特定的实施例中,通过入口端口进入装置的流体培养基的流量约为1升每分钟(l/min),通过收集端口(一个或多个)离开装置的细胞被耗尽的流体的流量约为10毫升每分钟(ml/min)。在一些测试中,具有2升至10升尺寸的生物反应器已经用含有高达10%酵母和高达5000万个细胞/ml的溶液进行了测试。通过入口端口的流量为约0.75l/min至约3l/min,通过收集流路(即,所有收集端口在一起)的流量为约1ml/min至约30ml/min。已经实现95%的细胞回收率。
本公开的声学灌注装置可以过滤非常高的细胞密度,约1亿个细胞每毫升,可能在约6000万至约1.2亿个细胞每毫升的范围内,而其他过滤技术(如atf)仅能够以小于8000万个细胞每毫升的密度进行过滤。与中空纤维膜不同,如果需要,还可以调节声驻波(一个或多个)以允许细胞通过,并允许细粒/碎屑通过。这可以作为生物反应器的清洁操作。连续的稳态操作可以在没有压力波动的情况下进行,并且产物流不会在生物反应器或过滤装置中积聚。
声学灌注装置可以由本领域已知的适当材料制成。这些材料包括高密度聚乙烯(hdpe)、其他塑料和可能的金属和玻璃。已经发现装置透明是非常方便的,从而可以在视觉上确认流体流动和超声换能器的操作。
图5示出了声学灌注装置500的另一实施例。该实施例非常类似于图4所示的装置400。主要区别在于图5的声学灌注装置500在收集区域456中具有在装置的一个侧壁上的第一超声换能器460和在装置的相反侧壁440上的第二超声换能器562。换句话说,两个换能器460,562位于收集流路453的相反两侧。利用这种布置,反射器580位于第一超声换能器460和第二超声换能器562之间的收集区域456内。换能器被取向成使得反射器580、第一超声换能器460和第二超声换能器562如上所述在流体单元450中产生多维驻波(一个或多个),或换句话说,换能器彼此面对。还示出了附接到装置的出口端口430处的流出泵592,流出泵592用于控制流过装置的流体培养基的流量。这里未示出的是附接到过滤装置500的收集端口(不可见)处的泵。
现在转而参考图6,示出了包括本公开的相关联的生物反应器610和声学灌注装置630的处理系统。该系统设置为用作灌注生物反应器。生物反应器610包括具有进料入口622、出口624和再循环物入口626的反应容器620。新鲜培养基通过加料管650加入进料入口622中。一些反应器还将包括出口端口或排出端口(这里未示出)以除去或“排出”细胞以保持反应器内的恒定的细胞密度。利用搅拌器625混合反应容器的内容物(附图标号605)。期望产物(例如重组蛋白)由位于容器620内的细胞连续产生,并存在于生物反应器的培养基中。灌注生物反应器中的产物和细胞通过管652从反应容器中抽出,并通过入口端口632进入声学灌注装置630。其中一部分期望产物与细胞分离。期望产物可以通过第一收集端口634(其是产品回收端口)和管654被抽出到收容容器640中,或者在真正连续的生产系统的情况下,可以被抽出到一些其它下游纯化过程。细胞在分离后返回到灌注生物反应器,从声学灌注装置的出口端口636(其是流体再循环端口)通过管656传递到反应容器的再循环物入口626,从而形成再循环路径。声学灌注装置的多维驻波(一个或多个)用于在装置的流体单元和收集端口之间产生分离屏障,从而在收集端口634中收集数量极大减少的生物细胞。
图7和图8是声学灌注装置的另一示例性实施例的视图。图7是正剖视图,图8是外部透视图。值得注意的是,该实施例被特别设计成使用可以使用vi类材料(例如,医疗装置级hdpe)或者甚至作为单个或焊接的注射成型部件通过清洁加工技术来制造。以这种方式,该实施例是伽马稳定的单次使用型装置的示例。冲洗该装置以除去生物负载(bioburden),然后进行伽马照射(通常为25-40kgy)以消灭可能破坏健康细胞培养物的任何潜在污染物,例如灌注生物反应器中存在的那些。
首先参考图7,在该装置700中,入口端口710和收集端口770都位于装置的顶端718处或装置的顶壁776上。出口端口730位于装置的底端716处。这里,入口端口710和出口端口730都在装置的第一侧712。入口流路751是通道755的形式,其从入口端口向下朝向底端延伸并且经过出口端口,通道与声学腔室750隔开(这里,隔开由内壁756造成)。流体将在通道中向下流动,然后向上升至声学腔室750。声学腔室的底壁720是向下朝出口端口730倾斜的倾斜平坦表面。超声换能器760的位置在此显示为两个正方形,在装置的顶端和底端之间。收集流路753位于换能器上方。
现在参考图8,装置700被示出为形成在三维矩形外壳706内。可以看出,装置的底端716处的出口端口730位于前壁775上。同样,收集端口770和入口端口710位于顶壁776上。由透明材料制成的观察窗708位于前壁中。通过该观察窗可以看出,超声换能器安装在装置外壳的后壁778中。观察窗用作反射器以产生多维声驻波。
图9和图10是声学灌注装置的又一示例性实施例的视图。图9是正剖视图,图10是透视图。
首先参考图9,在该装置900中,入口端口910沿着装置的第一侧912位于装置的前侧975。出口端口930(最好地在图10中看到)定位成与入口端口910正相对并且处于相同的高度,并且也位于第一侧912。在该实施例中,存在主要流体流,其几乎直接从入口端口910流到出口端口930,并且入口流路951仅从装置的第一侧面912将小的侧流转向声学腔室950。收集端口970位于装置的顶端918处或装置的顶壁976上。次级出口端口980也位于装置的第一侧912,从第一侧壁979延伸并且位于入口端口910的下方,并且可以用作排出端口。声学腔室的底壁920被成形为金字塔状,以向下朝顶点倾斜。排出管线981从声学腔室950的底部延伸到次级出口端口980。在这里,预期次级出口端口可用于俘获可被丢弃或也可返回生物反应器的小流量高浓度的细胞(细胞排出)。
现在参考图10,装置的前壁975具有矩形空间960,并且装置的后壁978具有矩形空间962。可以设想,可以以任意取向将一个换能器和一个反射器放置在这两个矩形空间960/962中,或可以将两个换能器放置在两个矩形空间中。在该视图中,入口端口910和出口端口930均可见。入口端口910位于装置的前侧,并且出口端口930位于装置的后侧(但是,如果需要可以反转)。澄清流路953位于换能器上方。虽然这里未示出,但是类似于图4中的安装件可以附接到装置的第二侧914。
现在更详细地描述在声学过滤装置中使用的超声换能器(一个或多个)可能是有帮助的。图11是常规的超声换能器的剖视图。该换能器具有在底端的耐磨板50、环氧树脂层52、陶瓷压电元件54(例如由锆钛酸铅(pzt)制成)、环氧树脂层56和背衬层58。在陶瓷压电元件的任一侧设有电极:正电极61和负电极63。环氧树脂层56将背衬层58附接到压电元件54。整个组件被容纳在外壳60中,外壳60可以由例如铝制成。外壳用作接地电极。电适配器62提供用于使导线穿过外壳并连接到附接于压电元件54的引线(未示出)的连接。通常,背衬层被设计成利用在宽范围频率上的均匀位移来增加阻尼并且产生宽带的换能器,并且被设计成抑制压电元件的特定振动本征模式的激发。耐磨板通常设计为阻抗变换器,以更好地匹配被换能器辐射到的培养基的特性阻抗。
图12是本公开的超声换能器81的纵截面图,其用于本公开的声学过滤装置中。换能器81成形为方形,并且具有铝外壳82。铝外壳具有顶端和底端。换能器外壳也可以由诸如医用级hdpe等塑料或其他金属制成。压电元件是一种钙钛矿陶瓷块,均由较大的二价金属离子(通常为铅或钡)的栅格中的小的四价金属离子(通常为钛或锆)和o2-离子组成。作为示例,pzt(锆钛酸铅)压电元件86限定换能器的底端,并且从外壳的底端的外部露出。压电元件借助位于压电元件和外壳之间小的弹性层98(例如环氧树脂、硅树脂或类似材料)被支撑在压电元件的周边。换句话说,不存在耐磨板或背衬材料。然而,在一些实施例中,存在将压电元件与产生声驻波的流体隔开的塑料或其它材料层。压电元件/晶体也具有外表面(其被露出)和内表面。
螺钉88借助于螺纹将外壳的铝顶板82a附接到外壳的主体82b。顶板包括用于为换能器供电的连接器84。pzt压电元件86的顶面与由绝缘材料94隔开的正极90和负极92连接。电极可以由诸如银或镍等任何导电材料制成。电功率通过压电元件上的电极提供给pzt压电元件86。注意,压电元件86没有背衬层或环氧树脂层。换句话说,在换能器中,在铝顶板82a和压电元件86之间存在内部容积或气隙87(即气隙完全为空)。在一些实施例中,可以提供最小的背衬58和/或耐磨板50,如图13所示。
换能器设计可以影响系统的性能。典型的换能器是将陶瓷压电元件结合到背衬层和耐磨板上的分层结构。由于换能器承载有由驻波提供的高机械阻抗,常规的耐磨板设计指导,例如对驻波应用而言的半波长厚度或对辐射应用而言的四分之一波长厚度以及制造方法可能不合适。相反,在本公开的一个实施例中,换能器没有耐磨板或背衬,从而允许压电元件在具有高q因子的一个本征模式下振动,或者以几个本征模式的组合振动。振动的陶瓷压电元件/盘直接暴露于流过流体单元的流体。
移除背衬(例如使压电元件以空气作为背衬)也允许陶瓷压电元件在极小阻尼的高阶振动模式(例如高阶模位移)下振动。在具有带有背衬的压电元件的换能器中,压电元件像活塞一样以更均匀的位移振动。移除背衬允许压电元件以不均匀位移模式振动。压电元件的振型越高阶,压电元件具有越多的节线(nodalline)。虽然俘获线与波节的相关性不一定是一一对应的而且以更高频率驱动压电元件不一定会产生更多的俘获线,但压电元件的高阶模位移产生更多的俘获线。
可以想到,在本公开的声学过滤装置的一些实施例中,压电元件可以具有对压电元件的q因子影响最小(例如小于5%)的背衬。背衬可以由诸如轻木、泡沫或软木等大致透声材料制成,大致透声材料在向压电元件提供一些机械支撑的同时允许压电元件以高阶振型振动并且保持高q因子。背衬层可以是实心的,或者可以为具有贯穿该层的孔的栅格,使得该栅格以特定的高阶振动模遵循振动压电元件的波节,从而在允许其余压电元件自由振动的同时在波节位置处提供支撑。栅格结构或透声材料的目标在于在不降低压电元件的q因子或不干扰特定振型的激励的情况下提供支撑。
将压电元件放置成与流体直接接触也通过避免环氧树脂层和耐磨板的减振和能量吸收效应而有助于高q因子。换能器的其它实施例可以具有耐磨板或耐磨表面,以防止含铅的pzt接触宿主流体。例如这在如哺乳动物细胞的血液分离、生物制药灌注或补料分批过滤等生物应用中是可取的。这些应用可使用诸如铬、电解镍或无电镀镍等耐磨层。也可以使用化学气相沉积来施加一层聚对二甲苯(例如parylene)或其它聚合物。有机和生物相容性涂层,如硅树脂或聚氨酯也可用作耐磨表面。
在一些实施例中,对于诸如油/水乳液分离和如灌注等其它方法的应用,超声换能器具有标称的2mhz共振频率。每个换能器可以消耗约28w的功率,用于以3gpm的流量进行液滴俘获。这转化为0.25kwhr/m3的能源成本。这表明这项技术的能源成本非常低。理想地,每个换能器由其自己的放大器供电和控制。在其他实施例中,超声换能器使用例如具有1”×1”尺寸的方形压电元件。可替代地,超声换能器可以使用矩形压电元件,例如具有1”×2.5”尺寸。为了获得足够的声学俘获力,每个换能器的功率耗散在每1”×1”换能器横截面积和每英寸声驻波跨度上为10w。对于4”跨度的中等尺度系统,每个1”×1”方形换能器消耗40w。较大的1”×2.5”矩形换能器在中等尺度系统中使用100w。三个1”×1”方形换能器的阵列将消耗总共120w,并且两个1”×2.5”换能器的阵列将消耗大约200w。紧密间隔的换能器的阵列代表该技术的替代的潜在实施例。换能器尺寸、形状、数量和位置可以根据需要而改变以产生期望的多维声驻波图案。
换能器的尺寸、形状和厚度确定了在不同激发频率下的换能器位移,这进而影响分离效率。通常,换能器以接近厚度共振频率(半波长)的频率操作。换能器位移的梯度通常产生细胞/生物分子的更多俘获位置。高阶模式位移在所有方向上的声场中产生具有强梯度的三维声驻波,从而在所有方向上产生同样强的声辐射力,产生多个俘获线,其中俘获线的数量与换能器的特定振型相关。
为了研究换能器位移曲线对声学俘获力和分离效率的影响,使用1”×1”方形换能器重复了10次实验,除了激发频率之外,所有条件都相同。图14中用圆圈圈起来的数字1-9和字母a表示的十个连续的声共振频率被用作激发频率。条件为实验持续时间为30分钟,1000ppm油浓度为约5微米sae-30油滴,流量为500ml/min,施加功率为20瓦。使用油滴,因为油比水密度低,并且可以使用声泳将油与水分离。
图14示出了作为2.2mhz换能器共振附近的频率的函数的方形换能器的测量到的电阻抗幅值。换能器电阻抗中的最小值对应于水柱的声共振,并表示潜在的操作频率。在激发了多维驻波的其他频率处存在额外的共振。数值模拟已经表明,在这些声共振频率处,换能器位移分布显著变化,从而直接影响声驻波和产生的俘获力。由于换能器在其厚度共振附近操作,电极表面的位移基本上是异相的。换能器电极的典型位移不均匀,并且根据激发频率而变化。例如,在具有一条油滴俘获线的一个激发频率处,位移在电极中间具有单个最大值,并且在换能器边缘附近具有最小值。在另一个激发频率处,换能器分布具有多个最大值,从而产生多条俘获油滴线。较高阶换能器位移图案导致对于俘获油滴而言俘获力更高且产生多个稳定俘获线。
当油-水乳液经过换能器时,观察并表征油滴俘获线。对于图14中标识的十个共振频率中的七个共振频率,如图15所示,表征涉及跨越流体通道的俘获线的数量的观察和图案。换能器的不同位移分布可以在驻波中产生不同的(更多)俘获线,位移分布中的更多梯度通常会产生更高的俘获力和更多的俘获线。
图16是示出与9俘获线图案匹配的压力场的数值模型。数值模型是二维模型;因此仅观察到三条俘获线。在垂直于纸面的第三维中存在另外两组三条俘获线。
换能器所产生的声辐射力的横向力可以通过以更高阶振型驱动换能器来增加,这与晶体有效地作为具有均匀位移的活塞而移动的振动形式相反。声压与换能器的驱动电压成比例。电功率与电压的平方成比例。换能器通常是薄的压电板,具有在z轴上的电场以及在z轴上的主要位移。换能器通常在一侧与空气(即,换能器内的气隙)耦合,另一侧与细胞培养基的流体培养基耦合。在板中产生的波的类型被称为复合波。压电板中的复合波的子集类似于泄漏的对称(也称为压缩或膨胀)兰姆波。板的压电性质通常导致对称兰姆波的激发。这些波是漏波,因为它们辐射到水层中,这导致在水层中产生声驻波。兰姆波存在于无限大的薄板上,该薄板的表面具有无应力条件。因为本实施例的换能器本质上是有限的,所以实际的模式位移更复杂。
图17示出了横跨板厚度的平面内位移(x位移)和平面外位移(y-位移)的典型变型,平面内位移在板的厚度上是偶函数,平面外位移是奇函数。由于板的有限尺寸,位移分量在板的整个宽度和长度上变化。通常,(m,n)模式是换能器的如下位移模式,其中在宽度方向上的换能器位移具有m个波动,在长度方向上具有n个波动,并且具有如图17所示的厚度变化。m和n的最大数是晶体尺寸和激发频率的函数。不呈现形式(m,n)的附加三维模式是存在的。
驱动换能器使得压电元件以通式(m,n)的高阶模式振动,其中m和n无关地为1或更大。通常,换能器将以比(2,2)高阶的模式振动。更高阶模式将产生更多的波节和波腹,导致产生水层中的三维驻波,三维驻波的特征在于在所有方向的声场中具有强梯度,不仅在驻波方向上,而且在横向上。结果,声梯度导致在横向上产生更强的俘获力。
在实施例中,驱动换能器的电压信号可以具有正弦、方形、锯齿、脉冲或三角波形;并具有500khz至10mhz的频率。电压信号可以用脉冲宽度调制驱动,这产生任何期望的波形。电压信号还可以具有幅度或频率调制启动/停止能力,以消除流(streaming)。
换能器用于产生压力场,该压力场产生在与驻波方向正交的方向上以及在驻波方向上均具有相同数量级的声辐射力。当力具有大致相同的数量级时,尺寸为0.1微米至300微米的粒子将更有效地朝向“俘获线”移动,使得粒子不会通过压力场并继续通过过滤装置的收集端口离开。相反,粒子将保留在声学腔室内以被再循环回生物反应器。
提供以下示例以说明本公开的装置、组件和方法。这些示例仅仅是说明性的,并不旨在将本公开内容限于本文所述的材料、条件或工艺参数。
示例
示例1
图18示出了如上详细描述的声学灌注装置的实验装置。除了底壁不弯曲,而是从第一端水平地延伸然后直接转向出口端口之外,这种声学灌注装置非常类似于图5所示的装置。管连接到入口端口、出口端口和两个收集端口。泵也可见地流体连接到出口端口。
图19是本公开的另一种声学灌注装置的照片,类似于图5所示的实施例,该声学灌注装置具有两个超声换能器和在装置底端的从入口端口通往出口端口的凹入底壁。含有流体培养基的细胞也存在于该装置中。在该照片中,如上所述,在反射器与第一和第二换能器之间的收集区域中产生声驻波。由此产生的声场由波和附图标记1664表示。从入口端口通过装置到出口端口的流体培养基的流型用表示流体流入装置的方向的箭头(附图标记1610)和表示流体通过装置朝向出口端口流动的方向的箭头(附图标记1630)示出。最后,用指示流动方向的箭头(附图标记1670)示出了期望产物的通过第一和第二收集端口从装置出来的一般流型。
已经使用图19的声学灌注装置和本公开的分离方法在不同的中国仓鼠卵巢(cho)细胞系上来测试声泳分离。图20-28显示了使用beckmancoultercellviabilityanalyzer(贝克曼库尔特细胞活力分析仪)改变不同参数且测量不同值的各种测试结果。
使用声学过滤装置的灌注流量为约2ml/min至约10ml/min,或者对于2.7l工作容积生物反应器,流量为约1vvd至约5vvd。vvd是指“容器容积每天”,或一天中生物反应器容器的容积循环通过声学过滤装置的次数。通过灌注端口收集灌注流量(qp)。相比之下,进料流量(qf)为约40ml/min至约200ml/min。
进料溶液的起始cho细胞密度为50×106个细胞/ml。反应器尺寸为2.7l,宿主流体的进料体积为1.5l。总共进行了一系列七次测试(t1-t7),以研究在2.7l溶剂反应器中改变vvd和流动分流的影响。试验的参数如下表1所示。
表1:2.7l反应器和1.5l进料体积的系统结果
结果包括在45v的dc电压下在89-93%之间的细胞澄清效率,而与如图20所示的流量无关。注意,t1的dc电压固定在60v,而对于测试t2-t7将dc电压降低至45v的固定量。换能器电压幅值是这些值的一半。
结果进一步包括与进料相比的90-94%的灌洗液浊度降低,如图21所示。该图显示进料、再循环流体(qc)和灌注液(qp)的浊度。进料进入入口端口,再循环流体离开出口端口并再循环,灌注液离开声过滤装置的灌注端口。应注意,测试t1和t2的浊度测量导致硬件错误,因此仅显示测试t3-t7,这相当于灌注流中相对于进料流的6-10%浊度,而不管流量如何。
图22由beckmancoultercellviabilityanalyzer产生,并显示了在仪器误差(即±6%)内的每个流量的细胞存活率,在所有测试中对照标准在79-84%的范围内。
使用指定为“cho系a”的溶液进行进一步的测试。该溶液的起始细胞密度为50×106个细胞/ml,浊度为2400ntu,细胞存活率约为80%。使用本公开的装置在反应器尺寸为2.7l的系统中分离溶液。进料流体的体积在1.5l和2.0l之间。灌注流量为2ml/min至10ml/min,或1至5vvd。进行了一系列六次测试,以研究改变vvd和流动分流对2.7l溶剂反应器的声学过滤性能的影响。试验的参数如下表2所示。
表2:2.7l反应器和1.5l-2.0l进料体积的系统结果
图23示出了测量到的进料流、再循环流和灌注流的总细胞密度。用于测试的生物反应器细胞保留显示约90%的灌注效率。图24显示了测试的测量细胞存活率,揭示了整个测试的存活率没有显著变化。
接下来,使用指定为“cho系b”的溶液进行另外的测试。该溶液的起始细胞密度为75×106个细胞/ml,浊度为2300ntu,细胞存活率约为80%。使用本公开的装置在反应器尺寸为2.7l的系统中分离溶液。进行了四次试验(t1-t4)。两个测试(t1,t3)使用具有单个换能器的装置。另外两个测试(t2,t4)使用具有两个串联换能器的装置(使得流体穿过两个驻波)。试验的参数如下表3所示。
表3:2.7l反应器和1.5l-2.0l进料体积的系统结果
图25显示了测量到的进料流、再循环流和灌注流的总细胞密度。用于测试的生物反应器细胞保留显示大于90%的灌注效率。当使用两个换能器而不是单个换能器时,结果进一步证明了高了大约3-5%的效率。图26显示了测试的测量细胞存活率,揭示了整个测试中存活率没有显著变化。实际上,在低vvd下操作提供了许多优点,如培养基成本降低。
在生物应用中,预期的是系统的所有部分(即,生物反应器、声学过滤装置、与之流体连接的管道等)可以彼此分离并且是可弃式的。避免离心机和过滤器允许更好地分离cho细胞,而不会降低细胞的存活率。换能器也可以被驱动以产生快速的压力变化,以防止或清除由于cho细胞附聚引起的阻塞。换能器的频率也可以改变以对于给定功率获得最佳效果。
示例2
图27示出了类似于图8所示的声学灌注装置的另一实验装置。管连接到入口端口、出口端口和收集端口。
以转换器电压的40v峰-峰值,15-30ml/min的灌注流量和2l/min的再循环流量测试该装置。每45-60分钟取样一次,确定细胞保留率。图28显示结果。y轴是保留率,以百分比表示(通过比较输出细胞计数与输入或生物反应器/培养物细胞计数来进行计算)。x轴是施加的dc电压(以v为单位)和灌注或收获流量(以ml/min为单位)二者;v和ml/min的数值范围相同只是巧合。灌注流量高达20ml/min时,细胞保留效率保持高于95%,并在直到约25ml/min之前都保持高于90%。图33是表示处于启动或者细胞沉降模式(左)和稳态细胞保持模式(右)的装置的组合照片。
接下来,进行实验以确定什么因素将影响细胞保留。灌注流量变化,换能器电压也变化。当灌注流量变化时,换能器电压保持在40v峰-峰值,再循环流量保持在2l/min。当换能器电压变化时,灌注流量保持在20ml/min,再循环流量保持在2l/min。结果表明,对于该具体实施方案,约15ml/min至约28ml/min的灌注流量是最佳的,并且约15v峰-峰值至约28v峰-峰值的换能器电压是最佳的。
可以通过检查进入装置并从装置收获的观察到的细胞样品来证明对由声学灌注装置提供的添加功能的更好理解。图29a是进料悬浮液的显微图像(来自vi-cell细胞计数器),这里是具有约5600万个细胞/ml的能活细胞培养物群。可观察到几个大的、圆的健康的细胞。图29b是显示群中细胞直径分布的直方图。直径分布是强双峰的,在约11微米和约23微米的值附近。这两个峰大致对应于较小的碎屑和非能活细胞、以及较大的能活细胞。应该注意的是,这个样品来自一个特别“脏”的细胞群。一般来说,生产细胞系将会更加清洁得多,大约11微米的峰值将会小得多,甚至不存在。
图30a是另一种显微图像(来自vi-cell细胞计数器),这次是从声学灌注装置收获的流的显微图像。在该图像中,与图29a相比,观察到非常少的明亮的大细胞。相反,图像中填充有更小、更暗的粒子或碎屑。在这种情况下的实验条件是灌注速率为4ml/min,循环速率为2l/min,dc输入电压为30v。该定性观察由图30b中的直方图证实,其显示了灌注液中的直径分布。参见图30b,粒子分布现在是单峰的,其峰值约为9微米。这表明较大的能活的细胞已经被俘获并保留,或者被大大地阻止在灌注液中排出。只有较小的细胞与细胞碎屑、细粒和碎片一起通过,从亚微米到微米级尺寸。
做出该装置的计算流体动力学(cfd)模型。图31显示了500秒后装置内的速度分布。单位是米/秒(m/s)。如预期的那样,在从入口端口到出口端口向下导向的通道中发现最高的速度。在流体单元中以及收集端口外部,速度接近于零。这是重要的,原因有二:声场在具有更低、更均匀速度的流动中更有效,并且因为生物制造中使用的细胞对流动敏感,并且诱导剪切速率。
图32是示出该实施例的若干方面的视图。流体通过入口端口710流入(箭头780)装置并进入声学腔室的声学边缘783的上方。声学腔室下方的流体的体积750包含由箭头782指示的切向流路。如箭头781所示,具有相对大量的能活细胞的流体将通过出口730离开。由驻波产生的声学边缘效应用附图标记783标记,并将大细胞与可以通过声驻波场784的较小的细胞碎片、粒子碎屑、期望的生物分子等等分离。然后,该收获流动流785通过收获端口770离开。切向流路是入口流路的一部分,并且位于由声驻波产生的声学边缘783的下方。切向流路将由于重力作用而将从声驻波场784掉落的细胞簇和由声学边缘效应保留的细胞传送出去。
示例3
通过观察数值研究的结果可以理解解释声学灌注装置的操作的另一种方式。在数值研究中,具有不同有效声学特性(即声速和密度)的两种流体在数值模拟软件comsol中用它们之间的界面建模。计算声场,由此使用戈尔科夫方程计算在流体速度方向上作用在粒子上的横向辐射力。
图34示出了利用压电换能器、钢反射器、铝外壳和两种流体的模拟的几何形状:第一流体是声场内的水,第二流体是在声场外水溶液中的cho细胞的15%浓度,第二流体具有比水流体更高的密度和更高的声速。
在图34的模型中,如实线所示分离两种流体。在该设置中,通过系统的流体速度在从左到右的水平方向上。因此,为了作为保留装置,声场需要在细胞上产生作用于负x方向(即与流体速度相反)上的力。利用流体密度为1000kg/m3以及声速为1500m/s对水进行建模。对cho细胞进行建模,其密度为1050kg/m3,声速为1550m/s。在各种激发频率下进行联接多物理数值模拟,包括压电材料的全压电模拟,两种流体的声学模拟以及钢和铝主体中的线性弹性模拟。换能器以40v的峰值电压驱动。
图35a-35c示出了在2.218mhz、2.2465mhz和2.3055mhz的操作频率下,两种流体中的声压和模型的压电材料、铝外壳和钢反射器的位移。在两个流体之间的界面处计算横向辐射力(即在流体流动方向上水平地)以及换能器消耗的实际电功率。显示了换能器和钢的结构位移以及流体中的声压。
图36示出了作用在悬浮的cho细胞上的横向辐射力(n)和由功率归一化的横向辐射力(n/w)对频率。该曲线图表明,在共振频率(即功率的局部最大值)下,界面上的平均横向辐射力为负,意味着它处于负x方向。结果是产生声壁效应或声学边缘效应。也就是说,声场的边缘在悬浮粒子上施加强的横向力,从而阻止较大的粒子进入声场,并且仅允许第一流体(即,仅包含较小粒子的流体,例如期望的产物,并排除所有细胞)进入声场,从而产生声学灌注细胞保留装置。以这种方式,只有澄清的流体才能逸出,细胞被辐射力保持。这个力永远不会是正的,这意味着该力总是将细胞保持在界面处,不允许它们逃离声学边缘。功率曲线中的多个峰值显示了包括平面共振模式和多维操作模式在内的多种操作模式的存在,表明可以通过利用平面和多维驻波等可以产生这种类型的操作。在具有1”×1”尺寸的系统中,约每30khz存在平面共振。该曲线图显示了表明存在多维模式的额外峰值的证据。每单位功率,这些模式可以与平面共振模式同等有效或甚至更有效。如上所述,由声辐射力阻挡的细胞然后可以通过流场的擦洗运动(即,界面下方的再循环流)来拾取,并且连续返回到生物反应器以确保它们接收营养和氧气而保持整个细胞培养物的产生。
示例4
图37和图38示出了类似于图9所示的声学灌注装置的另一个实验设置。管连接到入口端口、出口端口、收集端口和次级出口端口(用于流量集中细胞)。包括箭头以说明流体流动。箭头表示流入入口端口的流动;流出出口端口的流动;灌注液流出装置的顶部的流动以及浓缩液流出装置的底部的流动。通过入口端口流到出口端口是再循环流量。从装置顶部流出的灌注液是灌注流量,其含有耗尽细胞并含有期望产物的澄清流体。从装置底部流出的浓缩液是浓缩的细胞流。浓缩的细胞流可以用于细胞排出操作,或者如果需要,可以将细胞返回到生物反应器。
在40v峰-峰值的换能器电压下测试该装置,灌注流量(从顶部流出)为1-10ml/min,再循环流量为0.75-1l/min,浓缩液速率(从底部流出)为15ml/min。确定不同灌注流量的细胞保留率。图39显示了结果。y轴是保留率,1.00表示100%保留。灌注流量高达7ml/min时,细胞保留效率保持高于98%,并在10ml/min的流量处恰好低于90%。
已经参考示例性实施例描述了本公开。显然,在阅读和理解上述详细描述后,本领域其他技术人员将会进行修改和更改。意图是将本公开解释为包括所有这些修改和更改,只要它们落在所附权利要求或其等同内容的范围内。
- 还没有人留言评论。精彩留言会获得点赞!