与他汀类药物个体化用药相关的多个基因单核苷酸多态性位点组合及其应用的制作方法
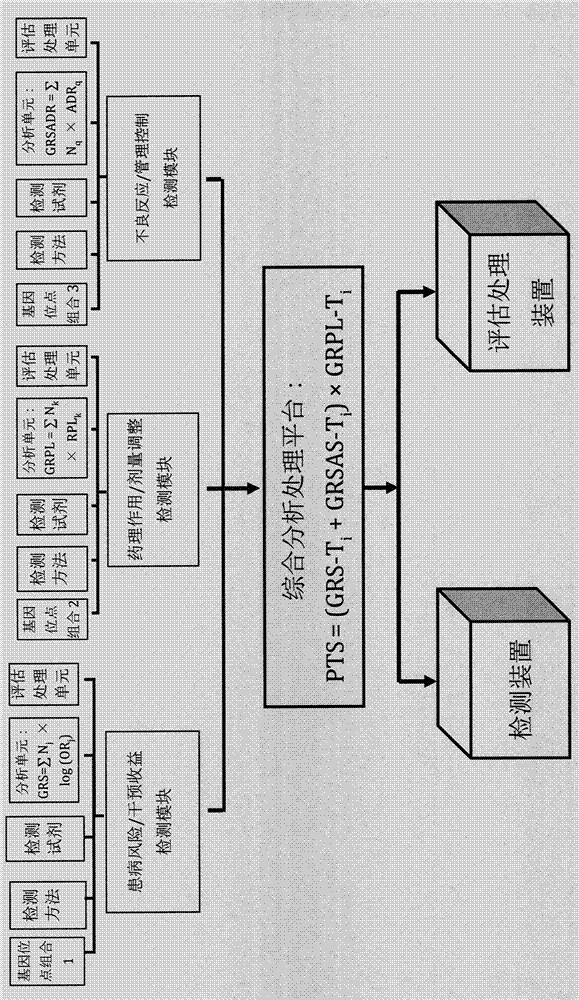
本发明涉及一种与他汀类药物个体化用药相关的多个基因单核苷酸多态性位点组合及其应用,具体包括分别与个体患冠心病的风险、他汀类药物降低胆固醇(ldl-c)药理作用敏感性、以及他汀类药物不良反应易感性三个方面相关联的多个基因单核苷酸多态性位点组合及其应用;本发明还涉及了针对所述的单核苷酸多态性位点组合的检测方法及其在制备用于预测和评估个体的患冠心病风险与他汀类药物干预收益、药理作用敏感性与剂量调整、不良反应易感性与管理控制的“三维”检测装置和评估处理装置中的应用
背景技术:
:心血管疾病不但是全球的也是我国的头号死亡原因。目前,全国约有心血管病患者2.9亿,每年约350万人死于心血管疾病,占总死亡人数40%以上,其中死于冠心病和脑卒中占90%。统计数据表明,近十年来我国脑卒中发病率和死亡率趋于平稳,但是冠心病发病率和死亡率在增长,流行趋势明显上升,且快速年轻化,不但给个人和家庭造成严重后果,也是公共卫生和健康事业所面临的严峻挑战。冠心病也称为缺血性心脏病或动脉粥样硬化性心脏病,包括无症状心肌缺血(隐匿性冠心病)、心绞痛,心肌梗死、缺血性心力衰竭和猝死等临床类型。冠心病的危险因素包括高脂血症、高血压、糖尿病、吸烟、肥胖等。高脂血症是公认的冠心病最重要致病因素之一,血浆中ldl-c水平与冠心病风险之间成线性相关。对存在冠心病风险性的个体,降低血液中的ldl-c能有效阻止冠状动脉动脉粥样硬化的形成,减少冠心病的风险,是一级预防的关键;对已患冠心病的个体进行二级预防措施来控制ldl-c达标,也能稳定冠状动脉硬化的斑块,延缓冠心病的再次发作和病人的死亡。人体中的胆固醇主要来自肝脏合成和肠道吸收,其中主要(70%)由肝脏合成,外源性食物提供约三成。他汀类药物(statins,简称他汀)能抑制肝脏胆固醇合成,是临床降低胆固醇的首选药。他汀抑制羟甲基戊二酸单酰基辅酶a(hmg-coa)还原酶,阻断的羟甲戊酸代谢途径,减少肝细胞内胆固醇合成,并且反馈性地刺激细胞膜表面的ldl受体数量和活性,增强细胞从血液循环中摄取胆固醇,从而降低低密度脂蛋白胆固醇(ldl-c)水平;他汀每降低1mmol/l的ldl-c,能减少各种心血管病风险(包括冠心病)20%-25%;近四十年的各种大规模的临床研究一致奠定了他汀类药物在心脑血管疾病一级预防和二级预防中的基石地位;他汀类药物是目前世界上使用最多的处方药物之一,全球约有2亿人在服用,我国服用他汀的患者每年也以20%的增长率快速增长。当前他汀类药物对冠心病的防治工作是建立在对冠心病的风险评估与预测的基础上。这些风险评估与预测的模型多是对传统确立的风险因子进行评估来预测个体的风险,从而确定他汀的适用对象。例如世界范围应用最为广泛是framingham风险评估模型,通过对年龄、性别、总胆固醇、高密度脂蛋白胆固醇、糖尿病、血压、吸烟等风险因子,进行直接评分和多元回归等分析,预测个体10年冠心病风险,并将其划分为低危(<10%)、中危(10%-20%)、高危(>20%)。多个国家和地区以framingham模型为基础,建立起针对不同的人群类似模型,包括欧洲score风险评估模型、who/ish风险预测图和中国缺血性心血管病风险评估模型等。这些评估模型均存在一定的局限性,如危险因素纳入不全和指标少、普遍缺少基因组学的标记物(如易感基因单核苷酸多态性位点)、低估了年轻个体的风险、难以预测超过10年或终生的患病风险,无法对这些潜在冠心病患者进行及时干预,这些不足极大限制他汀类药物的适用范围。遗传因素在心血管疾病的发生起到重要作用,也为临床精准化诊断和个体化治疗提供新途径。国内外多个大规模的全基因组关联性研究(gwas)发现,个体基因组中存在多个风险基因的“微效作用”累积和环境的危险因素共同作用的结果,能显著影响冠心病的发生和死亡。目前,gwas研究和大量重复试验已经发现超过58个与冠心病显著性关联的基因单核苷酸多态性位点(p<5.0x10-8)[参见文献nikpay等人,“acomprehensive1000genome-wideassociationmeta-analysisofcoronaryarterydisease”naturegenetics47:1121-1130(2015);roberts,“geneticsofcoronaryarterydisease:anupdate”mdcvjx(1):7-12(2014);和lu等人,“genome-wideassociationstudyinhanchineseidentifiesfournewsusceptibilitylociforcoronaryarterydisease”naturegenetics44:890-894(2012)],其中大部分位点也在以中国人群为主或有中国人参加的冠心病关联性试验中得到验证。利用这些位点可以进行冠心病的风险评估与预测。最近,美国哈佛大学mega博士等人根据文献选出了27个与冠心病显著性关联的基因单核苷酸位点的组合,并利用这些位点已发表的风险效应值(oddsratio,or)来计算待测个体的冠心病遗传风险评分(geneticriskscore,grs)。对超过4万8千人的冠心病患者的进行研究,发现这种冠心病遗传风险评分(grs)模型与传统的风险评估模型相比,不但能独立准确预测出一级预防和二级预防中的个体患病风险指数,而且能预测极为年轻的或无任何症状的个体超过10年以上的冠心病风险,能极大弥补现有各种风险评估预测系统的不足[参见文献mega等人“geneticrisk,coronaryheartdiseaseevents,andtheclinicalbenefitofstatintherapy:ananalysisofprimaryandsecondarypreventiontrials”lancet385:2264-2271(2015)];哈佛大学另一团队tada博士等人的从研究文献中选出更多(50个)冠心病显著性关联的基因单核苷酸位点的组合计算grs,对瑞典的一个社区的普通人群的进行风险评估和预测的验证工作,证实这50个位点组合的grs不但能进一步增强独立风险预测能力,而且对年轻个体冠心病风险预测特别有效[参见文献tada等人“riskpredictionbygeneticriskscoresforcoronaryheartdiseaseisindependentofself-reportedfamilyhistory”europeanheartjournal(2015)]。他汀类药物的药物基因组学同样是当前精准医学的主要热点之一,且进展迅速。哈佛大学mega等人按上述方法利用已发表的27个与冠心病显著性关联的基因单核苷酸位点及其已发表的风险效应值计算grs,根据grs评估他汀类药物干预的收益,发现他汀类药物对个体干预收益的高低与其冠心病遗传风险评分grs的高低成线性相关,grs高的个体比grs低的更需要他汀类药物干预,他汀药物治疗后,冠心病的发病率、死亡率明显下降[参见文献mega等人“geneticrisk,coronaryheartdiseaseevents,andtheclinicalbenefitofstatintherapy:ananalysisofprimaryandsecondarypreventiontrials”lancet385:2264-2271(2015)];哈佛大学tada的团队也利用从研究文献中选出上述的50个冠心病显著性关联的基因单核苷酸位点并计算个体的grs,与mega的27个位点的grs相比,50个位点的grs能进一步增强预测和评估个体患冠心病风险和他汀类药物干预收益的能力;这些结果提示与冠心病风险相关联的snp的组合具有两种功能:不但能预测和评估个体患冠心病风险的指数,也能预测和评估他汀类药物干预的收益[参见文献tada等人“riskpredictionbygeneticriskscoresforcoronaryheartdiseaseisindependentofself-reportedfamilyhistory”europeanheartjournal(2015)];因此,可以根据个体的冠心病遗传风险评分(grs)设定他汀类药物干预的收益率或收益指数,选择他汀类药物的干预方式。我国的顾东风等人选择9个与中国人冠心病显著性关联的基因单核苷酸位点组合,并成功独立预测冠心病患病的风险[参见中国专利:顾东风等人,“与冠心病相关的多个基因单核苷酸多态性位点组合及其应用”cn102762954b(2012)],这一结果进一步提示,只要选择合适数量的与中国人冠心病显著关联联基因位点的组合不但能够预测我国居民冠心病患病风险,也能够评估他汀类药物干预效果的收益。临床常用的他汀类药物包括阿托伐他汀(atorvastatin)、氟伐他汀(fluvastatin)、洛伐他汀(lovastatin)、匹他伐他汀(pitavastatin)、普伐他汀(pravastatin)、罗舒伐他汀(rosuvastatin)和辛伐他汀(simvastatin)等。这些他汀降低ldl-c作用(药理作用)强度各不相同,介于30%-63%。研究显示,将同一个体他汀服用剂量增加一倍,只能使降低ldl-c率增加约8%;个体对他汀药理作用敏感度也是有差异的,即不同个体对同一种他汀降低ldl-c反应也不一样,可从降低10mg/dl到70mg/dl不等;对于他汀药理作用不敏感的个体,即使调换不同类型他汀或提高剂量仍然难以将血脂控制达标,影响治疗效果;而对他汀反应强的个体,其发生不良反应的风险也相应变大。近年来的基因组学研究证实个体的遗传因素显著地影响他汀降低ldl-c的药理作用,并从大规模的药物基因组学研究中确定了多个与他汀降低ldl-c药理作用敏感性的呈显著性关联的基因单核苷酸多态性位点,这些位点的发现将为精细调整他汀用药剂量提供遗传学的基础[参见文献gryn等人,“pharmacogenomics,lipiddisorders,andtreatmentoptions”clinicalpharmacology&therapeutics96:36-47(2014)]。虽然他汀类药物具有良好的耐受性、安全性,但随着他汀类药物在临床应用的全面推广,其产生的不良反应不断凸显出来,主要包括肌肉病、新发ii型糖尿病等。他汀类可致5-10%患者肌肉病,多是轻微的肌肉酸痛,严重的骨骼肌溶解症发生是罕见的但威胁生命安全[参见文献zhang(本发明人)等,“lipin-1regulatesautophagyclearanceandintersectswithstatindrugeffectsinskeletalmuscle”cellmetabolism20:267-79(2014)]。此外,近年来的多个大样本群的随机临床对照实验和回顾性研究发现,他汀中度而显著性地增加新发ii型糖尿病发生率,达9%-48%[参见文献sattar等人,“statinsandriskofincidentdiabetes:acollaborativemeta-analysisofrandomizedstatintrials”lancet375:735-32(2010);和culver等人,“statinuseandriskofdiabetesmellitusinpostmenopausalwomeninthewomen’shealthinitiative”archivesofinternalmedicine172:144-52(2012)]。与低剂量或中等剂量相比,高剂量的他汀能额外地增加肌肉病、新发糖尿病的风险率。通过全基因组关联性研究(gwas)[参见文献link等人,“slco1b1variantsandstatin-inducedmyopathy-agenomewidestudy”newenglandjournalofmedicine359:789-99(2008)]或孟德尔随机化研究(mendelianrandomization)[参见文献swerdlow等人,“hmg-coenzymeareductaseinhibition,type2diabetes,andbodyweight:evidencefromgeneticanalysisandrandomizedtrials”lancet385:351-61(2015)]发现了数个分别与他汀所致肌肉病和新发糖尿病等不良反应关联的基因单核苷酸位点,这些位点的发现为预测和评估他汀不良反应提供遗传标记物。大规模的冠心病全基因组关联性研究和他汀药物全基因组学研究已经逐步阐明了个体的冠心病风险及他汀类药物干预的收益、药理作用(降低ldlc-c效应)敏感性、以及不良反应易感性等方面的遗传因素,并发现一系列的显著性关联的基因单核苷酸位点。近年来,国内外研究者根据上述基因组学研究的成果,已经研制了各种检测方法以及预测和评估模型,例如我国的顾东风等人利用9个与冠心病显著关联的基因单核苷酸多态性位点建立能预测冠心病患病风险的检测装置和评估模型,但这一装置和模型未对他汀类药物干预的收益、降低ldl-c的药理作用敏感性以及不良反应易感性等方面遗传因素进行检测和评估,因而无法指导他汀个体化用药[参见中国专利:顾东风等人,“与冠心病相关的多个基因单核苷酸多态性位点组合及其应用”cn102762954b(2012)];美国celera公司的shiffman等人从大规模的基因组学研究中鉴定出与患冠心病和脑中风的风险相关联位点,这些位点同时也与他汀药物干预减少心脑血管病风险的反应相关联,但是这一技术没有具体涉及他汀药理作用(降低ldl-c效应)敏感性或不良反应易感性等方面关联的基因位点,无法进行精细调整药物剂量或不良反应管理和控制,不能真正实现他汀个体化用药[参见美国专利:shiffman等人“geneticpolymorphismsassociatedwithcardiovasculardisease,methodsofdectionandusesthereof”us8216786b2(2008);或美国专利申请“geneticpolymorphismsassociatedwithstatinresponseandcardiovasculardiseasemethodsofdetectionandusesthereof”us20140235605a1(2010)];美国schaefer等人专注于他汀类药物剂量调整方面,重点研究了基因位点slco1b1和apoe在他汀类药物药理作用即降低ldl-c反应中的作用,但没有对个体的冠心病风险和干预收益的遗传因素进行系统检测和评估[参见美国专利:schaefer等人,“compositionandmethodsfortreatingandpreventingcoronaryheartdisease”us8765377(2011)];而英国link等人只是研究了slco1b1基因多态性研究和他汀诱发骨骼肌溶解症风险的关系[参见中国专利申请link等人,“diagnosticmethods”cn102016073a(2008)]。总之,当前出现的各种技术中都未能将个体的冠心病风险和他汀类药物干预的收益、药理作用(降低ldl-c)的敏感性、以及不良反应易感性等方面遗传因素和研究成果进行综合分析与归纳,没能绘出个体基因组中与冠心病风险、他汀干预收益、药理作用敏感性以及不良反应易感性等方面显著关联基因单核苷酸位点的全景图,无法全方位指导他汀个体化用药;这一技术的不足也导致他汀类药物在临床实际使用时精准率非常低,最新分析显示,美国他汀用药的精准率只有5%[参见文献schork,“personalizedmedicine:timeforone-persontrial”nature520:609-611],不但造成巨大的资源浪费,也给患者可能带来他汀所致的骨骼肌溶解症或新发2型糖尿病等新风险。因此,当前迫切需要整合个体的冠心病风险与他汀类药物干预的收益、药理作用敏感性、以及不良反应易感性等全方位的遗传信息,建立“三维”的遗传学检测装置和评估处理模型,分层递进式评估和调节他汀类药物干预方式和用药剂量,从而“一站式”指导他汀类药物个体化地预防和治疗冠心病。技术实现要素:针对现有的技术不足,本发明目的是提供一种与他汀类药物个体化用药相关的多个基因单核苷酸多态性位点组合,具体包括分别与待测个体患冠心病的风险、他汀类药物降低胆固醇(ldl-c)药理作用敏感性、以及他汀类药物不良反应易感性三个方面显著关联的多个基因单核苷酸多态性位点的组合;本发明的另一个目的是提供所述多个基因单核苷酸多态性位点组合在制备分别用于检测和评估个体的患冠心病风险与他汀类药物干预收益的检测模块、药理作用敏感性与剂量调整的检测模块、不良反应易感性与管理控制的检测模块中的应用;本发明另一个目的是提供一种用于检测本发明所述多个基因单核苷酸多态性位点组合的方法;本发明另一个目的是提供一种用于体外检测本发明所述多个基因单核苷酸多态性位点组合的试剂组合或系统及其用途;本发明的另一个目的是提供一种综合分析和处理所述患病风险与他汀类药物干预收益、药理作用敏感性与剂量调整、不良反应易感性与管理控制三个检测模块检测结果的方法及其在制备用于指导他汀类药物个体化用药“三维”检测装置和评估处理装置中的应用。首先,本发明另一个目的是提供一种与冠心病显著关联多个基因单核苷酸多态性位点的组合及其在制备用于预测和评估个体患冠心病风险与他汀类药物干预收益的检测模块中的应用;所述的检测模块包括5个检测单元:(1)与冠心病显著关联多个基因单核苷酸多态性位点的组合、(2)检测方法、(3)检测试剂、(4)分析单元、(5)干预收益的评估和处理单元。下面将具体说明所述检测模块的各个检测单元及其应用:(1)与冠心病显著关联多个基因单核苷酸多态性位点(snp)的组合:为了选择与冠心病显著关联多个基因单核苷酸多态性位点的组合来制备冠心病风险/干预收益的检测模块,荟萃分析了国内外冠心病全基因组关联性研究(gwas)确定的与冠心病显著关联的多个基因单核苷酸多态性位点(或与其紧密连锁的位点)(p<5×10-8),从这些位点选出已在全部由或部分由中国人(hanchinese)参加的关联性试验中得到验证的60个位点作为与中国人的冠心病显著关联的基因单核苷酸多态性位点,本所述60个与冠心病显著关联的基因单核苷酸多态性位点作及其等位基因的相对风险程度(oddsratio,or)参见表1。(2)检测方法:本发明还提供一种用于检测本发明所述与冠心病显著关联的多个基因单核苷酸多态性(snp)位点分型的方法,包括但不限于:直接测序法、基于杂交方法(如taqman探针法、基因芯片法、寡核苷酸探针特异杂交aso法、高分辨率溶解曲线分析hrm法等)、基于结构和构象法(如限制性片段长度多态性(rflp)分析法、单链构象多态性分析sscp法、变性梯度凝胶电泳dgge法、裂解酶切片段长度多态性分析cflp法、变性高效液相色谱法dhplc法)、基于引物延伸法(基质辅助激光解析离子飞行时间质谱(mald1-tof-ms分析)法。其中,可以用dna直接测序法检测,包括sanger法、焦磷酸测序(pyrosequencing)法和微测序法(snapshot)等。sanger法也被称为双脱氧测序或链终止法,sanger法是基于dna复制原理使用缺少3′-oh基团的ddntp,这些ddntp不具有与另一个dntp连接形成磷酸二酯键的功能,可用来中止dna链的延伸,结合产物分子量也不同,在这些ddntp上连接有放射性同位素或荧光标记基团,可检测出dna序列的差异;而焦磷酸测序法是一种基于聚合原理的dna测序,它与sanger法不同,依赖于核苷酸掺入中焦磷酸盐的释放,而非双脱氧核苷三磷酸参与的链终止反应,适用于dna短序列的测序分析。也可以采用基于杂交的方法检测,具体包括taqman探针法、基因芯片法等。其中taqman探针法用于snp基因分型的原理是:taqman探针是一种合成的寡核苷酸探针,其序列与靶模板的待测序列互补,在探针的5′末端连接荧光基团,在3′末端连接淬灭剂。当完整的寡核苷酸探针存在时,荧光基团发射的荧光被3′端连接的淬灭剂淬灭,无法检测荧光信号;在进行snp基因分型时,聚合酶链式反应(pcr)系统中加入2种不同荧光标记的探针,它们可分别与snp的等位基因完全配对,随着pcr的有效进行,与模板完全配对的探针逐步被taqdna聚合酶5′→3′外切酶活性切割,致使探针5′端上的荧光基团与3′端的淬灭基团分离,发射荧光且不被淬灭,因此可以检测荧光信号,并随着dna扩增循环次数的增加,发射出来的荧光强度不断积累,而与模板不能完全配对的探针(代表另一种等位基因)不能被有效切割,故检测不到荧光信号,通过相应仪器检测荧光值的变化即可实现snp位点检测。表1.所述与冠心病显著关联多个基因单核苷酸多态性位点及风险等位基因(riskallele)和相对的效应值(or)也可以采用基因芯片法检测:基因芯片又叫dna微阵列(dnamicroarray,chip),其原理:基因芯片是在微小的基片表面上以微阵列的方式有序排列一系列固定于一定位置的可寻址的识别分子(dna或rna片段),并以此作为探针;待测基因经提取后,被切成不同长度的片段,经荧光化学物质标记后,注射到嵌有芯片的载片上,由于dna和探针杂交的程度与荧光强度相关,因此通过激光扫描,即可根据荧光强弱测出被检测序列的变异。也可以采用高分辨率溶解曲线分析(hrm)法:该法是通过在一定的温度范围内将pcr扩增的产物进行变性期间实时监测升温过程中荧光染料与pcr扩增产物的结合情况,snp不同等位基因型以及是否是杂合子等都会影响熔解曲线的峰形,来判断是否存在snp多态性,实现对snp的分型。也可以应用限制性片段长度多态性(rflp)分析法检测:样本的含待测snp位点的相对应的dna片断经pcr扩增后用限制性内切酶切成“限制性片段”,随后利用凝胶电泳可将不同长度的限制性片段分开。若snp的位点正好处于特定限制性内切酶的识别位点处,其中一种多态对应的pcr扩增片断能够被限制性内切酶切断,而另一种却不能,因此通过对酶切后的pcr产物电泳后的片断长度分析可进行snp的分型;如果检测snp位点不存在引起酶切的位点,通常可以在pcr引物设计中引入特定的酶切位点,然后进行rflp分析。也可以应用单链构象多态性sscp法检测:sscp法是指在低温非变性的条件下,单链dna呈现一种由内部分子相互作用形成的一定的折叠结构,相同长度但不同核苷酸序列的dna折叠结构不同影响了其在非变性凝胶中的迁移率而被分离出。相同长度但不同核苷酸序列的dna由于在凝胶中的不同迁移率而被分离出,不同多态性的snp片段居于不同带。也可以应用变性梯度凝胶电泳dgge法检测:dgge法是在一般的聚丙烯酰胺凝胶基础上加入一定浓度梯度的变性剂,使双链dna分子在一定变性剂浓度下发生部分解链,导致电泳迁移率下降;一旦变性剂浓度达到dna片段最高的解链区域时,片段会完全解链,从而分离成两条带。snp等位基因型的两种dna片段间即使只有一个碱基对的差异,也会在不同时间发生部分解链,被分离成两条带而检测出不同的基因型。也可以应用变性高效液相色谱dhplc法检测:dhplc技术是一项在sscp和dgge基础上发展起来的新的杂合双链突变检测技术,在变性温度情况下将未知的dna片段与野生型dna混和,再使其降温重退,杂交会形成同源双链和异源双链,基于同源和异源双链解链温度的不同,通过控制dhplc的温度,使其维持在接近dna分子tm值下运行,然后进行洗脱,根据柱子保留时间的不同将同源双链和异源双链分离,从而识别snp分型。还可以应用基质辅助激光解析离子飞行时间质谱(mald1-tof-ms)法检测:与待测snp位点相对应的dna片断先经pcr扩增后,加入snp序列特异探针,并在反应体系中以ddntp替代dntp,使探针在snp位点处延伸一个碱基即终止,不同的snp位点将导致结合的ddnt不同,结合产物分子量也不同,而被质谱仪检测出snp位点的多态性。在具体实践时,本领域的技术人员可以根据实际情况选择上述的任一种技术进行体外检测本发明所述的一个或多个基因单核苷酸多态性位点。也可以采用多种技术的组合来体外检测所述一个或多个基因单核苷酸多态性位点。在本发明的一个具体实施方式中,采用taqman探针法,在美国应用生物系统(appliedbiosystems)的abi7900ht高通量快速实时荧光定量pcr仪上检测本发明所述的一个或多个基因单核苷酸多态性位点。(3)检测试剂:本发明还提供一种用于检测本发明所述的与中国人冠心病显著关联的多个基因单核苷酸多态性(snp)位点的试剂或系统,所述检测试剂或系统包括但不限于:用于直接测序的试剂;或用于taqman探针法检测的试剂(反应体系包括:以基因组dna或pcr产物为模板、一对pcr引物、分别用fam和vic标记的2条taqman-mgb探针检测snp的两种类型,以及其他试剂)、或用于基因芯片检测系统的组件、或用于高分辨率溶解曲线hrm分析法的试剂;也可以采用多种技术的试剂组合来检测,如或用于pcr与直接测序法相结合的试剂、或用于pcr与限制性片段长度多态性分析相结合的试剂;或用于以下任一种等位基因分型方法的试剂,如基于杂交方法、基于结构和构象法、基于引物延伸法等。在具体实践时,本领域的技术人员可以根据实际情况选择上述的任一种检测试剂或系统进行检测。本发明所述待测个体优选为中国汉族人(hahchinese)。本发明所述待测样本可以是血液、口腔拭子、尿、胃液、头发或活组织检查;优选来自血液;可以先从受试者的细胞获得含有本发明的基因的待测样品,然后按照常规方法提取样本的dna。(4)分析单元:本发明还提供一种对所述与冠心病呈显著关联基因单核苷酸多态性位点的检测结果进行分析并计算待测个体的冠心病遗传风险评分(geneticriskscore,grs)的检测单元。所述待测个体冠心病的遗传风险评分(grs)按照下列公式计算:grs=∑nj×log(orj),其中orj指待测个体携带的第j个单核苷酸多态性位点等位基因的相对风险程度(oddsration),nj指待测个体所携带的第j个单核苷酸多态性位点风险等位基因数目(杂合子为1,纯合子为2);在本发明的一个具体实施方式中对310例对照样本(未患冠心病的个体)和200例中国的冠心病患者进行上述60个冠心病显著关联基因单核苷酸多态性位点(snp)的遗传风险评分(geneticriskscore,grs)计算分析,上述510个研究样本的遗传风险评分(grs)呈典型的正态分布,最低grs为3.618,最高为7.011,平均grs(mean)是5.379标准差是0.459。本发明所述用于计算待测个体冠心病遗传风险评分(grs)的分析单元,可以是虚拟装置,只要能实现对所述检测结果进行数据分析处理单元的功能即可:所述分析单元可以是任何可以实现对检测结果进行分析、计算待测个体疾病遗传风险评分(grs)的计算公式、计算模块、仪器或是虚拟设备。(5)干预收益的评估和处理单元:本发明提供一种基于个体冠心病遗传风险评分(grs)评估他汀类药物干预的收益以及制定他汀类药物的干预收益指数(grs-t),据此选择合适干预方式的方法;其中冠心病遗传风险评分(grs)的高低与待测个体的他汀类药物干预收益的高低成线性相关;本发明所述的他汀类药物包括但不限于:阿托伐他汀(atorvastatin)、氟伐他汀(fluvastatin)、洛伐他汀(lovastatin)、匹他伐他汀(pitavastatin)、普伐他汀(pravastatin)、罗舒伐他汀(rosuvastatin)和辛伐他汀(simvastatin)等;本发明所述的他汀类药物干预方式或用药剂量具体指阿托伐他汀(atorvastatin)药物干预方式和其服用剂量,在具体实施时参见表2进行不同种类他汀类药物之间的剂量换算。下面具体说明基于个体的冠心病遗传风险评分(grs)制定他汀类药物的干预收益指数(grs-t)以及据此分层调整个体服用他汀类药物的剂量,选择合适干预方式的方法:对于冠心病的一级预防对象即未患冠心病的个体,根据个体冠心病的遗传风险评分(grs)从低到高的分布将待测个体分组,并制定他汀类药物的干预收益指数(grs-t):(1)冠心病低风险组[grs0-20%]:为他汀类药物干预低收益组,干预收益指数(grs-t)为0,不予以他汀类药物干预;(2)冠心病中等风险组[grs20%-80%]:为他汀类药物干预中等收益组:干预收益指数(grs-t)为20,他汀类药物剂量为20-40mg/日;(3)冠心病高风险组[grs80%-100%]:为他汀类药物干预高收益组:干预收益指数(grs-t)为40,他汀类药物剂量为40-80mg/日。对于冠心病的二级预防对象即已患冠心病的个体,根据个体冠心病的遗传风险评分(grs)从低到高的分布将待测个体分组,并制定他汀类药物的干预收益指数(grs-t):(1)冠心病再发低风险组[grs0-20%]:为冠心病再发作低风险组,也为他汀类药物干预冠心病再发低收益组,干预收益指数(grs-t)为15,他汀类药物剂量为10-20mg/日;(2)冠心病再发中等风险[grs20%-80%]:为冠心病再发作中等风险组,也为他汀类药物干预冠心病再发中等收益组,干预收益指数(grs-t)为20,他汀类药物剂量为20-40mg/日;(3)冠心病再发高风险组[grs80%-100%]:为冠心病再发作高风险组,也为他汀类药物干预冠心病再发高收益组,干预收益指数(grs-t)为40,他汀类药物剂量为40-80mg/日。在本发明的一个具体实施方式中对200例中国的冠心病患者和310例对照样本(未患冠心病的个体)的个体通过本发明所述干预收益评估和处理单元处理而得到的干预方案:200例冠心病患者和214例对照样本需要他汀类药物干预;而96例对照样本为冠心病低风险和他汀类药物干预低收益个体,不需要予以他汀类药物干预。表2.不同种类的他汀类药物之间的剂量换算本发明所述干预收益的评估和处理单元,可以是虚拟装置,只要能实现所述对检测和分析单元的结果的进行评估和处理单元功能即可;所述评估和处理单元可以是任何可以实现基于个体的冠心病的遗传风险评分(grs)而制定出他汀类药物的干预收益指数(grs-t),以及据此选择合适干预方式功能的计算公式、计算模块、仪器或是虚拟设备,例如可以是预先按照上述冠心病的遗传风险评分(grs)而制定的数据图表,将个体的检测结果对照该数据图表即能得出干预收益指数的数值和选择合适干预方式。第二方面,本发明另一个目的是提供一种与他汀类药物降低低密度脂蛋白胆固醇(ldl-c)效应(药理作用)敏感性呈显著关联的多个基因单核苷酸多态性位点组合及其在用于制备检测和评估药理作用敏感性遗传因素与剂量调整检测模块中的应用,所述的检测模块包括5个检测单元:(1)与他汀类药物降低ldl-c效应敏感性呈显著关联的多个基因单核苷酸多态性位点的组合、(2)检测方法、(3)检测试剂、(4)分析单元、(5)药理作用敏感性遗传因素与剂量调整的评估和处理单元。下面将具体说明所述的各个检测单元及其应用:(1)与他汀类药物降低ldl-c效应的敏感性呈显著关联的多个基因单核苷酸多态性位点(药理作用敏感基因位点)的组合:为了实现这一发明目的采取的技术方案是荟萃分析了他汀类药物的药物基因组学研究,确定了与他汀类药物降低ldl-c效应的敏感性呈显著关联的7个基因单核苷酸多态性及其影响他汀类药物降低ldl-c的效应值(参见表3)。(2)检测方法:本发明还提供一种用于检测本发明所述与他汀类药物降低ldl-c效应的敏感性呈显著关联的多个基因单核苷酸多态性位点(药理作用敏感基因位点)组合的方法,包括但不限于:直接测序法、基于杂交方法(如taqman探针法、基因芯片法、寡核苷酸探针特异杂交aso法、高分辨率溶解曲线分析hrm法等)、基于结构和构象法(如限制性片段长度多态性(rflp)分析法、单链构象多态性分析sscp法、变性梯度凝胶电泳dgge法、裂解酶切片段长度多态性分析cflp法、变性高效液相色谱法dhplc法)、基于引物延伸法(基质辅助激光解析离子飞行时间质谱(mald1-tof-ms分析)法。在具体实践时,本领域的技术人员可以根据实际情况选择上述的任一种技术进行体外检测本发明所述的一个或多个基因单核苷酸多态性位点。也可以采用多种技术的组合来体外检测所述一个或多个基因单核苷酸多态性位点。在本发明的一个具体实施方式中,采用taqman探针法,在美国应用生物系统(appliedbiosystems)的abi7900ht高通量快速实时荧光定量pcr仪上检测本发明所述的一个或多个基因单核苷酸多态性位点。(3)检测试剂:本发明还提供一种用于检测本发明所述与他汀类药物降低ldl-c效应的敏感性呈显著关联的多个基因单核苷酸多态性位点(药理作用敏感基因位点)组合的试剂或系统,所述检测试剂或系统包括但不限于:用于直接测序的试剂;或用于taqman探针法检测的试剂(反应体系包括:以基因组dna或pcr产物为模板、一对pcr引物、分别用fam和vic标记的2条taqman-mgb探针检测snp的两种类型,以及其他试剂)、或用于基因芯片检测系统的组件、或用于高分辨率溶解曲线hrm分析法的试剂;也可以采用多种技术的试剂组合来检测,如或用于pcp与直接测序法相结合的试剂、或用于pcr与限制性片段长度多态性分析相结合的试剂;或用于以下任一种等位基因分型方法的试剂,如基于杂交方法、基于结构和构象法、基于引物延伸法等。在具体实践时,本领域的技术人员可以根据实际情况选择上述的任一种检测试剂或系统进行检测。表3.与他汀类药物降低ldl-c效应的敏感性呈显著关联的多个基因单核苷酸多态性位点本发明所述待测个体优选为中国汉族人。本发明所述待测样本可以从待测个体的细胞获得,如来自血液、口腔拭子、尿、胃液、头发或活组织检查;优选来自血液;可以先从受试者的细胞获得含有本发明的基因的待测样品,然后按照常规方法提取样本的dna。(4)分析单元:本发明还提供一种对所述与他汀类药物降低ldl-c效应的敏感性呈显著关联多个基因单核苷酸多态性位点(药理作用敏感基因位点)组合的检测结果进行分析并计算待测个体的他汀类药物遗传降脂效应评分(geneticreductionpercentinldl-cwithstatin,grpl)的检测单元。所述待测个体的他汀类药物遗传降脂效应评分(grpl)按照下列公式计算:grpl=∑nk×rplk,其中rplk指待测个体携带的第k个药理作用敏感基因位点所影响他汀类药物降低ldl-c的效应值,nk指待测个体所携带的第k个药理作用敏感位点等位基因的数目(杂合子为1,纯合子为2);所述各个位点的rpl根据研究发表的结果选定,携带单个药理作用敏感基因位点可以影响他汀类药物对ldl-c的降低百分率,从额外使他汀降低ldl-c效应减少6.8%到额外使降低ldl-c效应增加6.5%不等(参见表3)。在本发明的一个具体实施方式中对上述需要他汀类药物干预的214例对照样本和200例冠心病患者进行上述7个药理作用敏感基因位点(snp)等位基因分型检测,计算个体的他汀类药物遗传降脂效应评分(grpl),上述414个中国人群的他汀类药物遗传降脂效应评分(grpl)呈典型的正态分布,最低grpl为-16.8%,最高为16.7%,平均grpl(mean)是0.2%,标准差是5.9%,根据个体他汀服用剂量增加一倍,能使降低ldl-c率增加约8%,因此本具体实施方式中的样本对他汀类药物药理作用高敏感个体和低敏感的相差四倍。本发明所述用于计算待测个体的他汀类药物遗传降脂效应评分(grpl)的分析单元,可以是虚拟装置,只要能实现对所述检测结果进行数据分析处理单元的功能即可;所述分析单元可以是任何可以实现对检测结果进行分析、计算待测个体他汀类药物遗传降脂效应评分(grpl)的计算公式、计算模块、仪器或是虚拟设备。(5)药理作用敏感性与剂量调整的评估和处理单元:本发明按上述的个体他汀类药物遗传降脂效应评分(grpl)从低到高的分布将个体分成降脂效应低敏感组、降脂效应中等敏感组、降脂效应高敏感组,并依次制定他汀类药物剂量调整系数grpl-t,从而进一步地分层调整个体服用他汀类药物的剂量。在本发明一个具体实施方式中,分组情况如下:(1)降脂效应低敏感组[grpl0-20%范围是-16.8%~5.0%],他汀类药物剂量调整系数grpl-t为0.5;(2)降脂效应中等敏感组[rpl20%-80%,范围是-5.0%~5.1%],他汀类药物剂量调整系数grpl-t为1;(3)降脂效应高敏感组[grpl80%-100%,范围是5.1%~16.7%]],他汀类药物剂量调整系数grpl-t为2;降脂效应高敏感组的他汀类药物剂量调整系数grpl-t为降脂效应低敏感组的四倍。本发明所述遗传性药理作用敏感性与剂量调整的评估和处理单元,可以是虚拟装置,只要能实现所述对检测和分析单元及其结果的进行评估和处理单元功能即可;所述评估和处理单元可以是任何可以实现基于个体的他汀类药物遗传降脂效应评分(grpl)制定出个体的他汀类药物剂量调整系数(grpl-t)的计算公式、计算模块、仪器或是虚拟设备,例如可以是预先按照上述个体的他汀类药物遗传降脂效应评分(grpl)而制定的数据图表,将分析单元得到的结果对照该数据图表即能得出药物剂量调整系数(grpl-t)的数值。第三方面,本发明另一个目的是提供一种由与他汀类药物不良反应易感性呈显著性关联的多个基因单核苷酸多态性位点(不良反应易感基因位点)构成的组合及其在用于制备检测和评估他汀类药物不良反应易感性与管理控制的检测模块中的应用。所述的检测模块包括5个检测单元:(1)他汀类药物不良反应易感基因位点的组合、(2)检测方法、(3)检测试剂、(4)分析单元、(5)不良反应管理和控制的处理单元。下面将具体说明所述的各个检测单元及其应用:(1)他汀类药物不良反应易感基因位点的组合:为了实现这一发明目的采取的技术方案是荟萃分析了他汀类药物不良反应的研究,选择了由全基因组关联性研(gwas)或孟德尔随机化等研究发现的他汀不良反应易感基因位点,如他汀类药物所致骨骼肌溶解症易感基因位点slco1b1上的rs4149056、他汀所致新发糖尿病易感基因位点hmcgr处的rs12916。(2)检测方法:本发明还提供一种用于检测本发明所述他汀类药物不良反应易感基因位点的组合的方法,包括但不限于:直接测序法、基于杂交方法(如taqman探针法、基因芯片法、寡核苷酸探针特异杂交aso法、高分辨率溶解曲线分析hrm法等)、基于结构和构象法(如限制性片段长度多态性(rflp)分析法、单链构象多态性分析sscp法、变性梯度凝胶电泳dgge法、裂解酶切片段长度多态性分析cflp法、变性高效液相色谱法dhplc法)、基于引物延伸法(基质辅助激光解析离子飞行时间质谱(mald1-tof-ms分析)法等。在具体实践时,本领域的技术人员可以根据实际情况选择上述的任一种技术进行体外检测本发明所述的一个或多个基因单核苷酸多态性位点。也可以采用多种技术的组合来体外检测所述一个或多个基因单核苷酸多态性位点。在本发明的一个具体实施方式中,采用taqman探针法,在美国应用生物系统(appliedbiosystems)的abi7900ht高通量快速实时荧光定量pcr仪上检测本发明所述的一个或多个基因单核苷酸多态性位点。(3)检测试剂:本发明还提供一种用于检测本发明所述的他汀类药物不良反应易感基因位点组合的试剂或系统,所述检测试剂或系统组件包括但不限于:用于直接测序的试剂;或用于taqman探针法检测的试剂(反应体系包括:以基因组dna或pcr产物为模板、一对pcr引物、分别用fam和vic标记的2条taqman-mgb探针检测snp的两种类型,以及其他试剂)、或用于基因芯片检测系统的组件、或用于高分辨率溶解曲线hrm分析法的试剂:也可以采用多种技术的试剂组合来检测,如或用于pcr与直接测序法相结合的试剂、或用于pcr与限制性片段长度多态性分析相结合的试剂;或用于以下任一种等位基因分型方法的试剂,如基于杂交方法、基于结构和构象法、基于引物延伸法等。在具体实践时,本领域的技术人员可以根据实际情况选择上述的任一种检测试剂或系统进行检测。本发明所述待测个体优选为中国汉族人。本发明所述待测样本可以来自血液、口腔拭子、尿、胃液、头发或活组织检查;优选来自血液;可以先从受试者的细胞获得含有本发明的基因的待测样品,然后按照常规方法提取样本的dna。(4)分析单元:本发明还提供一种对所述他汀类药物不良反应易感基因位点组合的检测结果进行分析并计算待测个体的他汀不良反应遗传风险评分(geneticriskscoreofadversedrugreactionwithstatin,grsadr)的检测单元。所述个体的他汀类药物不良反应遗传风险评分(grsadr)按照下列公式计算:药物不良反应遗传风险评分(grsadr)=∑nq×adrq,其中,adrq是指待测个体携带第q个不良反应易感基因位点等位基因相对风险效应值,nq是指待测个体携带第q个不良反应易感基因位点等位基因的数目(杂合子为1,纯合子为2)。在本发明的一个具体实施方式,选择了由全基因组关联性研(gwas)发现的他汀类药物所致骨骼肌溶解症易感基因slco1b1位点的snprs4149056-c和孟德尔随机化等研究发现的他汀所致新发糖尿病易感基因hmcgr位点的snprs12916-t组成不良反应易感基因位点组合,因此本具体实施方式中个体的他汀不良反应遗传风险评分grsadr计算公式为:他汀类药物不良反应遗传风险评分(grsadr)=nrs4149056-c×adrrs4149056-c+nrs12916-t×adrrs12916-t,其中,nrs4149056-c是指待测个体携带rs4149056-c等位基因的数目(杂合子为1,纯合子为2),adrrs4149056-c设定为1;nrs12916-t是指待测个体携带rs12916-t等位基因的数目(杂合子为1,纯合子为2),adrrs12916-t设定为0.5。在本发明的一个具体实施方式中对上述的需要他汀类药物干预的214例对照样本(未患冠心病的个体)和200例冠心病患者进行上述他汀类药物不良反应易感基因位点(snp)等位基因分型检测,rs4149056-c杂合子为18.2%,rs4149056-c纯合子为2.4%,rs12916-t杂合子为48.5%,纯合子为23.5%。本发明所述用于计算待测个体所述个体的他汀类药物不良反应遗传风险评分(grsadr)的分析单元,可以是虚拟装置,只要能实现对所述检测结果进行数据分析处理单元的功能即可;所述分析单元可以是任何可以实现对检测结果进行分析、计算待测个体的他汀类药物不良反应遗传风险评分(grsadr)的计算公式、计算模块、仪器或是虚拟设备。(5)他汀类药物不良反应管理控制的评估和处理单元:本发明还提供一种基于待测个体的他汀类药物不良反应遗传风险评分(grsadr)将个体分为他汀类药物所致骨骼肌溶解症易感的个体或/和新发糖尿病易感个体,并计算不良反应控制指数(grsadr-t)的检测单元,从而进一步优化他汀类药物干预方式包括改变用药剂量或使用其他降脂类药物干预如依折麦布等。在本发明的一个具体实施方式,所述他汀类药物的不良反应控制指数grsadr-t按下列公式计算:grsadr-t=grsadri×10,其中grsadri指待测个体i的他汀类药物不良反应遗传风险评分(grsadr);若grsadr-t为0,该个体的他汀类药物剂量不变;若grsadr-t为5,该个体的他汀类药物剂量减少5mg/日,若grsadr-t为10,该个体的他汀类药物剂量减少10mg/目;若grsadr-t为15,该个体的他汀类药物剂量减少15mg/日;若grsadr-t为20,该个体的他汀类药物剂量减少20mg/日;若grsadr-t为25,该个体的他汀类药物剂量减少25mg/日;若grsadr-t为30,该个体的他汀类药物剂量减少30mg/日。本发明所述他汀类药物不良反应管理控制的评估和处理单元,可以是虚拟装置,只要能实现所述对检测和分析单元结果的进行评估和处理单元功能即可;所述评估和处理单元可以是任何可以实现基于个体他汀类药物不良反应遗传风险评分(grsadr)制定出个体不良反应控制指数(grsadr-t)的计算公式、计算模块、仪器或是虚拟设备,例如可以是预先按照上述他汀不良反应遗传风险评分(grsadr)而制定的数据图表,将分析单得到的结果对照该数据图表即能得出不良反应控制指数(grsadr-t)的数值。第四方面,本发明另一目的是提供的一种综合分析处理平台对本发明所述的检测和评估个体的冠心病风险与(他汀类药物)干预收益、药理作用敏感性与剂量调整、不良反应易感性与管理控制的三个方面遗传因素的检测模块进行综合分析处理,计算待测个体的他汀类药物精准治疗的指数(precisiontherapyofstatinforcoronaryheartdisease,pts),所述个体的他汀类药物精准治疗的指数(pts)按下述公式计算:他汀类药物精准治疗的指数(pts)=[干预收益指数(grs-t)-不良反应控制指数(grsadr-t)]×剂量调整指数(grpl-t),即pts=(grs-ti-grsadr-ti)×grpl-ti,其中,grs-ti体是指待测个体i的他汀类药物干预收益指数、grsadr-ti体是指待测个体i的汀类药物不良反应控制指数、grpl-ti体是指待测个体i的汀类药物剂量调整指数。本发明所述他汀类药物的干预收益指数(grs-t)可基于个体的冠心病的遗传风险评分(grs)的而得、或由传统风险评分而得、或遗传风险评分(grs)与传统风险评分相结和而得;若待测个体属于冠心病低风险组即他汀类药物的干预收益指数(grs-t)为零时,该个体的他汀类药物精准治疗的指数(pts)为零,不予以他汀类药物干预;本发明所述他汀类药物的剂量调整指数(grpl-t)可基于个体的他汀类药物遗传降脂效应评分(grpl)而得、或基于传统检测的结果而得、或可基于个体的他汀类药物遗传降脂效应评分(grpl)与传统检测结果相结和而得;本发明所述他汀类药物的不良反应控制指数(grsadr-t)可基于个体的他汀类药物不良反应遗传风险评分(grsadr)而得、或基于传统不良反应检测的结果而得、或可基于个体的他汀类药物不良反应遗传风险评分(grsadr)与传统检测结果相结和而得。本发明所述综合分析处理平台,可以是虚拟装置,只要能实现对本发明所述个体的冠心病风险与(他汀类药物)干预收益、药理作用敏感性与剂量调整、不良反应易感性与管理控制的三个方面因素检测模块的检测结果进行分析处理功能即可;所述综合分析处理平台可以是任何可以实现对检测模块的结果进行分析处理而得出他汀类药物精准治疗的指数(pts)的计算公式、计算模块、仪器或是虚拟设备,例如可以是预先按照上述三个方面模块的处理结果而制定的数据图表,将检测单元对个体检测的结果对照该数据图表即能得出他汀类药物精准治疗的指数。第五方面,本发明另一目的是提供的一种制备“三维”遗传学检测装置和评估处理装置方法以及所述的检测装置和评估处理装置在分层递进式评估和调节他汀类药物干预方式和用药剂量中的应用。首先,所述的“三维”遗传学检测装置包括但不限于:能检测或制备所述的个体的冠心病风险与(他汀类药物)干预收益的检测模块、药理作用敏感性与剂量调整的检测模块、不良反应易感性与管理控制检测模块以及能对所述检测结果进行分析处理所需的单核苷酸位点组合、各种检测试剂或系统、试剂盒、检测仪器、计算公式、运算仪器、模块、或是虚拟装置、虚拟设备、数据图表等。在实际实施中可根据具体需要可以从本发明所述的三个检测模块中分别选择所需的一个或多个基因单核苷酸位点或与其紧密连锁的位点组成组合,只要能够实现检测和评估所述个体的冠心病风险与(他汀类药物)干预收益、药理作用敏感性与剂量调整、不良反应易感性与管理控制的三个方面的因素及据此分层递进式评估和调整他汀类药物干预方式和用药剂量的功能即可。其次,本发明所述“三维”遗传学评估处理装置是指能评估由综合分析处理平台的计算分析出的结果即个体的他汀类药物精准治疗的指数(pts),并据此制备指导他汀类药物个体化用药方案的装置。在本发明的一个具体实施方式,根据他汀类药物的精准治疗指数(pts)制定指导他汀类药物个体化用药方案如下:个体的pts为-20-0(pts≤0)应予以生活方式干预为主或者非他汀类药物如依折麦布等干预:(2)个体的pts在0-10之间(0<pts≤10)予以剂量10mg/日他汀类药物干预;(3)个体的pts在10-20之间(10<pts≤20)予以剂量20mg/日他汀类药物干预;(4)个体的pts为20-40(20<pts≤40)予以剂量40mg/日他汀类药物干预;(5)个体的pts为40-80(40<pts≤80)予以剂量80mg/日他汀类药物干预或/和其他降脂药物如依折麦布等进行联合干预。本发明所述的评估处理装置,可以是虚拟装置,只要能实现本发明所述对待测个体的他汀类药物精准治疗的指数(pts)进行评估和处理制定精准治疗方案的功能即可;所述评估处理装置可以是任何可以实现对检测模块的结果进行分析处理而得出他汀类药物精准治疗干预方式的计算公式、计算模块、仪器或是虚拟设备,例如可以是预先按照上述综合分析处理平台结果而制定的数据图表,将检测单元对个体检测的结果对照该数据图表即能得出他汀类药物精准治疗的指数。与利用传统冠心病风险评估模型进行评估来预测个体10年的冠心病风险、或其他基因诊断方法预测冠心病风险或他汀类药物不良反应等技术相比,本发明首次整合冠心病风险与(他汀类药物)干预收益、药理作用敏感性与剂量调整、不良反应易感性与管理控制等方面个体基因组中遗传信息,建立一个“三维”检测装置或评估处理模型,能全方位地检测和综合评估处理待测个体的患冠心病风险、他汀类药物干预的方式和收益、药理作用敏感性与不良反应易感性等方面的遗传因素,分层递进式调整他汀类药物干预方式和用药剂量,从而“一站式”指导他汀类药物个体化预防和治疗冠心病。附图说明图1.由与他汀类药物个体化用药相关的多个单核苷酸位点组合制备的“三维”检测装置或评估处理装置结构图。图2.制备指导他汀类药物个体化用药的“三维”检测装置或评估处理装置的流程图。图3.310例对照组和200例冠心病组样本的冠心病遗传风险评分(geneticriskscore,grs)的分布图。图4.214例对照组和200例冠心病组样本的他汀类药物遗传降脂效应评分(geneticreductionpercentinldl-cwithstatin,grpl)的分布图。图5.214例对照组和200例冠心病组样本的他汀类药物不良反应遗传风险评分(geneticriskscoreofadversedrugreactionwithstatin,grsadr)的分布图。具体实施方式下面参照实施例及附图对本发明进行更详细说明。应该注意的是实施例仅用于解释而不以一任何方式限制本发明。下面实施例中未注明具体条件的实验方法通常按所属领域熟知的常规方法和常规条件、或按制造厂商所建议的条件进行。实施例一、与冠心病显著关联的多个基因单核苷酸多态性位点组合的选择以及在用于制备检测和评估个体的疾病风险与他汀类药物干预收益的模块中的应用。1.研究人群:自中国汉族人群(hahchinese)中选取310例对照样本和200例冠心病患者,根据知情同意原则,采集空腹血放入抗凝管中,并收集年龄、性别、身高、体重、血压水平、血脂水平、血糖、吸烟、饮酒和疾病史等相关信息,具体如下:冠心病样本入选标准:冠心病病例包括心绞痛患者和心肌梗死患者。心绞痛病例的入选诊断标准为经冠脉造影发现冠状动脉主干或主要分支有70%以上狭窄。心肌梗死病例的入选诊断标准为急性心肌梗死诊断标准:即典型胸痛症状持续30分钟以上;心电图连续2个导联st段抬高0.1-0.2mv以上,持续24-48小时以上,并有动态演变;心肌坏死的血清标记物浓度升高,如血清心肌酶及其同功酶升高。符合上述两项诊断的病例作为冠心病样本,并经其他各项检查排除外心脏瓣膜疾病、先天性心脏病、继发性高血压、心力衰竭、心肌病、严重的肾脏及肝脏疾病、家族性高胆固醇血症。对照组样本入选标准:既往无冠心病的病史,无胸痛、胸闷等心脏病症状,心电图无明显缺血性改变。病例组和对照组样本均为中国汉族人,相互间不存在血缘关系。研究样本包括310例对照样本和200例冠心病患者,其基本特征如下表4:2.对上述的310例对照样本和200例冠心病患者全血基因组dna按常规基因组dna提取和纯化,所用血液基因组提取试剂盒购自天根生化科技(北京)有限公司,纯化的基因组dna置-20℃保存。表4.310例对照组和200例冠心病组样本的基本特征对照组冠心病组样本量310200男性/女性217/93162/38年龄54.68±12.0950.47±15.22收缩压123.19±21.44136.50±27.81舒张压80.23±10.3986.34±12.04血糖89.58±29.1697.75±37.35总胆固醇(tc)165.92±34.31178.23±44.07总甘油三酯(tg)135.63±78.72164.08±86.36高密度胆固醇(hdl)54.34±13.1634.96±14.53低密度胆固醇(ldl)93.65±26.24117.48±36.03高血压(%)37.153.5糖尿病(%)8.7121.0吸烟(%)42.2561.0饮酒(%)29.3545.53.检测与冠心病呈显著性关联的60个基因单核苷酸多态性位点(冠心病易感基因位点)的snp等位基因分型。所述60个冠心病易感基因位点的参见表5。表5.与冠心病呈显著性关联的60个基因单核苷酸多态性位点表5.(续)与冠心病呈显著性关联的60个基因单核苷酸多态性位点采用taqman探针法进行等位基因分型,其技术原理是:taqman探针是一种合成的寡核苷酸探针,其序列与靶模板的一段序列互补,在探针的5′末端连接荧光基团,在3′末端连接淬灭剂。当完整的寡核苷酸探针与目标序列配对时,荧光基团发射的荧光被3′端连接的淬灭剂淬灭,无法检测荧光信号。在进行延伸反应时,与引物比探针先与靶模板结合,当引物沿着dna模板延伸到荧光标记寡核苷酸探针的结合位点时,dna聚合酶的5′外切酶活性将寡核苷酸探针进行酶切,导致荧光基团与淬灭剂分离,发射荧光且不被淬灭,因此可以检测荧光信号。并随着dna扩增循环次数的增加,发射出来的荧光基团不断积累,荧光强度也不断增强;常用的荧光基团是fam,tet,vic,hex。本实施例所用仪器:abi7900ht高通量快速实时荧光定量pcr仪:appliedbiosystems公司;主要的试剂:snpgenotypingassay:购自thermofisherscientific-appliedbiosystems公司;genotypingmastermix:购自thermofisherscientific-appliedbiosystems公司;384孔pcr板和光学盖膜:购自thermofisherscientific-appliedbiosystems公司;dna样本:用于snp检测的基因组dna样本浓度在10ng/μl-50ngμl/之间,每个snp位点反应溶液至少10ng的样品,不含pcr抑制剂。实验方法:1.按如下体系配制384孔,板完成后密封384孔板并离心:试剂每孔剂量(384孔板)2×taqmanmastermix2.5μl20×taqmansnpgenotypingassay0.25μlnuclease-free水0.25μl基因组dna(浓度:10ng/μl)2μl(20ng)总体积5μl将384孔板放到在美国应用生物系统公司(appliedbiosystems)的abi7900ht高通量快速实时荧光定量pcr仪上,打开sds2.2应用软件,选择菜单file→new,新建一个空白文件;assay代表试验类型,实时定量选absolutequantification;终点读板选allelicdiscrimination;container选384孔反应板类型,template项用于调用事先设置好的模板文件;手工输入barcode条形码。设置完毕,点ok确认;接着设定detector的相关参数;在instrument窗口设定反应体系和下列的循环参数:设置完毕,保存文件;按键弹出样本架,放入样本板,按start按钮开始实验。实验结果表明,所述的62个snp的等位基因在上述510例样本中的频率为3.3%到95.3%。4.对上述与冠心病风险呈显著关联的60个基因单核苷酸多态性位点组合的检测结果进行分析,计算待测个体冠心病遗传风险评分(geneticriskscore,grs);所述待测个体冠心病的遗传风险评分(grs),计算公式:grs=∑nj×log(orj),其中orj指待测个体携带的第j个单核苷酸多态性位点相对风险程度,nj指待测个体所携带的第j个单核苷酸多态性位点风险等位基因数目(杂合子为1,纯合子为2)。上述510个研究样本的遗传风险评分(grs)呈典型的正态分布,最低grs为3.618,最高为7.011,平均grs(mean)是5.379标准差是0.459,风险最高个体是最低的1.94倍,结果见图3。5.制备他汀类药物干预收益指数(grs-t),选择合适干预方式:上述的310例对照组样本按其冠心病遗传风险评分(grs)从低到高的分布分成冠心病风险低、中、高三组,并设定他汀类药物干预收益指数(grs-t),据此分层调整个体服用他汀类药物的剂量,选择干预方式:(1)冠心病低风险组[grs0-20%,范围是3.618~5.000]:为他汀类药物干预低收益组,他汀类药物干预指数(grs-t)为0,不予以他汀类药物干预,有96个样本;(2)冠心病中等风险组[grs20%-80%,范围是5.000~5.727]:为他汀类药物干预中等收益组,他汀类药物干预指数(grs-t)为20,予以他汀类药物剂量为20-40mg/日,有183位;(3)冠心病高风险组[grs80%-100%,范围是5.729~7.011]:为他汀类药物干预高收益组,他汀类药物干预指数(grs-t)为40,予以他汀类药物剂量为40-80mg/日,有31位;上述的处理的结果参见表6。上述200例冠心病组按个体冠心病遗传风险评分(grs)从低到高的分布分成冠心病再次发作风险低、中、高三组,并设定他汀类药物干预收益指数(grs-t),据此分层调整个体服用他汀类药物的剂量,选择干预方式:(1)冠心病再发低风险组[grs0-20%,范围是3.618~5.000]:为冠心病再发低风险个体,也是他汀类药物干预低收益组,干预收益指数(grs-t)为15,他汀类药物剂量为10-20mg/日,有6位个体;(2)冠心病再发等风险组[grs20%-80%,范围是5.000~5.727]:为冠心病再发中等风险个体,也是他汀类药物干预中等收益组,干预收益指数(grs-t)为20,他汀类药物剂量为20-40mg/日,有123位个体;(4)冠心病再发高风险组[grs80%-100%,范围是5.729~7.011]:为冠心病再发高风险个体,他汀类药物干预高收益组,他汀类药物干预指数(grs-t)为40,予以他汀类药物剂量为40-80mg/日,有71位个体;上述的处理的结果参见表7。对本实施例中的510个样本,按grs评估和处理后,有96例对照组样本不需要他汀类药物干预,214例对照组样本不需要他汀类药物干预,而冠心病组200例均需要他汀类药物干预,结果参见表6和7。表6.310例对照组样本的遗传风险因素的评分(grs)与他汀类药物干预分组及情况表7.200例冠心病组样本冠心病再次发作风险遗传风险因素评分(grs)与他汀类药物干预分组及情况实施例二、与他汀类药物降低ldl-c效应的敏感性呈显著关联多个基因单核苷酸多态性位点(药理作用敏感基因位点)组合的选择以及在用于制备检测和评估个体的药理作用敏感性和剂量调整模块中的应用:1.研究对象是上述实施例一中的通过检测和评估个体的疾病风险和干预收益模块处理而需要他汀类药物干预的414位个体,包括200例冠心病患者和214对照样本;对这些个体进行他汀类药物的7个药理作用的敏感基因位点的等位基因分型检测和评估,据此进行进一步分层调整他汀类药物的使用剂量。2.检测与他汀类药物降低ldl-c效应的敏感性呈显著关联的多个基因单核苷酸多态性位点(药理作用敏感基因位点)的等位基因分型,所述7个他汀类药物药理作用敏感基因位点的参见表8。采用实施例一中的所述的taqman探针法检测上述200例冠心病患者和214例对照样本中的7个他汀类药物药理作用敏感基因位点等位基因分型。实验结果表明所述的7个药理作用敏感基因位点在中国汉族人中的频率2.0%到99.2%。3.对上述他汀类药物药理作用敏感基因位点组合的检测结果进行分析,计算待测个体的他汀类药物遗传降脂效应评分(geneticreductionpercentinldl-cwithstatin,grpl),grpl=∑nk×rplk,其中rplk指待测个体携带的第k个药理作用敏感基因位点所影响他汀类药物降低ldl-c的效应值,nk指待测个体所携带的第k个药理敏感位点等位基因的数目(杂合子为1,纯合子为2)。分析结果见图4和表8,上述414个中国人群的他汀类药物遗传降脂效应评分(grpl)呈典型的正态分布,最低grpl为-16.8%,最高为16.7%,平均grpl(mean)是0.2%,标准差是5.9%,根据个体他汀服用剂量增加一倍,能使降低ldl-c率增加约8%,因此本具体实施方式中的样本对他汀类药物药理作用高敏感样本是低敏感的四倍。4.制备个体的他汀类剂量调整指数(grpl-t)和调整剂量:将上述的414例个体他汀类药物遗传降脂效应评分(grpl)从低到高的分布分成降脂效应低敏感组、降脂效应中等敏感组、降脂效应高敏感组三个组,并依次制定他汀类药物剂量调整系数grpl-t,从而进一步地分层调整个体服用他汀类药物的剂量:(1)降脂效应低敏感组[grpl0-20%范围是-16.8%~5.0%],他汀类药物剂量调整系数grpl-t为0.5;(2)降脂效应中等敏感组[rpl20%-80%,范围是-5.0%~5.1%],他汀类药物剂量调整系数grpl-t为1;(3)降脂效应高敏感组[grpl80%-100%,范围是5.1%~16.7%]],他汀类药物剂量调整系数grpl-t为2;降脂效应高敏感组的他汀类药物剂量调整系数grpl-t为降脂效应低敏感组的四倍,分层处理的结果见表9。表8.与他汀类药物降低ldl-c效应的敏感性呈显著关联的多个基因单核苷酸多态性位点表9.214例对照组和200例冠心病组样本的他汀类药物遗传降脂效应评分(grpl)的分布和grpl-t结果实施例三、与他汀类药物不良反应呈显著性关联的多个基因单核苷酸多态性位点(不良反应易感基因位点)组合的选择以及在用于制备检测和评估他汀类药物不良反应易感性和管理控制中的应用:1.研究对象:上述实施例一中的通过检测和评估个体的疾病风险和干预收益模块处理而需要他汀类药物干预的414位个体,包括200例冠心病患者和214对照样本.2.检测他汀类药物不良反应易感基因位点的等位基因的分型:本具体实施例中所述他汀类药物不良反应2个易感基因位点是slco1b1rs4149056-c和hmgcrrs12916-t,参见表10。表10.他汀类药物不良反应易感基因位点及其相对风险效应值(adr)采用实施例一中所述的taqman探针法检测上述200例冠心病患者和214例对照样本中的slco1b1rs4149056和hmgcrrs12916的等位基因分型。实验结果表明所述的2个snp在中国汉人中的频率是rs4149056-c杂合子为18.2%,rs4149056-c纯合子为2.4%,rs12916-t杂合子为48.5%,rs12916-t纯合子为23.5%。3.分析他汀类药物不良反应易感基因位点组合的检测结果,计算待测个体的他汀类药物不良反应遗传风险评分(geneticriskscoreofadversedrugreactionwithstatin,grsadr),计算公式为:grsadr=∑nq×adrq,其中,adrq是指待测个体携带第q个不良反应易感基因位点等位基因相对效应值,nq是指待测个体携带第q个不良反应易感基因位点等位基因的数目(杂合子为1,纯合子为2)。在本具体实施方式,grsadr=rs4149056-c×na×1+rs12916-t×nb×0.5,其中,nrs4149056-c是指待测个体携带rs4149056-c等位基因的数目(杂合子为1,纯合子为2),adrrs4149056-c设定为1;nrs12916-t是指待测个体携带rs12916-t等位基因的数目(杂合子为1,纯合子为2),adrrs12916-t设定为0.5。对上述414待测个体的他汀类药物不良反应遗传风险评分(grsadr)计算结果表明,grsadr范围是从0到3,呈非正态分布,结果见图5和表11。表11.214例对照组和200例冠心病组样本的他汀类药物不良反应遗传风险评分(grsadr)分布情况4.制备个体的他汀类药物不良反应控制指数(grsadr-t),grsadr-t按下列公式计算:grsadr-t=grsadr1×10,其中grsadri指待测个体i的他汀类药物不良反应遗传风险评分(grsadr)。若grsadr-t为0,该个体的他汀类药物剂量不变;若grsadr-t为5,该个体的他汀类药物剂量减少5mg/日,若grsadr-t为10,该个体的他汀类药物剂量减少10mg/日;若grsadr-t为15,该个体的他汀类药物剂量减少15mg/日;若grsadr-t为20,该个体的他汀类药物剂量减少20mg/日;若grsadr-t为25,该个体的他汀类药物剂量减少25mg/日;若grsadr-t为30,该个体的他汀类药物剂量减少30mg/日。本实施例中414个体的他汀类药物不良反应控制指数(grsadr-t)结果见表12。表12.214例对照组和200例冠心病组样本的他汀类药物不良反应控制指数(grsadr-t)实施例四、计算待测个体的他汀类药物精准治疗的指数(precisiontherapyofstatinforcoronaryheartdisease,pts),所述个体的他汀类药物精准治疗的指数(pts)按公式计算:pts=(grs-ti-grsadr-ti)×grpl-ti,其中,grs-ti体是指待测个体i的干预收益指数、grsas-ti体是指待测个体i的不良反应控制指数、grpl-ti体是指待测个体i的剂量调整指数;其中需要说明的是,待测个体属于冠心病低风险组即他汀类药物的干预收益指数(grs-t)为零时,其他汀类药物精准治疗的指数(pts)为零。本实施例中310例对照样本和200例冠心病患者的他汀类药物精准治疗指数(pts)的分析结果见表13。表13.310例对照样本和200例冠心病患者的他汀类药物精准治疗指数(pts)的分析结果实施例五、根据个体的他汀类药物精准治疗的指数(pts)制备指导他汀类药物个体化用药方案如下:(1)个体的pts为-20-0(pts≤0),不予以他汀类药物干预,而应以生活方式干预为主等干预:(2)个体的pts在0-10之间(0<pts≤10)予以剂量10mg/日他汀类药物干预;(3)个体的pts在10-20之间(10<pts≤20)予以剂量20mg/日他汀类药物干预:(4)个体的pts为20-40(20<pts≤40)予以剂量40mg/日他汀类药物干预;(5)个体的pts为40-80(40<pts≤80)予以剂量80mg/日他汀类药物干预。根据上述方法,本实施例中310例对照样本的他汀类药物个体化用药方案见表14:(1)110人不需要他汀类药物干预;(2)72人予以他汀类药物10mg/日;(3)89人予以他汀类药物20mg/日;(4)33人予以他汀类药物40mg/日;(5)6人予以他汀类药物80mg/日。本实施例中200例冠心病患者的他汀类药物个体化用药方案见表14:(1)6人不需要他汀类药物干预,可予以药物依折麦布或生活方式调整等干预;(2)59人予以他汀类药物10mg/日;(3)64人予以他汀类药物20mg/日;(4)57人予以他汀类药物40mg/日;(5)14人予以他汀类药物80mg/日。实施例子结果表明,本发明全面检测和评估了个体的基因组中与冠心病风险与(他汀类药物)干预收益、药理作用敏感性与剂量调整、不良反应易感性与管理控制的等三方面因素,制定处理措施,分层递进式评估风险和调整药物干预方式和用药剂量,指导他汀类药物个体化防治冠心病。表14310例对照样本和200例冠心病患者的他汀类药物个体化用药方案当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1