聚羟基脂肪酸酯PHA颗粒结合蛋白PhaP突变体及其制备方法与应用与流程
本发明涉及生物技术领域,尤其涉及聚羟基脂肪酸酯pha颗粒结合蛋白phap突变体及其制备方法与应用。
背景技术:
生物表面活性剂是一大类生物合成的双亲性分子(mulligan等,environpollut,133(2005),183-98;khire等,advexpmedbiol,672(2010),146-57),包括低分子量的糖脂、脂肽、磷脂、中性类脂等和高分子量的含脂聚合物,如脂多糖、脂蛋白、多糖-蛋白-脂肪酸复合物等(syldatk等,znaturforschc,40(1985),61-7;ogawa等,bioscibiotechnolbiochem,64(2000),2466-8;morita等,jbioscibioeng,104(2007),78-81;wicke等,jnatprod,63(2000),621-6)。这些分子结构基本由两部分组成,分别是疏油亲水的极性基团,如单糖、聚糖、氨基酸和磷酸基等,以及是由疏水亲油的碳氢链组成的非极性基团,如饱和或非饱和的脂肪醇及脂肪酸等。正是由于具有这种既亲油又亲水的双亲性分子结构,生物表面活性剂才能显著降低界面张力,或吸附在界面上形成紧密的定向排列来改变界面的亲水/亲油性能,使油/水两相得以很好的分散。其中最为代表的是糖脂类(mata-sandoval等,microbiolres,155(2001),249-56;guilmanov等,biotechnolbioeng,77(2002),489-94;)。
聚羟基脂肪酸酯(polyhydroxyalkanoicacids,简称pha)是许多微生物在非平衡生长条件下合成的一种细胞内碳源和能源的贮藏性聚合物(anderson等,microbialrev.,54(1990)450-472;lee等,biotech.bioeng.,49(1996)1-14)。自然条件下的pha在细菌体内是以不溶性脂肪颗粒的形式存在。pha分子形成疏水核心,颗粒表面包裹着一层特殊的单层膜结构,由颗粒结合蛋白(phap)、调控蛋白(phar)、pha合成酶(phac)、pha降解酶(phaz)和单层磷脂膜等组成(steinbüchel等,can.j.microbiol.41(1995)94-105;york等,j.bacteriol.183(2001)2394-2397)。
pha颗粒表面结合蛋白phap(以下简称phap)广泛存在于各种pha合成菌中,虽然phap不是pha合成所必需的,但会直接影响pha包含体颗粒的尺寸大小和pha合成积累的速率(pieper-fürst等,j.bacteriol.,176(1994)4328-4337)。在ralstoniaeutropha中过表达自身的phap基因观察到pha的颗粒增多;而phap基因缺失突变的r.eutropha,合成的pha颗粒数目大大减少(wieczorek等,j.bacteriol.,177(1995)2425-2435)。在大肠杆菌中表达rodococcusrubber的phap使pha颗粒数目增多、尺寸减小(wieczorek等,j.bacteriol.,177(1995)2425-2435)。phap被认为是一种两性蛋白,具有疏水区和亲水区,疏水区和pha颗粒接触,亲水区朝向胞浆,这种结构有利于于其参与pha颗粒的形成(pieper-fürst等,j.bacterio1.,177(1995)2513-2523)。同时aeromonashydrophila菌种中的phap被报导具有生物表面活性剂的功能(wei等,appliedmicrobiologyandbiotechnology.,91(2011)1037-1047)。
技术实现要素:
本发明的一个目的是提供聚羟基脂肪酸酯pha颗粒结合蛋白phap突变体。
本发明提供的蛋白质,是如下a)或b):
a)对聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列中至少一个氨基酸残基进行氨基酸修饰,且具有与phap相同功能的蛋白;
b)将a)所示蛋白的氨基酸序列末端添加标签序列且具有相同功能由a)衍生的蛋白质。
上述与phap相同功能可以是乳化功能,也可以是其他功能。
聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列为序列1,其编码基因的核苷酸序列为序列2。
上述蛋白质中,所述氨基酸修饰为氨基酸置换。
上述蛋白质中,所述氨基酸置换为亲水氨基酸替换为疏水氨基酸。
上述蛋白质中,所述亲水氨基酸替换为疏水氨基酸为将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列中如下位点的亲水氨基酸中任一个或任2个或任3个替换为疏水氨基酸:第23、24、30、38、45、52、72和82。
上述蛋白质中,所述疏水氨基酸为甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸或甲硫氨酸;
所述亲水氨基酸为丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天门冬氨酸、天门冬酰胺、谷氨酸、谷氨酰胺、赖氨酸、精氨酸或组氨酸。
上述蛋白质中,
a所示的蛋白质为如下1)-9)中任一种方法得到的蛋白:
1)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第23位酪氨酸替换为苯丙氨酸或丙氨酸;
2)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第24位天门冬酰胺替换为亮氨酸或丙氨酸;
3)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第30位天门冬酰胺替换为亮氨酸或丙氨酸;
4)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第38位谷氨酰胺替换为亮氨酸、异亮氨酸或丙氨酸;
5)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第45位酪氨酸替换为苯丙氨酸或丙氨酸;
6)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第52位谷氨酰胺替换为亮氨酸、异亮氨酸或丙氨酸;
7)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第72位谷氨酰胺替换为亮氨酸、异亮氨酸或丙氨酸;
8)将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第82位谷氨酰胺替换为亮氨酸、异亮氨酸或丙氨酸;
9)1)-8)中任2个或任3个组合。
上述蛋白质中,所述9)所示的方法为如下9)-1)、9)-2)、9)-3)、9)-4):
9)-1):将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第38位谷氨酰胺替换为亮氨酸,且将所述phap氨基酸序列第52位谷氨酰胺替换为亮氨酸;
9)-2):将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第38位谷氨酰胺替换为亮氨酸,且将所述phap氨基酸序列第72位谷氨酰胺替换为亮氨酸;
9)-3):将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第38位谷氨酰胺替换为亮氨酸,且将所述phap氨基酸序列第82位谷氨酰胺替换为亮氨酸;
9)-4):将聚羟基脂肪酸酯颗粒结合蛋白phap氨基酸序列第38位谷氨酰胺替换为亮氨酸,且将所述phap氨基酸序列第52位谷氨酰胺替换为亮氨酸,且将所述phap氨基酸序列第82位谷氨酰胺替换为亮氨酸。
编码上述蛋白质的dna分子也是本发明保护的范围。
上述蛋白质或上述的dna分子在作为乳化剂中的应用也是本发明保护的范围;
或上述蛋白质或上述的dna分子在制备乳化剂中的应用也是本发明保护的范围;
或上述蛋白质或上述的dna分子在乳化油中的应用也是本发明保护的范围;
或上述蛋白质或上述的dna分子在制备油水乳状液中的应用也是本发明保护的范围;
或上述蛋白质或上述的dna分子在制备表面活性剂中的应用也是本发明保护的范围。
本发明另一个目的是提供一种产品。
本发明提供的产品,包括上述蛋白质。
上述产品为乳化剂或表面活性剂。
本发明的实验证明,本发明经过大量的实验以及结构生物学的解析,提供了多种聚羟基脂肪酸pha酯颗粒结合蛋白phap突变体,经过构建、表达以及纯化获得该突变体,该突变体相对于野生型蛋白具有更强的乳化性,同时具有更高的耐热性,有更强的降低溶液界面表面张力的能力。高性能的突变体可作为生物表面活性剂应用在医疗、化妆品、大众消费品、纳米材料、高分子材料、石油开采等领域应用,相对于野生型蛋白具有性能强、成本低的优势。
附图说明
图1为重组质粒pgex-6p-1-phap的电泳图。
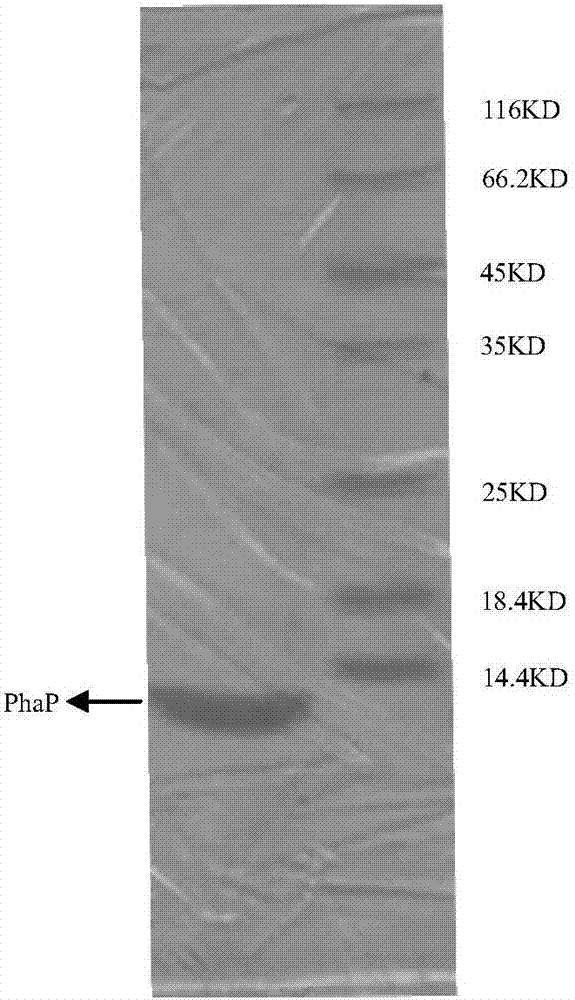
图2为聚羟基脂肪酸酯pha颗粒结合蛋白phap的sds-page图。
图3为凝胶过滤层析纯化phap的图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、pha颗粒结合蛋白phap及其突变体的制备
一、pha颗粒结合蛋白phap的制备
本发明使用两亲性蛋白是来自aeromonashydrophila中的聚羟基脂肪酸酯颗粒结合蛋白phap基因,将其在原核或真核过量表达,并用gst标签亲和纯化。
来自aeromonashydrophila中的聚羟基脂肪酸酯颗粒结合蛋白phap的氨基酸序列为序列表中序列1,其编码基因phap的核苷酸序列为序列表中序列2。具体操作如下:
1、重组质粒pgex-6p-1-phap的构建
重组质粒pgex-6p-1-phap为将序列表中序列2所示的基因phap替换pgex-6p-1(vt1258,优宝生物)载体的bamhi以及xhoi酶切位点间的片段,得到的载体,基因phap与载体上的gst标签共同表达共同表达融合蛋白phap。
2、蛋白phap的表达和纯化
将重组质粒pgex-6p-1-phap导入大肠杆菌bl21(de3)感受态细胞(购自全式金生物科技有限公司)中,涂抹抗性平板(含氨苄100μg/ml)筛选阳性菌落。将阳性菌落进行菌液pcr鉴定,引物为5’-cgggatccatgatgaatatg-3’;5’-cactcgagggccttgcccgtg-3’。得到与预计的理论值基本一致的350bp大小的片段为阳性,将该阳性菌命名为bl21/pgex-6p-1-phap。
挑取bl21/pgex-6p-1-phap单菌落,分别加入100mllb液体培养基中(含氨苄100μg/ml),37℃振荡培养至od600为0.5-0.8,加入终浓度为0.5mm的iptg,16℃过夜诱导表达融合蛋白,获得诱导后bl21/pgex-6p-1-phap菌液。同时设不加iptg的菌液为空白对照。
上述bl21/pgex-6p-1-phap菌液,转速为8000rpm离心12min,弃上清,收集沉淀重悬于bindingbuffer溶液(0.5mnacl,50mmtris-hcl,ph=8.0),冰浴,超声破碎细胞;以13000rpm的转速离心60分钟,上清即为澄清的细胞粗提物。
将细胞粗提物上样gst亲和层析介质(dp201-01,全式金)自装纯化柱,柱体积为4ml,并利用200mlbindingbuffer溶液(0.5mnacl,50mmtris-hcl,ph=8.0)洗去杂蛋白,最后将2倍柱体积的洗脱液(0.5mnacl,50mmtris-hclph=8.0)加入亲和层析柱中,并加入500ul3cprescissionprotease酶(清华大学生物系结构生物学中心制备)4度酶切过夜,切除gst,得到亲和层析纯化产物。
将亲和层析纯化产物用滤膜孔径大小为10kd的超滤浓缩管,在4℃条件下,以4000rpm的转速离心,由于蛋白大于滤膜孔径,被截留在上层,缓冲液及盐小于滤膜孔径,在离心的过程中被甩到下层,从而达到浓缩的效果,浓缩至终体积为1ml左右,收集浓缩产物进行凝胶柱过滤层析,凝胶柱过滤层析采用孔径为superdex20010/300的柱子,柱体积为25ml,洗脱时间为60min,洗脱液(0.5mnacl,50mmtris-hclph=8.0)流速为0.5ml/min,收集6ml的洗脱液(图3)。
将收集6ml的洗脱液用孔径大小为10kd的超滤浓缩管进行浓缩,收集浓缩液得到蛋白phap。
将蛋白phap进行sds-page,电泳结果见图2,可以看出,得到蛋白phap大小为约14kda,与文献报道分子量一致。
将空载体pgex-6p-1导入大肠杆菌bl21中,得到bl21/pgex-6p-1。采用上述方法进行表达和纯化蛋白,未得到14kda大小的目的蛋白。
二、phap突变体的制备
phap突变体为将phap蛋白的氨基酸序列中的至少一个氨基酸进行氨基酸置换,得到的蛋白,若一个氨基酸置换得到phap单点突变体,若2个氨基酸置换得到phap双点突变体,若3个氨基酸置换得到phap三点突变体。
phap单点突变体具体为phap/y23f、phap/y23a、phap/n24l、phap/n24a、phap/n30l、phap/n30a、phap/q38l、phap/q38i、phap/q38a、phap/y45f、phap/y45a、phap/q52l、phap/q52i、phap/q52a、phap/q72l、phap/q72i、phap/q72a、phap/q82l、phap/q82i、phap/q82a。
phap双点突变体具体为phap/q38l-q52l、phap/q38l-q72l、phap/q38l-q82l、phap/q52l-q72l;
phap三点突变体具体为phap/q38l-q52l-q72l。
突变体phap/y23f的氨基酸序列为将序列1第23位的酪氨酸(tyr)突变为苯丙氨酸(phe),突变体phap/y23f编码基因的核苷酸序列为将序列2第67位-69位的tac突变为ttc。
突变体phap/y23a的氨基酸序列为将序列1第23位的酪氨酸(tyr)突变为丙氨酸(ala),突变体phap/y23a编码基因的核苷酸序列为将序列2第67位-69位的tac突变为gcc。
突变体phap/n24l的氨基酸序列为将序列1第24位的天门冬酰胺(asn)突变为亮氨酸(leu),突变体phap/n24l编码基因的核苷酸序列为将序列2第70位-72位的aac突变为ctg。
突变体phap/n24a的氨基酸序列为将序列1第24位的天门冬酰胺(asn)突变为丙氨酸(ala),突变体phap/n24a编码基因的核苷酸序列为将序列2第70位-72位的aac突变为gcc。
突变体phap/n30l的氨基酸序列为将序列1第30位的天门冬酰胺(asn)突变为亮氨酸(leu),突变体phap/n30l编码基因的核苷酸序列为将序列2第88位-90位的aac突变为ctg。
突变体phap/n30a的氨基酸序列为将序列1第30位的天门冬酰胺(asn)突变为丙氨酸(ala),突变体phap/n30a编码基因的核苷酸序列为将序列2第88位-90位的aac突变为gcc。
突变体phap/q38l的氨基酸序列为将序列1第38位的谷氨酰胺(gln)突变为亮氨酸(leu),突变体phap/q38l编码基因的核苷酸序列为将序列2第112位-114位的cag突变为ctg。
突变体phap/q38i的氨基酸序列为将序列1第38位的谷氨酰胺(gln)突变为异亮氨酸(iie),突变体phap/q38i编码基因的核苷酸序列为将序列2第112位-114位的cag突变为atc。
突变体phap/q38a的氨基酸序列为将序列1第38位的谷氨酰胺(gln)突变为丙氨酸(ala),突变体phap/q38a编码基因的核苷酸序列为将序列2第112位-114位的cag突变为gcc。
突变体phap/y45f的氨基酸序列为将序列1第45位的酪氨酸(tyr)突变为苯丙氨酸(phe),突变体phap/y45f编码基因的核苷酸序列为将序列2第133位-135位的tac突变为ttc。
突变体phap/y45a的氨基酸序列为将序列1第45位的酪氨酸(tyr)突变为丙氨酸(ala),突变体phap/y45a编码基因的核苷酸序列为将序列2第133位-135位的tac突变为gcc。
突变体phap/q52l的氨基酸序列为将序列1第52位的谷氨酰胺(gln)突变为亮氨酸(leu),突变体phap/q52l编码基因的核苷酸序列为将序列2第154位-156位的cag突变为ctg。
突变体phap/q52i的氨基酸序列为将序列1第52位的谷氨酰胺(gln)突变为异亮氨酸(iie),突变体phap/q52i编码基因的核苷酸序列为将序列2第154位-156位的cag突变为atc。
突变体phap/q52a的氨基酸序列为将序列1第52位的谷氨酰胺(gln)突变为丙氨酸(ala),突变体phap/q52a编码基因的核苷酸序列为将序列2第154位-156位的cag突变为gcc。
突变体phap/q72l的氨基酸序列为将序列1第72位的谷氨酰胺(gln)突变为亮氨酸(leu),突变体phap/q72l编码基因的核苷酸序列为将序列2第214位-216位的cag突变为ctg。
突变体phap/q72i的氨基酸序列为将序列1第72位的谷氨酰胺(gln)突变为异亮氨酸(iie),突变体phap/q72i编码基因的核苷酸序列为将序列2第214位-216位的cag突变为atc。
突变体phap/q72a的氨基酸序列为将序列1第72位的谷氨酰胺(gln)突变为丙氨酸(ala),突变体phap/q72a编码基因的核苷酸序列为将序列2第214位-216位的cag突变为gcc。
突变体phap/q82l的氨基酸序列为将序列1第82位的谷氨酰胺(gln)突变为亮氨酸(leu),突变体phap/q82l编码基因的核苷酸序列为将序列2第244位-246位的cag突变为ctg。
突变体phap/q82i的氨基酸序列为将序列1第82位的谷氨酰胺(gln)突变为异亮氨酸(iie),突变体phap/q82i编码基因的核苷酸序列为将序列2第244位-246位的cag突变为atc。
突变体phap/q82a的氨基酸序列为将序列1第82位的谷氨酰胺(gln)突变为丙氨酸(ala),突变体phap/q82a编码基因的核苷酸序列为将序列2第244位-246位的cag突变为gcc。
突变体phap/q38l-q52l的氨基酸序列为将序列1第38位的谷氨酰胺(gln)突变为亮氨酸(leu),且将序列1第52位的谷氨酰胺(gln)突变为亮氨酸(leu);突变体phap/q38l-q52l编码基因的核苷酸序列为将序列2第112位-114位的cag突变为ctg,且将第154位-156位的cag突变为ctg。
突变体phap/q38l-q72l的氨基酸序列为将序列1第38位的谷氨酰胺(gln)突变为亮氨酸(leu),且将序列1第72位的谷氨酰胺(gln)突变为亮氨酸(leu);突变体phap/q38l-q72l编码基因的核苷酸序列为将序列2第112位-114位的cag突变为ctg,且将第214位-216位的cag突变为ctg。
突变体phap/q38l-q82l的氨基酸序列为将序列1第38位的谷氨酰胺(gln)突变为亮氨酸(leu),且将序列1第82位的谷氨酰胺(gln)突变为亮氨酸(leu);突变体phap/q38l-q82l编码基因的核苷酸序列为将序列2第112位-114位的cag突变为ctg,且将第244位-246位的cag突变为ctg。
突变体phap/q52l-q72l的氨基酸序列为将序列1第52位的谷氨酰胺(gln)突变为亮氨酸(leu),且将序列1第72位的谷氨酰胺(gln)突变为亮氨酸(leu);突变体phap/q52l-q72l编码基因的核苷酸序列为将序列2第154位-156位的cag突变为ctg,且将第214位-216位的cag突变为ctg。
突变体phap/q38l-q52l-q72l的氨基酸序列为将序列1第38位的谷氨酰胺(gln)突变为亮氨酸(leu),且将序列1第52位的谷氨酰胺(gln)突变为亮氨酸(leu),且将序列1第72位的谷氨酰胺(gln)突变为亮氨酸(leu);突变体phap/q38l-q52l-q72l编码基因的核苷酸序列为将序列2第112位-114位的cag突变为ctg,且将第154位-156位的cag突变为ctg,且将第214位-216位的cag突变为ctg。
1、表达突变体蛋白的重组载体的制备
表达不同突变体蛋白的重组载体为将不同突变体蛋白编码基因替换pgex-6p-1载体((vt1258,优宝生物))的bamhi以及xhoi酶切位点间的片段,得到的载体,不同突变体蛋白与载体上的gst标签共同表达不同突变体蛋白。
表达不同突变体蛋白的重组载体的制备方法具体如下:
分别以pgex-6p-1-phap作为模板,用表1所示的突变体引物分别进行pcr,获得表达不同突变体蛋白的重组载体:pgex-6p-1-phap/y23f、pgex-6p-1-phap/y23a、pgex-6p-1-phap/n24l、pgex-6p-1-phap/n24a、pgex-6p-1-phap/n30l、pgex-6p-1-phap/n30a、pgex-6p-1-phap/q38l、pgex-6p-1-phap/q38i、pgex-6p-1-phap/q38a、pgex-6p-1-phap/y45f、pgex-6p-1-phap/y45a、pgex-6p-1-phap/q52l、pgex-6p-1-phap/q52i、pgex-6p-1-phap/q52a、pgex-6p-1-phap/q72l、pgex-6p-1-phap/q72i、pgex-6p-1-phap/q72a、pgex-6p-1-phap/q82l、pgex-6p-1-phap/q82i、pgex-6p-1-phap/q82a、pgex-6p-1-phap/q38l-q52l、pgex-6p-1-phap/q38l-q72l、pgex-6p-1-phap/q38l-q82l、pgex-6p-1-phap/q52l-q72l、pgex-6p-1-phap/q38l-q52l-q72l。
2、突变体的表达和纯化
与上述一中的方法相同,不同的是将重组质粒pgex-6p-1-phap替换为上述1制备的表达不同突变体蛋白的重组载体,得到突变体phap/y23f、突变体phap/y23a、突变体phap/n24l、突变体phap/n24a、突变体phap/n30l、突变体phap/n30a、突变体phap/q38l、突变体phap/q38i、突变体phap/q38a、突变体phap/y45f、突变体phap/y45a、突变体phap/q52l、突变体phap/q52i、突变体phap/q52a、突变体phap/q72l、突变体phap/q72i、突变体phap/q72a、突变体phap/q82l、突变体phap/q82i、突变体phap/q82a、突变体phap/q38l-q52l、突变体phap/q38l-q72l、突变体phap/q38l-q82l、突变体phap/q52l-q72l、突变体phap/q38l-q52l-q72l。
表1为突变体引物
表1所示为单点突变的引物,多点突变的方法同单点突变,即利用突变引物在已经突变过的载体上引入其他突变位点。
实施例2、phap以及其突变体在乳化大豆油的能力
实施例1制备的蛋白phap以及不同突变体蛋白配置成相同浓度的水溶液(50μg/ml);油相为大豆油(金龙鱼牌)。
具体操作如下:
1、待测物质水溶液的制备:将实施例1制备的蛋白phap以及不同突变体蛋白分别配置成相同浓度的水溶液(50μg/ml)。
2、以大豆油为油相,将等体积(待测物质水溶液和油相均为0.5ml)的待测物质水溶液和大豆油在20℃混合进行乳化处理,乳化处理采用涡旋振荡器振荡处理,涡旋振荡器振荡处理采用涡旋振荡器(xh-c,金怡,金坛市医疗仪器厂)以1300转每秒的速度振荡120秒进行处理。乳化处理完成在避光25℃恒温下静置,静置2天拍照观察并记录油层、乳化层和水层的高度。并通过公式(1)计算得到相关的乳化值。同时以超纯水作为对照。
乳化值计算公式如下:
乳化值=乳化层/(油层+乳化层+水层)×100%(1)
其中,所有层总高是指油层、乳化层和水层三层的总高度。但有时水层或油层在乳化后可能消失,则总高为余下两层(layers)的高度之和。乳化值越大,说明乳化能力越强。
乳化实验均设三次重复,乳化值以平均值±标准差表示。
结果如表2所示,可见静置2天,经过结构分析得到的定点突变均在不同程度提高了蛋白phap的乳化性,其中突变体phap/q38l、phap/q52l、phap/q72l、phap/q82l、phap/q38l-q52l、phap/q38l-q72l、phap/q38l-q82l、phap/q38l-q52l-q72l这几种突变有明显的提高。
另外本实验提高phap以及其突变体蛋白水溶液浓度至150μg/ml,发现突变体与野生型的乳化能力基本相同(表3),该结果表明经过突变后的蛋白在低浓度时乳化性强于野生型,即达到相同乳化效果需要较少的用量。
表2phap以及其突变体蛋白水溶液(50μg/ml)乳化大豆油的乳化层比较
表3phap以及其突变体蛋白水溶液(150μg/ml)乳化大豆油的乳化层比较
因此,phap突变体可作为乳化剂。
实施例3、phap以及其突变体蛋白熔点(tm)测量
将实施例1制备的蛋白phap以及不同突变体蛋白配置成相同浓度的水溶液(50μg/ml),检测远紫外圆二色性(cd)光谱。所用仪器为jasco715光谱仪,比色杯光程为1mm。分辨率0.2nm,带宽2nm,扫描速度200nm/min,响应速度1秒,光电倍增管电压仪器自控,检测波长范围200nm-260nm,重复次数3次。取cd谱220nm处的强度对温度作图可得出蛋白质二级结构随温度变化。蛋白浓度为0.1mg/ml。之后利用s形曲线拟合cd获得的变温曲线,并利用公式2计算曲线拐点x0
y=ab+((at-ab)/(1+exp((x0-x)/w)))(2)
x0对应的y值为(ab+at)/2
ab为曲线下切线对应的y值
at为曲线上切线对应的y值
将拐点x0对应的温度蛋白发生二级结构明显改变,将该点对应的温度视为蛋白tm值
经过变温测试,获得如下结果(表4),经过突变后的蛋白tm值均有提高,特别的q38l,q38lq52l,q38lq72l,q38lq82l,q38lq52lq72l这几种突变tm值提高将近20℃。
该结果说明,phap突变体蛋白具有更高的热稳定性。
表4phap以及其突变体蛋白对应熔点tm值比较
实施例4、phap以及其突变体蛋白对于水溶液界面表面张力的影响
表面活性剂分子由于疏水作用,疏水基团靠在一起形成疏水内核,亲水基朝外与水接触,在水溶液内发生自组装形成各种结构、大小的聚集体。添加表面活性剂可以降低水溶液界面表面的张力。
使用的jz-200a界面张力仪采用达因环法测量溶液的表面张力值,将p实施例1制备的蛋白phap以及不同突变体蛋白配置成相同浓度的水溶液(10mg/l),测量该浓度下其表面张力值(表5)。发现突变体蛋白相对于野生型对于溶液表面张力降低的能力均有提高,其中突变体phap/q38l、突变体phap/q72l、突变体phap/q82l、突变体phap/q38lq52l、突变体phap/q38lq72l、突变体phap/q38lq82l、突变体phap/q38lq52lq72l这几种突变有更明显的效果。在相同浓度下(10mg/l),突变体相对于野生型可以降低更多的表面张力,具有更好的应用前景。
表5phap以及其突变体蛋白溶液(10mg/l)表面张力值
- 还没有人留言评论。精彩留言会获得点赞!