一种减少和/或去除多肽固相合成中缺省肽的方法与流程
本发明涉及多肽合成领域,特别涉及一种减少和/或去除多肽固相合成中缺省肽的方法。
背景技术:
:固相多肽合成中,一些多肽由于有困难序列的存在,反应不完全,容易形成缺省肽(非目的肽)杂质。有一些缺省肽杂质的性质和产品本身十分接近,现有的分离技术对其几乎没有分离效果。fmoc固相合成方法中,缺省肽的产生主要是因为肽链的聚集,临时保护基fmoc脱除不完全或缩合反应不完全导致。对于fmoc脱除不完全,一般采用2%的dbu可以达到完全脱除的效果,但伴随着副反应的发生。对于缩合反应不完全,采用假脯氨酸有较好的效果,但假脯氨酸价格昂贵,且需要有丝氨酸和苏氨酸时才可以使用,不具有通用性。另外,缺省肽杂质的产生一般是fmoc脱除不完全和缩合反应不完全同时作用的结果,单种方法并不能完全解决氨基酸缺省的问题。glp-1类化合物中存在两个二级结构区域,分子内的相互作用使得肽链发生聚集,反应在这两个区域很难进行,容易产生多种缺省肽杂质。作为glp-1类似物的利拉鲁肽,在采用fmoc固相方法进行制备时,产生的ala2缺省杂质和thr5缺省杂质在色谱上离主峰很近,现有的hplc纯化方法无法将它们有效去除。技术实现要素:有鉴于此,本发明提供一种减少和/或去除多肽固相合成中缺省肽的方法。该方法采用包含缺省氨基酸和其之前氨基酸(c-n)的全保护肽片段进行多肽的固相合成,同时解决了fmoc脱除不完全和缩合反应不完全导致的氨基酸缺省,可以在合成阶段将缺省肽杂质降低到质控限度以下。具体表现为可将利 拉鲁肽中ala2缺省杂质和thr5缺省杂质分别由原来的1%以上降低到不能检出和0.15%以下,并能将奈西利肽中ser19缺省肽杂质降低到未检出。为了实现上述发明目的,本发明提供以下技术方案:本发明提供了缺省氨基酸与紧邻所述缺省氨基酸并靠近c端的氨基酸组成的肽段在减少和/或去除多肽固相合成中缺省肽的用途。在本发明的一些具体实施方案中,所述紧邻缺省氨基酸并靠近c端的氨基酸的数量至少为1个。在本发明的一些具体实施方案中,所述缺省肽占所述多肽的质量百分含量不高于0.15%。在本发明的一些具体实施方案中,所述多肽为利拉鲁肽,所述缺省氨基酸为ala2、thr5。在本发明的一些具体实施方案中,所述肽段为全保护肽段。本发明还提供了一种减少和/或去除多肽固相合成中缺省肽的方法,采用包含缺省氨基酸与紧邻所述缺省氨基酸并靠近c端的氨基酸进行固相合成。在本发明的一些具体实施方案中,固相合成方法中所述紧邻缺省氨基酸并靠近c端的氨基酸的数量至少为1个。在本发明的一些具体实施方案中,固相合成方法中所述缺省肽占所述多肽的质量百分含量不高于0.15%。在本发明的一些具体实施方案中,固相合成方法中所述多肽为利拉鲁肽,所述缺省氨基酸为ala2、thr5;或所述多肽为奈西利肽,所述缺省氨基酸为ser19;所述肽段为全保护肽段。本发明还提供了一种减少和/或去除多肽固相合成中缺省肽的方法,所述多肽为利拉鲁肽,包括如下步骤:步骤1:将wangresin和fmoc-gly-oh反应制备fmoc-gly-wangresin;步骤2:按利拉鲁肽序列,依次连接fmoc-arg(pbf)-oh、fmoc-gly-oh、fmoc-arg(pbf)-oh、fmoc-val-oh、fmoc-leu-oh、fmoc-trp(boc)-oh、fmoc-ala-oh、fmoc-ile-oh、fmoc-phe-oh、fmoc-glu(otbu)-oh、fmoc-lys(alloc)-oh、fmoc-ala-oh、fmoc-ala-oh、fmoc-gln(trt)-oh、fmoc-gly-oh、fmoc-glu(otbu)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、 fmoc-ser(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-val-oh、fmoc-asp(otbu)-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-thr(tbu)-phe-oh、fmoc-gly-oh、fmoc-ala-glu(otbu)-oh、boc-his(trt)-oh、fmoc-glu-otbu和棕榈酸,得到利拉鲁肽肽树脂;步骤3:裂解利拉鲁肽肽树脂,得到利拉鲁肽粗品;步骤4:hplc纯化所述利拉鲁肽粗品,得到利拉鲁肽纯品;所述多肽为奈西利肽,包括如下步骤:步骤1:将2-ctc树脂和fmoc-his(trt)-oh反应制备fmoc-his(trt)-2-ctcresin;步骤2:按奈西利肽序列,依次连接fmoc-arg(pbf)-oh、fmoc-arg(pbf)-oh、fmoc-leu-oh、fmoc-val-oh、fmoc-lys(boc)-oh、fmoc-cys(trt)-oh、fmoc-gly-oh、fmoc-leu-oh、fmoc-ser(tbu)-ser(tbu)-ser(tbu)-ser(tbu)-gly-oh和fmoc-ile-oh、fmoc-arg(pbf)-oh、fmoc-asp(otbu)-oh、fmoc-met-oh、fmoc-lys(boc)-oh、fmoc-arg(pbf)-oh、fmoc-gly-oh、fmoc-gly-oh、fmoc-phe-oh、fmoc-cys(trt)-oh、fmoc-gly-oh、fmoc-ser(tbu)-oh、fmoc-gly-oh、fmoc-gln(trt)-oh、fmoc-val-oh、fmoc-met-oh、fmoc-lys(boc)-oh、fmoc-pro-oh和fmoc-ser(tbu)-oh,得到奈西利肽肽树脂;步骤3:裂解奈西利肽肽树脂,得到奈西利肽粗品;步骤4:hplc纯化奈西利肽粗品,得到奈西利肽纯品。本发明提供了缺省氨基酸与紧邻所述缺省氨基酸并靠近c端的氨基酸组成的肽段在减少和/或去除多肽固相合成中缺省肽的用途。本发明采用包含缺省氨基酸和其之前氨基酸(c-n)的全保护肽片段进行多肽的固相合成,同时解决了fmoc脱除不完全和缩合反应不完全导致的氨基酸缺省,可以在合成阶段将缺省肽杂质降低到质控限度以下。具体表现为可将利拉鲁肽中ala2缺省杂质和thr5缺省杂质分别由原来的1%以上降低到不能检出和0.15%以下,并能将奈西利肽中ser19缺省肽杂质降低到未检出。本发明采用缺省氨基酸有关全保护肽片段进行固相合成,不仅原料价廉易得,而且能有效降低缺省肽杂质,可以在所有多肽的合成中应用,具有广泛工业生产价值。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。图1示实施例3制得的利拉鲁肽粗品的hplc谱图;图2示对比例制得的利拉鲁肽粗品的hplc谱图;图3示实施例4制得的利拉鲁肽纯品的hplc谱图;图4示实施例9制得的奈西利肽纯品的hplc谱图;图5示对比例制得的利拉鲁肽纯品的hplc谱图。具体实施方式本发明公开了一种减少和/或去除多肽固相合成中缺省肽的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
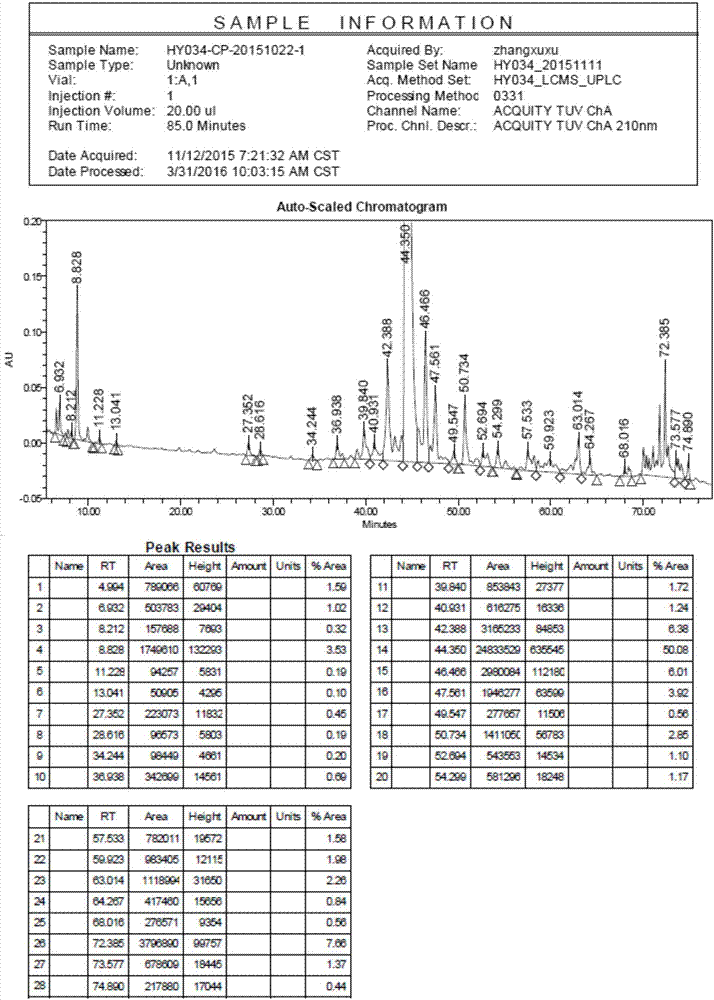
发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本发明提供了一种多肽合成中氨基酸缺省的解决方法,具体指glp-1化合物,特指利拉鲁肽,详细步骤如下:步骤1:将wangresin和fmoc-gly-oh反应制备fmoc-gly-wangresin;步骤2:按利拉鲁肽序列,依次连接fmoc-arg(pbf)-oh、fmoc-gly-oh、fmoc-arg(pbf)-oh、fmoc-val-oh、fmoc-leu-oh、fmoc-trp(boc)-oh、fmoc-ala-oh、fmoc-ile-oh、fmoc-phe-oh、fmoc-glu(otbu)-oh、fmoc-lys(alloc)-oh、fmoc-ala-oh、fmoc-ala-oh、fmoc-gln(trt)-oh、fmoc-gly-oh、fmoc-glu(otbu)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-val-oh、fmoc-asp(otbu)-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-thr(tbu)-phe-oh、fmoc-gly-oh、fmoc-ala-glu(otbu)-oh、boc-his(trt)-oh、fmoc-glu-otbu和棕榈酸,得到利拉鲁肽肽树脂;步骤3:裂解利拉鲁肽肽树脂,得到利拉鲁肽粗品;步骤4:hplc纯化利拉鲁肽粗品,得到利拉鲁肽纯品。奈西利肽的具体步骤如下:步骤1:将2-ctc树脂和fmoc-his(trt)-oh反应制备fmoc-his(trt)-2-ctcresin;步骤2:按奈西利肽序列,依次连接fmoc-arg(pbf)-oh、fmoc-arg(pbf)-oh、fmoc-leu-oh、fmoc-val-oh、fmoc-lys(boc)-oh、fmoc-cys(trt)-oh、fmoc-gly-oh、fmoc-leu-oh、fmoc-ser(tbu)-ser(tbu)-ser(tbu)-ser(tbu)-gly-oh和fmoc-ile-oh、fmoc-arg(pbf)-oh、fmoc-asp(otbu)-oh、fmoc-met-oh、fmoc-lys(boc)-oh、fmoc-arg(pbf)-oh、fmoc-gly-oh、fmoc-gly-oh、fmoc-phe-oh、fmoc-cys(trt)-oh、fmoc-gly-oh、fmoc-ser(tbu)-oh、fmoc-gly-oh、fmoc-gln(trt)-oh、fmoc-val-oh、fmoc-met-oh、fmoc-lys(boc)-oh、fmoc-pro-oh和fmoc-ser(tbu)-oh,得到奈西利肽肽树脂;步骤3:裂解奈西利肽肽树脂,得到奈西利肽粗品;步骤4:hplc纯化奈西利肽粗品,得到奈西利肽纯品。本发明提供了缺省氨基酸与紧邻所述缺省氨基酸并靠近c端的氨基酸组成的肽段在减少和/或去除多肽固相合成中缺省肽的用途。本发明采用包含缺省氨基酸和其之前氨基酸(c-n)的全保护肽片段进行多肽的固相合成,同时解决了fmoc脱除不完全和缩合反应不完全导致的氨基酸缺省,可以在合成阶段将缺省肽杂质降低到质控限度以下。具体表现为可将利拉鲁肽中ala2缺省杂质和thr5缺省杂质分别由原来的1%以上降低到不能检出和0.15%以下,并能将奈西利肽中ser19缺省肽杂质降低到未检出。1、本发明首先欲保护的一种解决氨基酸缺省的方法,具体描述为采用包含缺省氨基酸和其之前氨基酸的全保护肽片段进行固相合成;2、本发明方法主要应用在利拉鲁肽中ala2和thr5缺省杂质的去除,本发明欲保护所有针对这两个杂质的制备方法;或奈西利肽中ser19缺省肽杂质的去除。3、本发明所述方法具有通用性,尤其是该方法在利拉鲁肽和奈西利肽中的应用。本发明提供了一种减少和/或去除多肽固相合成中缺省肽的方法中所用原料及试剂均可由市场购得。本发明所涉及的缩写及英文含义请见表1:表1本发明所涉及的缩写及英文含义缩写及英文含义dicn,n'-二异丙基碳二亚胺dcm二氯甲烷et2o无水乙醚meoh甲醇dmap4-二甲氨基吡啶hobt1-羟基苯并三唑tfa三氟乙酸edt1,2-乙二硫醇dmfn,n-二甲基甲酰胺phenol苯酚20%dblk20%六氢吡啶(v)/n,n-二甲基甲酰胺(v)dbu1,8-二氮杂双环[5.4.0]十一碳-7-烯下面结合实施例,进一步阐述本发明:实施例1fmoc-gly-wangresin的制备称取40g替代度为0.75mmol/g的wangresin加入到固相反应柱中,dmf洗涤2次,dmf溶胀30min,dmf洗涤2次,将fmoc-gly-oh(13.38g,45mmol)和hobt(6.38g,47.3mmol)溶解于dmf中,冰浴10min后加入dic(5.95g,47.3mmol)活化3~5min后加入反应柱,同时加入dmap(0.55g,4.5mmol),氮气搅拌反应2h,抽干反应液,dmf洗涤4次,dcm洗涤3次,加入乙酸酐(61.2g,600mmol)和吡啶(47.5g,600mmol)的dcm溶液封闭8h,抽掉封闭液,dmf洗涤6次,dcm洗涤2次,meoh收缩,干燥,得到43.6gfmoc-gly-wangresin,替代度0.32mmol/g。实施例2利拉鲁肽肽树脂的合成称取31.3g替代度为0.32mmol/g的fmoc-gly-wangresin加入到固相反应柱中,dmf洗涤2次,dmf溶胀30min,dmf洗涤2次,将fmoc-arg(pbf)-oh(19.46g,30mmol)和hobt(4.26g,31.5mmol)溶解于dmf中,冰浴10min,加入dic(3.97g,31.5mmol)活化3~5min后加入到固相反应柱中,氮气搅拌反应2h,茚三酮检测反应完全,抽掉反应液,dmf洗涤3次,20%dblk脱保护(5+7min),dmf洗涤6次;将fmoc-gly-oh(8.92g,30mmol)和hobt(4.26g,31.5mmol)溶解于dmf中,冰浴10min,加入dic(3.97g,31.5mmol)活化3~5min后加入到固相反应柱中,氮气搅拌反应2h,茚三酮检测反应完全,抽掉反应液,dmf洗涤3次,20%dblk脱保护(5+7min),dmf洗涤6次;按上述步骤依次连接fmoc-arg(pbf)-oh、fmoc-val-oh、fmoc-leu-oh、fmoc-trp(boc)-oh、fmoc-ala-oh、fmoc-ile-oh、fmoc-phe-oh、fmoc-glu(otbu)-oh、fmoc-lys(alloc)-oh、fmoc-ala-oh、fmoc-ala-oh、fmoc-gln(trt)-oh、fmoc-gly-oh、fmoc-glu(otbu)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-val-oh、fmoc-asp(otbu)-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-thr(tbu)-phe-oh、fmoc-gly-oh、fmoc-ala-glu(otbu)-oh、boc-his(trt)-oh、fmoc-glu-otbu和棕榈酸,得到86.2g利拉鲁肽肽树脂。实施例3利拉鲁肽肽树脂裂解将86.2g利拉鲁肽肽树脂转移至1000ml单口圆底烧瓶中,加入860ml冰冻2h的裂解液(tfa:phenol:h2o:edt=87.5:5:5:2.5),室温搅拌反应2h,过滤,滤液加入到8.6l冰冻无水乙醚中,离心、洗涤、干燥后得到37.3g粗肽,收率:99.5%,纯度:53.79%,见图1。实施例4利拉鲁肽纯品的制备1.样品处理:将固体粗肽用10%乙腈/90%水(v/v),超声使样品完全溶解后用滤膜过滤,收集滤液备用。2.hplc纯化:纯化条件:色谱柱:以八烷基硅烷键合硅胶为固定相的色谱柱,柱子直径和长度为:50mm×250mm。流动相:a相:0.1%三氟乙酸85%水/15%异丙醇溶液水溶液;b相:0.1%三氟醋酸的乙腈,流速:50-80ml/min,梯度:40%b—60%b,检测波长:275nm。进样量为3g。纯化过程:将色谱柱用50%以上的乙腈冲洗干净后平衡上样,上样量为1.5-3g。线性梯度洗脱40min,收集目的峰,得到纯度大于95%以上馏分,将收集的目的峰馏分于水温不超过35℃的条件下减压旋蒸浓缩至约10-30mg/ml后作第二步纯化样品。3.第二步hplc纯化:纯化条件:色谱柱:以八烷基硅烷键合硅胶为固定相的色谱柱,柱子直径和长度为:50mm×250mm。流动相:0.15%高氯酸水溶液为a相,0.15%高氯酸的乙腈溶液为b相,梯度:40%b—70%b,检测波长:275nm。进样量为1.8g。纯化过程:将色谱柱用50%以上的乙腈冲洗干净平衡后将第一步纯化馏分上样,上样量为1.9g。线性梯度洗脱40min,收集目的峰,得到纯度大于97%以上馏分,将收集的目的峰馏分于水温不超过35℃的条件下减压旋蒸浓缩至约15-25mg/ml后作第三步脱盐纯化样品。4.第三步hplc脱盐纯化:色谱柱:以八烷基硅烷键合硅胶为固定相的色谱柱,柱子直径和长度为:50mm×250mm。0.01%氨水的水溶液为a相,色谱纯乙腈为b相,梯度:30%b—60%b,检测波长:275nm。进样量为1.2g。纯化过程:将色谱柱用50%以上的乙腈冲洗干净平衡后将第二步纯化馏分上样,上样量为1.3g。线性梯度洗脱30min,收集目的峰,得到纯度大于98%以上馏分,将收集的目的峰馏分于水温不超过35℃的条件下减压旋蒸浓缩至约65mg/ml后进行冷冻干燥,即可得到0.76g纯度99.65%的利拉鲁肽精肽,总收率25.3%,见图3。实施例5fmoc-his(trt)-2-ctcresin的制备称取60g替代度为0.5mmol/g的2-ctcresin加入到固相反应柱中,dmf洗涤2次,dmf溶胀30min,dmf洗涤2次,将fmoc-his(trt)-oh(74.4g, 120mmol)溶解于dmf中,冰浴5min后加入dipea(30.96g,240mmol)活化3~5min后加入反应柱,氮气搅拌反应1h,向反应液中加入meoh(19.2g,600mmol),继续氮气搅拌反应20min,抽干反应液,dmf洗涤4次,dcm洗涤3次,meoh收缩,干燥,得到66gfmoc-his(trt)-2-ctcresin,替代度0.28mmol/g。实施例6奈西利肽肽树脂的合成称取34.7g替代度为0.28mmol/g的fmoc-his(trt)-2-ctcresin加入到固相反应柱中,dmf洗涤2次,dmf溶胀30min,dmf洗涤2次,将fmoc-arg(pbf)-oh(19.46g,30mmol)、pybop(15.6g,30mmol)和hobt(4.26g,31.5mmol)溶解于dmf中,冰浴10min,加入dipea(7.74g,60mmol)活化3~5min后加入到固相反应柱中,氮气搅拌反应2h,茚三酮检测反应完全,抽掉反应液,dmf洗涤3次,20%dblk脱保护(5+7min),dmf洗涤6次;将fmoc-arg(pbf)-oh(19.46g,30mmol)、pybop(15.6g,30mmol)和hobt(4.26g,31.5mmol)溶解于dmf中,冰浴10min,加入dipea(7.74g,60mmol)活化3~5min后加入到固相反应柱中,氮气搅拌反应2h,茚三酮检测反应完全,抽掉反应液,dmf洗涤3次,20%dblk脱保护(5+7min),dmf洗涤6次;按上述步骤依次连接fmoc-leu-oh、fmoc-val-oh、fmoc-lys(boc)-oh、fmoc-cys(trt)-oh、fmoc-gly-oh、fmoc-leu-oh、fmoc-ser(tbu)-ser(tbu)-ser(tbu)-ser(tbu)-gly-oh和fmoc-ile-oh、fmoc-arg(pbf)-oh、fmoc-asp(otbu)-oh、fmoc-met-oh、fmoc-lys(boc)-oh、fmoc-arg(pbf)-oh、fmoc-gly-oh、fmoc-gly-oh、fmoc-phe-oh、fmoc-cys(trt)-oh、fmoc-gly-oh、fmoc-ser(tbu)-oh、fmoc-gly-oh、fmoc-gln(trt)-oh、fmoc-val-oh、fmoc-met-oh、fmoc-lys(boc)-oh、fmoc-pro-oh和fmoc-ser(tbu)-oh,得到61g奈西利肽肽 树脂。实施例7奈西利肽肽树脂裂解将61g利拉鲁肽肽树脂转移至1000ml单口圆底烧瓶中,加入610ml冰冻2h的裂解液(tfa:phenol:phsme:h2o:edt=82.5:5:5:5:2.5),室温搅拌反应2h,过滤,滤液加入到:6.1l冰冻无水乙醚中,离心、洗涤、干燥后得到25.3g线性肽,收率:99.5%,纯度:73.1%。实施例8奈西利肽线性肽氧化称取25.3g线性肽,按8-10mg/ml的比例配置反应液[纯化水和乙腈的混合溶液中(1:1=v:v)]。线性肽充分研磨后,缓慢加入反应液中,边加边搅拌,直到完全溶解,用25%氨水将反应溶液ph值调到8.1-8.4,通入氧气,搅拌反应4h,hplc显示氧化完全,停止反应,用tfa调ph至3.0~3.5。实施例9奈西利肽纯品的制备1.样品处理:将实施例8中氧化好的粗肽溶液减压旋蒸浓缩,去除溶液中的大部分乙腈,即旋蒸后体积为旋蒸前体积的50%—60%。0.45μm微孔滤膜过滤,滤液合并。2.hplc纯化:纯化条件:色谱柱:以十八烷基硅烷键合硅胶为固定相的色谱柱,柱子直径和长度为:50mm×250mm。流动相:a相:0.2%硫酸溶液,氨水调节ph至3.0;b相:乙腈,流速:50-80ml/min,梯度:10%b—30%b,检测波长:230nm。进样量为3g。纯化过程:将色谱柱用50%以上的乙腈冲洗干净后平衡上样,上样量为1.5-3g。线性梯度洗脱60min,收集目的峰,得到纯度大于95%以上馏分,将收集的目的峰馏分于水温不超过32℃的条件下减压旋蒸浓缩至约10-30mg/ml 后作第二步纯化样品。3.第二步hplc纯化:纯化条件:色谱柱:以十八烷基硅烷键合硅胶为固定相的色谱柱,柱子直径和长度为:50mm×250mm。流动相:0.2%磷酸溶液(用氨水调节ph至6.5)做为a相,乙腈溶液为b相,梯度:10%b—30%b,检测波长:230nm。进样量为1.8g。纯化过程:将色谱柱用50%以上的乙腈冲洗干净平衡后将第一步纯化馏分上样,上样量为1.9g。线性梯度洗脱60min,收集目的峰,得到纯度大于97%以上馏分,将收集的目的峰馏分于水温不超过32℃的条件下减压旋蒸浓缩至约15-25mg/ml后作第三步脱盐纯化样品。4.第三步hplc脱盐纯化:色谱柱:以十八烷基硅烷键合硅胶为固定相的色谱柱,柱子直径和长度为:50mm×250mm。0.2%醋酸铵溶液为a相,色谱纯乙腈为b相,梯度:30%b—60%b,检测波长:275nm。进样量为1.2g。纯化过程:将色谱柱用50%以上的乙腈冲洗干净平衡后将第二步纯化馏分上样,上样量为1.3g。线性梯度洗脱30min,收集目的峰,得到纯度大于98%以上馏分,将收集的目的峰馏分于水温不超过35℃的条件下减压旋蒸浓缩至约65mg/ml后进行冷冻干燥,即可得到0.76g纯度大于98.5%的活性药物奈西利肽,总收率25.3%,见图4。对比例利拉鲁肽合成称取6.25g替代度为0.32mmol/g的fmoc-gly-wangresin加入到固相反应柱中,dmf洗涤2次,dmf溶胀30min,dmf洗涤2次,将fmoc-arg(pbf)-oh(3.89g,6mmol)和hobt(0.85g,6.3mmol)溶解于dmf中,冰浴10min,加入dic(0.79g,6.3mmol)活化3~5min后加入到固相反应柱中,氮气搅拌反应2h,茚三酮检测反应完全,抽掉反应液,dmf洗涤3次,20%dblk脱 保护(5+7min),dmf洗涤6次;将fmoc-gly-oh(1.78g,6mmol)和hobt(0.85g,6.3mmol)溶解于dmf中,冰浴10min,加入dic(0.79g,6.3mmol)活化3~5min后加入到固相反应柱中,氮气搅拌反应2h,茚三酮检测反应完全,抽掉反应液,dmf洗涤3次,20%dblk脱保护(5+7min),dmf洗涤6次;按上述步骤依次连接fmoc-arg(pbf)-oh、fmoc-val-oh、fmoc-leu-oh、fmoc-trp(boc)-oh、fmoc-ala-oh、fmoc-ile-oh、fmoc-phe-oh、fmoc-glu(otbu)-oh、fmoc-lys(alloc)-oh、fmoc-ala-oh、fmoc-ala-oh、fmoc-gln(trt)-oh、fmoc-gly-oh、fmoc-glu(otbu)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-ser(tbu)-oh、fmoc-val-oh、fmoc-asp(otbu)-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-thr(tbu)-phe-oh、fmoc-gly-oh、fmoc-glu(otbu)-oh、fmoc-ala-oh、boc-his(trt)oh、fmoc-glu-otbu和棕榈酸,得到16.9g利拉鲁肽肽树脂。按实施例3方法将利拉鲁肽肽树脂裂解,得到利拉鲁肽粗肽7.3g,收率:97.3%,纯度:50.08%,谱图见图2。将得到的利拉鲁肽粗肽按实施例4的方法进行纯化,得到0.70g纯度97.74%的利拉鲁肽精肽,总收率23.3%,见图5。与实施例3和实施例4制得的利拉鲁肽比较,结果见表2:表2对比例与实施例制得的利拉鲁肽的比较结果实施例3和对比例相比,采用本发明所述方法得到的粗肽,无论是纯度还是缺省肽杂质均显著(p<0.05)优于对比方法,另外,采用相同的方法对粗肽进行纯化,实施例4得到的精肽无论是纯度还是缺省肽杂质均显著优于对比例得到的精肽。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1