齐口裂腹鱼HSP90基因的cDNA全长序列及其用途的制作方法
本发明属于生物
技术领域:
,具体涉及一种齐口裂腹鱼HSP90基因的cDNA全长序列及其用途。
背景技术:
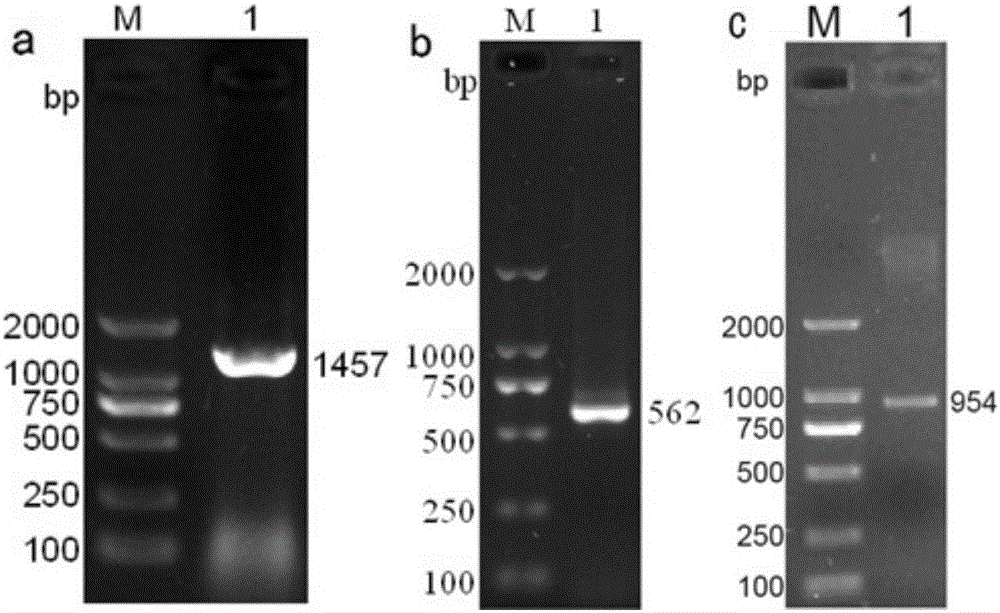
:齐口裂腹鱼(Schizothoraxprenanti)俗称雅鱼,是雅安三绝之一,属于鲤形目、鲤科、裂腹鱼亚科、裂腹鱼属鱼类,分布于长江上游、大渡河、岷江、青衣江、金沙江及乌江下游等水域。齐口裂腹鱼具有肉质细嫩、味道鲜美、营养价值丰富的特点,是我国名特优水产养殖鱼类,备受消费者青睐。近10多年来,该鱼作为一种新兴的水产养殖种类,在四川、贵州和重庆等快速发展,并逐渐形成具有地方优势特色的产业。但随着齐口裂腹鱼养殖规模与养殖密度的不断提高,细菌性疾病的发生日益严重,给齐口裂腹鱼养殖业带来巨大的经济损失。尤其是近年来在主要养殖区流行的由无乳链球菌感染引起的齐口裂腹鱼爆发性传染病,以突眼、体表出血和神经症状为临床特征,具有发病率和死亡率高的特点。2013年8月,四川雅安养殖场爆发了无乳链球菌病,发病率高达50%,病死率达100%,给养殖户造成极为严重的损害。目前,临床上检测齐口裂腹鱼感染无乳链球菌的方法,主要依靠对患病样品中病原微生物学分离、培养和生化试验等进行鉴定,但这种方法是在已明确发现齐口裂腹鱼细菌感染时进行,不利于病情控制。控制齐口裂腹鱼感染无乳链球菌最好的办法是预防和早期诊断,做到早发现、早隔离、早治疗,防止无乳链球菌病蔓延,促进齐口裂腹鱼健康养殖。热休克蛋白(HeatShockProtein,HSP)又名热应激蛋白,是机体在应激情况下细胞内迅速合成的一组蛋白质,在机体遭受热应激、低氧胁迫、重金属和微生物感染等胁迫中能快速作出响应,普遍存在于整个生物界。Hsp90是已知HSP家族中的一个重要成员,作为分子伴侣广泛参与细胞的发育、生长和分化。在鱼类中Hsp90的研究起步较晚,目前的研究主要集中在温度和缺氧、重金属胁迫等物理化学因素对Hsp90的应激方面。目前未见齐口裂腹鱼HSP90基因的报道,更未见齐口裂腹鱼HSP90与病原体感染相关的报道。技术实现要素:本发明的目的在于提供一种齐口裂腹鱼HSP90基因的cDNA全长序列及其用途。本发明提供了一种如SEQIDNO:1所示的核苷酸序列。本发明还提供了一种如SEQIDNO:2所示的核苷酸序列。本发明提供了一种齐口裂腹鱼HSP90蛋白,它是由SEQIDNO:1或SEQIDNO:2所示的核苷酸序列编码。其中,它的氨基酸序列如SEQIDNO:3所示。本发明还提供了上述核苷酸序列、上述蛋白在制备检测齐口裂腹鱼细菌感染的试剂中的用途。其中,所述试剂为检测齐口裂腹鱼血液、肝胰脏、中肾和/或脾脏的Hsp90核苷酸表达水平的试剂。其中,所述细菌感染为无乳链球菌感染。本发明还提供了一种检测齐口裂腹鱼细菌感染的试剂盒,它包含用来扩增SEQIDNO:1或SEQIDNO:2所示核苷酸序列的试剂。其中,所述试剂包含序列如SEQIDNO:4-5所示的引物对。其中,所述试剂为检测齐口裂腹鱼血液、肝胰脏、中肾和/或脾脏的Hsp90核苷酸表达水平的试剂;其中,所述细菌感染为无乳链球菌感染。本发明人克隆得到了齐口裂腹鱼Hsp90的cDNA全序列,并且发现齐口裂腹鱼Hsp90的表达水平与齐口裂腹鱼是否受细菌感染相关:例如齐口裂腹鱼在受细菌感染后,中肾的Hsp90表达量一直显著提高;细菌感染的急性期和早期,血液和肝胰脏的Hsp90表达量均显著提高,随后表达量下降。综上,本发明发现Hsp90可作为诊断细菌感染的靶标,用于制备细菌感染的检测试剂,尤其是无乳链球菌感染。本发明包含检测齐口裂腹鱼Hsp90的表达水平的试剂盒,可用于早期监控和检测齐口裂腹鱼细菌感染,实施早期预防和诊断,减少对齐口裂腹鱼造成的损害,临床应用前景良好。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1为总RNA凝胶电泳图,其中,1、2泳道为鳃,3泳道为脾脏,4、5泳道为中肾。图2为SpHsp90基因扩增图,其中,图2a为保守区域扩增图,图2b为5’端扩增图,图2c为3’端扩增图;泳道M:2000DNAMarker,泳道1:扩增产物。图3为SpHsp90全长cDNA序列及预测氨基酸序列图,其中,单横线表示单横线表示HSP90家族的典型模序,虚线表示C末端MEEVD模序,黑色方框表示多聚腺苷酸化信号序列(ATTAAA),星号(*)表示终止密码子。图4为SpHsp90的组织分布图,其中,Sk:皮肤,Mu:肌肉,In:肠,Tk:中肾,Sp:脾脏,Br:脑,He:心脏,Gi:鳃,Bl:血液,Hep:肝胰脏。a-f表示表达量显著性变化(*P<0.05),实验结果是通过β-actin和18SrRNA作为内参进行校准,校准数据经过最大值归一处理,误差线表示标准误(n=5尾/组)。图5为SpHsp90mRNA在齐口裂腹鱼组织中的表达量变化图,其中,○表示感染组,■表示对照组,*表示在同一时间点实验组与对照组的表达量有显著性差异(P<0.05)。实验结果是通过β-actin和18SrRNA作为内参进行校准,每个组织的校准数据单独进行最大值归一处理,误差线表示标准误(n=8尾/组)。具体实施方式下面以实施例作进一步说明,但本发明不局限于这些实施例。实施例1齐口裂腹鱼Hsp90基因的cDNA克隆一、试验材料1、菌体/载体大肠杆菌(Escherichiacoli,E.coli)DH5α感受态细胞(购自于天根生化科技有限公司,北京,中国);pMD19-T(购于宝生物工程公司,大连,中国)。2、试验动物健康齐口裂腹鱼购于四川润兆渔业有限公司。3、主要试剂(1)Sanprep柱式质粒DNA小量抽提试剂盒、Sanprep柱式DNA胶回收试剂盒、样品RNA/DNA保护剂、RNAisoPlus裂解液、PrimeScriptTMReagentKit(PerfectRealTime)cat#RR037A(购于宝生物工程公司,大连,中国)。(2)2×TaqMasterMix、Goldview、琼脂糖、DNAMarker(DL2000、DL1000DNAMarker)(购自于天根生化科技有限公司,北京,中国)。(3)SMARTTMRACEcDNAAmplificationKit(购于BDBiosciencesClontech,PaloAlto,CA,USA)4、主要仪器WaterProPlus超纯水仪(LABCONCO公司);Mis-3780型全自动高压灭菌锅(Sanyo公司);Allegra21R型高速冷冻离心机(Thermo公司);C1000ThermalCyclerPCR扩增仪(Bio-Rad公司);GelDoc2000凝胶成像分析系统(Bio-Rad公司);核酸检测仪(Bio-Rad公司);Mini-SUB凝胶电泳装置(Bio-Rad公司);725型超低温冰箱(Thermo公司)。5、主要试剂配置(1)培养基配置普通液体培养基(LB)见大连宝生物产品说明书附录,121℃灭菌30min;氨苄青霉素(Ampicillon,Amp)(100mg/mL)储备液见大连宝生物产品目录;Amp-LB琼脂培养基配置:在LB液体培养基中添加2.5%~3.0%的琼脂粉,调节pH值至7.0~7.2,121℃灭菌30min。待冷却至50℃~60℃后添加Amp(100mg/mL)储备液使其终浓度达到100μg/mL。(2)其他试剂配置5×TBE电泳缓冲液(储备液)、1×TBE电泳缓冲液(工作液)见大连宝生物产品目录;1%琼脂糖凝胶:450mL双蒸水中加入50mL5×TBE电泳缓冲液,配置成1×TBE电泳缓冲液,取100mL缓冲液加入1.0g琼脂糖融化。磷酸缓冲液(PhosphateBufferSaline,PBS):NaCl8.0g,KH2PO40.2g,Na2HPO42.9g,KCl0.2g,双蒸水1000mL,调pH至7.4。二、试验方法1、样品采集将健康齐口裂腹鱼用(45±3g)MS-222(0.1g/L)麻醉后,快速解剖取出鳃、脾脏、中肾,混合放入装有1mL样品RNA/DNA保护剂的1.5mL无菌EP管,-80℃冰箱冻存备用。2、组织总RNA的提取和cDNA反转录将冻存的齐口裂腹鱼组织在4℃融化后,用无菌双蒸水快速清洗数遍,然后在液氮中将组织磨成细粉,取50~100mg加入装有1mLRNAisoPlus裂解液的1.5mL的无菌EP管中,提取总RNA,用1%的琼脂凝胶电泳检测RNA的质量,用核酸检测仪测定总RNA浓度,保存于-80℃备用。提取组织RNA的具体操作如下:(1)将加入组织的裂解液用涡旋仪进行混匀处理。(2)混匀后,将EP管置于冰上静置5-10min,然后4℃10000×r/min离心10min,取上清。(3)每1ml裂解液加入0.2ml氯仿,剧烈振荡15sec,室温放置5min,4℃10000×r/min离心15min。(4)取上清移入新的EP管中加入等体积的异丙醇,室温放置10min,4℃10000×r/min离心10min。(5)弃上清,加入1mL预冷的75%乙醇洗涤RNA沉淀。4℃不超过10000×r/min离心5min,弃上清。(6)超净台中风干大约2-5min。加入20~50μL无RNase的水使RNA溶解。RNA反转录为cDNA参照反转录试剂盒PrimeScriptTMReagentKit(PerfectRealTime)cat#RR037A说明书进行。cDNA在-20℃保存备用。3、5’或3’RACE准备cDNA的合成按照SMARTTMRACEcDNAAmplificationKit说明书进行扩增cDNA,cDNA稀释200倍后分装,-20℃保存备用,操作步骤如下:(1)按照表1进行配置BufferMix。表1BufferMix配置好后,然后室温放置。(2)按照表2、3进行配置5’端和3’端扩增体系。表25’端扩增体系表33’端扩增体系按照表2、3配置好后,瞬时离心混匀,然后在PCR仪中进行程序:72℃3min,42℃2min,然后取出14000×r/min离心30sec。(3)向5’端扩增反应管中加入1μLSMARTERLLAolligo,混匀后瞬时离心3000×r/min3sec。(4)在(1)中BufferMix中依次加入0.25μLRNaseinhibitor(40U/μL)和1μLSMATERScribeTMReverseTranscriptase(100U)。(5)在5’端扩增反应管和3’端扩增反应管中加入(4)中的混合物,用移液枪轻柔的混匀试剂,瞬时离心。(6)在PCR仪中进行42℃90min,70℃10min反应。(7)反应完成后,加入TE缓冲液200倍稀释。稀释后产物在-20℃可保存3个月。4、Hsp90cDNA克隆(1)Hsp90保守区的扩增及克隆A.Hsp90保守区引物的设计齐口裂腹鱼的Hsp90的扩增引物设计见表4。表4Hsp90保守区域引物注:其中,兼并碱基代码:Y=C,T;K=G,T;S=G,C;R=A,GB.Hsp90保守区扩增齐口裂腹鱼Hsp90保守区域扩增引物如(表4),在上海生工合成,扩增Hsp90保守区域PCR体系按照表5进行,扩增体系为25μL。表5PCR体系齐口裂腹鱼Hsp90保守区域的PCR扩增程序为预变性94℃4min,变性94℃30sec,退火温度55.7℃30sec,延伸72℃90sec,35个循环,延伸72℃8min,4℃保存。取5μL反应产物以1%琼脂糖凝胶进行电泳,凝胶成像系统检测扩增结果。C.Hsp90保守区域的T载体克隆与鉴定a.用1%琼脂糖凝胶电泳分离PCR扩增产物,用Sanprep柱式DNA胶回收试剂盒回收目的基因片段。b.目的DNA与T-载体的连接按照表6中的体系进行,16℃连接过夜。表6pMD19-T载体连接体系c.将10μL的反应产物加入含有50μLDH5αE.coil的EP管中,冰浴30min,再42℃热激90sec,再冰浴5min。d.加入940μL的LB肉汤于EP管中,37℃震荡培养2h。e.取50μL菌液,铺于Amp-LB平板上。37℃过夜培养。f.挑取单个菌落进行菌落PCR,取阳性菌落进行扩大培养,并送到上海生工测序。(2)Hsp905’端和3’端RACE扩增A.Hsp905’端和3’端RACE扩增的引物设计根据Hsp90保守区域测序结果进行设计Hsp905’端和3’端RACE引物。引物序列如表7。表7Hsp90RACE扩增引物B.Hsp90基因的5’端RACE扩增将5’端RACEcDNA稀释200倍用作模板进行Hsp905’端的扩增,以UPM(UPM-Short:UPM-Long=5:1)作为上游引物,Hsp90-5’R1和Hsp90-5’R2分别作为第一次和第二次扩增的下游引物进行RACE扩增。第一次PCR为降落PCR,扩增程序为预变性94℃4min;变性94℃30sec,退火温度70℃60sec,延伸72℃60sec,5个循环;变性94℃30sec,退火温度68℃60sec,延伸72℃60sec,5个循环;变性94℃30sec,退火温度66℃60sec,延伸72℃60sec、16个循环延伸;72℃8min,4℃保存。经第一次扩增后,将PCR扩增产物进行150倍、200倍、250倍稀释后作为第二次扩增的模板进行PCR扩增,扩增程序为预变性94℃4min;变性94℃30sec,退火温度66℃60sec,延伸72℃60sec,30个循环;72℃8min,4℃保存。PCR产物取5μL反应产物以1%琼脂糖凝胶进行电泳,凝胶成像系统检测扩增结果。C.Hsp90的3’端RACE扩增将3’端RACEcDNA用作模板进行Hsp903’端的扩增,以UPM作为下游引物,Hsp90-3’F1和Hsp90-3’F2分别作为第一次和第二次扩增的上游引物进行RACE扩增。扩增方法与Hsp905’端扩增相同,第一次扩增程序为预变性94℃4min;变性94℃30sec,退火温度70℃30sec,延伸72℃2min,5个循环;变性94℃30sec,退火温度68℃30sec,延伸72℃2min,5个循环;变性94℃30sec,退火温度66℃30sec,延伸72℃2min、16个循环延伸;72℃8min,4℃保存。经第一次扩增后,将PCR扩增产物进行30倍、40倍、50倍稀释后作为第二次扩增的模板进行PCR扩增,扩增程序为预变性94℃4min;变性94℃30sec,退火温度64℃30sec,延伸72℃2min,30个循环;72℃8min,4℃保存。PCR产物取5μL反应产物以1%琼脂糖凝胶进行电泳,凝胶成像系统检测扩增结果。D.Hsp905’端和3’端扩增产物的T载体克隆与鉴定5’端和3’端扩增产物连接T载体,将鉴定的阳性菌落扩大培养后,送到上海生工测序。5、cDNA序列的分析3’端扩增序列、5’端扩增序列和基因的保守区域序列采用SeqMan拼接,将所得的完整基因cDNA序列输入NCBI进行核苷酸Blast比对(www.ncbi.nlm.nih.gov/BLAST/),基因cDNA序列的开放阅读框在开放阅读框查询器中进行查找(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)核酸序列的开放阅读框和氨基酸序列预测。并通过NCBI的BLAST(www.ncbi.nlm.nih.gov/BLAST/)进行核酸和蛋白的一致分析。通过DNAMAN软件完成(LynnonBiosoft,Quebec,Canada)多序列比对。通过Motifscan(http://myhits.isb.sib.ch/cigbin/motif_scan)进行特征性模序查找和结构域的预测。氨基酸序列的一致性比较用MegAlign完成。将氨基酸序列输入http://www.cbs.dtu.dk/services/CPHmodels/中,根据已知数据库建立热休克蛋白的蛋白结构模型。三、试验结果1、总RNA纯度和浓度检测通过1%琼脂糖凝胶电泳对提取的组织总RNA进行完整性检测,见图1。结果显示,提取的总RNA较为完整。通过核酸蛋白仪对总RNA进行纯度和浓度的检测,结果显示OD260/OD280比值在1.8-2.0之间,总RNA的浓度在469-1035μg/mL之间。结果表明提取的组织总RNA质量良好,符合进行下一步实验的要求。以4号泳道中肾组织提取的RNA来进行RACE逆转录。2、Hsp90cDNA克隆及序列分析(1)Hsp90克隆通过PCR技术对Hsp90的保守序列进行扩增,凝胶电泳检测扩增产物(见图2a),显示扩增到预期大小的目的条带(1457bp)。将目的条带连接到T载体上,并送到生工测序。用测序结果设计RACE引物。以RACE试剂盒反转录的cDNA作为模板,PCR扩增Hsp90的5’端和3’端,凝胶电泳检测扩增产物(见图2b,图2c)。将目的产物连接到T载体上,并送到生工测序。(2)Hsp90cDNA序列和预测氨基酸序列分析通过Hsp90的保守区域PCR扩增和利用RACE技术对其5’端和3’端扩增,将扩增产物克隆,并送到生工测序。测序所得到的序列通过SeqMan软件进行拼接得到齐口裂腹鱼Hsp90全长的cDNA序列。齐口裂腹鱼的Hsp90cDNA的全长为2663bp,其中包括ORF2181bp和84bp的5’-UTR和398bp的3’-UTR,在3’-UTR含有一个典型的多聚腺苷酸化信号序列(ATTAAA)和PloyA结构(见图3)。预测Hsp90编码726个氨基酸,分子质量为83.38kDa,理论等电点为4.91。氨基酸序列模序检测鉴定出该基因的氨基酸序列中含有5个保守的HSP90族特征模序分别为:NKEIFLRELISNASDALDKIR、LGTIAKSGT、IGQFGVGFYSAYLVAE、IKLYVRRVFI、GVVDSEDLPLNISRE(见图3)。在SpHsp90中同样含有保守的“G-X-G”模序和C末端的保守MEEVD模序(见图3)。通过氨基酸序列对SpHsp90基因进行结构分析发现该基因有保守的ATP/ADP绑定位点和Mg2+绑定位点,典型组氨酸激酶样ATP酶结构域,这些结构均普遍存在于HSP90蛋白家族成员。SEQIDNO:1Hsp90cDNA的全长序列CTCTGCTTTAGTGAGTATCAGTGTAGGGGAGATCAGCTGTTTCTGTGGCGATTAAACCATCAAAAACCAACGAAACGAACCAAAATGCCTGAAGAAATGCGCCAAGAGGAGGAGGCCGAGACCTTTGCCTTCCAGGCAGAGATCGCCCAGCTGATGTCTCTCATTATCAACACCTTCTACTCCAACAAAGAGATCTTCCTCAGGGAGCTCATCTCCAACGCCTCTGATGCTCTTGACAAAATCAGATATGAAAGCTTGACTGATCCCACCAAACTGGACAACGGCAAGGACCTGAAGATCGACATTACCCCCAACGTTCTTGAACGCACACTTACCATCGTTGACACTGGTATTGGAATGACCAAAGCGGATCTCATCAACAACTTGGGTACCATCGCCAAGTCCGGGACAAAGGCCCTCATGGAGGCTCTACAGGCTGGTGCAGATATCTCCATGATCGGGCAGTTTGGTGTGGGCTTCTACTCTGCCTACCTGGTGGCTGGAAAGGTCACGGTCATCACTAAACACAACGATGATGAGCAGTACACCTGGGAGTCATCCGCTGGTGGCTCTTTCACAGTCAAGGTGGACAATGGTGAGCCCATTGGCCGTGGAACCAAAGTCATTCTTCACATGAAAGAAGATCAGATTGAGTACATCGAGGAGAAGAGAGTGAAGGAAGTGGTCAAGAAACACTCCCAGTTCATCGGATACCCAATCACTCTCTTCGTGGAGAAGGAACGTGACAAGGAGATCAGTGACGACGAGGCAGAGGAGGAGAAGCCTGAGAAAGAGGAGAAGGAGAAGGAGGAAGGCGAAGACAAACCCAAGATTGAGGACGTCGGCTCAGATGATGAAGAGGACTCCAAAGACAAGGACAAGAAGAAAACGAAGAAGATCAAAGAGAAGTACATCGACCAGGAGGAGCTGAACAAAACCAAACCCATCTGGACCCGCAACCCTGACGACATCTCCAACGAAGAGTACGGAGAGTTTTACAAGAGCCTGACCAACGATTGGGAAGATCACCTGGCTGTCAAGCATTTCTCTGTGGAGGGTCAGCTGGAGTTCCGCGCTCTTCTCTTCATCCCTCGCCGCGCCCCCTTCGACCTCTTCGAGAACAAGAAAAAGAAGAATAACATCAAGCTGTACGTCAGAAGGGTCTTCATCATGGACAGCTGTGAAGAGCTCATCCCAGGGTATCTGAACTTCATCCGTGGTGTTGTGGACTCTGAAGATCTGCCTCTCAACATCTCCAGAGAGATGCTGCAACAGAGCAAGATTCTCAAGGTCATCCGCAAGAACATGGTCAAGAAGTGCCTGGAGCTGTTTGCCGAGCTGGCCGAGGACAAGGAGAACTACAAGAAGTTCTACGACGCCTTCTCCAAGAATCTGAAACTGGGCATCCACGAGGACTCTCAGAACCGCAAGAAGCTGCCAGAACTGTTGCGTTATCAGAGCTCGCAATCCGGCGACGAGATGACCTCCCTCACAGAATACGTCAGCCGTATGAAGGAAAACCAGAAGTCCATCTACTACATCACTGGTGAGAGCAAAGACCAGGTCGCCCACTCTGCTTTTGTGGAGCGCGTGTGCAAGAGAGGTTTCGAGGTGCTGTACATGACCGAGCCCATCGACGAGTACTGCGTCCAGCAGCTGAAGGACTTCGACGGCAAGTCTCTGGTGTCCATCACCAAGGAGGGACTGGAGCTGCCTGAGGATGAAGACGAGAAGAAAAAGATGGAGGAAGACAAGGCCAAGTTTGAGAACCTCTGCAAGCTCATGAAGGAGATTCTGGACAAGAAAGTAGAGAAGGTCACTGCATCAAACAGGCTGGTTTCTCCTcCCTGCTGTATCGTGACCAGCACCTACGGCTGGACGGCCAACATGGAGAGGATCATGAAGGCCCAGGCCTTGAGGGACAACTCCACCATGGGCTACATGATGGCCAAGAAACATCTGGAGATCAACCCCGATCATCCCATCATGGAGACCCTGAGGCAGAAGGCTGATGCGGATAAAAATGACAAGGCCGTGAAGGATCTGGTCATCCTCCTGTTTGAGACCGCGCTGCTTTCCTCTGGTTTCTCATTGGACGATCCTCAAACGCACTCAAACCGCATCTACAGAATGATCAAGCTGGGATTGGGTATTGATGAAGATGAAGACGTACCTGTGGAAGAGCCAAGCTCTGCTCCTGTCCCCGAAGACATGCCACCTCTGGAAGGAGACGATGACGCTTCTCGCATGGAGGAAGTCGATTAAACCCGTTTGTCTAAAACTCCCCAATCACTTTTCCGTAATCATTCCTTAACATCCTGTCGTTCTCTTTGACCTGTAGAAGGCTGACCTGATCTCAGTAATGATTCCTGAAAGAATCATAATGTAACTAAAGCATACCGTCTACTTTTGCTCTGTTTTGAGCCATAATGTACCTTTTAGTTTTTTTACGTAATGTGATGTTCATGGATTGCAGTATTGTCTGAGCACAATAAGCACTGTGCACTTTCACTGATACTGAGTTTGCTGGCTGTGCTGGATTGAATCAAGCATGATTTCTTTCTGCATGGAAGGGAAAGACCTTTGCTTGACTGCAGGCATGTTGTCTTGTTTTTCAGAAATTAAAACACATGGTGAAACCTGAAAAAAAAAAAAAAAAAAAASEQIDNO:2HSP90开放阅读框:ATGCCTGAAGAAATGCGCCAAGAGGAGGAGGCCGAGACCTTTGCCTTCCAGGCAGAGATCGCCCAGCTGATGTCTCTCATTATCAACACCTTCTACTCCAACAAAGAGATCTTCCTCAGGGAGCTCATCTCCAACGCCTCTGATGCTCTTGACAAAATCAGATATGAAAGCTTGACTGATCCCACCAAACTGGACAACGGCAAGGACCTGAAGATCGACATTACCCCCAACGTTCTTGAACGCACACTTACCATCGTTGACACTGGTATTGGAATGACCAAAGCGGATCTCATCAACAACTTGGGTACCATCGCCAAGTCCGGGACAAAGGCCCTCATGGAGGCTCTACAGGCTGGTGCAGATATCTCCATGATCGGGCAGTTTGGTGTGGGCTTCTACTCTGCCTACCTGGTGGCTGGAAAGGTCACGGTCATCACTAAACACAACGATGATGAGCAGTACACCTGGGAGTCATCCGCTGGTGGCTCTTTCACAGTCAAGGTGGACAATGGTGAGCCCATTGGCCGTGGAACCAAAGTCATTCTTCACATGAAAGAAGATCAGATTGAGTACATCGAGGAGAAGAGAGTGAAGGAAGTGGTCAAGAAACACTCCCAGTTCATCGGATACCCAATCACTCTCTTCGTGGAGAAGGAACGTGACAAGGAGATCAGTGACGACGAGGCAGAGGAGGAGAAGCCTGAGAAAGAGGAGAAGGAGAAGGAGGAAGGCGAAGACAAACCCAAGATTGAGGACGTCGGCTCAGATGATGAAGAGGACTCCAAAGACAAGGACAAGAAGAAAACGAAGAAGATCAAAGAGAAGTACATCGACCAGGAGGAGCTGAACAAAACCAAACCCATCTGGACCCGCAACCCTGACGACATCTCCAACGAAGAGTACGGAGAGTTTTACAAGAGCCTGACCAACGATTGGGAAGATCACCTGGCTGTCAAGCATTTCTCTGTGGAGGGTCAGCTGGAGTTCCGCGCTCTTCTCTTCATCCCTCGCCGCGCCCCCTTCGACCTCTTCGAGAACAAGAAAAAGAAGAATAACATCAAGCTGTACGTCAGAAGGGTCTTCATCATGGACAGCTGTGAAGAGCTCATCCCAGGGTATCTGAACTTCATCCGTGGTGTTGTGGACTCTGAAGATCTGCCTCTCAACATCTCCAGAGAGATGCTGCAACAGAGCAAGATTCTCAAGGTCATCCGCAAGAACATGGTCAAGAAGTGCCTGGAGCTGTTTGCCGAGCTGGCCGAGGACAAGGAGAACTACAAGAAGTTCTACGACGCCTTCTCCAAGAATCTGAAACTGGGCATCCACGAGGACTCTCAGAACCGCAAGAAGCTGCCAGAACTGTTGCGTTATCAGAGCTCGCAATCCGGCGACGAGATGACCTCCCTCACAGAATACGTCAGCCGTATGAAGGAAAACCAGAAGTCCATCTACTACATCACTGGTGAGAGCAAAGACCAGGTCGCCCACTCTGCTTTTGTGGAGCGCGTGTGCAAGAGAGGTTTCGAGGTGCTGTACATGACCGAGCCCATCGACGAGTACTGCGTCCAGCAGCTGAAGGACTTCGACGGCAAGTCTCTGGTGTCCATCACCAAGGAGGGACTGGAGCTGCCTGAGGATGAAGACGAGAAGAAAAAGATGGAGGAAGACAAGGCCAAGTTTGAGAACCTCTGCAAGCTCATGAAGGAGATTCTGGACAAGAAAGTAGAGAAGGTCACTGCATCAAACAGGCTGGTTTCTCCTcCCTGCTGTATCGTGACCAGCACCTACGGCTGGACGGCCAACATGGAGAGGATCATGAAGGCCCAGGCCTTGAGGGACAACTCCACCATGGGCTACATGATGGCCAAGAAACATCTGGAGATCAACCCCGATCATCCCATCATGGAGACCCTGAGGCAGAAGGCTGATGCGGATAAAAATGACAAGGCCGTGAAGGATCTGGTCATCCTCCTGTTTGAGACCGCGCTGCTTTCCTCTGGTTTCTCATTGGACGATCCTCAAACGCACTCAAACCGCATCTACAGAATGATCAAGCTGGGATTGGGTATTGATGAAGATGAAGACGTACCTGTGGAAGAGCCAAGCTCTGCTCCTGTCCCCGAAGACATGCCACCTCTGGAAGGAGACGATGACGCTTCTCGCATGGAGGAAGTCGATTAASEQIDNO:3HSP90氨基酸序列:MPEEMRQEEEAETFAFQAEIAQLMSLIINTFYSNKEIFLRELISNASDALDKIRYESLTDPTKLDNGKDLKIDITPNVLERTLTIVDTGIGMTKADLINNLGTIAKSGTKALMEALQAGADISMIGQFGVGFYSAYLVAGKVTVITKHNDDEQYTWESSAGGSFTVKVDNGEPIGRGTKVILHMKEDQIEYIEEKRVKEVVKKHSQFIGYPITLFVEKERDKEISDDEAEEEKPEKEEKEKEEGEDKPKIEDVGSDDEEDSKDKDKKKTKKIKEKYIDQEELNKTKPIWTRNPDDISNEEYGEFYKSLTNDWEDHLAVKHFSVEGQLEFRALLFIPRRAPFDLFENKKKKNNIKLYVRRVFIMDSCEELIPGYLNFIRGVVDSEDLPLNISREMLQQSKILKVIRKNMVKKCLELFAELAEDKENYKKFYDAFSKNLKLGIHEDSQNRKKLPELLRYQSSQSGDEMTSLTEYVSRMKENQKSIYYITGESKDQVAHSAFVERVCKRGFEVLYMTEPIDEYCVQQLKDFDGKSLVSITKEGLELPEDEDEKKKMEEDKAKFENLCKLMKEILDKKVEKVTASNRLVSPPCCIVTSTYGWTANMERIMKAQALRDNSTMGYMMAKKHLEINPDHPIMETLRQKADADKNDKAVKDLVILLFETALLSSGFSLDDPQTHSNRIYRMIKLGLGIDEDEDVPVEEPSSAPVPEDMPPLEGDDDASRMEEVD.本实验证明得到了齐口裂腹鱼的Hsp90基因和蛋白质。以下用实验例的方式说明本发明的有益效果:实验例1Hsp90基因在无乳链球菌感染后的表达量变化一、试验材料1、菌体无乳链球菌(Streptococcusagalactiae,S.agalactiae)由四川农业大学鱼病研究中心提供。2、主要试剂PrimeScriptTMReagentKitWithgDNAEraser(PerfectRealTime)cat#RR047A、PremixExTaqTMII(TliRNaseHPlus)(购于宝生物工程公司,大连,中国);Bloodtotalprotein,totalRNA,DNAandmicroRNA-kit(购于北京博凌科为生物科技有限公司。3、主要仪器StepOnePlusTM实时荧光定量PCR系统-LifeTech(appliedbiosystems)(life-technologies公司)。其他仪器实施例1的仪器。4、试验动物健康齐口裂腹鱼购于四川润兆渔业有限公司。5、主要试剂配置(1)培养基配置脑心浸出液肉汤(BrainHeartInfusionBroth,BHI):称取BHI37g,加蒸馏水至1000mL,每支试管10mL的量分装,115℃灭菌15min,冷却至室温保存备用。脑心浸出液琼脂平板(BrainHeartInfusionAgar,BHIA):在脑心浸出液液体培养基中添加2.0%~3.0%的琼脂粉,115℃灭菌15min,待冷却至50℃~60℃时倒入平板,每个平板约15mL~20mL。冷却凝固,4℃保存备用。(2)其他试剂配置同实施例1的试剂配置。二、Hsp90基因的组织表达谱分析1、方法如下:(1)样品采集取健康的齐口裂腹鱼(45±3g)5尾用MS-222(0.1g/L)麻醉后,先用0.1mL一次性注射器从鱼的尾柄静脉中抽取0.1mL的全血,将血液放入装有900μL的血细胞裂解液的1.5mL无菌离心管中,充分混匀后,保存在-80℃备用;分别取其鳃、脑、心脏、肝胰脏、脾脏、中肾、皮肤、肌肉、肠道共9个组织,将组织放入装有1mL样品RNA/DNA保护剂的1.5mL的无菌离心管中,保存在-80℃备用。(2)组织总RNA的提取和反转录方法同实施例1的二(2)。RNA反转录为cDNA参照反转录试剂盒PrimeScriptTMReagentKit(PerfectRealTime)cat#RR047A说明书进行。第一步除去基因组DNA,第二步将RNA反转录为cDNA,cDNA在-20℃保存备用。(3)齐口裂腹鱼Hsp90的组织表达谱分析A.qRT-PCR引物设计及制作标准曲线采用PrimerPremier5.0软件设计用于qPCR的引物(见表8),引物由上海生工合成。引物合成后,进行PCR检测引物的特异性。以cDNA为模板进行PCR扩增,反应产物用2%琼脂糖凝胶检测目的条带大小。若获得的目的片段与预期目的条带的大小一致,然后对其进行测序。将测序结果与原始序列比对,正确才进行下一步试验。将cDNA进行10倍梯度稀释,分别稀释1、1×10-1、1×10-2、1×10-3、1×10-4、1×10-5倍,以稀释的cDNA作为模板和双蒸水进行qPCR反应,然后制作标准曲线,并确定模板cDNA稀释倍数。表8荧光定量PCR引物B.quantityReal-timePCR采用StepOnePlusTM实时荧光定量PCR系统进行荧光定量检测,先按照表9在1.5mL的EP管中配制预混液,移取9μL的预混液到96孔板中,再加入1μL轻轻混匀的cDNA模板,每个样品进行三个技术平行。表9荧光定量反应体系qRT-PCR程序:95℃预变性2min;95℃变性5sec,退火延伸30sec,读板,40个循环;最后经60℃升温到95℃,每升高0.5℃读板一次,进行融解曲线分析,检测产物是否单一,引物是否具有特异性。导出的荧光定量结果采用2-△△CT法分析基因组织分布。(4)统计学分析RT-PCR的实验数据用平均数±标准误表示。实验数据通过SPSS19.0(SPSSInc,Chicago,IL,USA)软件进行处理,数据用单因素方差分析,P<0.05即达到显著水平。在本实验中,组织分布表达量的数据进行显著性分析,无乳链球菌感染后组织表达量的分析是同一组织在相同时间点与对照组进行显著性分析。2、表达谱分析结果(1)荧光定量标准曲线制作Hsp90、β-actin和18SrRNA内参基因的标准曲线有良好的线性关系,10倍梯度稀释Ct值的点在同一直线上,引物的相关系数分别为1.000、0.997、0.998,扩增效率分别为99.909%、100.500%、97.728%,斜率分别为-3.324、-3.31、-3.378。标准曲线的结果表明RT-PCR引物有良好的线性关系,适用于表达量的检测。(2)Hsp90的表达谱通过qRT-PCR对Hsp90基因在齐口裂腹鱼的11个组织中的表达量进行检测,结果显示Hsp90mRNA在检测的11个组织中普遍表达;显著性比较后,发现中肾中Hsp90mRNA的表达量最高,并显著高于其他被检测的组织(P<0.05),其次为肝胰脏,其表达量为中肾的0.636倍,而肌肉中Hsp90mRNA的表达量最低,除皮肤外其他组织中的Hsp90mRNA表达量显著高于肌肉(见图4),其表达量仅为中肾的0.018倍,皮肤、脑、心脏、鳃、肠道、脾脏、血液的表达量分别为中肾的0.065倍、0.093倍、0.122倍、0.122倍、0.190倍、0.212倍、0.308倍、0.324倍。三、Hsp90基因在无乳链球菌感染后的表达量变化1、方法如下:(1)细菌的活化将分离菌株GY101划线接种BHI平板,28℃孵育24h–48h。挑取单个菌落接种于BHI肉汤,28℃低速振荡,活化过夜培养;将活化后的菌液按10%接种于新鲜BHI肉汤,28℃过夜孵育后(OD600值在0.6-0.8之间),将培养的菌液8000×r/min离心15min,弃上清,然后用PBS缓冲液重悬,重复操作二次;用麦氏比浊法,调节细菌浓度,将细菌浓度调节至1.5×107CFU。(2)动物饲养健康齐口裂腹鱼(45±3g)85尾,饲养于装有160L水的40cm×60cm×100cm鱼缸,水源为经曝气处理后的自来水,水质标志均符合渔业水质标准(GB11607-89)。鱼在饲养期间水温保持在23±1℃左右,每天换掉总体积1/2的水,且定期清洁鱼缸。试验前健康齐口裂腹鱼在鱼缸中暂养一周,暂养期间每天按体重2%投喂商业饵料,每天喂食2次,上午9:00和晚上5:00分别喂食。(3)动物分组及处理将暂养一周后的齐口裂腹鱼随机分成2个组,分别为(即感染组)和对照组(40尾/组),每组鱼分为2个平行水缸,20尾/缸。感染组通过人工注射无乳链球菌感染,具体操作为将鱼先用MS-222(0.1g/L)麻醉后,腹鳍基部腹腔注射0.1mL的浓度为1.5×107CFU的无乳链球菌;对照组进行模拟注射,在腹鳍基部腹腔注射等量的PBS缓冲液。注射后的鱼放回原来的水缸中。(4)样品采集在攻毒前及攻毒后的6h、24h、72h、120h采取组织样品;每个时间点每组取8尾鱼,在每个平行水缸中随机取4尾。用MS-222(0.1g/L)麻醉后,用1mL注射器尾静脉采血,取0.1mL血液放入装有1mL血细胞裂解液的EP管中,并快速混匀。取肝胰脏、脾脏、中肾快速放入装有0.8mL样品保护剂的EP管中,然后将EP管放入-80℃超低温冰箱中保存,直至使用。(5)组织总RNA的提取和反转录方法同实施例1的二(2)。RNA反转录为cDNA参照反转录试剂盒PrimeScriptTMReagentKit(PerfectRealTime)cat#RR047A说明书进行。第一步除去基因组DNA,第二步将RNA反转录为cDNA,cDNA在-20℃保存备用。2、无乳链球菌感染后Hsp90的表达变化分析结果在齐口裂腹鱼感染无乳链球菌后,将同一组织中的Hsp90mRNA表达量在感染后的相同时间点与对照组进行显著性分析,结果表明,与对照组相比,实验组齐口裂腹鱼的血液、肝胰脏、脾脏和中肾中SpHsp90mRNA的表达量均发生了显著变化(P<0.05),具体数值如下:血液中Hsp90mRNA表达量,在感染后迅速上升并在6h达到峰值,随后表达量下降,且在72h下降至与对照组表达水平无显著性差异,并维持其表达量至120h;肝胰脏中其表达量在6h、24h均显著性升高,在72h表达量降至与对照组无显著性差异的水平,并持续下降在120h显著低于对照组表达水平;脾脏中其表达量在24h-120h均显著高于对照组;在中肾中其表达量6h-120h均显著高于对照组。见图5、表10。表10实验组的Hsp90mRNA表达量变化不同组织感染后6h24h72h120h血液5.350倍*1.580倍*0.812倍0.874倍肝胰脏1.572倍*1.566倍*0.987倍0.704倍*中肾1.760倍*2.941倍*1.280倍*1.534倍*脾脏0.988倍1.592倍*1.280倍*1.520倍*注:表中“倍”指实验组的Hsp90mRNA表达量与相同时间点的对照组相比。*表示与对照组的表达量相同有显著差异(P<0.05)。腹腔内注射细菌感染鱼被分为急性期(6h),早期(24h),中期(72h)和晚期(120h)。其中,急性期和早期,从外观上看不到鱼体变化;中期开始,偶见有鱼表现出离群、体表发黑、反应迟钝等症状;感染晚期,才能明显体现出整个鱼群的发病症状,并出现鱼死亡。本实验结果表明,齐口裂腹鱼在感染无乳链球菌后,SpHsp90mRNA的表达量变化在血液、肝胰脏、中肾和脾脏中都显示出了时间变化;例如,齐口裂腹鱼在受细菌感染后,中肾的Hsp90表达量一直显著提高;细菌感染的急性期和早期,血液和肝胰脏的Hsp90表达量均显著提高,随后表达量下降;而脾脏中的Hsp90表达量在细菌感染的早期、中期和晚期,均显著提高。因此,Hsp90mRNA可作为齐口裂腹鱼细菌感染的辅助生物标记物。通过检测齐口裂腹鱼群血液、肝胰脏、中肾和/或脾脏组织的Hsp90mRNA表达水平,可以筛查齐口裂腹鱼是否被细菌感染,用来监测齐口裂腹鱼健康状态。综上,本发明克隆得到了齐口裂腹鱼Hsp90的cDNA全序列,并且发现齐口裂腹鱼Hsp90的表达水平与齐口裂腹鱼是否受细菌感染相关。结果表明本发明的Hsp90可作为诊断齐口裂腹鱼无乳链球菌感染的靶标,用于制备细菌感染的检测试剂,临床应用前景良好。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1