检测SortaseA活性的底物蛋白、表达载体、构建方法及应用与流程
本发明属于生物检测技术领域,具体涉及一种检测SortaseA活性的底物蛋白、表达载体、构建方法及应用。
背景技术:
金黄色葡萄球菌分选酶SortaseA兼具蛋白酶和转肽酶的功能。细菌表面蛋白在成熟前首先在细菌胞质中合成带有N端信号肽及C端分选信号的蛋白前体,并通过分泌途径分泌到胞外。在这一过程中信号肽被信号肽酶切除,蛋白前体通过C端疏水区定位在细胞膜上。随后其特征基序被分选酶SortaseA识别,并断开LPXTG中的T-G键,催化Thr与细胞壁肽聚糖的共价结合,从而将表面蛋白锚定到细胞壁上。由于细菌表面蛋白在病原菌的吸附感染,生物被膜形成方面具有关键作用,因此分选酶SortaseA是革兰氏阳性菌致病性的重要药物靶点,筛选抑制其活性的抑制剂在医药领域具有重要的实际意义。
目前,分选酶Sortase A抑制剂的筛选方法目前大致可分为四种:基于片段小分子化合物库高通量筛选、荧光共振能量转移法、HPLC检测法及纤连蛋白结合法。这几种方法中,适宜高通量的筛选方法是引用FRET的底物蛋白筛选法,即人工合成序列为LPXTG的小肽,两端分别进行化学修饰使其含有Dabcyl-Edans或abz-dnp荧光淬灭对修饰,当分选酶SortaseA催化底物蛋白链断裂,淬灭基团与荧光基团分离,荧光强度就会发生变化。因此可以用于筛选影响分选酶SortaseA活性的抑制剂。
虽然FRET的底物蛋白筛选法可以对分选酶SortaseA的活性进行高通量检测,但是由于其底物蛋白是化学合成制备,合成费用高,周期长,有时甚至合成失败,需要反复优化合成条件,在一定程度上限制了它的应用。
技术实现要素:
本发明的目的是提供一种检测分选酶Sortase A活性的底物蛋白、表达载体、构建方法及应用,解决了现有的分选酶Sortase A活性检测方法中底物蛋白需要化学合成,费用高,合成周期长,容易失败的问题。
本发明提供了一种检测分选酶Sortase A活性的底物蛋白,其核苷酸序列如SEQ ID NO.1所示,其氨基酸序列如SEQ ID NO.2所示。
本发明还提供了一种检测分选酶Sortase A活性的底物蛋白表达载体,所述底物蛋白表达载体是在大肠杆菌表达载体pET28a的NcoI、XhoI酶切位点插入如SEQ ID NO.1所示的核苷酸序列构建而成。
本发明还提供一种上述检测分选酶Sortase A活性的底物蛋白表达载体的构建方法,具体包括以下步骤:
步骤1,在SEQ ID NO.1所示的核苷酸序列的5’端添加NcoI的酶切位点,3’端添加XhoI的酶切位点,设计并合成如SEQ ID NO.3所示的DNA片段;
步骤2,底物蛋白表达载体的构建
以NcoI、XhoI双酶切如SEQ ID NO.3所示的DNA片段,并回收1.6kb的目的DNA片段;以NcoI、XhoI双酶切大肠杆菌表达载体pET28a,并回收5.2kb的载体DNA片段;将1.6kb的目的DNA片段连接到5.2kb的载体DNA片段上,构建成底物蛋白表达载体。
本发明还提供了一种上述底物蛋白表达载体,在检测金黄色葡萄球菌的分选酶Sortase A活性中的应用。
本发明还提供了一种利用上述底物蛋白表达载体检测金黄色葡萄球菌的分选酶Sortase A活性的方法,包括以下步骤:
步骤(1),制备底物蛋白表达载体;
步骤(2),将底物蛋白表达载体转化至大肠杆菌BL21DE3菌感受态细胞中,诱导表达底物蛋白,得到底物蛋白表达产物,然后利用Ni-NTA亲和层析柱对底物蛋白表达产物进行纯化,得到底物蛋白溶液;
步骤(3),利用大肠杆菌表达载体pET28a构建含有金黄色葡萄球菌基因组中分选酶Sortase A基因的表达载体pET28a-srtA,然后将表达载体pET28a-srtA转化入大肠杆菌BL21DE3菌感受态细胞中,诱导表达分选酶Sortase A,得到分选酶SortaseA表达产物,然后利用Ni-NTA亲和层析柱对分选酶SortaseA表达产物进行纯化,得到分选酶SortaseA溶液;
步骤(4),以底物蛋白溶液为空白对照组,利用酶标仪检测分选酶Sortase A溶液中分选酶SortaseA的活性。
优选的,上述的检测分选酶SortaseA活性的方法中,利用酶标仪检测分选酶SortaseA溶液中分选酶Sortase A的活性,具体包括以下步骤:
将底物蛋白溶液和分选酶Sortase A溶液混合加入到酶标板中,作为检测组,同时以底物蛋白溶液为空白对照组;
将酶标板置于37℃,避光孵育1h;
酶标仪参数设定为350nm激发,495nm记录,测定酶标板内溶液的荧光强度;
比较空白对照组和检测组的荧光强度大小,判断分选酶SortaseA是否具有活性。
本发明提供的一种检测分选酶Sortase A活性的底物蛋白是用原核表达载体表达制备,不需要化学合成和修饰,制备的底物蛋白是受分选酶特异性激活的GFP蛋白,在没有被分选酶Sortase A切割前,不产生成熟的GFP荧光蛋白,不会产生荧光,而被分选酶Sortase A切割后,可以产生成熟的GFP荧光蛋白,产生荧光,在灵敏度上完全可以替代现有的基于FRET原理的化学合成的底物蛋白。
本发明提供的一种检测分选酶Sortase A活性的底物蛋白,一般实验条件下就可制备,成本低、周期短,且不受化学合成技术的限制,底物蛋白的制备成功率高,具有很好的应用前景。
附图说明
图1为底物蛋白表达载体pET28a-GFP-QALPETGEE-QP的结构示意图;
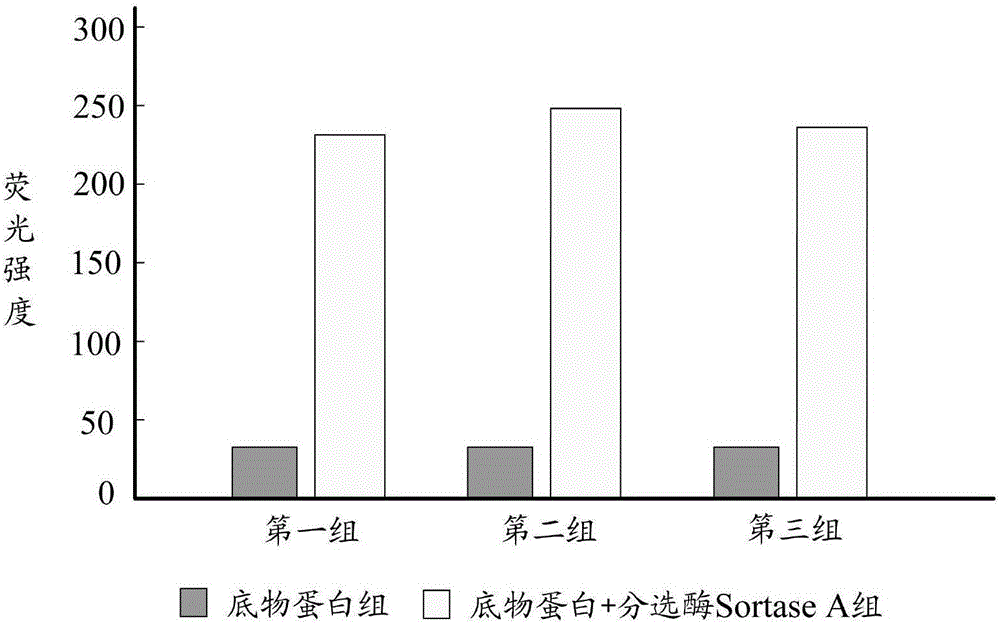
图2为底物蛋白和金黄色葡萄球菌的分选酶SortaseA反应的荧光强度变化图。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明,但应当理解本发明的保护范围并不受具体实施方式的限制。
本发明提供了一种检测分选酶Sortase A活性的底物蛋白,其核苷酸序列如SEQ ID NO.1所示,其氨基酸序列如SEQ ID NO.2所示,所述底物蛋白的核苷酸序列中含有分别编码分选酶Sortase A特异识别的核苷酸序列、GFP荧光淬灭序列以及GFP蛋白的核苷酸序列。
基于同一种发明构思,本发明还提供了一种检测分选酶SortaseA活性的底物蛋白表达载体,所述底物蛋白表达载体是在大肠杆菌表达载体pET28a中插入如SEQ ID NO.1所示的核苷酸序列构建而成,具体按照以下步骤构建:
步骤1,人工合成如SEQ ID NO.3所示的DNA片段。
根据增强型绿色荧光蛋白EGFP的基因序列,编码金黄色葡萄球菌分选酶Sortase A能识别的表面蛋白C端分选信号所含的保守基序LPXTG的核苷酸序列,以及编码荧光淬灭蛋白(quenching peptide,QP)的核苷酸序列,在SEQ ID NO.1所示的核苷酸序列的5’端添加NcoI的酶切位点,3’端添加XhoI的酶切位点,设计并人工合成如SEQ ID NO.3所示的DNA片段,SEQ ID NO.3所示的具体序列片段如下:
,其中5’端的划线部分为Nco I的酶切位点,3’端的划线部分为XhoI的酶切位点,大写字母所示的核苷酸序列中含有可编码GFP的序列,小写加黑字母所示的核苷酸序列用于编码可被分选酶SortaseA特异性识别并剪切的肽段的序列,小写斜体所示的核苷酸序列为编码荧光淬灭蛋白的核苷酸序列。
需要说明的是,SEQ ID NO.3所示的DNA片段既包括了如SEQ ID NO.1所示的DNA片段,也包括了Nco I、XhoI的酶切位点。
步骤2,底物蛋白表达载体的构建
将如SEQ ID NO.3所示的DNA片段经NcoI和XhoI双酶切,并将双酶切后的产物连接到大肠杆菌表达载体pET28a相应的NcoI和XhoI双酶切位点上,构建成底物蛋白表达载体,具体包括:
步骤2.1,以NcoI、XhoI双酶切如SEQ ID NO.3所示的DNA片段,并回收1.6kb的目的DNA片段;以NcoI、XhoI双酶切大肠杆菌表达载体pET28a,并回收5.2kb的载体DNA片段;将1.6kb的目的DNA片段与5.2kb的载体DNA片段于16℃连接过夜(10-16h),构建成底物蛋白表达载体,将底物蛋白表达载体命名为,底物蛋白表达载体pET28a-GFP-QALPETGEE-QP,该底物蛋白表达载体pET28a-GFP-QALPETGEE-QP的结构如图1所示。
步骤2.2,将底物蛋白表达载体转化至大肠杆DH5α菌感受态细胞,通过抗性筛选获得阳性菌株,测序鉴定底物蛋白表达载体pET28a-GFP-QALPETGEE-QP是否构建成功。
基于同一种发明构思,本发明还提供了一种上述底物蛋白表达载体(底物蛋白表达载体pET28a-GFP-QALPETGEE-QP),在检测金黄色葡萄球菌的分选酶Sortase A活性中的应用,且上述底物蛋白表达载体检测金黄色葡萄球菌的分选酶SortaseA活性的方法,具体包括以下步骤:
步骤(1),按上述步骤1-2的方法制备底物蛋白表达载体pET28a-GFP-QALPETGEE-QP。
步骤(2),获取底物蛋白溶液
将底物蛋白表达载体pET28a-GFP-QALPETGEE-QP转化至大肠杆菌BL21DE3(大肠杆菌BL21(DE3))中,诱导表达底物蛋白,然后利用Ni-NTA亲和层析柱对底物蛋白产物进行纯化,得到底物蛋白溶液,具体包括:
步骤(2.1),将底物蛋白表达载体pET28a-GFP-QALPETGEE-QP转化入大肠杆BL21DE3菌感受态细胞中,次日挑取单菌落,并于LB液体培养基中培养过夜,培养过夜的时间为10-16h,得到培养液;
步骤(2.2),取10mL培养液接种于含有卡那霉素的LB液体培养基中,且每毫升LB液体培养基中含有25μg卡那霉素,37℃振荡培养至OD600=0.6-0.8。
步骤(2.3),将步骤(2.2)的溶液温度降至16℃,加入IPTG,并使IPTG的终浓度为1mmol/L,之后于16℃诱导过夜,诱导过夜的时间为10-16h,得到诱导培养液。
步骤(2.4),将诱导培养液于4℃、14000rpm,离心30min,收集沉淀,并用50mL裂解缓冲液重悬沉淀,冰浴上超声破碎30min,其中超声破碎的频率是400W,后于4℃、14000rpm、离心30min,收集上清,得到含有底物蛋白表达产物的上清液,最后通过SDS-PAGE电泳检测上清液中的底物蛋白。
步骤(2.5),利用Ni-NTA亲和层析柱(镍柱)对底物蛋白表达产物进行纯化,得到底物蛋白溶液。
用5mL浓度为10mmol/L的咪唑洗涤缓冲液平衡Ni-NTA亲和层析柱后,将含有底物蛋白表达产物的上清液过柱,因为底物蛋白的N端上有His标签,因此能够结合到Ni-NTA亲和层析柱上,再用5ml浓度为150mmol/L咪唑洗脱液洗脱,收集流出液,得到底物蛋白溶液,测定底物蛋白溶液中底物蛋白的浓度,并将底物蛋白命名为GFP-QALPETGEE-QP。
其中,10mmol/L的咪唑洗涤缓冲液由NaH2PO4、NaCl、Tween-20、咪唑和去离子水制备而成,且裂解缓冲液中NaH2PO4的浓度为50mmol/L、NaCl的浓度为300mmol/L、Tween-20的体积百分比浓度为0.05%、咪唑的浓度为10mmol/L,配制好后用3mol/L NaOH调节为pH为7.0。
150mmol/L咪唑洗脱液由NaH2PO4、NaCl、Tween-20、咪唑和去离子水制备而成,且裂解缓冲液中NaH2PO4的浓度为50mmol/L、NaCl的浓度为300mmol/L、Tween-20的体积百分比浓度为0.05%、咪唑的浓度为150mmol/L配制好后用3mol/L NaOH调节为pH为7.0。
步骤(3),获取分选酶SortaseA溶液
利用大肠杆菌表达载体pET28a构建含有金黄色葡萄球菌基因组中分选酶Sortase A基因的表达载体pET28a-srtA,然后将表达载体pET28a-srtA转化入大肠杆菌BL21DE3菌感受态细胞中,诱导表达分选酶Sortase A,得到分选酶Sortase A表达产物,然后利用Ni-NTA亲和层析柱对分选酶Sortase A表达产物进行纯化,得到分选酶SortaseA溶液,具体包括:
步骤(3.1),引物设计:根据金黄色葡萄球菌的分选酶SortaseA基因序列,用Prime5.0软件设计合成了一对寡核苷酸引物,包括上游引物:5′-CATGCCATGGGCCAAGCTAAACCT-3′(划线部分为NcoI酶切位点);下游引物:5′-CCGCTCGAGGCTGCTGCCTTTGACTTCTGTAGCTACAAAGA-3′(划线部分为XhoI酶切位点)。
步骤(3.2),提取金黄色葡萄球菌基因组DNA,并以金黄色葡萄球菌基因组DNA为模板DNA,进行分选酶Sortase A基因的PCR扩增,最后经1.0%琼脂糖电泳回收PCR产物。
PCR总体积25μL,包括:模板DNA 1μL(模板DNA浓度为50ng/μL)、2.5μL 10×buffer、上游引物1μL(上游引物浓度为10μmol/L)、下游引物1μL(下游引物浓度为10μmol/L)、2.0μL的2.5mmol/L dNTP、0.2μL ExTaq聚合酶、17.3μL ddH2O。
PCR扩增的反应条件:94℃预变性4min,94℃变性45s,60.2℃退火1min,72℃延伸1min,共28个循环,然后72℃延伸7min,最后4℃终止反应。
步骤(3.3),步骤(3.2)的PCR产物和大肠杆菌表达载体pMD18T于4℃连接过夜,连接过夜时间为10-16h,将连接产物转化至大肠杆菌DH5α感受态细胞,并进行测序确认,得到含有分选酶SortaseA基因的pMD18T载体的阳性细胞。
步骤(3.4),提取步骤(3.3)的阳性细胞中含有分选酶Sortase A基因的pMD18T载体,然后经NcoI、XhoI双酶切,回收0.46kb的目的DNA片段;同时以NcoI、XhoI双酶切大肠杆菌表达载体pET28a,回收5.2kb的载体DNA片段;0.46kb的目的DNA片段与5.2kb的载体DNA片段于16℃连接过夜,该连接过夜时间为10-16h,构建成分选酶SortaseA表达载体。
步骤(3.5),将分选酶Sortase A表达载体经热击转化到大肠杆BL21DE3菌感受态细胞中,获得携带有分选酶SortaseA表达载体的原核表达菌。
步骤(3.6),挑取原核表达菌的单菌落,接种至含有卡那霉素的LB培养基中,且每毫升LB液体培养基中含有50ug卡那霉素,37℃培养过夜,该培养过夜时间为10-16h,得到原核表达菌培养物。
步骤(3.7),按原核表达菌培养物:含有卡那霉素的LB培养基=1:100的体积比例,将原核表达菌培养物接种至20mL的含有卡那霉素的LB培养基中,且每毫升LB液体培养基中含有50ug卡那霉素,37℃220r/min,培养至OD600=0.6。
步骤(3.8),将步骤(3.7)的溶液温度降至28℃,加入IPTG,并使IPTG的终浓度为1mmol/L,之后于28℃180r/min,诱导表达6h,得到原核表达菌诱导培养液。
步骤(3.9),取原核表达菌诱导培养液400μL,4℃、10000r/min,离心30s,收集沉淀物,并将沉淀物重悬于5mL裂解缓冲液中,加入50μL 100mg/mL溶菌酶,冰上放置30min,然后400W超声波破碎5min,再依次加入0.5μL 5U/mL DnaseI、5μL 10μg/mL RnaseA、125μL 1mol/L MgCl2、250μL 20%TrionX-100,4℃放置30min,14 000g离心10min,收集上清,得到含有分选酶Sortase A表达产物的上清液。
其中,步骤(2.4)和步骤(3.9)的裂解缓冲液由NaH2PO4、NaCl、Tween-20和去离子水制备而成,且裂解缓冲液中NaH2PO4的浓度为50mmol/L、NaCl的浓度为300mmol/L、Tween-20的体积百分比浓度为0.05%,配制好后用3mol/L NaOH调节至pH=8.0。
步骤(3.10),利用Ni-NTA亲和层析柱(镍柱)对分选酶SortaseA表达产物的上清液进行纯化,得到分选酶SortaseA溶液,包括:
用5mL浓度为20mmol/L咪唑洗涤缓冲液洗平衡Ni-NTA亲和层析柱后,将含有分选酶Sortase A表达产物的上清液过柱,再用5mL浓度为250mmol/L咪唑洗脱液洗脱,收集流出液,得到分选酶SortaseA溶液。
20mmol/L的咪唑洗涤缓冲液由NaH2PO4、NaCl、Tween-20、咪唑和去离子水制备而成,且裂解缓冲液中NaH2PO4的浓度为50mmol/L、NaCl的浓度为300mmol/L、Tween-20的体积百分比浓度为0.05%、咪唑的浓度为20mmol/L,配制好后用3mol/L NaOH调节为pH为7.0。
250mmol/L咪唑洗脱液由NaH2PO4、NaCl、Tween-20、咪唑和去离子水制备而成,且裂解缓冲液中NaH2PO4的浓度为50mmol/L、NaCl的浓度为300mmol/L、Tween-20的体积百分比浓度为0.05%、咪唑的浓度为250mmol/L配制好后用3mol/L NaOH调节为pH为7.0。
步骤(4),以底物蛋白溶液为空白对照组,利用酶标仪对分选酶Sortase A溶液中分选酶SortaseA的活性进行检测
步骤(4.1),将底物蛋白溶液和分选酶SortaseA溶液混合加入到酶标板中,作为检测组,同时以底物蛋白溶液为空白对照组;
步骤(4.2),将酶标板置于37℃,避光孵育1h;
步骤(4.3),酶标仪参数设定为350nm激发,495nm记录,测定每孔的荧光强度;
步骤(4.4),比较空白对照组和检测组的荧光强度大小,判断分选酶Sortase A是否具有活性。
图2为底物蛋白和金黄色葡萄球菌的分选酶Sortase A反应的荧光强度变化图,共计三组平行实验,如图2所示,当底物蛋白和分选酶Sortase A反应后,可以在酶标仪下检测到荧光值升高的现象;而底物蛋白组荧光值很低,说明本发明提供的底物蛋白可以有效的检测分选酶Sortase A的活性。
需要说明的是,上述大肠杆菌BL21DE3感受态细胞和大肠杆菌DH5α感受态细胞均购自新英格兰生物实验室公司,Ni-NTA亲和层析柱由购自德国默克生物科学公司的Ni-NTAHis·Bind树脂(货号70666)和空色谱柱(货号69673)按常规方法制备而成。
需要说明的是上述试验中,利用Ni-NTA亲和层析柱(镍柱)对底物蛋白表达产物进行纯化的步骤,和利用Ni-NTA亲和层析柱(镍柱)对分选酶Sortase A表达产物进行纯化的步骤,均是按照常规的Ni-NTA亲和层析柱(镍柱)使用方法进行纯化的。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!