抗菌肽Lexapeptide及其制备方法和用途与流程
本发明属于肽类抗生素的应用领域,具体涉及一种抗菌肽Lexapeptide及其制备方法和用途。
背景技术:
羊毛硫肽类抗菌肽是一类主要由革兰氏阳性菌产生的抗生素,是由核糖体合成而后经过一系列翻译后修饰进而生成的高度修饰的肽类抗生素。结构上以羊毛硫氨酸、甲基羊毛硫氨酸、脱氢丙氨酸以及脱氢氨基丁酸为特征,同时也因羊毛硫氨酸的存在而得名。羊毛硫肽类抗菌肽一般大小在10-50个氨基酸,结构上存在由半胱氨酸与脱氢丙氨酸/脱氢氨基丁酸形成的含硫羊毛硫氨酸和甲基羊毛硫氨酸环状结构。正是这些结构上的显著特征,赋予了羊毛硫肽类抗菌肽很强的抗菌活性。
作为羊毛硫肽类抗菌肽家族里研究的最为透彻的乳酸链球菌素(Nisin),已经作为食品防腐剂在乳制品及肉制品保鲜中应用长达40余年,而且至今仍未出现大范围耐药性的报道。但是Nisin存在对温度耐受性不足,而且只有在低pH值条件下(pH<7)才能显示出良好的活性。羊毛硫肽类抗菌肽作用靶点通常位于细胞壁或细胞膜上,造成细胞壁或膜的结构不完整,形成孔洞从而杀死细菌,这一杀菌机制也导致羊毛硫肽类抗菌肽的耐药性极少出现。由于传统抗生素的应用出现了大面积的耐药性问题,而羊毛硫肽类抗菌肽对耐药性的金黄色葡萄球菌,耐药性的粪肠球菌显示出良好的抗菌活性,羊毛硫肽类抗菌肽作为现有抗生素的替代品的研究正在成为研究热点。目前已经发现及报道的羊毛硫肽类抗菌肽在50种左右,其中NVB302,mutacin1140,duramycin,gallidermin,lacticin 3147及microbisporicin已经进入临床研究。这样高的临床研究转化率使得羊毛硫肽类抗菌肽在药物研发中极具前景。但是羊毛硫肽类抗菌肽通常存在抗菌谱较窄和抗逆性不足的缺点。因此开发研究新型高效的抗逆性较强的羊毛硫肽类抗菌肽具有重要的价值。链霉菌中存在很多编码羊毛硫肽类抗菌肽的生物合成基因簇,这些基因簇在野生型菌株通常是沉默的,通过异源表达的方法实现这些羊毛硫肽类抗菌肽的生产对于研发新型高效的羊毛硫肽类抗菌肽具有重要意义。
技术实现要素:
本发明旨在从链霉菌中发现高效有活性的抗菌肽,为药物研发提供前体;具体是提供一种新型高效的羊毛硫肽类抗菌肽Lexapeptide及其制备方法和用途。
本发明的目的是通过以下技术方案来实现的:
第一方面,本发明涉及一种羊毛硫肽类抗菌肽Lexapeptide,其包含如SEQ ID NO:1所示的一级氨基酸序列:
Phe-Ser-Pro-Thr-Ile-Pro-Trp-Ala-Ile-Arg-Ala-Thr-Ile-Ile-Thr-Ala-Arg-Ser-Ser-Gln-Gln-Cys-Ala-Ala-Ala-Leu-Gly-Ser-Leu-Thr-Ala-Lys-Thr-Ile-Glu-Lys-Lys-Cys;其中,多个丝氨酸(Ser)和苏氨酸(Thr)被脱水生成脱氢丙氨酸(Dha)和脱氢氨基丁酸(Dhb)。
优选的,所述氨基酸序列中第2、18、19位的丝氨酸脱水生成脱氢丙氨酸,第4、12位的苏氨酸经脱水生成脱氢氨基丁酸,第28位丝氨酸脱水、还原生成D-丙氨酸。
优选的,所述羊毛硫肽类抗菌肽Lexapeptide含有一个甲基羊毛硫氨酸,由所述氨基酸序列中22位的半胱氨酸与33位的苏氨酸之间缩合而成。
优选的,所述氨基酸序列末端第38位的半胱氨酸经历了氧化脱羧反应形成2-氨基乙烯硫醇(2-aminoenethiol),进一步与30位的脱氢氨基丁酸缩合形成稀有的2-氨基烯基-3-甲基-半胱氨酸(AviMeCys)结构。
优选的,所述氨基酸序列N-端的苯丙氨酸的氨基被两个甲基基团进行修饰。
优选的,所述氨基酸序列第28位的丝氨酸被修饰成为D-构型丙氨酸。
所述羊毛硫肽类抗菌肽Lexapeptide的分子式为:
第二方面,本发明还涉及上述任一项所述的羊毛硫肽类抗菌肽Lexapeptide的制备方法,所述方法包括如下步骤:
S1、来源于娄彻氏链霉菌(Streptomyces rochei)Sal35菌株的细菌人工染色体文库在变铅青链霉菌(Streptomyces lividans)SBT5中异源表达,获得重组的变铅青链霉菌(Streptomyces lividans)SBT5/Sal35 6A8 CGMCC No.12751;
S2、所述重组的变铅青链霉菌发酵培养,获得所述羊毛硫肽类抗菌肽Lexapeptide。
优选的,步骤S2中,发酵培养后还包括分离纯化的步骤。
优选的,步骤S2包括:
A1、重组的变铅青链霉菌在发酵培养基YBP上发酵5~8天,收集固体发酵产物;
A2、等体积甲醇浸提固体发酵物若干遍,真空浓缩旋干;
A3、甲醇浸提物用水溶后,等体积正丁醇萃取若干遍,真空浓缩旋干;
A4、正丁醇萃取物经大孔吸附树脂CHP20P,凝胶色谱LH20纯化后经液相分离到纯品Lexapeptide。
优选的,所述分离纯化中采用的高效液相色谱制备条件为:
流动相为:A相为水相(添加1‰三氟乙酸[体积比]),B相为乙腈;
洗脱条件为:40%B相[体积比]等度洗脱15min,流速为0.6ml/min,Lexapeptide在10min洗脱。
第三方面,本发明还涉及一种上述任一项所述的羊毛硫肽类抗菌肽Lexapeptide在制备抗革兰氏阳性菌制剂中的用途。
第四方面,本发明还涉及一种上述任一项所述的羊毛硫肽类抗菌肽Lexapeptide在制备用于治疗细菌、真菌或病毒感染药物中的用途。
优选的,所述治疗细菌、真菌或病毒感染药物为治疗耐甲氧西林的金黄色葡萄球菌或表皮葡萄球菌感染的药物。
第五方面,本发明还涉及一种上述任一项所述的羊毛硫肽类抗菌肽Lexapeptide在制备动物饲料中的用途。
第六方面,本发明还涉及一种药物组合物,该组合物以上述任一项所述的羊毛硫肽类抗菌肽Lexapeptide或其药学上可接受的盐作为活性成分。
优选的,所述组合物还含有可药用赋形剂、载体或稀释剂。
第七方面,本发明还涉及一种变铅青链霉菌(Streptomyces lividans)SBT5/Sal35 6A8 CGMCC No.12751。
该基因工程重组的变铅青链霉菌制备方法为:筛选来源于娄彻氏链霉菌(Streptomyces rochei)Sal35菌株的细菌人工染色体(BAC,Bacterial Artificial Chromosome)文库,获得阳性BAC SAL35-6A8;SAL35-6A8导入异源表达宿主变铅青链霉菌(Streptomyces lividans)SBT5中,获得产生Lexapeptide的重组变铅青链霉菌Streptomyces lividans SBT5/Sa15 6A8。
本发明中,所述变铅青链霉菌(Streptomyces lividans)SBT5/Sal35 6A8已于2016年7月11日递交中国微生物菌种保藏管理委员会普通微生物中心保藏(地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所邮编100101),菌种保藏编号为CGMCC No.12751。
进一步对新型羊毛硫肽类抗菌肽Lexapeptide进行抗菌实验,对耐甲氧西林的金黄色葡萄球菌及表皮葡萄球菌进行抑菌实验,与万古霉素抑菌效果相当。对耐甲氧西林的金黄色葡萄球菌及表皮葡萄球菌的MIC值分别为0.52μM及1.03μM;万古霉素相应的MIC值为0.61μM及1.21μM。
与现有技术相比,本发明具有如下有益成果:
1、本发明公开了一种新型高效的羊毛硫肽类抗菌肽Lexapeptide。源于娄彻氏链霉菌(Streptomyces rochei Sal35)Sal35菌株的细菌人工染色体文库在变铅青链霉菌(Streptomyces lividans)SBT5中异源表达后分离得到的新化合物;Lexapeptide由38个氨基酸构成,分子式为:C179H286N50042S2,结构式如图8所示,相对分子质量为:3872.61g/mol。
2、Lexapeptide为第一例报道的同时包含C末端2-氨基烯基-3-甲基-半胱氨酸结构和N末端甲基化修饰结构的羊毛硫肽,这种结构上的高度修饰赋予了Lexapeptide相对于其它羊毛硫肽类抗菌肽更好的稳定性;相较于Nisin对温度(50℃)及pH(2~12)有更好的耐受性。
3、生物活性测定发现Lexapeptide对临床上广泛存在的耐甲氧西林的金黄色葡萄球菌及表皮葡萄球菌具有非常好的抑菌活性,其抑菌活性与临床应用抗生素的最后一道防线万古霉素相当甚至优于万古霉素,对革兰氏阴性菌没有抑制活性。对耻垢分枝杆菌mc2155显示出了优于Nisin的抑菌活性。
4、Lexapeptide可以用作抗革兰氏阳性菌制剂,对临床普遍遇到的耐药性问题提供解决方案。
5、基于羊毛硫肽类抗菌肽的抑菌机制不同于万古霉素,Lexapeptide有潜在的用于临床辅助或替代万古霉素的应用价值。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为携带Lexapeptide的细菌人工染色体在变铅青链霉菌中表达生测图;重组菌株Streptomyces lividans SBT5/Sal35 6A8在筛选平板上能够显著抑制生测指示菌金黄色葡萄球菌的生长。
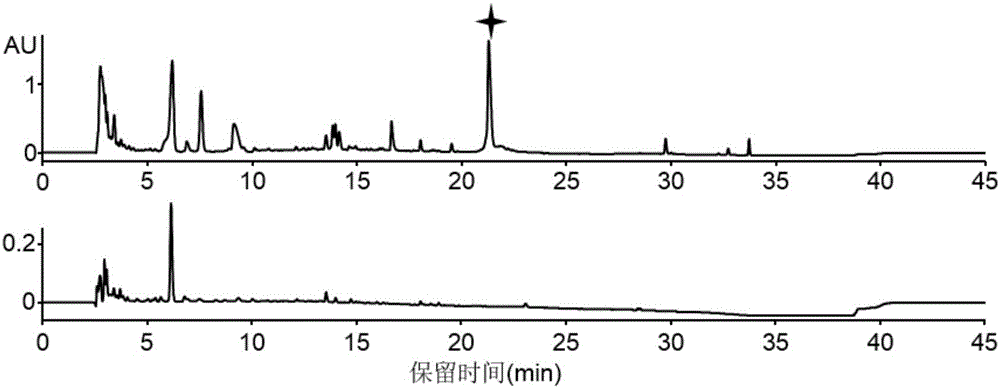
图2为Lexapeptide表达的液相检测图谱;Lexapeptide在21min左右洗脱,图中以星号标注的色谱峰即为Lexapeptide。
图3为Lexapeptide纯化的液相图谱;Lexapeptide在10min左右洗脱,图中以星号标注的色谱峰即为Lexapeptide。
图4为Lexapeptide的MALDI-FTICR检测质谱图。
图5为Lexapeptide的ESI-FTICR串联质谱图;Lexapeptide的b/y碎片见图中标注。
图6为Lexapeptide结构以及串联质谱碎裂行为图。
图7为Lexapeptide活性测试以及抗逆性研究示意图;其中,a为Lexapeptide(100μg/ml)及Nisin(100μg/ml)对耻垢分枝杆菌的生物活性测试图。b为Lexapeptide(100μg/ml)及Nisin(50μg/ml)经不同pH的PBS缓冲液处理后对藤黄微球菌的生物活性测试图。c为Lexapeptide(100μg/ml)及Nisin(100μg/ml)经50℃处理不同天数后的生物活性测试图。
图8为羊毛硫肽类抗菌肽Lexapeptide的分子结构示意图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
本发明涉及一种新型高效的羊毛硫肽类抗菌肽Lexapeptide及其制备方法和用途;其中,
LB培养基:用于大肠杆菌的培养;
胰蛋白胨10g,酵母提取物5g,氯化钠5g,去离子水定容至1,000ml,pH 7.0。
2×YT培养基:大肠杆菌一链霉菌属间接合转移;
胰蛋白胨16g,酵母提取物10g,氯化钠5g,去离子水定容至1,000ml,pH 7.0。
Mueller Hinton培养基:MIC测定时培养金黄色葡萄球菌、表皮葡萄球菌等用,购自0xoid。
SFM培养基:链霉菌培养产孢和大肠杆菌-链霉菌属间接合转移;
黄豆饼粉20g,甘露醇20g,自来水定容至1,000ml,pH 7.2~7.4。
黄豆饼粉20g先用1,000ml自来水浸泡,121℃灭菌20min,然后过滤收集黄豆饼粉浸提液配制培养基。
YBP培养基:链霉菌发酵用;
葡萄糖10g,酵母提取物2g,牛肉提取物2g,蛋白胨4g,MgSO41g,NaCl 15g,自来水定容至1,000ml,pH 7.2~7.4。
相应固体培养基需要添加15g琼脂粉,SFM固体培养基添加20g琼脂粉。
本发明所涉及的娄彻氏链霉菌Streptomyces rochei Sal35,系中国典型培养物保藏中心(CCTCC)的AA97007暗黑链霉菌,分离自神农架山区,在文献“Xu M,Wang Y,Zhao Z,Gao G,Huang S-X,Kang Q,He X,Lin S,Pang X,Deng Z,Tao M.2016.Functional genome mining for metabolites encoded by large gene clusters through heterologous expression of a whole-genome bacterial artificial chromosome library in Streptomyces spp.Appl.Environ.Microbiol.doi:10.1128/AEM.01383-16.”中公开过。
异源表达宿主Streptomyces lividans SBT5在文献“白亭丽,俞燕飞,徐钟,陶美凤;变铅青链霉菌高效异源表达宿主SBT5的构建,2014,华中农业大学学报”中公开过,公众可以从上海交通大学微生物代谢国家重点实验室获得。
本发明所涉及的接合转移辅助菌株Escherichia coli ET12567/pUB307在文献“Flett F,Mersinias V,Smith CP;Highefficiencyintergenericconjugal transfer of plasmid DNA from Escherichia coli to methyl DNA-restricting streptomycetes.1997,FEMS Microbiol Lett 155(2):223-229.”中公开过。
本发明所涉及的生物活性测定的菌株金黄色葡萄球菌Staphylococcus aureus ATCC 29213由ATCC获取,公众可以从美国模式培养物集存库(ATCC)获取。
粪肠球菌Enterococcus faecalis ATCC 29212由中国科学院南海海洋研究所鞠建华老师惠赠,具有耐氨苄青霉素和耐卡那霉素的性状。公众可以从美国模式培养物集存库(ATCC)获取。
耐甲氧西林金黄色葡萄球菌(Methicillin Resistant Staphylococcus aureus,MRSA)以及耐甲氧西林表皮葡萄球菌(Methicillin Resistant Staphylococcus epidermis,MRSE)均由中国科学院南海海洋研究所鞠建华老师惠赠。
耻垢分枝杆菌Mycobacteria smegmatis mc2155由山东大学庞秀华教授惠赠。藤黄微球菌Micrococcus luteus ATCC4698由福建微生物所彭飞老师惠赠,公众可以从美国模式培养物集存库(ATCC)获取。
实施例1、含有Lexapeptide生物合成基因簇的细菌人工染色体的异源表达
(一),从-80℃冰箱中取出娄彻氏链霉菌(Streptomyces rochei)Sal35的细菌人工染色体文库(8块96孔板),37℃培养箱放置2小时至融化完全。
(二)在96孔板中加入130μl新鲜LB培养基,利用复制器将娄彻氏链霉菌(Streptomyces rochei)Sal35的细菌人工染色体文库接种至96孔板中,37℃,220rpm培养4~6小时。
(三)与此同时,在盛有100ml含50μg/m1卡那霉素LB培养基的250ml三角瓶中接种ET12567/pUB307菌株,37℃,220rpm培养4~6小时。
(四)4,000rpm离心10min收集ET12567/pUB307菌体,用新鲜的LB培养基洗涤3遍,再用15ml新鲜LB重悬。
(五)利用排枪取15μl浓缩的ET12567/pUB307菌液加入培养娄彻氏链霉菌(Streptomyces rochei)Sal35的细菌人工染色体文库的96孔板的每个孔中。200rpm继续培养5min,充分混匀。
(六)利用复制器将混合的菌液影印到均匀涂布了一层热激过的变铅青链霉菌(Streptomyces lividans)SBT5孢子的SFM平板,在生物安全柜中吹干,30℃培养12~16小时。
(七)在SFM平板上覆盖三甲氧苄啶和阿泊拉霉素至终浓度为50μg/ml,在生物安全柜中吹干,30℃培养4~6天至接合转移子长出。
(八)利用复制器将长出的接合转移子影印至含有萘啶酮酸(25μg/ml)和阿泊拉霉素(50μg/ml)的SFM平板上除去残留的大肠杆菌和受体菌变铅青链霉菌(Streptomyces lividans)SBT5,30℃培养4~6天至产孢完全。
(九)利用复制器将产孢的接合转移子转移至发酵培养基YBP上,30℃发酵培养4~6天至产素完全。
(十)在产素完全的平板上覆盖一层含有1%金黄色葡萄球菌的软琼脂(0.5%琼脂),37℃培养过夜,观察抑菌圈的生成。观察到的抑菌圈如图1所示,6A8克隆发酵产生的化合物能够显著抑制生测指示菌金黄色葡萄球菌的生长。得到含有Lexapeptide的细菌人工染色体的表达菌株变铅青链霉菌(Streptomyces lividans)SBT5/Sal35 6A8 CGMCC No.12751。
实施例2、Lexapeptide的检测
(一)从娄彻氏链霉菌(Streptomyces rochei)Sal35的细菌人工染色体文库中挑选出6A8克隆进行培养。然后通过大肠杆菌-链霉菌属间接合转移将细菌人工染色体导入异源表达宿主Streptomyces lividans SBT5中得到能够产生Lexapeptide的菌株变铅青链霉菌(Streptomyces lividans)SBT5/Sal35 6A8 CGMCC No.12751。
(二)将产Lexapeptide的细菌人工染色体异源表达菌株接种至固体YBP培养基上,每个菌株发酵3块平板,30℃发酵培养4~6天。
(三)发酵结束后,收集固体发酵物,用等体积甲醇萃取3遍,真空浓缩旋干得到甲醇粗提物。
(四)将甲醇粗提物用10ml无菌水溶解,用等体积正丁醇萃取3遍,真空浓缩旋干得到正丁醇粗提物,用2ml甲醇溶解样品。
(五)12,000rpm离心10min,用0.22μm滤膜过滤甲醇样品后,进行高效液相色谱分析,进样量为10μl。液相分析色谱柱型号为:Agilent Zorbax 300SB-C18(5μm,4.6×250mm)。
流动相为:
A相为水相(添加1‰三氟乙酸),
B相为乙腈。
分析条件为:0-5min,5%B;5-20min,B相由5%浓度升至50%;20-30min,B相由50%浓度升至100%;30-35min,B相100%浓度维持5min:35-36min,B相由100%浓度降至5%;36-45min,B相5%浓度平衡9min。流速为0.6ml/min,室温。Lexapeptide在21min洗脱出来,如图2中所示,Lexapeptide对应洗脱峰以星号注明。
实施例3、Lexapeptide的纯化及鉴定
经实施例2中分析以变铅青链霉菌(Streptomyces lividans)SBT5/Sal35 6A8 CGMCC No.12751菌株出发积累Lexapeptide进行纯化和鉴定。
(一)将Streptomyces lividans SBT5/Sal35 6A8 CGMCC No.12751菌株接种至SFM平板上进行产孢,30℃培养7天至产孢完全。Lexapeptide对菌株生长有明显抑制,产孢时间显著往后推迟。
(二)将Streptomyces lividans SBT5/Sal35 6A8 CGMCC No.12751菌株新鲜孢子接种至30L固体YBP培养基上进行Lexapeptide的大规模发酵积累,30℃发酵培养4~6天。
(三)收集Streptomyces lividans SBT5/Sal35 6A8 CGMCC No.12751菌株的固体发酵物,等体积甲醇(30L)浸提3遍,真空浓缩旋干得甲醇粗提物。
(四)将甲醇粗提物溶于1L无菌水中,用1L正丁醇萃取3遍,将正丁醇相真空浓缩旋干,得正丁醇粗提物。
(五)干法上样将正丁醇粗提物与CHP20P填料拌匀,将拌好的填料装到CHP20P开放柱上(50×500mm),甲醇和水进行梯度洗脱。甲醇洗脱浓度升至80%时,Lexapeptide开始洗脱直至甲醇洗脱浓度升至100%。收集80-100%甲醇洗脱组分,真空浓缩旋干。
(六)将CHP20P柱洗脱组分重新用甲醇溶解,用0.22μm滤膜过滤得澄清甲醇溶液。将甲醇样品上样到装有LH20填料的层析柱上(20×1500mm),纯甲醇以10滴/s的速度洗脱,收集馏分至试管中,每管5ml。收集的馏分进行高效液相色谱检测,合并含有Lexapeptide的馏分进行下一步分析。
(七)收集LH20柱洗脱含有Lexapeptide的组分,真空浓缩旋干,重新用甲醇溶解。用0.22μm滤膜过滤得澄清甲醇溶液,进行高效液相色谱分离纯化,进样量10~20μl。液相分析色谱柱型号为:Agilent Zorbax 300SB-C18(5μm,4.6×250mm)
流动相为:
A相为水相(添加1‰三氟乙酸),
B相为乙腈。
分析条件为40%B相等度洗脱15min,流速为0.6ml/min。Lexapeptide在10min左右开始洗脱,11.5min左右洗脱结束,收集Lexapeptide单一峰洗脱组分进行分析。Lexapeptide洗脱色谱峰见图3,图中以星号标注的色谱峰即为Lexapeptide。
(八)对纯化的Lexapeptide进行质谱分析确定其分子量,利用MALDI-FTICR MS测得Lexapeptide的分子量为3872.16Da。Lexapeptide的分子量确定如图4所示。
(九)利用ESI-FTICR-MS/MS对Lexapeptide进行串联质谱分析确定其结构。选择母离子[M+4H]4+=969.00Da进行二级质谱分析,串联质谱所获得Lexapeptide的‘b/y’碎片离子见图5,碎片离子对应Lexapeptide片段见图6。
实施例4、Lexapeptide的生物活性测定
Lexapeptide的最低抑菌浓度(MIC)值依据微孔板法测定,待测试的菌株为金黄色葡萄球菌ATCC25923,耐甲氧西林金黄色葡萄球菌(MRSA),耐甲氧西林表皮葡萄球菌(MRSE)以及粪肠球菌ATCC29212。MIC值定义为抑制超过90%浓度菌株生长的最低抗生素浓度。以氨苄青霉素、卡那霉素及万古霉素作为对照,每个样品3个平行。
(一)选用Mueller-Hinton(MH)肉汤培养基培养实验菌,37℃过夜培养12-16小时。在实验菌长好之前准备好样品溶液。
(二)配制样品溶液,以DMSO溶解样品(氨苄青霉素Ampicillin、卡那霉素Kanamycin、万古霉素Vancomycin及Lexapeptide)分别制成浓度为32mg/ml、32mg/ml、3.2mg/ml及6.4mg/ml的母液。
(三)在96孔板中加入无菌MH肉汤培养基,第1列加入184μl无菌MH肉汤,其余各列分别加入100μl无菌MH肉汤。第11列和第12列分别作为阳性对照和阴性对照。
(四)吸取16μl配制好的母液加入第1列96孔板中,利用移液器轻轻吹打混匀。
(五)从第1列中吸取100μl混有抗生素的培养液至第2列中,用移液器轻轻吹打混匀后再吸出100μl至第3列中,依此类推稀释至第10列。第10列混匀后吸出多余的100μl培养液弃去。
(六)将过夜培养的菌体用新鲜的MH肉汤培养基稀释1000倍,取100μl稀释的菌液加入第1列至第11列的孔中,第12列加入100μl新鲜的MH肉汤培养基作为空白对照。如此得到氨苄青霉素和卡那霉素的药物浓度梯度为:1280,640,320,160,80,40,20,10,5,2.5μg/ml;万古霉素的药物浓度梯度为:128,64,32,16,8,4,2,1,0.5,0.25μg/ml;Lexapeptide的药物浓度梯度为:256,128,64,32,16,8,4,2,1,0.5μg/ml。
(七)盖上96孔板盖,于37℃培养箱过夜培养16-24小时。
(八)以第11列为阳性对照,第12列为空白对照,利用酶标仪在OD600下读取菌浓,确定每个样品的MIC值,如下表1所示。
表1 Lexapeptide及相关抗生素的最低抑菌浓度(MICμg/ml)
表1中MIC数据系以质量浓度表示;若换算成摩尔浓度,万古霉素对耐甲氧西林金黄色葡萄球菌(MRSA)以及耐甲氧西林表皮葡萄球菌(MRSE)的MIC浓度分别为0.61μM和1.21μM;Lexapeptide对耐甲氧西林金黄色葡萄球菌以及耐甲氧西林表皮葡萄球菌的MIC浓度分别为0.52μM以及1.03μM。因此,Lexapeptide抑菌效果与万古霉素相当。
Lexapeptide对耻垢分枝杆菌(Mycobacteria smegmatis mc2155)抑菌活性的测定:
用100mM Tris-HCl(pH 7.0)配制100μg/ml的Lexapeptide及Nisin溶液。取30μl加入到打有小孔的耻垢分枝杆菌的生测平板上,37℃培养24小时观察抑菌圈的形成。等浓度的Lexapeptide对耻垢分枝杆菌的活性优于Nisin,见图7a,在该实例中Lexapeptide对耻垢分枝杆菌有抑制活性,而Nisin没有活性。
实施例5、Lexapeptide的抗逆性研究。
(一)pH抗逆性研究:配制PBS缓冲液,用磷酸或盐酸调节至不同pH值待用(2,4,6,8,10,12)。用PBS缓冲液配制100μg/ml的Lexapeptide及50μg/ml Nisin母液。取6μl Lexapeptide以及Nisin母液分别加入24μl不同pH值的缓冲液中,室温静置2小时。将30μl样品加入到打有小孔的藤黄微球菌的生测平板上,30℃培养24小时观察抑菌圈的形成。
生测结果见图7b,由图可知在碱性pH范围内Nisin的活性显著减弱,至pH值为12时完全丧失抑菌活性。然而Lexapeptide在所测试的pH值范围内均显示出与对照相当的抑菌活性。表明Lexapeptide对酸、碱均有有更强的耐受性。
(二)温度抗逆性研究:用100mM Tris-HCl(pH 7.0)配制Lexapeptide和Nisin的溶液。将Lexapeptide(100μg/ml)和Nisin(100μg/ml)置于50℃水浴温浴8天,每天取30μl留样进行生物活性测定。将处理后的样品加入打有小孔的藤黄微球菌的生测平板上,30℃培养24小时观察抑菌圈的形成。
生测结果见图7c,由图可知Nisin经50℃处理一天后抑菌活性逐渐减弱,至5天基本完全丧失活性。Lexapeptide则对温度表现出了良好的耐受性,处理8天后活性仍然与未处理的Lexapeptide对照样品活性相当。延长温浴时间至10天,Lexapeptide的活性仍不受影响。由此可见Lexapeptide较之Nisin对温度有更好的耐受性。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!