羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4及其应用的制作方法
本发明属于动物分子生物学领域,涉及一种羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4及其应用。
背景技术:
羊传染性脓疱病(Orf)由羊口疮病毒(Orf Virus,ORFV)引起,是世界范围内危害养羊业发展的人畜共患疾病之一。ORFV不仅能引起小型反刍动物和部分野生动物感染,还可能污染环境,造成与受污染环境密切接触的人员感染发病。ORFV的基因组大小为134kb~139kb,为线性双股DNA,G+C含量丰富占整个基因组的63%~65%,有132个基因。病毒基因组的中心区域为一个长的中心编码区(ORF001~ORF134),编码区两端是相同的反向末端重复序列。其中,B2L(ORF011)基因位于中心保守区,且G+C含量约占B2L总序列的63.3%,使得B2L基因具有很高的稳定性。国内外常利用B2L基因的稳定性开展同源性分析比较和构建进化树,鉴定病毒,从分子水平了解毒株间亲缘关系以及变异情况。
病毒的糖蛋白是研究病毒与宿主相互作用的一个重要靶蛋白。目前对B2L蛋白如何参与病毒与宿主的相互作用还不清楚。2013年张克山等基于蛋白B2L的氨基酸序列,通过比较和进化树分析了34株国内外已测序公布B2L基因序列的羊口疮病毒,有14个株是于2009年至2011年间在国内发生的。将毒株分为3个基因型,其中基因型Ⅰ的羊口疮广泛分布于中部以及南部省份,与德国已发现的D1701株具有同源性,占国内总数的11/14,基因型Ⅱ的羊口疮分布于宁夏以及吉林,与印度发现的分离株具有同源性,占国内总数的2/14,基因型Ⅲ的羊口疮分布于东部的山东,与美国、新西兰以及韩国发现的羊口疮具有同源性,占国内总数的1/14。随后对发现的弱毒株与强毒株蛋白B2L的氨基酸序列进行多重比对,发现有11个氨基酸的突变位点可能是导致ORFV毒力变弱的原因。
利用黑龙江大庆地区发现Orf疑似病例,通过病原分离、病毒形态学观察、间接免疫荧光检测(IFA)、DNA序列和氨基酸序列比对、家兔和小鼠的感染试验以及回归动物试验等,最终确定获得一株ORFV,命名为OV/HLJ/04。流行株之间遗传关系分析基于B2L基因的系统发育进化树表明OV/HLJ/04应当归类于基因Ⅲ型ORFV。
选择ORFV的B2L基因为靶基因,构建原核表达载体,将表达产物纯化后用于免疫4~6周龄的雌性BALB/c小鼠,制备单克隆抗体。通过杂交瘤技术获得了3株能够稳定分泌特异性抗体的杂交瘤细胞株,其中2E4具备中和ORFV毒力的能力。抗体的间接ELISA试验和Western Blot证明,2E4能够特异性识别B2L蛋白,显示出良好的抗体—抗原特异性。B2L蛋白单抗的制备、生物学特性分析和单抗腹水制备,为ORFV的实验室诊断提供了更为便捷的方法。
ORFV B2L蛋白单克隆抗体,与常规免疫血清相比具有高度的同质性和特异性的优点,在疾病诊断、治疗方面和遗传学研究等应用性潜力巨大。尽管如此,国内外研究ORFV单抗及其应用的工作并不多见,进展不大。因此,对于ORFV单抗2E4的详细研究显得尤为重要。
技术实现要素:
本发明的第一目的是提供一种羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4的轻链可变区和重链可变区的氨基酸序列,对ORFV单抗2E4做一步的详细研究。
本发明的第二目的是提供上述羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4的编码基因。
本发明的第三目的是提供上述羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4的编码基因的特异性PCR引物。
本发明的第四目的是提供上述羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4的用途。
本发明通过以下技术方案来实现:
一、一种羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4,其轻链可变区的氨基酸序列如SEQ ID No.2所示,其重链可变区的氨基酸序列如SEQ ID No.4所示。
二、上述的羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4的编码基因,其轻链可变区的核苷酸序列如SEQ ID No.1所示,其重链可变区的核苷酸序列如SEQ IDNo.3所示。
三、上述的羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4的编码基因的特异性PCR引物,序列如下:
轻链可变区:
上游引物2E4LF:CAGCTG ACCCAGTCTCCAGC;(SEQ ID No.5)
下上游引物2E4LR:CCGTTTTATTTCCAGCTTGG TCCC;(SEQ ID No.6)
重链可变区:
上游引物:2E4HF:GTCCAACTACAG CAGCCTGGG;(SEQ ID No.7)
下游引物2E4HR:TGAGGAGA CTGTGAGAGTGGTG。(SEQ ID No.8)
四、上述的羊传染性脓疱病毒流行株OV/HLJ/04单克隆抗体2E4在制备治疗羊口疮药物中的应用。
具体如下:将单克隆抗体2E4的杂交瘤细胞株培养至对数生长期,抽提总RNA并合成cDNA,以cDNA为模板,利用设计的鼠源抗体可变区基因特异性引物,分别扩增抗体轻重链可变区基因,并将PCR产物分别克隆于pMD18T载体,送上海生工公司测序。根据测序结果,利用GenBank数据库进行BLAST搜索,从而获得单抗2E4轻重链可变区序列基因中CDRs和FRs结构域一级结构。继而,采用SWISS-MODEL网络平台和Discovery Studio(DS)Modeling 1.1软件成功模拟了抗体单链链可变区(single-chain variable fragment,scFv)氨基酸的3D空间构型,在分子层面上阐述和分析了2E4抗体可变区特征。
采用上述技术方案的积极效果:本发明对ORFV单抗2E4的序列进行了精确鉴定,并对该抗体的氨基酸的3D空间构型进行了模拟,在分子层面上阐述和分析了2E4抗体可变区特征,不仅可以提供单克隆抗体在氨基酸水平上与其表位相互作用的关键数据,并有助于今后研制羊口疮诊断制剂和开发基因工程抗体制剂。
附图说明
图1是2E4单抗杂交瘤细胞培养状态,A:杂交瘤细胞(10×);B:杂交瘤细胞(20×);
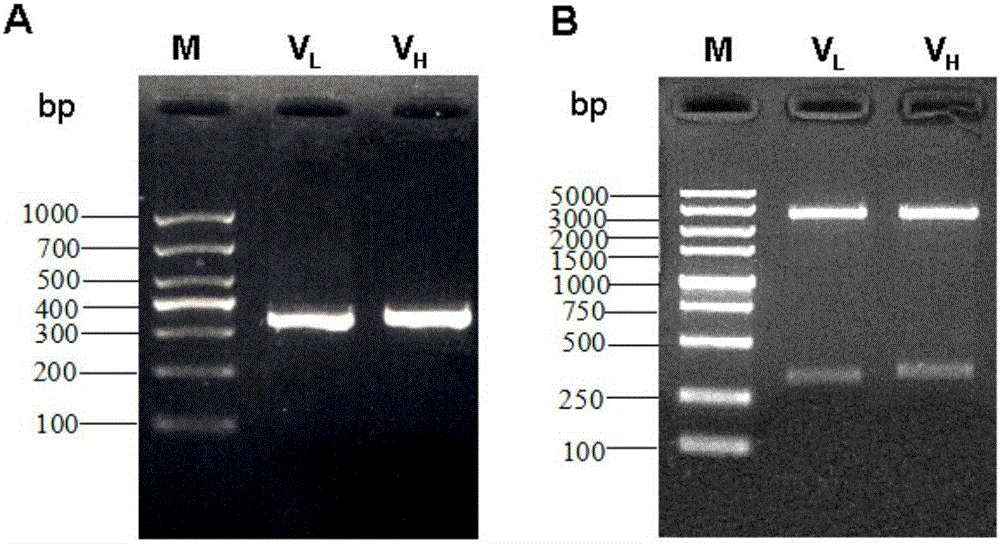
图2是2E4抗体轻链和重链PCR扩增和酶切鉴定结果;
图3是2E4轻链可变区序列及其功能区,CDR1-3:互补决定区;FR1-3:骨架区;
图4是2E4重链可变区序列及其功能区,CDR1-3:互补决定区;FR1-3:骨架区;
图5是2E4轻链可变区进行IgBLAST分析结果;
图6是2E4重链可变区进行IgBLAST分析结果;
图7是2E4轻链可变区(VL)二级结构和三级机构;
图8是2E4重链可变区(VH)二级结构和三级机构;
图9是2E4重链可变区/轻链可变区(VH-VL)二级结构和三级机构;
图10是2E4重链可变区/轻链可变区(VH-VL)三级机构及其结构域,图中,虚线 的椭圆形区域代表抗体特异性结构域(其中两个CDR3起关键作用,而两个CDR1和两个CDR2只负责辅助CDR3共同形成该结构域);绿色箭头表示几个CDR对抗体结构域的形成具有辅助作用;白色箭头表示该结构域可促进抗原表位锚定于此空间构象之中。
具体实施方式
本发明中生物材料的来源:
1、单克隆抗体2E4的杂交瘤细胞:羊口疮病毒的分离鉴定及B2L囊膜蛋白单克隆抗体的制备,谭强,硕士论文,授予单位:黑龙江八一农垦大学,导师:崔玉东,发表时间:2014年,并由申请人保证从本申请日起二十年内向公众发放该生物材料;
2、所有引物为自行设计并委托金唯智北京公司合成。
下面结合具体的实施方式对本发明的技术方案做进一步的说明,但不应理解为对本发明的限制:
实施例1
本实施例说明杂交瘤细胞的复苏、传代培养和抗体检测。
(1)杂交瘤细胞的复苏、传代培养将冻存的2E4单抗杂交瘤细胞从液氮罐中取出后,快速放入37℃水浴锅中,10~30秒摇动一次,直到融化。从水浴锅中取出并移入超净工作台内,用移液枪转入到15mL离心管内,并加入37℃预热的无血清的RPMI-1640细胞培养液10mL,2000rpm离心3min,弃上清。用10mL经过预热的RPMI-1640完全培养液(10%FBS,1%青链霉素)重悬管内细胞,至细胞完全混匀,然后将细胞悬液全部移入10cm培养皿内,最后将培养皿移入CO2细胞培养箱中培养。杂交瘤细胞传代按照实验室常规方法进行。杂交瘤细胞培养状态如图1所示。
(2)抗体ELISA检测用提纯的病毒抗原包被于微孔板中,4℃过夜。5%脱脂乳封闭,37℃1h,PBS洗板。加入100μL杂交瘤细胞培养上清,37℃温育1h后洗涤,加入1:5000稀释的HRP标记的羊抗鼠二抗,洗涤后加入底物TMB,避光显色10min,用2M H2SO4终止反应,于波长450nm测定吸光值。结果如表1所示,抗体滴度达到1:1280。
表1 2E4杂交瘤细胞上清抗体滴度检测效价结果
实施例2
本实施例说明杂交瘤细胞总RNA的提取。
将2E4杂交瘤细胞培养至最佳状态,细胞数量约为1×107/ml,3000rpm离心3min洗涤细胞;加入1ml Trizol溶液使细胞沉淀轻微震荡溶解,充分混匀后室温静置5min;加入200μL氯仿,充分震荡混匀,4℃12000rpm离心15min;取上层水相500μL并加入500μL异丙醇,充分混匀后于-20℃静止沉淀1h;4℃12000rpm离心10min,弃去上清液;用提前预冷的1ml 75%乙醇洗涤沉淀,4℃12000rpm离心5min,弃去上清液;干燥RNA,溶于20μL经DEPC处理的水中,可55-60℃水浴助溶,-20℃保存备用。用核酸分析仪测定提取RNA的浓度及质量。
实施例3
本实施例说明RT-PCR扩增VL、VH基因。
为了去除残存的基因组DNA对RNA产生的影响,反应体系如下:提取的RNA样品1μL,5×gDNA Eraser Buffer 2μL,gDNA Eraser 1μL,灭菌水6μL,总体积为10μL。该反应于42℃水浴2min或室温静止5min,4℃保存备用。反转录反应体系如下:上述反应液10μL,Buffer 2(for Real Time)4μL,RT Enzyme MixI 1μL,RT Primer Mix 1μL,灭菌水4μL,总体积为20μL。该反应于37℃水浴15min,85℃5s,反转录为cDNA后用核酸分析仪测定其浓度,4℃保存备用。以cDNA为模板进行PCR扩增,根据GenBank中鼠源单克隆抗体的参考序列设计特异性PCR引物,序列如下:
轻链可变区:
上游引物2E4LF:CAGCTG ACCCAGTCTCCAGC(SEQ ID No.5);
下上游引物2E4LR:CCGTTTTATTTCCAGCTTGG TCCC(SEQ ID No.6);
重链可变区:
上游引物:2E4HF:GTCCAACTACAG CAGCCTGGG(SEQ ID No.7);
下游引物2E4HR:TGAGGAGACTGTGAGAGTGGTG(SEQ ID No.8)。
反应体系如下:cDNA 1μL,dNTPs 2μL,轻/重链上、下游引物各0.5μL,10×Trans HiFi Buffer I 2.5μL,TransHiFi DNA Polymerase 0.25μL,灭菌水18.25μL, 总体积为25μL。PCR反应条件:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。取扩增产物5μL于含有1%琼脂糖凝胶电泳进行检测。
结果:VL基因片段大小为330bp,VH基因片段大小为360bp,与预期的VL和VH基因片段大小相符(图2-A);PCR产物连接T载体后,酶切鉴定结果如图2-B所示。
实施例4
本实施例说明PCR产物克隆质粒的鉴定及测序。
参照OMEGA胶回收试剂盒说明书回收轻、重链PCR产物。连接体系分别共10μL:回收的PCR产物4.5μL,PMD18-T Vector 0.5μL,Solution I 5μL,16℃连接过夜。取10μL连接产物于100μL DH5α感受态细胞悬液中,冰浴30min,42℃热击90s,冰浴5min后加入LB液体培养基700μL,37℃振荡培养1h;5000r/min离心10min,弃上清液留约100μL,重悬沉淀,涂布于含Amp的LB平板上,37℃培养14h,挑取单菌落小量培养,参照OMEGA质粒小提试剂盒说明书提取重组质粒。
分别以轻、重链重组质粒为模板,进行PCR扩增鉴定,并用BamH I和Hind III酶切(37℃酶切1h)鉴定,于2%琼脂糖凝胶电泳观察结果。取鉴定为阳性的重组质粒送生工生物工程(上海)股份有限公司进行测序。
实施例5
本实施例说明可变区测序结果BLAST和功能区分析。
由于单抗2E4的VH和VL测序结果,上传GenBank进行BLIAST搜索,从而获得轻重链可变区CDR和FR框架结构数据。结果如图3、图4所示。然后按Kabat等(72)的方法对VH和VL基因片段进行序列分析。发现所展示的可变区信息与IgG的抗体信息同源性较高,如图5、图6所示。表位与国外报道的位置相似,因此将4B2与国外先前发表的相关单抗进行抗体重链可变区包括互补决定区序列氨基酸同源性比对,确定单抗之间的异同点,进而分析确定表位间的远近关系。利用SWISS-MODEL和Discovery Studio(DS)Modeling 1.1生物信息软件对于所建的分子模型优化处理。在模型中找到相关表位或位点位置,在空间结构下分析表位特征。结果如图7-10所示。
本发明对ORFV单抗2E4的序列进行了精确鉴定,并对该抗体的氨基酸的3D空间构型进行了模拟,在分子层面上阐述和分析了2E4抗体可变区特征,不仅可以提供 单克隆抗体在氨基酸水平上与其表位相互作用的关键数据,并有助于今后研制羊口疮诊断制剂和开发基因工程抗体制剂。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于羊传染性脓疱病毒分离培养和增殖的细胞系及其制备方法和应用的制作方法
- 一种羊传染性脓疱病毒细胞弱毒疫苗及其制备方法和应用的制作方法
- 羊传染性脓疱病毒细胞弱毒疫苗耐热冻干保护剂及其制备方法和应用的制作方法
- 抗羊病毒性疾病卵黄抗体饲料添加剂和注射剂及制备方法
- 一种基于羊传染性脓疱病毒b2l基因的dna疫苗载体及其制备方法和应用的制作方法
- 用于局部使用1-氨基-烷基环己烷衍生物的凝胶制剂的制作方法
- 一种治疗羊传染性脓疱病毒的擦剂及其制备方法
- 一种用于检测羊传染性脓疱皮炎病毒的试剂盒及其检测方法
- 羊传染性脓疱病毒pcr诊断试剂盒的制作方法
- 一种羊口疮病毒蛋白orfv059单克隆抗体杂交瘤g3及单克隆抗体的制作方法