涉及工程化Fc构建体的组合物和方法与流程
治疗性蛋白质,例如治疗性抗体和Fc-融合蛋白质已快速成为一种用于患有免疫学疾病和炎症疾病的患者的临床上重要的药物类别。
发明概述
本发明涉及具有生物活性的含Fc结构域的治疗性构建体。此类构建体可以具有令人希望的血清半衰期和/或针对Fc受体的结合亲和力和/或亲合力。这些构建体可以适用于例如减轻受试者中的炎症、促进受试者中的自身抗体清除、抑制受试者中的抗原呈递、阻断受试者中的免疫应答(例如,阻断该免疫应答基于免疫复合物的激活)、并且治疗受试者中的免疫学疾病和炎症疾病(例如,自身免疫性疾病)。在此描述的Fc构建体可以用于治疗患有免疫学疾病和炎症疾病的患者而不需要显著刺激免疫细胞。
总的来说,本发明涉及具有2-10个Fc结构域的Fc构建体,例如具有2、3、4、5、6、7、8、9、或10个Fc结构域的Fc构建体。在一些实施例中,Fc构建体包含2-10个Fc结构域、2-5个Fc结构域、3-5个Fc结构域、2-8个Fc结构域、或2-6个Fc结构域。该构建体可以包含2-6(例如,2、3、4、5、或6)个相关多肽,每个多肽包含至少一个Fc结构域单体,其中该构建体的每个Fc结构域单体与该构建体的另一个单体是相同的或不同之处不多于20个氨基酸(例如,不多于15个、10个氨基酸),例如不多于20、15、10、8、7、6、5、4、3或2个氨基酸。在此描述的Fc构建体不包含免疫球蛋白的抗原结合结构域。在一些实施例中,Fc构建体(或Fc构建体内的Fc结构域)完全或部分地通过存在于不同多肽中的Fc构域单体缔合而形成。在某些实施例中,Fc构建体不包含促进两个多肽缔合的额外结构域(例如,IgM尾片或IgA尾片)。在其他实施例中,共价键仅存在于Fc构建体中连接形成Fc结构域的两个Fc结构域单体之间。在其他实施例中,Fc构建体不包含Fc结构域之间的共价键。仍在其他实施例中,Fc构建体提供足够的结构柔性,这样使得Fc构建体中的所有或基本上所有Fc结构域能够同时与细胞表面上的Fc受体相互作用。在一些实施例中,Fc构建体包含通过接头(例如,柔性氨基酸间隔区)连接的至少两个Fc结构域。在一个实施例中,结构域单体的一级序列与野生型或彼此的不同之处在于它们具有二聚化选择性模块。
本发明的Fc构建体可以处于一种药物组合物中,该药物组合物包含具有2-10个Fc结构域的Fc构建体(例如,具有2、3、4、5、6、7、8、9、或10个Fc结构域的构建体,诸如在此描述的那些构建体)的基本上同源的集合(population)(例如,至少85%、90%、95%、98%、或99%同源)。因此,可以产生不具有大量聚集或不需要的多聚化的Fc构建体的药物组合物。
在一个方面中,Fc构建体包含形成两个Fc结构域的三个多肽。第一多肽具有化学式A-L-B,其中A包含第一Fc结构域单体;L是接头;并且B包含第二Fc结构域单体。第二多肽包含第三Fc结构域单体,并且该第三多肽包含第四Fc结构域单体。在此方面中,第一Fc结构域单体和第三Fc结构域单体组合以形成第一Fc结构域。类似地,第二Fc结构域单体和第四Fc结构域单体组合以形成第二Fc结构域。本发明此方面的示例性Fc构建体在图4和6中示出。
在某些实施例中,第一Fc结构域单体和第三Fc结构域单体包含促进在这些Fc结构域单体之间的二聚化的互补二聚化选择性模块。在其他实施例中,第二Fc结构域单体和第四Fc结构域单体包含促进在这些Fc结构域单体之间的二聚化的互补二聚化选择性模块。
在某些实施例中,A、B、第二多肽以及第三多肽中的一个或多个由Fc结构域单体组成。在一个实施例中,A、B、第二多肽以及第三多肽各自均由Fc结构域单体组成。
在某些实施例中,Fc构建体可以进一步包含一个异源部分,例如肽,例如结合血清蛋白的肽,例如白蛋白结合肽。该部分可以例如通过接头连接至B或第三多肽的N-末端或羧基末端。
在某些实施例中,Fc构建体进一步包含一个IgG CL抗体恒定结构域和一个IgG CH1抗体恒定结构域。IgG CH1抗体恒定结构域可以例如通过接头附接至A或第二多肽的N-末端。
在其他实施例中,Fc构建体的第二多肽和第三多肽具有相同的氨基酸序列。
在另一个方面中,本发明涉及一种包含形成三个Fc结构域的四个多肽的Fc构建体。第一多肽具有化学式A-L-B,其中A包含第一Fc结构域单体;L是接头;并且B包含第二Fc结构域单体。第二多肽具有化学式A’-L’-B’,其中A’包含第三Fc结构域单体;L’是接头;并且B’包含第四Fc结构域单体。第三多肽包含第五Fc结构域单体,并且该第四多肽包含第六Fc结构域单体。在此方面中,A和A’组合以形成第一Fc结构域,B和第五Fc结构域单体组合以形成第二Fc结构域,并且B’和第六Fc结构域单体组合以形成第三Fc结构域。本发明此方面的一个示例性Fc构建体在图5中示出。
在某些实施例中,A和A’各自包含促进在这些Fc结构域单体之间二聚化的一个二聚化选择性模块。在其他实施例中,B和第五Fc结构域单体各自包含促进在这些Fc结构域单体之间二聚化的一个二聚化选择性模块。在另外的其他实施例中,B’和第六Fc结构域单体各自包含促进在这些Fc结构域单体之间二聚化的一个二聚化选择性模块。
在某些实施例中,A、B、A’、B’、第三多肽以及第四多肽中的一个或多个由Fc结构域单体组成。在一个实施例中,A、B、A’、B’、第三多肽以及第四多肽各自均由Fc结构域单体组成。
在某些实施例中,Fc构建体进一步包含IgG CL抗体恒定结构域和IgG CH1抗体恒定结构域,其中该IgG CL抗体恒定结构域通过接头附接至该IgG CH1抗体恒定结构域的N-末端,并且该IgG CH1抗体恒定结构域例如通过接头附接至A的N-末端。在一个实施例中,Fc构建体进一步包含第二IgG CL抗体恒定结构域和第二IgG CH1抗体恒定结构域,其中该第二IgG CL抗体恒定结构域例如通过接头附接至该第二IgG CH1抗体恒定结构域的N-末端,并且该第二IgG CH1抗体恒定结构域例如通过接头附接至A’的N-末端。
在某些实施例中,Fc构建体进一步包含一个异源部分,例如肽,例如,例如通过接头连接至B或B’的N-末端或C-末端的白蛋白结合肽。
在其他实施例中,Fc构建体的第一多肽和第二多肽具有相同的氨基酸序列,并且Fc构建体的第三多肽和第四多肽具有相同的氨基酸序列。
在另一个方面中,本发明涉及一种包含两个多肽的Fc构建体。第一多肽具有化学式A-L-B,其中A包含第一Fc结构域单体;L是接头;并且B包含一个血清蛋白结合部分,例如白蛋白结合肽。第二多肽包含第二Fc结构域单体。在此方面中,第一Fc结构域单体和第二Fc结构域单体组合以形成一个Fc结构域。
在某些实施例中,第一Fc结构域单体和第二Fc结构域单体包含促进在该第一Fc结构域单体与该第二Fc结构域单体之间的二聚化的互补二聚化选择性模块。
在某些实施例中,A和第二多肽各自由Fc结构域单体组成。
在又另一个方面中,本发明涉及一种包含两个多肽的Fc构建体。第一多肽具有化学式A-L1-B-L2-C,其中A包含一个IgG CL抗体恒定结构域;L1和L2各自是接头;B包含一个IgG CH1抗体恒定结构域;并且C包含第一Fc结构域单体。第二多肽具有化学式A’-L1’-B’-L2’-C’,其中A’包含一个IgGCL抗体恒定结构域;L1’和L2’各自是接头;B’包含一个IgG CH1抗体恒定结构域;并且C’包含第二Fc结构域单体。在此方面中,第一Fc结构域单体和第二Fc结构域单体组合以形成一个Fc结构域。本发明此方面的一个示例性Fc构建体在图7A中示出。
在某些实施例中,第一Fc结构域单体和第二Fc结构域单体包含促进在该第一Fc结构域单体与该第二Fc结构域单体之间的二聚化的二聚化选择性模块。
在某些实施例中,C和C’各自由Fc结构域单体组成。
在某些实施例中,Fc构建体进一步包含一个血清蛋白结合部分,例如通过接头连接至C或C’的N-末端或C-末端的白蛋白结合肽。
在又另一个方面中,本发明涉及一种包含四个或更多个多肽的Fc构建体。第一多肽具有化学式A-L1-B-L2-C,其中A包含一个IgG CL抗体恒定结构域;L1和L2各自是接头;B包含一个IgG CH1抗体恒定结构域;并且C包含第一Fc结构域单体。第二多肽具有化学式A’-L1’-B’-L2’-C’,其中A’包含一个IgG CL抗体恒定结构域;L1’和L2’各自是接头;B’包含一个IgG CH1抗体恒定结构域;并且C’包含第二Fc结构域单体。在此方面中,第一Fc结构域单体与第三Fc结构域单体组合以形成第一Fc结构域,并且第二Fc结构域单体与第四Fc结构域单体组合以形成第二Fc结构域。此外,第一多肽的IgG CH1抗体恒定结构域与第二多肽的IgG CL抗体恒定结构域组合,并且第二多肽的IgG CH1抗体恒定结构域与第一多肽的IgG CL抗体恒定结构域组合以形成一个包含两个或更多个Fc结构域的Fc构建体。本发明此方面的一个示例性Fc构建体在图7B中示出。
在另一个方面中,本发明涉及一种包含两个多肽的Fc构建体。第一多肽包含第一Fc结构域单体,并且该第二多肽包含第二Fc结构域单体。在此方面中,第一Fc结构域单体和第二Fc结构域单体组合以形成一个Fc结构域。本发明此方面的一个示例性Fc构建体在图1中示出。另外,在此方面中,第一Fc结构域单体和第二Fc结构域单体各自包含促进在该第一Fc结构域单体与该第二Fc结构域单体之间二聚化的一个二聚化选择性模块。此实施例的示例性Fc构建体在图2和图3中示出。
在某些实施例中,第一多肽和第二多肽各自由Fc结构域单体组成。
在某些实施例中,Fc构建体进一步包含一个血清蛋白结合部分,例如,例如通过接头连接至第一多肽或第二多肽的N-末端或C-末端的白蛋白结合肽。
在另一个方面中,本发明涉及一种包含两个多肽的Fc构建体。第一多肽具有化学式A-L-B,其中A包含第一Fc结构域单体;L是接头;并且B包含第二Fc结构域单体。第二多肽具有化学式A’-L’-B’,其中A’包含第三Fc结构域单体;L’是接头;并且B’包含第四Fc结构域单体。在此方面中,第一Fc结构域单体和第二Fc结构域单体在它们对应的CH3抗体恒定结构域内各自包含一个工程化腔体,并且第二Fc结构域单体和第四Fc结构域单体在它们对应的CH3抗体恒定结构域内各自包含一个工程化突出物,其中该工程化腔体和该工程化突出物被定位来形成一个突出物-进入-腔体对。同样在此方面中,第一Fc结构域单体和第三Fc结构域单体组合以形成第一Fc结构域,并且第二Fc结构域单体和第四Fc结构域单体组合以形成第二Fc结构域。
在某些实施例中,A、B、A’以及B’中的一个或多个由Fc结构域单体组成。在一个实施例中,A、B、A’以及B’各自均由Fc结构域单体组成。
在某些实施例中,Fc构建体进一步包含一个血清蛋白结合部分,例如,例如通过接头连接至B或B’的N-末端或C-末端的白蛋白结合肽。
在某些实施例中,Fc构建体进一步包含IgG CL抗体恒定结构域和IgG CH1抗体恒定结构域,其中该IgG CL抗体恒定结构域例如通过接头附接至该IgGCH1抗体恒定结构域的N-末端,并且该IgG CH1抗体恒定结构域通过接头附接至A的N-末端。在一个实施例中,Fc构建体进一步包含第二IgG CL抗体恒定结构域和第二IgG CH1抗体恒定结构域,其中该第二IgG CL抗体恒定结构域通过接头附接至该第二IgG CH1抗体恒定结构域的N-末端,并且该第二IgG CH1抗体恒定结构域通过接头附接至A’的N-末端。
在另一个方面中,本发明涉及一种由以下各项组成的Fc构建体:a)具有化学式A-L-B的第一多肽;其中A包含第一Fc结构域单体或由该第一Fc结构域单体组成;L是接头;并且B包含第二Fc结构域单体或由该第二Fc结构域单体组成;b)具有化学式A’-L’-B’的第二多肽;其中A’包含第三Fc结构域单体或由该第三Fc结构域单体组成;L是接头;并且B’包含第四Fc结构域单体或由该第四Fc结构域单体组成;c)包含第五Fc结构域单体或由该第五Fc结构域单体组成的第三多肽;以及d)包含第六Fc结构域单体或由该第六Fc结构域单体组成的第四多肽。第一多肽的A和第二多肽的A’组合以形成第一Fc结构域;第一多肽的B和第五Fc结构域单体组合以形成第二Fc结构域;并且第二多肽的B’和第六Fc结构域单体组合以形成第三Fc结构域。第一Fc结构域单体和第三Fc结构域单体各自均包含促进在该第一Fc结构域单体与该第三Fc结构域单体之间的二聚化的互补二聚化选择性模块,第二Fc结构域单体和第五Fc结构域单体各自均包含促进在该第二Fc结构域单体与该第五Fc结构域单体之间的二聚化的互补二聚化选择性模块,并且第四Fc结构域单体和第六Fc结构域单体各自均包含促进在该第四Fc结构域单体与该第六Fc结构域单体之间的二聚化的互补二聚化选择性模块;其中Fc构建体含有不多于三个Fc结构域。
在此方面的一些实施例中,第一Fc结构域单体或第三Fc结构域单体之一包含一个带负电荷的氨基酸取代,并且另一个Fc结构域单体包含一个带正电荷的氨基酸取代,第二Fc结构域单体和第四Fc结构域单体或第五Fc结构域单体和第六Fc结构域单体之一包含一个工程化突出物,并且另外的Fc结构域单体包含一个工程化腔体。在一些实施例中,接头L1、L2、L1’、和/或L2’的长度是3-200个氨基酸。在一些实施例中,接头L和/或L’由SEQ ID NO:1、2和3中任一个的序列组成。
在另一个方面中,本发明涉及一种由以下各项组成的Fc构建体:a)具有化学式A-L1-B-L2-C的第一多肽;其中A包含第一Fc结构域单体或由该第一Fc结构域单体组成;L1是接头;B包含第二Fc结构域单体或由该第二Fc结构域单体组成;L2是接头;并且C包含第三Fc结构域单体或由该第三Fc结构域单体组成;以及b)具有化学式A’-L1’-B’-L2’-C’的第二多肽;其中A’包含第四Fc结构域单体或由第四Fc结构域单体组成;L1’是接头;B’包含第五Fc结构域单体或由该第五Fc结构域单体组成;L2’是接头;并且C’包含第六Fc结构域单体或由该第六Fc结构域单体组成;c)包含第七Fc结构域单体或由该第七Fc结构域单体组成的第三多肽;d)包含第八Fc结构域单体或由该第八Fc结构域单体组成的第四多肽;e)包含第九Fc结构域单体或由该第九Fc结构域单体组成的第五多肽;以及f)包含第十Fc结构域单体或由该第十Fc结构域单体组成的第六多肽。第一多肽的A和第七Fc结构域单体组合以形成第一Fc结构域;第一多肽的B和第二多肽的B’组合以形成第二Fc结构域;第一多肽的C和第八Fc结构域单体组合以形成第三Fc结构域,第二多肽的A’和第九Fc结构域单体组合以形成第四Fc结构域,并且第二多肽的C’和第十Fc结构域单体组合以形成第五Fc结构域。第一Fc结构域单体和第七Fc结构域单体各自均包含促进在该第一Fc结构域单体与该第七Fc结构域单体之间的二聚化的互补二聚化选择性模块,第二Fc结构域单体和第五Fc结构域单体各自均包含促进在该第二Fc结构域单体与该第五Fc结构域单体之间的二聚化的互补二聚化选择性模块,第三Fc结构域单体和第八Fc结构域单体各自均包含促进在该第三Fc结构域单体与该第八Fc结构域单体之间的二聚化的互补二聚化选择性模块;第四Fc结构域单体和第九Fc结构域单体各自均包含促进在该第四Fc结构域单体与该第九Fc结构域单体之间的二聚化的互补二聚化选择性模块;并且第六Fc结构域单体和第十Fc结构域单体各自均包含促进在该第六Fc结构域单体与该第十Fc结构域单体之间的二聚化的互补二聚化选择性模块;其中该Fc构建体含有不多于五个Fc结构域。
在此方面的一些实施例中,第一Fc结构域单体、第三Fc结构域单体、第四Fc结构域单体、以及第六Fc结构域单体各自均包含一个工程化突出物,第二Fc结构域单体包含一个带负电荷的氨基酸取代,第五Fc结构域单体包含一个带正电荷的氨基酸取代,并且第七Fc结构域单体、第八Fc结构域单体、第九Fc结构域单体、以及第十Fc结构域单体各自均包含一个工程化腔体。在一些实施例中,接头L1、L2、L1’、和/或L2’的长度是3-200个氨基酸。在一些实施例中,接头L1、L2、L1’、和/或L2’由SEQ ID NO:1、2和3中任一个的序列组成。
在另一个方面中,本发明涉及一种由以下各项组成的Fc构建体:a)具有化学式A-L1-B-L2-C的第一多肽;其中A包含第一Fc结构域单体或由该第一Fc结构域单体组成;L1是接头;B包含第二Fc结构域单体或由该第二Fc结构域单体组成;L2是接头;并且C包含第三Fc结构域单体或由该第三Fc结构域单体组成;以及b)具有化学式A’-L1’-B’-L2’-C’的第二多肽;其中A’包含第四Fc结构域单体或由第四Fc结构域单体组成;L1’是接头;B’包含第五Fc结构域单体或由该第五Fc结构域单体组成;L2’是接头;并且C’包含第六Fc结构域单体或由该第六Fc结构域单体组成;c)包含第七Fc结构域单体或由该第七Fc结构域单体组成的第三多肽;d)包含第八Fc结构域单体或由该第八Fc结构域单体组成的第四多肽;e)包含第九Fc结构域单体或由该第九Fc结构域单体组成的第五多肽;f)包含第十Fc结构域单体或由该第十Fc结构域单体组成的第六多肽。第一多肽的A和第二多肽的A’组合以形成第一Fc结构域;第一多肽的B和第七Fc结构域单体组合以形成第二Fc结构域;第一多肽的C和第八Fc结构域单体组合以形成第三Fc结构域,第二多肽的B’和第九Fc结构域单体组合以形成第四Fc结构域,并且第二多肽的C’和第十Fc结构域单体组合以形成第五Fc结构域。第一Fc结构域单体和第四Fc结构域单体各自均包含促进在该第一Fc结构域单体与该第四Fc结构域单体之间的二聚化的互补二聚化选择性模块,第二Fc结构域单体和第七Fc结构域单体各自均包含促进在该第二Fc结构域单体与该第七Fc结构域单体之间的二聚化的互补二聚化选择性模块,第三Fc结构域单体和第八Fc结构域单体各自均包含促进在该第三Fc结构域单体与该第八Fc结构域单体之间的二聚化的互补二聚化选择性模块;第五Fc结构域单体和第九Fc结构域单体各自均包含促进在该第五Fc结构域单体与该第九Fc结构域单体之间的二聚化的互补二聚化选择性模块;并且第六Fc结构域单体和第十Fc结构域单体各自均包含促进在该第六Fc结构域单体与该第十Fc结构域单体之间的二聚化的互补二聚化选择性模块;其中该Fc构建体含有不多于五个Fc结构域。
在此方面的一些实施例中,第一Fc结构域单体包含一个带负电荷的氨基酸取代,第四Fc结构域单体包含一个带正电荷的氨基酸取代,第二Fc结构域单体、第三Fc结构域单体、第五Fc结构域单体、以及第六Fc结构域单体各自均包含一个工程化突出物,并且第七Fc结构域单体、第八Fc结构域单体、第九Fc结构域单体、以及第十Fc结构域单体各自均包含一个工程化腔体。在一些实施例中,接头L1、L2、L1’、和/或L2’的长度是3-200个氨基酸。在一些实施例中,接头L1、L2、L1’、和/或L2’由SEQ ID NO:1、2和3中任一个的序列组成。
在另一个方面中,本发明涉及一种包含一个或多个Fc结构域的Fc构建体,其中Fc构建体由单个多肽序列装配。该多肽具有化学式A-L-B,其中A包含第一Fc结构域单体;L是接头(可任选地是具有例如一个、两个或更多个切割位点的可裂解接头);并且B包含第二Fc结构域单体。该接头可以是一种具有足够长度(例如,至少15个氨基酸、优选至少约20个氨基酸残基的长度,例如15-200个氨基酸的长度)和柔性(多肽的第一Fc结构域单体和第二Fc结构域单体组合以形成Fc结构域)的氨基酸间隔区。在某些实施例中,第一Fc结构域单体和第二Fc结构域单体包含促进在该第一Fc结构域单体与该第二Fc结构域单体之间的二聚化的互补二聚化选择性模块。这种构建体可以通过单个多肽序列在宿主细胞中的表达来形成。在一个实施例中,该多肽具有化学式A-L1-B-L2-C,其中A包含第一Fc结构域单体;L1是接头(可任选地是具有例如一个、两个或更多个切割位点的可裂解接头);B包含第二Fc结构域单体;L2是接头;并且C是第三Fc结构域单体。该接头可以是一种具有足够长度(例如,至少15个氨基酸、优选至少约20个氨基酸残基的长度,例如15-200个氨基酸的长度)和柔性(多肽的第一Fc结构域单体和第二Fc结构域单体组合以形成Fc结构域)的氨基酸间隔区。在某些实施例中,第一Fc结构域单体和第二Fc结构域单体包含促进在该第一Fc结构域单体与该第二Fc结构域单体之间的二聚化的互补二聚化选择性模块。此实施例的Fc构建体的一个实例在图10中描绘,该Fc构建体包含三个Fc结构域。
于在此描述的任何Fc构建体中,该构建体的Fc结构域的Fc结构域单体可以具有相同的初级氨基酸序列。例如,Fc结构域的两个Fc结构域单体均可以是野生型序列,或者Fc结构域的两个Fc结构域单体均可以具有相同的二聚化选择性模块,例如Fc结构域的两个Fc结构域单体均可以在CH3结构域之间的界面处带电荷残基的环内至少两个位置处具有相同的相反电荷突变。
于在此描述的任何Fc构建体中,构建体的Fc结构域的Fc结构域单体可以具有不同的序列,例如在两个Fc单体之间(即,Fc构建体的Fc结构域单体与另一个单体之间)不同之处不多于20个氨基酸(例如,不多于15、10个氨基酸),例如不多于20、15、10、8、7、6、5、4、3或2个氨基酸的序列。例如,在此描述的构建体的Fc单体序列可以是不同的,因为任何Fc构建体的互补二聚化选择性模块可以包含在一个结构域单体的CH3抗体恒定结构域中的一个工程化腔体以及在另一个Fc结构域单体的CH3抗体恒定结构域中的一个工程化突出物,其中该工程化腔体和该工程化突出物被定位来形成Fc结构域单体的一个突出物-进入-腔体对。示例性工程化腔体和突出物在表1中示出。在其他实施例中,互补二聚化选择性模块包含在一个结构域单体的CH3抗体恒定结构域中的一个工程化(取代的)带负电荷的氨基酸以及在另一个Fc结构域单体的CH3抗体恒定结构域中的一个工程化(取代的)带正电荷的氨基酸,其中该带负电荷的氨基酸和该带正电荷的氨基酸被定位来促进在互补结构域单体之间Fc结构域的形成。示例性互补氨基酸变化在表2中示出。
在一些实施例中,除二聚化选择性模块(例如,工程化腔体和突出物,或工程化带正电荷和带负电荷的氨基酸(参见,例如,表1和表2中的示例性氨基酸变化))之外,在此描述的Fc构建体在Fc单体序列中还可以包含来自野生型序列的额外氨基酸取代,以便例如帮助稳定Fc构建体或防止蛋白质聚集。
在一些实施例中,在此描述的Fc构建体包含2-10个Fc结构域(例如,2、3、4、5、6、7、8、9、10个结构域),其中该构建体的Fc结构域中的至少两个具有不同的二聚化选择性模块。例如,构建体5、8、9以及10具有包含工程化腔体和突出物的至少一个Fc结构域以及包含互补相反电荷突变的至少一个Fc结构域。
在其他实施例中,在此描述的Fc构建体中的一个或多个接头是一个键。
在其他实施例中,在此描述的Fc构建体中的一个或多个接头是一个间隔区,例如一个具有2-200个氨基酸的氨基酸间隔区。
在某些实施例中,该氨基酸间隔区是富含甘氨酸和/或丝氨酸的间隔区,例如该间隔区包含序列GS、GGS、GGGGS(SEQ ID NO:1)、GGSG(SEQ ID NO:2)、或SGGG(SEQ ID NO:3)中的两个或更多个基序。
在某些实施例中,当Fc构建体包含白蛋白结合肽时,该白蛋白结合肽具有DICLPRWGCLW(SEQ ID NO:28)的序列。
在其他实施例中,在此描述的Fc构建体中的一个或多个Fc结构域单体包含IgG铰链结构域、IgG CH2抗体恒定结构域、以及IgG CH3抗体恒定结构域。
在某些实施例中,前述Fc构建体中的每个Fc结构域单体包含IgG铰链结构域、IgG CH2抗体恒定结构域、以及IgG CH3抗体恒定结构域。
在某些实施例中,该IgG具有选自下组的亚型,该组由以下各项组成:IgG1、IgG2a、IgG2b、IgG3、以及IgG4。
在又另一个方面中,本发明涉及一种药物组合物,该药物组合物包含在此描述的任何Fc构建体的基本上同源(例如,至少85%、90%、95%、97%、98%、99%同源)的集合。在一个实施例中,对于药物用途合格的无菌注射器或小瓶含有一种药物组合物,其中唯一或主要活性成分是在此描述的任何一种Fc构建体的基本上同源(例如,至少85%、90%、95%、98%、或99%同源)的集合。该药物组合物可以包含一种或多种无活性成分,例如选自盐、洗涤剂、表面活性剂、膨胀剂、聚合物、防腐剂、以及其他药用赋形剂,在另一个实施例中,该基本上同源的药物组合物含有少于10%、少于5%、少于4%、少于3%、少于2%、少于1%、或少于0.5%的Fc构建体的聚集体或不需要的多聚体。
在另一个方面中,本发明涉及一种制备任何一种前述Fc构建体的方法。该方法包括提供一种包含编码装配该Fc构建体所需要的多肽的一个或多个多核苷酸的宿主细胞、在允许该Fc构建体形成的条件下在宿主细胞中表达多肽、并且回收(例如,纯化)该Fc构建体。
在一些实施例中,Fc构建体至少部分地通过存在于不同多肽中的Fc结构域单体缔合而形成。在某些实施例中,Fc构建体通过存在于不同多肽中的Fc结构域单体缔合来形成。在这些实施例中,Fc构建体不包含促进两个多肽缔合的额外结构域(例如,IgM尾片或IgA尾片)。在其他实施例中,共价键(例如,二硫键)仅存在于连接形成Fc结构域的两个Fc结构域单体之间。在其他实施例中,Fc构建体不包含Fc结构域之间的共价键(例如,二硫键)。仍在其他实施例中,Fc构建体提供足够的结构柔性,这样使得Fc构建体中的所有或基本上所有Fc结构域能够同时与细胞表面上的Fc受体相互作用。在任何这些实施例的某些实例中,Fc构建体包含通过接头(例如,柔性氨基酸间隔区)连接的至少两个Fc结构域。
在一个实施例中,Fc结构域的Fc结构域单体见于缔合以形成Fc结构域的不同多肽链中。例如,图4和图6中描绘的构建体具有包含三个缔合多肽的两个Fc结构域。这三个多肽之一包含两个Fc结构域单体并且这些多肽中的其他两个多肽各自包含一个Fc结构域单体。图5中描绘的构建体具有包含四个缔合多肽的三个Fc结构域;这四个多肽中的两个多肽具有两个Fc结构域单体并且这四个多肽中的其他两个多肽各自具有一个Fc结构域单体。图7B中描绘的Fc构建体可以具有包含2n个多肽的n个Fc结构域(其中n是2-10),每个多肽包含一个Fc结构域单体、一个IgG CL抗体恒定结构域、以及一个IgG CH1抗体恒定结构域。图8和图9中描绘的构建体各自具有包含六个缔合多肽的五个Fc结构域。这六个多肽中的两个多肽具有三个Fc结构域单体并且这六个多肽中的其他四个多肽各自具有一个Fc结构域单体。图10中描绘的构建体具有包含两个缔合多肽的三个Fc结构域。这两个多肽各自均含有以串联形式连接的三个Fc结构域单体。
在另一个方面中,本发明涉及用于促进Fc结构域单体的选择性二聚化的组合物和方法。本发明包括一种Fc结构域,其中该Fc结构域的两个Fc结构域单体在CH3抗体恒定结构域之间的界面处带电荷残基环内的至少两个位置处包含相同的突变。本发明还包括一种制备这种Fc结构域的方法,该方法包括引入在两个Fc结构域单体序列中在CH3抗体恒定结构域之间的界面处带电荷残基环内的至少两个位置处具有相同突变的互补二聚化选择性模块。在CH3抗体恒定结构域之间的界面由通过带电荷残基环围绕的疏水片(patch)组成。当一个CH3抗体恒定结构域与另一个结合在一起时,这些带电荷残基与具有相反电荷的残基配对。通过逆转两个或更多个互补残基对的两个成员的电荷,突变的Fc结构域单体保持与相同突变序列的Fc结构域单体互补,但与不具有这些突变的Fc结构域单体具有较低互补性。在此实施例中,相同的二聚化选择性模块促进同源二聚化。示例性Fc结构域包括含有双突变体K409D/D339K、K392D/D399K、E357K/K370E、D356K/K439D、K409E/D339K、K392E/D399K、E357K/K370D、或D356K/K439E的Fc单体。在另一个实施例中,Fc结构域包含Fc单体,这些Fc单体包括组合任何双突变体对的四突变体,例如,K409D/D399K/E357K/K370E。在另一个实施例中,除相同的二聚化选择性模块之外,Fc结构域的Fc结构域单体包含具有促进特定缔合的不同突变的互补二聚化选择性模块(例如,工程化腔体和突出物)。其结果是,这两个Fc结构域单体包含两个二聚化选择性模块并且保持彼此互补,但与其他Fc结构域单体具有降低的互补性。此实施例促进含腔体Fc结构域与含突出物Fc结构域单体之间的异源二聚化。在一个实例中,两个Fc结构域单体的带电荷对残基中的相同突变与一个Fc结构域单体上的突出物和另一个Fc结构域单体上的腔体组合。
在另一个方面中,本发明涉及一种减轻有需要的受试者中的炎症的方法。在另一个方面中,本发明涉及一种促进有需要的受试者中的自身抗体清除的方法。在另一个方面中,本发明涉及一种抑制有需要的受试者中的抗原呈递的方法。在另一个方面中,本发明涉及一种减少有需要的受试者中的免疫应答的方法,例如减少有需要的受试者中免疫应答基于免疫复合物的激活的方法。这些方法包括向受试者给予一种在此描述的Fc构建体或药物组合物。
在另一个方面中,本发明涉及一种通过向有需要的受试者给予在此描述的Fc构建体或药物组合物(例如,构建体1-10和5*中的任一种)来治疗该受试者的炎症或自身免疫或免疫疾病的方法。示例性疾病包括:类风湿性关节炎(RA);系统性红斑狼疮(SLE);ANCA-相关性脉管炎;抗磷脂抗体综合征;自身免疫性溶血性贫血;慢性炎性脱髓鞘性神经病;移植中的抗异体、GVHD中的抗自身抗体、抗替代品、IgG治疗剂、IgG异常蛋白的清除;皮肌炎;古德帕斯彻氏综合征;通过抗体依赖性细胞介导的细胞毒性介导的靶向器官系统II型超敏反应综合征,例如吉兰-巴雷综合征、CIDP、皮肌炎、费尔蒂综合征、抗体介导的排斥、自身免疫性甲状腺疾病、溃疡性结肠炎、自身免疫性肝病;特发性血小板减少性紫癜;重症肌无力、视神经脊髓炎;天疱疮和其他自身免疫发泡性紊乱;硬皮病;自身免疫性血细胞减少和其他通过抗体依赖性吞噬作用介导的病症;其他FcR依赖性炎性综合症,例如滑膜炎、皮肌炎、系统性血管炎、肾小球炎以及血管炎。
在另一个方面中,本发明涉及一种用于减轻有需要的受试者中的炎症的在此描述的Fc构建体或药物组合物(例如,构建体1-10和5*中的任一种)。在另一个方面中,本发明涉及一种用于促进有需要的受试者中的自身抗体清除的在此描述的Fc构建体或药物组合物(例如,构建体1-10和5*中的任一种)。在另一个方面中,本发明涉及一种用于抑制有需要的受试者中的抗原呈递的在此描述的Fc构建体或药物组合物(例如,构建体1-10和5*中的任一种)。在另一个方面中,本发明涉及一种用于减少有需要的受试者中的免疫应答,例如减少有需要的受试者中免疫应答基于免疫复合物的激活的在此描述的Fc构建体或药物组合物(例如,构建体1-10和5*中的任一种)。
在另一个方面中,本发明涉及一种用于治疗受试者中的炎症或自身免疫或免疫疾病的在此描述的Fc构建体或药物组合物(例如,构建体1-10和5*中的任一种)。示例性疾病包括:类风湿性关节炎(RA);系统性红斑狼疮(SLE);ANCA-相关性脉管炎;抗磷脂抗体综合征;自身免疫性溶血性贫血;慢性炎性脱髓鞘性神经病;移植中的抗异体、GVHD中的抗自身抗体、抗替代品、IgG治疗剂、IgG异常蛋白的清除;皮肌炎;古德帕斯彻氏综合征;通过抗体依赖性细胞介导的细胞毒性介导的靶向器官系统II型超敏反应综合征,例如吉兰-巴雷综合征、CIDP、皮肌炎、费尔蒂综合征、抗体介导的排斥、自身免疫性甲状腺疾病、溃疡性结肠炎、自身免疫性肝病;特发性血小板减少性紫癜;重症肌无力、视神经脊髓炎;天疱疮和其他自身免疫发泡性紊乱;硬皮病;自身免疫性血细胞减少和其他通过抗体依赖性吞噬作用介导的病症;其他FcR依赖性炎性综合症,例如滑膜炎、皮肌炎、系统性血管炎、肾小球炎以及血管炎。
于在此描述的任何Fc构建体中,应当理解这些Fc结构域单体的顺序是可互换的。例如,在具有化学式A-L-B的多肽中,A的羧基端可以连接至L的氨基端,该L又进而在其羧基端连接至B的氨基端。或者,B的羧基端可以连接至L的氨基端,该L又进而在其羧基端连接至C的氨基端。这些构型两者均由化学式A-L-B涵盖在内。
在一个相关方面中,本发明涉及一种表达任一种前述Fc构建体的宿主细胞。该宿主细胞包含编码装配该Fc构建体所需要的多肽的多核苷酸,其中这些多核苷酸是在该宿主细胞中表达的。
定义:
如在此使用的,术语“Fc结构域单体”是指包含至少一个铰链结构域以及第二抗体恒定结构域和第三抗体恒定结构域(CH2和CH3)或其功能片段(例如,能够(i)与另一个Fc结构域单体二聚化以形成Fc结构域并且(ii)结合Fc受体的片段)的一种多肽链。Fc结构域单体可以是任何免疫球蛋白抗体同种型,包括IgG、IgE、IgM、IgA、或IgD。此外,Fc结构域单体可以是IgG亚型(例如,IgG1、IgG2a、IgG2b、IgG3、以及IgG4)。Fc结构域单体不包含能够充当抗原识别区域(例如,可变结构域或互补决定区(CDR))的任何免疫球蛋白部分。Fc结构域单体可以含有多达十个来自野生型Fc结构域单体序列的变化(例如,1-10个、1-8个、1-6个、1-4个氨基酸取代、添加、或缺失),这些变化改变了Fc结构域与Fc受体之间的相互作用。适合的变化的实例是本领域已知的。
如在此使用的,术语“Fc结构域”是指能够结合Fc受体的两个Fc结构域单体的二聚体。在该野生型Fc结构域中,这两个Fc结构域单体通过两个CH3抗体恒定结构域之间的相互作用,以及在两个二聚化Fc结构域单体的铰链结构域之间形成的一个或多个二硫键来二聚化。
在本发明中,术语“Fc构建体”是指在如在此描述的2-10个Fc结构域之间形成的缔合多肽链。在此描述的Fc构建体可以包含具有相同或不同序列的Fc结构域单体。例如,Fc构建体可以具有两个Fc结构域,其中一个包含IgG1或IgG1来源的Fc结构域单体,并且第二个包含IgG2或IgG2来源的Fc结构域单体。在另一个实例中,Fc构建体可以具有两个Fc结构域,其中一个包含“突出物-进入-腔体对”并且第二个不包含“突出物-进入-腔体对”。在本发明中,Fc结构域不包含抗体的可变区,例如VH、VL、CDR、或HVR。Fc结构域形成结合Fc受体的最小结构,该Fc受体例如FcγRI、FcγRIIa、FcγRIIb、FcγRIIIa、FcγRIIIb、FcγRIV。
如在此使用的,术语“抗体恒定结构域”是指一种对应于抗体的恒定区结构域(例如,CL抗体恒定结构域、CH1抗体恒定结构域、CH2抗体恒定结构域、或CH3抗体恒定结构域)的多肽。
如在此使用的,术语“促进”意在鼓励和促成,例如促成Fc结构域由相比于对其他不同的Fc结构域单体,彼此具有更高结合亲和力的两个Fc结构域单体形成。如在此描述的,组合以形成Fc结构域的两个Fc结构域单体在它们对应的CH3抗体恒定结构域界面处可以具有相容的氨基酸修饰(例如,工程化突出物和工程化腔体)。相对于与缺乏此类氨基酸修饰或具有不相容的氨基酸修饰的其他Fc结构域单体,相容的氨基酸修饰促进或促成此类Fc结构域单体彼此的选择性相互作用。这是因为由于在两个相互作用的CH3抗体恒定结构域的界面处的氨基酸修饰,相比于对缺乏氨基酸修饰的其他Fc结构域单体,Fc结构域单体彼此具有更高亲和力。
如在此使用的,术语“二聚化选择性模块”是指Fc结构域单体有助于两个Fc结构域单体之间优先配对的序列。“互补”二聚化选择性模块是促进或促成两个Fc结构域单体彼此选择性相互作用的二聚化选择性模块。互补二聚化选择性模块可以具有相同或不同的序列。在此描述示例性互补二聚化选择性模块。
如在此使用的,术语“工程化腔体”是指使用一种具有小于原始氨基酸残基的侧链体积的不同氨基酸残基来取代CH3抗体恒定结构域中的至少一个原始氨基酸残基,从而在CH3抗体恒定结构域中形成一个三维腔体。术语“原始氨基酸残基”是指一种由野生型CH3抗体恒定结构域的遗传密码编码的天然存在的氨基酸残基。
如在此使用的,术语“工程化突出物”是指使用一种具有大于原始氨基酸残基的侧链体积的不同氨基酸残基来取代CH3抗体恒定结构域中的至少一个原始氨基酸残基,从而在CH3抗体恒定结构域中形成一个三维突出物。术语“原始氨基酸残基”是指由野生型CH3抗体恒定结构域的遗传密码编码的天然存在的氨基酸残基。
如在此使用的,术语“突出物-进入-腔体对”描述一种包含两个Fc结构域单体的Fc结构域,其中第一Fc结构域单体在其CH3抗体恒定结构域中包含一个工程化腔体,而第二Fc结构域单体在其CH3抗体恒定结构域中包含一个工程化突出物。在一个突出物-进入-腔体对中,第一Fc结构域单体的CH3抗体恒定结构域中的工程化突出物被定位成使得它与第二Fc结构域单体的CH3抗体恒定结构域中的工程化腔体相互作用,而不显著干扰在CH3抗体恒定结构域间界面处的二聚体的正常缔合。
如在此使用的,术语“连接”用于描述两个或更多个元件、组件、或蛋白质结构域(例如,多肽)通过包含化学偶联、重组方式、以及化学键(例如,二硫键和酰胺键)的方式进行的组合或附接。例如,两个单个多肽可以通过化学偶联、化学键、肽接头、或共价键的任何其他方式连接以形成一个连续的蛋白质结构。在一些实施例中,第一Fc结构域单体通过肽接头连接至第二Fc结构域单体,其中该肽接头的N-末端通过化学键(例如,肽键)连接至第一Fc结构域单体的C-末端,并且该肽接头的C-末端通过化学键(例如,肽键)连接至第二Fc结构域单体的N-末端。在其他实施例中,白蛋白结合肽的N-末端通过接头以与如上所述的相同方式连接至Fc结构域单体的CH3抗体恒定结构域的C-末端。
如在此使用的,术语“缔合”用于描述多肽(或一个单个多肽内的序列)之间的相互作用(例如,氢键键合、疏水性相互作用、或离子相互作用)这样使得这些多肽(或一个单个多肽内的序列)被定位为形成具有至少一个Fc结构域的Fc构建体。例如,各自包含一个Fc结构域单体的两个多肽可以缔合以形成Fc构建体(例如,如图1-图3所描绘的)。在一些实施例中,三个多肽,例如包含两个Fc结构域单体的一个多肽和各自包含一个Fc结构域单体的两个多肽缔合以形成具有两个Fc结构域的Fc构建体(例如,如图4和图6所示的)。在一些实施例中,四个多肽,例如各自包含两个Fc结构域单体的两个多肽和各自包含一个Fc结构域单体的两个多肽缔合以形成具有三个Fc结构域的Fc构建体(例如,如图5所描绘的)。在其他实施例中,2n个多肽,例如包含Fc结构域单体、IgG CL抗体恒定结构域、以及IgG CH1抗体恒定结构域的各多肽缔合以形成具有n个Fc结构域的Fc构建体(如图7B所描绘的)。这两个多肽可以通过它们各自的Fc结构域单体、或通过该多肽的其他组件缔合。例如,在图7B中,多肽708通过其Fc结构域单体与多肽706缔合,并且通过其CL结构域与多肽710的CH1结构域缔合的缔合来与多肽710缔合。多肽之间的缔合不包含共价相互作用。例如,在图10中,单个多肽内的Fc单体序列1014和1012缔合以形成Fc结构域,Fc单体序列1004和1006也一样。
如在此使用的,术语“接头”是指两个元件(例如,蛋白质结构域)之间的一种连接。接头可以是共价键或间隔区。术语“键”是指一种化学键(例如酰胺键或二硫键)、或由化学反应形成的任何类型的键,例如化学偶联。术语“间隔区”是指出现在两个多肽或多肽结构域之间以便在这两个多肽或多肽结构域之间提供空间和/或柔性的部分(例如,聚乙二醇(PEG)聚合物)或氨基酸序列(例如,3-200个氨基酸、3-150个氨基酸、或3-100个氨基酸序列)。氨基酸间隔区是多肽的一级序列的一部分(例如,经由多肽主链连接至间隔的多肽或多肽结构域)。例如,在形成Fc结构域的两个铰链区或两个Fc结构域单体之间形成的二硫键不被认为是接头。
如在此使用的,术语“可裂解接头”是指一种含有例如在构建体形成之后可以选择性裂解的一个或多个元件的接头,例如可裂解接头包括可以被蛋白酶选择性裂解的多肽序列。
如在此使用的,术语“白蛋白结合肽”是指具有12至16个氨基酸的氨基酸序列,该氨基酸序列对血清白蛋白具有亲和性并且起到结合血清白蛋白的作用。白蛋白结合肽可以具有不同的来源,例如人类、小鼠、或大鼠。在本发明的一些实施例中,白蛋白结合肽融合至Fc结构域单体的C-末端以增加Fc构建体的血清半衰期。白蛋白结合肽可以直接或通过接头融合至Fc结构域单体的N-末端或C-末端。
如在此使用的,术语“多聚体”是指一种包含在此描述的至少两个缔合的Fc构建体的分子。
如在此使用的,术语"多核苷酸"是指一种寡核苷酸、或核苷酸、以及其片段或部分,并且是指可以是单链或双链并代表有义链或反义链的基因组来源或合成来源的DNA或RNA。单个多核苷酸被翻译成单个多肽。
如在此使用的,术语“多肽”描述一种单个聚合物,其中单体是通过酰胺键结合在一起的氨基酸残基。多肽旨在包括天然存在的、重组的、或合成产生的任何氨基酸序列。
如在此使用的,术语“氨基酸位置”是指氨基酸在蛋白质或蛋白质结构域中的位置编号。使用卡巴特编号系统(Kabat numbering system)对抗体或Fc构建体的氨基酸位置进行编号(卡巴特等人,具有免疫学意义的蛋白质序列(Sequences ofProteins ofImmunological Interest),马里兰州贝塞斯达的美国国家卫生研究院(National Institutes of Health,Bethesda,Md.),第5版,1991)。
如在此使用的,术语“宿主细胞”是指包含由其相应核酸表达蛋白质所需要的必要细胞组件(例如,细胞器)的一种载体。这些核酸典型地包含在核酸载体中,这些核酸载体可以通过本领域已知的常规技术(转化、转染、电穿孔、磷酸钙沉淀、直接显微注射等)引入到宿主细胞中。宿主细胞可以是原核细胞,例如细菌细胞,或真核细胞,例如哺乳动物细胞(例如,CHO细胞)。如在此描述的,宿主细胞用于表达编码所希望结构域的一种或多种多肽,这些多肽然后可以组合以形成所希望Fc构建体。
如在此使用的,术语“药物组合物”是指含有活性成分以及一种或多种赋形剂和稀释剂以使得该活性成分适用于给予方法的一种药学或药物配制品。本发明的药物组合物包含与Fc构建体相容的药学上可接受的组分。药物组合物典型地是处于用于静脉内给药或皮下给药的水溶液形式。
如在此使用的,多肽或Fc构建体的“基本上同源的集合”是其中组合物(例如,药物组合物)中至少85%的多肽或Fc构建体具有相同数目的Fc结构域和相同Fc结构域结构的一个集合。在不同实施例中,组合物中至少90%、92%、95%、97%、98%、99%、或99.5%的多肽或Fc构建体是相同的。因此,包含Fc构建体基本上同源的集合的药物组合物是其中该组合物中至少85%的Fc构建体具有相同数目的Fc结构域和相同结构的一种药物组合物。Fc构建体基本上同源的集合不包括Fc构建体的多于10%(例如,不多于8%、5%、2%、或1%)的多聚体或聚集体。
如在此使用的,术语“药学上可接受的载体”是指药物组合物中的一种赋形剂或稀释剂。药学上可接受的载体必须与配制品的其他成分相容并且对接受者无害。在本发明中,药学上可接受的载体必须为Fc构建体提供适当的药物稳定性。载体的性质由于给药模式而不同。例如,对于口服给药,固体载体是优选的;对于静脉给药,通常使用水溶液载体(例如,WFI和/或缓冲溶液)。
如在此使用的,“治疗有效量”是指有效诱导受试者或患者所希望的生物效应或有效治疗患有在此描述的病状或病症的患者的量,例如药物剂量。在此还应理解的是"治疗有效量"可以解释为以一个剂量或以任何剂量或途径使用,单独或与其他治疗剂组合使用产生所希望的治疗效果的量。
附图说明
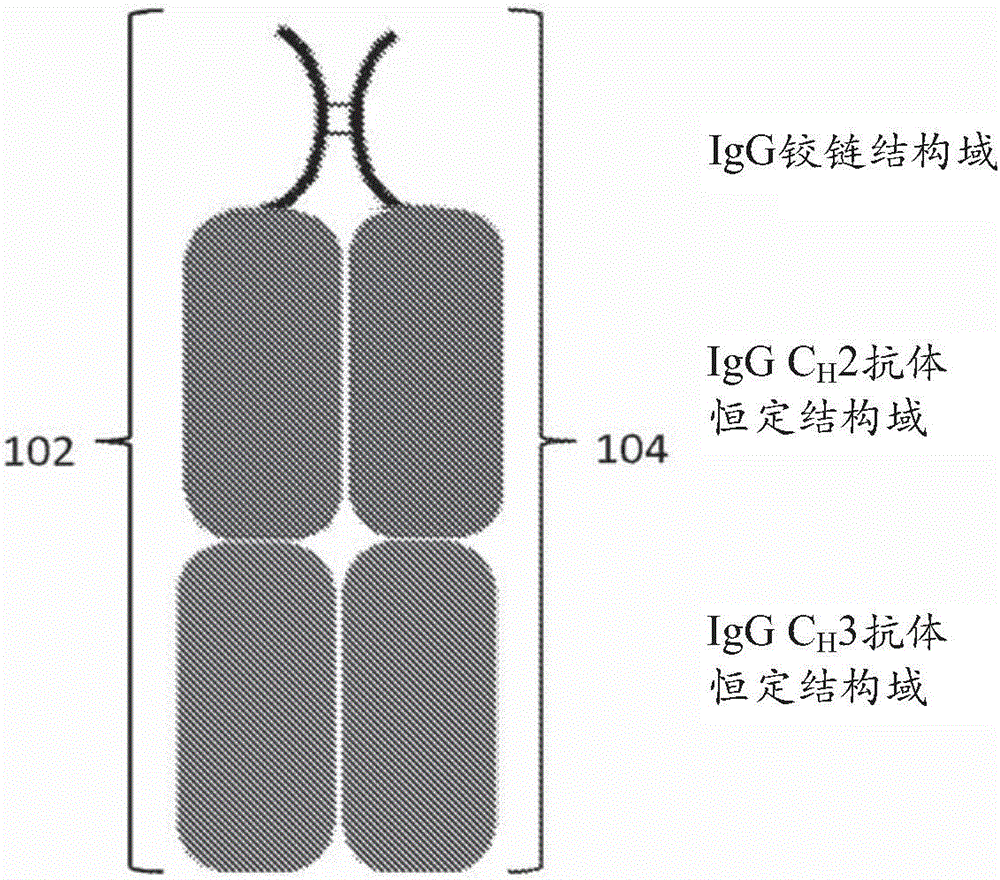
图1是含有两个野生型(wt)Fc结构域单体(102和104)的二聚体的Fc构建体(构建体1)的图示。
图2是含有两个Fc结构域单体的二聚体的Fc构建体(构建体2)的图示。第一Fc结构域单体(202)在其CH3抗体恒定结构域中含有一个突出物,而第二Fc结构域单体(204)在其CH3抗体恒定结构域中的并置位置中含有一个腔体。
图3是另一个Fc构建体的图示(构建体3)。此Fc构建体含有两个Fc结构域单体(302和304)的二聚体,其中两个Fc结构域单体在其CH3-CH3界面处均含有与wt序列不同的带电荷氨基酸以促进两个Fc结构域单体之间有利的静电相互作用。
图4是含有两个Fc结构域的Fc构建体(构建体4)的图示。此构建体由三个多肽形成。第一多肽(402)含有以串联形式连接的两个wt Fc结构域单体(404和406)。第二多肽和第三多肽(分别是408和410)各自均含有一个wt Fc结构域单体。
图5是含有由四个多肽形成的三个Fc结构域的Fc构建体(构建体5或构建体5*)的图示。第一多肽(502)含有在CH3-CH3界面处具有与wt序列不同的带电荷氨基酸的一个Fc结构域单体(506),该Fc结构域单体以串联形式与含突出物的Fc结构域单体(504)连接。第二多肽(508)含有在CH3-CH3界面处具有与wt序列不同的带电荷氨基酸的一个Fc结构域单体(512),该Fc结构域单体以串联形式与另一个含突出物的Fc结构域单体(510)连接。第三多肽和第四多肽(分别是514和516)各自含有一个含腔体Fc结构域单体。
图6是含有由三个多肽形成的两个Fc结构域的Fc构建体(构建体6)的图示。第一多肽(602)含有以串联形式连接的两个含突出物的Fc结构域单体(604和606),而第二多肽和第三多肽(分别是608和610)各自含有一个工程化为含有相应腔体的Fc结构域单体。
图7A是另一个Fc构建体(构建体7)的图示。此Fc构建体含有两个CL-CH1-Fc结构域单体(702和704)的二聚体。在此实施例中,CL抗体恒定结构域已连接至相邻的CH1抗体恒定结构域。
图7B是含有具有多个Fc结构域的CL-CH1-Fc结构域单体(例如,706、708、以及710)的多聚体的Fc构建体(构建体8)的图示。在此Fc构建体中,组成型多肽可以与构建体7中的组成型多肽相同。一个Fc构建体的CL抗体恒定结构域(例如,712)与第二个相邻Fc构建体的CH1抗体恒定结构域(例如,714)相互作用。
图8是含有由六个多肽形成的五个Fc结构域的Fc构建体(构建体9)的图示。第一多肽和第二多肽(802和810)各自含有以串联形式连接的三个Fc结构域单体(分别是804、806、808和812、814、816)。确切地说,在多肽802或810中,第一含突出物的Fc结构域单体(804或812)被连接至在CH3-CH3界面处含有与wt序列不同的带电荷氨基酸的第二Fc结构域单体(806或814),该第二Fc结构域单体被连接至第三含突出物的Fc结构域单体(808或816)。第三多肽至第六多肽(818、820、822、以及824)各自含有一个含腔体的Fc结构域单体并且分别与各Fc结构域单体804、808、812以及816形成Fc结构域。
图9是含有由六个多肽形成的五个Fc结构域的Fc构建体(构建体10)的图示。第一多肽和第二多肽(902和910)各自含有以串联形式连接的三个Fc结构域单体(分别是904、906、908和912、914、916)。确切地说,在多肽902或910中,第一含突出物的Fc结构域单体(904或912)被连接至第二含突出物的Fc结构域单体(906或914),该第二含突出物的Fc结构域单体被连接至在CH3-CH3界面处含有与wt序列不同的带电荷氨基酸的第三Fc结构域单体(908或916)。第三多肽至第六多肽(918、920、922、以及924)各自含有一个含腔体的Fc结构域单体并且分别与各Fc结构域单体904、906、912以及914形成Fc结构域。
图10是含有由具有相同序列的两个多肽形成的三个Fc结构域的Fc构建体(构建体11)的图示。这两个多肽(1002和1010)各自含有以串联形式连接的三个Fc结构域单体(分别为 1004、1006、1008和1012、1014、1016)。确切地说,每个多肽含有连接至第二含腔体的Fc结构域单体(1006或1014)的第一含突出物的Fc结构域单体(1004或1012),该第二含腔体的Fc结构域单体被连接至在CH3-CH3界面处具有与wt序列不同的带电荷氨基酸的第三Fc结构域单体(1008或1016)。Fc结构域单体1008和1016缔合以形成第一Fc结构域;Fc结构域单体1004和1006缔合以形成第二Fc结构域;并且Fc结构域单体1012和1014缔合以形成第三Fc结构域。构建体11可以通过单个多肽序列在宿主细胞中的表达来形成。
图11A-图11B分别示出构建体4的还原性和非还原性SDS-PAGE。
图12A-图12B分别示出构建体6的还原性和非还原性SDS-PAGE。
图13是构建体5的SDS-PAGE,以及示出在构建体5纯化之前和之后表达的蛋白质的百分比的表,该蛋白质具有三个Fc结构域(三聚体)、两个Fc结构域(二聚体)、或一个Fc结构域(单体)。
图14A和图14B示出使用构建体1、5和6的THP-1单核细胞激活(图14A)和阻断(图14B)测定。
图15示出IVIG以及构建体5和6在类风湿性关节炎的K/BxN模型中的效果。
图16示出IVIG以及构建体5和6在慢性ITP模型中的效果。
图17示出IVIg或构建体5对在THP-1单核细胞中的吞噬作用的抑制。
发明详细说明
包括IgG的Fc结构域的治疗性蛋白质可以用于治疗炎症以及免疫学疾病和炎症疾病。本发明涉及用于制备含有两个或更多个(例如,2-10个)Fc结构域的不同Fc构建体的组合物和方法。
I.Fc结构域单体
Fc结构域单体包含一个铰链结构域、一个CH2抗体恒定结构域以及一个CH3抗体恒定结构域。Fc结构域单体可以是免疫球蛋白抗体同种型IgG、IgE、IgM、IgA、或IgD。Fc结构域单体还可以是任何免疫球蛋白抗体同种型(例如,IgG1、IgG2a、IgG2b、IgG3、或IgG4)。Fc结构域单体的二聚体是一种可以结合Fc受体(例如,FcγRIIIa,该Fc受体是一种位于白细胞表面上的受体)的Fc结构域(在此进一步定义)。在本发明中,Fc结构域单体的CH3抗体恒定结构域可以在CH3-CH3抗体恒定结构域的界面上含有氨基酸取代以促进它们彼此的缔合。在一些实施例中,Fc结构域单体包含附接至N-末端的两个其他恒定结构域,例如CL抗体恒定结构域和CH1抗体恒定结构域(图7)。在其他实施例中,Fc结构域单体包含附接至C-末端的一个另外的部分,例如白蛋白结合肽。在本发明中,Fc结构域单体不含有任何类型的抗体可变区,例如,VH、VL、互补决定(CDR)、或高变区(HVR)。
II.Fc结构域
如在此定义的,Fc结构域包含通过CH3抗体恒定结构域之间的相互作用二聚化的两个Fc结构域单体。在本发明中,Fc结构域不包含抗体的可变区,例如VH、VL、CDR、或HVR。Fc结构域形成结合Fc受体的最小结构,该Fc受体例如FcγRI、FcγRIIa、FcγRIIb、FcγRIIIa、FcγRIIIb、FcγRIV。
III.二聚化选择性模块
在本发明中,二聚化选择性模块是有利于两个Fc结构域单体优选配对以形成Fc结构域的Fc结构域单体的一部分。确切地说,二聚化选择性模块是Fc结构域单体的CH3抗体恒定结构域包含位于两个Fc单体相互作用的CH3抗体恒定结构域之间的界面处的氨基酸取代的一部分。在二聚化选择性模块中,这些氨基酸取代使得两个CH3抗体恒定结构域由于针对这些取代选择的氨基酸的相容性而二聚化是有利。相对于由缺乏二聚化选择性模块的或在二聚化选择性模中具有不相容的氨基酸取代的Fc结构域单体形成的其他Fc结构域,可选择最终形成有利的Fc结构域。可以使用本领域熟知的常规分子克隆技术来制备此类型的氨基酸取代,该技术诸如诱变。
在一些实施例中,二聚化选择性模块包含在CH3抗体恒定结构域中的工程化腔体(在此进一步描述)。在其他实施例中,二聚化选择性模块包含在CH3抗体恒定结构域中的工程化突出物(在此进一步描述)。为了选择性地形成Fc结构域,将具有相容性二聚化选择性模块的两个Fc结构域单体(例如,一个含有工程化腔体的CH3抗体恒定结构域和另一个含有工程化突出物的CH3抗体恒定结构域)组合以形成Fc结构域单体的突出物-进入-腔体对。
在其他实施例中,具有含带正电荷氨基酸取代的二聚化选择性模块的Fc结构域单体与具有含带负电荷氨基酸取代的二聚化选择性模块的Fc结构域单体可以选择性地组合以通过带电荷氨基酸有利的静电转向(在此进一步描述)形成Fc结构域。在表1和表2中进一步列出(但不限于)具体的二聚化选择性模块,在下文中进一步描述。
在其他实施例中,两个Fc结构域单体包含在CH3结构域之间的界面处带电荷残基环内的至少两个位置中含有相同的相反电荷突变的二聚化选择性模块。通过逆转两个Fc结构域单体中的两个或更多个互补残基对的两个成员的电荷,突变的Fc结构域单体保持与相同突变序列的Fc结构域单体互补,但与不具有这些突变的Fc结构域单体具有较低互补性。在一个实施例中,Fc结构域包含含有双突变体K409D/D339K、K392D/D399K、E357K/K370E、D356K/K439D、K409E/D339K、K392E/D399K、E357K/K370D、或D356K/K439E的Fc单体。在另一个实施例中,Fc结构域包含Fc单体,这些Fc单体包括组合任何双突变体对的四突变体,例如,K409D/D399K/E357K/K370E。
此类Fc结构域的形成通过CH3抗体恒定结构域中的相容氨基酸取代来促进。含有不相容氨基酸取代的两个二聚化选择性模块(例如,两者均含有工程化腔体、两者均含有工程化突出物、或两者在CH3-CH3界面处均含有相同的带电荷氨基酸)将不会促进Fc结构域的形成。
此外,用于促进具有限定Fc结构域单体的Fc结构域形成的其他方法包括但不限于:LUZ-Y方法(美国专利申请公开号WO2011034605),该方法包括将亮氨酸拉链的单体α–螺旋的C-末端融合至各Fc结构域单体以允许异源二聚体形成,以及链交换工程化结构域(SEED)主体方法(戴维斯(Davis)等人,蛋白质工程设计选择(Protein Eng Des Sel.)23:195-202,2010),该方法生成具有各自包含IgA和IgG CH3序列的交替片段的异源二聚体Fc结构域单体的Fc结构域。
IV.工程化腔体和工程化突出物
工程化腔体和工程化突出物(或“突起进入孔”策略)的使用由卡特(Carter)和同事进行描述(里奇韦(Ridgway)等人,蛋白质工程(ProteinEng.)9:617-612,1996;阿特韦尔(Atwell)等人,分子生物学(J Mol Biol.)270:26-35,1997;默切特(Merchant)等人,自然生物技术(NatBiotechnol.)16:677-681,1998)。突起和孔相互作用促成异源二聚体形成,而突起-突起与孔-孔相互作用由于空间冲突和有利相互作用的缺失而妨碍同源二聚体形成。该“突起进入孔”技术还在美国专利号5,731,168中披露。
在本发明中,工程化腔体和工程化突出物用于制备在此描述的Fc构建体。工程化腔体是当蛋白质中的原始氨基酸被具有较小侧链体积的不同氨基酸替换时所形成的空隙。工程化突出物是当蛋白质中的原始氨基酸被具有较大侧链体积的不同氨基酸替换时所形成的凸起。确切地说,被替换的氨基酸是处于Fc结构域单体的CH3抗体恒定结构域中,并且参与两个Fc结构域单体的二聚化。在一些实施例中,在一个CH3抗体恒定结构域中形成工程化腔体以接纳另一个CH3抗体恒定结构域中的工程化突出物,这样使得两个CH3抗体恒定结构域均充当促进或促成两个Fc结构域单体二聚化的二聚化选择性模块(以上描述的)。在其他实施例中,在一个CH3抗体恒定结构域中形成工程化腔体以更好地接纳另一个CH3抗体恒定结构域中的原始氨基酸。在另外的其他实施例中,在一个CH3抗体恒定结构域中形成工程化突出物以与另一个CH3抗体恒定结构域中的原始氨基酸形成另外的相互作用。
可以通过用含有较小侧链的氨基酸(诸如丙氨酸、缬氨酸、或苏氨酸)替换含有较大侧链的氨基酸(诸如酪氨酸或色氨酸)来构造工程化腔体。确切地说,一些二聚化选择性模块(以上进一步描述)在CH3抗体恒定结构域中含有诸如Y407V突变的工程化腔体。类似地,可以通过用含有较大侧链的氨基酸替换含有较小侧链的氨基酸来构造工程化突出物。确切地说,一些二聚化选择性模块(以上进一步描述)在CH3抗体恒定结构域中含有诸如T366W突变的工程化突出物。在本发明中,工程化腔体和工程化突出物还与工程化为增强异源二聚体形成的CH3结构域间二硫键组合。确切地说,腔体Fc含有Y349C突变,并且突出物Fc含有S354C突变。与二硫键工程化或结构化计算(混合型HA-TF)组合的其他工程化腔体和工程化突出物被包括而不限于在表1中。
表1
可以通过改变编码原始氨基酸残基的核酸来实现用不同的氨基酸残基替换CH3抗体恒定结构域中的原始氨基酸残基。在仍维持界面处的充分相互作用的情况下,可以被替换的原始氨基酸残基数目的上限是CH3抗体恒定结构域界面中残基的总数目。
V.静电转向
静电转向是利用在肽中带相反电荷的氨基酸、蛋白质结构域、以及蛋白质之间有利的静电相互作用来控制高级蛋白质分子的形成。在美国专利申请公开号2014-0024111中披露了一种使用静电转向效应改变抗体结构域的相互作用以减少有利于双特异性抗体生成中的异源二聚体形成的同源二聚体形成的方法。
在本发明中,静电转向用于控制Fc结构域单体的二聚化和Fc构建体的形成。具体地说,为了使用静电转向控制Fc结构域单体的二聚化,用带正电荷或带负电荷的氨基酸残基替换构成CH3-CH3界面的一个或多个氨基酸残基,这样使得该相互作用根据所引入的带特定电荷的氨基酸而变得静电有利或不利。在一些实施例中,用带负电荷的氨基酸(诸如天冬氨酸或谷氨酸)替换界面中带正电荷的氨基酸(诸如赖氨酸、精氨酸、或组氨酸)。在其他实施例中,用带正电荷的氨基酸替换界面中带负电荷的氨基酸。带电荷氨基酸可以引入到相互作用的CH3抗体恒定结构域之一或二者中。通过将带电荷氨基酸引入到相互作用的CH3抗体恒定结构域中,形成的二聚化选择性模块(以上进一步描述)可以选择性地形成Fc结构域单体二聚体,如通过由带电荷氨基酸之间的相互作用引起的静电转向效应控制的。
在一个具体实例中,为了形成包含相反电荷的二聚化选择性模块,用Lys替换CH3抗体恒定结构域中的氨基酸Asp399,并且用Asp替换氨基酸Lys409。可以通过在两个Fc结构域单体中引入不同但相容的突变来促进Fc结构域单体的异源二聚化,这些突变诸如包括但不限于在表2中的带电荷残基对,可以通过以对称方式在两个Fc结构域单体中引入相同的突变来促进Fc结构域单体的同源二聚化,这些突变诸如双突变体K409D/D339K或K392D/D399K。
表2
VI.接头
在本发明中,接头用于描述多肽或蛋白质结构域和/或缔合的非蛋白质部分之间的连接或联接。在一些实施例中,接头是至少两个Fc结构域单体之间的连接或联接,这些结构域单体的接头将第一Fc结构域单体的CH3抗体恒定结构域的C-末端连接至第二Fc结构域单体的铰链结构域的N-末端,这样使得两个Fc结构域单体以串联形式彼此连接。在其他实施例中,接头是Fc结构域单体与附接至其上的任何其他蛋白质结构域之间的连接。例如,接头可以将Fc结构域单体的CH3抗体恒定结构域的C-末端附接至白蛋白结合肽的N-末端。在另一个实例中,接头可以将CH1抗体恒定结构域的C-末端连接至Fc结构域单体的铰链结构域的N-末端。在另外的其他实施例中,接头可以连接两个单个蛋白质结构域(不包括Fc结构域),例如CL抗体恒定结构域的C-末端可以通过接头附接至CH1抗体恒定结构域的N-末端。
接头可以是简单的共价键(例如,肽键)、合成聚合物(例如,聚乙二醇(PEG)聚合物)、或由化学反应形成的任何类型的键(例如化学偶联)。在接头是肽键的情况下,一个蛋白质结构域的C-末端处的羧酸基团可以与另一个蛋白质结构域的N-末端处的氨基基团以缩合反应进行反应从而形成肽键。确切地说,肽键可以由通过本领域熟知的常规有机化学反应的合成方式形成,或者通过由宿主细胞天然产生而形成,其中编码串联形式的两种蛋白质(例如,两个Fc结构域单体)的DNA序列的多核苷酸序列可以通过宿主细胞中必需的分子机器(例如,DNA聚合酶和核糖体)直接转录并翻译成编码两种蛋白质的连续肽。
在接头是合成聚合物(例如,PEG聚合物)的情况下,该聚合物可以在各末端处用反应性化学官能团来官能化以便与两个蛋白质的连接末端处的末端氨基酸反应。
在接头(除上述肽键以外)是由化学反应形成的情况下,化学官能团(例如,胺、羧酸、酯、叠氮化合物、或在本领域中通常使用的其他官能团)可以分别以合成方式附接至一个蛋白质的C-末端和另一个蛋白质的N-末端。然后两个官能团进行反应以通过合成化学方式来形成化学键,由此将两个蛋白质连接在一起。这种化学偶联程序对于本领域技术人员而言是常规的。
间隔区
在本发明中,两个Fc结构域单体之间的接头可以是一种包含3-200个氨基酸的氨基酸间隔区。适合的肽间隔区是本领域已知的,并且包括例如含有柔性氨基酸残基(诸如甘氨酸和丝氨酸)的肽接头。在某些实施例中,间隔区可以含有基序,例如GS、GGS、GGGGS(SEQ ID NO:1)、GGSG(SEQ ID NO:2)、或SGGG(SEQ ID NO:3)的多个基序或重复基序。在某些实施例中,间隔区可以含有2至12个氨基酸,包括GS的基序,例如GS、GSGS(SEQ ID NO:4)、GSGSGS(SEQ ID NO:5)、GSGSGSGS(SEQ ID NO:6)、GSGSGSGSGS(SEQ ID NO:7)、或GSGSGSGSGSGS(SEQ ID NO:8)。在某些其他实施例中,间隔区可以含有3至12个氨基酸,包括GGS的基序,例如GGS、GGSGGS(SEQ ID NO:9)、GGSGGSGGS(SEQ ID NO:10)、以及GGSGGSGGSGGS(SEQ ID NO:11)。在另外的其他实施例中,间隔区可以含有4至12个氨基酸,包括GGSG(SEQ ID NO:12)的基序,例如GGSG(SEQ ID NO:13)、GGSGGGSG(SEQ ID NO:14)、或GGSGGGSGGGSG(SEQ ID NO:15)。在其他实施例中,间隔区可以含有GGGGS(SEQ ID NO:16)的基序,例如GGGGSGGGGSGGGGS(SEQ ID NO:17)。在其他实施例中,间隔区还可以含有除甘氨酸和丝氨酸以外的氨基酸,例如GENLYFQSGG(SEQ ID NO:18)、SACYCELS(SEQ ID NO:19)、RSIAT(SEQ ID NO:20)、RPACKIPNDLKQKVMNH(SEQ ID NO:21)、GGSAGGSGSGSSGGSSGASGTGTAGGTGSGSGTGSG(SEQ ID NO:22)、AAANSSIDLISVPVDSR(SEQ ID NO:23)、或GGSGGGSEGGGSEGGGSEGGGSEGGGSEGGGSGGGS(SEQ ID NO:24)。在本发明的某些实施例中,使用12-或20-氨基酸肽间隔区以串联形式连接两个Fc结构域单体(图4-图6),该12-和20-氨基酸肽间隔区分别由序列GGGSGGGSGGGS(SEQ ID NO:25)和SGGGSGGGSGGGSGGGSGGG(SEQ ID NO:26)组成。在其他实施例中,使用由序列GGSGGGSGGGSGGGSGGS(SEQ ID NO:27)组成的18-氨基酸肽间隔区连接CL和CH1抗体恒定结构域(图7A-图7B)。
VII.血清蛋白结合肽
结合至血清蛋白肽可以改善蛋白质药物的药代动力学,并且具体地说在此描述的Fc构建体可已与血清蛋白结合肽融合。
作为一个实例,可以用于在此描述的方法和组合物的白蛋白结合肽通常是本领域已知的。在一个实施例中,白蛋白结合肽包含序列DICLPRWGCLW(SEQ ID NO:28)。
在本发明中,白蛋白结合肽可以附接至Fc构建体中某些多肽的N-末端或C-末端。在一个实施例中,白蛋白结合肽可以附接至构建体1、2、3、或7A(分别是图1、图2、图3、以及图7A)中一个或多个多肽的C-末端。在另一个实施例中,白蛋白结合肽可以融合至编码在构建体4、5以及6(分别是图4、图5、以及图6)中以串联形式连接的两个Fc结构域单体的多肽的C-末端。在又另一个实施例中,白蛋白结合肽可以附接至Fc结构域单体的C-末端,该Fc结构域单体连接至编码以串联形式连接的两个Fc结构域单体的多肽中的第二Fc结构域单体,如在构建体4和构建体6(分别是图4和图6)中所示。白蛋白结合肽可以遗传方式融合至Fc构建体或通过化学方式(例如,化学偶联)附接至Fc构建体。如有需要,间隔区可以被插入在Fc构建体与白蛋白结合肽之间。在不受理论的束缚的情况下,所预期的是在本发明的Fc构建体中包含白蛋白结合肽可以使得治疗性蛋白质通过其结合至血清白蛋白而延长保留。
VIII.Fc构建体
总的来说,本发明涉及具有2-10个Fc结构域的Fc构建体。这些Fc构建体可以对于Fc受体(例如,FcγRIIIa)具有大于单个野生型Fc结构域的结合亲和力和/或亲合力。本发明披露了对两个相互作用的CH3抗体恒定结构域的界面处的氨基酸进行工程化,以使得Fc结构域的两个Fc结构域单体彼此选择性地形成一种二聚体,因此防止形成不需要的多聚体或聚集体的方法。Fc构建体包含偶数个Fc结构域单体,其中各Fc结构域单体对形成一个Fc结构域。Fc构建体最少包含由两个Fc结构域单体的二聚体形成的一个功能性Fc结构域。
在一些实施例中,Fc构建体含有包含两个Fc结构域单体的二聚体的一个Fc结构域(图1-图3和图7A)。相互作用的CH3抗体恒定结构域可以是未修饰的(图1)或者可以在它们的界面处含有氨基酸取代。确切地说,氨基酸取代可以是工程化腔体(图2)、工程化突出物(图2)、或带电荷氨基酸(图3)。
在其他实施例中,Fc构建体含有由三个多肽形成的两个Fc结构域(图4和图6)。第一多肽含有通过接头连接的以串联形式连接的两个Fc结构域单体,并且第二多肽和第三多肽含有一个Fc结构域单体。第二多肽和第三多肽可以是相同的多肽或者可以是不同的多肽。图4描绘这种Fc构建体的一个实例。第一多肽含有通过接头以串联形式连接的两个野生型Fc结构域单体,并且第二多肽和第三多肽各自含有一个野生型Fc结构域单体。第一多肽中的一个Fc结构域单体与第二多肽形成第一Fc结构域,而第一多肽中的另一个Fc结构域单体与第三多肽形成第二Fc结构域。第二多肽和第三多肽彼此不附接或连接。图6描绘与图4的Fc构建体类似的Fc构建体。在图6中,第一多肽中的Fc结构域单体二者均含有在CH3抗体恒定结构域中的工程化突出物,而第二多肽和第三多肽含有在CH3抗体恒定结构域中的工程化腔体。工程化突出物-进入-腔体CH3-CH3界面促成Fc结构域单体形成异源二聚体,并且防止不受控制地形成不需要的多聚体。如在此进一步描述的,在实例4中,包含工程化CH3抗体恒定结构域的二聚化选择性模块防止形成实例3中可见的不需要的多聚体,该实例3描述了来自缺乏二聚化选择性模块的Fc结构域单体的Fc构建体形成。
此外,在其他实施例中,Fc构建体可以含有由四个多肽形成的三个Fc结构域(图5)。第一多肽和第二多肽可以是相同或不同的,第三多肽和第四多肽也可以是这样的。在此实例中,第一多肽和第二多肽两者编码通过接头以串联形式连接的两个Fc结构域单体,其中一个Fc结构域单体在CH3抗体恒定结构域中含有带电荷的氨基酸取代,而另一个Fc结构域单体在CH3抗体恒定结构域中含有突出物。第三多肽和第四多肽二者均编码具有腔体的Fc结构域单体。第一多肽和第二多肽通过它们CH3抗体恒定结构域中相反电荷的相互作用来彼此形成第一Fc结构域。第二Fc结构域和第三Fc结构域通过第一多肽和第二多肽中的突出物与第三多肽和第四多肽中的腔体之间的突出物-进入-腔体相互作用而形成。在此Fc构建体中的各Fc结构域单体含有促进特定Fc结构域形成的二聚化选择性模块。
在另外的其他实施例中,单个多肽可以形成二聚体(例如,构建体7A;图7A)或多聚体(例如,构建体7B;图7B),不是通过CH3抗体恒定结构域之间的相互作用,而是通过CL恒定结构域与CH1恒定结构域之间的相互作用。图7B描绘了含有其中一个Fc结构域的CL结构域与相邻Fc结构域的CH1结构域相互作用的多重Fc结构域的Fc构建体。
在另外的其他实施例中,Fc构建体可以含有由六个多肽形成的五个Fc结构域。两个实例描绘于图8和图9中。当这些描绘的Fc构建体包含六个多肽时,这些多肽中的四个多肽可以由相同核酸编码,并且其余两个多肽也可以由相同核酸编码。其结果是,这些Fc构建体可以通过两个核酸在适合的宿主细胞中表达来产生。
在另一个实施例中,含有两个或更多个Fc结构域的Fc构建体可以由具有相同一级序列的两个多肽形成。这种构建体可以通过单个多肽序列在宿主细胞中的表达来形成。一个实例描绘于图10中。在此实例中,单个核酸足以编码含有三个Fc结构域的Fc构建体。通过包含具有足够长度和柔性的柔性接头来允许作为相同多肽的一部分的两个Fc结构域单体形成Fc结构域;此接头可以是可裂解接头。这种相同多肽还含有通过任选的柔性接头连接的第三Fc结构域单体。这种第三Fc结构域单体能够连接至另一个Fc结构域单体以产生描绘于图10中的Y-形Fc构建体。Fc结构域的形成可以通过使用二聚化选择性模块来控制,还如图10所描绘的。
IX.宿主细胞和蛋白质生产
在本发明中,宿主细胞是指一种包含由其相应核酸表达在此描述的多肽和构建体所需要的必需细胞组件(例如,细胞器)的载体。这些核酸可以被包含在可以通过本领域已知的常规技术(转化、转染、电穿孔、磷酸钙沉淀、直接显微注射等)引入到宿主细胞中的核酸载体中。宿主细胞可以是哺乳动物来源或细菌来源。哺乳动物宿主细胞包含但不限于CHO(或CHO来源的细胞株,例如CHO-K1、CHO-DXB11、CHO-DG44)、鼠类宿主细胞(例如,NS0、Sp2/0)、VERY、HEK(例如,HEK293)、BHK、HeLa、COS、MDCK、293、3T3、W138、BT483、Hs578T、HTB2、BT20以及T47D、CRL7O3O以及HsS78Bst细胞。还可以选择调节蛋白质构建体的表达,或以所希望的特定方式修饰和加工蛋白质产物的宿主细胞。不同的宿主细胞对于蛋白质产物的翻译后加工和修饰具有特征性的和具体的机制。可以选择适当的细胞系或宿主系统以确保该表达的蛋白质的正确修饰和加工。
为了由它们相应的DNA质粒构建体表达和分泌蛋白质产物,可以使用由本领域已知的适当表达控制元件控制的DNA转染或转化宿主细胞,这些控制元件包括启动子、增强子、序列、转录终止子、聚腺苷酸化位点,以及可选择性标记。用于表达治疗性蛋白质的方法是本领域已知的。参见,例如,宝琳娜巴尔巴斯(Paulina Balbas)、阿赫利娅洛朗斯(Argelia Lorence)(编辑)重组基因表达:回顾和协议(分子生物学方法)(Recombinant Gene Expression:Reviews and Protocols(Methods in Molecular Biology)),胡马纳出版社(Humana Press);第二版2004版(2004年7月20日);弗拉基米尔沃伊诺夫(Vladimir Voynov)和贾斯汀(Justin)A.卡拉维尔(Caravella)(编辑)治疗性蛋白质:方法和协议(Therapeutic Proteins:Methods and Protocols)(分子生物学方法)胡马纳出版社;第二版2012版(2012年6月28日)。
X.纯化
可以通过蛋白质纯化领域已知的任何方法来纯化Fc构建体,例如通过色谱法(例如,离子交换、亲和色谱法(例如,蛋白A亲和色谱法)、以及大小排阻柱色谱法)、离心、差别溶解法、或通过用于纯化蛋白质的任何其他标准技术。例如,可以通过适当地选择和组合亲和柱(诸如蛋白A柱与色谱柱)、过滤、超滤、盐析以及渗析程序来分离并纯化Fc构建体(参见,例如,抗体的生产规模纯化(Process Scale Purification ofAntibodies),乌韦戈特沙尔克(Uwe Gottschalk)(编辑)约翰威利父子公司(John Wiley&Sons,Inc.),2009;以及萨勃拉曼尼亚(Subramanian)(编辑)抗体-第I卷-生产和纯化(Antibodies-Volume I-Production and Purification),克鲁维尔学术/普莱南出版社(Kluwer Academic/Plenum Publishers),纽约(2004))。在一些情况下,Fc构建体可以偶联至标记物序列,诸如一种有助于纯化的肽。标记物氨基酸序列的一个实例是结合具有微摩尔亲和力的镍官能化琼脂糖亲和柱的六组氨酸肽。适用于纯化的其他肽标签包括但不限于,对应于衍生自流感血球凝集素蛋白的表位的血球凝集素"HA"标签(威尔逊(Wilson)等人,1984,细胞(Cell)37:767)。
对于Fc构建体,可以使用蛋白A柱色谱法作为纯化方法。蛋白A配体通过Fc区域与Fc构建体相互作用,使蛋白A色谱法成为一种能够消除大部分宿主细胞蛋白的高选择性俘获方法。在本发明中,可以使用如实例2描述的蛋白A柱色谱法纯化Fc构建体。
XI.药物组合物/制备
本发明涉及包含在此描述的一种或多种Fc构建体的药物组合物。在一个实施例中,药物组合物包含结构相同或基本上相同的Fc构建体的基本上同源的集合。在不同实例中,药物组合物包含构建体1-10和5*中任一个的基本上同源的集合。
本发明的治疗性蛋白质构建体(例如,Fc构建体)可以被掺入到药物组合物中。包含治疗性蛋白质的药物组合物可以通过本领域技术人员已知的方法来配制。该药物组合物可以可注射配制品形式(该配制品包括在水中或在另一种药学上可接受的液体中的无菌溶液或悬浮液)肠胃外给药。例如,该药物组合物可以通过适当地将该Fc构建体与药学上可接受的载体或介质组合,随后以通常可接受的药学实践所需要的单位剂型混合来进行配制,该载体或介质诸如灭菌注射用水(WFI)、生理盐水、乳化剂、悬浮剂、表面活性剂、稳定剂、稀释剂、粘合剂、赋形剂。药物制剂中包含的活性成分的量是提供在指定范围中的这种适合的剂量。
注射用无菌组合物可以根据常规药学实践使用注射用蒸馏水作为一种媒介物来配制。例如,生理盐水或含有葡萄糖和其他补充物诸如D-山梨糖醇、D-甘露糖、D-甘露醇以及氯化钠的等渗溶液可以用作一种注射用水溶液,任选地与一种适合的增溶剂,例如醇如乙醇和多元醇(如丙二醇或聚乙二醇)、以及一种非离子表面活性剂如聚山梨酯80TM、HCO-50、以及本领域通常已知的类似物组合。用于治疗性蛋白质产物的配制方法是本领域已知的,参见例如,邦加(Banga)(编辑)治疗性肽和蛋白质:配制、处理和递送系统(Therapeutic Peptides and Proteins:Formulation,Processing and Delivery Systems)(第二版)泰勒-弗朗西斯集团CRC出版社(Taylor&Francis Group,CRC Press)(2006)。
XII.剂量
该药物组合物以与剂量配制品相容的方式并且以治疗有效的此量来给药以便产生症状的改善或好转。以多种剂型给予该药物组合物,例如静脉内剂型、皮下剂型、口服剂型(诸如可摄取的溶液、药物释放胶囊)等。用于个体受试者的适当剂量取决于治疗目的、给药途径、以及患者的病状。总体上,重组蛋白质以1-200mg/kg,例如1-100mg/kg,例如20-100mg/kg的剂量给药。因此,对于医疗提供者来说必要的是调整和确定剂量并且根据需要改进给药途径以获得最佳的治疗效果。
XIII.适应症
本发明的药物组合物和方法适用于减轻受试者中的炎症、促进受试者中的自身抗体清除、抑制受试者中的抗原呈递、减轻受试者中的免疫应答(例如,阻断免疫应答基于免疫复合物的激活)以及治疗受试者中的免疫学和炎性病状或疾病。示例性病状和疾病包括类风湿性关节炎(RA);系统性红斑狼疮(SLE);ANCA-相关性脉管炎;抗磷脂抗体综合征;自身免疫性溶血性贫血;慢性炎性脱髓鞘性神经病;移植中的抗异体、GVHD中的抗自身抗体、抗替代品、IgG治疗剂、IgG异常蛋白的清除;皮肌炎;古德帕斯彻氏综合征;通过抗体依赖性细胞介导的细胞毒性介导的靶向器官系统II型超敏反应综合征,例如吉兰-巴雷综合征、CIDP、皮肌炎、费尔蒂综合征、抗体-介导的排斥、自身免疫性甲状腺疾病、溃疡性结肠炎、自身免疫性肝病;特发性血小板减少性紫癜;重症肌无力、视神经脊髓炎;天疱疮及其他自身免疫发泡性紊乱;硬皮病;自身免疫性血细胞减少及其他通过抗体依赖性吞噬作用介导的病症;其他FcR依赖性炎性综合症,例如滑膜炎、皮肌炎、系统性血管炎、肾小球炎以及血管炎。
实例
实例1–DNA质粒构建体的设计和克隆
将总计八种DNA质粒构建体用于装配八种Fc构建体(图1-图7B)。将DNA质粒构建体转染至人胚肾(HEK)293细胞内以用于蛋白质产生。八种编码的分泌多肽具有如下描述的一般结构:
A.wt Fc:野生型Fc结构域单体(图1:102和104;图4:408和410)。
B.突出物Fc:在CH3抗体恒定结构域中具有工程化突出物的Fc结构域单体(图2:202)。
C.腔体Fc:在CH3抗体恒定结构域中具有工程化腔体的Fc结构域单体(图2:204;图5:514和516)。
C*.腔体Fc*:在CH3抗体恒定结构域中具有工程化腔体的Fc结构域单体(图2:204;图5:514和516)。相对于腔体Fc,腔体Fc*还含有另外的氨基酸取代。
D.电荷Fc:在CH3抗体恒定结构域中具有相反电荷的Fc结构域单体(图3:302和304)。
E.wt-12-wt Fc2:通过12-氨基酸GGGS肽接头以串联形式连接的两个Fc结构域单体(图4:402)。
F.突出物-20-电荷Fc2:通过20-氨基酸SGGG肽接头以串联形式连接的在CH3抗体恒定结构域中具有相反电荷的Fc结构域单体和在CH3抗体恒定结构域中具有工程化突出物的Fc结构域单体(图5:502和508)。
F*.突出物-20-电荷Fc2*:通过20-氨基酸SGGG肽接头以串联形式连接的在CH3抗体恒定结构域中具有相反电荷的Fc结构域单体和在CH3抗体恒定结构域中具有工程化突出物的Fc结构域单体(图5:502和508)。相对于突出物Fc,突出物-20-电荷Fc2*还含有另外的氨基酸取代。
G.突出物-20-突出物Fc2:通过20-氨基酸GGGS肽接头以串联形式连接的在CH3抗体恒定结构域中均具有工程化突出物的两个Fc结构域单体(图6:602)。
H.CHCL Fc+:附接至铰链结构域的具有CH1和CL恒定结构域的Fc结构域单体(图7A:702和704;图7B:706、708、710、712、714、以及716)。CL恒定结构域通过18氨基酸GGGS肽接头附接至CH1恒定结构域。
Fc DNA序列来源于人IgG1Fc。在亲本Fc序列中取代突出物、腔体和电荷突变。将编码来源于人免疫球蛋白κ轻链的前导肽的DNA附接至5’区域。除一个之外的所有多肽(CHCLFc+)均在氨基端上含有这种编码的肽以指导蛋白质转位到内质网以便装配和分泌。应当理解,多种前导肽中的任一种可以用于与本发明相结合。该前导肽通常在ER腔内被剪去。将含有5’末端EcoR1位点的11个核苷酸序列添加至ATG起始密码子的上游。将含有3’末端Xho1位点的30个核苷酸序列添加至3’末端TGA翻译终止密码子的下游。优化这些DNA序列以在哺乳动物细胞中表达并且将这些序列克隆至pcDNA3.4哺乳动物表达载体中。
由野生型氨基酸残基跟随使用EU卡巴特编号系统的位置(卡巴特等人,具有免疫学意义的蛋白质序列,马里兰州贝塞斯达的美国国家卫生研究院,第5版,1991)并且然后是单字母代码的替换残基来表示突变。以下提供以上描述的分泌的多肽A-H的核苷酸和氨基酸序列(除了对其仅提供氨基酸序列的腔体Fc*和突出物-20-电荷Fc2*之外)。
wt Fc
SEQ ID NO:29:
SEQ ID NO:30:
突出物Fc
SEQ ID NO:31:
SEQ ID NO:32:
腔体Fc
SEQ ID NO:33:
SEQ ID NO:34:
腔体Fc*SEQ ID NO:45:
电荷Fc
SEQ ID NO:35:
SEQ ID NO:36:
wt-12-wt Fc2
SEQ ID NO:37:
SEQ ID NO:38:
突出物-20-电荷Fc2
SEQ ID NO:39:
SEQ ID NO:40:
突出物-20-电荷Fc2*
SEQ ID NO:46:
突出物-20-突出物Fc2
SEQ ID NO:41:
SEQ ID NO:42:
CHCL Fc+
SEQ ID NO:43:
SEQ ID NO:44:
实例2–Fc构建体蛋白质的表达
对于Fc构建体的蛋白质表达,将选自实例1中描述的A-H的两个DNA质粒构建体转染至EXPI293细胞(生命技术公司(LifeTechnologies))中。使用脂质体转染将质粒DNA引入到EXPI293细胞。转染的质粒构建体的总量是固定的,而不同质粒构建体的比率被改变为最大化所希望的构建体的产率(参见下表3)。对于各Fc构建体,两个转染的DNA质粒构建体的比率(按质量计)在表3中示出。这些构建体的图示在图1-图7B中示出。
在蛋白质表达后,通过基于蛋白A的亲和柱色谱法将表达的构建体从细胞培养物上清液中纯化。使用AKTA Avant制备型色谱系统(GE医疗保健生命科学公司(GE Healthcare Life Sciences))将培养基上清液负载到PorosMabCapture A(生命技术公司)柱上。然后用磷酸盐缓冲盐水洗涤捕获的Fc构建体(低盐洗涤),随后用补充有500mM NaCl的磷酸盐缓冲盐水洗涤(高盐洗涤)。用100mM甘氨酸、150mM NaCl、pH 3缓冲液洗脱Fc构建体。通过添加pH 7.4的1M TRIS直至最终浓度为100mM来中和从该柱中出来的蛋白质溶液。通过使用XS树脂进行离子交换色谱法来对Fc构建体进行进一步分馏(应用的生物科学目录号#4404336)。用pH 6的10mMMES(缓冲液A)预平衡该柱,并且用针对pH 6的10mM MES、500mM氯化钠(缓冲液B)的梯度洗脱样品。
获得总计七种Fc构建体(参见以下表3和图1-图7B)。通过在还原和非还原两种条件下进行SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)来分析纯化的Fc构建体,随后进行考马斯亮蓝染色法以确认具有预期大小的蛋白带的存在。
表3
实例3–构建体4的制备和SDS-PAGE分析
使用两个DNA质粒构建体wt-12-wt Fc2(实例1中的DNA质粒构建体E)和wt Fc(实例1中的DNA质粒构建体A)表达构建体4(图4)。将两个质粒构建体转染至HEK 293细胞中以用于如实例2中描述的蛋白质表达和纯化。图11A-图11B示出构建体4的还原性和非还原性SDS-PAGE。在还原性SDS-PAGE(图11A)上,观察到与wt Fc结构域单体相对应的约25kDa的一个条带(泳道2和3,图11A)和与wt-12-wt Fc2串联二聚体相对应的50kDa的一个条带(泳道1-3,图11A)。在非还原性SDS-PAGE(图11B)上,泳道2和3各自含有分别为较高(1/2)和较低(1/3)蛋白质量的构建体4的最终蛋白质产物。观察到与wt-12-wt Fc2串联二聚体和两个wt Fc结构域单体用以形成构建体4的缔合相对应的约100kDa的一个主要条带,以及与未和wt Fc结构域单体连接的游离wt-12-wt Fc2串联二聚体相对应的约50kDa的具有近似相等信号强度的另一个主要条带。
此外,观察到与wt-12-wt Fc2和wt Fc结构域单体的多聚体相对应的约150kDa、200kDa和250kDa的较高分子量条带(泳道2和3,图11B)。
实例4–构建体6的制备和SDS-PAGE分析
使用两个质粒构建体突出物-20-突出物Fc2(实例1中的DNA质粒构建体G)和腔体Fc(实例1中的DNA质粒构建体C)表达构建体6(图6)。将两个质粒构建体转染至HEK 293细胞中以用于如实例2中描述的蛋白质表达和纯化。图12A-图12B示出构建体6的还原性和非还原性SDS-PAGE。在还原性SDS-PAGE(图12A)上,观察到与腔体Fc结构域单体相对应的约25kDa的一个条带(泳道2和3,图12A)和与突出物-20-突出物Fc2串联二聚体相对应的50kDa的一个条带(泳道1-3,图12A)。在非还原性SDS-PAGE(图12B)上,泳道2和3各自含有较高(1/2)和较低(1/3)蛋白质量的构建体6的最终蛋白质产物。观察到与突出物-20-突出物Fc2串联二聚体和两个腔体Fc结构域单体的缔合相对应的约100kDa的一个主要条带,以及与未和任何腔体Fc结构域单体组合的游离突出物-20-突出物Fc2串联二聚体相对应的约50kDa的具有较弱信号强度的一个次要条带。
用构建体5进行类似的实验(图13)。使用两个质粒构建体突出物-20-电荷Fc2(实例1中的DNA质粒构建体F)和腔体Fc(实例1中的DNA质粒构建体C)表达构建体5(图5)。通过阳离子脂质转染以通过经验确定的比率将两个质粒构建体转染至EXPI293细胞中。将转染的培养物在细胞培养基中孵育6-8天。在此之后,通过离心作用移除这些细胞。该上清液(培养基,图13的泳道1)含有由转染细胞分泌至培养基中的构建体5。培养基中还存在污染的宿主细胞蛋白质。通过蛋白-A亲和色谱法从该培养基中纯化构建体5。就这一点,培养基包含所希望的构建体5,该构建体具有三个Fc结构域(三聚体)以及一定比例的含有两个Fc结构域(二聚体,约10%-15%)和一个Fc结构域(单体,5%-10%)的错误装配的蛋白质。还仍然存在少量污染的宿主细胞蛋白质。将蛋白A柱洗脱物缓冲交换、浓缩并且通过强阳离子交换剂(SCX)色谱法进行分馏。简言之,将构建体5结合SCX柱并且然后用盐和pH梯度洗脱。此步骤使具有三个Fc结构域的所希望的构建体5能与大部分具有两个或一个Fc结构域的错误装配的蛋白质、与具有不需要的翻译后修饰的构建体5、以及与污染的宿主细胞蛋白质分离。在另一轮的浓缩和缓冲交换后,获得一种构建体5的最终的纯蛋白质产物(纯的,图13的泳道2)。
图13描绘了由培养的工程化为表达构建体5(泳道1)和纯化的构建体5(泳道2)的宿主细胞获得的培养基的SDS-PAGE。还示出显示各样品的SDS-PAGE的主要条带的百分比的表格。在该培养基样品(泳道1)中,观察到约150kDa的一个主要条带,该主要条带与具有三个Fc结构域的构建体5的最终蛋白质产物相对应。该培养基样品还含有与具有两个Fc结构域的蛋白质相对应的100kDa的具有较弱信号强度的一个次要条带,以及与具有一个Fc结构域的蛋白质相对应的50kDa的具有最弱信号强度的一个第二次要条带。在纯化(泳道2)后,将具有三个Fc结构域的构建体5的最终蛋白质产物相对应的大约150kDa的一个主要条带富集。在构建体5的SDS-PAGE上的蛋白质条带信号强度的量化显示在培养基中在蛋白质纯化前约79%总蛋白质是所希望的构建体5的蛋白质产物。在蛋白质纯化后,获得具有约95%纯度的构建体5的基本上同源的集合。
这些发现证实,在CH3抗体恒定结构域中含有工程化突出物或工程化腔体的选择性二聚化模块减少自缔合并且防止不受控制的Fc-介导的聚集体或多聚体形成,这表明使用于在此描述的构建体中的二聚化选择性模块可以用于产生Fc构建体的基本上同源的制品。此观察对于在构建体的制造、产率和纯度中的优点具有显著影响,例如,为了控制生物学活性和效力。
实例5–结合亲和力和亲合力
使用基于细胞的FRET竞争性测定(Cisbio生物测定)来评估构建体与多个Fcγ受体的结合。相对于野生型Fc结构域(构建体1),构建体5和构建体6针对FcγRIIa、FcγRIIbn和FcγRIIIa示出至少十倍IC50降低(即,增强的结合)。
实例6–单核细胞激活和阻断测定
测试分别含有一个、三个和两个Fc结构域的三种Fc构建体,构建体1、构建体5和构建体6自其身激活THP-1单核细胞的能力。将IL-8释放用作单核细胞激活的指示。构建体1、构建体5和构建体6是如实例1和2描述地进行表达和纯化的。将各纯化的Fc构建体添加至THP-1单核细胞。对于三种构建体中的任一种未观察到大量IL-8释放。该数据在图14A中提供。
然后测试相同的三种Fc构建体抑制Fc受体-介导的单核细胞激活的能力。在96孔板上固定IgG1(100μg/mL)并且将其用于诱导由THP-1单核细胞进行的IL-8释放。随后在组织培养板中进行构建体1、构建体5和构建体6或对照物质(静脉注射免疫球蛋白(IVIg)、人血清白蛋白(HSA)、和甘氨酸缓冲液)的连续稀释。立即添加THP-1单核细胞(1.5×105个细胞)同时彻底混合。将培养物孵育18h并且分析上清液的IL-8。发现在低剂量下构建体5和构建体6比构建体1更有效地抑制IL-8释放。该数据在图14B中提供。
实例7–K/BxN关节炎模型
使用一种在安东尼(Anthony),美国科学院院报(Proc.Natl.Acad.Sci.U.S.A)105:19571-19578(2008)中描述的方法在K/BxN血清传递模型中测试Fc构建体1、Fc构建体5和Fc构建体6以及IVIg保护小鼠使其免于关节炎症的能力。12周大的K/BxN小鼠自杰克逊实验室(Jackson Laboratories)获得/购买。将总计30只C57BL小鼠分成各6只小鼠的五个组。在注射200μl K/BxN血清(一种关节炎诱导血清)前一个小时,用200μl的0.1g/kg构建体6、200μl的0.1g/kg构建体5、200μl的0.1g/kgIVIg、230μl的0.1g/kg IVIg、或200μl的磷酸盐缓冲盐水(PBS)静脉内注射(i.v.)各组(第0天)。通过临床检查足肿胀和踝关节厚度来评分炎症。对于足肿胀,每只足被评分为0-3分(0,无肿胀;3,最大肿胀)。针对每单个小鼠的总临床评分添加四只足的评分。对于踝关节厚度,使用卡尺测量。从第0天至第10天每天对每只小鼠进行评分。每个组六只小鼠的每日平均临床评分绘制在图15中。如图15所示,1g/kg的IVIg、0.1g/kg的构建体5、以及0.1g/kg的构建体6提供类似水平的炎症保护。鉴于构建体5和构建体6以与IVIg的剂量相比低十倍的剂量给药,构建体5和构建体6似乎比IVIg更有效。
实例8–慢性ITP模型
测试构建体1和构建体5以及IVIg治疗罹患免疫性血小板减少(ITP)的小鼠的能力。ITP由一种导致血小板缺失的抗血小板Ab诱导。每天用1.5μg/小鼠的大鼠抗-CD41抗体(Ab)(克隆MWReg30BioLegend公司目录号#133910)i.p.注射45只C57BL/6小鼠(18-22g,马塞诸州的查尔斯河实验室(Charles Rivers Labs,MA)),持续4天(在第1天、第2天、第3天和第4天)。用1.5μg/小鼠的大鼠IgG1、k同种型对照Ab(BioLegend公司目录号#400414)注射5只小鼠以确定正常血小板水平。以100μl PBS注射Ab。在第3天注射第三次抗-CD41Ab后,用200μl盐水对照,1g/kg的IVIg、0.02、0.03、0.1和0.3g/kg的构建体1、以及0.004、0.02和0.1g/kg的构建体5向所有小鼠静脉内给药一次。在第5天(在第四次抗-CD41Ab注射后24h)将小鼠放血以通过VetScan仪器定量总血小板水平。遵循动物福利法案(Animal Welfare Act)和实验室动物护理和应用指南(Guide for the Care andUse ofLaboratoryAnimals)来进行所有程序。
如图16所示,当与盐水对照时,在用0.02和0.1g/kg的构建体5进行治疗性处理后,血小板水平显著提高(通过使用多重比较测试的单向方差分析****p<0.0001)。这些组中的血小板水平类似于正常的同种型处理组中的水平。当与盐水对照时,用1g/kg的IVIg与0.1和0.3g/kg的构建体1进行治疗性处理,也显著提高了血小板水平(通过使用多重比较测试的单向方差分析分别为*p<0.05;**p<0.01),但这些组中的血小板水平低于0.02和0.1g/kg的构建体5处理组中的血小板水平。在此模型中,构建体5似乎比IVIg更加有效约50倍。
实例9–构建体5*示出与IVIg相比增强的与FcγR的结合和亲合力
根据如实例8描述的相同方案,将编码突出物-20-电荷Fc2*(实例1中的构建体F*)和腔体Fc*(实例1中的构建体C*)的两个质粒构建体用于表达并纯化构建体5*。在荧光共振能量转移(FRET)竞争性结合测定中将此构建体与不同Fc受体的结合特性与IVIG进行比较。
构建体5*显示出类似于IVIg的与不同Fcγ-受体的整体结合特性(其中对FcγRIIb观察到最低的结合亲和力),但当与IVIg相比时具有与所有低亲和力FcγR的极大增强的结合。与FcγR增强的结合对应于较高的亲合力,该亲合力是指各单个结合相互作用的累计亲和力的累积效应。构建体5*的IC50值始终低于IVIg的IC50值,这表明与单个IgG分子相比,与低亲和力FcγR的结合显著增强。例如,与IVIg相比,构建体5*显示约170倍增强的对FcγRIIa(H131变体)的亲和力、55倍增强的对FcγRIIb的亲和力。
实例10–抑制THP-1单核细胞中的吞噬作用
在一个吞噬作用模型中测试构建体5*和IVIg。
吞噬作用是细胞(吞噬细胞)吞噬固体颗粒(诸如细菌)以形成一种称为吞噬体的内部囊泡的过程。在免疫系统中,吞噬作用是一种用于消除病原体和细胞碎片的主要机制。单核细胞和巨噬细胞包括在通过吞噬作用(一种很大程度上依赖于FcγR介导的接合的机制)专门从免疫系统清除受调理(抗体包覆)颗粒的细胞中。然而,在自身免疫性疾病中,吞噬细胞可以被激活,从而导致身体中促炎细胞因子的有害释放以及其他关键细胞的吞噬作用。将含有从超过一千名供血者的血浆中提取的合并的、多价的IgG抗体的IVIg用于治疗自身免疫性疾病。
在此测定系统中,将荧光标记抗体包覆的乳胶珠(一种对受调理的细菌或病毒的模仿)送至THP-1细胞中并且允许在构建体5*和IVIg存在和缺乏下吞噬。在孵育期结束时,用台盼蓝猝灭任何外部荧光,并且通过流式细胞计数法量化细胞内荧光的量。将所有组归一化至它们的未处理对照(仅THP-1细胞和乳胶珠)。结果代表两个独立的实验。
如图17所示,THP-1单核细胞对受调理的珠子的吞噬作用通过使用IVIg和构建体5*两者的处理进行抑制,但构建体5*的IC50值比IVIg的IC50值低约100倍。这表明,本发明的Fc构建体(例如,构建体5*)可以用于治疗自身免疫适应症以及使用IVIg可治疗的其他适应症。
- 还没有人留言评论。精彩留言会获得点赞!