一种高效生产κ‑卡拉胶低聚糖的生物反应器及其应用的制作方法
本发明属于固定化细胞制备技术领域,涉及一种高效生产κ-卡拉胶低聚糖的生物反应器及其应用。
背景技术:
固定化细胞技术是指用物理或化学的手段将游离细胞定位于限定的空间区域,并使其保持催化活性、反复使用的方法。由于固定化细胞保持了细胞的生命活动能力,它不但比游离细胞的发酵更具有优越性,而且比固定化酶有更多的优点,因为固定化细胞省去了制备酶或含酶细胞处理过程所需要的完整酶系,并能不断产生新酶及其所需的辅助因子,且固定化方法较简单,可以连续发酵,节约了成本,而且在蒸馏和提取前不用分离去细胞,能一边徘出发酵液,一边进行培养,排除了产物抑制和消耗。
磁性高分子微球是指通过适当的方法使有机高分子与无机磁性物质结合起来形成具有一定磁性和特殊结构的微球。磁性微球的核心是磁性材料,多为Fe、Co、Ni等过渡金属特定晶型的氧化物、混合氧化物及其水化物。目前被研究最多并且应用最广泛的是铁及其氧化物,其中以Fe3O4居多。磁核赋予磁性微球以分离功能,壳层生物高分子功能基团赋予磁性微球以载体的功能。近年来,采用具有生物相容性的表面改性剂制备出的磁性复合颗粒,其表面可引入不同的功能基团如-OH,-COOH,-NH2,-CH3Cl等,拓宽Fe3O4纳米粒子在材料、医学、食品等领域的应用范围。
壳聚糖为一种天然多糖衍生物,具有优良的生物亲和性和可降解性能,对于细胞不产生毒副作用,且其分子链上丰富的羟基和氨基使其易于进一步进行化学修饰而赋予多种功能,接连上具有生物活性的物质如药物、蛋白质类物质等,在生物医学等领域具有广泛的应用前景。由于壳聚糖具有良好的生物相容性和血液相容性,与复合形成的微球具有磁响应性,在磁性材料、细胞生物学、分子生物学和医学等诸多领域显示强大的生命力。
目前卡拉胶低聚糖制备方法主要有:物理降解法、化学降解法及酶解法(酸水解、碱处理、超声波、微波处理、辐射及生物酶解法)。其中,化学法是制备卡拉胶低聚糖主要方法,但化学降解方法存在反应条件不易控制、降解产率低、目的产物不易分离等瓶颈问题,制约了其在工业生产中的应用。而微生物酶解法能弥补化学降解法的不足,不但对生产工艺要求简单,反应条件温和、产物活性高,而且产物专一,从而成为制备卡拉胶低聚糖的热点。已有报道中,多种海洋细菌可有效降解卡拉胶,但由于游离菌株酶解效率低,耗时长,限制了微生物发酵生产卡拉胶低聚糖在工厂的开发。目前仍未见有采用固定化细胞技术生产制备κ-卡拉胶低聚糖,其中,集美大学肖安风以公开了一种固定化κ-卡拉胶酶及其制备κ-卡拉胶寡糖的方法。但由于酶固定化技术中存在的问题如:酶活力易损失、反应条件要求高等,因此本发明以实验组自主筛选的κ-卡拉胶降解菌为原始菌,设计制备了一种菌株高浓度富集的生物反应器,以用于高效生产卡拉胶低聚糖。
技术实现要素:
本发明的目的提供一种高效生产κ-卡拉胶低聚糖的生物反应器及其应用,通过载体的制备,菌株固定化的温度、时间对载体富集菌株效果的影响,确定最佳固定化条件。并对反应器发酵生产κ-卡拉胶低聚糖的最佳条件及重复使用率进行研究,以期为固定化菌株生产κ-卡拉胶低聚糖提供理论依据。
本发明的技术方案:
一种高效生产κ-卡拉胶低聚糖的生物反应器,其生物反应器制备步骤如下:
步骤一、固定化载体的制备:
配制5wt%的醋酸溶液,采用超声辅助溶解,配制浓度为1.5wt%的壳聚糖醋酸溶液,取20mL壳聚糖醋酸溶液,按照壳聚糖与Fe3O4磁性纳米粒子质量比1:1加入Fe3O4磁性纳米粒子,超声波分散20min使Fe3O4磁性纳米粒子充分混匀。控制搅拌器低速运转,将配制的磁性纳米级Fe3O4/壳聚糖醋酸逐滴加到80mL液体石蜡(油水相比4:1)和2mL Span-80的混合液中,在室温下充分乳化搅拌30 min后,缓慢加入1 mL戊二醛(25wt%)溶液,在50℃水浴中反应 1 h后,再升温到70℃反应1.5 h,反应结束时用永磁铁将产物——磁性壳聚糖微球(Fe3O4/CTS)分离,依次用有机溶剂石油醚、丙酮及超纯水充分洗涤,将有机溶剂和乳化剂砂芯抽滤后超纯水洗净,60℃下干燥,轻研成粉末,即得到磁性壳聚糖微球载体(Fe3O4/CTS)。
步骤二、生物反应器的制备
取磁性纳米载体Fe3O4/CTS 0.1~0.5g 用去离子水溶胀1-2小时,再洗涤至无紫外吸收峰灭菌待用;制备菌悬液,将1g菌泥溶解于100mL无菌去离子水中;无菌条件下,磁场下倒出去离子水,将磁性纳米载体移入菌悬液中,4~30℃下固定1~4 h,然后用无菌去离子水洗涤3次,磁场下去除未固定游离细胞,即得到固定化生物反应器。
磁性纳米级Fe3O4采用H2O2氧化水热法制备,其粒径为20~30nm。
菌泥为菌株Thalassospira sp. Fjfst-332经液体发酵培养后,采用0.9wt%生理盐水清洗2~3次,10000r/min离心20min获得。
菌株Thalassospira sp. Fjfst-332,为实验室自主筛选获得,保藏号为CCTCC M 2013706,经检测可有效酶解κ-卡拉胶获得κ-卡拉胶低聚糖的野生菌。
κ-卡拉胶低聚糖的制备包括如下步骤:
1)取固定化生物反应器无菌状态下加入30 mL发酵培养基中,25℃,130r/min恒温摇床中发酵培养24 h后,用永磁铁吸附生物反应器,发酵液8000r/min离心20min取上清酶液;
2)上清酶液经10kDa超滤膜浓缩后,按1:20(v/v)的比例加入到0.5% κ-卡拉胶水溶液中,酶解24 h;
3)酶解液加热5min停止反应,10000r/min离心30min去除未降解的κ-卡拉胶片段,取上清液分别过10kDa及3kDa超滤膜,收集分子量小于3kDa的酶解液,经旋蒸后真空冷冻干燥,得到不同聚合度的κ-卡拉胶低聚糖。
发酵培养基的成分为:氯化钠15 g/L,低聚果糖1 g/L,κ-卡拉胶3 g/L,酵母膏1 g/L,NaNO3 2 g/L,MgSO4•7H2O 0.5g/L,K2HPO4 1 g/L,CaC12 0.l g/L,余量为去离子水,pH= 7.5±0.1。
本发明的效益在于:生物反应器载体制备工艺简单并可大量生产,生物反应器酶解κ-卡拉胶效果好,效率高,且重复使用率高,产物易分离,对于实现卡拉胶低聚糖产业化生产有重要的应用价值。
以一定配比的生物反应器与κ-卡拉胶发酵液混合生产κ-卡拉胶低聚糖,酶解时间与游离菌株发酵相比,缩短了3倍。
附图说明
图1生物反应器合成原理图。
图2磁性Fe3O4电镜扫描图。
图3磁性壳聚糖微球载体(Fe3O4/CTS)电镜扫描图。
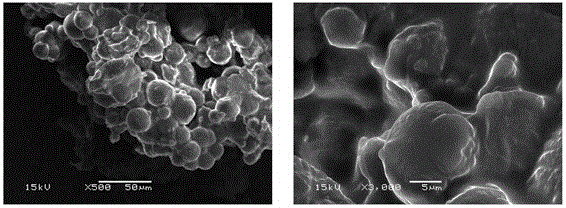
图4磁性壳聚糖微球载体(Fe3O4/CTS)固定化菌株Thalassospira sp. Fjfst-332的电镜扫描图。
图5 傅里叶红外光谱分析图。
图6固定化温度、时间对固定化效果的影响。
图7生物反应器添加量对κ-卡拉胶低聚糖生产的影响。
图8 生物反应器发酵生产κ-卡拉胶低聚糖的稳定性。
图9固定菌株及游离菌株产酶曲线分析。
图10 固定化菌株制备κ-卡拉胶低聚糖的TLC图。
具体实施方式
以下是说明本发明的具体实施例,但本发明并不限于此:
实施例1
步骤一、固定化载体的制备:
配制5wt%的醋酸溶液,采用超声辅助溶解,配制浓度为1.5wt%的壳聚糖醋酸溶液,取20mL壳聚糖醋酸溶液,按照壳聚糖与Fe3O4磁性纳米粒子质量比1:1加入Fe3O4磁性纳米粒子,超声波分散20min使Fe3O4磁性纳米粒子充分混匀。控制搅拌器低速运转,将配制的磁性纳米级Fe3O4/壳聚糖醋酸逐滴加到80mL液体石蜡(油水相比4:1)和2mL Span-80的混合液中,在室温下充分乳化搅拌30 min后,缓慢加入1 mL戊二醛(25wt%)溶液,在50℃水浴中反应 1 h后,再升温到70℃反应1.5 h,反应结束时用永磁铁将产物——磁性壳聚糖微球(Fe3O4/CTS)分离,依次用有机溶剂石油醚、丙酮及超纯水充分洗涤,将有机溶剂和乳化剂砂芯抽滤后超纯水洗净,60℃下干燥,轻研成粉末,即得到磁性壳聚糖微球载体(Fe3O4/CTS)。所述的磁性纳米级Fe3O4采用H2O2氧化水热法制备,其粒径为20nm。
步骤二、生物反应器的制备
取磁性纳米载体Fe3O4/CTS 0.1 g 用去离子水溶胀2个小时,再洗涤至无紫外吸收峰灭菌待用;制备菌悬液,将1g菌泥溶解于100mL无菌去离子水中;无菌条件下,磁场下倒出去离子水,将磁性纳米载体移入菌悬液中,4℃下固定4 h,然后用无菌去离子水洗涤3次,磁场下去除未固定游离细胞,即得到固定化生物反应器。所述的菌泥为菌株Thalassospira sp. Fjfst-332经液体发酵培养后,采用0.9wt%生理盐水清洗2次,10000r/min离心20min获得。
步骤三、κ-卡拉胶低聚糖的制备包括如下步骤:
1)取固定化生物反应器无菌状态下加入30 mL发酵培养基中,25℃,130r/min恒温摇床中发酵培养24 h后,用永磁铁吸附生物反应器,发酵液8000r/min离心20min取上清酶液;
2)上清酶液经10kDa超滤膜浓缩后,按1:20(v/v)的比例加入到0.5wt% κ-卡拉胶水溶液中,酶解24 h;
3)酶解液加热5min停止反应,10000r/min离心30min去除未降解的κ-卡拉胶片段,取上清液分别过10kDa及3kDa超滤膜,收集分子量小于3kDa的酶解液,经旋蒸后真空冷冻干燥,得到不同聚合度的κ-卡拉胶低聚糖。
所述发酵培养基的成分为:氯化钠15 g/L,低聚果糖1 g/L,κ-卡拉胶3 g/L,酵母膏1 g/L,NaNO3 2 g/L,MgSO4•7H2O 0.5g/L,K2HPO4 1 g/L,CaC12 0.l g/L,余量为去离子水,pH 7.5±0.1。
所述不同聚合度的κ-卡拉胶低聚糖分别为二糖、四糖、六糖、八糖。
图1为该生物反应器的合成原理,即以纳米级Fe3O4为反应器核心,赋予磁性微球以分离功能,外层为带有功能基团(-COOH及-NH2)的壳聚糖生物高分子,赋予微球以载体的功能。所复配成的磁性微球的磁核与外壳的结合,主要借助氢键、范德华力及配位键牢牢束缚在一起,形成坚实的载体微球。而此生物反应器是通过物理吸附,菌体附着于磁性微球表面,并与功能基团-COOH、-NH结合,不添加其他化学试剂,从而确保了菌体的功能稳定性及活性。
图2 为本实施例Fe3O4纳米颗粒的SEM图,由图可观察Fe3O4纳米粒子粒径分布均匀,表面光滑,且颗粒明显的团聚在一起,可能由于颗粒间带有较强的磁性,分子间的磁响应作用促进了颗粒的团聚。图3为本实施例Fe3O4/CTS的SEM图,可观察到Fe3O4纳米粒子依旧呈现球状,但表面附着了壳聚糖,粒径较Fe3O4纳米颗粒大,但相差并不明显。颗粒间表现出团聚现象,分析由于粒子粒径小,间距短,粒子间的范德华力远大于粒子自身重力,从而产生团聚现象,且粒子本身被磁化,也造成了粒子团聚。图4为本实施例Fe3O4/CTS固定化菌体的SEM图,由图可知,微球表面的颗粒密集度相较于Fe3O4/CTS颗粒更大,表面有大量的菌体有效包覆于Fe3O4/CTS粒子表层,且固定化后微球粒径明显变大,同时,微球间由于磁性及范德华力,依旧存在团聚现象。
图5为本实施例生物反应器的FTIR图分析,571.62cm-1是Fe-O的特征吸收峰,由图可知,经过载体制备及菌体吸附后,生物反应器仍有磁性吸收峰存在。Fe3O4/CTS在3415.66cm-1处有吸收峰,归因于壳聚糖中-NH2及-OH的伸缩振动。1070.15,1045.63cm-1是C-O键典型变形振动峰, 1397.15cm-1是C-H的变形振动峰,这是由于壳聚糖没有完全脱去乙酰基团所产生。Fe3O4/CTS图中1558.41和1650.40 cm-1吸收峰在经过菌体固定化后,在Fe3O4/CTS Immobilized cell图中表现为1558.41cm-1吸收峰消失,1646.32 cm-1处有一个较强特征吸收峰,表明由于壳聚糖上的基团与菌体结合形成了Schiff碱,使菌体固定于微球表面。
由图6、7可知,固定化温度及时间对生物反应器的制备有重要影响,从其产物量可知,该磁性微球在20℃、2 h及具有较好的固定效果,且发酵反应中,生物反应器添加量为700mg/30ml时,具有较高的应用效果。图8为以Fe3O4/CTS为载体,采用两种方法固定化菌株的实例图,实例1把灭菌后的载体添加到发酵培养基中,在发酵过程中制备固定化菌,Fe3O4/CTS(2)是将灭菌后的载体加入菌悬液中,静态吸附菌体制备生物反应器,两种方法制备的的生物反应器降解卡拉胶能力实例1较好,但方法二(Fe3O4/CTS(2))操作简单,且效果也较佳。此外,由图8可知,该生物反应器具有较好的稳定性及重复使用率,反复使用7次后产生明显的活力下降。与游离菌株相比(图9),固定菌在12 h即可达到底物生产最高值,时间效率提高了3倍。图10表明,经过固定化后的菌株,其产物与游离菌所生产的寡糖种类一直,表明固定过程中,菌体并为发生物理及化学改变,其遗传及功能稳定性较好。
实施例2
步骤一、固定化载体的制备:
配制5wt%的醋酸溶液,采用超声辅助溶解,配制浓度为1.5wt%的壳聚糖醋酸溶液,取20mL壳聚糖醋酸溶液,按照壳聚糖与Fe3O4磁性纳米粒子质量比1:1加入Fe3O4磁性纳米粒子,超声波分散20min使Fe3O4磁性纳米粒子充分混匀。控制搅拌器低速运转,将配制的磁性纳米级Fe3O4/壳聚糖醋酸逐滴加到80mL液体石蜡(油水相比4:1)和2mL Span-80的混合液中,在室温下充分乳化搅拌30 min后,缓慢加入1 mL戊二醛(25wt%)溶液,在50℃水浴中反应 1 h后,再升温到70℃反应1.5 h,反应结束时用永磁铁将产物——磁性壳聚糖微球(Fe3O4/CTS)分离,依次用有机溶剂石油醚、丙酮及超纯水充分洗涤,将有机溶剂和乳化剂砂芯抽滤后超纯水洗净,60℃下干燥,轻研成粉末,即得到磁性壳聚糖微球载体(Fe3O4/CTS)。所述的磁性纳米级Fe3O4采用H2O2氧化水热法制备,其粒径为25nm。
步骤二、生物反应器的制备
取磁性纳米载体Fe3O4/CTS 0.3 g 用去离子水溶胀1个小时,再洗涤至无紫外吸收峰灭菌待用;制备菌悬液,将1g菌泥溶解于100mL无菌去离子水中;无菌条件下,磁场下倒出去离子水,将磁性纳米载体移入菌悬液中,4℃下固定4 h,然后用无菌去离子水洗涤3次,磁场下去除未固定游离细胞,即得到固定化生物反应器。所述的菌泥为菌株Thalassospira sp. Fjfst-332经液体发酵培养后,采用0.9wt%生理盐水清洗3次,10000r/min离心20min获得。
步骤三、κ-卡拉胶低聚糖的制备包括如下步骤:
1)取固定化生物反应器无菌状态下加入30 mL发酵培养基中,25℃,130r/min恒温摇床中发酵培养24 h后,用永磁铁吸附生物反应器,发酵液8000r/min离心20min取上清酶液;
2)上清酶液经10kDa超滤膜浓缩后,按1:20(v/v)的比例加入到0.5wt% κ-卡拉胶水溶液中,酶解24 h;
3)酶解液加热5min停止反应,10000r/min离心30min去除未降解的κ-卡拉胶片段,取上清液分别过10kDa及3kDa超滤膜,收集分子量小于3kDa的酶解液,经旋蒸后真空冷冻干燥,得到不同聚合度的κ-卡拉胶低聚糖。
所述发酵培养基的成分为:氯化钠15 g/L,低聚果糖1 g/L,κ-卡拉胶3 g/L,酵母膏1 g/L,NaNO3 2 g/L,MgSO4•7H2O 0.5g/L,K2HPO4 1 g/L,CaC12 0.l g/L,余量为去离子水,pH 7.5±0.1。
所述不同聚合度的κ-卡拉胶低聚糖分别为二糖、四糖、六糖、八糖。
实施例3
步骤一、固定化载体的制备:
配制5wt%的醋酸溶液,采用超声辅助溶解,配制浓度为1.5wt%的壳聚糖醋酸溶液,取20mL壳聚糖醋酸溶液,按照壳聚糖与Fe3O4磁性纳米粒子质量比1:1加入Fe3O4磁性纳米粒子,超声波分散20min使Fe3O4磁性纳米粒子充分混匀。控制搅拌器低速运转,将配制的磁性纳米级Fe3O4/壳聚糖醋酸逐滴加到80mL液体石蜡(油水相比4:1)和2mL Span-80的混合液中,在室温下充分乳化搅拌30 min后,缓慢加入1 mL戊二醛(25wt%)溶液,在50℃水浴中反应 1 h后,再升温到70℃反应1.5 h,反应结束时用永磁铁将产物——磁性壳聚糖微球(Fe3O4/CTS)分离,依次用有机溶剂石油醚、丙酮及超纯水充分洗涤,将有机溶剂和乳化剂砂芯抽滤后超纯水洗净,60℃下干燥,轻研成粉末,即得到磁性壳聚糖微球载体(Fe3O4/CTS)。所述的磁性纳米级Fe3O4采用H2O2氧化水热法制备,其粒径为30nm。
步骤二、生物反应器的制备
取磁性纳米载体Fe3O4/CTS 0.5 g 用去离子水溶胀1.5个小时,再洗涤至无紫外吸收峰灭菌待用;制备菌悬液,将1g菌泥溶解于100mL无菌去离子水中;无菌条件下,磁场下倒出去离子水,将磁性纳米载体移入菌悬液中,20℃下固定2 h,然后用无菌去离子水洗涤3次,磁场下去除未固定游离细胞,即得到固定化生物反应器。所述的菌泥为菌株Thalassospira sp. Fjfst-332经液体发酵培养后,采用0.9wt%生理盐水清洗3次,10000r/min离心20min获得。
步骤三、κ-卡拉胶低聚糖的制备包括如下步骤:
1)取固定化生物反应器无菌状态下加入30 mL发酵培养基中,25℃,130r/min恒温摇床中发酵培养24 h后,用永磁铁吸附生物反应器,发酵液8000r/min离心20min取上清酶液;
2)上清酶液经10kDa超滤膜浓缩后,按1:20(v/v)的比例加入到0.5wt% κ-卡拉胶水溶液中,酶解24 h;
3)酶解液加热5min停止反应,10000r/min离心30min去除未降解的κ-卡拉胶片段,取上清液分别过10kDa及3kDa超滤膜,收集分子量小于3kDa的酶解液,经旋蒸后真空冷冻干燥,得到不同聚合度的κ-卡拉胶低聚糖。
所述发酵培养基的成分为:氯化钠15 g/L,低聚果糖1 g/L,κ-卡拉胶3 g/L,酵母膏1 g/L,NaNO3 2 g/L,MgSO4•7H2O 0.5g/L,K2HPO4 1 g/L,CaC12 0.l g/L,余量为去离子水,pH 7.5±0.1。
所述不同聚合度的κ-卡拉胶低聚糖分别为二糖、四糖、六糖、八糖。
实施例中采用的检测方法:
1、κ-卡拉胶酶活力测定:取 l mL 酶液加入到盛有5 mL 0.2% 卡拉胶底物的试管中,于32 ℃恒温水浴反应60 min,对照组用 l mL灭活酶液和 5mL 底物溶液混合。以反应液中还原糖的增加量作为检测酶活力的指标。还原糖的测定则采用DNS法(3,5-二硝基水杨酸)。取 1 mL 反应液加 l mL DNS溶液,沸水浴反应5 min 后,冷却,定容至10 mL,于540 nm 下测定吸光值。以半乳糖做标准曲线,根据反应组和对照组吸光值的差值计算还原糖的产生量。1 个酶活力单位(U)定义为在32℃条件下,每分钟产生 1 µg 还原糖(以半乳糖计)所需要的酶量。
2、载体微球吸附效果测定:考虑到细胞增殖对检测的影响,将菌悬液稀释4倍进行全波长扫描,发现其在600nm下有吸收,以此作为检测依据。去离子水作为参比,稀释4倍的细胞液的紫外吸收作为初始浓度,固定化后的上层液的吸收作为Ai值,吸附率AD=(Ao-Ai)/Ao*100%。AD值越大,说明吸附后的上层液中含细胞越少,吸附效果越好。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!