检测和评价力量训练效果的miRNA标志物或其组合及其应用的制作方法
本发明属于生物
技术领域:
,涉及检测和评价力量训练效果的miRNA标志物或其组合及其应用。
背景技术:
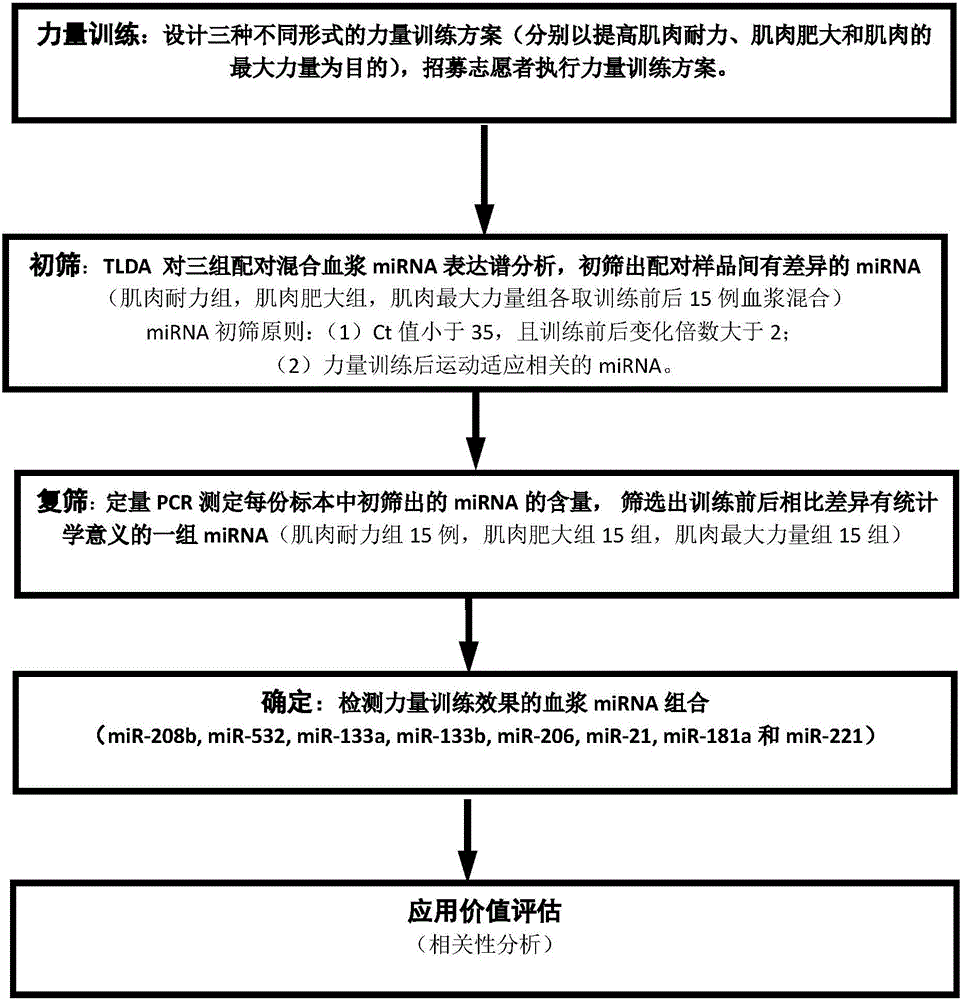
:在预防疾病(如2型糖尿病、心血管疾病、肌萎缩等)方面,提高生活质量方面,以及提升运动能力方面,骨骼肌的质量和功能起到关键作用(1-4)。力量练习是提高和维持骨骼肌的质量和功能一个最有效的运动方式。近30年,力量训练普及率迅速提高,在日常的运动实践中,可以根据不同的目的(提升骨骼肌耐力、提高骨骼肌肥大程度、增强肌肉最大力量),选择不同的运动学参数(力量训练方式、训练强度和量、选择练习手段和顺序、组间休息时间、速度和次数),设计不同的力量训练计划,以极大促进大众的健康。如何评定力量训练效果,是力量训练研究中的一个重点问题。力量训练的标志物应对于训练负荷敏感,不受其它因素影响(如饮食、生物节律)。但是,直至今日仍没有可行的标志物符合这一标准。通过测量急性力量训练后循环血液中激素(睾酮、皮质醇、胰岛素生长因子1)和肌肉损伤标志物(肌酸激酶、白介素-6、白介素-10和C反应蛋白)的变化来进行力量训练评定,是传统使用的手段。然而,长期力量训练后,尽管力量增加、骨骼肌肥大,但是静息状态下这些激素无显著变化。另外,激素检测方面存在下列问题:首先,影响血液中激素浓度水平因素众多,包括样本的保存、批内和批间变异等。其次,用来检测激素的一些技术的重复性较差(5)。此外,一些研究认为力量训练可引起骨骼肌细胞损伤,研究推测这些损伤标志物可能在运动性骨骼肌肥大过程中起着重要的作用,但是在肥大形成时,通常缺少肌肉的损伤(6)。因此,寻找一种新型运动生理分子标志物,用以评定力量训练的效果,有着重要理论和实际意义。在这方面血液中的循环microRNA(miRNA)可能更具有优势。miRNA是一类由动物、植物和病毒基因组所编码的长约22个核苷酸并参与基因转录后水平调控的非编码单链小核糖核酸分子。miRNA能够与靶mRNA的3’非翻译序列完全或部分互补结合,使mRNA降解或抑制mRNA表达,从而导致特定基因的沉默(7)。miRNA在维持骨骼肌的结构和功能方面具有非常重要的作用,参与了病理或生理状态下肌肉生成、肌肉质量的增加和肌肉营养代谢等过程。运动时,来源于不同组织miRNA可被细胞内的微小囊泡(exosome)包裹,释放入血,进入到循环系统中的miRNA可能被下游靶细胞接收并调控下游靶细胞的功能,因此检测血浆中循环miRNA可揭示运动状态下各种生理过程的变化(8)。通过对这些miRNA进行研究,有可能发现一组与力量训练相关的循环miRNA,进而作为标志物用于检测不同力量训练方案的效果。技术实现要素:本发明的目的是通过研究不同目的力量训练方案后血浆miRNA的动态且特异性的变化,筛选出在肌肉耐力训练、肌肉肥大训练、肌肉最大力量训练后表达差异显著的血浆miRNA,通过检测这些miRNA,为预测力量训练方案的效果提供新的信息和指标。血浆miRNA生物标志物的检测将提供分子水平的遗传信息,有助于揭示力量训练后的运动适应过程,对预测不同目的力量训练的效果提供新的指标。目前,本发明已发现不同目的力量训练(肌肉耐力训练、肌肉肥大训练、肌肉最大力量训练)后血浆miRNA存在动态的、特异性的变化,并且发现特异性的miRNA组合与力量训练后的运动适应过程密切相关,可作为预测不同目的力量训练效果的生物分子标志物。本发明的上述目的是采用以下技术方案来实现的:一种与力量训练(肌肉耐力训练、肌肉肥大训练、肌肉最大力量训练)相关的miRNA标志物或其组合,包括下列miRNA中的任意一种或多种:miR-208b、miR-532、miR-133a、miR-133b、miR-206、miR-21、miR-181a和miR-221。miRNA对应的核苷酸序列序列编号miR-208bAUAAGACGAACAAAAGGUUUGUSEQIDNO.1miR-532-5pCAUGCCUUGAGUGUAGGACCGUSEQIDNO.2miR-133aUUUGGUCCCCUUCAACCAGCUGSEQIDNO.3miR-133bUUUGGUCCCCUUCAACCAGCUASEQIDNO.4miR-206UGGAAUGUAAGGAAGUGUGUGGSEQIDNO.5miR-181aAACAUUCAACGCUGUCGGUGAGUSEQIDNO.6miR-21CAACACCAGUCGAUGGGCUGUSEQIDNO.7miR-221AGCUACAUUGUCUGCUGGGUUUCSEQIDNO.8一种与肌肉耐力训练相关的血浆miRNA组合,由miR-208b和miR-532组成。相比于训练前安静状态,肌肉耐力训练后miR-532的水平持续升高,在训练后24小时达到最高水平;miR-208b在肌肉耐力训练后即刻显著降低,训练后1小时表达水平略微升高,在训练后24小时再次降低。一种与肌肉肥大训练相关的血浆miRNA组合,由miR-133a、miR-133b、miR-206、miR-21、miR-181a和miR-221组成。miR-133a在肌肉肥大训练后即刻降低,训练后1小时恢复至正常水平;相比于肌肉肥大训练后即刻,miR-133b在训练后24小时显著升高;相比于运动后即刻,miR-206在肌肉肥大训练后1小时显著升高,训练后24小时恢复至正常水平;miR-21在肌肉肥大训练后即刻降低,训练后1小时回升且高于正常水平,训练后24小时恢复至正常水平;miR-181a在肌肉肥大训练后1小时达到最高水平;miR-221在肌肉肥大训练后即刻升高,训练后1小时降低至低于正常水平,训练后24小时表达量回升且高于正常水平。一种与肌肉最大力量训练相关的血浆miRNA组合,由miR-133a和miR-133b组成。miR-133a在肌肉最大力量训练后即刻降低,训练后1小时恢复至正常水平;相比于训练后即刻,miR-133b在肌肉最大力量训练后1小时显著升高,训练后24小时恢复至正常水平。上述miRNA组合的筛选方法包括以下步骤:(1)构建三种不同目的力量训练(肌肉耐力训练、肌肉肥大训练、肌肉最大力量训练)方案,将受试者随机分配为三组,各组对应执行一组力量训练方案。(2)收集血浆样本,包括所有志愿者运动前安静状态、运动后即刻、运动后1小时、运动后24小时4个时间点的血浆样本,并提取总RNA;(3)采用高灵敏度、高特异性、高重复性和宽动态范围的人类微小RNA芯片(TaqManLowDensityArray),对上述RNA进行检测,初步筛选出三组力量训练运动前后发生特异性变化的miRNA;(4)进一步使用实时荧光定量PCR方法验证。具体来说,上述筛选方法包括以下步骤:(1)采用经典训练方式,构建三种不同目的力量训练方案(肌肉耐力训练、肌肉肥大训练、肌肉最大力量训练),将受试者随机分配为三组,各组对应执行一组力量训练方案;(2)分别收集力量训练前安静状态、力量训练后即刻、力量训练后1小时、力量训练后24小时受试者的血浆,并提取总RNA,其中所述力量训练包括肌肉耐力训练,肌肉肥大训练和肌肉最大力量训练;(3)根据人的已知的754个miRNA,对上述RNA进行高通量检测,初筛出力量训练前后血浆中表达差异明显的一组miRNA;(4)从个体血浆中提取RNA,逆转录成cDNA,采用荧光定量PCR(TaqMan探针法)方法进一步对初筛出的miRNA进行复筛,挑选出稳定、特异性变化的miRNA,作为力量训练效果的生物标志物,特异性检测和评价肌肉耐力训练、肌肉肥大训练和肌肉最大力量训练三种力量训练的效果。检测本发明所述的血浆miRNA标志物或其组合的试剂在检测力量训练的效果和/或为力量训练方案的设计提供评判标准中的应用;所述的力量训练选自肌肉耐力训练、肌肉肥大训练、肌肉最大力量训练中的一种或多种。检测所述的血浆miRNA组合的试剂在检测肌肉耐力训练的效果和/或为肌肉耐力训练方案的设计提供评判标准中的应用。所述的血浆miRNA组合由miR-208b和miR-532组成。检测本发明所述的血浆miRNA组合的试剂在检测肌肉肥大训练的效果和/或为肌肉肥大训练方案的设计提供评判标准中的应用。所述的血浆miRNA组合由miR-133a、miR-133b、miR-206、miR-21、miR-181a和miR-221组成。检测本发明所述的血浆miRNA组合的试剂在检测肌肉最大力量训练的效果和/或为肌肉最大力量训练方案的设计提供评判标准中的应用。所述的血浆miRNA组合由miR-133a和miR-133b组成。本发明使用的检测方法可以选自:RT-PCR方法、人类微小RNA技术(TaqManLowDensityArray)、Real-timePCR方法以及生物芯片方法中的一种或几种。例如,血浆中miRNA分子的检测方法包括以下步骤:(1)使用Trizol试剂(Invitrogen公司)提取血浆总RNA;(2)通过RNA逆转录反应得到cDNA;(3)根据人全部成熟体miRNA设计引物进行PCR反应;(4)进行PCR产物的琼脂糖凝胶电泳;(5)EB染色后在紫外灯下观察结果。在所述步骤(5)之后还可以包括下列步骤:用TaqMan探针法检测并比较力量训练前后血浆样本中miRNA的量的变化。本发明所述的miRNA组合和单个miRNA及其对应的探针组合可应用于不同目的力量训练方案效果的检测中,例如为力量训练后的机体运动适应过程的监测补充新的指标,以及用于力量训练方案的效果评价之中。本发明所提供的上述miRNA组合具有以下几个方面的有益效果:第一,已有血浆miRNA的检测结果表明,miRNA分子广泛存在于正常人的血浆中,并且随着训练状况变化,miRNA分子在血浆中存在的种类和数量将发生显著变化,血浆miRNA作为体能标志物具有灵敏度高、特异性好的特点,显著优于传统生物标志物如激素和肌肉损伤标志物等;第二,血浆miRNA是一种新型生物标志物,区别于传统生物标志物,不仅稳定、微创、易于检测,而且定量精确,该类小分子RNA生物标志物的成功开发是对以激素和肌肉损伤标志物为主的传统生物标志物的改进,将为运动训练评定与监控开创全新局面;第三,血浆miRNA监测系统是一种实时、全面的诊断方法,可全面的反映训练生理状态,避免既往繁杂检测,节约了成本和时间,为快速准确的掌握训练状态、及时采取个性化的训练方案提供支持;第四,血浆miRNA指纹图谱的筛选采用严密、多阶段的验证和评价体系,初期采用TaqManlow-densityarray芯片技术对血浆miRNA进行高通量测量以获取力量训练相关的miRNA表达谱,其后应用实时荧光定量RT-PCR的方法对初筛的miRNA表达谱进行大样本独立验证,之后再使用统计学分析软件及数据分析程序对血浆miRNA标志物进行效果评价及准确率评估,以上程序和策略的应用保证了血浆miRNA生物标志物在运动效果评价和运动方式评判上应用的准确性。综上所述,检测血浆中的miRNA,简单易行且效果优越,从血浆miRNA的特异性变化这一新角度出发,能发现力量训练运动适应的新机制并且区分不同目的力量训练方案的效果。该技术仅仅需要人的血浆而不需要任何其它组织,通过简单的miRNA组合及单个miRNA来预测力量训练方案的合理性及其可达到的效果。此外力量训练过程中迅速发生变化的循环miRNA可能具有独特性,其动态变化规律不同于常规生物标志物,能够弥补常规生物标志物应用上的缺陷,实时反映出骨骼肌适应过程,可作为评定和监控力量训练的一种新型的分子标志物,具有极重要的应用潜力和价值。附图说明图1本发明的主要流程图。图2TaqMan探针Real-timePCR法测定miRNA(miR-208b和miR-532)在肌肉耐力训练中的动态性变化。(A)相比于训练前安静状态,训练后miR-532的水平持续升高,在训练后24小时达到最高水平;(B)miR-208b在训练后即刻显著降低,训练后1小时表达水平略微升高,在训练后24小时再次降低。图3TaqMan探针Real-timePCR法测定miRNA(miR-133a、miR-133b、miR-206、miR-181a、miR-21和miR-221)在肌肉肥大训练中的动态性变化。(A)miR-133a在训练后即刻降低,训练后1小时恢复至正常水平;(B)相比于训练后即刻,miR-133b在训练后24小时显著升高;(C)相比于运动后即刻,miR-206在训练后1小时显著升高,训练后24小时恢复至正常水平;(D)miR-21在训练后即刻降低,训练后1小时回升且高于正常水平,训练后24小时恢复至正常水平;(E)miR-181a在训练后1小时达到最高水平;(F)miR-221在训练后即刻升高,训练后1小时降低至低于正常水平,训练后24小时表达量回升且高于正常水平。图4TaqMan探针Real-timePCR法测定miRNA(miR-133a和miR-133b)在肌肉最大力量训练中的动态性变化。(A)miR-133a在训练后即刻降低,训练后1小时恢复至正常水平;(B)相比于训练后即刻,miR-133b在训练后1小时显著升高,训练后24小时恢复至正常水平。图5肌肉耐力训练后血浆中特异性变化的miR-532与IL-10、IGF-1紧密相关。(A)所有受试者训练前后血浆中IL-10的动态性变化;(B)所有受试者训练前后血浆中miR-532的动态性变化;(C)所有受试者训练前后血浆中IGF-1的动态性变化;(D)训练后miR-532的变化倍数与IL-10的变化倍数呈正相关,其中相关性分析包含训练后即刻、训练后1小时、训练后24小时3个时间点的数据;(E)训练后miR-532的变化倍数与IGF-1的变化倍数呈负相关,其中相关性分析包含训练后即刻、训练后1小时、训练后24小时3个时间点的数据。图6肌肉最大力量训练后血浆中特异性变化的miR-133a与皮质醇、睾酮/皮质醇紧密相关。(A)所有受试者训练前后血浆中皮质醇的动态性变化;(B)所有受试者训练前后血浆中miR-133a的动态性变化;(C)所有受试者训练前后血浆中睾酮/皮质醇的动态性变化;(D)训练后即刻miR-133a的变化倍数与皮质醇的变化倍数呈负相关;(E)训练后即刻miR-133a的变化倍数与睾酮/皮质醇的变化倍数呈正相关。具体实施方式以下通过实施例对本发明作进一步的阐述。本发明通过研究不同目的力量训练前后血浆miRNA的动态及特异性变化,筛选出在力量训练前后表达差异显著的一组血浆miRNA,将它们的探针应用于不同目的力量训练效果的检测,以此针对特定的目的设计出最优的力量训练方案。实施例1:力量训练方案的特异miRNA表达谱筛选(1)研究对象为无力量训练经历的身体健康的青年男性,所有受试者均无神经肌肉、代谢、激素相关和心血管方面的疾病。整个实验期间所有受试者均无服用药物且保持相似的生活饮食习惯。将45名受试者随机分为3组,每组15人(志愿者详细信息见表1),各自执行肌肉耐力训练、肌肉肥大训练、肌肉最大力量训练方案中的一种。每组力量训练皆包含5个动作,即卧推、半蹲、坐姿下拉、过头举和站姿哑铃弯举,以训练前安静状态为对照。受试者禁止身体锻炼3天后执行相应的力量训练,整个力量训练持续约2小时且在每天的同一时间段进行。抽取受试者训练前安静状态、训练后即刻、训练后1小时和训练后24小时的血液,抽血针上残留的血液用EKFdiagnosticGmbH乳酸分析仪进行乳酸分析。血液收集在EDTAK2处理的一次性真空采血管,1500g离心10分钟,收集上清,再4℃、10000g离心5分钟,收集上清(血浆)。表1.所有受试者的临床信息肌肉耐力肌肉肥大肌肉最大力量年龄(岁)19.36±0.1419.72±0.2018.87±0.12BMI指数(千克/米-2)21.30±0.2522.12±0.3121.90±0.30心率(次/分钟)74.64±0.8972.66±1.4172.10±1.76卧推(千克)50.71±1.2353.10±2.0150.83±1.57半蹲(千克)82.86±2.5179.83±1.5085.83±2.34坐姿下拉(千克)82.86±1.9884.66±1.9584.67±2.17过头举(千克)36.96±1.0736.55±1.2231.75±0.68站姿哑铃弯举(千克)14.20±0.3915.00±0.4814.82±0.41数据以mean±SE表示。(2)对每一组力量训练,取运动前安静状态,运动后即刻的血浆标本分别混合,3组力量训练共收集混合血浆6组,总体积均为10毫升。分别提取6组混合血浆中的RNA,具体方案为:利用Trizol试剂(Invitrogen公司)提取总RNA。(3)对6组血浆中总miRNA进行TaqMan低密度芯片分析(Invitrogen)。具体方案为:将TaqManMicroRNAAssays的所有优势集合并预装成便利的微流体芯片形式,将384个定量PCR反应在一块微流量板上进行。每个阵列的内容与各自的MagaplexPrimerPools匹配,用MegaplexRTPrimer反转录miRNA靶点及用MegaplexPreAmpPrimers预扩增之后,TaqManUniversalPCRMasterMix可与每个反应简单混合,并移至TaqManArray的八个上样口中之一,然后在7900HT定量PCR仪上运行分析,产生SangermiRBase的综合数据集。(4)miRNA表达谱分析。TaqMan低密度芯片分析后得到了754个miRNA循环数(Ct值),Ct值反应各个miRNA的表达量,Ct值越大,其相对的miRNA的含量越低,反之亦然。以Let-7d、Let-7g和Let-7i的Ct值的平均值[let-7d/g/i=1/3(Let-7d(Ct)+Let-7g(Ct)+Let-7i(Ct))]为内参,矫正所得miRNA的Ct值。采用2^(-△△Ct)公式计算miRNA的变化倍数,其中△Ct=Ct(miRNA)–Ct(let-7d/g/i),△△Ct=△Ct(运动后)-△Ct(运动前)。若miRNA的Ct值小于35,且在运动前后的变化大于2.0倍,被认为变化明显,否则视为不变化。结果发现,在所检测的754个miRNA中,肌肉耐力训练组1个miRNA升高、93个miRNA降低;肌肉肥大训练组75个miRNA升高、7个miRNA降低;肌肉最大力量训练组16个miRNA升高、60个miRNA降低。表2-4列出了根据芯片结果筛选出的变化倍数大于10的miRNA。表2.低密度芯片初筛的在肌肉耐力训练前后变化倍数大于10的miRNA数据以mean±SE表示。Pre代表训练前安静状态,0h代表训练后即刻状态。表3低密度芯片初筛的在肌肉肥大训练前后变化倍数大于10的miRNA数据以mean±SE表示。Pre代表训练前安静状态,0h代表训练后即刻状态。表4低密度芯片初筛的在肌肉最大力量训练前后变化倍数大于10的miRNA数据以mean±SE表示。Pre代表训练前安静状态,0h代表训练后即刻状态。实施例2:TaqMan探针Real-timePCR法测定血浆中miRNA并确定特异性变化的miRNA作为评测力量训练效果的生物标志物利用miRNA特异性反向引物进行逆转录,得到含共同茎环结构但属于特定miRNA的cDNA(ABI公司产品)。miRNA的cDNA逆转反应体系为:2μlRNA、2μl5×AMV缓冲液、1μl10mmol各种dNTP混合物(Takara公司)、0.5μlAMV(Takara公司)以及1μlmiRNA成熟体逆转录引物(美国ABI公司提供,专用于miRNA逆转录),用3.5μlDEPC水补足体积至10μl。其后进行Real-timePCR反应,结果发现,2种miRNA(miR-208b和miR-532)在肌肉耐力训练前后有显著差异(图2),6种miRNA(miR-133a、miR-133b、miR-206、miR-21、miR-181a和miR-221)在肌肉肥大训练前后有显著差异(图3),2种miRNA(miR-133a和miR-133b)在肌肉最大力量训练前后有显著差异(图4)。综合来看,miR-133a和miR-133b在肌肉肥大训练和肌肉最大力量训练组中的动态性变化有显著差异(见表5-7)。表5.肌肉耐力训练训练后所选的16种血浆miRNA的相对浓度表6.肌肉肥大训练训练后所选的16种血浆miRNA的相对浓度表7肌肉最大力量训练后所选的16种血浆miRNA的相对浓度数据以mean±SE表示。Pre代表训练前安静状态,0h代表训练后即刻状态,1h代表训练后一个小时,24h代表训练后24小时,ND表示miRNA值低于检测水平。*表示和运动前安静状态的值相比,p<0.05,表示和训练后即刻的值相比,p<0.05,表示和训练后一个小时的值相比,p<0.05。在检测3种力量训练的效果和/或为3种力量训练方案的设计提供评判标准时,必须要用这种力量训练对应的miRNA组合中的全部miRNA。比如在检测肌肉最大力量训练的效果和/或为肌肉最大力量训练方案的设计提供判断标准时,需检测miR-133a和miR-133b。通过检测miR-133a在训练后即刻是否显著降低及降低的幅度,miR-133b在训练后1小时相对训练后即刻是否显著升高及升高的幅度来判断肌肉最大力量训练的效果和/或为肌肉最大力量训练方案的设计提供判断标准。实施例3:统计学分析肌肉耐力训练后血浆中特异性变化的miRNA与传统标志物激素和肌肉损伤标志物的关系为了进一步验证上述三种力量训练后特异性变化的miRNA作为评价力量训练效果生物标志物的可行性,将miRNA与8种传统的力量训练生物标志物做相关性分析。相关性分析发现肌肉耐力训练后即刻、训练后1小时和24小时的miR-532水平和IL-10、IGF-1具有显著的相关性(图5)。肌肉最大力量训练后即刻,miR-133a的水平和皮质醇、睾酮/皮质醇的值具有显著的相关性(图6)。参考文献1.ScottBR,DuthieGM,ThorntonHR,DascombeBJ.TrainingMonitoringforResistanceExercise:TheoryandApplications.SportsMed2016.2.A,WeigertC,StaigerH,HU.Exerciseanddiabetes:relevanceandcausesforresponsevariability.Endocrine2016;51:390-401.3.IshiguroH,KodamaS,HorikawaC,FujiharaK,HiroseAS,HirasawaR,etal.InSearchoftheIdealResistanceTrainingProgramtoImproveGlycemicControlanditsIndicationforPatientswithType2DiabetesMellitus:ASystematicReviewandMeta-Analysis.SportsMed2016;46:67-77.4.SicilianoG,SimonciniC,GiannottiS,ZampaV,AngeliniC,RicciG.Muscleexerciseinlimbgirdlemusculardystrophies:pitfallandadvantages.ActaMyol2015;34:3-8.5.KraemerWJ,RatamessNA.HormonalResponsesandAdaptationstoResistanceExerciseandTraining.SportsMed2005;35:339-61.6.SchoenfeldBJ.Doesexercise-inducedmuscledamageplayaroleinskeletalmusclehypertrophyJStrengthCondRes2012;6:1441-53.7.StarkA,BushatiN,JanCH,KheradpourP,HodgesE,BrenneckeJ,etal.AsingleHoxlocusinDrosophilaproducesfunctionalmicroRNAsfromoppositeDNAstrands.GenesDev2008;22:8-13.8.Aoi,W.FrontierimpactofmicroRNAsinskeletalmuscleresearch:afutureperspective.FrontPhysiol2014;5:495.当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 普适型用于同时检测多种肿瘤标志物的微流控芯片装置的制造方法
- 男性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 女性适用的典型肿瘤标志物联合检测用微流控芯片装置的制造方法
- 一种检测口腔癌的标志物及其试剂盒的制造方法与工艺
- microRNA 标志物组及其在制备检测胃癌淋巴结转移试剂盒中的应用的制造方法与工艺
- 基于弹性蛋白酶荧光底物检测乳腺癌肿瘤标志物CA153的酶联免疫试剂盒制备方法与制造工艺
- 检测和评价力量训练效果的miRNA标志物或其组合及其应用的制造方法与工艺
- 一种最优超平面的构建方法、动态优化系统和构建装置与制造工艺
- 癌症标志物及癌症的判定方法与制造工艺
- 检测尿液中单羟酚类代谢物的试剂盒及其制备方法与制造工艺