用于治疗代谢疾病的双功能蛋白的制作方法
发明领域
本发明涉及包含已知改善施用对象的代谢谱的成纤维细胞生长因子21(FGF21)和其他代谢调节物的新型蛋白质。
发明背景
成纤维细胞生长因子(FGF)家族的特征是22种遗传上有区别的同源配体,被分为7个亚家族。FGF-21与FGF-19和FGF-23最密切相关,并形成亚家族。该FGF亚家族调控多种对经典FGF而言不常见的生理学过程,即,能量和胆酸的内稳态、葡萄糖和脂类代谢,以及磷酸盐和维生素D的内稳态。此外,与其他FGF不同,该亚家族以内分泌的方式发挥作用(Moore,D.D.(2007)Science 316,1436-8)(Beenken等人(2009)Nature Reviews Drug Discovery 8,235)。
FGF21是209个氨基酸的多肽,含有28个氨基酸的前导序列(SEQ ID NO:132)。人FGF21与小鼠FGF21具有约79%氨基酸同一性,与大鼠FGF21具有约80%氨基酸同一性。成纤维细胞生长因子21(FGF21)被描述为用于治疗缺血性血管病、创伤愈合、和与肺、支气管或肺泡细胞功能丧失相关的疾病(Nishimura等人(2000)Biochimica et Biophysica Acta,1492:203-206;专利公开WO01/36640;和专利公开WO01/18172)。虽然FGF-21激活FGF受体和下游信号传递分子,包括FRS2a和ERK,但尚未检测到FGFR与FGF-21的直接相互作用。研究已鉴别了在肝脏、脂肪细胞和胰腺中高表达的β-klotho是FGF-21细胞应答的决定子,也是通过FGFR介导FGF-21信号传递的辅助因子(Kurosu,H.等人(2007)J Biol Chem 282,26687-95)。FGF21是FGFR1(IIIc)、FGFR2(IIIc)和FGFR3(IIIc)β-klotho信号传递复合物的强力激动剂。
FGF-21已表现出诱导不依赖胰岛素的葡萄糖摄入。FGF-21还表现出减轻多种糖尿病啮齿类模型中的高血糖。此外,发现过表达FGF-21的转基因小鼠耐受膳食诱导的代谢异常,并且表现出减少的体重和脂肪质量,和胰岛素敏感性的增强(Badman,M.K.等人(2007)Cell Metab 5,426-37)。向糖尿病的非人灵长类施用FGF-21导致空腹血浆葡萄糖、甘油三酯、胰岛素和胰高血糖素水平减少,并导致脂蛋白谱的显著改善,包括HDL胆固醇增加几乎80%(Kharitonenkov,A.等人(2007)Endocrinology 148,774-81)。目前的研究探讨了FGF21作用的分子机制,已经鉴别FGF21是帮助控制适应空腹状态的重要内分泌激素(Badman等人(2009)Endocrinology 150,4931)(Inagaki等人(2007)Cell Metabolism 5,415)。这提供了之前缺乏的PPARα下游的关联,肝脏藉此与身体的其余部分在调控能量内稳态生物学中沟通(Galman等人(2008)Cell Metabolism 8,169)(Lundasen等人(2007)Biochemical and Biophysical Research Communications 360,437)。
FGF21通过激活AMPK/SIRT1/PGC1α通路抑制PPARγ表达和增加线粒体功能,来调控脂肪细胞内稳态。(Chau等人(2010)PNAS 107,12553)如培养的人肌管和分离的小鼠组织中测量的,FGF21还增加骨骼肌的葡萄糖摄入(Mashili等人(2011)Diabetes Metab Res Rev 27,286-97)。啮齿类胰岛细胞的FGF21治疗导致通过激活ERK1/2和Akt通路的改善的功能和存活(Wente等人(2006)Diabetes 55,2470)。FGF21治疗还导致啮齿类肝脏中关于脂肪发生和脂肪酸氧化酶的基因表达改变,可能是通过HNF4α和Foxa2信号传递。然而,目前的研究(Wei等人(2012)PNAS 109,3143-48)提示,由于消退的PPARγ激活(通过降低的SUMO化作用),用FGF21治疗膳食诱导的肥胖小鼠诱导骨丢失;在FGF21治疗后,骨中存在增加的PPARγ活性的条件下,可观察到充质干细胞从向成骨细胞分化转变为向脂肪细胞分化。
与使用FGF-21直接作为生物治疗剂相关的困难是其半寿期非常短(Kharitonenkov,A.等人(2005)Journal of Clinical Investigation 115:1627-1635)。在小鼠中,人FGF21的半寿期是0.5至1小时,而在食蟹猴中,半寿期是2至3小时。FGF21可以作为多用途的、无菌药物制剂使用。然而,已确定防腐剂,即,间甲酚,在上述条件下对其稳定性具有不利作用。
另一种已处于临床的强力代谢调节物是胰高血糖素样肽-1(GLP-1)(Knudsen等人(2004)Journal of Medicinal Chemistry 47,4128)。GLP-1是由哺乳动物肠道的L细胞分泌的36个氨基酸的肠降血糖素,作用于α和β细胞,以依赖于葡萄糖的方式刺激胰岛素分泌和抑制胰高血糖素释放(Hare等人(2010)Diabetes 59,1765;Meier等人(2005)Diabetes-Metabolism Research and Reviews 21,91)。GLP-1结合和激活GLP-1受体(GLP-1R),后者是II类G蛋白偶联受体(GPCR)家族的7次跨膜的螺旋蛋白质(Mayo等人(2003)Pharmacological Reviews 55:167)。作为GLP-1受体激动剂,GLP-1通过刺激胰腺分泌胰岛素,从而增加外周组织吸收葡萄糖和抑制胰高血糖素分泌,导致降低的肝葡萄糖释放,在减少餐后血糖水平中扮演了重要的角色。
第二个临床上重要的GLP-1受体激动剂是毒蜥外泌肽(Exendin)-4.毒蜥外泌肽-4是由毒蜥蜥蜴(Gila Monster)唾液腺生产的39个残基的多肽(Goke等人(1993)Diabetes 46:433-439;Fehmann等人(1995)Endocrine Rev.16:390-410)。虽然它是独特的非哺乳动物基因的产物,并且似乎仅由唾液腺表达,但是毒蜥外泌肽-4与GLP-1享有52%氨基酸序列同源性,且在哺乳动物中与GLP-1受体相互作用(Goke等人;Thorens等人(1993)Diabetes 42:1678-1682)。在体外,毒蜥外泌肽-4已表现出促进胰岛素生产细胞分泌胰岛素,在给予等摩尔量时,比GLP-1更强力地导致胰岛素生产细胞释放胰岛素。此外,毒蜥外泌肽-4在啮齿类和人类中都强力刺激胰岛素释放以降低血浆葡萄糖水平,且比GLP-1作用时间更长;然而,由于它不是哺乳动物中天然存在的,毒蜥外泌肽-4在哺乳动物中具有GLP-1所缺少的某些潜在抗原特性。
临床上已经建立了GLP-1和毒蜥外泌肽-4类似物(例如,利拉鲁肽(Liraglutide)和艾塞那肽(Byetta))改善人体内的葡萄糖控制的能力(Idris(2010)Diabetes Obesity&Metabolism 12,89;Monami等人(2009)European Journal of Endocrinology 160,909)。还报道了GLP-1通过诱导增殖和抑制凋亡,来增加β细胞量(Egan,A等人(2003)Diabetes-Metabolism Research and Reviews 19,115;Farilla,L.等人(2003)Endocrinology 144,5149;Xu,G.等人(1999)Diabetes 48,2270)。它还作为肠道激素发挥作用,抑制胃内的胃酸分泌和胃排空,同时提供减少胃口的饱食信号(Vilsboll等人(2009)Best Practice&Research Clinical Endocrinology&Metabolism 23,453)。这些效果可能解释了向2型糖尿病患者施用GLP-1类似物时观察到的有益的体重减轻。GLP-1还在缺血后的啮齿类心脏中表现出护心作用(Ossum等人(2009)Pharmacological Research 60,411;Sonne,D.P.等人(2008)Regulatory Peptides 146,243;Nikolaidis,L.A.等人(2004)Circulation 109,962)。
此外,GLP-1可以通过降低PPARγ的表达,降低人充质干细胞(hMSC)向脂肪细胞分化,并且GLP-1促进细胞增殖和hMSC的细胞保护作用(Sanz等人(2010)Am J Physiol Endocrinol Metab 298,E634-E643)。
在研发用作治疗1型和2型糖尿病和其他代谢病况的治疗剂的FGF21蛋白(包括其变体或类似物)时,半寿期和稳定性的增加是理想的。具有增强的半寿期和稳定性的FGF21蛋白将允许对要施用所述蛋白质的患者频率较低的给药。明显的,需要研发用于治疗性蛋白质FGF21的稳定的水性蛋白质制剂。
此外,在研发蛋白质药剂(如代谢调节物FGF21、GLP-1和毒蜥外泌肽-4)中的重大挑战是解决其物理和化学的不稳定性。蛋白质的组成变化和特征定义了特殊的行为,如折叠、构象稳定性和解折叠/变性。当目标是利用水性的蛋白质溶液使研发药物制剂条件过程中的蛋白质稳定时,应该解决这类特征(Wang,W.,Int.J.of Pharmaceutics,18,(1999))。稳定目标治疗蛋白(例如本发明的蛋白质)的理想效果是增加对蛋白水解和酶促降解的耐受性,从而改善蛋白质稳定性和降低蛋白质聚集。
发明概述
本发明涉及鉴别新型蛋白质,例如,融合蛋白,所述融合蛋白包含成纤维细胞生长因子21(FGF21)和其他代谢调节物(例如GLP-1和毒蜥外泌肽-4),并且在药剂制剂条件下,具有相比构件活性剂改良的药剂特性,例如更稳定、具有改善施用对象的代谢参数的能力、对蛋白水解和酶促降解更不易受、更不可能聚集和形成复合物,和更不可能是免疫原性的。本发明的蛋白质具有FGF21受体激动剂和GLP-1受体激动剂活性;其包含FGF21的截短形式和变体,并且还包含例如,胰高血糖素样肽-1(GLP-1)、毒蜥外泌肽-4或其他代谢调节物或其变体中的一个或多个。
还公开了这样的方法,所述方法用于治疗FGF21相关疾病和GLP-1相关疾病,以及其他代谢的、内分泌的和心血管的病症,如肥胖、1型和2型糖尿病、胰腺炎、血脂异常、非醇型脂肪肝病(NAFLD)、非醇型脂肪性肝炎(NASH)、胰岛素耐受、高胰岛素血症、葡萄糖不耐受、高血糖、代谢综合征、急性心肌梗塞、高血压、心血管病、动脉粥样硬化、外周动脉病、中风、心脏衰竭、冠心病、肾病、糖尿病并发症、神经病、胃轻瘫、与胰岛素受体的严重失活突变相关的病症、包括HIV相关性脂肪营养不良在内的脂肪营养不良和其他的代谢病症,和降低垂危患者的死亡率和发病率。
本发明的蛋白质可以用作规律施用的(例如,每天、更优选每周、每两周或每月)可注射剂、单独或与口服抗糖尿病剂组合,将改善1型和2型糖尿病患者的血糖控制、体重和脂类谱。蛋白质还可用于治疗肥胖或其他FGF21或GLP-1相关性病况。
本发明的蛋白质,例如,本发明的GLP-1-FGF21变体和毒蜥外泌肽-4-FGF21变体融合蛋白,克服了与蛋白质治疗剂相关的,包括例如与施用野生型FGF21相关的生理学不稳定性的显著障碍,因为其在药物制剂条件下,比野生型FGF21更稳定、对蛋白水解和酶促降解更不易受、更不可能聚集和形成复合物,和更不可能是免疫原性的。
在第一个方面,本发明提供了成纤维细胞生长因子21(FGF21)蛋白,例如包含表1列举的和本文进一步描述的一条或多条序列的融合蛋白。本发明的蛋白质还可包含GLP-1和/或毒蜥外泌肽-4蛋白,不论是野生型、截短的或突变的形式,或其变体。表1列举的FGF21序列是野生型FGF21序列的变体,例如,具有NCBI参考号NP_061986.1的野生型FGF21序列,并可见于专利公开中,例如属于Chiron Corporation的US 6,716,626B1。表1列举的GLP-1和毒蜥外泌肽-4序列是野生型GLP-1和毒蜥外泌肽-4序列的变体,例如,分别具有NCBI参考号NP_002045和AAB22006.1的那些序列,并可见于专利公开中,例如分别属于Eli Lilly and Co.和General Hospital Corp.的WO98/19698和WO87/06941A(GLP-1)和属于Amylin的US 5,424,286(毒蜥外泌肽-4)。
其他实施方案涉及编码本发明的双功能蛋白质的多核苷酸,含有所述多核苷酸的载体和携带所述载体的宿主细胞。
本文提供了用于生成本发明的蛋白质的方法,其中所述方法涉及通过例如在野生型FGF21蛋白的目标位置上位点特异性地掺入氨基酸来修饰野生型FGF21蛋白,以及在分子的FGF21部分与其他代谢调节物(如胰高血糖素样肽-1(GLP-1)和毒蜥外泌肽-4)之间的融合,或者与用GLP-1和/或毒蜥外泌肽-4修饰的聚合物缀合。所述修饰和融合增强了本发明的蛋白质相对于蛋白质的野生型形态(例如,FGF21、GLP-1和毒蜥外泌肽-4)的生物学特性,以及在一些情况下,作为例如标签和蛋白质半寿期延长活性剂的连接点,并用于将所述变体固定在固体支持物的表面的目的。本发明的相关实施方案是生产能够生产本发明的所述蛋白质的细胞的方法,和生产能够生产含有编码所述变体和融合物的DNA的载体的细胞的方法。
在多个实施方案中,本发明的蛋白质可包含FGF21、毒蜥外泌肽-4和/或GLP-1序列的一个或多个片段,包括长度小至8-12个氨基酸残基的片段,其中多肽能够降低哺乳动物中的血糖。在多个实施方案中,本发明的蛋白质可包括FGF21、毒蜥外泌肽-4和/或GLP-1序列的一个或多个变体,例如,相对于其野生型序列具有一个或多个氨基酸缺失、插入、添加或取代。
在一些实施方案中,本发明的蛋白质可以与一种或多种聚合物共价连接,例如聚乙二醇(PEG)或多聚唾液酸,不论是在相对于野生型FGF21、GLP-1或毒蜥外泌肽-4进行位点特异性氨基酸修饰的位置上,还是在与这些蛋白质的野生型形态通常共享的氨基酸位置上。PEG基团是以这样的方式连接的,所述方式增强,和/或不干扰本发明的融合蛋白的构件部分(例如,GLP-1蛋白变体或FGF21蛋白变体)的生物学功能。在其他实施方案中,本发明的多肽可以与异源氨基酸序列融合,任选通过接头,如GS、GGGGSGGGGSGGGGS(SEQ ID NO:8)或SGGGGSGGG(SEQ ID NO:128)。异源氨基酸序列可以是IgG恒定结构域或其片段(例如Fc区)、人血清白蛋白(HSA)或白蛋白结合多肽。本文公开的这类融合蛋白也可以形成多聚物。
在一些实施方案中,异源氨基酸序列(例如,HSA、Fc等)与本发明的蛋白质的氨基端融合。在其他实施方案中,融合异源氨基酸序列(例如,HSA、Fc等)与本发明的蛋白质的羧基端融合。在其他仍然更优选的实施方案中,异源氨基酸序列(例如,HSA、Fc等)位于本发明的双功能蛋白质的中间,即,在GLP-1或毒蜥外泌肽-4序列的C-末端残基与FGF21序列的N-末端残基之间。所述优选的实施方案,例如,为了最大的GLP-1(毒蜥外泌肽-4)活性留下游离的N-末端,和为了最大的FGF21活性留下游离的完整C-末端。
在一些实施方案中,GLP-1受体激动剂与抗体的重链和轻链的N-末端融合,同时FGF21与同一抗体的重链和轻链的C-末端融合(即,本文所述的fusobody)。所述优选的实施方案为了最大的GLP-1(毒蜥外泌肽-4)活性留下游离的N-末端,和为了最大的FGF21活性留下游离的完整C-末端。优选的实施方案使用PCT公开WO2011/076781中描述的抗体序列。
在一些实施方案中,GLP-1或毒蜥外泌肽-4肽与FGF21化学连接。在一些实施方案中,所述肽与FGF21的氨基酸残基侧链连接。在其他实施方案中,所述肽通过天然的化学键或本领域已知的其他方法,与FGF21的N-末端连接。优选的实施方案为了最大的活性而留下GLP-1(毒蜥外泌肽-4)的游离的N-末端,和为了最大活性而留下FGF21的完整的C-末端。
在一些实施方案中,GLP-1或毒蜥外泌肽-4肽共价连接于聚合物分子,所述聚合物分子转而与FGF21蛋白变体连接。在优选的实施方案中,GLP-1或毒蜥外泌肽-4肽连接于PEG聚合物,所述PEG聚合物同时连接于FGF21蛋白变体。所述优选的实施方案为了最大的GLP-1(毒蜥外泌肽-4)活性而留下了游离的N-末端,和为了最大的FGF21活性而留下了游离的完整C-末端。在本发明的一些实施方案中,GLP-1受体激动剂肽通过PEG接头或其他聚合物接头与FGF21变体连接的,所述其他聚合物接头同时提供了半寿期延长和两种受体激动剂的共价连接。
另一个实施方案涉及治疗患者的方法,所述患者表现出一种或多种FGF21相关疾病或GLP-1-相关疾病,如肥胖、2型糖尿病、1型糖尿病、胰腺炎、血脂异常、非醇型脂肪肝病(NAFLD)、非醇型脂肪性肝炎(NASH)、胰岛素耐受、高胰岛素血症、葡萄糖不耐受、高血糖、代谢综合征、急性心肌梗塞、高血压、心血管病、动脉粥样硬化、外周动脉病、中风、心脏衰竭、冠心病、肾病、糖尿病并发症、神经病、胃轻瘫、与胰岛素受体的严重失活突变相关的病症、包括HIV相关性脂肪营养不良在内的脂肪营养不良和其他的代谢病症,所述方法包括向所述需要这类治疗的患者施用治疗有效量的一种或多种本发明的蛋白质或其药物组合物。
本发明还提供了包含本文公开的本发明的双功能蛋白质和可药用的配制剂的药物组合物。这类药物组合物可用于治疗代谢病症的方法中,并且方法包括向所述有需要的人类患者施用本发明的药物组合物。可以治疗的代谢病症的非限制性例子包括1型和2型糖尿病,以及肥胖。
在本发明的下列详细说明中,阐明了在本发明的这些和其他方面。
附图简介
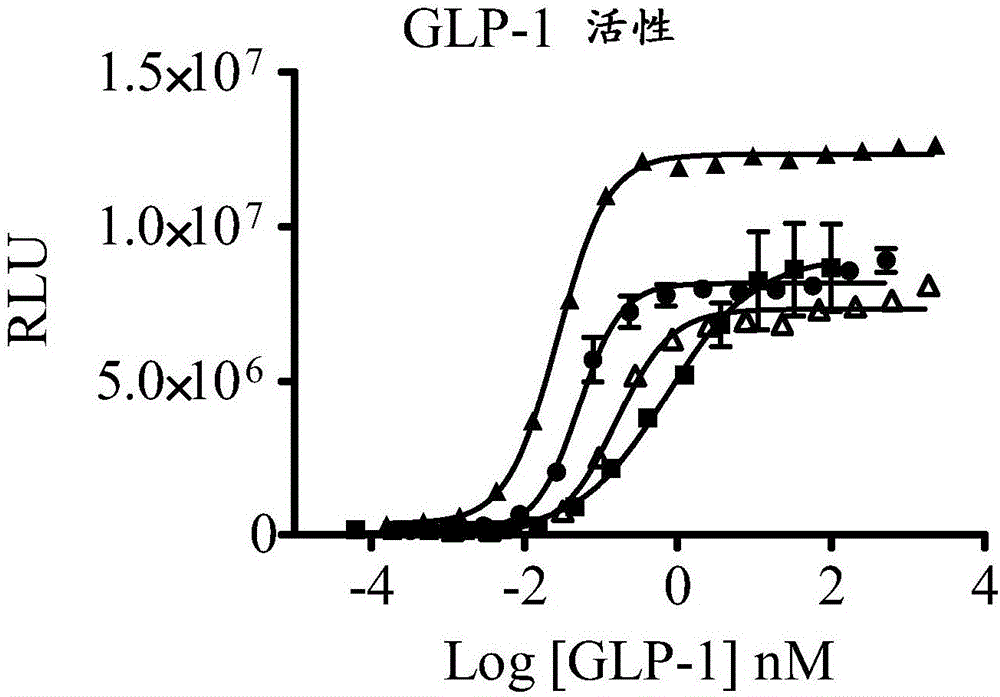
图1A和1B显示了具有不同N-末端突变的GLP-1-FGF21-PEG融合蛋白,和毒蜥外泌肽-4-FGF21-PEG融合蛋白的活性。图1A显示了添加的用于减慢DPP-4蛋白酶加工的突变(GLP-1肽(圆圈)或含有野生型(V231;空心方块)、G0(V251;空心圆圈)、A8G(V258;空心三角)、A8S(V232;三角)或E9P(V271;方块)GLP-1的双功能蛋白质)。图1B显示了毒蜥外泌肽-4融合物(GLP-1肽(方块)或具有毒蜥外泌肽-4 1-39(V234;三角)、1-30(V267;圆圈)或1-30/E16G/E17Q(V268;空心三角)的双功能蛋白质)。
图2显示了GLP-1-FGF21-PEG融合蛋白(FGF21-PEG(V294;空心方块)、GLP-1(A8S)-PEG(V253;空心圆圈)或具有野生型GLP-1(V237;圆圈)或GLP-1(A8S)(V235;三角)GLP-1的双功能蛋白质)的药代动力学特性(PK)。显示了注射0.25mg/kg的野生型非PEG化的FGF21的PK用于比较(方块)。
图3A-3C显示了使用口服糖耐受测试(OGTT)测量半寿期延长的GLP-1-FGF21-PEG融合蛋白的效力的结果。腹膜内(i.p.)注射1mg/kg化合物或载体(实心白色柱;三角),对8周龄C57BL/6J小鼠(n=5)给药。在给药1和24小时后测量血糖,评估GLP-1的急性效果,1小时的效果与野生型GLP-1(V239;散列柱;方块)和GLP-1(A8S)形态(V232;黑色柱;圆圈)相似,而24小时仍然保持比GLP-1(A8S)形态略佳。在第三晚,在给药后72小时用1.5g/kg口服葡萄糖刺激前,使小鼠空腹。用A8S形态给药的小鼠表现出比用野生型GLP-1形态给药的小鼠显著改善的血糖控制,提示A8S突变增加活性GLP-1的长期水平。
图4显示了GLP-1-FGF21-PEG融合蛋白在ob/ob小鼠中的功效。用所示化合物对10周龄雄性ob/ob小鼠(n=8)i.p.给药,每周2次,共计2周。等量给药的FGF21-PEG(V238;对角线散列柱;方块)和GLP-1-FGF21(R154C)-PEG(V239;水平线散列柱;空心方块)显示出与载体治疗组(圆圈)非常相似的对血糖水平、体重和肝脏健康状态(由血清ALT水平和肝重测量)的改善作用。DPP-4-抗性融合物、0.2mg/kg GLP-1(A8S)-FGF21(R154C)-PEG(V235;垂直线散列柱;空心三角)显示出与其他化合物相似的效力,但以1mg/kg GLP-1(A8S)-FGF21(R154C)-PEG(V235;黑色柱;三角)的相等给药产生额外降低血糖、体重、丙氨酸转氨酶(ALT)和肝重。
图5A-5G显示了在ob/ob小鼠中GLP-1(A8S)-FGF21(R154C)-PEG(V235;黑色柱;空心三角)融合蛋白与共同施用FGF21(R154C)-PEG+GLP-1(A8S)-PEG(垂直线散列柱;空心圆圈)、单一施用FGF21(R154C)-PEG(V238;0.2mg/kg(浅色对角线散列柱);1mg/kg(深色对角线散列柱;方块)),和单一施用GLP-1(A8S)-PEG(V253;0.2mg/kg(浅色水平线散列柱);1mg/kg(深色水平线散列柱;空心方块))的比较。用所示化合物或载体(实心白色柱;圆圈)对9周龄雄性ob/ob小鼠(n=8)i.p.给药,每周2次,共计4周。融合物显示出比共同施用FGF21(R154C)-PEG+GLP-1(A8S)-PEG显著改善的效力。虽然仅在FGF21(R154C)-PEG和GLP-1(A8S)-FGF21(R154C)-PEG中观察到中等程度的体重丢失,但其他组却增加了大量体重,仅部分是由于食物摄取的差异。
图6A-6F显示了GLP-1(A8S)-FGF21-PEG融合蛋白在ob/ob小鼠中的效力,比较FGF21(R154C)-PEG(V235;深色柱)与FGF21(V76)-PEG(V272;浅色柱)。用所示化合物或载体(实心白色柱)对9周龄雄性ob/ob小鼠(n=8)i.p.给药,每周2次,共计2周。从0.05至0.2mg/kg(0.05对角线散列柱;0.1水平线散列柱;0.2垂直线散列柱),GLP-1(A8S)-FGF21(R154C)-PEG和GLP-1(A8S)-FGF21(V76)-PEG融合物都表现出对葡萄糖控制和体重的剂量应答。在0.2mg/kg,GLP-1(A8S)-FGF21(V76)-PEG比GLP-1(A8S)-FGF21FGF21(R154C)-PEG更有效,特别是对于降低葡萄糖水平、体重、血清甘油三酯和胆固醇。图6A-6C分别显示了基础葡萄糖(AUC)、丙氨酸转氨酶(ALT)和血清总胆固醇的水平。图6D-6F分别显示了D12体重、肝脂类和血清甘油三酯的水平。
图7A-7B显示了相对于单独的活性剂的组合,GLP-1(A8S)-FGF21(V76)-PEG融合蛋白改善胰腺功能和增加胰岛的胰岛素含量的能力。用单独的GLP-1(A8S)-PEG+FGF21(V76)-PEG的组合(V76+V253;垂直线散列柱),以及用本发明的GLP-1(A8S)-FGF21(V76)-PEG双功能融合蛋白(V272;对角线散列柱;浅色为0.5mg/kg,深色为1mg/kg)或载体(白色柱)对Db/db小鼠每周给药2次,共计4周。
图8A-8B显示了相对于单独的活性剂的组合,GLP-1-FGF21-PEG融合蛋白改善葡萄糖降低和体重的能力。使用载体(白色柱;空心圆圈)、单独的GLP-1(A8S)-PEG(V253;3mg/kg(浅色水平线散列柱;空心菱形)和5mg/kg(深色水平线柱;菱形))和FGF21(V76)-PEG(3mg/kg(V76;浅色对角线散列柱;空心方块)和5mg/kg(深色对角线散列柱;方块))的组合,以及用本发明的GLP-1(A8S)-FGF21(V76)-PEG双功能融合蛋白(V272;0.2mg/kg(小格子柱;空心三角);1mg/kg(大格子柱;三角)),对Db/db小鼠每周给药2次,共计2周。如图可见,0.2mg/kg的GLP-1(7-35;A8S)-FGF21(V76)-PEG双功能融合蛋白(V272)与5mg/kg的FGF21(V76)-PEG同样有效。图中还可见,对于血糖和体重终点而言,1.0mg/kg的GLP-1(7-35;A8S)-FGF21(V76)-PEG双功能融合蛋白(V272)比FGF21(V76)-PEG+GLP-1(7-35;A8S)-PEG(1+1mg/kg(浅色水平线散列柱;X形)和3+3mg/kg(深色水平线柱;星形)的最大有效组合剂量更有效。
图9显示了FGF21活性测定的结果。在用所示化合物处理HEK293-β-klotho细胞后,测量ERK的磷酸化。在存在或缺少等摩尔艾塞那肽(艾塞那肽)的条件下,与相同的FGF21变体FGF21(V76)-PEG对比,GLP-1(A8S)-V76-PEG(V272)的信号高度的活性显著更高。
图10展示了与匹配的单个激动剂蛋白质或肽相比,用于测量融合蛋白活性的受体药理学测定法的结果。在化合物处理1小时后,测定用GLP-1R和FGFR1c/β-klotho(10a和10b),或仅用GLP-1R(10c和10d)转染的HEK293细胞的GLP-1R对β-抑制蛋白的招募。测定法中检测的分子是:毒蜥外泌肽-4(方块)、GLP-1(A8S)-FGF21(V76)-PEG(V272;圆圈)、GLP-1(A8S)-PEG(V253;三角)、V253+FGF21(V76)-PEG(空心菱形)、毒蜥外泌肽-4(1-39)-Fc-FGF21(V103)(V211;空心圆圈)、毒蜥外泌肽-4(1-39)-Fc(V201;空心三角)和V201+FGF21(V101)(菱形)。
发明详述
本发明的蛋白质代表了如本领域已知的全长野生型FGF21多肽的修饰的形态。以FGF21野生型序列作为参考序列(SEQ ID NO:1),例如当需要比较FGF21野生型序列和蛋白质变体时。FGF21野生型序列具有NCBI参考序列号NP_061986.1,并且可见于这类公开的专利中,例如属于Chiron Corporation的US 6,716,626B1(SEQ ID NO:1)。
下面显示了编码全长FGF21多肽的相应mRNA序列(NCBI参考序列号NM_019113.2)(SEQ ID NO:2):
成熟的FGF21序列缺少前导序列,并且还可以包括多肽的其他修饰,如氨基末端(有或无前导序列)和/或羧基末端的蛋白水解加工、从较大的前体切割较小的多肽、N-连接和/或O-连接的糖基化,和本领域技术人员已知的其他翻译后修饰。成熟的FGF21序列的代表性例子具有下列序列(SEQ ID NO:3,其代表全长FGF21蛋白序列(NCBI参考序列号NP_061986.1)的第29-209位氨基酸):
下面显示了编码成熟的FGF21多肽(SEQ ID NO:3)的相应cDNA序列(SEQ ID NO:4):
本发明的蛋白质代表了全长的野生型GLP-1多肽的修饰形态,如本领域已知的。以GLP-1野生型序列作为参考序列(SEQ ID NO:5),例如当需要比较GLP-1野生型序列和蛋白质变体时。
GLP-1野生型序列是翻译后修饰的,否则源自前原胰高血糖素野生型序列。前原胰高血糖素(preproglucagon)序列(SEQ ID NO:5)具有NCBI参考序列号NP_002045,并且可见于这类专利公开中,例如分别属于Eli Lilly和Co.and the General Hospital Corp.的WO98/19698和WO87/06941A。如上所述,例如,在Goke,等人(1991)European Journal of Clinical Investigation 21,135中,GLP-1是源自前原胰高血糖素的37mer(GLP-1构成了前原胰高血糖素的第92-138位残基,在下文SEQ ID NO:5中是下划线的)。通过切割6个N-末端残基,将GLP-1进一步加工成活性31mer。
加工的、野生型GLP-1序列的例子如下(SEQ ID NO:129):
1 HDEFERHAEG TFTSDVSSYL EGQAAKEFIA WLVKGRG
活性GLP-1序列的例子如下(SEQ ID NO:30):
1 HAEGTFTSDV SSYLEGQAAK EFIAWLVKGR G
编码前原胰高血糖素GLP-1野生型序列(SEQ ID NO:5)的相应mRNA序列显示如下(SEQ ID NO:6):
本发明的蛋白质代表了全长野生型毒蜥外泌肽-4多肽的修饰形态,如本领域已知的。以毒蜥外泌肽-4野生型序列作为参考序列(SEQ ID NO:7),例如当需要比较毒蜥外泌肽-4野生型序列和蛋白质变体时。
毒蜥外泌肽-4野生型序列具有NCBI参考序列号GenBank:AAB22006.1,并可见于这类专利公开中,例如属于Amylin Pharmaceuticals,Inc.和Eli Lilly and Co.的US 5,424,286。野生型序列的例子如下(SEQ ID NO:7):
1 HGEGTFTSDL SKQMEEEAVR LFIEWLKNGG PSSGAPPPS
本发明的蛋白质可包含本文列举的野生型蛋白质的蛋白质变体或突变体,例如,FGF21变体、GLP-1变体,和/或毒蜥外泌肽-4变体。如本文使用的,术语“蛋白质变体”、“人变体”、“多肽或蛋白质变体”、“变体”、“突变体”及其任何类似的术语或其特定形态(例如,“FGF21蛋白变体”、“人GLP-1变体”、“毒蜥外泌肽-4多肽或蛋白变体”、“变体”、“FGF21突变体”等)定义了包含天然存在的(即,野生型)蛋白质或多肽对应物或相应的天然序列的修饰、截短、其他变体的蛋白质或多肽序列。例如,相对于本文所述的野生型(即,天然存在的)FGF21蛋白,描述了“变体FGF21”或“FGF21突变体”。
表1中列举了本发明的代表性的双功能蛋白质序列。所述激动剂的描述包括了单个构件激动剂,以及适用时,接头。如果使用变体作为构件激动剂,则所作出的改变或取代是相对于其野生型对应物编号的。作为示例,“双功能蛋白-1”(SEQ ID NO:9)含有本文所述的野生型GLP-1序列的第7-35位残基(即,GLP-1受体激动剂)、接头序列和FGF21变体(即,FGF21受体激动剂),所述FGF21变体具有多个所列举对本文所述FGF21野生型序列(SEQ ID NO:1)的改变。
表1.本发明的双功能蛋白和核苷酸
用于本发明的蛋白质中的变体或突变体,例如,野生型FGF21、GLP-1和/或毒蜥外泌肽-4的变体的特征是相对于野生型蛋白质至少一个取代的、添加的和/或去除的氨基酸。此外,变体可包括相对于野生型蛋白质的N-和/或C-末端截短。一般而言,变体具有野生型蛋白质的一些改性的结构或功能的特性。例如,变体可具有在浓缩溶液中增强的或改善的物理稳定性(例如,较少的疏水性介导的聚集作用),当与血浆孵育时增强的或改善的血浆稳定性,或降低的免疫原性风险,或增强的或改善的生物活性,同时保留有利的生物活性谱。
构成本发明的蛋白质的部分及其野生型比较蛋白质之间的差异的可接受的氨基酸取代和修饰包括,但不限于,一个或多个氨基酸取代,包括用吡咯赖氨酸、吡咯啉-羧基-赖氨酸(Pcl)和非天然存在的氨基酸类似物取代,和截短。因此,本发明的蛋白质(例如,本发明的融合蛋白)包括但不限于,定点突变体、截短的多肽、抗蛋白水解的突变体、聚集作用降低的突变体、组合突变体,和本文所述的融合蛋白。
蛋白质表达领域的技术人员将认识到,可以在任何本发明的蛋白质的N-末端导入甲硫氨酸或甲硫氨酸-精氨酸序列,用于在大肠杆菌中表达,并且被考虑落入本发明的范围内。
蛋白质表达领域的技术人员将认识到,用于调控表达水平、纯化或稳定的目的,可以在任何本发明的蛋白质的N-末端导入额外的标签或融合结构域,有或没有被用于之后去除所述标签或融合结构域的特定蛋白酶靶向消化的额外的肽,用于在任何宿主细胞中表达,并且被考虑落入本发明的范围内。
蛋白质表达领域的技术人员将认识到,可以在任何本发明的蛋白质的N-末端导入将表达的蛋白质靶向到周质空间或胞外空间的前导肽,用于在大肠杆菌或其他细菌宿主中表达,并被考虑落入本发明的范围内。
蛋白质表达领域的技术人员将认识到,可以在任何本发明的蛋白质的N-末端导入将表达的蛋白质靶向到ER、分泌囊泡或胞外空间的前导肽,用于在真核宿主细胞中表达,并被考虑落入本发明的范围内。
本发明的蛋白质可具有与药物防腐剂(例如,间甲酚、苯酚、苯甲醇)增加的相容性,因此使得能够制备保藏的药物制剂,该制剂在储藏过程中维持蛋白质的物理化学特性和生物学活性。因此,在生理学和保藏的药物制剂条件下,相对于野生型具有增强的药物稳定性的变体在浓缩溶液中都具有改善的物理稳定性,同时维持了生物学效价。作为非限制性的例子,相比其对应的野生型对应物或相应的天然序列,本发明的蛋白质可以更耐受蛋白水解和酶促降解;可以具有改善的稳定性;可以较不易聚集。如本文使用的,这些术语不是互斥的或限制的,给定的变体完全可能具有野生型蛋白质的一种或多种改性的特性。
本发明还涵盖了编码本发明的蛋白质的核酸分子,所述蛋白质包含例如,与SEQ ID NO:3的氨基酸序列具有至少约95%同一性的FGF21氨基酸序列,但其中赋予FGF21蛋白变体理想特性(例如,改善的FGF21-受体效价、蛋白水解抗性、增加的半寿期或降低的聚集特性,及其组合)的特定残基没有被另外修饰。换言之,除了FGF21突变体序列中为了赋予蛋白水解抗性、降低的聚集作用或其他特性而已经被修饰的残基外,约5%(可选的4%,可选的3%,可选的2%,可选的1%)的FGF21突变体序列中的所有其他氨基酸残基可被修饰。这样的FGF21突变体具有野生型FGF21多肽的至少一种活性。
类似的,本发明还包含编码分子的GLP-1和毒蜥外泌肽-4部分的核酸分子,其氨基酸序列分别与SEQ ID NO:30和7的氨基酸序列具有至少约85%同一性,更优选具有至少约90至95%同一性,但其中赋予双功能蛋白质变体理想特性(例如,蛋白水解抗性、增加的半寿期或降低的聚集特性,及其组合)的特定残基没有被另外修饰。
本发明还涵盖了包含这样的核苷酸序列的核酸分子,所述核苷酸序列与SEQ ID NO:2、SEQ ID NO:4、SEQ ID NO:6,和编码野生型毒蜥外泌肽-4的cDNA序列的核苷酸序列具有至少约85%同一性,更优选至少约90至95%同一性,但其中编码赋予被编码的蛋白质的蛋白水解抗性、降低的聚集特性或其他特性的氨基酸残基的核苷酸没有被另外修饰。换言之,除了编码FGF21、GLP-1或毒蜥外泌肽-4突变体序列中为了赋予蛋白水解抗性、降低的聚集特性或其他特性而已经被修饰的残基的核苷酸外,突变体序列中约15%,更优选约10至5%的所有其他核苷酸可被修饰。这样的核酸分子编码具有其野生型对应物的至少一种活性的蛋白质。
本文提供了用于生成本发明的蛋白质的方法,其中这类方法涉及对蛋白质的野生型形态(例如,本文所述的FGF21野生型蛋白质)的位点特异性修饰和非位点特异性修饰,例如,野生型蛋白质的截短,和在野生型蛋白质内的目标位置位点特异性掺入氨基酸。所述修饰增强了本发明的蛋白质相对于野生型蛋白质的生物学特性,并且,在一些情况下,充当例如标记和蛋白质半寿期延长活性剂的连接点,并用于将所述变体固定在固体支持物表面上的目的。本发明相关的实施方案是生产能够生产本发明所述的双功能蛋白质的细胞,和生产能够生产含有编码所述变体的DNA的载体的细胞的方法。
在某些实施方案中,使用这样的修饰,例如位点特异性修饰,来连接缀合物(例如,连接PEG基团与本发明的蛋白质、多肽和/或肽),用于例如延长所述蛋白质、多肽和/或肽的半寿期或改善所述蛋白质、多肽和/或肽的生物学特性的目的。本文其他地方描述了所述技术。
在其他实施方案中,使用这样的修饰,例如位点特异性修饰,来连接延长本发明的蛋白质的半寿期的其他聚合物、小分子和重组蛋白质序列。一个这样的实施方案包括连接脂肪酸或特定的白蛋白结合化合物与蛋白质、多肽和/或肽。在其他实施方案中,修饰对特定的氨基酸类型进行,并且可以连接蛋白质上的一个或多个位点。
在其他实施方案中,使用这样的修饰,例如位点特异性修饰,作为连接工具,用于生产野生型和/或变体多聚体,例如二聚体(同源二聚体或异源二聚体)或三聚体或四聚体。这些多聚的蛋白质分子可以额外具有这样的基团(如PEG、糖和/或PEG-胆固醇缀合物),所述基团与其他蛋白质(如Fc、人血清白蛋白(HAS)等)氨基末端或羧基末端连接或融合。
在其他实施方案中,使用这样的位点特异性修饰来生产蛋白质、多肽和/或肽,其中位点特异性掺入的吡咯赖氨酸、吡咯啉-羧基-赖氨酸或吡咯赖氨酸类似物或非天然存在的氨基酸(对-乙酰-Phe、对-叠氮-Phe)的位置允许这类蛋白质、多肽和/或肽在固体支持物的表面上受控的方向和连接,或者具有连接的基团例如PEG、糖和/或PEG-胆固醇缀合物。
在其他实施方案中,使用这样的位点特异性修饰来位点特异性地交联蛋白质、多肽和/或肽,从而形成异源寡聚物,包括但不限于异源二聚体和异源三聚体。在其他实施方案中,使用这样的位点特异性修饰来位点特异性地交联蛋白质、多肽和/或肽,从而形成蛋白质-蛋白质缀合物、蛋白质-多肽缀合物、蛋白质-肽缀合物、多肽-多肽缀合物、多肽-肽缀合物或肽-肽缀合物。在其他实施方案中,位点特异性修饰可包括允许在蛋白质、多肽或肽的单个位点上连接多于一种类型的分子的分枝点。
在其他实施方案中,可以以非位点特异性方式进行本文列举的修饰,并获得本发明的蛋白质-蛋白质缀合物、蛋白质-多肽缀合物、蛋白质-肽缀合物、多肽-多肽缀合物、多肽-肽缀合物或肽-肽缀合物。
定义
本文全文使用了多种定义。大部分词汇都具有属于本领域技术人员词汇的含义。在本文的下文或其他地方具体定义的词汇具有本发明上下文作为整体所提供的含义,并且通常是本领域技术人员理解的意思。
如本文使用的,术语“FGF21”指成纤维细胞生长因子(FGF)蛋白质家族的成员。FGF21的氨基酸序列(GenBank登录号NP_061986.1)如SEQ ID NO:1所述,其相应的多核苷酸序列如SEQ ID NO:2所述(NCBI参考序列号NM_019113.2)。“FGF21变体”、“FGF21突变体”和相似术语描述了FGF21蛋白的修饰的形态,例如,构件氨基酸残基被缺失、添加、修饰或取代。
如本文使用的,术语“FGF21受体”指FGF21的受体(Kharitonenkov,A,等人(2008)Journal of Cellular Physiology 215:1-7;Kurosu,H等人(2007)JBC 282:26687-26695;Ogawa,Y等人(2007)PNAS 104:7432-7437)。
术语“FGF21多肽”指在人中表达的天然存在的多肽。出于本公开内容的目的,术语“FGF21多肽”可互换的使用,指任何全长FGF21多肽,例如,由209个氨基酸残基组成且由SEQ ID NO:2的核苷酸序列编码的SEQ ID NO:1;多肽的任何成熟形式,其由181个氨基酸残基组成,并且其中去除了全长FGF21多肽的氨基末端的28个氨基酸残基(即,构成信号肽)。
如本文使用的,“变体76”或“V76”是FGF21蛋白变体,特征是通过Cys154连接的40kDa分枝的PEG,和相对于177个氨基酸的野生型蛋白质的8个点突变。本文详细的描述了变体的合成。
如本文使用的,“变体101”或“V101”是FGF21蛋白变体,特征是改造的二硫桥,和相对于177个氨基酸的野生型蛋白质的8个点突变,其作为含GS接头的与人IgG1Fc-结构域的融合物表达。本文详细的描述了变体的合成。
如本文使用的,“变体103”或“V103”是FGF21蛋白变体,特征是改造的二硫桥,和相对于177个氨基酸的野生型蛋白质的8个点突变,其作为含GS接头的与人IgG1Fc-结构域的融合物表达。本文详细的描述了变体的合成。
如本文使用的,“变体188”或“V188”是FGF21蛋白变体,特征是改造的二硫桥,和相对于177个氨基酸的野生型蛋白质的8个点突变,其作为含(SGGGG)3接头的与人IgG1Fc-结构域的融合物表达。本文详细的描述了变体的合成。
“GLP-1-FGF21-PEG双重激动剂”、“双功能蛋白质”、“双功能融合蛋白”、“双活性蛋白质”、“融合产物”、“双重FGF21受体激动剂和GLP-1受体激动剂”、“本发明的双重FGF21受体激动剂和GLP-1受体激动剂”、“GLP-1-FGF21融合蛋白”、“本发明的融合蛋白”、“本发明的融合物”和相似的术语定义了蛋白质或多肽融合物,所述蛋白质或多肽融合物至少包含与另一个代谢调节物(如GLP-1或毒蜥外泌肽-4)融合或连接的FGF21多肽或蛋白质变体、突变体或截短的形态。其包含具有关于其各个构件的受体的双活性或双功能的单个分子,即,其表现出激发FGF21受体和GLP-1受体的能力。所述融合蛋白的构件序列可包含天然存在的(即,野生型)蛋白质或多肽对应物的修饰、截短、其他变体,并可应用任何数量的多种其他修饰,例如用于延长半寿期的PEG基团。
本发明的GLP-1-FGF21-PEG融合蛋白的特别优选的实施方案掺入(本文定义的)V76作为FGF21变体。所述优选的实施方案在本文中也被称为“GLP-1(A8S)-FGF21-PEG”,并且特征是相对于野生型GLP-1序列(SEQ ID NO:5129)第8位丙氨酸被取代为丝氨酸,和相对于野生型FGF21序列(SEQ ID:1)第154位精氨酸被取代为半胱氨酸。GLP-1(A8S)-FGF21(V76)-PEG的序列如下(SEQ ID NO:9)。
术语“分离的核酸分子”指这样的本发明的核酸分子,所述核酸分子(1)已经与从源细胞中分离总核酸时至少约50%的天然发现的蛋白质、脂类、碳水化合物或其他材料分离,(2)不与“分离的核酸分子”天然连接的全部或部分多核苷酸连接,(3)与不天然连接的多核苷酸有效连接,或(4)不作为较大的多核苷酸序列的一部分天然存在。优选的,本发明的分离的核酸分子基本上不含在其自然环境中可见的任何其他污染的核酸分子或其他污染物,所述污染的核酸分子或污染物将干扰其在多肽生产或其治疗、诊断、预后或研究用途中的应用。
术语“载体”用于指任何用于将编码信息转移到宿主细胞的分子(例如,核酸、质粒或病毒)。
术语“表达载体”指适合转化宿主细胞和含有核酸序列的载体,所述核酸序列指导和/或控制插入的异源核酸序列的表达。表达包括但不限于这样的过程,如转录、翻译和RNA剪切(如果存在内含子)。
术语“有效连接的”在本文中用于指侧翼序列的排列,其中配制或装配所述侧翼序列以实施其正常的功能。融合蛋白的元件可以是彼此有效连接的,使得允许融合蛋白如同其为天然存在的、内源性蛋白质那样发挥功能,和/或以协同的方式组合所述融合蛋白的不同元件。
在核苷酸水平,与编码序列有效连接的侧翼序列能够影响编码序列的复制、转录和/或翻译。例如,当启动子能够指导编码序列的转录时,编码序列与启动子是有效连接的。只要能够正确的发挥功能,侧翼序列不必与编码序列连续。因此,例如,启动子序列和编码序列之间可以存在间插的非翻译但转录的序列,并且启动子序列仍然可以被认为是与编码序列“有效连接的”。
术语“宿主细胞”用于指已被转化的,或能够用核酸序列转化,并然后能够表达选择的目标基因的细胞。术语包括亲代细胞的后代,不论后代的形态学或遗传学组成是否与原始亲本相同,只要仍存在选择的基因。
如本文使用的,术语“氨基酸”指天然存在的氨基酸、以与天然存在的氨基酸相似的方式发挥功能的非天然氨基酸、氨基酸类似物和氨基酸模拟物,都处于其D型和L型立体异构体如果其结构允许这类立体异构体形式。在本文中,用名称、常规已知的三字母符号或IUPAC-IUB生物化学命名委员会推荐的一字母符号称呼氨基酸。
当与生物学材料(如核酸分子、多肽、宿主细胞等)结合使用时,术语“天然存在的”指在自然界发现的材料并且不是人为操作的。类似的,“非天然存在的”在本文中用于指在自然界中没有发现的,或经过结构修饰或人为合成的材料。当与核苷酸结合使用时,术语“天然存在的”指碱基腺嘌呤(A)、胞嘧啶(C)、鸟嘌呤(G)、胸腺嘧啶(T)和尿嘧啶(U)。当与氨基酸结合使用时,术语“天然存在的”指20种常规氨基酸(即,丙氨酸(A)、半胱氨酸(C)、天冬氨酸(D)、谷氨酸(E)、苯丙氨酸(F)、甘氨酸(G)、组氨酸(H)、异亮氨酸(I)、赖氨酸(K)、亮氨酸(L)、甲硫氨酸(M)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、缬氨酸(V)、色氨酸(W)和酪氨酸(Y)),以及硒代半胱氨酸、吡咯赖氨酸(Pyl或O)和吡咯啉-羧基-赖氨酸(Pcl或Z)。
吡咯赖氨酸(Pyl)是在甲烷八叠球菌(Methanosarcina)科的产甲烷古菌(methanogenic archaea)的甲胺甲基转移酶中天然发现的氨基酸。吡咯赖氨酸是在相应mRNA中符合读框的UAG密码子处共翻译掺入的赖氨酸类似物,被认为是第22种天然氨基酸。
至少如PCT专利公开WO2010/48582(申请人IRM,LLC)所述,在大肠杆菌中尝试生物合成吡咯赖氨酸(Pyl)导致形成“去甲基化的吡咯赖氨酸”,在本文中被称为吡咯啉-羧基-赖氨酸或Pcl。如本文使用的,“Pcl”指Pcl-A或Pcl-B。
如本文使用的,术语“非天然氨基酸”和“不天然氨基酸”是可互换的,意在代表不能在任何生物体中使用来自任何生物体的未修饰或修饰的基因,而生物合成生成的氨基酸结构,不论是相同或不同的。术语指在天然存在的(野生型)FGF21蛋白序列或本发明的序列中不存在的氨基酸残基。这包括但不限于,不是20种天然存在的氨基酸,硒代半胱氨酸,吡咯赖氨酸(Pyl)或吡咯啉-羧基-赖氨酸(Pcl,例如PCT专利公开WO2010/48582所述)中的一种的修饰的氨基酸和/或氨基酸类似物。可以通过取代天然存在的氨基酸,和/或向天然存在的(野生型)FGF21蛋白序列或本发明的序列中插入非自然氨基酸,导入这类非自然氨基酸残基。还可以掺入非天然氨基酸残基,使得给予FGF21分子理想的功能性,例如连接官能团(例如,PEG)的能力。如本文使用的,当与氨基酸结合使用时,符号“U”应该意指“非天然氨基酸”和“不天然氨基酸”。
此外,应理解这类“不天然氨基酸”通常需要修饰的tRNA和修饰的tRNA合成酶(RS)用于掺入到蛋白质中。这些“选择的”正交tRNA/RS对是通过Schultz等人研发的选择过程,或通过随机或靶向突变产生的。作为示例,吡咯啉-羧基-赖氨酸是“天然的氨基酸”,因为它是通过从一种生物体转移到宿主细胞中的基因生物合成产生的,且因为它是通过使用天然的tRNA和tRNA合成酶基因掺入到蛋白质中的,但是p-氨基苯丙氨(参见Generation of a bacterium with a 21amino acid genetic code,Mehl RA,Anderson JC,Santoro SW,Wang L,Martin AB,King DS,Horn DM,Schultz PG.J Am Chem Soc.2003Jan 29;125(4):935-9)则是“不天然氨基酸”,因为它虽然是生物合成产生,但它是通过“选择的”(即,不是“天然存在的”)正交tRNA/tRNA合成酶对掺入到蛋白质中的。
修饰的编码的氨基酸包括但不限于羟脯氨酸、γ-羧基谷氨酸、O-磷酸丝氨酸、吖丁啶羧酸、2-氨基已二酸、3-氨基已二酸、β-丙氨酸、氨基丙酸、2-氨基丁酸、4-氨基丁酸、6-氨基己酸、2-氨基庚酸、2-氨基异丁酸、3-氨基异丁酸、2-氨基庚二酸、叔丁基甘氨酸、2,4-二氨基异丁酸、锁链素、2,2’-二氨基庚二酸、2,3-二氨基丙酸、N-乙基甘氨酸、N-甲基甘氨酸、N-乙基天冬酰胺、高脯氨酸、羟赖氨酸、别-羟赖氨酸、3-羟脯氨酸、4-羟脯氨酸、异锁链素、别-异亮氨酸,N-甲基丙氨酸、N-甲基甘氨酸、N-甲基异亮氨酸、N-甲基戊基甘氨酸、N-甲基缬氨酸、naphthalanine、正缬氨酸、正亮氨酸、鸟氨酸、戊基甘氨酸、2-哌啶酸和硫代脯氨酸。术语“氨基酸”还包括这样的天然存在的氨基酸,其在某些生物体中是代谢物但不由遗传密码编码用于掺入到蛋白质中。这类氨基酸包括但不限于鸟氨酸、D-鸟氨酸或D-精氨酸。
如本文使用的,术语“氨基酸类似物”指具有与天然存在的氨基酸相同基础化学结构的化合物,仅作为示例,结合氢原子、羧基、氨基和R基的α-碳。氨基酸类似物包括天然的和不天然的氨基酸,所述氨基酸是可逆或不可逆地化学封闭的,或者其C-末端的羧基、其N-末端的氨基和/或其侧链官能团是化学修饰的。这类类似物包括但不限于甲硫氨酸亚砜、甲硫氨酸砜、S-(羧基甲基)-半胱氨酸,S-(羧基甲基)-半胱氨酸亚砜、S-(羧基甲基)-半胱氨酸砜、天冬氨酸-(β-甲酯)、N-乙基甘氨酸、丙氨酸甲酰胺、高丝氨酸、正亮氨酸和甲硫氨酸甲基锍。
如本文使用的,术语“氨基酸模拟物”指具有与氨基酸的一般化学结构不同,但其以与天然存在的氨基酸相似的方式发挥功能的结构的化学化合物。
术语“生物学活性变体”指任何用于本发明的双功能蛋白质中的多肽变体,例如,作为融合物的构件蛋白,具有其野生型(例如,天然存在的)蛋白质或多肽对应物的活性,如调节血糖、HbA1c、胰岛素、甘油三酯或胆固醇水平;增加胰腺功能;降低肝脏的脂类水平;减少体重;改善糖耐受、能量消耗或胰岛素敏感性的能力,而不论导入到多肽变体中的修饰的类型或数量。具有相对于其野生型形态一定程度减少的活性水平的多肽变体仍然可以被认为是生物学活性的多肽变体。本发明的生物学活性的多肽变体的非限制性的代表例子是这样的FGF21变体,其是修饰的,且具有与野生型FGF21相似或增强的生物学特性。
术语“有效量”和“治疗有效量”都指用于支持野生型多肽或蛋白质对应物的一种或多种生物学活性的可观察水平的本发明的融合蛋白的量,如降低血糖、胰岛素、甘油三酯或胆固醇水平;降低肝脏的甘油三酯或胆固醇水平;降低肝脏的甘油三酯或脂类水平;减少体重;或改善糖耐受、能量消耗或胰岛素敏感性的能力。例如,向表现出、患有或倾向患有FGF21-相关疾病或GLP-1-相关疾病(如1型或2型糖尿病、肥胖或代谢综合征)的患者施用的“治疗有效量”是这样的量,所述量导致、减轻或者引起与上述病症相关的病理学症状、疾病进程、生理病况的改善或抵抗死于上述病症。出于本发明的目的,“对象”或“患者”优选是人,但也可以是动物,更具体的是伴侣动物(例如,狗、猫等)、农场动物(例如,牛、绵羊、猪、马等)和实验室动物(例如,大鼠、小鼠、豚鼠等)。
术语“可药用的运载体”或“生理学可接受的运载体”在本文中指适合实现或增强本发明的融合蛋白递送的一种或多种制剂材料。
术语“抗原”指分子或分子的一部分,其能够被抗体结合,并且还能够用于在动物中生产能够结合该抗原的表位的抗体。抗原可具有一个或多个表位。
术语“天然Fc”指包含获得自完整抗体的消化,或者通过其他手段生产的非抗原结合片段的序列的分子或序列,不论其是单体或多聚体的形式,且可以含有铰链区。天然Fc的原始免疫球蛋白来源优选是人起源的,并可以是任何免疫球蛋白,但IgG1和IgG2是优选的。天然Fc分子由可以通过共价(即,二硫键)和非共价缔合连接成二聚体或多聚体形式的单体多肽组成。在天然Fc分子的单体亚基之间的分子间二硫键的数量范围是从1至4个,取决于类型(例如,IgG、IgA和IgE)或亚类(例如,IgG1、IgG2、IgG3、IgA1和IgGA2)。天然Fc的一个例子是以二硫键连接的二聚体,其获得自IgG的木瓜蛋白酶消化(参见Ellison等人,1982,Nucleic Acids Res.10:4071-9)。用于本文中的术语“天然Fc”一般是单体、二聚体和多聚体形式。术语“Fc变体”指由天然Fc修饰而来,但仍然包含补救受体FcRn(新生儿Fc受体)的结合位点的分子或序列。国际公开号WO 97/34631和WO 96/32478描述了示例性的Fc变体,以及与补救受体的相互作用,并通过引用整合到本文中。因此,术语“Fc变体”可包含从非人的天然Fc人源化的分子或序列。此外,天然Fc包含可以去除的区域,因为这些区域提供了本发明的蛋白质融合分子不需要的结构特征或生物学活性。因此,术语“Fc变体”包含这样的分子或序列,所述分子或序列缺少一个或多个天然Fc位点或残基,或者其中的一个或多个天然Fc位点或残基已被修饰,所述位点或残基影响或参与:(1)二硫键形成,(2)与选择的宿主细胞的不相容性,(3)在选择的宿主细胞表达时N-末端异质性,(4)糖基化作用,(5)与补体的相互作用,(6)与补救受体以外的Fc受体结合,或(7)抗体依赖性的细胞毒性(ADCC)。下文进一步详细描述了Fc变体。
术语“Fc结构域”涵盖了天然Fc和Fc变体和上述序列。对于Fc变体和天然Fc分子,术语“Fc结构域”包括单体或多聚体形式的分子,不论是从完整抗体消化获得的,或者通过其他手段生产的。在本发明的一些实施方案中,Fc结构域可以通过例如,Fc结构域和FGF21序列之间的共价键,与FGF21或FGF21突变体(包括FGF21或FGF21突变体的截短的形式)融合。这类融合蛋白可以通过Fc结构域的缔合形成多聚体,并且这些融合蛋白及其多聚体也是本发明的一个方面。
如本文中使用的,术语“fusobody”指包含2个异源二聚体的抗体样可溶性蛋白质,每个异源二聚体都由1条氨基酸重链和1条氨基酸轻链组成,通过例如一个或多个二硫键彼此稳定地缔合在一起。每条重链或轻链包含抗体的恒定区,在下文中分别被称为fusobody的重链和轻链恒定区。重链恒定区至少包含抗体的CH1区,还可包含CH2和CH3区,包括铰链区。轻链恒定区包含抗体的CL区。在fusobody中,抗体的可变区被异源的可溶性结合结构域取代。作为非限制性例子,本发明的fusobody可包含本发明的双功能融合蛋白,其中GLP-1受体激动剂与抗体的重链和轻链的N-末端融合,并且FGF21同时与同一抗体的重链和轻链的C-末端融合。
术语“异源”意指这些结构域不是天然发现与抗体恒定区缔合的。特别的是,这类异源的结合结构域不具有由4个框架区FR1、FR2、FR3和FR4,和之间的3个互补决定区(CDR)组成的抗体可变结构域的典型结构。因此,fusobody的每个臂包含第一单链多肽和第二单链多肽,所述第一单链多肽包含共价连接在抗体的恒定CH1重链区的N-末端部分上的第一结合结构域,而所述第二单链多肽包含共价连接在抗体的恒定CL轻链区的N-末端部分上的第二结合结构域。共价连接可以是直接的,例如通过肽键,或者可以是间接的,通过接头,例如肽接头。fusobody的2个异源二聚体是共价连接的,例如通过其铰链区处的至少一个二硫键,类似抗体结构。本领域已经描述了具有fusobody结构的分子实例,特别是包含异源二聚体受体的配体结合区的fusobody(参见例如,国际专利公开号WO01/46261和WO11/076781)。
术语“聚乙二醇”或“PEG”指聚烷撑二醇化合物或其衍生物,有或无偶联剂或者由偶联或激活部分衍生。
术语“艾塞那肽”表示毒蜥外泌肽-4的合成形态,作为Byetta和Bydureon销售的艾塞那肽是2005年4月批准的胰高血糖素样肽-1激动剂(GLP-1激动剂)药物,用于治疗2型糖尿病。它属于肠降血糖素模拟物,由Amylin Pharmaceuticals生产。
毒蜥外泌肽-4是在毒蜥蜥蜴(Gila Monster)唾液腺中生产的39个残基的多肽(Goke等人(1993)Diabetes 46:433-439;Fehmann等人(1995)Endocrine Rev.16:390-410)。虽然它是一种独特的非哺乳动物基因的产物,并且似乎仅由唾液腺表达,但是毒蜥外泌肽-4与GLP-1享有52%氨基酸序列同源性,且在哺乳动物中与GLP-1受体相互作用(Goke等人;Thorens等人(1993)Diabetes 42:1678-1682)。
术语“FGF21-相关病症”、“GLP-1-相关病症”、“毒蜥外泌肽-4-相关病症”和本文类似使用的术语包括了肥胖、1型和2型糖尿病、胰腺炎、血脂异常、非醇型脂肪肝病(NAFLD)、非醇型脂肪性肝炎(NASH)、胰岛素耐受、高胰岛素血症、葡萄糖不耐受、高血糖、代谢综合征、急性心肌梗塞、高血压、心血管病、动脉粥样硬化、外周动脉病、中风、心脏衰竭、冠心病、肾病、糖尿病并发症、神经病、胃轻瘫、与胰岛素受体的严重失活突变相关的病症、包括HIV相关性脂肪营养不良在内的脂肪营养不良和其他的代谢病症。
术语“与胰岛素受体中的严重失活性突变相关的病症”和本文类似使用的术语描述了患有胰岛素受体(或其直接下游的可能的蛋白质)突变的对象中的病况,所述突变导致了严重的胰岛素耐受,但通常(并非一直)没有2型糖尿病中常见的肥胖。在许多方面,患有这些病况的对象表现出1型糖尿病和2型糖尿病的杂合症状。因而受累对象按基本递增的严重程度分为若干类别,包括:A型糖尿病抗性、C型胰岛素抗性(AKA HAIR-AN综合征)、Rabson-Mendenhall综合征,最后是Donohue氏综合征或矮怪病(Leprechaunism)。这些病症与非常高的内源性胰岛素水平相关,和非常常见的与高血糖相关。因而受累对象还存在多种与“胰岛素毒性”相关的临床特征,包括雄激素过多、多囊卵巢综合征(PCOS)、多毛症和在皮肤褶皱中的黑棘皮病(过度的生长和色素沉积)。
“包括HIV相关性脂肪营养不良的脂肪营养不良”,是脂肪组织的病症,其特征是选择性的丢失体脂。脂肪营养不良的患者具有出现胰岛素抗性、高胰岛素血症、高血糖、高甘油三酯血症和脂肪肝的倾向。存在多种形式的先天性(遗传的)或获得性的脂肪营养不良。遗传形式的脂肪营养不良包括先天性全身脂肪营养不良(Berardinelli-Seip综合征)和若干种类型的家族性部分脂肪营养不良(Dunnigan型、Kobberling型、下颌骨末端发育不良型)。获得性形式的脂肪营养不良包括获得性全身脂肪营养不良(Lawrence综合征)、获得性部分脂肪营养不良(Barraquer-Simons综合征),和由用于治疗HIV的蛋白酶抑制剂和核苷逆转录酶抑制剂导致的脂肪营养不良。
“2型糖尿病”是这样的病况,其特征是无视胰岛素的可利用度的葡萄糖过度生产,并且由于不充分的葡萄糖清除导致循环葡萄糖水平仍然非常高。
“1型糖尿病”是这样的病况,其特征是由总体缺少的胰岛素导致的高血糖水平。是当身体的免疫系统攻击胰腺中的胰岛素生产β细胞并破坏这些细胞时发生的。于是胰腺生产很少或不生产胰岛素。
“葡萄糖不耐受”或受损的糖耐受(IGT)是血糖代谢障碍的前糖尿病状态,与增加的心血管病理风险相关。前糖尿病病况阻止对象将葡萄糖有效率地移入细胞并利用葡萄糖作为有效率的燃料来源,导致血液中升高的葡萄糖水平和一定程度的胰岛素耐受。
“高血糖症”定义为血液中过多的糖(葡萄糖)。
“低血糖症”也被称为低血糖,当血糖水平降至太低而不能提供身体活动足够的能源时发生。
“高胰岛素血症”定义为血液中高于正常水平的胰岛素。
“胰岛素耐受”定义为这样的状态,其中,正常量的胰岛素产生了低于正常的生物学应答。
“肥胖”就人类对象而言,可定义为体重比给定群体的理想体重高出20%(R.H.Williams,Textbook of Endocrinology,1974,904-916页)。
“糖尿病并发症”是由高血糖水平和其他的身体功能(如肾、神经(神经病)、足(足部溃疡和循环低下)和眼(例如,视网膜病))导致的问题。糖尿病还增加心脏病和骨和关节病症的风险。糖尿病的其他长期并发症包括皮肤问题、消化问题、性功能障碍和牙齿与牙龈的问题。
“代谢综合征”可定义为下列信号中的至少3个的群:腹部肥胖--大部分男性中,40英寸腰或更粗;高血糖--空腹后至少110毫克/分升(mg/dl);高甘油三酯--血流中至少150mg/dL;低HDL--少于40mg/dl;130/85mmHg或更高的血压。
“胰腺炎”是胰腺的炎症。
“血脂异常”是脂蛋白代谢的病症,包括脂蛋白过度生产或缺陷。血脂异常可以表现为血液中的总胆固醇、低密度脂蛋白(LDL)胆固醇和甘油三酯浓度的升高,和高密度脂蛋白(HDL)胆固醇浓度的减少。
“非醇型脂肪肝病(NAFLD)”是与醇消耗无关的肝病,其特征是肝细胞的脂肪改变。
“非醇型脂肪性肝炎(NASH)”是与醇消耗无关的肝病,其特征是肝细胞的脂肪改变,伴随小叶内炎症和纤维化。
“高血压”或高血液压力是全身动脉血压暂时或持续升高至可能导致心血管损害或其他不利结果的水平。高血压可人为定义为高于140mmHg的收缩压或高于90mmHg的舒张压。
“心血管疾病”是涉及心脏或血管的疾病。
“急性心肌梗塞”当在对部分心脏的血液供应中断时发生。如果在足够长的时间内没有治疗所导致的缺血和缺氧,可以导致心脏肌肉组织(心肌)的损害或死亡(梗塞)。
“外周动脉病”当在将血液携带给头部、内脏或四肢的动脉中斑块增多时发生。斑块可以随时间变硬,使动脉变窄,这限制富氧血流向器官和身体的其他部分。
“动脉粥样硬化”是血管病,其特征是在大型和中型动脉的内膜上不规则分布的脂类沉积物,导致动脉管腔变窄,并最终发展为纤维化和钙化。病损通常是病灶性的,并缓慢且间歇地发展。血流受限是大部分临床表现的原因,但临床表现随病损的分布和严重程度改变。
“中风”是与持续超过24小时的脑循环损伤相关的任何急性临床事件。中风涉及不可逆的脑损害,症状的类型和严重程度取决于循环已经受损的脑组织的位置和范围。
“心力衰竭”,也被称为阻塞性心力衰竭,是心脏不再泵送充足的血液至身体其余部分的病症。
“冠心病”,也被称为冠状动脉病,是为心脏供应血液和氧气的小血管变窄。
“肾脏病”或肾病是肾脏的任何疾病。糖尿病性肾病是1型或2型糖尿病人的发病率和死亡率的主要原因。
“神经病”是任何涉及脑神经或外周或自主神经系统的疾病。
“胃轻瘫”是胃蠕动减弱,导致延迟的肠排空。
“点击化学(Click chemistry)”是由K.B.Sharpless在2001年引入的术语,描述了高产率、范围广、仅产生可以不用色谱去除的副产物的反应,所述反应是立体异构特异性的、易于实施,且可以在易于去除的或良性溶剂中进行。
本发明涵盖的危重患者一般经历着不稳定的高代谢状态。该不稳定的代谢状态是由于底物代谢改变造成的,这可导致一些营养物的相对缺乏。一般而言,脂肪和肌肉都存在增加的氧化作用。
此外,危重患者优选是经历全身性炎性应答综合征或呼吸窘迫的患者。发病率降低意指危重患者出现其他疾病、病况或症状的可能性降低,或者其他疾病、病况或症状的严重程度降低。例如,降低的发病率可对应于减少的细菌血症或败血症或与多器官衰竭相关的并发症发生。
如本文使用的,除非上下文中另外明确指出,否则单数形式“a”、“an”和“the”包括了复数的指代。因此,例如,“抗体”的称呼包括了两个或多个这类抗体的混合物。
如本文使用的,术语“约”指数值的+/-20%,更优选+/-10%,或仍然更优选+/-5%。
术语“多肽”和“蛋白质”是可互换使用的,指任何长度的氨基酸的聚合形式,可以包括编码和非编码的氨基酸、天然和非天然存在的氨基酸、化学或生物化学修饰的或衍生的氨基酸,和具有修饰的肽骨架的多肽。术语包括融合蛋白,包括但不限于具有异源氨基酸序列的融合蛋白、具有异源和同源前导序列的融合物、有或无N-末端甲硫氨酸残基;免疫标记的蛋白质等。
术语“个体”、“对象”、“宿主”和“患者”可互换的使用,指任何需要诊断、治疗或疗法的对象,特别是人。其他对象可包括牛、狗、猫、豚鼠、兔、大鼠、小鼠、马等。在一些优选的实施方案中,对象是人。
如本文使用的,术语“样品”指来自患者的生物学材料。本发明测定的样品不限于任何特定的类型。作为非限制性的例子,样品包括单细胞、多细胞、组织、肿瘤、生物体液、生物分子,或任何上述材料的上清液或提取物。例子包括从活组织检查移出的组织、在切除中移出的组织、血液、尿液、淋巴组织、淋巴液、脑脊液、粘液和粪便样品。使用的样品一般根据测定模式、检测方法和待测定的肿瘤、组织、细胞或提取物的性质而改变。用于制备样品的方法是本领域普遍已知的,可以方便地调整从而获得与所用方法相容的样品。
如本文使用的,术语“生物学分子”包括但不限于多肽、核酸和糖类。
如本文使用的,术语“调节”指基因、蛋白质或位于细胞内侧、外侧或表面上的任何分子的质量或数量的改变。改变可以是分子的表达或水平的增加或减少。术语“调节”还包括改变生物学功能/活性的质量或数量,所述生物学功能/活性包括但不限于降低血糖、胰岛素、甘油三酯或胆固醇水平;降低肝脏的脂类或肝脏甘油三酯的水平;减少体重;改善糖耐受、能量消耗或胰岛素敏感性的能力。
如本文使用的,术语“调节剂”指调节一个或多个与FGF21相关性疾病(如1型或2型糖尿病或代谢病况(如肥胖))相关的生理学或生物化学事件的组合物。所述事件包括但不限于降低血糖、胰岛素、甘油三酯或胆固醇水平;降低肝脏的脂类或肝脏甘油三酯的水平;减少体重;改善糖耐受、能量消耗或胰岛素敏感性的能力。
“基因产物”是由基因表达或产生的生物聚合产物。基因产物可以是例如未剪切的RNA、mRNA、mRNA剪切变体、多肽、翻译后修饰的多肽、剪切变体多肽等。该术语还涵盖了使用RNA基因产物作为模板生产的生物聚合产物(即,RNA的cDNA)。基因产物可以酶促的、重组的、化学的生产,或者在对该基因而言是天然的细胞内生产。在一些实施方案中,如果基因产物是蛋白质性质的,则其表现出生物学活性。在一些实施方案中,如果基因产物是核酸,则其可翻译成表现出生物学活性的蛋白质性质的基因产物。
如本文使用的,“调节FGF21活性”、“调节GLP-1活性”和“调节毒蜥外泌肽-4活性”分别指FGF21、GLP-1或毒蜥外泌肽-4活性的增加或减少,其可以是例如活性剂与FGF21、GLP-1或毒蜥外泌肽-4多核苷酸或多肽相互作用、抑制FGF21、GLP-1或毒蜥外泌肽-4转录和/或翻译(例如,通过与FGF21、GLP-1或毒蜥外泌肽-4基因,或与FGF21、GLP-1或毒蜥外泌肽-4转录物的反义或siRNA相互作用,通过调节促进FGF21、GLP-1或毒蜥外泌肽-4表达的转录因子)等的结果。例如,调节生物学活性指生物学活性的增加或减少。可以通过以下手段评估FGF21、GLP-1或毒蜥外泌肽-4活性,包括但不限于测定对象的血糖、胰岛素、甘油三酯或胆固醇水平,评估FGF21、GLP-1或毒蜥外泌肽-4多肽水平,或通过评估FGF21、GLP-1或毒蜥外泌肽-4转录水平。
还可以通过例如测量FGF21、GLP-1或毒蜥外泌肽-4下游生物标志物的水平,和测量FGF21、GLP-1或毒蜥外泌肽-4信号传递的增加,实现FGF21、GLP-1或毒蜥外泌肽-4活性的比较。还可以通过测量:细胞信号传递;激酶活性;脂肪细胞中摄入的葡萄糖;血液胰岛素、甘油三酯或胆固醇水平的波动;肝脏脂类或甘油三酯水平的改变;FGF21、GLP-1或毒蜥外泌肽-4与受体之间的相互作用;或FGF21、GLP-1或毒蜥外泌肽-4受体的磷酸化,来评估FGF21、GLP-1或毒蜥外泌肽-4活性。在一些实施方案中,FGF21、GLP-1或毒蜥外泌肽-4受体的磷酸化可以是酪氨酸磷酸化。在一些实施方案中,调节FGF21、GLP-1或毒蜥外泌肽-4活性可以导致调节FGF21、GLP-1或毒蜥外泌肽-4-相关的表型。
如本文使用的,“FGF21、GLP-1或毒蜥外泌肽-4下游生物标志物”是基因或基因产物,或基因或基因产物的可测量标记。在一些实施方案中,是FGF21、GLP-1或毒蜥外泌肽-4的下游标志物的基因或活性表现出改变的表达水平。在一些实施方案中,在存在FGF21、GLP-1或毒蜥外泌肽-4调节剂的条件下,下游标志物的活性是改变的。在一些实施方案中,当用本发明的双功能蛋白质干扰FGF21、GLP-1或毒蜥外泌肽-4信号传递时,下游标志物表现出改变的表达水平。例如,FGF21下游标志物包括但不限于葡萄糖或2-脱氧葡萄糖摄取、pERK和其他磷酸化或乙酰化的蛋白质或NAD水平。
如本文使用的,术语“上调”指活性或数量的增加、激活或刺激。例如,FGF21、GLP-1或毒蜥外泌肽-4调节剂(如本发明的双功能蛋白质)可以增加或激动FGF21、GLP-1或毒蜥外泌肽-4受体的活性。在一个实施方案中,应答于本发明的双功能蛋白质,FGFR-1(IIIc)、FGFR-2(IIIc)或FGFR-3(IIIc)和/或β-klotho中的一个或多个可上调。上调还可以指FGF21、GLP-1或毒蜥外泌肽-4-相关的活性,例如降低血糖、胰岛素、甘油三酯或胆固醇水平;降低肝脏的脂类或甘油三酯水平;减少体重;或改善糖耐受、能量消耗或胰岛素敏感性;或导致FGF21、GLP-1或毒蜥外泌肽-4受体磷酸化;或增加FGF21、GLP-1或毒蜥外泌肽-4下游标志物的能力。例如,FGFR21受体可以是FGFR-1(IIIc),FGFR-2(IIIc)或FGFR-3(IIIc)和/或β-klotho中的一个或多个。相比对照,上调的范围可以是从25%至500%的任何。
如本文使用的,术语“N-末端”指蛋白质的至少前20个氨基酸。
如本文使用的,术语“N-末端结构域”和“N-末端区”可互换的使用,指从蛋白质的第一个氨基酸处开始并在蛋白质N-末端一半的任一氨基酸处结束的蛋白质片段。例如,FGF21的N-末端结构域是从SEQ ID NO:1的第一位氨基酸至SEQ ID NO:1的第10和105位氨基酸之间的任一氨基酸。
如本文使用的,术语“C-末端”指蛋白质的至少最后20个氨基酸。
如本文使用的,术语“C-末端结构域”和“C-末端区”可互换的使用,指从蛋白质C-末端一半的任一氨基酸处开始并在蛋白质的最后一个氨基酸处结束的蛋白质片段。例如,FGF21的C-末端结构域在从SEQ ID NO:1的第105和200位氨基酸之间的任一氨基酸处开始并在SEQ ID NO:1的第209位氨基酸处结束。
术语“结构域”在本文中指对生物分子的已知功能或疑似功能有贡献的生物分子的结构部分。结构域可以扩及区域或其部分,还可以并入全部或部分所述区域以外,不同于特定区域的生物分子的部分。
如本文使用的,术语“信号结构域”(也被称为“信号序列”或“信号肽”)指位于前体蛋白质(通常是膜结合的或分泌的蛋白质)的N-末端区的氨基酸序列的连续片段中的肽结构域,并参与翻译后蛋白质运输。在许多情况下,在完成分选过程后,通过专门的信号肽酶,从全长蛋白质中去除信号结构域。每个信号结构域指明了前体蛋白质在细胞中的特定目的地。FGF21的信号结构域是SEQ ID NO:1的第1-28位氨基酸。
如本文使用的,术语“受体结合结构域”指与膜结合型受体蛋白质接触的蛋白质的任何部分或区域,导致细胞应答,如信号传递事件。
如本文使用的,术语“配体结合结构域”指本发明的融合蛋白的任何部分或区域,所述部分或区域保留了相应天然序列的至少一个定性的结合活性。
术语“区域”指生物分子的初级结构的物理上连续的部分。在蛋白质的情况下,区域定义为该蛋白质的氨基酸序列的连续部分。在一些实施方案中,“区域”与生物分子的功能相关。
术语“片段”在本文中指生物分子的初级结构的物理上连续的部分。在蛋白质的情况下,部分定义为该蛋白质的氨基酸序列的连续部分并且指至少3-5个氨基酸,至少8-10个氨基酸,至少11-15个氨基酸,至少17-24个氨基酸,至少25-30个氨基酸,和至少30-45个氨基酸。在寡核苷酸的情况下,部分定义为该寡核苷酸的核酸序列的连续部分并且指至少9-15个核苷酸,至少18-30个核苷酸,至少33-45个核苷酸,至少48-72个核苷酸,至少75-90个核苷酸,和至少90-130个核苷酸。在一些实施方案中,生物分子的部分具有生物学活性。在本发明的上下文中,FGF21多肽片段不包含SEQ ID NO:1中所述的整个FGF21多肽序列。
“天然序列”多肽是具有与自然界来源的多肽相同的氨基酸序列的多肽。这类天然序列多肽可以从自然界分离,或者可以通过重组或合成的手段生产。因此,天然序列多肽可以具有天然存在的人多肽、鼠多肽或来自任何其他哺乳动物物种的多肽的氨基酸序列。
如本文使用的,词组“同源核苷酸序列”或“同源氨基酸序列”或其变化形式,指由至少指明的百分比的核苷酸水平或氨基酸水平的同源性表征的序列,并与“序列同一性”可互换的使用。同源核苷酸序列包括那些编码蛋白质同种型的序列。作为例如RNA的可变剪切的结果,这类同种型可以在同一生物体的不同组织中表达。可选的,同种型可以由不同的基因编码。同源核苷酸序列包括编码人以外的物种(包括,但不限于哺乳动物)的蛋白质的核苷酸序列。同源核苷酸序列还包括但不限于本文所示出的核苷酸序列的天然存在的等位改变和突变。同源氨基酸序列包括含有保守性氨基酸取代并且所述多肽具有相同的结合和/或活性的那些氨基酸序列。在一些实施方案中,如果与对比序列具有至少60%或更大的,最多99%的同一性,则核苷酸或氨基酸序列是同源的。在一些实施方案中,如果与对比序列享有一个或多个,最多60个核苷酸/氨基酸取代、添加或缺失,核苷酸或氨基酸序列是同源的。在一些实施方案中,同源氨基酸序列具有不超过5个或不超过3个保守的氨基酸取代。
可以通过例如Gap程序(Wisconsin序列Analysis Package,Version 8for UNIX,Genetics Computer Group,University Research Park,Madison WI)和使用默认设置,来确定百分比同源性或同一性,该程序使用Smith和Waterman算法(Adv.Appl.Math.,1981,2,482-489)。在一些实施方案中,探针和靶之间的同源性在约75%至约85%之间。在一些实施方案中,核酸具有与SEQ ID NO:2或其部分至少约95%,约97%,约98%,约99%和约100%同源的核苷酸。
同源性还可以在多肽水平。在一些实施方案中,本发明的双功能蛋白质的构件多肽可以与其全长野生型对应物或相应的天然序列、或其部分至少95%同源。本发明的双功能蛋白质或其部分和不同氨基酸序列的同一性程度或百分比计算为两条序列比对中准确匹配的数量除以“本发明序列”或“外源序列”的最短长度。结果表示为百分比同一性。
如本文使用的,术语“混合”指在相同区域中组合一个或多个化合物、细胞、分子等在一起的过程。这可以在例如允许一个或多个化合物、细胞、分子混合的试管、培养皿或任何容器中实施。
如本文使用的,术语“基本纯化的”指从其天然环境中移出且不含至少60%,至少75%,和至少90%的与其天然相关的其他组分的化合物(例如,多核苷酸或多肽或抗体)。
术语“可药用的运载体”指用于施用治疗剂,如抗体或多肽、基因和其他治疗剂的运载体。术语指任何本身不导致产生对接受组合物的个体有害的抗体的药学运载体,且可以施用而没有不过度的毒性。合适的载体可以是大的、代谢缓慢的大分子,如蛋白质、多糖、多聚乳酸、多聚甘油酸、多聚氨基酸、氨基酸共聚物、脂类聚集物和失活的病毒颗粒。这类运载体是本领域普通技术人员普遍已知的。治疗组合物中的可药用的运载体可包括液体,如水、生理盐水、甘油和乙醇。这类运载体中也可以存在辅助物质,如湿润剂或乳化剂、pH缓冲物质等。
由半胱氨酸残基提供的天然存在的二硫键一般地增加了蛋白质的热动力学稳定性。按融解温度增加测量的,增加的热动力学稳定性的成功例子是酶T4溶菌酶(Matsumura等人,PNAS 86:6562-6566(1989))和芽孢杆菌RNA酶(barnase)(Johnson等人,J.Mol.Biol.268:198-208(1997))的多个二硫键突变体。本发明的一个方面是在存在防腐剂的条件下FGF21的增强的物理稳定性,这是由变体中存在的二硫键实现的,所述二硫键限制了野生型FGF21的灵活性从而限制了防腐剂接近蛋白质的疏水核心。由于变体中存在的二硫键的本发明蛋白质的FGF21的物理稳定性的增强,可以赋予所述蛋白质额外的保护作用,不论是否存在防腐剂,包括但不限于保护其免受环境条件的波动,如pH和温度。
本发明的双功能蛋白质相对于野生型蛋白质比较物及其组合的改善
本领域普遍已知,研发蛋白质药物的重要挑战是处理蛋白质的物理和化学不稳定性。当预计将蛋白质药物制剂用于多种用途时,该挑战甚至更明显,可注射制剂需要稳定的、浓缩的和保藏的溶液,同时保持有利的生物活性谱。文献中的野生型FGF21的生物物理特征确立了当浓缩的蛋白质溶液(>5mg/ml)暴露于胁迫条件(如高温或低pH)时,导致加快的缔合和聚集(即,低下的物理稳定性和生物制药特性)。FGF21的浓缩蛋白质溶液暴露于制药防腐剂(例如,间甲酚)也对物理稳定性具有负面影响。
因此,本发明的一个实施方案是在生理学和防腐制剂条件下,增强浓缩溶液的物理稳定性,同时维持化学稳定性和生物学效价。认为缔合和聚集可能是由疏水性相互作用导致的,因为在给定的蛋白质浓度,温度和离子强度对物理稳定性具有可观的影响。
就大部分情况而言,靶向非保守的、假定的表面暴露的氨基酸残基。分析这些残基的局部环境,并选择在结构上被视为不重要的那些进行诱变。一种开始特异性改变的方法是通过导入谷氨酸残基进一步降低蛋白质的pI(“谷氨酸扫描”)。带电的取代基的导入可以通过电荷-电荷排斥作用抑制疏水介导的聚集,并潜在的改善防腐剂相容性。此外,本领域技术人员还将认识到,在充分诱变的条件下,通过导入正电荷,有或没有同时减少负电荷,可以将pI改变到碱性pH范围内,从而允许电荷-电荷排斥作用。
与野生型FGF21作为生物治疗剂的治疗性应用相关的其他困难是例如其体内半寿期非常短(在小鼠和灵长类中,分别在0.5和2h的量级)。因此需要研发通过更高效价或更长半寿期而更有效的后续化合物。类似的,通过使用毒蜥外泌肽-4或抵抗DPP4切割的其他类似物,以及用于延长化合物的半寿期或减慢化合物释放的其他修饰和制剂,已应用了多种机制来增强GLP-1的血清半寿期(1-2分钟,由于内源性蛋白酶,特别是二肽肽酶-4(DPP4)的快速切割)。
作为这样的方式研发本发明的蛋白质,例如本发明的双重FGF21受体激动剂和GLP-1受体激动剂蛋白质,所述方式以更高的效价和半寿期延长的制剂实现FGF21和GLP-1治疗的理想效果。文献中,例如在专利公开WO2010/068735和WO2009/020802中已描述了共同施用GLP-1和FGF21,数据提示了共同施用GLP-1和FGF21用于治疗肥胖和2型糖尿病的累加或协同效应。然而,两种受体激动剂在单个分子中的共定位,例如以本发明蛋白质的形式,让GLP-1和FGF21更好地接近组织或细胞,并提供了与作为单独的实体简单共同施用相比增加的好处。将两种激动剂组合成单个分子比简单共同施用每种激动剂的这一优点尤其有利于在同一组织中GLP-1和FGF21受体都表达的组织,如脂肪组织、胰腺β-细胞、肝细胞和下丘脑细胞。由于改变的受体运输、改变的信号传导效应和/或熵(亲合力)效应,本发明的双重FGF21受体激动剂和GLP-1受体激动剂蛋白质和其他单个的双活性实体具有改善的生物学特性。
因为FGF21和GLP-1(或毒蜥外泌肽-4)通过不同的机制发挥作用,因此预期当以例如本发明的双功能蛋白质的形式同时施用时,其具有累加或协同效应。GLP-1和毒蜥外泌肽-4主要作用于增加响应食物摄入的胰岛素分泌,同时FGF21使身体敏化以更好应答胰岛素,可以为1型和2型糖尿病提供管理血糖水平的益处。与改善的β细胞功能和胰岛素灵敏度组合的β细胞保护效应即使在1型糖尿病中也有提供益处的潜力。
另一个例子是体重丢失:预期通过GLP-1或毒蜥外泌肽-4的饱食信号和减慢的胃排空将减少胃口,同时FGF21增加了脂肪组织和其他组织中的代谢,这可以增加脂肪丢失。使用组合给药,这两个效应可以导致累加的、或者甚至协同的体重丢失。在代谢活跃的组织中FGF21和GLP-1的受体的表达提示了向这类组织同时递送FGF21受体激动剂和GLP-1受体激动剂对治疗代谢疾病是有益的。GLP-1和毒蜥外泌肽-4的心脏保护效应和用FGF21可见的改善的脂类谱的组合也可以在与肥胖、2型和1型糖尿病相关的心血管疾病中导致累加益处。
GLP-1和FGF21双重激动作用的另一个可能的益处是改善的,即,降低的负面效应谱。近期的研究(Wei等人(2012)PNAS 109,3143-48)表示,用FGF21治疗膳食诱导的肥胖小鼠导致了由于减退的PPARγ失活的骨丢失(通过降低的SUMO化作用);在FGF21治疗后,在骨中存在增加的PPARγ活性的条件下,可观察到充质干细胞从向成骨细胞分化转变为向脂肪细胞分化。然而,还已经报道了(Sanz等人(2010)Am J Physiol Endocrinol Metab 298,E634-E643)GLP-1可以通过降低PPARγ的表达,降低人充质干细胞向脂肪细胞分化。因此,GLP-1具有骨保护性的潜力,GLP-1-FGF21融合蛋白可能比仅用FGF21治疗降低骨丢失的风险。
虽然本发明的实施方案涉及在生理学和保藏的药物制剂条件下的物理和化学稳定性,保持本发明的蛋白质与例如野生型FGF21相比的生物学效价也是重要的考虑因素。因此,本发明的蛋白质的生物学效价由蛋白质影响葡萄糖摄取和/或降低血浆葡萄糖水平的能力定义,如本文实施例中所示。
可以通过本领域已知的任何手段生成和/或分离根据本发明施用的本发明的蛋白质、多肽和/或肽。用于生产变体的最优选的方法是通过重组DNA方法,且是本领域技术人员普遍已知的。这类方法描述在Molecular Biology的Current Protocols中(John Wiley&Sons,Inc.),其通过引用整合到本文中。
此外,优选的实施方案包括源自本文所述变体的生物学活性肽。这类肽将含有所述取代中的至少一个,且变体将具有生物学活性。可以由本领域技术人员已知的任何和所有手段生产肽,其例子包括但不限于酶促消化、化学合成或重组DNA方法。
本领域已确立某些成纤维细胞生长因子的肽的片段是生物学活性的。参见例如Baird等人,Proc.Natl.Acad.Sci(USA)85:2324-2328(1988)和J.Cell.Phys.Suppl.5:101-106(1987)。因此,对变体的片段或肽的选择是基于本领域已知的标准的。例如,已知二肽肽酶IV(DPP-IV或DPP-4)是丝氨酸型蛋白酶,参与神经肽、内分泌肽和细胞因子的失活(Damme等人Chem.Immunol.72:42-56,(1999))。FGF21的N-末端(HisProIlePro)含有可以潜在地是DPP-IV的底物的2个二肽,导致在N-末端截短4个氨基酸的FGF21片段。预料不到的是,野生型FGF21的这一片段被证实保留了生物学活性,因此,在N-末端截短至多4个氨基酸的本发明的蛋白质是本发明的一个实施方案。
本发明还涵盖了编码上述变体的多核苷酸,可以是RNA的形式或DNA的形式,所述DNA包括cDNA、基因组DNA和合成DNA。DNA可以是双链的或单链的。编码本发明的蛋白质的编码序列可以作为遗传密码冗余性或简并性的结果而改变。
编码本发明的蛋白质的多核苷酸可包括下列:仅变体的编码序列、变体的编码序列和额外的编码序列,如功能性多肽,或前导序列或分泌序列或原蛋白质序列;变体的编码序列和非编码序列,如内含子或变体的编码序列的5’和/或3’非编码序列。因此,术语“编码变体的多核苷酸”涵盖了这样的多核苷酸,其不仅可包括变体的编码序列,还包括包含额外的编码和/或非编码序列的多核苷酸。
本发明还涉及所述编码含有提示的取代的肽的片段、类似物和衍生物的多核苷酸的变体。多核苷酸的变体可以是人FGF21序列的天然存在的等位变体、上述非天然存在的变体,或截短的变体。因此,本发明还包括编码上述变体的多核苷酸,以及这类多核苷酸的变体,所述变体编码公开的变体的片段、衍生物或类似物。这类核苷酸变体包括缺失变体、取代变体、截短的变体,和添加或插入变体,只要存在第一或第二实施方案的提示的氨基酸取代中的至少一种。
在将序列与表达控制序列有效连接后(即,放置在确保功能的位置上),可在宿主中表达本发明的多核苷酸。这些表达载体通常在宿主生物体中是可复制的,是作为附加体或作为宿主染色体DNA的整合部分。通常,表达载体将含有选择标志物,例如四环素、新霉素和二氢叶酸还原酶,来允许检测用想要的DNA序列转化的细胞。双功能蛋白质或其片段可以在恰当的启动子控制下,在哺乳动物细胞、昆虫、酵母、细菌或其他细胞中表达。也可以应用无细胞翻译系统生产这类蛋白质,使用源自本发明的DNA构建体的RNA。
大肠杆菌是克隆本发明的多核苷酸的特别有用的原核宿主。其他适合使用的微生物宿主包括枯草芽孢杆菌(Bacillus subtilus)、鼠伤寒沙门氏菌(Salmonella typhimurium)、和沙雷氏菌属(Serratia)、假单胞菌属(Pseudomonas)、链球菌属(Streptococcus)和葡萄球菌属(Staphylococcus)的多个物种,但其他也可以用作选择对象。在这些原核宿主中,还可以制备通常含有与宿主细胞相容的表达控制序列(例如,复制起点)的表达载体。此外,可以存在多种普遍已知的启动子中的任一种,如乳糖启动子系统、色氨酸(Trp)启动子系统、β-内酰胺酶启动子系统或来自噬菌体λ或T7的启动子系统。启动子,任选地与操纵子序列,通常控制表达,并且具有核糖体结合位点序列等,用于起始和完成转录和翻译。
蛋白质表达领域的技术人员将认识到,甲硫氨酸或甲硫氨酸-精氨酸序列可以在成熟序列(SEQ ID NO:3)的N-末端导入用于在大肠杆菌中表达,并考虑落入本发明的范围内。因此,除非另外指出,否则在大肠杆菌中表达的本发明的蛋白质在N-末端具有导入的甲硫氨酸序列。
其他微生物,如酵母或真菌,也可用于表达。巴斯德毕赤酵母(Pichia pastoris)、酿酒酵母(Saccharomyces cerevisiae)、粟酒裂殖酵母(Schizosaccharomyces pombe)和安格斯毕赤酵母(Pichia angusta)是优选的酵母宿主的例子,其含有具有表达控制序列(如启动子),需要时包括3-磷酸甘油酸激酶或其他糖分解酶,复制起点、终止序列等的合适载体。黑曲霉(Aspergillus niger)、里氏木霉(Trichoderma reesei);和裂褶菌(Schizophyllum commune)是真菌宿主的例子,但也可以应用其他菌作为选择对象。
还可以使用哺乳动物组织细胞培养表达和生产本发明的多肽。真核细胞实际上是优选的,因为现有技术已经研发了多种能够分泌完整的变体的合适的宿主细胞系,包括CHO细胞系、多种COS细胞系、NSO细胞、叙利亚仓鼠卵巢细胞系、HeLa细胞或人胚肾细胞系(即,HEK293、HEK293EBNA)。
用于这些细胞的表达载体可包括表达控制序列,如复制起点、启动子、增强子和必要的加工信息位点,如核糖体结合位点、RNA剪切位点、多聚腺苷酸化位点,和转录终止子序列。优选的表达控制序列是源自SV40、腺病毒、牛乳头瘤病毒、巨细胞病毒、劳氏肉瘤病毒等的启动子。优选的多聚腺苷酸化位点包括源自SV40和牛生长激素的序列。
可以将含有目标多核苷酸序列(例如,本发明的蛋白质和表达控制序列)的载体通过普遍已知的方法转移到宿主细胞中,所述方法取决于细胞宿主的类型。例如,氯化钙转染是通常用于真核细胞的,而磷酸钙处理或电穿孔则可用于其他细胞宿主。
可以使用多种蛋白质纯化的方法,这类方法是本领域已知的,描述在例如Deutscher,Methods in Enzymology 182:83-9(1990)和Scopes,Protein Purification:Principles and Practice,Springer-Verlag,NY(1982)。选择的纯化步骤将取决于例如用于本发明的蛋白质的生产过程的性质。
本发明的蛋白质、多肽和/或肽,例如本发明的双活性融合蛋白,应该以与良好的医学实践一致的方式配制和给药,考虑患者的临床病况、递送蛋白质组合物的位点、施用方法、施用的计划,和实践人员已知的其他因素。因此,通过这类考虑确定用于本文目的的本发明蛋白质的“治疗有效量”。
可以通过实现一般预期目的:治疗1型和2型糖尿病、肥胖、代谢综合征或危重患者的任何手段,施用本发明的蛋白质的药物组合物。非限制性的可允许的施用手段包括例如,通过吸入或栓剂或例如通过灌洗阴道、直肠、尿道、口腔和舌下组织,口腔、鼻、局部、鼻内、腹膜内、不经肠道、静脉内、肌肉内、胸骨内、通过关节内注射,淋巴管内、间质、动脉内、皮下、滑膜内、经上皮和经皮向粘膜组织施用。在一些实施方案中,通过灌洗、口腔或动脉内施用药物组合物。其他合适的导入方法还可以包括可充电的或可生物降解的装置,和缓释或持续释放的聚合物装置。本发明的药物组合物还可以作为与其他已知代谢剂的组合疗法的一部分施用。
施用剂量取决于接受者的年龄、健康和体重、同步治疗的种类(如果有的话)、治疗的频率,和理想效应的性质。本发明范围内的组合物包括所有其中存在FGF21变体的组合物,所述FGF21变体的量有效实现了治疗1型或2型糖尿病、肥胖或代谢综合征的理想医学效果。虽然个体需求在每个患者中不同,确定所有组分的有效量的最佳范围属于普通医生的能力范围内。
可以根据已知方法配制本发明的蛋白质,以制备制药上有效的组合物。理想的制剂是可用高纯度的恰当稀释剂或水性溶液重建的稳定的冻干产物,任选地具有可药用的运载体、防腐剂、赋形剂或稳定剂(Remington’s Pharmaceutical Sciences第16版(1980))。可以组合本发明的蛋白质与可药用的缓冲剂,并且调节pH以提供可接受的稳定性和对于施用而言可接受的pH。
对于不经肠道的施用,在一个实施方案中,一般如下配制本发明的蛋白质:在可注射形式(溶液、悬浮液或乳化液)的单位剂量中,以理想的纯度混合一种或多种所述蛋白质与可药用的运载体,即,在所应用的剂量和浓度下对接受者无毒且与制剂的其他成分相容的运载体。优选的,可以添加一种或多种可药用的抗微生物剂。苯酚、间甲酚和苯甲醇是优选的可药用的抗微生物剂。
任选的,可以添加一种或多种可药用的盐以调节离子强度或渗透压。可以添加一种或多种赋形剂以进一步调节制剂的等渗性。甘油、氯化钠和甘露醇是等渗性调节赋形剂的例子。
本领域技术人员可以容易地优化用于包含本发明的蛋白质的治疗组合物的制药上有效的剂量和施用方案,如由良好医学实践和个体患者的临床病况所确定。本发明蛋白质的典型剂量范围是成人从约0.01mg/天至约1000mg/天(或约0.05mg/周至约5000mg/周,每周施用1次)。优选的,剂量范围是从约0.1mg/天至约100mg/天(或约0.5mg/周至约500mg/周,每周施用1次),更优选从约1.0mg/天至约10mg/天(或约5mg/周至约50mg/周,每周施用1次)。最优选的,剂量是约1-5mg/天(或约5mg/周至约25mg/周,每周施用1次)。施用的FGF21变体的恰当剂量将导致降低的血糖水平,增加空腹的能量消耗和更有效的葡萄糖利用,因而可用于治疗1型或2型糖尿病、肥胖和代谢综合征。
此外,由于在使用营养支持的危重患者中常见高血糖和胰岛素抗性,一些重症监护病房(ICU)施用胰岛素,来治疗饲喂的危重患者的过高的高血糖。事实上,近期研究记载了使用外源性胰岛素维持血糖在不超过110mg/分升的水平降低了手术重症监护病房中的危重患者的发病率和死亡率,不论所述患者是否具有糖尿病史(Van den Berghe等人N Engl J Med.,345(19):1359,(2001))。因而,本发明的蛋白质是独特地适合帮助恢复代谢不稳定的危重患者中的代谢稳定性的。本发明的蛋白质(如含有FGF21变体的蛋白质)是独特的,在于其刺激葡萄糖摄取并增强胰岛素灵敏度,且不诱导高血糖。
在本发明的另一个方面,考虑使用本发明的蛋白质作为药物,用于治疗肥胖、1型和2型糖尿病、胰腺炎、血脂异常、非醇型脂肪肝病(NAFLD)、非醇型脂肪性肝炎(NASH)、胰岛素耐受、高胰岛素血症、葡萄糖不耐受、高血糖、代谢综合征、急性心肌梗塞、与胰岛素受体的严重失活突变相关的病况、包括HIV相关性脂肪营养不良在内的脂肪营养不良和其他代谢病症。
目前已经详细的描述了本发明,但参考下列实施例将更明确的理解本发明,所述实施例仅出于示例的目的才包括在本文中,而并非意在限制本发明。
除非另外指出,否则本发明的实践将应用本领域技术人员已知的常规的化学、生物化学、分子生物学、免疫学和药理学方法。文献中更全面的解释了这类技术。参见例如,Remington’s Pharmaceutical Sciences,第18版(Easton,Pennsylvania:Mack Publishing Company,1990);Methods In Enzymology(S.Colowick和N.Kaplan编著,Academic Press,Inc.);和Handbook of Experimental Immunology,第I-IV卷(D.M.Weir和C.C.Blackwell编著,1986,Blackwell Scientific Publications);和Sambrook等人,Molecular Cloning:A Laboratory Manual(第2版,1989)。
位点特异性FGF21突变体
在一些实施方案中,本发明的融合蛋白包括GLP-1或毒蜥外泌肽-4的额外的突变体、GLP-1/胰高血糖素杂交肽、具有非天然氨基酸(赋予DPP-4抗性,用于PEG化或其他目的)的GLP-1类似物。
在一些实施方案中,本发明的蛋白质包含具有野生型FGF21的一个或多个下列额外修饰的的FGF21激动剂:
(i)额外的二硫键、非天然氨基酸或修饰以促进二聚化,如在R154C处形成二硫键,或在另一个位点导入半胱氨酸,或通过融合的Fc结构域二聚化,或通过交联剂(如双功能PEG)形成二聚体;
(ii)FGF21的片段;
(iii)选择的具有FGF21活性(与β-klotho结合,结合和激活FGFR)的蛋白质;和
(iv)FGF21模拟抗体(多种模式,如Fab、unibody、svFc等)。
在一些实施方案中,本发明的双活性蛋白质包含一个或多个下列接头:简单的酰胺键、短肽(特别是Ser/Gly重复)、FGF21翻译序列的额外残基,或多至完整蛋白质的较大接头(如Fc结构域、结合HAS的螺旋束,HSA等)。还可以通过其他化学手段连接两个部分,如通过非天然氨基酸或标准化学接头(马来酰亚胺-Cys、NHS-Lys、“点击化学”等)。用于FGF21模拟抗体方式的“接头”可包括已列举的那些,以及环中插入片段,其之后切割以释放GLP-1N-末端。
在一些实施方案中,本发明的融合蛋白包含在1、2或多个特异性位点发生的PEG化。在优选的实施方案中,PEG化发生在FGF21分子或接头中。在一些实施方案中,PEG化不在双功能蛋白质的N-末端的~10个氨基酸内,优选不在FGF21起点的~10个氨基酸内。PEG化连接化学可包括NHS-Lys、马来酰亚胺-Cys、非天然氨基酸(醛、“点击化学”、Pcl等),并可与合适的蛋白质变体组合以控制反应的化学计量。
本发明的融合蛋白的PEG基团可以是任何大小(例如,1、2、3、4、5、10、20、24、29、30、40kDa),且可以是线性的、分枝的或梳状的结构,优选总PEG化大于或等于40kDa。最佳的PEG化实现了使半寿期延长至足以进行每周1次给药。使用较短的PEG聚合物,蛋白质二聚体、三聚体、四聚体等的PEG化可以导致充分的血清半寿期延长。分枝的和梳状的PEG结构对较低的粘度而言是有益的。
用于本发明的融合蛋白的优选的半寿期延长方法包括在接头中掺入IgG Fc结构域或HAS,且可以不需要PEG化。此外,使用Fc结构域融合物可导致二聚体化,并且除延长半寿期外,还可导致增强的效价。
本发明的其他实施方案包括但不限于下列用于延长半寿期的连接:结合HAS的脂类或小分子或微团与融合物的单体或二聚体形态连接。
在本发明的某些实施方案中,可以对本发明的蛋白质、多肽和/或肽进行其他连接,实现延长半寿期和其他改良的生物学特性。可包括连接PEG-胆固醇缀合物(包括微团和脂质体)与本发明的蛋白质、多肽和/或肽,和/或连接糖类(糖基化)与本发明的蛋白质、多肽和/或肽。在仍然其他的实施方案中,应用类似的技术向蛋白质、多肽和/或肽添加缀合物,例如,多唾液酸(PSA)、羟乙基淀粉(HES)、白蛋白结合配体,或碳水化合物盾。
HES化技术通过还原性烷基化作用,例如偶联分枝的羟乙基淀粉(HES)链(60kDa或100kDa,来自玉米淀粉的高分枝的支链淀粉片段)与蛋白质、多肽和/或肽。多唾液酸化作用以与PEG化相似的方式用多唾液酸(PSA)缀合目标蛋白质、多肽和/或肽。PSA聚合物是天然存在于体内的带负电的、非免疫原性的聚合物,并且可以10-50kD的分子量获得。
在本发明的仍然其他的实施方案中,可以对本发明的蛋白质、多肽和/或肽进行其他连接或修饰,以实现延长半寿期和其他改善的生物学特性。这些包括生成重组PEG(rPEG)基团,及其与本发明的蛋白质、多肽和/或肽的连接。如公司Amunix,Inc.研发的。rPEG技术是基于具有PEG-样特性的蛋白质序列,所述序列在遗传上与生物药剂融合,避免了额外的化学缀合步骤。rPEG是半寿期延长的艾塞那肽构建体,其含有疏水性氨基酸的长的非结构性尾部,并且能够增加蛋白质或肽的血清半寿期并减慢其吸收速率,因此显著降低了峰-谷比。rPEG具有增加的水动力学半径,并且显示了是其实际分子量约15倍的表观分子量,模拟了PEG化实现长的血清半寿期的方式。XL-protein GmbH已经研发了用于蛋白质“PAS化”的类似重组多肽序列。
化学修饰的双功能蛋白质突变体
本领域技术人员可以参考本文所述的公开内容,制备本文所述的融合蛋白的化学修饰形式,包括例如本文所述的双功能融合蛋白的截短的和变体形式。改变这类化学修饰的双功能蛋白质,使得化学修饰的突变体在与突变体天然连接的分子的类型或位置上不同于未修饰的突变体。化学修饰的突变体可包括通过缺失一个或多个天然连接的化学基团而形成的分子。
在一个实施方案中,可以通过共价连接一个或多个聚合物,修饰本发明的蛋白质。例如,选择的聚合物通常是水溶性的,使得其连接的蛋白质在水性环境,如生理环境中不沉淀。包括在合适的聚合物的范围内的是聚合物的混合物。优选的,为了终产物制品的治疗用途,聚合物将是可药用的。与本发明的蛋白质缀合的不溶于水的聚合物也形成本发明的一个方面。
每种示例性聚合物可以是任何分子量,且可以是分枝的或不分枝的。每种聚合物通常具有在约2kDa至约100kDa之间的平均分子量(术语“约”表示,在水溶性聚合物的制品中,一些分子重于,而一些轻于所述分子量)。每种聚合物的平均分子量优选在约5kDa至约50kDa之间,更优选在约12kDa至约40kDa之间,最优选在约20kDa至约35kDa之间。
合适的水溶性聚合物或其混合物包括但不限于N-连接或O-连接的碳水化合物、糖、磷酸盐、聚乙二醇(PEG)(包括已经用于衍生蛋白质的PEG的形式,包括单-(C1-C10)、烷氧基,或芳氧基-聚乙二醇)、单甲氧基-聚乙二醇、葡聚糖(如低分子量葡聚糖,例如约6kD)、纤维素或基于其他碳水化合物的聚合物、聚-(N-乙烯吡咯烷酮)聚乙二醇、丙二醇同聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙基化的(polyoxyethlated)多元醇(例如,甘油)和聚乙烯醇。本发明还涵盖了可用于制备共价连接的双功能蛋白质变体多聚体的双功能交联分子。本发明还涵盖了与多唾液酸共价连接的双功能蛋白质变体。
在本发明的一些实施方案中,双功能蛋白质变体经共价或化学修饰以包括一个或多个水溶性聚合物,包括但不限于聚乙二醇(PEG)、聚氧乙二醇或聚丙二醇。参见例如美国专利号4,640,835;4,496,689;4,301,144;4,670,417;4,791,192和4,179,337。在本发明的一些实施方案中,双功能蛋白质包含一个或多个聚合物,包括但不限于单甲氧基-聚乙二醇、葡聚糖、纤维素、基于另一种碳水化合物的聚合物、聚-(N-乙烯吡咯烷酮)聚乙二醇、丙二醇同聚物、聚环氧丙烷/环氧乙烷共聚物聚氧乙基化的多元醇(例如,甘油)、聚乙烯醇,或这类聚合物的混合物。
在本发明的一些实施方案中,双功能蛋白质是用PEG亚基共价修饰的。在一些实施方案中,一个或多个水溶性聚合物与双功能蛋白质突变体的一个或多个特定位置(例如,N-末端)结合。在一些实施方案中,一个或多个水溶性聚合物与双功能蛋白质突变体的一个或多个侧链随机连接。在一些实施方案中,使用PEG改善双功能蛋白质突变体的治疗能力。某些这类方法公开在例如美国专利号6,133,426中,其出于任何目的通过引用整合到本文中。
在其中聚合物是PEG的本发明的实施方案中,PEG基团可以具有任何方便的分子量,并且可以是线性或分枝的。PEG基团的平均分子量的范围优选是从约2kD至约100kDa,更优选从约5kDa至约50kDa,例如10、20、30、40或50kDa。PEG基团一般通过经由PEG部分上的反应性基团(例如,醛基、氨基、巯基或酯基)与双功能蛋白质突变体上的反应基团(例如,醛基、氨基或酯基)的酰化作用或还原性烷基化作用与双功能蛋白质突变体连接。
分枝的PEG衍生物,也被称为“Y形”PEG衍生物,含有与中央核心连接的2条线性甲氧基PEG链。这类“Y形”PEG衍生物的立体主结构将促进修饰的分子的单点连接。作为例子,3种类型的“Y形”PEG衍生物是Y-NHS-40K(用于胺基PEG化);Y-MAL-40K(用于巯基PEG化);和Y-ALD-40K(例如,Y-AALD-40K和Y-PALD-40K)(用于N-末端PEG化)。对于胺基PEG化,“Y形”NHS酯将与赖氨酸的氨基或生物学活性分子的N-末端胺基反应,产生稳定的酰胺键。在pH 7-8.5,该NHS酯将与靶向的分子偶联。对于巯基PEG化,“Y形”马来酰亚胺将与生物学活性分子的巯基反应,生成稳定的3-巯基琥珀酰亚胺醚键。该马来酰亚胺将在存在其他官能团的条件下,在约pH 7.4与靶向的分子偶联。对于N-末端PEG化,“Y形”醛将在存在还原剂(如氰基硼氢化钠)的条件下,优选与生物学活性分子的N-末端胺基反应,产生稳定的胺键。该醛将在pH 5-8与靶向的分子的N-末端胺基偶联。用于实施分枝的PEG化的试剂可自例如JenKem Technology获得。
可以使用本领域已知的任何PEG化反应,特异性地进行多肽,包括本发明的蛋白质的PEG化。这类反应描述在例如下列文献中:Francis等人,1992,Focus on Growth Factors 3:4-10;欧洲专利号0 154 316和0 401 384;和美国专利号4,179,337。例如,可以通过与本文所述的反应性聚乙二醇分子(或类似的反应性水溶性聚合物)的酰化反应或烷基化反应,进行PEG化。对于酰化反应,选择的聚合物应具有单个反应性酯基。对于还原性烷基化,选择的聚合物应具有单个反应性醛基。反应性醛是例如水稳定性的聚乙二醇丙醛,或其单C1-C10烷氧基或芳氧基化衍生物(参见例如美国专利号5,252,714)。
在本发明的一些实施方案中,用于连接PEG基团与多肽的有效对策涉及通过在溶液中形成缀合物连接,组合肽和PEG部分,所述肽和PEG部分分别具有彼此相互反应的特定官能团。可以用常规的固相合成方便的制备肽。用恰当的官能团在特定位点“预活化”肽。纯化前体,并在与PEG部分反应前完全表征。肽和PEG的连接通常发生在水相中,并且可以通过逆相分析性HPLC方便的监控。可以通过制备性的HPLC方便的纯化PEG化肽,并通过分析性HPLC、氨基酸分析和激光吸附质谱表征。
多糖聚合物是可用于蛋白质修饰的另一类型的水溶性聚合物。因此,与多糖聚合物融合的本发明的蛋白质形成了本发明的实施方案。葡聚糖是包含主要通过α1-6键连接的单个葡萄糖亚基的多糖聚合物。葡聚糖本身可以多种分子量获得,并可以从约1kD至约70kD的分子量方便的获得。葡聚糖是本身适用作为载体或与另一种载体(例如Fc)组合的水溶性聚合物。参见例如国际公开号WO 96/11953。已报道了与治疗性或诊断性免疫球蛋白缀合的葡聚糖的用途。参见例如欧洲专利公开号0 315 456,其通过引用整合到本文中。本发明还涵盖了约1kD至约20kD的葡聚糖的用途。
一般而言,可以在任何适合反应蛋白质与活化的多聚物分子的条件下实施化学修饰。用于制备化学修饰的多肽的方法一般包括步骤:(a)在使得FGF21蛋白变体变得与一个或多个聚合物分子连接的条件下,使多肽与活化的聚合物分子(如聚合物分子的反应性酯类或醛类衍生物)反应,和(b)获得反应产物。基于已知的参数和理想的结果,确定最佳反应条件。例如,聚合物分子与蛋白质的比例越大,连接的聚合物分子的百分比就越大。在本发明的一个实施方案中,化学修饰的FGF21突变体可以在氨基末端具有单个聚合物分子部分(参见例如美国专利号5,234,784)。
在本发明的另一个实施方案中,本发明的蛋白质可以与生物素化学偶联。然后,本发明的生物素化的蛋白质允许与链霉亲和素结合,获得三价的链霉亲和素/生物素/本发明的蛋白质。本发明的蛋白质还可以与二硝基苯酚(DNP)或三硝基苯酚(TNP)共价偶联,并且用抗DNP或抗TNP-IgM沉淀得到的缀合物,以形成10价的十聚缀合物。
一般而言,可以通过施用本发明的化学修饰的双功能蛋白质突变体减轻或调节的病况包括本文所述的关于本发明的蛋白质的那些病况。然而,本文公开的化学修饰的双功能蛋白质突变体可具有额外的活性、增强的或降低的生物学活性或其他特征,如与未修饰的双功能蛋白质突变体相比增加的或减少的半寿期。
双功能蛋白质的治疗组合物及其施用
包含本发明的双功能蛋白质的治疗组合物落入本发明的范围内,且在例如表现出增强的特性的若干突变双功能蛋白质序列的鉴别中具体考虑。这类双功能蛋白质突变体药物组合物可包含治疗有效量的双功能蛋白质变体与制药上或生理上可接受的制剂活性剂的混合,根据与施用模式的适合性选择所述制剂活性剂。
在应用的剂量和浓度,可接受的制剂材料优选对受体是无毒的。
药物组合物可含有制剂材料,用于修饰、维持或保持例如组合物的pH、渗透压、粘度、清澈度、颜色、等渗性、气味、无菌、稳定性、溶解或释放速率、吸收或渗透。合适的制剂材料包括但不限于氨基酸(如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸)、抗微生物剂、抗氧化剂(如抗坏血酸、亚硫酸钠或亚硫酸氢钠)、缓冲剂(如硼酸盐、碳酸氢盐、Tris-HCl、柠檬酸盐、磷酸盐或其他有机酸)、填充剂(如甘露醇或甘氨酸)、螯合剂(如乙二胺四乙酸(EDTA))、络合剂(如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精)、填料、单糖、二糖和其他碳水化合物(如葡萄糖、甘露糖或糊精)、蛋白质(如血清白蛋白、明胶或免疫球蛋白)、着色剂、芳香剂和稀释剂、乳化剂、亲水性聚合物(如聚乙烯吡咯烷酮)、低分子量多肽、成盐的抗衡离子(如钠)、防腐剂(如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢)、溶剂(如甘油、丙二醇或聚乙二醇)、糖醇(如甘露糖醇或山梨糖醇)、悬浮剂、表面活性剂或湿润剂(如普朗尼克(pluronic);PEG;山梨糖酯;聚山梨醇酯类如聚山梨醇酯20或聚山梨醇酯80;triton;氨丁三醇;卵磷脂;胆固醇或tyloxapal)、稳定性增强剂(如蔗糖或山梨醇)、张力增强剂(如碱金属卤化物;优选氯化钠或氯化钾;或甘露醇山梨糖醇)、递送载体、稀释剂、赋形剂和/或药物佐剂(参见例如,Remington’s Pharmaceutical Sciences(第18版,A.R.Gennaro编著,Mack Publishing Company 1990)及其随后版,出于任何目的通过引用整合到本文中)。
熟练的技术人员可根据例如预期的施用途径、递送模式和理想剂量,确定最佳的药物组合物(参见例如,Remington’s Pharmaceutical Sciences,见上文)。这类组合物可以影响本发明的融合蛋白的物理状态、稳定性、体内释放速率和体内清除速率。
药物组合物中的主要载体或运载体本质上可以是水性的或非水性的。例如,用于注射的合适载体或运载体可以是水、生理盐溶液或人工脑脊液,可能补充了不经肠道施用的其他组合物中常见的材料。中性的缓冲生理盐水或与血清白蛋白混合的生理盐水是另一示例性的载体。其他示例性的药物组合物包含约pH 7.0-8.5的Tris缓冲剂,或约pH 4.0-5.5的醋酸缓冲剂,其还可包括山梨糖醇或合适的组分。在本发明的一个实施方案中,可以通过混合处于冻干的饼或水性溶液形式的具有理想纯度的选择的组合物与任选的制剂活性剂(Remington’s Pharmaceutical Sciences,见上文),制备双功能药物组合物用于储藏。此外,可以使用恰当的赋形剂(如蔗糖),将双功能蛋白质产物配制为冻干产物。
可以选择含有本发明的融合蛋白的药物组合物用于不经肠道的递送。备选的,可以选择组合物用于吸入,或用于通过消化道,如口腔递送。这类可药用的组合物的制备是本领域的常规技术。
制剂组分以施用位点可接受的浓度存在。例如,使用缓冲剂维持组合物处于生理学pH或略低的pH,通常在从约5至约8的pH范围内。
当考虑不经肠道的施用时,用于本发明的治疗性组合物可以是不含致热源的、肠道外可接受,水性溶液的形式,在可药用的运载体中包含理想的双功能蛋白质。用于不经肠道注射的特别合适的载体是无菌蒸馏水,其中双功能蛋白质被配制为无菌的等渗溶液,被正确的保藏。而另一种制品可以涉及理想的分子和活性剂的制剂,所述活性剂例如可注射的微球、可生物蚀解的颗粒、多聚化合物(如聚乳酸或聚乙醇酸)、珠或脂质体,所述活性剂提供产物的受控或持续的释放,然后通过积存注射剂递送所述产物。还可以使用透明质酸,其具有促进在循环中持续期的效果。用于导入理想分子的其他合适手段包括可植入的药物递送装置。
在一个实施方案中,可以配制用于吸入的药物组合物。例如,可以将本发明的双功能蛋白质配制为用于吸入的干燥粉末。也可以用推进剂配制双功能蛋白质的吸入溶液,用于气雾剂递送。在仍然另一个实施方案中,溶液可以是雾化的。国际公开号WO 94/20069中进一步描述了肺部施用,其描述了肺部递送化学修饰的蛋白质。
还考虑某些可以口服施用的制剂。在本发明的一个实施方案中,可以用或不用在混合固体剂型(如片剂和胶囊)中常规使用的运载体,配制以该方式施用的本发明的双功能蛋白质。例如,当使生物利用度最大化和使前全身性降解最小化时,可以设计胶囊以在胃肠道中的点释放制剂的活性部分。可以包括额外的活性剂以促进吸收本发明的双功能蛋白质。还可以应用稀释剂、风味剂、低熔点蜡、蔬菜油、润滑剂、悬浮剂、片剂崩解剂和粘合剂。
另一种药物组合物可以涉及有效量的本发明的蛋白质与适用于生产片剂的无毒的赋形剂的混合物。通过在无菌水或另一种恰当的载体中溶解片剂,可以制备单位剂型的溶液。合适的赋形剂包括但不限于惰性稀释剂,如碳酸钙、碳酸钠或碳酸氢钠、乳糖或磷酸钙;或结合剂,如淀粉、明胶或阿拉伯树胶;或润滑剂,如硬脂酸镁、硬脂酸或滑石。
包含本发明的双功能蛋白质的额外的药物组合物对本领域技术人员是明显的,包括涉及处于持续或受控递送制剂的本发明的双功能蛋白质的制剂。用于配制多种其他持续或受控递送工具的技术也是本领域技术人员已知的,如脂质体运载体、可生物蚀解的颗粒、或多孔珠和积存注射剂(参见例如,国际公开号WO 93/15722,其描述了用于递送药物组合物的多孔聚合物微颗粒的受控释放,和Wischke&Schwendeman,2008,Int.J Pharm.364:298-327,和Freiberg&Zhu,2004,Int.J Pharm.282:1-18,其讨论了微球/微颗粒制品及用途)。
缓释制品的额外的例子包括作为成型物件形式的半透性聚合物基质,例如膜或微胶囊。缓释基质可包括聚酯、水凝胶、聚丙交酯(美国专利号3,773,919和欧洲专利号0 058 481)、L-谷氨酸和γ乙基-L-谷氨酸的共聚物(Sidman等人,1983,Biopolymers 22:547-56)、聚(2-羟乙基-甲基丙烯酸酯)(Langer等人,1981,J.Biomed.Mater.Res.15:167-277和Langer,1982,Chem.Tech.12:98-105)、乙烯-醋酸乙烯(Langer等人,见上文)或聚-D-3-羟基丁酸(欧洲专利号0 133 988)。缓释组合物还可包括脂质体,其可以通过本领域已知的若干种方法的任一种制备。参见例如,Epstein等人,1985,Proc.Natl.Acad.Sci.U.S.A.82:3688-92;和欧洲专利号0 036 676、0 088 046和0 143 949。
用于体内施用的本发明药物组合物通常必须是无菌的。这可以通过无菌过滤膜过滤来实现。当冻干组合物时,可以在冻干和重建之前或之后进行利用该方法的灭菌。用于不经肠道施用的组合物可以以冻干的形式或溶液储藏。此外,不经肠道的组合物一般放在具有无菌入口的容器中,例如具有可被皮下注射针头穿刺的塞子的静脉输液袋或输液瓶。
一旦配制了药物组合物,则可以作为溶液、悬浮液、凝胶、乳剂、固体或作为脱水的或冻干的粉末储藏在无菌瓶中。这类制剂可以以即用形式,或者以需要在施用前重建的形式(例如冻干的)储藏。
在特定的实施方案中,本发明涉及用于生产单剂量施用单元的试剂盒。每个试剂盒可含有具有理想蛋白质的第一容器和具有水性制剂的第二容器。本发明的范围内还包括了含有单室和多室的预填装的注射器(例如,液体注射器和lyosyringe)的试剂盒。
双功能蛋白质的剂量及其施用
待应用的本发明的药物组合物的有效量在治疗上取决于例如治疗内容和目标。本领域技术人员将理解,用于治疗的恰当的剂量水平将部分的根据递送的分子、融合蛋白变体所用于的适应症、施用途径、患者的大小(体重、体表面积或器官大小)和条件(年龄和健康状态)而改变。因此,医生可以滴定剂量,并修饰施用途径,以获得最佳的治疗效果。典型的剂量范围可从约0.1μg/kg至多至约100mg/kg或更高,取决于上述因素。在其他实施方案中,剂量范围可从0.1μg/kg多至约100mg/kg;或1μg/kg多至约100mg/kg。
给药频率将取决于使用的制剂中的双功能蛋白质的药代动力学参数。通常,医生将施用组合物直到达到实现理想效果的剂量。因此,组合物可以通过植入装置或导管随时间作为单次剂量、作为两次或多次剂量(可含有或不含相同量的理想分子),或作为连续灌注来施用。本领域普遍技术人员常规地对恰当剂量进行进一步精细化,这属于常规实施的任务的范围。可以通过使用恰当的剂量-应答数据,确定恰当的剂量。
药物组合物的施用途径与已知的方法一致,例如口服;通过静脉内、腹膜内、脑内(脑实质内)、脑室内、肌肉内、动脉内、门静脉内或病损内的途径注射;通过缓释系统(也可以注射的);或通过植入装置。需要时,可以通过团注射(bolus injection)或连续灌注,或通过植入装置,来施用组合物。
可选的或此外,可以通过植入其上已经吸附或囊封了理想分子的膜、海绵或其他恰当的材料,局部施用组合物。当使用植入装置时,装置可以植入到任何合适的组织或器官中,可以通过扩散、控制时间的快速浓注或连续施用,递送理想的分子。
双功能蛋白质的治疗性用途
本发明的蛋白质可用于治疗、诊断、减轻或预防多种疾病、病症或病况,包括但不限于代谢病症。在一个实施方案中,所治疗的代谢病症是糖尿病,例如2型糖尿病。在其他实施方案中,代谢病症是肥胖。其他实施方案包括代谢病况或病症,如1型糖尿病、胰腺炎、血脂异常、非醇型脂肪肝病(NAFLD)、非醇型脂肪性肝炎(NASH)、胰岛素耐受、高胰岛素血症、葡萄糖不耐受、高血糖、代谢综合征、高血压、心血管病、急性心肌梗塞、动脉粥样硬化、外周动脉病、中风、心脏衰竭、冠心病、肾病、糖尿病并发症、神经病、与胰岛素受体的严重失活突变相关的病症、包括HIV相关性脂肪营养不良在内的脂肪营养不良、胃轻瘫和其他的代谢病症。
在应用中,可以通过向有需要的患者施用治疗有效剂量的本文所述的双功能蛋白质变体,治疗病症或病况如1型或2型糖尿病或肥胖。可以如本文所述实施施用,如通过IV注射、腹膜内注射、肌肉内注射或以片剂形式或液体制剂口服。在大部分情况下,理想的剂量可以由医生确定,如本文所述,并可以代表双功能蛋白质多肽的治疗有效剂量。对本领域技术人员显而易见的是,双功能蛋白质多肽的治疗有效剂量将尤其取决于施用计划、施用的抗原的单位剂量、核酸分子或多肽是否与其他治疗剂组合施用、接受者的免疫状态和健康。如本文使用的,术语“治疗有效剂量”意指研究人员、医学博士或其他医生发现在组织系统、动物或人中触发生物学或医学应答的双功能蛋白质多肽的量,包括所治疗的疾病或病症的症状的减轻。
药物组合物
本发明还提供了包含一种或多种本文所述的本发明的双功能蛋白质或突变体和可药用的运载体的药物组合物。在一些实施方案中,药物组合物以作为液体溶液或悬浮液的可注射剂制备;也可以制备适合在注射前溶解或悬浮在液体载体中的固体形式。脂质体也包括在可药用的运载体的定义范围内。药物组合物中也可以存在可药用的盐,例如矿物酸盐,如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐等;和有机酸的盐,如醋酸盐、丙酸盐、丙二酸盐、安息香酸盐等。对可药用的赋形剂的全面讨论可获得自Remington:The Science and Practice of Pharmacy(1995)Alfonso Gennaro,Lippincott,Williams,&Wilkins。
融合蛋白和肽化合物
在另一个实施方案中,可以将本发明的蛋白质制备成源自本发明的双功能蛋白质的氨基酸序列的融合蛋白或肽化合物。可以使用本领域已知的标准技术,制备这类融合蛋白和肽化合物。例如,可以使用标准肽合成技术,通过化学合成制备肽化合物,然后通过本领域已知的多种用于将肽导入至细胞内的工具(例如,脂质体等)导入细胞中。
可以通过产生肽修饰,如在本发明的双功能蛋白质中添加N-连接糖基化位点,或缀合本发明的双功能蛋白质与聚乙二醇(PEG;PEG化作用),例如通过赖氨酸-单PEG化或半胱氨酸-单PEG化,改善本发明的融合蛋白或肽化合物的体内半寿期。已证实这类技术对延长治疗性蛋白质药物的半寿期是有益的。预期对本发明的蛋白质的PEG化可以导致相似的制药优点。
此外,可以通过导入非自然氨基酸,在本发明多肽的任何部分中实现PEG化。可以通过Deiters等人,J Am Chem Soc 125:11782-11783,2003;Wang和Schultz,Science 301:964-967,2003;Wang等人,Science 292:498-500,2001;Zhang等人,Science 303:371-373,2004或美国专利号7,083,970中描述的技术,导入某些非自然氨基酸。简而言之,一些这类表达系统涉及定点诱变,向编码本发明多肽的开放阅读框中导入无义密码子,如琥珀TAG。然后,将这类表达载体导入这样的宿主中,所述宿主可利用特异性针对所导入的无义密码子并装载有选择的非自然氨基酸的tRNA。有益于缀合部分与本发明多肽这一目的的特别的非自然氨基酸包括具有乙炔和叠氮侧链的氨基酸。然后,可以在蛋白质中这些选择的位点,将含有这些新型氨基酸的本发明的蛋白质PEG化。
类似的,可以通过如Ou等人所述(Proc Natl Acad Sci U S A.2011Jun 28;108(26):10437-42.Epub 2011Jun 13)导入吡咯赖氨酸或吡咯啉-羧基-赖氨酸,在本发明蛋白质的任何部分实现PEG化。
实施例
实施例1:设计本发明的GLP-1/蛋白质
为了测试GLP-1和FGF21在一起的功效,设计融合分子。因为GLP-1需要游离的N-末端,而FGF21需要游离的C-末端用于受体结合和激活,按N-GLP-1-接头-FGF21-C的顺序克隆二者。用GLP-1第7-35位残基制备初始构建体,N-末端有或没有用于DPP-4保护的若干修饰(讨论在下文中)。测试GLP-1的其他修饰(点突变体或缺失),并通过体外效价评分。
克隆3、8、10或20个氨基酸的接头。对于FGF21,使用野生型人蛋白质的第33-209位残基。产生有或没有PEG化位点的构建体。使用与导入的Cys反应的马来酰亚胺-PEG试剂(40kDa线性和分枝的PEG),实现PEG化。将Cys放在FGF21的R154和GLP-1或毒蜥外泌肽-4和接头中若干位点的位置上。还通过在FGF21的R154或GLP-1的K34位置导入TAG(琥珀)密码子,掺入Pcl、Pyl、Pyl类似物或反应性非天然存在的氨基酸,设计修饰的构建体。通过在R154或K34包括Cys,和在其他位点包括用于掺入Pcl、Pyl、Pyl类似物或反应性非天然存在的氨基酸的TAG密码子,设计两种不同修饰的其他构建体。制备将GLP-1和FGF21与人抗体的Fc结构域融合的构建体。向融合模式中导入FGF21的变体76(V76)序列。
融合物的表达和纯化:通过将编码特定的双功能变体的DNA克隆到含有若干可去除结构域(例如,NPro或NPro变体,其有或无His6标签、或含有TEV蛋白酶识别肽的His6标签、或His6-泛素或His6-Smt3)之一的编码序列的载体中,通常在大肠杆菌中表达融合蛋白。载体还包括诱导型启动子,用于起始表达蛋白质的mRNA转录,如lac、T7或阿拉伯糖启动子。简而言之,将载体转化到源自DH10b的大肠杆菌细胞中或源自BL21(DE3)的细胞中,在标准条件下生长,并向培养基中添加0.2%阿拉伯糖或IPTG诱导蛋白质表达。在诱导3-4小时后收获细胞,离心,并冷冻。解冻沉淀团块,通过超声处理重悬裂解,通过离心分离不可溶的蛋白质。然后,将沉淀团块溶解在6M胍中,并将溶解的澄清蛋白质上样到Ni-NTA柱上。根据标准实践,用变性缓冲剂,再用非变性缓冲剂洗涤柱,并在非变性缓冲剂中洗脱。将洗脱液进行缓冲剂交换以去除咪唑,用特异性蛋白酶消化去除标签(例如,TEV蛋白酶、泛素酶Usp2或Ulp1用于特异性去除smt3),并通过Ni-NTA纯化。在PEG化前,通过尺寸排阻层析进一步纯化含有融合蛋白的级分(通常用NOF Sunbright GL2-400MA 40kDa分枝的PEG马来酰亚胺)。通过阴离子交换层析分离PEG化的蛋白质,放在PBS中,浓缩或储藏用于多种测定。
通过N-末端突变保护GLP-1:因为已知DPP-4对GLP-1的N-末端的加工使得肽对于其原发性受体失活,因此尝试了文献中报道的若干突变来减慢该过程。在基于细胞的GLP-1活性测定法中,测试了具有N-末端添加额外的甘氨酸、Glu9突变为Pro,或Ala8突变为Gly或Ser的所有构建体。在具有与FGF21连接的40kDa PEG的FGF21融合物的情况下,Ala8处的突变保持了比其他N-末端修饰更好的活性(图1a),并在后续设计中使用A8S突变。此外,在融合物中还测试了DPP-4-抗性类似物——毒蜥外泌肽-4,作为具有延长的体内半寿期的备选部分(图1b)。[参见例如,J.Y.Oh等人(2009)Bulletin of the Korean Chemical Society 30,2471-2474;K.Adelhorst,(1994)JBC 269,6275;B.D.Green等人(2003)Biological Chemistry 384,1543;J.C.Parker等人(1998)Journal of Peptide Research 52,398;C.F.Deacon等人(1998)Diabetologia 41,271;R.Burcelin等人(1999)Metabolism-Clinical and Experimental 48,252;U.Ritzel等人(1998)Journal of Endocrinology 159,93.]
还比较了A8S突变与野生型GLP-1的体内药代动力学特性。向大鼠静脉内注射1mg/kg的含野生型GLP-1(V329)的融合蛋白和含GLP-1(A8S)突变(V232)的融合蛋白,并根据给药溶液的标准曲线测量血清水平。当用人FGF21-反应性ELISA试剂盒测量时,分子似乎表现出彼此相似和与连接了相同大小(40kDa)PEG的单独的FGF21相似的行为(图2)。为了测量GLP-1活性的半寿期延长,用含有野生型GLP-1或GLP-1(A8S)的相同的两种双功能蛋白质变体注射C57BL/6J小鼠。尽管两者在给药后都使餐后葡萄糖水平急性降低,但在给药3天后的口服葡萄糖耐受测试(OGTT)测量中,GLP-1(A8S)变体保持了较大的活性(图3)。这些数据证实,A8S突变增加了融合物的GLP-1部分的有效半寿期,同时FGF21部分的PK不太受添加GLP-1的影响。
设计在GLP-1和FGF21之间的肽接头:测试3、8、10或20个氨基酸的接头。在具有不同接头的变体中,没有观察到任何显著的活性差异,尽管在一些融合物环境下,表达产量存在差异。此外,用各种长度GLP-1(8至31个残基)或毒蜥外泌肽-4(30或更多个残基)的测试构建体,并在基于GLP-1R细胞的测定中测试体外活性。
实施例2:在ob/ob和db/db糖尿病小鼠模型中测试融合物
FGF21已表现出改善2型糖尿病(T2D)的ob/ob小鼠模型的血糖水平、肝脂类水平和体重(参见例如,A.Kharitonenkov等人(2005)Journal of Clinical Investigation 115,1627;T.Coskun等人(2008)Endocrinology 149,6018;和E.D.Berglund等人(2009)Endocrinology 150,4084)。同样的,在该遗传性小鼠糖尿病模型中,GLP-1类似物已表现出改善葡萄糖控制、β细胞功能和肝脏健康(Gallwitz B.,Glucagon-like peptide-1as a treatment option for type 2diabetes and its role in restoringβ-cell mass.Diabetes Technol Ther.2005,7:651-7)。
为了确定GLP-1与FGF21的融合物是否导致额外的功效,测试WT GLP-1和GLP-1(A8S)形态与等价的FGF21分子,每者连接了相同的40kDa分枝的PEG。在每周给药2次、为期2周的研究中,FGF21(R154C)-PEG(V238)和GLP-1-FGF21(R154C)-PEG(V239)表现出对血糖、体重和肝脏健康(由丙氨酸转氨酶(ALT)血清水平、重量和表观进行评估)相似的效果(图4)。在第一次给药后,葡萄糖测量表现出融合物比单独的FGF21更快速的改善。两者在给药后超过1天的时间点汇合,提示由GLP-1造成的额外益处比FGF21的效力存在时间短。
GLP-1(A8S)-FGF21(R154C)-PEG(V235)融合物也在0.2mg/kg,而非其他化合物使用的1mg/kg表现出相似的效果。该化合物一般也在给药间产生更一致的结果,提示了相比GLP-1-FGF21(R154C)-PEG(V239)的升降行为,DPP-4-抗性对效力的整体改善是关键性的。还观察到在1mg/kg的GLP-1(A8S)-FGF21(R154C)-PEG(V235)表现出额外地降低葡萄糖、体重、ALT/AST,和肝重量。
还继续了其他的研究,观察共同施用单独的FGF21和GLP-1化合物是否可以复制改善的效力。为了使组间蛋白质给药相似,制备了这样的工具化合物,其中从FGF21的C-末端去除了14个氨基酸。相比其他的融合物,该分子(V253)在FGF21受体测定法中的效价低至少1000x但在GLP-1R测定法中却保持了相等的效价,且不能抑制野生型FGF21活性。当通过FGF21水平评估时,该化合物在大鼠中具有与其他融合物相似的药代动力学(图2)。
图5显示了在用FGF21(V76)-PEG、GLP-1(A8S)-PEG(V253)、两者共同、或GLP-1(A8S)-FGF21(V76)-PEG融合物(V272)治疗的ob/ob小鼠中,为期4周的研究结果。融合物比共同施用单独的FGF21(V76)-PEG和GLP-1(A8S)-PEG分子对于餐后葡萄糖AUC、OGTT葡萄糖AUC、研究结束时的体重、肝脂质含量和ALT测量值显著更有效(全部p值<0.05)。
检测末梢血清样品中的人FGF21和GLP-1的血清暴露以验证多个组的暴露。在所有的治疗组中都检测到了人FGF21,并在所有用GLP-1(A8S)-PEG(V253)或GLP-1(A8S)-FGF21(V76)-PEG(V272)治疗的组中都测量到了活性GLP-1的显著增加。GLP-1(A8S)-FGF21(V76)-PEG(V272)组表现出与0.2mg/kg FGF21(V76)-PEG组相似的人FGF21水平,提示改善的效力不是由于融合物在动物体内更高的全身性积累。GLP-1(A8S)-PEG(V253)分子在体外是完全活性的(表8)。这些数据证实,融合物的效力取决于单个分子中的两个部分,并且例如受益于细胞水平的协同作用。
为了进一步测试GLP-1(A8S)-FGF21(V76)-PEG(V272)vs.共同施用,在db/db小鼠中进行3次研究。在每次研究中,对雄性db/db小鼠(8-11周龄)i.p.给药,每周2次。在研究的前三周,相等剂量的双功能融合蛋白GLP-1(A8S)-FGF21(V76)-PEG(V272)与共同施用的葡萄糖降低等同并优于单个实体给药的功效。双功能融合蛋白还表现出更优秀的体重减轻。
在第2个为期2周的研究中,GLP-1(A8S)-FGF21(V76)-PEG(V272)表现出与剂量高25倍的FGF21(V76)-PEG和剂量高5倍的GLP-1(A8S)-PEG(V253)相似的葡萄糖降低。此外,GLP-1(A8S)-FGF21(V76)-PEG(V272)对HbA1c的降低和对体重的降低都显著超过了单一疗法或共同施用组的最大有效剂量(图8,表2)。预料不到的是,将共同治疗的给药比例改变至大于1:1也没有改善观察到的功效(表2)。这提示,包括等量GLP-1部分和FGF21部分的双功能蛋白质可以在体内治疗中实现最佳功效。
表2.治疗剂量
1p-值vs.载体<0.05.2p-值vs.共同治疗组<0.05
表2显示了在为期2周给药的db/db小鼠研究中,不同剂量的单一疗法和共同治疗相比双功能蛋白质的功效。报道的值是8只动物中的测量平均值,含标准差。在为期4周的研究中,用单一疗法、共同治疗或双功能融合蛋白对雄性db/db小鼠(n=8)每周给药2次,共计4周。在第27天,小鼠空腹,测量所有动物的血液胰岛素水平。在研究结束时,提取并测量胰腺的胰岛素含量(n=3)。GLP-1(A8S)-FGF21(V76)-PEG(V272)在从0.1-1mg/kg表现出强大的剂量应答,对葡萄糖水平、HbA1c和体重的疗效等于或优于剂量高10倍的单独的FGF21(V76)-PEG或GLP-1(A8S)-PEG(V253),且改善的功效优于共同施用的最大有效给药。GLP-1(A8S)-FGF21(V76)-PEG(V272)还降低了血清中的空腹胰岛素水平,同时使胰腺的胰岛素含量增加到了大于GLP-1(A8S)-PEG(V253)和FGF21(V76)-PEG单一治疗或组合治疗的程度(图7)。GLP-1(A8S)-FGF21(V76)-PEG(V272)治疗的动物在餐后葡萄糖、HbA1c和体重数值上接近体重控制小鼠。
为了估计代谢速率和底物利用,使用Oxymax间接量热系统(Columbus Instruments,Columbus,OH)测量了氧气消耗和二氧化碳生产。小鼠饲养在具有12h光照/12h黑暗循环的笼中,环境温度22–24℃。在Oxymax系统设置和操作程序下,确定VO2和VCO2速率。用标准气体混合物校正系统,测量消耗的O2(VO2,ml/kg/h)和生成的CO2(VCO2,ml/kg/h)。评估72h时间段内的代谢速率(VO2)和呼吸交换比值(RER)(VCO2/VO2的比)。计算的RER值提示,相比载体或组合治疗的组,用融合蛋白治疗的动物更依赖于脂类底物(RER值接近0.75-0.85),特别是在第二次给药后的24-72小时期间。在此时期中,载体和组合治疗的组显示RER值接近0.9,提示更多的碳水化合物底物利用用于能量和更低程度的脂质底物利用用于能量消耗。数据提示,融合蛋白治疗导致脂肪酸氧化增加,这可对其在db/db小鼠中的体重减轻效应有贡献。
当与组合相比时,双功能融合蛋白表现出改善的体内β-细胞功能。在双功能蛋白质GLP-1(A8S)-FGF21(V76)-PEG(V272)或GLP-1(A8S)-PEG(V253)加FGF21(V76)-PEG给药四次后,用葡萄糖和精氨酸对db/db小鼠口服给药。双功能蛋白质治疗组的葡萄糖波动(低于载体72%)显著低于组合治疗的组(低于载体56%)。在实验过程中,双功能蛋白质治疗的组的分泌的胰岛素的量(高于载体279%)也高于组合治疗的组(高于载体122%)。
综上所述,图、表和本文未显示的数据证实了,相比单独的GLP-1和FGF21的组合(例如FGF21(V76)-PEG和GLP-1(A8S)-PEG(V253)),本发明的双功能融合蛋白(例如GLP-1(A8S)-FGF21(V76)-PEG(V272))改善体外和体内啮齿类糖尿病模型中的代谢参数的能力。所述改善的参数(如本文使用的“代谢参数”)包括但不限于餐后葡萄糖(AUC)、体重、肝甘油三酯、血浆HbA1c、血清甘油三酯水平、总胆固醇水平,口服糖耐受测试的血清葡萄糖测量值(AUC)、空腹血清胰岛素、胰腺胰岛素含量,和体脂百分比。
实施例3:从FGF21变体设计本发明的GLP-1/蛋白质
用下列FGF21变体序列制备融合物,所述变体在本文中被称为“变体76”或“V76”:
FGF21(V76)-PEG的特征是通过Cys154连接的40kDa分枝的PEG,和相对于177个氨基酸的野生型蛋白质的8个点突变(Q56E、D74H、Q82E、R105K、K150R、R154C、R159Q、S195A,都是相对于全长FGF21蛋白序列(NCBI参考序列号NP_061986.1)进行的)。基于对人T细胞应答的EpiScreen时间过程测定法,该分子的临床免疫原性的风险被认为是低的。在每周两次注射1mg/kg的情况下,分子在小鼠和大鼠中具有大于30h的血清半寿期,并且在ob/ob小鼠中显著降低葡萄糖AUC。
以3种剂量(0.05、0.1和0.2mg/kg)测试GLP-1(A8S)-FGF21(V76)-PEG(V272)分子和GLP-1(A8S)-FGF21(R154C)-PEG(V235)融合物。两种融合物在降低葡萄糖AUC、体重、食物摄入和ALT中都表现出剂量应答(图6)。在0.2mg/kg剂量时,GLP-1(A8S)-FGF21(V76)-PEG(V272)一般是相等或更好的,并且对所有参数都表现出更高的功效。在0.1和0.2mg/kg时,GLP-1(A8S)-FGF21(V76)-PEG(V272)也表现出降低血清甘油三酯和胆固醇。基于这些数据,GLP-1(A8S)-FGF21(V76)-PEG(V272)分子显示出与初始融合物相似的或改良的特性,并且适用于进一步的研究和开发。
在ob/ob 2周的研究中,Ex4(1-30)-L20-FGF21(V76)-PEG(V277)也表现出与GLP-1(A8S)-FGF21(V76)-PEG(V272)相似的葡萄糖控制、体重和脂类水平的功效。
选择用于延长半寿期的PEG化位点。例如图2所见,使用PEG化延长分子的半寿期,如在大鼠中测量的,将GLP-1的数分钟或FGF21的少于半小时延长至大于30个小时。为了观察融合物的两个部分是否能受PEG放置的调控,构建一系列构建体,其中额外的半胱氨酸不在FGF21序列中而在GLP-1序列或接头中。在基于细胞的测定法中,测试这些构建体的GLP-1和FGF21活性。实验揭示了融合蛋白序列中的一段位置,在所述位置上的PEG化不重大地影响两者之中每者的活性。在该段的N-末端仔细放置PEG,可用于制备具有敲低的GLP-1活性的分子,而放置在接头中则可用于敲低FGF21活性。这类分子可用于调和融合物的效价(例如,如果高效价的GLP-1或毒蜥外泌肽-4导致低下的治疗窗口,当以较低效价FGF21的有效水平给药时)。
基于这些数据,用序列如下的FGF21(V76-C154R)制备在GLP-1(V273)的K34C处或毒蜥外泌肽-4(V274)的K27C处具有PEG化的融合物:
在ob/ob小鼠中为期2周的研究证实,虽然新的融合物(V273和V274)表现出与之前的融合物相似的体外效价,和在大鼠中相似的药代动力学,但其在体内效果较差,在0.2mg/kg时,GLP-1融合物变体对葡萄糖或体重没有表现出任何显著的功效。相比载体,毒蜥外泌肽-4融合变体表现出显著降低ALT和体重,和降低AST的倾向,但对血糖没有显著的效果。虽然这些融合物可以在更高剂量下表现出功效,但仍选择在FGF21的R154C上PEG化的原始模式进行进一步研究。不清楚的是,这一预料之外的差异是否提示了被交替的位点处的PEG化阻断的融合物的GLP-1(A8S)-FGF21(V76-154R)-PEG形态的特殊性质,或者是否存在其他解释,如PEG对GLP-1R相互作用的阻断在具有天然受体水平的天然细胞上比在体外测定法中使用的转染细胞上更高。
实施例4:进一步表征本发明的GLP-1/FGF21蛋白
为了进一步优化和分级本发明的GLP-1-FGF21-PEG双活性蛋白质,和为了获得对其相比共同施用模型改善的功效的更全面理解,在功效的ob/ob模型中测试融合物。这些融合物包括但不限于这样的分子,所述分子具有改善血清稳定性或活性的更长或更短接头、本发明的其他蛋白质(可包括但不限于基于变体76的突变体,或研发中的其他变体,如额外的或不同的点突变、插入或缺失、二聚体化分子、备选的PEG化对策、具有额外的二硫键的分子、在不同的表达系统中生产的分子),和毒蜥外泌肽-4或GLP-1的变体。还通过计算机免疫原性预测、表达水平和终产物品质(与溶解度、聚集作用和稳定性相关)过滤候选物。
为了进一步表征FGF21和GLP-1用于治疗糖尿病和肥胖的协同作用,定位了两个分子的相互作用动力学,并比较融合蛋白与单个亲本分子的最大有效共同施用。在关注肥胖和体重减轻的模型(在大鼠或小鼠中膳食诱导的肥胖)中,和在糖尿病各方面(如高血糖、血脂异常和受损的β细胞功能)的更好的模型中(ob/ob或db/db小鼠)进行这些实验。可以通过定位各单体分子的功效、两者以不同比例的组合,和融合物,进一步确定本发明的双活性蛋白质的协同程度。
在用原代或永生化的大鼠胰岛和原代人胰岛的基于细胞的测定法中进行测试,评估融合物对细胞增殖、保护免于凋亡,和功能的效果,例如以在接受的1型糖尿病模型中验证本发明的双活性蛋白质(还参见Van Belle,T.L.等人Drug Discovery today:disease models.209.第41-45页)。优选的体内模型是以下模型,其特征是用链脲霉素(STZ)的胰腺消融;在遗传修饰的和诱导型小鼠品系(RIP-DTA)中靶向的β-细胞消融,其中β-细胞被膳食中补充的诱导白喉毒素的靶向表达的强力霉素破坏;或具有自身免疫机制的1型糖尿病的非肥胖型糖尿病(NOD)小鼠模型。在这些模型中,既可以进行预防性给药以评估β-细胞保护作用(特别是在NOD中),也可以进行刺激后给药以评估β-细胞刺激作用和增殖(特别是在STZ和RIP-DTA中)。
进行下列实验,以更全面的认识相比共同施用方案由本发明的双活性蛋白质实现的功效协同机制:可以使用用两种受体(GLP-1R;FGFR1(IIIc)、2(IIIc)、3(IIIc)或4;和β-klotho)共转染的细胞,确定受体是否能够加强细胞表面的对立信号。在天然表达两种受体的细胞(例如β细胞)中,可以检测到下游信号之间的交流。在动物中,可以更深入的研究食物摄入(用成对喂食组研究)、增加的代谢速率(在膜片钳和代谢房实验中研究)和其他机制的贡献,以阐述两种信号的协同效应的作用模式。为了阐述融合蛋白的独特的信号传递,潜在地解释其改善的功效,还可以进行关键组织(肝、胰腺、脂肪、肠、心脏、主动脉、脑等)的基因表达制谱。
进行下列实验以理解本发明的双功能蛋白质控制或修饰充质干细胞(MSC)分化的活性:可以仅用本发明的蛋白质,或用已知诱导骨生成的化合物或化合物的混合物,或用已知诱导脂肪生成的化合物或化合物的混合物处理MSC,并可以测量所获得的成骨细胞样细胞或脂肪细胞样细胞的分化速率。
实施例5:从Fc-融合物FGF21变体设计本发明的含有GLP-1和毒蜥外泌肽-4的蛋白质
用备选的接头(例如,SGGGGSGGGGSGGGGSA(SEQ ID NO:138)、GGGGS(SEQ ID NO:173)、GG和GGGGSGGGGSGGGGS(SEQ ID NO:174))、FGF21变体和GLP-1-相关的肽制备构建体。通常在HEK293细胞中表达含有Fc结构域的双功能蛋白质。将这些融合物的DNA编码序列克隆到载体中,所述载体含有编码指导蛋白质分泌的前导肽的序列,并且还含有促进理想产物的mRNA合成和蛋白质表达所必需的序列。用载体瞬时转染HEK293细胞。收集来自这些细胞培养物的培养基,过滤,并通过蛋白A亲和层析纯化。使洗脱液成为中性pH,并通过尺寸排阻层析进一步纯化。然后浓缩和储藏产物,用于多种测定法。在四种测定法中测试变体的体外活性:在用GLP-1R转染的HEK293中CRE-荧光素酶表达诱导(表3)和在INS1E细胞中葡萄糖刺激的胰岛素分泌(表6)以通过GLP-1R测量活性;在用β-klotho转染的HEK293中ERK磷酸化诱导(表4)和3T3L1细胞的2-脱氧葡萄糖摄入(表5)以测量FGF21活性。具有GLP-1(A8S)和15个氨基酸接头的变体比具有GLP-1和较短接头的变体更有活性。测试的具有所有接头的毒蜥外泌肽-4(1-39)变体都是有活性的。含有毒蜥外泌肽-4(1-30)的变体与含有毒蜥外泌肽-4(1-39)的构建体具有相似的体外效价。具有串联重复的毒蜥外泌肽-4(1-39)的变体不如具有单拷贝的GLP-1-相关肽的变体有效力。
表3.在HEK293-GLP-1R-CRE-荧光素酶报告子细胞中的GLP-1R活化
表4.在HEK293-KLB细胞的FGF21活性的ERK磷酸化测定法中测量的活性
表5.在3T3L1小鼠脂肪细胞的2-脱氧葡萄糖摄入中测量的活性
表6.在INS1E大鼠胰岛素瘤细胞中通过葡萄糖刺激的胰岛素分泌(GSIS)测量的活性
用0.5mg/kg变体给药8只ob/ob小鼠,每周2次,共计2周。在研究过程中,测量血糖和体重,在研究结束时,测量肝脂类。如下表可见(表7),在整个研究中,相比载体处理的年龄匹配的动物,治疗的动物具有降低的血糖、较低的体重和较低的肝脂类。
表7. 0.5mg/kg治疗ob/ob小鼠,每周2次,共计2周的结果概述
*p-值vs.载体<0.05
实施例6:在受体药理学测定法中进一步表征本发明的蛋白质
例如图9可见,在用β-klotho转染的HEK293中,比较本发明的双重激动剂蛋白质与多种形式的FGF21和艾塞那肽诱导ERK磷酸化的能力。在10分钟,当与用FGF21(V76)-PEG加艾塞那肽处理的细胞相比时,用GLP-1(A8S)-FGF21(V76)-PEG(V272)处理的细胞表现出更高的效价和更高的磷酸-ERK比总ERK的最大比例。更高的最大磷酸-ERK信号显示出相比FGF21(V76)-PEG分子,双功能蛋白质V272是用于经过FGFR1c/β-klotho信号传递的更优秀的激动剂,可能是由于与受体更好的相互作用(例如,N-末端延伸导致双功能蛋白质获得了更有利的用于受体结合或激活的结构)。
测试选择的双功能蛋白质在人脂肪细胞中诱导磷酸-ERK信号传递的能力。相比单功能FGF21分子(V101),双功能蛋白质V208、V209、V211、V14和V272更有效地刺激ERK的磷酸化。因为是人细胞,因此还可以提示相比包括其他FGF21模拟物的治疗,本发明的双功能蛋白质在人类疾病的治疗中是高活性的,与迄今为止在啮齿类中证实的活性相似。
例如表8和图10可见,比较本发明的双重激动剂蛋白质与艾塞那肽、GLP-1肽、毒蜥外泌肽-4(1-39)-L5-Fc(V201),和GLP-1(A8S)-PEG(V253)在用GLP-1R转染的HEK293细胞或用GLP-1R、β-klotho和FGFR1c共转染的细胞中通过GLP-1R传递信号的能力。用化合物处理细胞30分钟,测量cAMP水平。表8显示,在含有GLP-1R和FGF21受体复合物的细胞中,双重激动剂蛋白质(V272和V211)表现出比单独的单个激动剂(V253和V101)或与毒蜥外泌肽-4的组合更高的效价。在仅含GLP-1R的细胞中,单独的单个激动剂或与毒蜥外泌肽-4的组合的效价等于双重激动剂蛋白质。在测定法中,单独的FGF21变体是失活的。
表8.用本发明的双功能蛋白质处理的细胞中的cAMP诱导测定
在Discoverx的PathHunder测定模式中生成两个额外的HEK293细胞系,所述细胞系利用β-半乳糖苷酶片段对β-抑制蛋白和GLP-1R的C-末端的互补作用以在受体激活后测量对抑制蛋白的招募。图10a-10d显示,用蛋白质或肽孵育细胞1小时,GLP-1(A8S)-FGF21(V76)-PEG(V272)、毒蜥外泌肽-4(1-39)-L15-Fc-L15-FGF21(V103)(V211)、GLP-1(A8S)-PEG(V253)和毒蜥外泌肽-4(1-39)-L5-Fc(V201)不如艾塞那肽有效招募β-抑制蛋白,且不论细胞含有GLP-1R/FGFR1c/β-klotho或单独的GLP-1R,注意到行为并无差异。
此处展示的受体药理学研究提示,本发明的双功能蛋白质的活性和功效比常规FGF21和GLP-1/艾塞那肽分子的组合或共同治疗更优秀。PEG化的双功能蛋白质GLP-1(A8S)-FGF21(V76)-PEG(V272)令人惊讶的表现出比FGF21(V76)-PEG分子更高的磷酸-ERK诱导效价和最大信号。这些数据显示,相比其他FGF21变体,双功能蛋白质的FGF21信号传递相等或更优秀。同样的,当细胞表达GLP-1和FGF21受体时,双功能蛋白质对GLP-1R下游的cAMP信号传递表现出更高的效价。这些特性可以反映在受体之间的直接相互作用或间接效应,如通过对两种受体的亲合力增强局部浓度。这些观察结果提示了双功能蛋白质的改善的活性的机制,所述机制可以解释为何单独的GLP-1和FGF21变体的共同治疗不足以匹配双功能蛋白质的体内功效,如本发明的其他实例中所示。
实施例7:在1型糖尿病(T1D)模型中表征本发明的蛋白质
用强力霉素治疗RIP-DTA转基因小鼠(9-10周龄)3天以诱导受控的β-细胞消融(与Thorel等人,Nature 2010(464)1149-1154相似)。然后,用FGF21(V76)-PEG,FGF21(V76)-PEG+GLP-1(A8S)-PEG(V253),或GLP-1(A8S)-FGF21(V76)-PEG(V272)治疗小鼠3周,每周2次。在所有3组中,治疗的动物在研究过程中都表现出降低的餐后葡萄糖水平。双功能蛋白质治疗(比载体降低64%)比组合治疗(比载体降低55%)导致显著更低的葡萄糖AUC。空腹后,对小鼠给予葡萄糖团,并测量血糖波动。与载体治疗的动物相比,所有3组治疗降低了血糖水平,其中双功能蛋白质治疗导致76%降低,与之相比组合治疗导致66%降低。所有的治疗组都具有比载体增加的胰腺胰岛素含量,其中双功能蛋白质治疗导致比组合治疗高76%的胰岛素含量。
用GLP-1(A8S)-FGF21(154C)-PEG(V235)或GLP-1(A8S)-PEG(V253)+FGF21(154C)-PEG(V238)治疗NOD小鼠3周,每周2次。在2周后,使小鼠空腹,并给与葡萄糖团用于OGTT。双功能蛋白质治疗的小鼠表现出与载体相比显著更低的空腹葡萄糖(载体的~60%)和在刺激过程中的葡萄糖波动(~45%),而组合治疗的动物具有与载体相比不显著不同的空腹葡萄糖水平(~70%)和在刺激过程中相似的葡萄糖波动。在研究结束时,双功能蛋白质治疗的动物具有比载体显著更低的基础胰高血糖素水平(~50%),而组合治疗的动物具有与载体相似的水平。
实施例8、预测性的免疫原性结果——MHC-相关肽蛋白组学(MAPP)和T细胞测定法结果
mAb和其他治疗性蛋白质的抗药抗体(ADA)的形成可以潜在地导致严重的免疫毒性反应,如IgE-介导的过敏反应(Chung等人(2008)N Eng J Med,358,1109-17)或免疫复合物病,例如,血管炎、肾小球肾炎(Descotes和Gouraud(2008)Expert Opin Drug Metab Toxicol 4,1537-49)以及丧失临床暴露和功效。一些用治疗性蛋白质PEG化的巨核细胞生长和发育因子(PEG-MGDF)和红细胞生成素(EPO;Eprex)治疗的患者出现了与其各自内源性对应物交叉反应的中和性ADA,导致使用PEG-MGDF时严重的血小板减少症,和使用Eprex时纯红细胞发育不全(Li等人(2007)Blood 98,3241-8;Casadevall等人(2002)N Engl J Med 346,469-75)。因此,重要的是在人体测试前评估免疫原性风险。为临床研发阶段评估免疫原性风险和安排固相免疫原性风险缓解计划对含有修饰性的,非人序列的治疗性蛋白质是特别重要的,如本发明主题的FGF21变体。
可以以至少2种方式诱导形成ADA。已描述了用于B细胞活化的T细胞依赖性和非依赖性途径。强大的,高亲和力IgG应答是T细胞依赖性的并且需要涉及CD4+T辅助细胞(TH细胞)。免疫应答与对外源抗原的应答类似:新生的TH细胞被专门的抗原呈递细胞(APC)(如树突状细胞(DC))特异性激活,并反过来诱导药物特异性的B细胞活化。
MHC-相关性肽蛋白组学(MAPP)测定法涉及体外鉴别II型HLA相关肽,所述肽是专门的抗原呈递细胞(APC)(如树突状细胞)所具有的。考虑抗原摄入、加工和呈递过程。在该方法中,在存在激活刺激的条件下,用不同的生物治疗性药物候选物孵育不同的健康血液供体的未成熟的人单核细胞来源的DC。通过液相色谱-质谱(Kropshofer和Spindeldreher(2005)于Antigen Presenting Cells:From Mechanisms to Drug Development,编者.Kropshofer和Vogt,Wiley-VCH,Weinheim,159-98)鉴别源自生物治疗性蛋白质的天然加工的II型HLA相关肽。
T细胞测定法提供了可以评估整个蛋白质治疗剂的潜在免疫原性风险的模式。T细胞测定法评估了治疗性蛋白质诱导CD4+T细胞应答的能力。使用覆盖了广泛的II型HLA单体型组的健康血液供体组,测试纯化的治疗性蛋白质的体外T细胞增殖和/或细胞因子分泌。该技术已成功地用于比较蛋白质变体诱导体内免疫应答的潜力(Jones等人(2004)J Interferon Cytokine Res.24,560-72.;Jones等人(2005)J Thromb Haemost.3,991-1000),且对目前批准的单克隆抗体的这一评估确实显示了在体外观察到的T细胞激活和临床免疫原性之间一定程度的相关性(Perry等人(2008)Drugs R D 9,385-96)。在本发明的上下文中,将来自代表世界群体(基于HLA的同种异型)的50名健康供体的组的外周血单核细胞(PBMC)与FGF21变体孵育,并使用增殖测定法([3H]-胸苷摄取)和IL-2细胞因子分泌(ELISpot)测量T细胞应答。之后,分析CD4+T细胞应答的频率和幅度,以评估临床免疫原性的风险。
组合使用T细胞和MAPP测定法为使用人细胞的临床免疫原性的风险评估提供了有效的方法。对治疗性蛋白质候选物的这样的修饰是有利的,所述修饰导致树突细胞呈递降低数量的肽和在T细胞测定中有应答的供体的数量降低,因为这些蛋白质具有较低的出现临床免疫原性的风险。已描述降低免疫原性的蛋白质修饰的例子是PEG化。然而,降低的免疫原性不总是随PEG化发生(Li等人(2007)Blood 98,3241-8)。
在MAPP测定法中,所有测试的PEG化的GLP-1(A8S)和毒蜥外泌肽-4FGF21-融合物分子,包括V272(PEG化的)和V277(PEG化的)和含有Q55C、G148C突变的非PEG化的Fc-FGF21变体(V101、V103和V188)显示了低数量的簇、和可与V76(PEG化的)相比较的和低于野生型FGF21或V76(非PEG化的)的肽长度变体。在T细胞测定法中,对于V272(PEG化的)和V277(PEG化的)和含有Q55C、G148C突变的非PEG化的Fc-FGF21变体(V101、V103和V188)而言,研究组的T细胞应答的频率<10%,且应答幅度低(表10)。缺少PEG部分或缺少Q55C、G148C处的额外的二硫键可以对野生型FGF21和V76(非PEG化的)中所见的增加的MAPP和T细胞测定法应答有贡献(表9和10)。基于MAPP和T细胞测定法的结果,可以认为在临床中出现免疫原性的风险对于V76(PEG化的)、V272(PEG化的)、V277(PEG化的)和含有Q55C、G148C突变的非PEG化的Fc-FGF21变体(V101、V103、V188)而言是低的。已知向蛋白质添加二硫键可以增强它的蛋白水解稳定性且含有Q55C、G148C突变的Fc-FGF21变体的这一特征可以对MAPP测定法中由负载抗原的成熟树突细胞所展示的肽的数量降低有贡献。
此外,可以用导致分子二聚化并从而影响抗原加工和呈递的游离半胱氨酸解释测定法中对非PEG化的V76增加的MAPP应答。这与具有导入的游离半胱氨酸的野生型FGF21表现出相同的二聚化倾向并导致增加的肽呈递的观察结果是一致的。额外的PEG化的双功能蛋白质,和含有Q55C、G148C突变的GLP-1(A8S)-Fc-FGF21变体(V202、V203、V212、V213、V214、V215、V216、V218等)和毒蜥外泌肽-4-Fc-FGF21变体(V196、V197、V198、V199、V206、V207、V208、V209、V210、V211等)可能也表现出与临床中出现免疫原性的低风险相一致的MAPP和T细胞测定应答。
表9.用野生型FGF21、V76(非PEG化的)和V76(PEG化的)实验的T细胞测定法概述
表10.用V76(PEG化的)、V272(PEG化的)、V277(PEG化的)、V101、V103和V188实验的T细胞测定法概述
- 还没有人留言评论。精彩留言会获得点赞!