一种用于中国地方猪品种大肠杆菌抗性的分子标记方法与应用与流程
本发明属于猪遗传育种及分子标记辅助选择技术领域,具体涉及一种用于中国地方猪品种大肠杆菌抗性的分子标记方法与应用。
背景技术:
疾病可导致畜禽产量下降、质量低劣,同时它还严重降低遗传进展,给养猪业造成的直接经济损失约占总产值的12%~15%。仔猪腹泻是规模化猪场最常见的一类疾病,对哺乳仔猪的危害尤为严重。据有关资料的统计数字表明,许多猪群仔猪腹泻性疾病发病率高达50%以上,病死率高达15%~20%,由腹泻引起的仔猪死亡数占仔猪死亡总数的39.8%(何维明等,2001)。尽管当前对仔猪腹泻采取的一些预防性措施(如提高管理水平、改善卫生环境、注射药物以及亚单位疫苗接种等),在一定程度上减少了该病的发生,但并没有从根本上消除断奶仔猪腹泻的发生与流行,大肠杆菌性仔猪腹泻仍然是引起仔猪高发病率和死亡率最主要的原因之一。由此可见,从长远发展考虑,寻求一种全新的预防与控制策略,采用遗传学方法,培育出抗病新品种(品系),从遗传素质上永久性地提高仔猪对大肠杆菌病的抵抗能力,是现代育种学家共同追求的目标。
F18大肠杆菌是目前在养猪业中发生最普遍、危害最大的肠毒素大肠杆菌病原(Van den BroeckW et al,2000),可引起断奶仔猪腹泻(porcine post-weaning diarrhea,PWD)等疾病,在猪的病原学上有极为重要的意义(Boldin,2008)。
Vogeli等(1997)通过候选基因法和连锁分析法,研究了位于猪染色体6q11区的α(1,2)岩藻糖转移酶(alpha(l,2)fucosyltransferase)基因1(FUT1),发现FUT1基因第307个碱基的突变可以作为一个遗传标记,用于筛选对F18菌毛化大肠杆菌具抵抗力的新品系;Meijerink等(2000)认为FUT1酶的第103个氨基酸(即FUT1基因M307位点)对小肠粘膜F18菌毛受体的表达具有重要的作用,导致猪对F18黏附素的抗性和敏感性,AA基因型猪表现为抗性,GG基因型猪表现为敏感性。Meijerink以此为标记,并在250头的瑞士大约克、杜洛克、汉普夏、皮特兰等猪种中进行基因型测定,依据测定结果通过适当的选种选配,实施了抗性育种。美国的ARS(Agricultural Research service)买断该成果并申请专利(专利号:443766),同时进行大规模产业化生产,且于1999年7月宣布在大约克中育成该病的抗性猪。在国外宣布育成大约克抗F18抗大肠杆菌病新品系后,国内针对地方猪种FUT1基因的研究开始成为热点,本课题组(吴圣龙等,2006;Bao et al,2008)以及国内国内许多学者如晏学明等(2003)和施启顺等(2003)已经系统研究了杜洛克、皮特兰、约克夏、长白猪和汉普夏等5个外来猪种和几十个国内地方猪种FUT1基因M307位点的多态性,结果都显示FUT1基因M307位点在外来猪种以及含外血的杂交培育品种(如:苏太猪)中具有多态性,但在中国地方猪种中尚未发现AA基因型甚至AG基因型存在。这就充分表明:国外猪种的F18大肠杆菌抗性遗传基础与国内地方猪种的F18大肠杆菌抗性遗传基础确实存在着明显的差异,适用于国外猪种的FUT1基因遗传标记并不能同样适合于中国地方猪种,因此近年来关于中国地方猪种抗F18大肠杆菌病的相关研究和育种工作也陷于困境。
microRNAs(miRNAs)是一类短的参与基因转录后水平调控的非编码RNA分子,广泛存在于动植物细胞中。miRNA主要是通过与靶标mRNA的3′-UTR区域完全或不完全配对而降解靶标mRNA或抑制mRNA的正常翻译,进而对基因转录后表达进行调控。随着近几年不断的深入研究,发现miRNA在细胞周期调控、细胞生长与分化、凋亡以及胚胎发育等生物学过程中发挥着重要的重要作用。此外,miRNA作为一种重要的免疫调节因素参与了多种癌症、肾病、呼吸系统疾病等疾病的发生。近几年,国内外学者逐渐把miRNA研究从人扩展到其他模式动物上,研究发现miRNA在猪骨骼肌和心肌发育、脂肪生成代谢以及各种病毒性和细菌性疾病发生等过程均发挥了重要的调控作用。本课题组前期运用Illumina Solexa高通量测序技术对E.coli F18抗性型和敏感型个体十二指肠内差异表达的miRNAs进行分析(数据已经提交于NCBI数据库中Gene Expression Omnibus,GEO Series accession number GSE32527),并通过定量验证筛选出表达量差异极显著的miRNA—miR-215。
核酸内切酶Drosha和Dicer通过识别miRNA前体的特异构象对其进行切割加工,所以miRNA前体序列的突变,必然会影响其构象,进而使其加工成熟发生变化,使成熟miRNA水平上调或下调,并最终影响到其对靶基因的调控,如果突变发生在“种子序列”,则有可能失去对原有靶基因的调控或者产生新的靶基因,使生物的相应性状发生改变甚至产生疾病。到目前为止,miRNA前体多态性的相关研究主要集中在人类疾病发生上,而对猪疾病易感性相关的报道较少。
技术实现要素:
本发明的目的是提供一种用于中国地方猪品种大肠杆菌抗性的分子标记方法与应用。具体采用miRNA-215前体序列中的AT插入突变作为中国地方猪品种大肠杆菌抗性的分子标记及方法与应用。
实现上述目的的技术解决方案是:
检测该分子标记的方法包括待测样本的猪基因组DNA的提取及整个miRNA-215前体序列的PCR扩增,miRNA-215前体序列的PCR经SSCP分析,当待测猪个体基因型为BB型(出现4条带中间的第2和第3这2条带,在miR-215前体序列6bp处存在2个碱基(AT)的插入突变),则为大肠杆菌抗性强的个体。
其中,待测样本选择梅山猪或/和东串猪,每个个体采取耳组织样约1.0g,放入1.5mL的离心管内,置-20℃存放。采用常规酚-氯仿法提取基因组DNA,超纯水溶解后用NanoDrop-1000微量核酸测定仪测定其浓度和纯度,根据其浓度用超纯水稀释成100mg/μL,-20℃保存备用。
miRNA-215前体序列的PCR扩增引物如SEQ ID NO.1和SEQ ID NO.2所示:
F:5’-CTGTTCAGTCGCTTTAGAAA-3’(SEQ ID NO.1);
R:5’-CATCTACCATTGTGTTGCTT-3’(SEQ ID NO.2)。
所述PCR扩增反应体系为20μL:基因组DNA(100ng/μL)1.0μL,PCR Master-Mix10.0μL,上下游引物(10pmol/L)各1.0μL,加ddH2O补足至20μL。反应条件为:95℃预变性5min,95℃变性30s,60℃退火30s,72℃延伸30s,35个循环,72℃延伸10min,最后4℃保存备用。
本发明为从遗传素质上永久性地提高中国地方猪品种断奶仔猪大肠杆菌抗性提供了有效的分子标记育种手段。
本发明与现有技术相比,其优点体现在:
1)本发明为中国地方猪品种大肠杆菌性腹泻抗病育种工作的分子标记辅助选择提供一个更加高效准确的分子遗传标记,为提高仔猪腹泻抗病力提供了一种有效的分子标记育种手段。用该遗传标记对猪大肠杆菌抗性进行标记辅助选择,开展抗病育种,提高猪的抗大肠杆菌侵染的能力,从根本上降低腹泻病的发病率。
2)使用该遗传标记进行分子选育,不仅加快育种进程,而且对于猪的免疫应答能力和一般抗病力没有任何不利的影响。
3)本发明的检测方法操作简单,费用较为低廉,准确度高,并可实现自动化的直接检测,本发明将在中国地方猪品种的抗病育种中发挥巨大作用。
附图说明
图1为miR-215PCR-SSCP带型(其中第1、3、4、6、7泳道为AA基因型;2泳道为BB基因型;5、8、9泳道为AB基因型)。
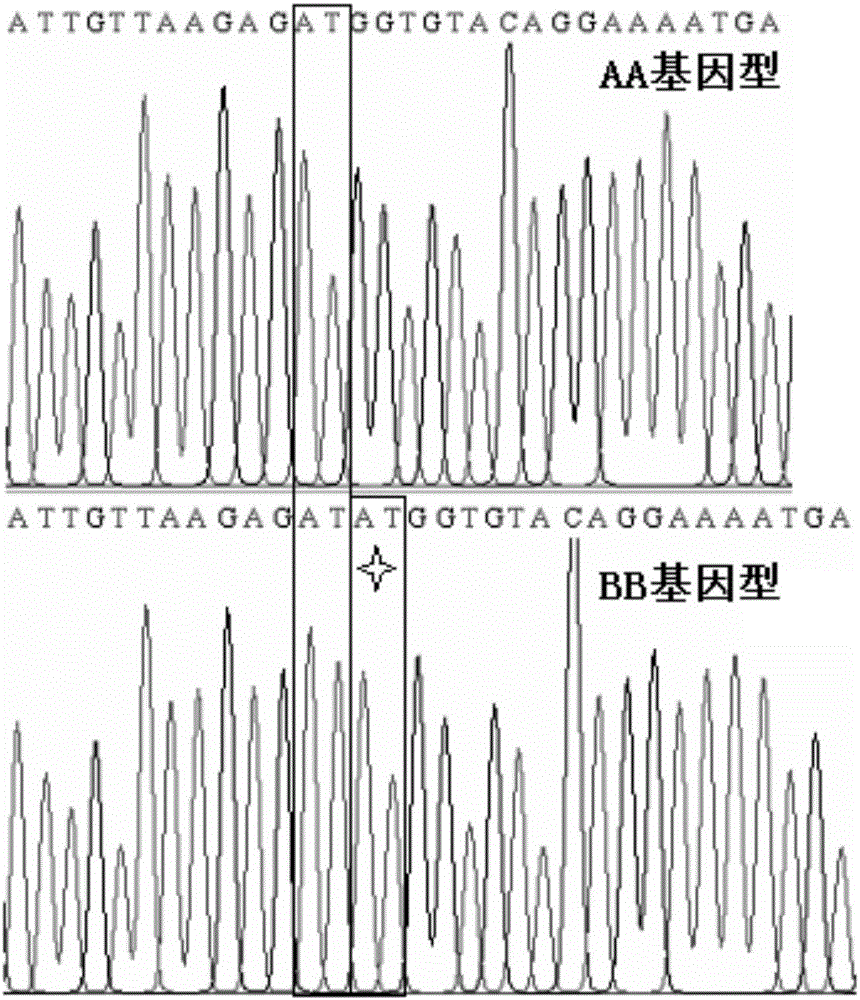
图2为miR-215前体序列插入突变测序峰图。
图3为大肠杆菌易感型判定结果(A:标准菌株107/86;B:rE.coli1534;C:pnirBMisL-fedF(照片均使用油镜镜头,以1000倍放大比例拍摄))。
图4为大肠杆菌抗性型判定结果(A:标准菌株107/86;B:rE.coli1534;C:pnirBMisL-fedF的能力丧失(照片均使用油镜镜头,以1000倍放大比例拍摄))。
具体实施方式
为了更好地理解本发明,下面通过具体的实施例来具体说明本发明的技术方案。
实施例1利用miRNA-215前体序列中的AT插入突变变异位点标记对地方猪品种梅山猪和东串猪核心群全面检测基因型
1实验材料与方法
1.1实验动物
梅山猪和东串猪分别来自昆山市梅山猪保种有限公司和南通华多种猪繁育有限公司(东串猪省级保种场)。
1.2DNA提取
每个个体采取耳组织样约1.0g,放入1.5mL的离心管内,置-20℃存放。采用常规酚-氯仿法提取基因组DNA,超纯水溶解后用NanoDrop-1000微量核酸测定仪测定其浓度和纯度,根据其浓度用超纯水稀释成100mg/μL,-20℃保存备用。
1.3PCR扩增
设计扩增片段包含整个miRNA前体序列的PCR引物,利用Primer Premier 5.0软件进行引物设计。miR-215扩增引物,上下游引物序列为:
F:5’-CTGTTCAGTCGCTTTAGAAA-3’(SEQ ID NO.1);
R:5’-CATCTACCATTGTGTTGCTT-3’(SEQ ID NO.2);
目的片段长度203bp。引物由上海生工生物工程有限公司合成。
以提取的基因组DNA为模板进行PCR扩增。扩增体系为20μL:基因组DNA(100ng/μL)1.0μL,PCR Master-Mix 10.0μL,上下游引物(10pmol/L)各1.0μL,加ddH2O补足至20μL。反应条件为:95℃预变性5min,95℃变性30s,60℃退火30s,72℃延伸30s,35个循环,72℃延伸10min,最后4℃保存备用。
1.4SSCP检测
取3μL PCR产物与3μL变性上样缓冲液(2×)混合,98℃变性15min,立即冰浴15min,经12%聚丙烯酰胺凝胶(丙烯酰胺:甲叉双丙烯酰胺=29:1)110V电泳12h,利用0.1%AgNO3进行银染,1.5%NaOH(含体积比1‰的甲醛)显色。
根据PCR-SSCP检测结果,选取不同基因型个体交由上海生工生物工程技术服务有限公司ABI PRISM 377 DNA自动测序仪进行双向测序分析。
PCR-SSCP结果发现,miRNA-215前体序列检测到3种基因型,分别定义为AA、AB、BB(出现4条带的为AB型,出现4条带中间的第2和第3这2条带的为BB型,出现4条带中间的第1和第4这2条带的为AA型)(图1)经直接测序确定BB型在miR-215前体序列6bp处存在2个碱基(AT)的插入突变(图2)。
对miR-215前体序列插入突变位点基因型进行统计,结果如表1所示。在东串猪中AA基因型82头,BB基因型24头,AB基因型44头,基因型频率分别为0.547、0.160、0.293,A、B等位基因频率分别为0.693、0.307;梅山猪中AA基因型82头,BB基因型16头,AB基因型20头,基因型频率分别为0.695、0.136、0.169,A、B等位基因频率分别为0.780、0.220。东串猪和梅山猪基因型分布相同,均为AA型最多,AB型次之,BB型最少。该突变位点在所检测2个群体中基因型分布不符合哈代温伯格平衡。
表1插入突变等位基因及基因型频率
注:χ20.05(1)=3.841,χ20.01(1)=6.635
Note:χ20.05(1)=3.841,χ20.01(1)=6.635
实施例2仔猪小肠上皮细胞的黏附试验确定个体大肠杆菌F18菌株抗性/易感性
在仔猪断奶前后,也是最易感染大肠杆菌F18菌株而表现出腹泻症状的35日龄阶段屠宰取十二指肠、空肠肠段15cm用于小肠上皮细胞的制备,
产F18ab菌毛标准菌株107/86(O139:K12:H1)由美国宾夕法尼亚大学兽医学院微生物实验室惠赠。能诱导表达F18ac菌毛含fed操纵子全基因的重组大肠菌rE.coli1534由本实验室构建并保存,能表面分泌表达F18ab菌毛FedF亚单位的重组大肠杆菌pnirBMisL-fedF也由本实验室构建。将厌氧诱导的细菌用PBS反复离心洗涤3次,调整细菌浓度至约1×109CFU/ml。分别取上述野生菌或诱导表达的重组菌菌液0.5ml,在其中添加终浓度为1%甘露糖于37℃作用30min后和0.5ml小肠上皮细胞混合,再于37℃孵育30min,1000r/min离心5min,用PBR溶液悬浮后取50μl滴于洁净玻片上,自然干燥,火焰固定,用美兰染色3-5min,油镜观察结果。
断奶仔猪的小肠上皮细胞如均能与表达F18ab菌毛标准菌株107/86、诱导表达的重组大肠杆菌rE.coli1534及诱导表达的重组大肠杆菌pnirBMisL-fedF发生黏附作用(图3),将其定义为大肠杆菌F18菌株敏感型;而如仔猪小肠上皮细胞对上述三株大肠杆菌的黏附能力几乎为零(图4),则将其定义为抗性型。
实施例3miRNA-215前体序列中的AT插入突变与F18大肠杆菌抗性的关系分析及抗性标记的确定
对梅山猪和东串猪miRNA-215前体序列3种基因型个体大肠杆菌F18菌株抗性/易感性进行分析,东串猪和梅山猪3种基因型个体大肠杆菌F18菌株抗性/易感性的频率分别见表2和表3;可见,东串猪BB基因型中大肠杆菌F18菌株抗性型个体的频率为91.7%,显著或极显著地高于AB基因型(41.7%)和AA基因型(16.7%)的个体。梅山猪BB基因型中大肠杆菌F18菌株抗性型个体的频率为87.5%,显著或极显著地高于AB基因型(31.5%)和AA基因型(18.8%)的个体。无论是东串猪还是梅山猪,均可以将miRNA-215前体序列中的AT插入突变基因型BB基因型确定为抗大肠杆菌的分子遗传标记。
表2东串猪miRNA-215前体序列3种基因型个体大肠杆菌F18菌株抗性/易感性的频率表
表3梅山猪miRNA-215前体序列3种基因型个体大肠杆菌F18菌株抗性/易感性的频率表
实施例4猪一般抗病力指标(重要细胞因子)的测定
利用猪多细胞因子检测试剂盒(Procarta Immunoassay Kits)(Affymetrix,USA)对上述样本血清中部分重要细胞因子(IL-2、IL-4、IL-6、IL-10、IL-12、IFN-α、IFN-β、IFN-γ)水平进行测定,具体操作步骤严格按照说明书进行。
实施例5miRNA-215前体序列中的AT插入突变及其与一般抗病力指标间的关系分析
分别测定了苏太猪和梅山猪不同基因型样本血清中部分重要细胞因子(IL-2、IL-4、IL-6、IL-10、IL-12、IFN-α、IFN-β、IFN-γ)的表达水平。显著性关联分析表明(表4和表5)。
表4东串猪插入突变不同基因型免疫因子水平
表5梅山猪插入突变不同基因型免疫因子水平
在动物抗病育种过程中,大部分的研究只是注重于一种或几种疾病的抗性筛选,而忽略了机体的整体免疫力。机体的免疫系统是由中枢淋巴器官、外周淋巴器官、免疫细胞和免疫分子组成,所涉及的基因数量众多,各个基因的表达水平会随着机体内环境的变化而变化。因此我们在对遗传变异筛选的同时,对机体部分重要细胞免疫因子的水平进行了测定。关联分析显示,梅山猪和东串猪不同基因型个体间部分细胞免疫因子(IL-2、IL-4、IL-6、IL-10、IL-12、IFN-α、IFN-β、IFN-γ)水平均不存在显著性差异。这一方面由于本实验所涉及的个体均处于健康状态,未受到外界病原菌的干扰,因此各个免疫指标水平也均处在正常范围之内;另一方面进一步推测miR-215主要通过靶向重要的抗性基因调控F18大肠杆菌的抗性,因此miR-215前体突变并没有影响到机体的一般免疫力,进一步表明了其作为抗大肠杆菌病遗传标记的可行性。
- 还没有人留言评论。精彩留言会获得点赞!