用于捕获血液病相关基因的基因捕获试剂盒的制作方法
本发明属于分子体外诊断领域,具体涉及特别适用于血液病相关基因特定的结构变异的体外诊断的基因捕获试剂盒。
背景技术:
血液病作为非实体瘤,其基因相关研究在癌症中处于领先定位,血液病相关基因的检测也是最早进入临床应用的。近年来,由于分子生物学技术的发展,对血液病细胞分子遗传学改变的了解也不断深入。迄今报道血液病涉及至少数十种融合基因。已经认识到大部分的血液病中存在着染色体结构畸变,包括缺失、重复、倒位、易位等,导致原癌基因及抑癌基因结构变异,原癌基因激活或抑癌基因失活,产生新的融合基因,编码融合蛋白。有些基因是调控细胞增殖、分化和凋亡的转录因子,当基因发生变异,直接影响了下游信号传递途径,导致细胞增殖能力增强、凋亡障碍、分化障碍等,产生血液病表型。随着血液病致病机理研究的深入和基因检测技术的发展,血液病的遗传物质改变研究经历了染色体核型分析(细胞遗传学)检测,融合基因基因检测到点突变和微小缺失重复检测。这三种不同维度的检测,逐步成为血液病诊治的依据和参考。
新一代高通量快速基因测序技术是国际上近十年发展起来的新技术,对于研究人类某些疾病的科学家来说,他们感兴趣的往往只是很小部分的基因组区域,因此选择性地对这些区域进行测序,将使测序总成本显著降低同时也能缩短测序时间。序列捕获技术是一种对基因组特定区域进行选择性富集的技术,其通过合适的方法将感兴趣的区域从基因组中分离出来,然后再对该目标区域进行测序,目标区域测序技术可以快速、全面地检测出目标基因突变。
基于杂交的序列捕获技术是目前在第二代测序平台中使用较多的序列富集方法,主要分为固相芯片杂交和液相杂交两种。液相杂交技术是制备杂交探针库,对目标基因进行富集,液相杂交在动力学上相对固相杂交更具优势,能降低对于样品起始量要求。
基因的拷贝数变异(Copy Number Variation,CNV)是一类在临床上非常重要的结构变异,与血液病的诊断、预后、靶向药物的敏感性相关。可靠的CNV检测结果可以为诊断、临床用药以及病情评估等提供十分重要的依据。
基于新一代测序(Next-Generation Sequencing,NGS)平台的CNV检测,可以在保证检测性能的前提下一次性给出多个基因的CNV检测结果,同时对于低纯度肿瘤样本有更好的检测效果。
传统的基于NGS平台的CNV检测使用全基因组低深度测序数据。随着NGS技术的不断进步,基于目标区域捕获的高深度测序技术在临床检测的应用场景下逐渐表现出优势。
对于基于NGS平台的CNV检测而言,需要在后期的数据处理中引入背景数据库。这种引入背景数据库的数据处理方式存在下述缺点:1.背景数据库一般获得自健康正常人的目标基因测序数据,需要单独建立,成本高;2.背景数据库受建立时的实验条件、测序平台的影响大,如何确保获得目标基因测序数据时的实验条件、测序平台与建立背景数据库时的实验条件、测序平台的一致性是一个难题;3.对于全基因组测序这种偏好性相对较小的数据而言,背景库的建立过于繁琐。
技术实现要素:
鉴于上述现有技术中存在的不足,本发明的目的在于提供一种新的基因捕获试剂盒,如果在基于基因捕获测序的血液病相关基因的CNV检测中,使用该基因捕获试剂盒进行基因捕获,则即使在后期的数据处理中不使用背景数据库的情况下,仍能够获得良好的检测结果。
本发明人为解决上述问题进行了深入研究,结果发现:通过在基于基因捕获测序的血液病相关基因的CNV检测中,使用包含针对内参基因的探针的基因捕获试剂盒,即使在后期的数据处理中不使用背景数据库的情况下,也能够获得良好的检测结果,从而完成了本发明。需要说明的是,在本说明书中,特定的结构变异是指基因拷贝数变异、大片段重排或部分串联重复。
即,本发明包括:
1.一种血液病相关基因的基因捕获试剂盒,其包括用于基因捕获的探针,所述用于基因捕获的探针包括:
针对血液病相关的目标基因的探针;以及
针对内参基因的探针;
其中,所述内参基因包括选自下组中的一个或两个以上:
ABL1基因的外显子4、
ABL2基因的外显子5、
CUX1基因的外显子1、
CUX1基因的外显子2、
CUX1基因的外显子3、
CUX1基因的外显子4、
CUX1基因的外显子5、
CUX1基因的外显子6、
CUX1基因的外显子7、
CUX1基因的外显子8、
CUX1基因的外显子9、
CUX1基因的外显子10、
CUX1基因的外显子11、
CUX1基因的外显子12、
CUX1基因的外显子13、
CUX1基因的外显子14、
CUX1基因的外显子15、
CUX1基因的外显子16、
CUX1基因的外显子17、
CUX1基因的外显子18、
CUX1基因的外显子19、
CUX1基因的外显子20、
CUX1基因的外显子21、
CUX1基因的外显子22、
CUX1基因的外显子23、
CUX1基因的外显子24、
CUX1基因的内含子2、
CUX1基因的内含子16、
CUX1基因的内含子17、
CUX1基因的内含子22、
CUX1基因的内含子23、
DNAH9基因的内含子52、
FBXW7基因的外显子8、
FBXW7基因的外显子9、
FBXW7基因的外显子10、
FBXW7基因的外显子11、
GNAS基因的外显子1、
GNAS基因的外显子8、
GNAS基因的外显子9、
NTRK2基因的外显子1、
NTRK2基因的外显子2、
NTRK2基因的外显子3、
NTRK2基因的外显子4、以及
NTRK2基因的外显子5。
2.根据项1所述的基因捕获试剂盒,其中,所述用于基因捕获的探针是生物素化的。
3.根据项1或2所述的基因捕获试剂盒,其中,该基因捕获试剂盒还包括链霉亲和素标记的磁珠。
4.根据项1~3中任一项所述的基因捕获试剂盒,其中,该基因捕获试剂盒还包括用于阻断非特异性杂交的DNA片段。
5.根据项1~4中任一项所述的基因捕获试剂盒,其中,该基因捕获试剂盒还包括用于提供杂交捕获反应的离子环境的缓冲液。
6.根据项1~5中任一项所述的基因捕获试剂盒,其中,该基因捕获试剂盒还包括用于洗脱物理吸附或非特异性杂交的清洗液。
7.根据项1~6中任一项所述的基因捕获试剂盒,其中,该基因捕获试剂盒还包括用于对捕获到的目标基因和/或内参基因进行扩增的引物。
8.根据项1~7中任一项所述的基因捕获试剂盒,其中,该基因捕获试剂盒用于在血液病相关基因的基因捕获测序中进行基因捕获;优选地,所述基因捕获测序用于检测血液病相关基因的基因拷贝数变异、大片段重排或部分串联重复。
9.一种血液病相关基因的基因捕获方法,其使用项1~8中任一项所述的基因捕获试剂盒进行基因捕获。
10.一种用于血液病相关基因的基因拷贝数变异、大片段重排或部分串联重复检测的二代测序DNA文库的构建方法,其包括:对DNA文库中的血液病相关的目标基因和内参基因进行基因捕获的步骤,其中,所述基因捕获使用项1~8中任一项所述的基因捕获试剂盒进行。
根据本发明,在基于基因捕获测序的血液病相关基因的CNV检测中,即使在后期的数据处理中不使用背景数据库的情况下,也能够获得良好的检测结果。
附图说明
图1显示在实施例1的数据处理步骤中,采用A方案的数据处理结果的图。
图2显示在实施例1的数据处理步骤中,采用B方案的数据处理结果的图。
发明的具体实施方式
本说明书中提及的科技术语具有与本领域技术人员通常理解的含义相同的含义,如有冲突以本说明书中的定义为准。
首先,在一个方面,本发明提供一种血液病相关基因的基因捕获试剂盒(本发明的基因捕获试剂盒),其包括用于基因捕获的探针,所述用于基因捕获的探针包括:针对血液病相关的目标基因的探针、以及针对内参基因的探针。
在本说明书中,基因捕获是指:基于核苷酸序列之间的互补配对原理,利用带有标记(例如生物素)的寡核苷酸探针调取一个或多个目的基因,并通过链霉亲和素磁珠将目的基因从基因文库中分离出来。
在本说明书中,寡核苷酸、多核苷酸与核酸三者可以互换使用,构成上述三者的基本单元均是核苷酸(包括核糖核苷酸和/或脱氧核糖核苷酸)。
在本说明书中,目标基因是指:可反映目标疾病状态、指导目标疾病用药和/或预测预后的基因。通常认为,在罹患目标疾病的患者中,该基因具有拷贝数变异。例如,在所述目标疾病为癌症的情况下,所述目标基因可以是在癌症中可能发生拷贝数变异的基因。
作为目标基因,因不同的目标疾病而异,通常是不同的。所述目标疾病可以是例如:血液病(例如白血病)或实体癌(例如胃癌、乳腺、结肠直肠癌、肺癌等)。
在本发明中,所述目标疾病是血液病。在本说明书中,血液病相关基因,血液病相关的目标基因是指:可用作诊断血液病、指导血液病用药和/或预测血液病预后的基因。通常认为,在罹患血液病的患者中,该基因具有特定的结构变异。例如,该基因可以是MLL基因。
在本说明书中,内参基因是指:不能用作检测目标疾病的基因、但可用作参照,提供背景数据信息的染色体DNA区域或基因。内参基因是人类基因组上拷贝数相对稳定的基因或区域,其是一段高度保守、且不具有特定的结构变异的DNA序列。通常认为,无论是在健康正常人中,还是在目标疾病的患者中,该基因都不具有特定的结构变异。
所述内参基因可以是选自下组中的一个或两个以上:
除了针对目标基因的探针和针对内参基因的探针以外,所述用于基因捕获的探针还可以包括针对与目标疾病相关的其它基因的探针。与目标疾病相关的其它基因是指:在目标疾病中可能发生各种类型突变的基因,其可用作诊断目标疾病、指导目标疾病用药和/或预测预后的基因,但在罹患目标疾病的患者的患病细胞的基因组中,该基因的特定的结构变异不常见或不具备临床意义。
优选地,所述用于基因捕获的探针是生物素化的。这样,可以使用链霉亲和素标记的固相载体将捕获了目标基因后的探针分离出来,所述固相载体优选为磁珠。因此,优选地,本发明的基因捕获试剂盒还包括链霉亲和素标记的磁珠。
在基因捕获二代测序中,基因捕获的处理对象一般是通过PCR扩增得到的带有标签(Index)的DNA文库,该DNA文库中的DNA分子的末端通常带有接头序列。在进行基因捕获时,通常需要将该接头序列封闭。因此,优选地,本发明的基因捕获试剂盒中还包含用于封闭所述接头序列的寡核苷酸,其通常可以是PCR扩增得到的所述DNA文库时使用的上下游引物。
优选地,本发明的基因捕获试剂盒中还包含用于阻断非特异性杂交的DNA片段,其用于封闭基因组上的重复区域。所述用于阻断非特异性杂交的DNA片段可以是胎盘来源的DNA,其长度主要为50~300bp,并且富含重复的DNA序列,通常用于在微阵列筛选中阻断非特异型杂交,还能用于抑制重复DNA序列,可以采用例如罗氏的COT human DNA或者ThermoFisher公司的Human Cot-I DNA。
优选地,本发明的基因捕获试剂盒中还包含用于提供杂交捕获反应的离子环境的缓冲液。
优选地,本发明的基因捕获试剂盒中还包含用于洗脱物理吸附或非特异性杂交的清洗液,它们用于提高基因捕获的特异性。
优选地,本发明的基因捕获试剂盒中还包含该基因捕获试剂盒还包括用于对捕获到的目标基因和/或内参基因进行扩增的引物和/或PCR反应液。
优选地,本发明的基因捕获试剂盒中还包含对照品,其用作阳性对照和/或阴性对照。
本发明的基因捕获试剂盒中的各个组分优选独立地包装于容器中,但在不影响使用的前提下,也可以将其中的一些组分合并包装。
本发明的基因捕获试剂盒,可以用于在基因捕获测序中进行血液病相关基因的基因捕获。优选地,所述基因捕获测序可以用于检测血液病相关基因的特定的结构变异。
本发明的基因捕获试剂盒可用于构建基因捕获二代测序DNA文库,该基因捕获二代测序DNA文库可用于血液病相关基因的特定的结构变异检测。因此,在另一方面中,本发明提供一种用于血液病相关基因的特定的结构变异检测的二代测序DNA文库的构建方法(本发明的构建方法),其包括:对DNA文库中的血液病相关的目标基因和内参基因进行基因捕获的步骤,其中,所述基因捕获使用本发明的基因捕获试剂盒进行。将本发明的基因捕获试剂盒用于构建基因捕获二代测序DNA文库时,基因捕获、构建文库的操作可以采用本技术领域已知的操作。
一般而言,本发明的构建方法可以包括下述步骤:
步骤A:将希望进行测序的样本中的DNA片段进行末端修复,得到多组平末端DNA片段;
步骤B:将所述平末端DNA片段进行3′端加A,得到3′端加A的DNA片段;
步骤C:将所述3′端加A的DNA片段进行加接头,得到加接头DNA片段;
步骤D:将所述加接头DNA进行PCR扩增,得到扩增产物(例如带有标签的DNA文库);
步骤E:以所述扩增产物作为对象,使用本发明的基因捕获试剂盒进行基因捕获,并对捕获到的基因(包括目标基因和内参基因,视情况还可以包括与目标疾病相关的其它基因)进行PCR扩增,得到捕获基因文库。
所述样本可以选自血液、脑脊液、胸腹水、组织或FFPE样本。所述样本中的DNA片段例如可以是循环肿瘤DNA(ctDNA)。所述样本可以是一个,也可以是多个,例如2个以上,再例如5个以上,再例如10个以上。
所述捕获基因文库可以经质检后上机测序,从而得到测序数据。测序平台可以是例如用Illumina HiSeq 2500、4000平台或者NextSeq 550AR平台。
在对所述测序数据进行数据处理的过程中,传统上需要引入背景数据库。但是,如果构建基因捕获二代测序DNA文库的过程中,使用了本发明的基因捕获试剂盒进行基因捕获,则可以将获取的内参基因的测序数据作为背景,而无需引入背景数据库(当然,引入背景数据库也可以)。这种方式的优点包括:(1)无需单独建立背景数据库,节约了成本;(2)获得内参基因的测序数据时的实验条件、测序平台与获得目标基因的测序数据时的实验条件、测序平台完全一致。
因此,根据本发明,在基于基因捕获测序的CNV检测中,即使在后期的数据处理中不使用背景数据库(当然,也可以使用背景数据库)的情况下,也能够获得良好的检测结果。在本说明书中,“检测结果良好”是指:在基于基因捕获测序的CNV检测中,在使用本发明的基因捕获试剂盒进行基因捕获的情况下,通过将获取的内参基因的测序数据作为背景,所得检测结果与通过引入背景数据库而获得的检测结果一致。
实施例
以下通过实施例对本发明进行更具体的说明。应当理解,此处所描述的实施例是用于解释本发明,而非用于限定本发明。
实施例1
1.1血液病基因检测液体芯片的设计及合成
根据文献报道及多个数据库(NCBI-PDB、PubMed、COSMIC、Clinvar、HGMD、GeneCards、zj-LOVD等)的信息,选择了用于血液病检测的目标基因,其中,MLL基因在血液病患者中可能具有部分串联重复,其位于第11号染色体。探针针对特定疾病致病基因的外显子(或外显子前后两端200bp)或特定目标区域进行设计。设计好的探针与NCBI等数据库进行Blast比对,并且要确保探针的碱基个数在60~80nt之间、TM值适中、无回文序列等特殊结构、与序列同源性在50%~80%之间,通过这些数值以确保探针的特异性。
将设计出的探针序列合成为寡核苷酸探针,PCR验证后获得血液病相关基因捕获探针克隆库。
此外,将下述基因作为内参基因:ABL1、CUX1、DNAH9、FBXW7、GNAS、NTRK2、SMAD4和SYK,具体区域及在人类基因组中的位置请参见说明书中的描述。针对内参基因的探针的设计及合成与针对目标基因的探针的设计及合成相同。
利用生物素标记数量和位置确定的扩增引物或接头元件制备含有利于靶标片段抓取的捕获探针文库,最终得到已知生物素标记数量和位置的捕获探针集即带有生物素标记的捕获探针库。
1.2DNA提取
使用过膜法提取血液基因组DNA,具体步骤参照天根血液提取试剂盒步骤。
1.3末端修复(End Repair):
(1)预先从-20℃保存的试剂盒中取出所需试剂,将其置于冰盒上化冻并震荡混匀。
单个样本配制量参见表2,多样本可按比例配制Mix。
表2
(2)末端修复反应:向1.5mL的离心管中分装好25μL Mix,分装完成并确认加入无误后,加入DNA样本将1.5mL离心管置于Thermomixer中20℃温浴30分钟。反应结束后使用1.8×核酸纯化磁珠回收纯化反应体系中的DNA,溶于32μL EB。
1.4末端加“A”(A-Tailing)
(1)预先从-20℃保存的试剂盒中取出所需试剂,将其置于冰盒上化冻并震荡混匀。单个样本配制量参见表3,多样本可按比例配制Mix:
表3
(2)末端加“A”反应:向1.5mL的离心管中分装18μLMix,确认无误后,加入32μL上一步纯化回收的DNA。加完后震荡混匀并离心,将1.5mL离心管置于Thermomixer中37℃温浴30分钟。使用1.8×核酸纯化磁珠回收纯化反应体系中的DNA,溶于18μL EB中。
1.5接头的连接(Adapter Ligation)
(1)预先从-20℃保存的试剂盒中取出所需试剂,将其置于冰盒上化冻并震荡混匀。单个样本配制量参见表4,多样本可按比例配制Mix:
表4
(2)接头的连接反应:向1.5mL的离心管中分装27μL Mix,确认无误后,加入加入18μL上一步纯化回收的DNA。加完后震荡混匀并离心,将样本管置于Thermomixer中20℃温浴15分钟。使用1.8×核酸纯化磁珠回收纯化反应体系中的DNA,溶于30μL的EB中。
1.6PCR反应
(1)从-20℃保存的试剂盒中取出所需试剂,将其置于冰盒上化冻并震荡混匀。0.2mL的PCR管中配制PCR反应体系,多样本可按比例配制Mix:
表5
(2)设定PCR程序,PCR反应的程序设定如下:
反应结束及时将样品取出放入4℃冰箱保存并按要求退出或关闭仪器。
(3)用0.9×核酸纯化磁珠回收纯化反应体系中的DNA,纯化后的文库溶于20μL的ddH2O中。贴好标签,小片段文库建库完成。对文库进行Qubit检测,记录各个文库浓度大小。将文库送检安捷伦2100,保存峰图结果。
1.7准备杂交文库
(1)本实验中,用于提供杂交捕获反应的离子环境的缓冲液、以及用于洗脱物理吸附或非特异性杂交的清洗液、漂洗液均购自Roche公司。
(2)准备杂交文库:将待杂交的DNA文库在冰上融化,取总质量1μg(在后续操作步骤中将此DNA文库称为样本文库)。
(3)制备Ann引物Pool:将样本文库Index对应的标签引物In1(100μM)及公共引物(1000μM)置于冰上融化,各各取1000pmol混合混合,(在后续操作步骤中将此混合物称为Ann引物pool)。
(4)杂交样本的制备:向1.5mL EP管中加入5μL COT DNA(Human Cot-1DNA,Life technologies,1mg/mL)以及1μg样本文库。向混合物中加入Ann引物pool。用封口膜密封制备好的杂交样本EP管,调节真空干燥仪的温度至50~60℃,将盛有样本文库pool/COT DNA/Ann引物pool的EP管置于真空装置中直到完全干燥。
(5)杂交样本的溶液:向样本文库pool/COT DNA/Ann引物pool的干粉中加入:
7.5μL 2×杂交缓冲液
3μL杂交组分A
至此,EP管中含有以下组分:
1.8准备杂交文库
(1)将加入杂交缓冲液的上述混合物涡旋震荡10秒,充分混匀后最大转速离心10秒。
(2)将上述混合物置于预先准备好的95℃加热模块上变性10分钟。取下变性后的混合物,室温下最大转数离心10秒。
(3)将上述混合物转移至含有4.5μL捕获芯片的0.2mL平盖PCR管中。涡旋震荡3秒,充分混匀后最大转数离心10秒。至此,杂交样品混合物中含有如下组分:
(4)将杂交样品混合物置于47℃加热模块上16小时。加热模块的热盖温度需设定为57℃,杂交后产物需进行后续洗脱回收操作。
(5)将10×清洗液(I,II与III)、10×漂洗液和2.5×磁珠清洗液配置成1×工作液。
表8
(6)将下列试剂在47℃加热模块中预热:
400μL 1×漂洗液
100μL 1×清洗液I
1.9制备亲和吸附磁珠
(1)实验开始前,将链霉亲和素磁珠(Dynabeads M-280Streptavidin,以下简称磁珠)在室温下平衡30分钟后,将磁珠充分涡旋混匀15秒。
(2)向1.5mL离心管中分装100μL磁珠,1个1.5mL离心管最多可用来制备6个杂交捕获所需的磁珠。
(3)将盛有磁珠的离心管置于磁力架上,约5分钟后小心吸弃上清,将磁珠留在离心管中,加两倍于磁珠初始体积的1×磁珠清洗液。将离心管从磁力架上取下,涡旋混匀10秒。将盛有磁珠的离心管放回磁力架,吸附磁珠。待溶液澄清,吸弃上清。重复次步骤,共洗涤两次。
(4)洗涤完毕后吸弃磁珠清洗液,用磁珠初始体积的1×磁珠清洗液涡旋重悬磁珠。将重悬的100μL磁珠转入0.2mL的PCR管中。将PCR管置于磁力架上吸附磁珠,溶液澄清后吸弃上清。至此,捕获DNA所需的亲和吸附磁珠制备完毕,应立即进行下步结合反应。
1.10DNA与亲和吸附磁珠的结合及漂洗
(1)将杂交的样本文库转入盛有亲和吸附磁珠的0.2mL PCR管中,吸打10次,将二者混匀。
(2)将0.2mL PCR管置于47℃加热模块45分钟,每隔15分钟涡旋混匀一次,使DNA与磁珠结合。
(3)45分钟孵育后,向15μL捕获的DNA样本中加入47℃预热的1×清洗液I 100μL。涡旋混匀10秒。将0.2mL PCR管中的全部组分转入1.5mL离心管中。将1.5mL离心管置于磁力架上吸附磁珠,弃上清。
(4)将1.5mL离心管从磁力架上取下,加入200μL预热47℃的1×漂洗液。吸打混匀10次(需迅速操作,防止试剂、样品温度低于47℃)。混匀后样本置于47℃加热模块上5分钟。重复此步骤,用47℃的1×漂洗液共洗涤两次。将1.5mL的离心管置于磁力架上,吸附磁珠,弃上清。
(5)向上述1.5mL离心管中加入200μL室温的1×清洗液I,涡旋混匀2分钟。将离心管置于磁力架上,吸附磁珠,弃上清。向上述1.5mL离心管中加入200μL室温的1×清洗液II,涡旋混匀1分钟。将离心管置于磁力架上,吸附磁珠,弃上清。向上述1.5mL离心管中加入200μL室温的1×清洗液III,涡旋混匀30秒。将离心管置于磁力架上,吸附磁珠,弃上清。
(6)1.5mL离心管从磁力架上取下,加入45μL PCR水,溶解洗脱磁珠捕获样本。将磁珠-样本混合物放在-20℃保存。
1.11捕获DNA的PCR扩增
(1)按下表制备捕获后PCR mix,制备好后涡旋震荡混匀。余下的磁珠吸附DNA放在-20℃保存。富集引物F和富集引物R均购自英潍捷基公司。
(2)磁珠吸附DNA PCR的扩增程序设定如下:
(3)杂交捕获DNA PCR产物的回收纯化:用核酸纯化磁珠回收纯化反应体系中的DNA,磁珠使用量为0.9×,纯化后的文库溶于30μL的ddH2O中。贴好标签,杂家捕获文库建库完成。
1.12文库定量
对文库进行2100Bioanalyzer(Agilent)/LabChip GX(Caliper)及QPCR检测,记录文库浓度。
1.13文库上机测序
构建好的文库用Illumina NextSeq 550AR进行测序。
1.14数据处理及分析
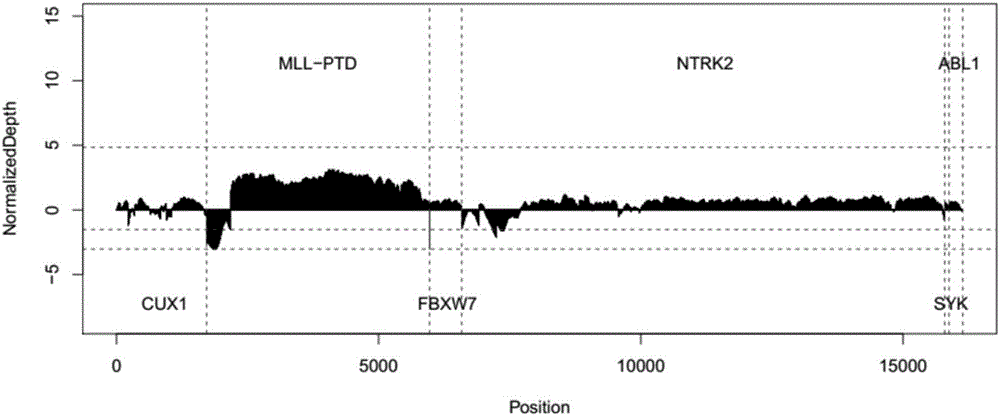
将NGS测序数据,采用常规的比对算法获得深度信息,并通过对待检测区域的深度信息进行分析得到CNV检测结果。A方案:引入另行建立的背景数据库作为背景;B方案:不引入背景数据库,而是将获得的内参基因的测序数据作为背景。
采用上述A方案和方案B的数据分析结果分别如图1和图2所示。
图1和图2的数据分析结果均显示该样本中MLL基因具有部分串联重复。
A方案使用了背景库,由图1可知,横轴为人参考基因组(hg19)坐标,纵轴为经过均一化处理的深度信号值。一般认为该信号值在0附近波动为正常。图1中标记MLL-PTD的区域为待检测区域:可以看到,待检测区域的深度信号值已明显偏离了0附近的区域,故该结果被认为MLL-PTD阳性。
B方案没有使用背景库,而是将内参基因或其部分区域作为检测过程中的参考标准。由图2可知,横轴为人参考基因组(hg19)坐标,纵轴为经过均一化处理的深度信号值。一般认为该信号值在0附近波动为正常。
图2中除被标记为MLL-PTD的区域以外,均为内参基因或其部分区域。可以看到:其深度信号值均在0附近波动,即,内参基因或其部分区域一般被认为不存在特定的基因结构变异。
图2中被标记为MLL-PTD的区域为待检测区域:可以看到,其深度信号值已经显著偏离0附近,与内参基因区域的深度信号值差异显著,故该检测结果被认为是MLL-PTD阳性。
本实施例通过将内参基因的测序数据作为背景,即使在不引入背景数据库的情况下,仍能够获得良好的检测结果。
公共引物序列:
5′-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT-3′
标签引物In1引物序列:
5′-CAAGCAGAAGACGGCATACGAGATTAGAGCTAGTGACTGGAGTTCAGACGTGTGCTCTTCCGATCT-3′
工业实用性
根据本发明,能够提供一种特别适于在基因捕获测序中作为基因捕获工具的基因捕获试剂盒。
- 还没有人留言评论。精彩留言会获得点赞!