一种鲁氏不动杆菌的检测引物及荧光定量PCR检测方法与流程
本发明属于生物工程技术领域,具体涉及一种鲁氏不动杆菌的实时荧光定量PCR检测方法。
背景技术:
鲁氏不动杆菌(Acinetobacter lwoffii)广泛存在于自然界中,主要在水和土壤中,在牛奶、奶制品、家禽及冷冻食品中亦可检出本菌。鲁氏不动杆菌是重要的机会致病菌,常引发败血症,肺炎,心内膜炎等[1],此外,鲁氏不动杆菌可产生耐热的蛋白酶和脂肪酶破坏食品成分,热杀菌处理可以破坏鲁氏不动杆菌,但这些耐热酶的活性基本不受影响,甚至经过超高温杀菌处理后仍能保持部分活性,它们在食品贮藏的过程中将继续分解蛋白质和脂肪,从而导致产品发生变化,最终对食品品质产生不良影响:(1)蛋白酶分解乳蛋白将导致产品发苦,水解过程中释放的氨基酸会使褐变反应加剧;(2)蛋白酶分解酪蛋白会引起蛋白胶凝化;(3)脂肪酶分解脂肪球膜,将释放出自由脂肪酸,导致脂肪聚合上浮,产生一系列的风味缺陷,例如乳酪味、鱼味、麦芽味、腐烂味、肥皂味、不洁味或酵母味等等[2]。由此可见,鲁氏不动杆菌是影响食品工业发展的重要因素之一,快速、准确地检测食品中鲁氏不动杆菌含量对提高乳制品品质,加强企业经济效益有战略意义。
常规测定原料乳中鲁氏不动杆菌的方法是利用培养基分离鉴定,或者通过普通的PCR方法进行检测。其中,培养基分离鉴定法在实际操作中非常繁琐,且容易受到环境中杂菌的污染:而普通PCR方法相较于传统的分离鉴定检测法,虽然较为灵敏快捷,但是对鲁氏不动杆菌在菌液中的含量以及杂菌数量等方面要求较为严格,且有可能出现假阳性与假阴性等结果,使筛选出的食品污染程度出现偏差。近年来,实时荧光定量PCR技术因具有特异性强、灵敏度高、快速和应用范围广等特点,已经成功应用于食品中的微生物检测[3]。
研究发现细菌基因组内的某些序列具有高度的保守性,这些高度保守的基因序列为生物的科、属、种的鉴定提供了基础[4]。因此,可根据保守序列设计特异的PCR引物来对食品中的微生物进行检测。关晶岩[5]等根据假单胞菌属的16S rRNA基因序列设计引物,建立了荧光定量PCR检测原料乳中假单胞菌的方法,研究结果表明,该法可在10h内快速、稳定地检出原料乳中的假单胞菌,检测限低于103cfu/mL。Martins[6]等借助PCR技术检测乳中携带apr基因的假单胞菌,apr基因可编码一种碱性金属蛋白酶,结果显示在人为污染的牛奶中假单胞菌的最低检出限是105cfu/mL。研究发现,鲁氏不动杆菌的β-内酰胺酶基因可作为特异性识别序列[7]。
参考文献
[1]明德松,潘艳萍,朱炎.鲁氏不动杆菌的临床分布及耐药性分析[J].中华医院感染学杂志,2014,24(10):2351-2353.
[2]Samarzija D,Zamberlin S,Pogacic T.Psychrotrophic bacteria and their negative effects on milk and dairy products quality[J].Mljekarstvo,2012,62(2):77-95.
[3]朱萍,李楠,任婧.牛乳中嗜冷菌危害及其检测方法研究进展[J].食品安全质量检测学报,2014,5(10):3142-3148.
[4]Vithanage NR,Yeager TR,Jadhav SR et al.Comparison of identification systems for psychrotrophic bacteria isolated from raw bovine milk[J].International Journal of Food Microbiology,2014,189:26-38.
[5]关晶岩,赵新淮.原料乳样品中嗜冷菌快速PCR计数方法研究[J].食品工业,2009,5:63-66.
[6]Martins ML,de Araujo EF,Mantovani HC et al.Detection of the apr gene in proteolytic psychrotrophic bacteria isolated from refrigerated raw milk[J].International Journal of Food Microbiology,2005,102(2):203-211.
[7]Turton JF.,Hyde R,Martin K,et al.Genes encoding OXA-134-like enzymes are found in Acinetobacter lwoffii and A.schindleri and can be used for identification[J].Journal of Clinical Microbiology,2012,50(3):1019-1022.
技术实现要素:
本发明的目的在于提供一种鲁氏不动杆菌荧光定量PCR引物及检测方法,以灵敏度高、特异性强、快速准确地定量检测食品中的鲁氏不动杆菌,如原料乳中、乳制品中的鲁氏不动杆菌,为食品厂在生产上有效控制鲁氏不动杆菌的数量,减少其对产品品质的危害,提高产品质量提供理论依据,对保障食品安全具有重要意义。本发明的基本原理是,通过基因组比对,寻找鲁氏不动杆菌中的特异性识别序列,以此设计引物,进行荧光定量PCR检测食品中的鲁氏不动杆菌。采用SYBR GreenⅠ嵌合荧光法进行检测,灵敏度及特异性好。
为了实现以上目的,本发明的技术方案如下:
本发明提供了一种鲁氏不动杆菌荧光定量PCR检测引物,其核苷酸序列如下:
AL-F:TTATTTGATCAGGCGCAAAG,
AL-R:CGTTTCTTGCCATCCCATTTA。
本发明提供了一种鲁氏不动杆菌荧光定量PCR检测方法,包括以下步骤:
1)提取待测样品中的DNA;
2)以步骤1)中提取的DNA为模板,采用荧光定量PCR方法扩增鲁氏不动杆菌,其中所使用的引物的核苷酸序列如下:
AL-F:TTATTTGATCAGGCGCAAAG,
AL-R:CGTTTCTTGCCATCCCATTTA;
在55℃退火阶段收集荧光值,即Ct样品值,并在上述扩增条件后增加60℃至95℃的融解曲线分析,以确定产物是否单一,进而反映引物的特异性;
可选地,所述的荧光定量PCR方法中使用的荧光染料为SYBR Green I。
3)标准曲线的绘制与检测结果判定:根据所选用的模式细菌在其浓度为×102、×103、×104、×105、×106、×107时对应的Ct标准值,建立鲁氏不动杆菌的细菌数lg标准(cfu/mL)与Ct标准值的标准曲线,并且将步骤2)所得的待测样本Ct样品值,在标准曲线上确定样品中的鲁氏不动杆菌的数量。
可选地,上述检测方法具体包括以下步骤:
1)提取待测样品中的DNA;
2)以步骤1)中提取的DNA为模板,采用基于SYBR Green I的荧光定量PCR方法扩增鲁氏不动杆菌,其中所使用的引物的核苷酸序列如下:
AL-F:TTATTTGATCAGGCGCAAAG,
AL-R:CGTTTCTTGCCATCCCATTTA;
在55℃退火阶段收集荧光值,即Ct样品值,并在上述扩增条件后增加60℃至95℃的融解曲线分析;
进一步地,当使用SYBR Green I荧光定量测试方法时,所述的PCR扩增反应体系为20μL:SYBR Premix Ex TaqⅡ10μL,AL-F 0.8μL,AL-R 0.8μL,DNA模板2.0μL,ddH2O 6.0μL,Rox Reference DyeⅡ0.4μL;
进一步地,所述的荧光定量PCR方法中,PCR反应条件为:95℃30s;95℃5s,55℃34s,40个循环;
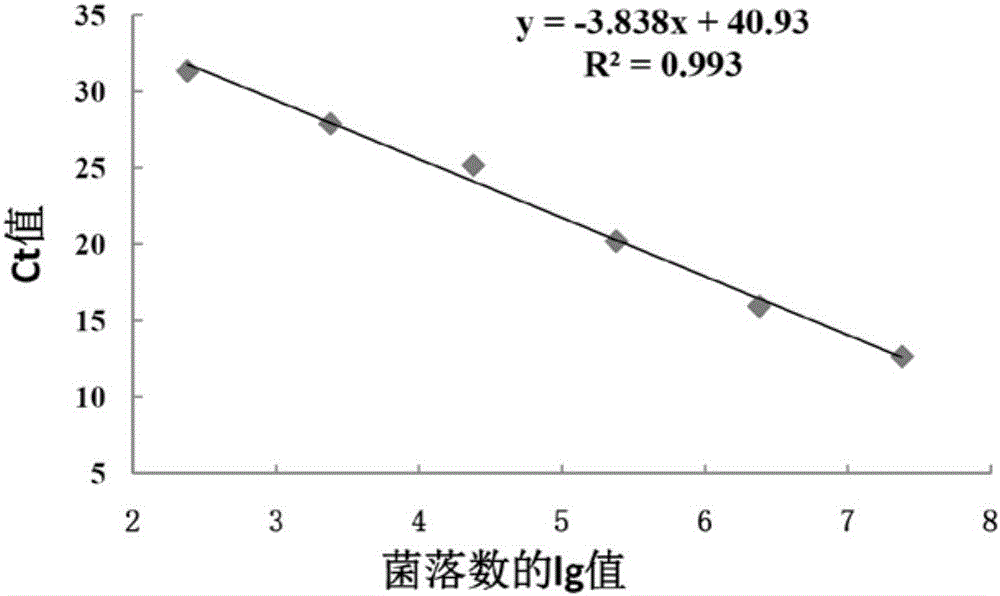
3)标准曲线的绘制:选用A.lwoffii ATCC1530为模式细菌,根据其浓度为2.4×102、2.4×103、2.4×104、2.4×105、2.4×106、2.4×107时对应的Ct标准值,建立鲁氏不动杆菌的细菌数lg标准(cfu/mL)与Ct标准值的标准曲线为y=-3.838x+40.93,R2=0.993;
4)检测结果判定:将步骤2)所得的待测样本Ct样品值,在标准曲线上确定样品中的鲁氏不动杆菌的数量。
本发明还提供了上述鲁氏不动杆菌荧光定量PCR检测引物,以及鲁氏不动杆菌荧光定量PCR检测方法在检测食品鲁氏不动杆菌方面的应用。
本发明的技术方案达到的有益效果是:
1)本发明根据不动杆菌属微生物的基因组比对,确定OXA134家族的β-内酰胺酶基因作为鲁氏不动杆菌的特异性保守基因序列,以此设计一对特异性引物,成功建立了鲁氏不动杆菌的荧光定量PCR检测方法。该方法特异性强,对食品中常见的微生物均检测不到荧光信号,仅对鲁氏不动杆菌检测为阳性,可以快速准确地检测食品中是否存在鲁氏不动杆菌,整个检测耗时短,与常规培养检测法相比大大提高了检测效率;
2)本发明的鲁氏不动杆菌的荧光定量PCR检测方法的灵敏度较高,其灵敏度可达到240cfu/mL,可用于食品中鲁氏不动杆菌的定量检测,对保障食品安全具有重要意义。
附图说明
图1是荧光定量PCR产物琼脂糖凝胶电泳。M:1000bp Marker,1.β-内酰胺酶基因PCR产物,2.Control。
图2是鲁氏不动杆菌荧光定量PCR扩增标准曲线。
图3是荧光定量PCR检测鲁氏不动杆菌β-内酰胺酶基因的敏感性实验。其中,1-7:2.4×107~2.4×101cfu/mL。
图4常规PCR检测鲁氏不动杆菌β-内酰胺酶基因的敏感性实验。其中,1-7:2.4×107~2.4×101cfu/mL。
图5是鲁氏不动杆菌β-内酰胺酶基因荧光定量PCR扩增特异性实验。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合附图及具体实施方式对本发明做进一步的介绍。
实施例1
1.引物的设计与合成:
通过比对鲁氏不动杆菌及其相近菌种的基因组序列,如鲍氏不动杆菌(Acinetobacter baumannii)、申氏不动杆菌(Acinetobacter schindleri)、溶血不动杆菌(Acinetobacter haemolyticus)等,找出鲁氏不动杆菌的种间特异性序列,然后将此序列进行BLAST比对,分析其与非不动杆菌属微生物的同源性,最终确定OXA134家族的β-内酰胺酶基因为鲁氏不动杆菌的特异性保守基因序列。根据此基因设计特异性引物进行分析。
设计引物时,首先根据A.lwoffii ATCC1530的β-内酰胺酶氨基酸序列(GenBank:WP_004728961),比对数据库中的各种鲁氏不动杆菌,A.lwoffii strain St17095(GenBank:AHA11126.1)、A.lwoffii AL3(GenBank:ADM47435.1)和A.lwoffii strain S459(GenBank:ALM26450.1),找出种间保守序列区段;再对该段氨基酸序列的编码区序列进行DNAMAN软件同源比对,设计引物AL-F和AL-R如下:
AL-F:TTATTTGATCAGGCGCAAAG,
AL-R:CGTTTCTTGCCATCCCATTTA。
2.通过A.lwoffii ATCC1530β-内酰胺酶基因序列的克隆,实现所设计引物的正确性的检测:
利用天根细菌基因组DNA提取试剂盒提取A.lwoffii ATCC1530的总DNA,使用上述引物序列AL-F和AL-R进行PCR扩增:
PCR扩增反应体系为20μL:SYBR Premix Ex TaqⅡ10μL;AL-F 0.8μL,AL-R 0.8μL;DNA模板2.0μL;ddH2O 6.0μL;Rox Reference DyeⅡ50x 0.4μL;
PCR反应条件为:95℃30s;95℃5s,55℃34s,40个循环;在55℃退火。
将所获得的PCR产物用1%琼脂糖凝胶电泳分析,结果(见图1)显示,扩增鲁氏不动杆菌β-内酰胺酶基因部分片段197bp。回收目的条带并与pUCm-T连接,转化JM109,鉴定正确后送上海生工测序。经测序分析发现,与拟克隆的基因序列一致,说明A.lwoffii ATCC15309β-内酰胺酶基因序列扩增正确。
3.荧光定量PCR标准曲线的绘制:
a)使用A.lwoffii ATCC1530为绘制荧光定量PCR标准曲线的模式细菌,它可代表其它鲁氏不动杆菌。将A.lwoffii ATCC1530在脑心浸液培养基(BHI)培养基中过夜培养,根据GB4789.2-2010食品微生物学检验--菌落总数测定中的方法定量菌液,经10倍梯度稀释,得到不同浓度菌液:2.4×101、2.4×102、2.4×103、2.4×104、2.4×105、2.4×106、2.4×107cfu/mL。
b)采用天根细菌基因组DNA提取试剂盒提取不同浓度菌液的基因组DNA;
c)使用SYBR Green I实时定量PCR试剂盒进行PCR扩增,扩增体系和反应条件如上面2中所述;此外,在55℃退火阶段收集荧光值,即Ct标准值,并在上述扩增条件后增加60℃至95℃的融解曲线分析,每个样本3个平行;
d)进行荧光定量PCR后得到每个浓度的Ct标准值,这个值对应荧光信号初次被检测到时的循环数,可以反映模板初始量,以细菌数的lg标准值和Ct标准值制作细菌悬液的标准曲线y=-3.838x+40.93,相关系数为0.993(图2),说明本发明建立的检测方法可以准确定量检测食品中的A.lwoffii;且其检测限为×102cfu/mL。
实施例2
在实施例2中,使用本发明提供的检测鲁氏不动杆菌的实时荧光定量PCR方法检测不同月份(11、12、1、2月)从江苏省扬州市8个奶牛场中取样的原料乳,以确定每个牧场的原料乳是否污染了鲁氏不动杆菌(A.lwoffii),以此监控每个牧场的奶源质量。
具体方法如下:
(1)提取待测原料乳样品中的DNA:
取1mL原料乳,12000g/min离心5min,弃上层脂肪,无菌生理盐水洗涤两次,12000g/min离心2min,然后采用专利《从牛奶中提取总DNA的方法》(专利申请号:200810115822.9)中的方法提取下层沉淀中的DNA。
(2)以步骤(1)中所提取的DNA为模板,荧光定量PCR扩增鲁氏不动杆菌β-内酰胺酶基因部分片段;
PCR扩增反应体系为20μL,包括:SYBR Premix Ex TaqⅡ10μL、上游引物AL-F 0.8μL、下游引物AL-R 0.8μL、DNA模板2.0μL、ddH2O 6.0μL和Rox Reference DyeⅡ0.4μL;其中,所述的上游引物AL-F与下游引物AL-R的核苷酸序列见实施例1的步骤1)引物的设计与合成。
PCR反应条件为:95℃30s;95℃5s,55℃34s,40个循环;在55℃退火阶段收集荧光值Ct样品,并在上述扩增条件后增加60℃至95℃的融解曲线分析。
(3)检测结果判定:参照实施例1中3d)所建立的鲁氏不动杆菌的细菌数lg标准(cfu/mL)与Ct标准值的标准曲线,确定细菌浓度为2.4×102、2.4×103、2.4×104、2.4×105、2.4×106、2.4×107时对应的Ct标准值。根据步骤(2)所得的待测样本Ct样品值,对照标准曲线(y=-3.838x+40.93,R2=0.993),确定原料乳中的鲁氏不动杆菌的数量。
在对32份原料乳样品进行的检测中,常规PCR并未检测出A.lwoffii阳性样品,而荧光定量PCR方法检测出A.lwoffii阳性样品2份,Ct值介于30-31之间,阳性率为6.25%。由此可见,本发明可用于原料乳中鲁氏不动杆菌的定量检测,对保障乳制品的安全具有重要意义。
实施例3
本实施例3中比较了本发明荧光定量PCR检测方法与常规PCR的敏感性。
以实例1中步骤4)所获得的不同浓度菌液的基因组DNA为模板,AL-F和AL-R为引物进行常规PCR扩增,其反应条件为:95℃3min,30个循环(95℃30s,55℃30s,72℃30s),72℃10min。由图4可见,常规PCR检测A.lwoffii的灵敏度是2.4×103cfu/mL;将其与图3所示的本发明荧光定量PCR检测的最低菌落数(2.4×102cfu/mL)相比,本发明的灵敏度明显高于普通PCR检测。
实施例4
本实施例4中,利用本发明提供的引物及荧光定量PCR方法(见实施例2)对8种乳中的常见微生物(阪崎肠杆菌、金黄色葡萄球菌、大肠杆菌、沙门氏菌、李斯特菌、粘质沙雷氏菌、荧光假单胞菌)进行扩增,并选取A.lwoffii ATCC1530作为阳性对照,检测本发明方法的特异性。
结果(见图5)显示只有A.lwoffii ATCC1530样品出现了较强的荧光信号,而其余8个样品未出现相应的荧光信号,由此可见本发明的特异性强。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用