一种3α,7α‑二羟基‑6α‑乙基胆烷酸的制备方法与流程
本发明属于药物合成技术领域,具体涉及一种3α,7α-二羟基-6α-乙基胆烷酸的制备方法。
背景技术:
法尼醇X受体(farnesoid X receptor,FXR)的命名来源于1995年的一项研究,结果表明:该受体可以被法尼醇及其中间产物所激活,FXR在相应配体、协同活化因子及激素的调控下,对胆汁酸代谢的多种酶和胆盐载体进行精密的调控。1999年,3个研究小组同时独立的发现胆汁酸(bile acids)在生理浓度下激活FXR,从而证明FXR是胆汁酸的受体。如鹅去氧胆酸(chenodexycholic acid,CDCA)是常用的一种FXR天然激动剂。
2002年,Pellicciari等报道了第一个合成的高活性甾体类FXR配体3α,7α-二羟基-6α-乙基胆烷酸(6α-ECDCA)(Pellicciari R,Fiorucci S,Camaioni E,et al,J.Med.Chem.2002,45,3569-72),6α-ECDCA对受体的兴奋作用是CDCA的100倍。在结构上,6α-ECDCA与CDCA的差别是在6位上多了α-乙基。CDCA和6α-ECDCA的结构式如下所示:
6α-ECDCA是一种高活性的人工合成激动剂,关于其合成制备方法目前有以下报道。CN101203526报道了由3α-羟基-7-羰基石胆酸经甲酯化,三甲基氯硅烷保护3α-羟基、7-羰基烯醇化保护后,采用三氟化硼乙醚作催化剂使其与乙醛发生向山羟醛反应生成6-亚乙基产物,再经过水解、还原双键和羰基得到6α-ECDCA,其反应路线图如图1所示。该方法存在以下不足:反应需要的温度很低(-80℃),LDA反应剧烈,产物颜色较深,不易除去,反应产物收率较低。
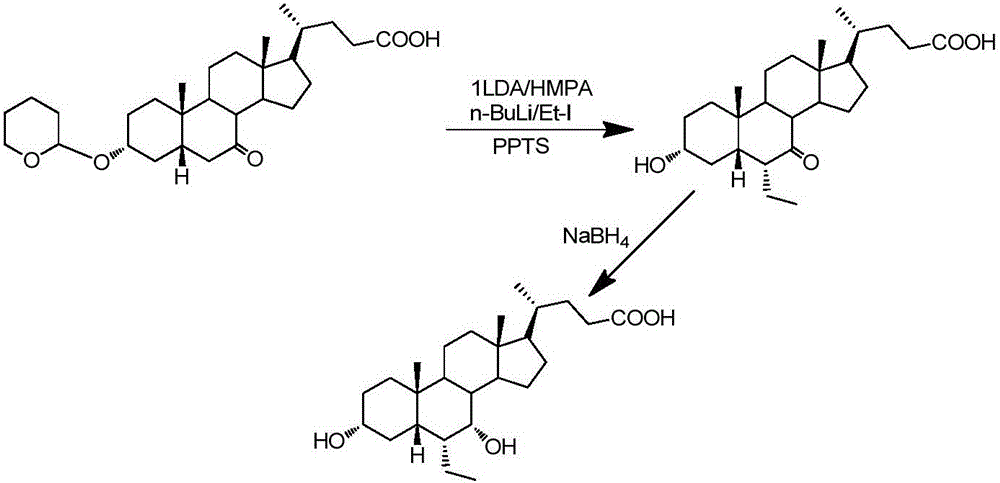
WO02/072598报道了由3α-羟基-7-羰基石胆酸经四氢吡喃基保护3α-羟基后在低温下接入乙基、脱保护、还原羰基从而得到目标产物6α-ECDCA,其反应路线图如图2所示。尽管该种方法步骤较少,不用催化氢化还原反应,但该工艺收率非常低,并且需要使用有致癌性的六亚甲基磷酸酰胺(HMPA)。
技术实现要素:
为了更好的开发和应用6α-ECDCA,建立可以工业化的绿色合成工艺,本发明的目的在于提供一种3α,7α-二羟基-6α-乙基胆烷酸的制备方法。
本发明目的通过以下技术方案实现:
一种3α,7α-二羟基-6α-乙基胆烷酸的制备方法,包括如下制备步骤:
(1)以3α-羟基-7-羰基胆烷酸为原料在酸性条件下与甲醇反应制备3α-羟基-7-羰基胆烷酸甲酯(I);
(2)在碱性和-80~-10℃条件下,以硅酯为催化剂,3α-羟基-7-羰基胆烷酸甲酯与三甲基卤硅烷反应得到3α,7-二(三甲基硅氧基)-6-烯-胆烷酸甲酯(II);
(3)在路易斯酸催化剂和-80~-10℃下,将3α,7-二(三甲基硅氧基)-6-烯-胆烷酸甲酯与山羟醛反应,得到3α-羟基-6-亚乙基-7-羰基胆烷酸甲酯(III);
(4)在碱性醇/水混合溶剂和80~100℃温度下,使用钯碳催化剂和氢气还原3α-羟基-6-亚乙基-7-羰基胆烷酸甲酯,得到3α-羟基-6α-乙基-7-羰基胆烷酸(IV);
(5)使用硼氢化钠还原3α-羟基-6α-乙基-7-羰基胆烷酸得到3α,7α-二羟基-6α-乙基胆烷酸。
上述制备过程的反应路线图如图3所示。
优选地,步骤(2)中所述的硅酯为三氟甲磺酸三甲基硅酯。
优选地,所述的三甲基卤硅烷为三甲基氯硅烷、三甲基溴硅烷、三甲基碘硅烷中的一种。三甲基碘硅烷的亲电性强,更易于与亲核试剂反应,但考虑到工艺成本等问题,其中更优选为三甲基氯硅烷。
优选地,步骤(2)和步骤(3)的反应温度为-60~-20℃。
优选地,步骤(3)中所述的路易斯酸催化剂为三氟化硼乙腈、溴化镁乙醚、四氯化钛中的一种,更优选为三氟化硼乙腈。
优选地,所述的山羟醛为乙醛、乙缩醛、1,1-二甲氧基乙烷中的一种,更优选为乙醛。
优选地,步骤(4)中所述的碱性醇/水混合溶剂是指氢氧化钠或者氢氧化钾的甲醇/水混合溶剂。
相对于现有技术,本发明具有如下优点及有益效果:
本发明的制备方法以市场上易得的3α-羟基-7-羰基胆烷酸为原料,经甲酯化、硅醚保护和烯醇硅醚化,MuKaiyama羟醛反应、催化氢化/水解、羰基还原得到目标产物6α-ECDCA,具有反应条件温和,操作简单,产品收率高的优点,适合工业化。
附图说明
图1和图2为现有技术中6α-ECDCA的反应路线图;
图3为本发明6α-ECDCA的反应路线图;
图4为本发明实施例所得6α-ECDCA的1H-NMR图;
图5为本发明实施例所得6α-ECDCA的高分辨质谱图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。对于未特别注明的参数,可参照常规技术进行。
核磁谱采用瑞士Bruker公司Avance III 400MHz核磁共振仪测定。
质谱采用德国Bruker公司Agilent1290/maXis impact高分辨质谱仪测定。
实施例
(1)3α-羟基-7-羰基胆烷酸甲酯(I)的合成
向三颈烧瓶中加入3α-羟基-7-羰基-胆烷酸(32.7g,83.7mmol)、120mL无水甲醇,2mL盐酸(含22.52mmol盐酸),加完后回流反应4.0h后TLC检测原料反应完全。然后将甲醇减压除去,200mL二氯甲烷溶解残留物,将有机相分别用100mL饱和碳酸氢钠溶液、100mL水、100mL饱和食盐水洗涤至中性,无水硫酸钠干燥后过滤,有机相减压下蒸除,得到33.2g白色粉末状物质(I),收率:98%,该产物不需要纯化直接投入下一步反应。
1H NMR(CDCl3,400MHz):δ(ppm):3.66(s,3H),3.64-3.56(m,1H),2.86(dd,J=8.0,12.0Hz,1H),2.41-2.31(m,2H),2.26-2.16(m,2H),2.02-1.77(m,9H),1.48-1.23(m,10H),1.20(s,3H),0.92(d,J=8.0Hz,3H),0.65(s,3H)。
(2)3α,7-二(三甲基硅氧基)-6-烯-胆烷酸甲酯(II)的合成
将17.0g 3α-羟基-7-羰基胆烷酸甲酯(I)溶解在200mL二氯甲烷中,降温至-20℃,加入30mL三乙胺,然后缓慢滴加20mL三甲基氯硅烷和5mL三氟甲磺酸三甲基硅酯,滴毕后保温反应2.0h。加入50mL饱和碳酸氢钠溶液,搅拌下缓慢升温至室温,再加入100mL二氯甲烷,收集二氯甲烷层,然后分别用100mL饱和碳酸钠溶液和水各洗涤两次,无水硫酸钠干燥,减压回收二氯甲烷,得3α,7-二(三甲基硅氧基)-6-烯-胆烷酸甲酯(II)21.3g。
1H NMR(CDCl3,400MHz):δ(ppm):4.72(dd,J=4.0,8.0Hz,1H),3.66(s,3H),3.54-3.47(m,1H),2.39-2.31(m,1H),2.56-2.18(m,1H),2.00-1.75(m,7H),1.72-1.50(m,4H),1.43-1.24(m,10H),1.22-1.1(m,2H),1.07-0.99(m,2H),0.92(d,J=4.0Hz,3H),0.82(s,3H),0.15(s,9H),0.10(s,9H)。
(3)3α-羟基-6-亚乙基-7-羰基胆烷酸甲酯(III)的合成
将3α,7-二(三甲基硅氧基)-6-烯-5-胆烷酸甲酯(II)(21.0g)溶解于250mL二氯甲烷中,降温至-50℃,加入15mL乙醛,滴加74mL三氟化硼乙腈溶液,反应2.0h后,将反应体系自然升温至-10℃,加入80mL饱和碳酸氢钠溶液,待搅拌至室温后加入100mL二氯甲烷溶液,分离二氯甲烷层,分别用100mL饱和碳酸钠溶液和水洗涤,无水硫酸钠干燥,蒸干溶剂得到3α-羟基-6-亚乙基-7-羰基胆烷酸甲酯(III)15.8g。
1H NMR(400MHz,CDCl3):δ(ppm):6.17(q,J=8.0Hz,1H),3.65(s,3H),3.63-3.61(m,1H),2.57(dd,J=4.0,12.0Hz,1H),1.68(d,J=8.0Hz,3H),0.99(s,3H),0.91(d,J=8.0Hz,3H),0.63(s,3H)。
(4)3α-羟基-6α-乙基-7-羰基胆烷酸(IV)的合成
将3α-羟基-6-亚乙基-7-羰基胆烷酸甲酯(15.5g)溶解于600mL甲醇中,然后加入0.7g 5%的钯碳和200mL 30%的氢氧化钠溶液,混合物在80~100℃,3-4atm的氢气下氢化3h。降至室温后硅藻土过滤,减压除去混合液中的甲醇,用稀盐酸调节至pH 3~4,析出固体,过滤,干燥得到产物3α-羟基-6α-乙基-7-羰基胆烷酸(IV)13.7g。
1H NMR(400MHz,CDCl3):δ(ppm):3.66-3.50(m,1H),2.32-2.14(m,2H),1.21(s,3H),0.92(d,J=4.0Hz,3H),0.80(t,J=8.0Hz,3H),0.65(s,3H)。
(5)3α,7α-二羟基-6α-乙基胆烷酸的合成
将12.0g 3α-羟基-6α-乙基-7-羰基胆烷酸(IV)溶解在200mL无水甲醇中,分批次在0℃和搅拌下加入10g硼氢化钠,反应4h。然后加入水和稀盐酸溶液淬灭反应,将甲醇蒸出后用乙酸乙酯萃取。乙酸乙酯层用无水硫酸钠干燥,旋干。用乙酸乙酯和石油醚混合液重结晶得到目标产物6α-ECDCA 10.6g。所得产物的1H-NMR图和高分辨质谱图分别如图4和图5所示。1H-NMR数据如下:
1H NMR(400MHz,CDCl3):δ(ppm):3.70(s,1H),3.45-3.31(m,1H),2.43-2.35(m,1H),2.29-2.21(m,1H),0.93(d,J=4.0Hz,3H),0.92-0.86(m,6H),0.66(s,3H)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!