TNF‑α蛋白B细胞表位,含此表位的多抗原肽及应用的制作方法
本发明属于免疫学及消化病学领域,具体涉及一种TNF-α蛋白的B细胞表位、及基于该表位、结合MAP方案合成的8分支肽构象的多抗原肽,以及在制备溃疡性结肠炎疫苗中的应用。
背景技术:
TNF-α是一种具有复杂生物活性的细胞因子,除了能在体内、外杀伤肿瘤细胞外,还具有诱导炎症反应、抗病毒感染、调节机体免疫、促进细胞增殖和活化等多种功能。然而研究表明,当TNF-α过量表达时,它会协同产生多种病理损伤,如炎症性肠病、感染性疾病、恶液质等;同时,TNF-α也是一种可作为治疗靶点的人体自身抗原,中和体内过量的TNF-α则可以使得上述病理性损伤减轻。目前针对此类人体自身抗原的免疫治疗手段主要有两种:第一种方法即给病人注射单克隆抗体直接中和体内自身抗原的被动免疫:如抗TNF-α单克隆抗体(英夫利昔单抗,infliximab),是目前最常用的被动免疫治疗生物制剂。Infliximab是一种合成的嵌合体单克隆抗TNF-α抗体,由75%人源性和25%鼠源性构成,可与单核巨噬细胞和活化的T细胞膜结合型TNF-α结合或与血浆中游离的TNF-α结合,并将其中和,从而达到减少TNF-α的作用。现认为,infliximab可用于对激素和免疫抑制剂无反应或不能耐受的、且不适宜接受手术治疗的、重度活动性克罗恩病(Crohn disease,CD)患者的治疗;临床试验显示其对于治疗溃疡性结肠炎(Ulcerative colitis,UC)亦有较为肯定的疗效。但是Infliximab存在用药量大、生产成本高、需长期反复使用、易引起超敏反应等缺陷;此外,针对此类单克隆抗体类药物存在的缺陷,Nature杂志也曾发表题为“超级抗体药物是否能被驯服?”的文章,指出该类药物诱发的免疫反应产生的潜在危害已成为限制其使用的一个关键因素。第二种免疫治疗手段是给病人免疫具有自身抗原表位的自体疫苗使体内产生针对自体分子的多克隆抗体的主动免疫:鉴于疫苗具有生产成本低、使用方便、只需少量注射就可以诱发产生抗体、且可克服抗体及可溶性受体药物的缺陷等优点,因此,由被动地接受单克隆抗体药物转向寻求针对人类自身蛋白的主动免疫疫苗(即自体疫苗),已成为抗自身分子免疫治疗的新的发展方向。
自体疫苗研究领域目前最热门的当属表位疫苗的研究。表位疫苗包括T细胞表位疫苗和B细胞表位疫苗。表位疫苗的研发可以为多种疾病提供一个更好的治疗手段,但是由于自体分子属于自身抗原,分子量较小、结构单一,往往造成免疫原性降低,在体内不能诱发理想的免疫反应,特别是体液免疫反应,这也是B细胞表位疫苗研究相对较少的主要原因。为了解决这一问题,短肽疫苗多采用表位多肽交联载体蛋白的方法来提高其免疫原性,但由于载体蛋白本身也是大分子外来抗原,往往诱生的抗体多是针对载体蛋白而非目的表位。
近些年在肿瘤相关抗原(tumor associated antigen,TAA)的研究领域,有学者提出了多抗原肽(muptile antigenic peptides,MAP)设计方案,采用分子量小且免疫原性弱的赖氨酸(K)为核心基质,将若干条(一般为4条或8条)抗原表位相同或不同的单体肽偶联在一起,形成树枝状结构。这种设计模式不但能很好模拟天然表位构象,而且无需再偶联载体蛋白,便能激活体液免疫,诱生高滴度、高亲和力抗体。因此,采用MAP方案设计的分枝状多抗原表位复合肽有望提高肽类疫苗的质量、去除载体蛋白的缺陷。
MAP设计方案主要用于构建肿瘤相关抗原等大分子抗原的T细胞及B细胞表位多抗原肽的研究,在肝素酶的研究中有着较多的应用。由于自身抗原相对与大分子抗原,具有天然免疫耐受、分子量更小、表位肽更短且更难筛选、更不易引起体液免疫反应等缺陷,因此,本领域研究人员未曾将MAP设计方案应用于自身小分子抗原。然而,我们基于以往对B细胞表位MAP疫苗的大量研究基础,前期在国家自然科学基金的资助下,成功的用MAP方案构建了具有较强免疫原性的TNF-αB细胞表位疫苗。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供一种TNF-α蛋白的B细胞表位、及基于该表位,结合MAP方案合成的8分支肽构象的多抗原肽,以及在制备溃疡性结肠炎疫苗中的应用。
本发明的目的是通过以下技术方案实现的:一种TNF-α蛋白的B细胞表位,所述表位的氨基酸序列为VMVPRRKAGTSKS或VCFTLNKSQSNQE。优势表位为VCFTLNKSQSNQE。
一种溃疡性结肠炎多抗原肽,所述多抗原肽为经过MAP设计,用分子量小且免疫原性弱的赖氨酸(K)为核心基质,与序列为VCFTLNKSQSNQE的表位多肽偶联在一起,形成8分支肽构象的多抗原肽。
一种氨基酸序列为VMVPRRKAGTSKS或VCFTLNKSQSNQE的人TNF-α蛋白的B细胞表位在制备溃疡性结肠炎疫苗中的应用。
一种溃疡性结肠炎多抗原肽在制备溃疡性结肠炎疫苗中的应用。
本发明的有益效果在于:本发明创造性地将MAP设计方案应用于小分子自身抗原的免疫学研究领域,通过大量试验,预测、筛选、鉴定出具有良好的亲水性、可及性、可塑性,且在二级结构上位于蛋白伸展结构或无规则卷曲结构内的人TNF-α蛋白的B细胞优势表位。在此基础上,应用MAP设计方案,得到以赖氨酸为核心基质的8分支肽构象,该8分支肽构象多肽疫苗相对于现有技术,具有以下优势:
TNF-αB细胞表位MAP疫苗属于自体抗原表位疫苗,因而有着给药方便且次数少、只需少量注射就可以诱发产生抗体的优点;且具有价格相对低廉、安全性及耐受性好、防治兼施等优势。因此,若能通过TNF-αMAP疫苗来防治溃疡性结肠炎病情的加重及反复,势必能提高溃疡性结肠炎患者依从性、提高生活质量及节约医疗费用,同时也契合了新医改“预防为主”的思路及习近平总书记“健康中国”的理念,有望为自体抗原MAP疫苗的研发提供重要的理论基础,也可为临床治疗溃疡性结肠炎提供新的思路。
附图说明
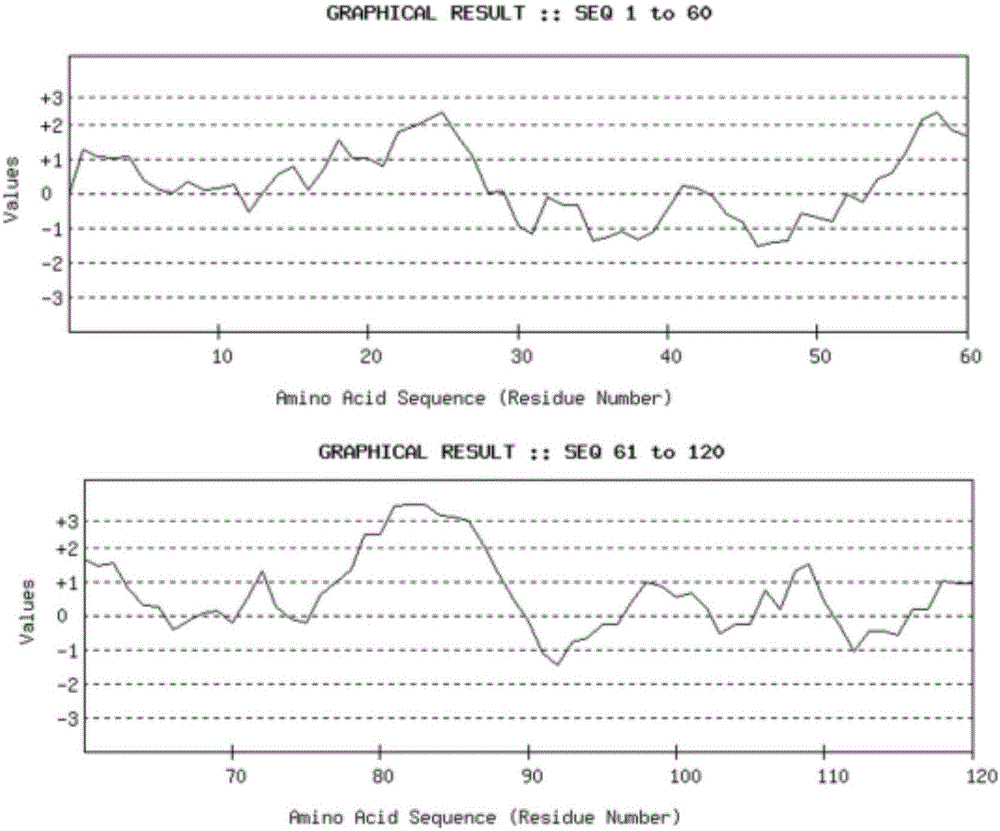
图1为人TNF-αB细胞表位DNAstar预测结果图;
图2为人TNF-αB细胞表位Bcepred预测结果图;
图3为候选的8分支肽MAP结构示意图;
图4为MAP1和MAP2与商品化TNF-α抗体的结合力示意图;
图5为Western blotting检测各MAP抗体特异性结果图;
图6为MAP免疫后小鼠血清特异性抗体滴度动态变化图;
图7为MAP抗体减弱TNF-α对L929细胞的杀伤作用示意图;
图8为接种了MAP疫苗的小鼠结肠组织MPO活性示意图,表明MPO活性明显降低;
图9为接种MAP疫苗小鼠结肠组织病理性损伤示意图,表明接种MAP疫苗后,病理性损伤明显减轻;
图10为接种MAP疫苗小鼠结肠组织E-钙粘蛋白表达示意图,表明接种MAP疫苗后,E-钙粘蛋白表达显著降低。
具体实施方式
实施例1:人TNF-αB细胞表位优势表位的筛选及多抗原肽的构建。
①检索NCBI GenBank数据库,获得人TNF-α蛋白质氨基酸序列;采用DNAStar、GOLDENKEY(军事医学科学院)软件及互联网上的计算机疫苗设计工具Bcepred,分析获得亲水区中抗原性最强的氨基酸序列信息和B细胞表位;根据抗原表位预测,选择富含亲水性氨基酸长度约为6-25氨基酸的肽段,同时避开4个以上连续相邻的疏水性氨基酸残基和含2个以上半胱氨酸的肽段,以免通过二硫键形成复杂的多聚体。
②分析软件(图1)及互联网设计工具(图2)的预测结果。以13个氨基酸残基为一组,分析其亲水性、可及性、可塑性及抗原性指数评估人TNF-α分子高亲水性区域的抗原性。最后综合几种分析方法,取各结果的重叠区域,确定第22-34(VMVPRRKAGTSKS)、第54-66(VCFTLNKSQSNQE)氨基酸所组成的肽段具有良好的亲水性、可及性及可塑性,在二级结构上位于蛋白伸展结构或无规则卷曲结构内,为TNF-α蛋白的B细胞候选表位。
③以赖氨酸(K)为核心基质,采用MAP设计方案,委托杭州中肽生化有限公司将第22-34(VMVPRRKAGTSKS)、第54-66(VCFTLNKSQSNQE)氨基酸的C端以8分支肽构象偶联在核心基质赖氨酸的氨基上,通过HPLC分离纯化、质谱鉴定分析及肽段氨基酸测序,分别制备TNF-αB细胞候选表位MAP多肽,并分别命名为MAP1和MAP2,MAP1、MAP2结构示意图见图3。
④候选MAP的筛选如下:
(1)MAP抗体与MAP在体外的结合能力:1)分别用浓度为10μg/mL的不同MAP,稀释液为pH9.6的碳酸盐缓冲液;2)包被微孔反应板,每孔100μL,4℃过夜;3)用PBS缓冲液洗涤1遍,每孔加入1%BSA,37℃1-2小时;4)用PBS洗涤1遍,拍干;5)加入一抗(PBS 1:4000稀释后的MAP抗体),加入已包被的反应板,每孔100μL,以PBS作对照。37℃孵育60min;6)加入用1%BSA稀释的羊抗兔IgG-HRP,每孔100μL,37℃孵育60min;7)加入显色剂OPD,37℃孵育10-20分钟;8)加入终止液,每孔50μl;8)在波长492nm下读数,结果以OD均值表示,结果如图4所示,MAP2多肽与TNF-α全蛋白抗体的结合力明显强于MAP1。
(2)MAP抗体特异性检验:将离心洗涤后的1×109H22细胞(该细胞株稳定高效表达TNF-α,购自华中科技大学),加入1mL冰预冷的悬浮缓冲液用漩涡振荡器分散细胞5min;于4℃以3000r/min离心5min;弃上清,尽快加入等体积的2×SDS以提取总蛋白;用总蛋白制作SDS-PAGE,用商品化TNF-α蛋白做对照;Western blot采用化学发光法,具体步骤参照试剂盒说明书进行,所用抗体为商品化的抗TNF-α全蛋白抗体(购自Cilag AG Ltd,Switzerland)或所提纯的抗TNF-αB细胞表位MAP抗体;免疫荧光观察所得条带,与商品化全蛋白抗体所得条带的kDa数值作比,鉴定所得到的经纯化抗体的特异性,内参选用GAPDH。商品化抗体在分子量约17kD处出现1条非常清晰的条带;MAP1及MAP2均在分子量约17kD处出现清晰条带,经半定量分析比较,MAP2条带的灰度值明显高于MAP1。依据商品化抗体说明书,17kD处为TNF-α蛋白。而TNF-α重组蛋白抗血清和阴性对照在相应位置无明显条带出现,见图5。
(3)检验MAP体外刺激人单核细胞(PBMC)增殖能力及IFN-β释放能力:采用经典的标准3H-TdR掺入试验。淋巴细胞受特异性抗原刺激转化为淋巴母细胞的过程中,DNA的合成明显增加,且其转化程度与DNA的合成呈正相关,此时将合成DNA的前体物质胸腺嘧啶核苷用放射性同位素(3H-TdR)标记,加入到培养体系中,即被转化的淋巴细胞摄取而掺入DNA分子内。培养终止后,测定淋巴细胞内掺入的3H-TdR的放射量从而判断淋巴细胞的转化程度。结果表明,MAP多抗原肽体外能显著刺激PBMC增殖及释放IFN-β,其中MAP2刺激PBMC释放IFN-β的能力明显强于MAP1。
综合分析MAP抗体与MAP在体外亲和力试验、MAP抗体特异性检验、MAP疫苗体外刺激人单核细胞(PBMC)增殖能力及IFN-β释放能力等试验的结果,筛选并鉴定第54-66位氨基酸(VCFTLNKSQSNQE)为TNF-αB细胞优势表位。因此,多抗原肽MAP2,即经过MAP设计,用分子量小且免疫原性弱的赖氨酸为核心基质,与序列为VCFTLNKSQSNQE的表位多肽偶联在一起,形成8分支肽构象的MAP为优势B细胞表位的多抗原肽疫苗。
实施例2:实施例1所述方法构建的多抗原肽的体内外免疫学效应考证。
由于大鼠与人TNF-α具有极高的同源性,本实施例以大鼠为考证对象,按照实施例1所述的方法筛选、鉴定出的优势表位,继而用其优势表位合成的TNF-αB细胞表位MAP多抗原肽疫苗进行大鼠的体内外免疫学效应考证,以证明本发明构建的8分支肽构象的多抗原肽在人和鼠溃疡性结肠炎中的积极作用。
其中,体外效应考证包括:MAP抗体对TNF-α体外杀伤小鼠成纤维细胞L929的影响;MAP抗体对TNF-α体外溶破3H-TdR标记的肝癌细胞HCC97H的影响。体内效应考证包括:TNF-αB细胞表位MAP疫苗对模型小鼠疾病活动指数的影响;MAP疫苗对模型小鼠血清CRP、ESR、DAO等水平的影响;MAP疫苗对模型小鼠肠系膜淋巴结移位的影响;MAP疫苗对模型小鼠结肠粘膜病理改变、结肠组织E-钙粘蛋白表达及结肠组织MPO活性的影响。具体如下:
①MAP2皮下多点免疫BALB/c小鼠,每2周1次,共4次,Freund’s不完全佐剂及Th通用辅助短肽用于加强免疫,每次免疫后10天分批用眼眶取血法收集动物血清,标准间接ELISA法测定并比较各组(MAP2、TNF-α全蛋白及PBS对照组)血清中MAP抗体滴度。首次免疫2周后即可检出特异性抗体,MAP2免疫的抗体滴度在6周后测得的平均最高抗体滴度为1:130000,8周后达最高峰,其平均抗体滴度为1:140000,TNF-α对照组和PBS对照组均无特异性抗体产生,见图6。MAP2诱生出的特异性抗体经Sephadase柱层析法分离纯化收集IgG,并委托杭州中肽生化有限公司用抗体亲合层析法分离、纯化抗血清中所含的特异性多克隆抗体;提纯后用考马斯亮蓝测定所得抗体平均浓度为28.6mg/dL。。
②MAP抗体介入后,观察TNF-α体外对小鼠成纤维细胞L929细胞的杀伤作用:将生长状态良好的小鼠L929细胞调至106/mL的细胞悬液,96孔培养板中每孔加入100μL细胞悬液,5%CO2、37℃培养过夜;弃上清,每孔加入TNF-α,及MAP抗体5%CO2、37℃培养16h,弃上清,每孔加入30μL的浓度为500μg/mL结晶紫染色3-5min,用流水小心冲去结晶紫,摔干残余水分,每孔加入脱色液100μL,酶标仪570nm处测定吸光值。结果如图7所示,随着MAP抗体浓度的增加,TNF-α对小鼠成纤维细胞L929细胞的杀伤作用逐步减弱(P<0.05)。
③MAP抗体介入后,观察TNF-α体外对3H-TdR标记的人原发性肝癌细胞HCC97H的溶破率:TNF-α受体广泛地分布于多种肿瘤细胞,某些肿瘤细胞膜表面的TNF-α受体与TNF-α结合后,可导致这些肿瘤细胞的死亡,可通过检测对肿瘤细胞的杀伤能力,来反映TNF-α的生物学活性。HCC97H肝癌细胞先用3H-TdR标记,被杀伤后3H-TdR释放至细胞外,通过测定肿瘤细胞释放的3H-TdR显示,MAP抗体介入后,TNF-α对HCC97H细胞的溶破率明显降低。
③体内免疫学效应考证:
A、小鼠UC模型的建立:参考Kihara N等的方法反复摸索,加以改良后建立了疾病负荷较为均一的DSS BALB/c小鼠UC模型,空白对照组小鼠每日用等量蒸馏水灌胃作为对照。
B、选取体重18-20克,5-6周龄雄性BALB/c UC模型小鼠30只,分为3组,组间体重无统计学差异。第1组10只,免疫方法为皮下多点免疫MAP疫苗,免疫剂量为50μg/只,第一次免疫用弗氏完全佐剂,后三次加强免疫用弗氏不完全佐剂,佐剂与抗原1:1充分混合,隔周免疫一次,共免疫4次;第2组10只,用赖氨酸基质50μg/只皮下多点免疫,免疫频率与第1组相同。第三组10只,免疫方法为皮下多点免疫,免疫剂量为100μL生理盐水/只,免疫频率与第1组相同。免疫后4周开始每周记录各组小鼠的平均疾病活动指数,结果显示实验组小鼠疾病活动指数显著低于基质组或生理盐水对照组。每组实验动物于免疫后4周、8周各处死5只。标本采集前小鼠禁食12h,自由饮水。将盐酸氯胺酮和速眠新以l:l比例配成麻醉剂,按1mg/kg剂量腹腔注射麻醉待处死小鼠,麻醉后仰卧位固定:
i、血清:用无菌镊摘除小鼠眼球,用虹吸管反复从眼眶内采血,取血约lml,装入经1%肝素湿润的离心管中,室温静置30min,4℃3000r/min离心10min,收集上清,分装至2个无菌的Eppendorf管后,-80℃保存,用于检测血清D-LAC、ESR、CRP及DAO的含量。结果提示,溃疡性结肠炎小鼠接种了MAP疫苗后,血清中D-LAC、ESR、CRP含量及DAO含量显著降低。
ⅱ、肠系膜淋巴结细菌培养观察细菌移位情况:取血后迅速开腹,无菌条件下取肠系膜淋巴结约200mg,放入无菌研磨器中,加入2mL无菌生理盐水,手工研磨2min,取100ul研磨液接种到血琼脂培养皿。结果显示,接种了MAP疫苗的溃疡性小鼠肠系膜淋巴结细菌培养阳性率较对照组显著降低,提示接种疫苗后肠道细菌移位情况减轻。
ⅲ、结肠组织:暴露腹腔组织,小心分离结肠(从回盲部到肛门),沿肠系膜纵向剖开肠段,用冰生理盐水漂洗,洗去肠腔内容物,距肛门lcm处取结肠组织2cm,以10%的福尔马林固定,常规石蜡包埋,连续4μm切片,共切3张,用于组织切片的H&E染色及免疫组化染色。紧临再取结肠组织10mg,迅速放进Eppendorf管后置入盛好液氮的保温罐,后放入-80℃冰箱冷冻保存,用于结肠组织MPO活性的测定,结果如图8所示,接种了MAP疫苗的小鼠(MP组)结肠组织MPO活性较基质组(M组)及TH对照组明显降低。
iv、结肠组织切片观察:H&E染色后光镜下(×100,×400)观察、比较小鼠结肠组织病理变化,结果如图9所示,接种MAP疫苗的溃疡性结肠炎小鼠结肠组织有核细胞浸润及腺体破坏情况明显减轻。
v、结肠组织E-钙粘蛋白免疫组化检测:用SP法,所用抗体为兔抗E-钙粘蛋白单抗及加生物素标记的羊抗兔IgG工作液,显微镜下观察并摄片,细胞膜染色呈棕黄色者为阳性,结果如图10所示,接种MAP疫苗的溃疡性结肠炎小鼠结肠组织E-钙粘蛋白表达显著降低。
通过以上考证数据可知,本发明构建的8分支肽构象的多抗原肽疫苗在防治溃疡性结肠炎病情的加重及反复中具有积极作用。
本发明通过上述实施例来说明本发明的详细特征以及方法,但本发明并不局限于上述详细特征以及方法,即不意味着本发明必须依赖上述详细特征以及方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用材料和步骤的等效替换以及辅助材料和步骤的增加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!