一种生产子囊霉素FK520的基因工程菌及其制备方法与流程
本发明属于生物工程领域,特别涉及一种生产子囊霉素fk520的基因工程菌及其制备方法。
背景技术:
子囊霉素fk520是含23元环的大环内酯类化合物,具有免疫抑制和抗真菌活性,其分子式为c43h67no12,分子量为789.99,易溶于甲醇、丙酮等。fk520是他克莫司(tacrolimus,fk506)的乙基类似物,能够抑制t细胞的活性及相关炎症因子的合成,其衍生物“匹美莫司”,已成为一种重要的免疫抑制药物。
目前,fk520主要还是通过吸水链霉菌(streptomyceshygroscopicus)发酵的方法进行大规模生产,但是在实际的生产过程中,其发酵过程难以控制,菌体生长过快、过稠、过密,氧气利用下降严重制约次生代谢产物fk520的积累。控制fk520发酵过程成为一个生产难题。
技术实现要素:
本发明所要解决的技术问题是针对现有的吸水链霉菌在发酵过程中氧气受限的不足,提供一种能够在fk520发酵过程中高效利用氧气的吸水链霉菌及相应的基因、重组载体、转化子和制备子囊霉素fk520的方法,可改善吸水链霉菌发酵过程的溶氧,促进菌体呼吸作用效果,提高所得fk520的发酵单位。
本发明解决上述技术问题的技术方案之一是:一种生产子囊霉素fk520的基因工程菌,其是天然生产fk520的吸水链霉菌的基因组中整合有血红蛋白基因(vitreoscillahemoglobingene,vgb)的工程菌。其中,所述vgb基因可以是天然的外源vgb基因,也可以是针对天然产子囊霉素fk520的吸水链霉菌做过密码子优化的vgb基因。较佳地,所述vgb基因的核苷酸序列如seqidno.1所示。
本发明解决上述技术问题的技术方案之二是:一种vgb基因,其核苷酸序列如seqidno.1所示。
本发明解决上述技术问题的技术方案之三是:一种vgb全序列基因,核苷酸序列如seqidno.3所示。该vgb全序列基因包括erme*启动子和vgb基因。
本发明解决上述技术问题的技术方案之四是:一种包含本发明所述vgb基因的重组载体。其中,所述重组载体的骨架为本领域常规的载体。较佳地,所述重组载体的骨架为质粒pset-152。较佳地,所述质粒pset-152的核苷酸序列如seqidno.2所示。其可通过本领域常规的方法将本发明的vgb基因的核苷酸序列连接于载体。较佳地为,将双酶切后获得的具有粘性末端的目的vgb全序列基因片段插入到pset-152载体的多克隆位点上,经连接酶连接,形成含有本发明的vgb基因的重组载体pset-vgb。
本发明解决上述技术问题的技术方案之五是:一种包含本发明所述的重组载体的转化子。其中,该转化子的宿主细胞可以是本领域的常规宿主,优选大肠杆菌(escherichiacoli)et12567,将前述重组载体pset-vgb转化至大肠杆菌et12567即可获得转化子。
本发明解决上述技术问题的技术方案之六是:一种制备所述生产子囊霉素fk520的基因工程菌的方法,包括将所述转化子与天然产fk520的吸水链霉菌接合,挑选接合子即得。其中,所述天然产fk520的吸水链霉菌为常规的天然产fk520的吸水链霉菌,较佳地为吸水链霉菌atcc14891。所述的转化子的宿主细胞可以是本领域的常规宿主,优选宿主为大肠杆菌et12567(puz8002)。转化子中含有的重组载体的骨架优选质粒pset-152。
本发明解决上述技术问题的技术方案之七是:一种制备子囊霉素fk520的方法,包括将所述生产子囊霉素fk520的基因工程菌发酵,从发酵液中获得fk520。
其中,所述发酵所需的种子液为本领域常规,一般为28℃斜面培养生产子囊霉素fk520的7-8天,将约1/4的孢子转接到一级种子培养基,28℃培养48小时后,获得的种子液。
所述发酵为本领域常规。其中,所述发酵的培养基为常规的培养基。较佳地,所述发酵的培养基包括以下组分:6.0%甘油、2.0%酵母提取物、2.0%黄豆饼粉、0.02%磷酸二氢钾和微量元素;所述百分比为占培养基的质量体积百分比(如,1%为1g/100ml,本发明中所有“质量体积百分比”均为相同含义)。较佳地,所述微量元素由0.001%硫酸亚铁、0.001%硫酸铜、0.001%硫酸锌和0.000015%氯化钴组成,所述百分比为占培养基的质量体积百分比。较佳地,所述发酵还进行搅拌;更佳地,所述搅拌的转速为600~800rpm;较佳地为780rpm。所述发酵的温度为本领域天然产fk520的吸水链霉菌发酵所需的常规温度,较佳地为28℃。所述发酵的周期较佳地为5~8天;更佳地为7天。所述发酵的溶氧量,较佳地为5~40%;更佳地为15~40%,所述百分比为体积百分比。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的有益效果如下:
本发明通过向天然产fk520的吸水链霉菌中导入vgb基因,从而促进菌体的呼吸作用,产生足够多的atp和nadph,进一步促进fk520的积累,提高fk520的生产效率和降低fk520的生产成本。
天然产fk520的吸水链霉菌的发酵为好氧发酵过程,但是在发酵时即使通气量、搅拌条件达到最高参数下,发酵液中的溶氧量还是较低。然而,在天然产fk520的吸水链霉菌中导入外源的vgb基因,促进了菌体呼吸,改善了吸水链霉菌发酵过程的溶氧,解除了菌体发酵过程中氧气的抑制对于菌体的生长,尤其对次级代谢产物的积累具有积极的作用,具有一定的普适性。
罐上研究发现,在培养条件相同的条件下vgb改造菌株发酵所得fk520的发酵单位是未改造的天然fk520产生菌发酵所得fk520发酵单位的1.38倍。而带有vgb基因的天然产雷帕霉素的吸水链霉菌发酵所得雷帕霉素的发酵单位是未经改造的吸水链霉菌发酵所得雷帕霉素发酵单位的0.917倍。说明vgb基因的插入并不是对所有吸水链霉菌的呼吸作用起到促进作用。
附图说明
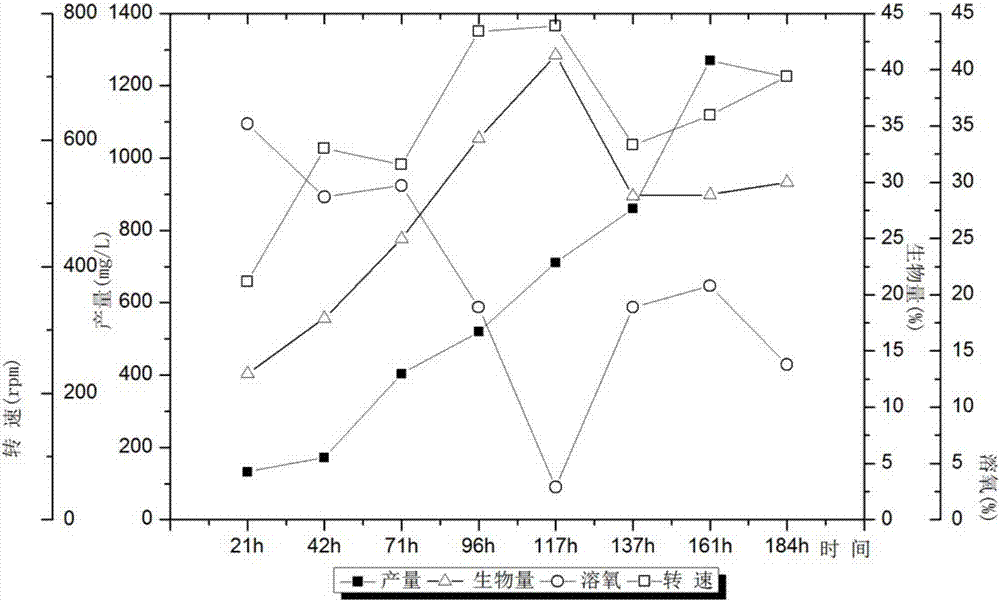
图1为pset-vgb质粒图谱。
图2为vgb改造的fk520产生菌的发酵过程。
图3为fk520液相检测图谱。
图4为未改造的fk520产生菌的发酵过程。
图5为vgb改造的雷帕霉素产生菌的发酵过程。
图6为未改造的雷帕霉素产生菌的发酵过程。
具体实施方式
本发明人经过广泛的研究和反复的试验,发现将vgb基因导入天然产fk520的吸水链霉菌atcc14891中,可以提高吸水链霉菌对氧气的利用率。因此,本发明通过基因工程构建一株含有vgb基因的吸水链霉菌基因工程菌,改善fk520发酵过程中溶氧量低的问题。
首先对外源vgb基因进行克隆,可用常规的方法克隆得到。
接着构建用于位点整合的重组载体,用本领域常规方法,如双酶切将vgb基因连接到质粒pset-152,构建成含vgb基因的基因工程质粒pset-vgb。
然后用该重组载体转化宿主细胞,获得转化子。该转化子菌株和吸水链霉菌野生菌株共培养,发生接合,即得到基因组中含有vgb基因的突变株,可以提高吸水链霉菌对氧气的利用率,解决fk520发酵过程中溶氧量低的问题。所获菌株的培养方法为本领域常规方法。本发明中,采用罐上培养。
发酵罐样品取样处理方法:
取300μl发酵液,加入4倍体积的丙酮,超声20min后,12000rpm离心3min,取上清,用于hplc分析。
发酵产物的检测方法为hplc分析方法(等度系统):
柱子:hypersilbdsc18,5μm,4.6mm×150mm;
流动相:35%水(ph4.8)+65%乙腈;
柱温:55℃;
波长:210nm;
流速:1.0ml/min;
时间:15min。
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
所使用的工具酶和dna分子量marker均购自takara公司,具体的反应条件和使用的方法均参考商品说明书。所使用的胶回收试剂盒购自生工,使用方法参考商品说明书。pset-152购自takara公司,其核苷酸序列如seqidno.2所示。et12567感受态细胞购自takara公司。吸水链霉菌atcc14891购自美国模式培养物集存库,雷帕霉素产生菌nrrl5491购自美国农业研究菌种保藏中心。
实施例1
导入外源vgb基因的工程菌株的构建
1.含vgb基因工程质粒pset-vgb的构建
根据吸水链霉菌密码子的偏好性针对原有的来自透明颤菌(vitreoscillasp.)外源vgb基因序列进行改造,并且在优化后vgb基因的两端加上ndei和asci的酶切位点,即seqidno.1序列由优化后的vgb基因以及两端的酶切位点ndei和asci组成;在erme*启动子的前端添加xbai的酶切位点;终止子的后端整合有bamhi的酶切位点,整合有酶切位点xbai和bamhi的全基因序列如seqidno.3所示。将设计好的序列进行全合成,通过xbai和bamhi双酶切获得目的基因片段,插入到pset-152载体的xbai和bamhi位点上,即可获得如图1所示的重组载体pset-vgb。pset-152的序列如seqidno.2所示。
2.将重组载体转化et12567感受态细胞
取50μl感受态细胞et12567,向其中加入重组载体pset-vgb,吹打混匀后,冰上静置约30min;42℃热激45s后,继续冰上静置2min;在离心管中加入450μl的新鲜lb培养基(无抗生素),混匀后于37℃摇床,150rpm振荡培养45min,复苏;离心8000rpm,1min,倾去上清,加入100μllb培养基,吹打混匀,稀释涂布含有抗生素的lb平板上(氯霉素、卡那霉素和安普霉素的浓度分别为25μg/ml、25μg/ml和50μg/ml);37℃过夜培养,即可获得重组子。
3.通过接合转移将vgb基因导入到天然产fk520的吸水链霉菌中
将天然产fk520的吸水链霉菌atcc14891接种到新鲜的斜面上,28℃培养8天,待白色的菌苔表面产生黑色的孢子。用1.5ml离心管离心收集孢子(1ml),4000rpm,5min。将沉淀在底部的黑色孢子重悬于500μltes缓冲液(0.05m,ph8.0)中,封上封口膜,50℃水浴热激10min。自然冷却5min后,加入500μl的2×孢子预萌发液(1%酵母提取物、1%酪蛋白、0.01mcacl2,ph7.0,所述百分比为质量体积百分比),37℃,200rpm培养3h。然后4000rpm,5min离心收集预萌发孢子,重悬于500μl的lb或ddh2o中,此为孢子预萌发液。
将携带重组载体pset-vgb的大肠杆菌et12567接种到含氯霉素、卡那霉素和安普霉素的浓度分别为25μg/ml、25μg/ml和50μg/ml的lb液体培养基中(1%胰蛋白胨、0.5%酵母提取物、1%nacl,ph7.0,所述百分比为占培养基的质量体积百分比)5ml中,37℃,200rpm,过夜培养。按体积百分比为1%的接种量(文中所述接种量百分比均为体积百分比)转接到5ml相同lb培养基(同样加有三抗)中,37℃培养至od值0.5,4000rpm,5min离心收集菌体,用lb液体培养基洗涤2次,最终悬浮于500μl的lb液体培养基中,此为大肠杆菌液。
将上述所制的孢子预萌发液与大肠杆菌液按体积比1∶1混合于离心管中,充分混合后,4000rpm,3min离心,倾去上清后,加入100μl的lb重悬,吹打混匀后,稀释涂布ms琼脂培养基(2%甘露醇、2%黄豆饼粉、2%琼脂,ph7.0,所述百分比为占培养基的质量体积百分比)。28℃培养18h后,再用安普霉素和奈啶酮酸浓度都为50μg/ml的无菌水1ml覆盖平板,于28℃培养一周。从ms平板上随机挑取若干单菌落在含50μg/ml安普霉素的ms平板上进行平板划线,7天后即可从平板上挑选出接合子。
4.检测改造菌株中vgb基因的表达及其活性
(1)利用菌落pcr检测vgb基因是否成功导入安普霉素抗性平板上长出来的抗性株中。
合成引物如下:
上游引物vgb-5’:5’-atgctcgaccagcaaaccat-3’;
下游引物vgb-3’:5’-tcattcaaccgcttgagcgt-3’。
pcr条件如下:以所述平板上长出的安普霉素抗性株的基因组dna为模板,使用两条引物进行pcr扩增。pcr总体系为50μl体系:无菌枪头挑取的单菌落的一部分为模板、10×buffer5μl、dntpmix4μl、上游引物vgb-5’1μl、下游引物vgb-3’1μl、模板1μl、rtaq酶1μl、ddh2037μl。pcr扩增步骤为:(1)94℃预变性10min;(2)94℃变性30s;(3)52℃退火30s;(4)72℃延伸1min;步骤2-4重复30次;(5)72℃继续延伸10min,冷却至4℃。
pcr产物经琼脂糖凝胶电泳纯化,用琼脂糖凝胶dna回收试剂盒回收约450bp的dna片段(未改造的对照菌株未能扩增出该条带),对该dna片段的碱基序列进行分析,结果确认是vgb基因。表明,通过接合转移的方法已成功地将vgb基因整合到了吸水链霉菌的基因组中,因此获得生产子囊霉素fk520的基因工程菌菌株。
实施例2
对vgb改造菌株进行罐上研究
从甘油管中将保藏的如实施例1所述的生产子囊霉素fk520的基因工程菌菌株取出。经过28℃斜面培养8天,将约1/4的孢子转接到一级种子培养基,28℃培养48h后,接种到2l发酵罐中(6.0%甘油、2.0%酵母提取物、2.0%黄豆饼粉、0.02%磷酸二氢钾和微量元素,微量元素由0.001%硫酸亚铁、0.001%硫酸铜、0.001%硫酸锌和0.000015%氯化钴组成,所述百分比为占培养基的质量体积百分比),接种量5%,28℃发酵,发酵周期为7天。发酵过程如图2所示,随着菌体的生长,其生物合成过程中能够需氧量增加,更多的氧气被消耗,溶氧量下降;随着菌体内vgb基因的表达,血红蛋白含量增高,氧气利用率相应得到提高、耗氧减少,溶氧量上升。发酵过程中,发酵罐中插入溶氧电极检测溶氧,溶氧维持在15%以上。检测fk520的发酵单位,最高为1269.7mg/l,发酵时间为161h(液相检测图谱,见图3)。
实施例3
对未改造的天然fk520产生菌进行罐上研究
从甘油管中将保藏的原始的天然产fk520的吸水链霉菌atcc14891经过28℃斜面培养8天,将约1/4的孢子转接到种子培养基,28℃培养48h后,接种到2l发酵罐中(6.0%甘油、2.0%酵母提取物、2.0%黄豆饼粉、0.02%磷酸二氢钾和微量元素,微量元素由0.001%硫酸亚铁、0.001%硫酸铜、0.001%硫酸锌和0.000015%氯化钴组成,所述百分比为占培养基的质量体积百分比),接种量5%,28℃发酵,发酵周期为7天。发酵过程如图4所示,原始菌种在发酵47h后,搅拌转速达到上限780rpm,但溶氧都小于10%。随着菌体的生长,其生物量逐渐提高,耗氧增加,罐中溶氧逐渐下降至5%以下,即使在最大转速、最高通气量的情况下,溶氧依旧没有改善,对照菌的代谢过程受到抑制,低的溶氧值对发酵产量影响较明显,fk520最高产量为921.8mg/l,发酵时间为114h。
实施例4
将vgb基因导入雷帕霉素产生菌中,进行罐上研究
用同样的方法将vgb基因整合到一种天然产雷帕霉素的吸水链霉菌nrrl5491中,获得vgb基因改造株。将vgb基因改造的雷帕霉素产生菌30℃斜面培养30天,待孢子成熟后,转接到种子培养基,30℃培养72h后,接种到2l发酵罐中(2.0%葡萄糖、2.0%酵母提取物、8.0%甘油、0.1%磷酸二氢钾、0.1%磷酸氢二钾和微量元素,微量元素由0.0125%硫酸镁、0.005%硫酸锌、0.001%硫酸钼、0.002%硫酸亚铁和0.00024%氯化钴组成,所述百分比为占培养基的质量体积百分比),接种量10%,30℃发酵,发酵周期为10天。发酵过程如图5所示,发酵罐内的溶氧量维持在20%以上(所述百分比为体积百分比),雷帕霉素的产量最高为782.5mg/l。
实施例5
对未改造的天然雷帕霉素产生菌进行罐上研究
从甘油管中将保藏的原始的雷帕霉素产生菌nrrl5491,经30℃斜面培30天,待孢子成熟后,转接到种子培养基,30℃培养72h后,接种到2l发酵罐中(2.0%葡萄糖、2.0%酵母提取物、8.0%甘油、0.1%磷酸二氢钾、0.1%磷酸氢二钾和微量元素,微量元素由0.0125%硫酸镁、0.005%硫酸锌、0.001%硫酸钼、0.002%硫酸亚铁和0.00024%氯化钴组成,所述百分比为占培养基的质量体积百分比),接种量10%,30℃发酵,发酵周期为10天。发酵过程如图6所示,发酵过程中溶氧量维持在22.5%以上(所述百分比为体积百分比),雷帕霉素的产量最高为853.3mg/l。与导入vgb基因的改造菌株相比,对照菌株本身的产量和溶氧量更高。
这说明,用同样的方法将同样的vgb基因导入到类似的吸水链霉菌中,其雷帕霉素的产量与未改造的对照菌株相比,不仅没有提高,甚至略有下降。说明,vgb基因的导入对该株菌雷帕霉素的积累并没有起到促进作用。
应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求数所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!