丁酸梭菌的分段连续发酵工艺的制作方法
本发明属于微生物发酵
技术领域:
,尤其是涉及一种丁酸梭菌的分段连续发酵工艺。
背景技术:
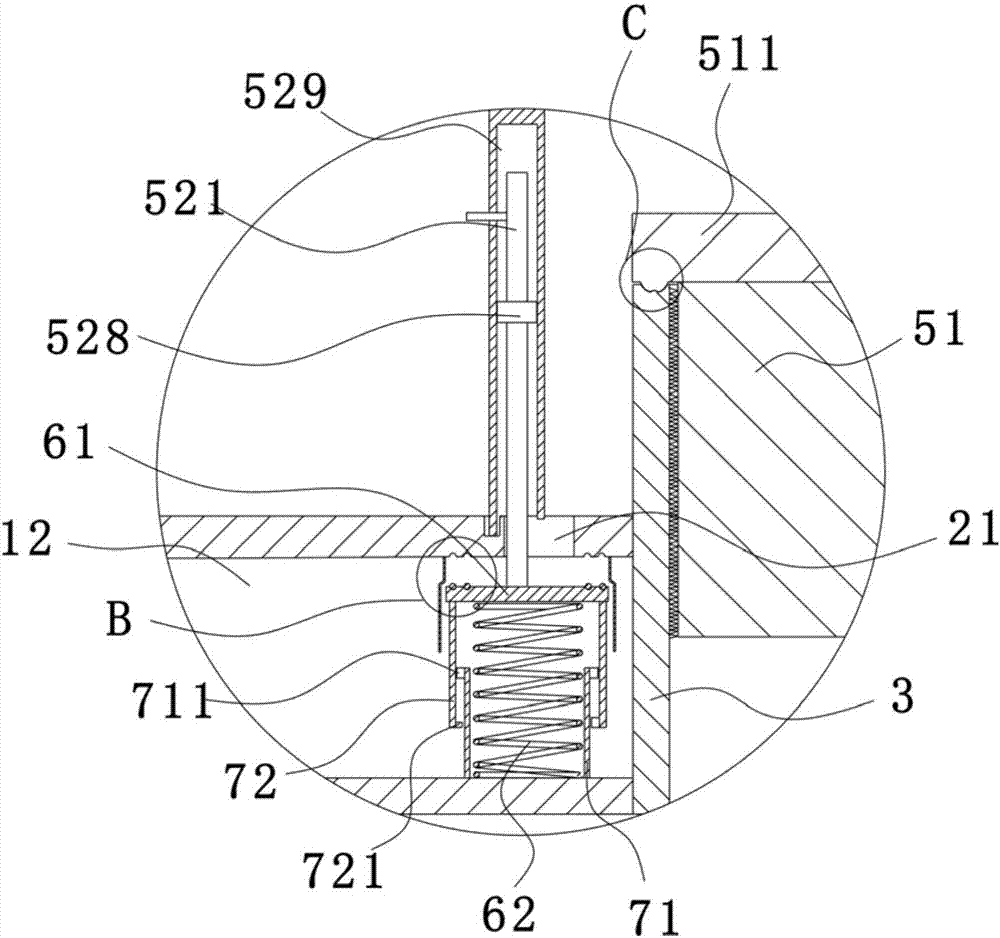
:丁酸梭菌(clostridiumbutyricum)又名酪酸菌,是一种厌氧的革兰氏阳性芽孢杆菌,是1933年由日本千叶医科大学宫入近治博士首先发现并报告的,因此又叫宫入菌。1935年,kingimiyairi博士从人的粪便和土壤中分离出丁酸梭菌,随后发现其厌氧培养的过滤物中含有较少的脂肪酸,可抑制肠道中的致病菌,促进肠道中有益菌如双歧杆菌和乳杆菌的生长,具有极强的整肠作用。丁酸梭菌、乳酸菌以及双歧杆菌在调节肠道环境上有着相似的功能,但双歧杆菌、乳酸杆菌等微生态制剂在临床使用中存在一个致命的弱点,即贮存和口服过程中易受外界各种生化和物理因素的影响而失去活性。特别是双歧杆菌对外界环境抵抗力极弱,室温保存活菌数会大幅度降低,直接口服也易被胃酸灭活而降低疗效,需制成肠溶胶囊加以保护且低温存放,另外抗生素也对其有杀灭作用,因而临床上不宜与抗生素同服。而丁酸梭菌耐热、耐酸、耐胆汁,并且对常用抗生素有抗性,能够克服上述微生态制剂的种种弊端。因此,丁酸梭菌在临床上已被广泛应用于治疗消化、小儿等各种原因引起的肠道菌群紊乱、急慢性腹泻、肠易激综合征、抗生素相关性肠炎等各种肠道疾病,而且在日本、韩国等地作为饲料添加剂应用于畜禽养殖上也取得了很好的效果,是一种理想的、具有广阔开发前景的微生态制剂。由于丁酸梭菌严格厌氧,在发酵环境中如有氧气存在,丁酸梭菌菌体将不会生长甚至死亡;丁酸梭菌对于生长最佳ph要求较严格,若偏离最佳ph范围,亦将导致菌体生长不良,因此在生产上极难发酵生产,据可查资料报告,目前实验室最佳发酵成绩是达到菌体浓度8亿cfu/ml,而工业化大生产最佳发酵水平为4亿cfu/ml。技术实现要素:本发明为了克服现有技术的不足,提供一种菌体浓度高、发酵活菌数多的丁酸梭菌的分段连续发酵工艺。为了实现上述目的,本发明采用以下技术方案:一种丁酸梭菌的分段连续发酵工艺,包括以下步骤:(1)依次对丁酸梭菌进行试管培养、三角瓶深层培养、种子罐扩大培养,以此得到丁酸梭菌菌液;(2)制配培养基,之后将培养基的ph调节至7.0于121-128℃条件下消毒30-35min,然后投入发酵罐中,成为基础发酵液;之后向基础发酵液中投加复合酶制剂,进行12-24h的发酵,制得发酵液a;(3)对步骤2)中制得的发酵液a进行低温灭菌,按1%的比例向发酵液a中加入步骤1)制得的丁酸梭菌菌液,并进行24-48h的发酵,得到发酵液c;(4)将步骤3)制得的发酵液c进行排放,同时向发酵罐内补充添加等量的发酵液a,进行发酵,以此循环往复;(5)将步骤3)中制得的发酵液c进行真空减压浓缩后,通过喷雾设备进行喷雾干燥得到成品。本发明具有两次接种、两次发酵过程,第一次接种诱导酶进行诱导酶的发酵,第二次接种丁酸梭菌菌液进行丁酸梭菌芽孢的发酵;发酵过程中只需第一次投入发酵液,间隔一定时间进行补料,即可连续向发酵罐外排放发酵液,由此反复循环,避免了间歇性发酵工艺的清罐、上料、灭菌、冷却等复杂的准备性工艺环节,保证了完全在密闭的管道内进行,从而有效地减少了污染机会,降低了生产成本。进一步的,所述培养基由葡萄糖2份、玉米粉1.0份、大豆粉4.0份、酵母粉0.8份、消泡剂0.1份加生活饮用水配制而成。优选的,所述复合酶制剂为蛋白酶、脂肪酶、纤维素酶、木聚糖酶、葡聚糖酶、甘露聚糖酶中的一种或多种。进一步的,所述步骤3)中,在投放丁酸梭菌菌液之前,先行向发酵液a中加入碳酸氢钙、氯化钙、硫酸铵、硫酸镁、硫酸锰。进一步的,按重量份数计,所述碳酸氢钙、氯化钙、硫酸铵、硫酸镁、硫酸锰的投放量为碳酸氢钙0.05份,氯化钙0.0015份,硫酸铵0.1份,硫酸镁0.015份,硫酸锰0.015份。进一步的,所述步骤2)的发酵环节中发酵罐的温度为37℃、罐压为0.01mpa。进一步的,所述步骤3)的发酵环节中发酵罐的温度为37℃、罐压为0.01mpa,罐内ph为6.5。进一步的,所述发酵罐包括内罐体、外罐体、进料管件、设于内罐体和外罐体间的加热层、设于内罐体内的加热管件及与进料管件相配合的密封部件,所述加热管件与所述加热层相连通;所述密封部件包括第一密封件和套设于第一密封件上的第二密封件,所述第一密封件和第二密封件间具有液封层,该液封层通过设于外罐体上的流液开口与加热层相连通;通过设置内加热管件和加热层,可对发酵罐内的液体进行恒温水浴加热,且内管件于内部加热,加热层于外部加热,使整个发酵液内外均匀受热,且维持于37℃恒温下,保持菌体正常生长;设置第一密封件件可对进料管件实现初步密封,避免短时间内氧气进入至发酵罐内,导致菌体死亡,设置第二密封件可实现了二次密封,进一步将进料管件和大气隔开,且于第一密封件和第二密封件之间形成的空隙作为液封层,向内部通入液体实现液封,可完全隔绝氧气进入至发酵罐内,且密封的时间长,不受密封时间的影响,可顺利保证菌体的正常生长;通过设置流液开口将加热层和液封层相连通,因此加热层内的液体可进入至液封层内,对液封层填充液体,且保持液封层的液体温度与加热层内液体温度相同,避免外部温度通过进料管件穿入至发酵罐内,造成发酵罐内温度不稳定而导致菌体无法正常生长;同时还减小了操作工序,无需专门添加液体至液封层内以实现液封,便于操作。进一步的,所述加热层内设有与所述流液开口相配合的封闭件和与所述封闭件固连的弹性件,所述弹性件与所述内罐体固连;所述第二密封件上设有用于推动所述封闭件向下活动的推杆;封闭件可封闭流液开口,于第二封闭件未安装时,使加热层封闭,便于液体填充满加热层,便于提前加热发酵罐,使加热罐内温度达到所需温度,便于发酵液快速达到所需的温度,且使整个发酵液整体受热均匀,避免局部受热而造成部分发酵液无法发酵出菌体;弹性件使封闭件与流液开口紧密贴合,实现对流液开口密封;而设置推杆,在第二密封件套设于进料管件时,推动推杆使封闭件向下活动,打开流液开口使液体进入至液封层内,对液封层实现液封,其操作简单,使用便捷。进一步的,所述外罐体内壁上设有限位套,所述封闭件设于该限位套内;所述弹性件上套设有一套管部件,该套管部件包括固设于内罐体上的下套管和固设于所述封闭件下端面上的上套管,所述下套管部分穿设于所述上套管内;所述下套管外壁上设有一第一凸环,所述上套管内壁上设有与所述第一凸环相配合的第二凸环;设置限位套,且封闭件位于限位套内,对封闭件实现限位,避免封闭件封闭时位置发生偏移而造成流液开口无法完全封闭,导致加热层内液体流出;设置上套管和下套管套设在弹性件上,对弹性件实现定位,避免因弹性件左右晃动而造成封闭件偏移,确保封闭件成功封闭流液开口,且设置成上下套管,不会影响弹性件向下收缩,确保弹性件正常使用;于上套管内设置第一凸环,下套管内设置第二凸环,两凸环相互限制,避免上套管从下套管上脱离开,造成装置不稳定。综上所述,本发明具有以下优点:采用发酵液排出,间隔补料的方式进行循环发酵操作,无需进行多次清罐、上料、灭菌、冷却等操作,极大程度的降低了工作量和工人的投入量,降低了生产成本;同时,由于循环发酵全程均在密闭状态下进行,有效避免了菌体内污染的可能,极大程度的提高发酵活菌数和提升菌体浓度。附图说明图1为本发明的结构示意图。图2为图1中a处的放大图。图3为图2中b处的放大图。图4为图4中c处的放大图。具体实施方式为了使本
技术领域:
的人员更好的理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述。实施例1一种丁酸梭菌的分段连续发酵工艺,包括以下步骤:(1)依次对丁酸梭菌进行试管培养、三角瓶深层培养、种子罐扩大培养,以此得到丁酸梭菌菌液;其中试管培养为:将冻存管中的丁酸梭菌菌株,置于具有液体培养基的试管中,培养48h;之后将试管置于80℃的水中水浴10min,随后将试管中的丁酸梭菌接入至500ml(装量为200ml)的种子培养基中,在温度为37℃,厌氧条件下于培养8h;三角瓶深层培养为:将经过种子培养基培养后的丁酸梭菌按5%的接种量接入至装液量为2l的5l三角瓶中继续培养8h;种子罐扩大培养为:将经过三角瓶培养后的丁酸梭菌按5%的接种量投入50l种子罐中进行扩大培养;(2)将葡萄糖2kg,玉米粉1.0kg,大豆粉4.0kg,酵母粉0.8kg,消泡剂0.1kg,加生活饮用水配制制成培养基,之后向培养基中投入nahco3,nahco3的投入量为直至将培养基的ph调节至7.0为止;之后将培养基于121℃条件下消毒30min,然后投入1000l的发酵罐中,成为基础发酵液;之后向基础发酵液中投加蛋白酶、脂肪酶、纤维素酶、木聚糖酶、葡聚糖酶、甘露聚糖酶,具体投入量根据实际需要而定;之后于37℃、0.01mpa罐压的条件下对发酵罐内的物料进行12h的发酵,制得发酵液a;(3)对步骤2)中制得的发酵液a进行低温灭菌;随后以碳酸氢钙0.05kg,氯化钙0.0015kg,硫酸铵0.1kg,硫酸镁0.015kg,硫酸锰0.015kg的比例向发酵液a中添加上述物料;之后再按1%的比例向发酵液a中加入步骤1)制得的丁酸梭菌菌液;之后向培养基中投入nahco3,nahco3的投入量为直至将培养基的ph调节至6.5为止;之后于37℃、0.01mpa罐压的条件下对发酵罐内的物料进行24h的发酵,得到发酵液c;上述数据是经过多次实验之后得到的最优方案,实验证明当ph低于6.5或高于6.5时,丁酸梭菌菌液会出现极大程度的灭活现象,在最终得到的发酵液中,丁酸梭菌的活菌数过低,制得的饲料与普通饲料差异无几;而当ph处于6.5,而温度低于37℃时,丁酸梭菌依旧难以维持在最佳的活化状态上;而当温度高于37℃时,大量的丁酸梭菌将出现失活,制得的发酵液活菌数甚至还要低于采用普通制备方法制得的发酵液;从而,经过对此的对比试验之后,确定出,只有当ph值等于6.5,发酵温度等于37℃时,才能够使得发酵液中的丁酸梭菌的活菌数达到最高,达到20-25×108cfu/ml的活菌数,从而成为最优方案。(4)将发酵液c进行排放,同时向发酵罐内补充添加等量的发酵液a,进行发酵,以此循环往复;之后将排放出的发酵液c采用真空减压浓缩罐进行真空减压浓缩后,通过喷雾设备进行喷雾干燥得到成品。进一步的,如图1-4所示,所述的发酵罐包括内罐体1、外罐体2、加热层12、加热管件4及密封部件5,所述的内罐体1设在外罐体2内,且两罐体之间具有间隙,该间隙为所述的加热层12;所述的加热管件4螺旋设在内罐体1内,且该加热管件4一端与所述加热层12相连通,另一端与设于发酵罐外的恒温池相连通,所述的恒温池通过泵体将恒温水泵送入加热管件4内,同时加热管件4内的水进入至加热层12内,将加热层12填充满,从而实现对发酵罐的整体升温,使发酵罐内的整体温度达到37℃;进一步的,所述的进料管件3设再外罐体2上,且穿过两个罐体与设于内罐体1内的腔室相连通,该进料管件3为带有内螺纹的金属管。为了保证对进料管件实现密封,在所述进料管件上设置有一个密封部件5,该密封部件5包括第一密封件51和第二密封件52,所述的第一密封件51为一带有外螺纹的圆台形金属塞,因此第一密封件51可螺接入进料管件3上,且第一密封件51上端部上设有一密封帽511,该密封帽511上设有一凹环512,且凹环512内设有一密封圈513,该密封圈为o形橡胶密封圈;所述进料管件3上端部的内壁上设有与所述密封圈513相配合的密封凹环313,该密封凹环313内设有一向上凸起的凸筋314,所述第一密封件51螺接入进料管件3后,所述密封圈513侧壁与所述密封凹环313的侧壁紧密贴合,所述的凸筋314使密封圈513发生局部变形,从而在密封圈513在弹力作用下,与凸筋314紧密贴合,不会留有缝隙,完全杜绝液体从第一密封件51和进料管件3的连接处进入至内罐体1中;进一步的,所述的第二密封件52套设在进料管件3外,且第二密封件52与第一密封件51间设有液封层53,该液封层53为第一密封件51和第二密封件52间的间隙,且在外罐体2上设置了两个流液开口21,者两个流液开口21为对称设置,通过这两个流液开口21使液封层53与加热层12相连通,从而加热层12内的水可通过一个流液开口21进入至液封层53,然后通过另一个流液开口21回到加热层53。进一步的,为了对流液开口21实现开启和关闭,在所述加热层12内设有两个封闭件61,两封闭件61分别分配至两流液开口21处,即每个流液开口21通过一个密封件61实现密封,所述的密封件61为一金属板;在所述的第二密封件上设有用于推动所述密封件61向下按活动的推杆521,该推杆为金属杆;具体的,在所述的第二密封件52的侧壁上设有活动腔529,所述的推杆521设在活动腔529内;该活动腔下端部为开口设置,因此推杆521可部分伸出活动腔,从而下压封闭件61,且推杆521上固设有橡胶活塞528,该橡胶活塞528与所述活动腔529的内壁紧密贴合,且活动腔529的内壁为光滑设置,因此液体无法从活动腔529内流出,避免发生漏液情况;为了增强密封件61对流液开口21的密封性,在所述流液开口21的周边设有两个由内向外凹陷的凹环219,在所述密封件61的上端面上设有两个与所述凹环219相配合的防漏圈619,该漏圈为o形橡胶圈,封闭件61封闭流液开口21,防漏圈619卡入至凹环219内,且防漏圈619与凹环219内壁紧密贴合;为了保持封闭件61封闭流液开口21,在所述封闭件61的底面上固连有两个弹性件62,该弹性件62为弹簧,且两弹性件62固设在所述内罐体1上,从而封闭件61在弹性件62弹力作用下,保持对流液开口21封闭。进一步的,为了保证封闭件61对流液开口21封闭的准确性,在所述外罐体2的内壁上设有一限位套22,该限位套22包括第一套体221和第二套体222,所述的第一套体221的横切面直径与封闭件的直径大小相同,即封闭件61的侧壁与第一套体221内壁相贴合,第二套体222的横切面直径大于第一套体221的横切面直径,且两个套体无缝连接,因此密封件61在经过外力向下推动时,密封件61从第一套体221内推至第二套体222中,密封件61和第二套体222的侧壁具有间隙,因此水从该间隙流进或流出;进一步的为了避免弹性件62发生左右晃动,从弹性件62下端套设有一个下套管71,上端套设有一上套管72,所述的上套管72与封闭件61的下端面固连,下套管71与所述内罐体1的外壁固连,且下套管71部分穿设于上套管72内,且在所述的上套管72的内壁上固设有一第二凸环721,下套管71外壁的上端固设有第一凸环711,所述的第二凸环721和第一凸环711相互限制,从而上套管72无法从下套管71中脱离开,确保了装置的稳定性。为了使得加热管件4、加热层12及液封层53内的液体循环流动,在所述外壳体上设有与加热层12相连通的出水管件81,该出水管件81的高于所述第二密封件52的高度,因此可保持液封层53内的液体充满;在发酵罐的下端部上设有与所述内罐体相连通的出料管道82;在所述发酵罐的侧壁上设有伸入至内罐体内的温度计83和ph计84。实施例2一种丁酸梭菌的分段连续发酵工艺,包括以下步骤:(5)依次对丁酸梭菌进行试管培养、三角瓶深层培养、种子罐扩大培养,以此得到丁酸梭菌菌液;其中试管培养为:将冻存管中的丁酸梭菌菌株,置于具有液体培养基的试管中,培养48h;之后将试管置于80℃的水中水浴10min,随后将试管中的丁酸梭菌接入至500ml(装量为200ml)的种子培养基中,在温度为37℃,厌氧条件下于培养8h;三角瓶深层培养为:将经过种子培养基培养后的丁酸梭菌按5%的接种量接入至装液量为2l的5l三角瓶中继续培养8h;种子罐扩大培养为:将经过三角瓶培养后的丁酸梭菌按5%的接种量投入50l种子罐中进行扩大培养;(6)将葡萄糖2kg,玉米粉1.0kg,大豆粉4.0kg,酵母粉0.8kg,消泡剂0.1kg,加生活饮用水配制制成培养基,之后向培养基中投入nahco3,nahco3的投入量为直至将培养基的ph调节至7.0为止;之后将培养基于128℃条件下消毒35min,然后投入1000l的发酵罐中,成为基础发酵液;之后向基础发酵液中投加蛋白酶、脂肪酶、纤维素酶、木聚糖酶、葡聚糖酶、甘露聚糖酶,具体投入量根据实际需要而定;之后于37℃、0.01mpa罐压的条件下对发酵罐内的物料进行24h的发酵,制得发酵液a;(7)对步骤2)中制得的发酵液a进行低温灭菌;随后以碳酸氢钙0.05kg,氯化钙0.0015kg,硫酸铵0.1kg,硫酸镁0.015kg,硫酸锰0.015kg的比例向发酵液a中添加上述物料;之后再按1%的比例向发酵液a中加入步骤1)制得的丁酸梭菌菌液;之后向培养基中投入nahco3,nahco3的投入量为直至将培养基的ph调节至6.5为止;之后于37℃、0.01mpa罐压的条件下对发酵罐内的物料进行48h的发酵,得到发酵液c;上述数据是经过多次实验之后得到的最优方案,实验证明当ph低于6.5或高于6.5时,丁酸梭菌菌液会出现极大程度的灭活现象,在最终得到的发酵液中,丁酸梭菌的活菌数过低,制得的饲料与普通饲料差异无几;而当ph处于6.5,而温度低于37℃时,丁酸梭菌依旧难以维持在最佳的活化状态上;而当温度高于37℃时,大量的丁酸梭菌将出现失活,制得的发酵液活菌数甚至还要低于采用普通制备方法制得的发酵液;从而,经过对此的对比试验之后,确定出,只有当ph值等于6.5,发酵温度等于37℃时,才能够使得发酵液中的丁酸梭菌的活菌数达到最高,达到20-25×108cfu/ml的活菌数,从而成为最优方案。(8)将发酵液c进行排放,同时向发酵罐内补充添加等量的发酵液a,进行发酵,以此循环往复;之后将排放出的发酵液c采用真空减压浓缩罐进行真空减压浓缩后,通过喷雾设备进行喷雾干燥得到成品。本实施例中的发酵罐与实施例1中的结构相同,故不再赘述。实施例3一种丁酸梭菌的分段连续发酵工艺,包括以下步骤:(9)依次对丁酸梭菌进行试管培养、三角瓶深层培养、种子罐扩大培养,以此得到丁酸梭菌菌液;其中试管培养为:将冻存管中的丁酸梭菌菌株,置于具有液体培养基的试管中,培养48h;之后将试管置于80℃的水中水浴10min,随后将试管中的丁酸梭菌接入至500ml(装量为200ml)的种子培养基中,在温度为37℃,厌氧条件下于培养8h;三角瓶深层培养为:将经过种子培养基培养后的丁酸梭菌按5%的接种量接入至装液量为2l的5l三角瓶中继续培养8h;种子罐扩大培养为:将经过三角瓶培养后的丁酸梭菌按5%的接种量投入50l种子罐中进行扩大培养;(10)将葡萄糖2kg,玉米粉1.0kg,大豆粉4.0kg,酵母粉0.8kg,消泡剂0.1kg,加生活饮用水配制制成培养基,之后向培养基中投入nahco3,nahco3的投入量为直至将培养基的ph调节至7.0为止;之后将培养基于125℃条件下消毒35min,然后投入1000l的发酵罐中,成为基础发酵液;之后向基础发酵液中投加蛋白酶、脂肪酶、纤维素酶、木聚糖酶、葡聚糖酶、甘露聚糖酶,具体投入量根据实际需要而定;之后于37℃、0.01mpa罐压的条件下对发酵罐内的物料进行18h的发酵,制得发酵液a;(11)对步骤2)中制得的发酵液a进行低温灭菌;随后以碳酸氢钙0.05kg,氯化钙0.0015kg,硫酸铵0.1kg,硫酸镁0.015kg,硫酸锰0.015kg的比例向发酵液a中添加上述物料;之后再按1%的比例向发酵液a中加入步骤1)制得的丁酸梭菌菌液;之后向培养基中投入nahco3,nahco3的投入量为直至将培养基的ph调节至6.5为止;之后于37℃、0.01mpa罐压的条件下对发酵罐内的物料进行30h的发酵,得到发酵液c;上述数据是经过多次实验之后得到的最优方案,实验证明当ph低于6.5或高于6.5时,丁酸梭菌菌液会出现极大程度的灭活现象,在最终得到的发酵液中,丁酸梭菌的活菌数过低,制得的饲料与普通饲料差异无几;而当ph处于6.5,而温度低于37℃时,丁酸梭菌依旧难以维持在最佳的活化状态上;而当温度高于37℃时,大量的丁酸梭菌将出现失活,制得的发酵液活菌数甚至还要低于采用普通制备方法制得的发酵液;从而,经过对此的对比试验之后,确定出,只有当ph值等于6.5,发酵温度等于37℃时,才能够使得发酵液中的丁酸梭菌的活菌数达到最高,达到20-25×108cfu/ml的活菌数,从而成为最优方案。(12)将发酵液c进行排放,同时向发酵罐内补充添加等量的发酵液a,进行发酵,以此循环往复;之后将排放出的发酵液c采用真空减压浓缩罐进行真空减压浓缩后,通过喷雾设备进行喷雾干燥得到成品。本实施例中的发酵罐与实施例1中的发酵罐结构相同,故不再赘述。表1:本制备工艺发酵得到的丁酸梭菌产品菌数与通过常规发酵得到的产品的菌数比较表发酵工艺普通发酵工艺本发明发酵工艺试验一2×108cfu/ml22×108cfu/ml试验二1.8×108cfu/ml21×108cfu/ml试验三2.5×108cfu/ml25×108cfu/ml试验四3.0×108cfu/ml23×108cfu/ml试验五2.6×108cfu/ml21×108cfu/ml试验结果表明:本制备工艺能有效提高发酵后丁酸梭菌产品的活菌数。试验报告:实验目的:本产品对断奶仔猪的促生长和调整肠道菌群的作用实验时间:2015年10月1日~11月11日实验方法:选取21日龄断奶的仔猪192头,分为4个处理组,每个处理4个重复,每个重复12头,空白对照组饲喂基础日粮,试验2-4组分别在基础日粮中添加100、200和300mg/kg的丁酸梭菌制剂(即丁酸梭菌含量分别为1.0×108、2.0×108、3.0×108cfu/kg饲料),试验期21天。实验期间观察各组猪群采食和饮水情况,记录耗料量,测定断奶后21天的体重,计算平均日增重、平均日采食和料重比;收集试验结束时的粪样,测定其中大肠杆菌、乳酸杆菌和双歧杆菌的数量。实验结果:如下表。表2:丁酸梭菌对断奶仔猪生长性能的影响注:同行标注不同字母表示差异显著。试验结果表明:本发明生产的丁酸梭菌可以显著提高断奶仔猪的平均日增和平均日采食量,降低料重比,减少粪便中大肠杆菌的数量,对乳酸菌的数量无影响影响,显著提高双歧杆菌的繁殖。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1