检测人类EGFR基因突变的试剂盒、反应体系及方法与流程
本发明涉及一种检测基因突变的试剂盒、反应体系及方法,特别涉及一种检测人类EGFR基因突变的试剂盒、反应体系及方法。
背景技术:
一直以来肺癌都位居全球癌症相关死亡的首位。世界卫生组织国际癌症研究署发布的癌症报告显示:全球肺癌新发病例预测约161万例,死亡约138万例,分别占恶性肿瘤新发病例及死亡病例的13%及18%,居恶性肿瘤第一位。其中非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)占肺癌的80%以上,尽管肺癌的诊断方法和治疗手段不断提高,肺癌的死亡率仍未得到有效控制,患者的预后较差,5年生存率仍<20%。
人类表皮生长因子受体家族(epidermal growth factor receptor family,EGFR家族)属于酪氨酸激酶受体家族,是一种多功能糖蛋白,其广泛分布于人体各组织细胞膜上,是原癌基因的表达产物,其基因位于第七号染色体短臂上(7p12),由188.307K个碱基组成,共有28个外显子,EGFR具有酪氨酸激酶(tyrosine kinase,TK)区,其是传递胞外信号到胞内的重要途经蛋白,并由外显子18.24编码。EGFR家族成员的结构相似,都包括胞外段、跨膜区和胞内段三部分。胞外段为受体与配体结合部,跨膜段为疏水部,将受体固定于细胞膜上,胞内区有典型的ATP结合位点和酪氨酸激酶区,其酪氨酸激酶活性在调节细胞增殖及分化中起着至关重要的作用。肺癌病人EGFR基因的编码区突变主要发生于外显子18.21上,当配体与受体结合后,引起受体的二聚化作用,形成同型或异型二聚体,二聚化的受体发生交联磷酸化,即一个受体和另外一个受体上特定的酪氨酸残基磷酸化,激活胞内区的TK亚区,从而激发下一级信号传导。
近年来,表皮细胞生长因子受体(EGFR)酪氨酸激酶抑制物(TKIs)吉非替尼、厄洛替尼和阿法替尼等被证明对具有EGFR激活突变的晚期非小细胞肺癌(NSCLC)患者具有显著疗效,EGFR-TKI成为非小细胞肺癌治疗的里程碑。同时,几乎所有初始时对EGFR-TKI反应良好的患者会在6-12个月内出现耐药、疾病进展,称为“获得性耐药”。许多研究已证实EGFR的突变状态决定了肿瘤对EGFR-TKI的反应,存在T790M突变的患者对TKI类药物不敏感或耐药。因此治疗前应进行EGFR突变检测筛选具备EGFR-TKIs治疗指征的患者,治疗中持续监测突变状态的变化,及时发现耐药突变改变治疗策略,对于EGFR-TKI的个体化治疗及预测预后有重要意义。
目前检测EGFR基因突变最常用的样本来源是肿瘤的病理组织或细胞学标本,但是组织取材均为有创操作,有时难以实施,且这些操作受肿瘤大小、部位、患者一般情况等影响,有时不能取得满意的组织或组织量太少不能进行基因突变检测。并且随着疾病的进展和EGFR-TKIs耐药性的出现,常常需要再次进行分子生物学检测,而组织取材为有创操作,不能便捷、反复进行。近些年血浆游离DNA(ctDNA)被认为是一种可能代替肿瘤组织用来检测肿瘤特异性改变的样本。肿瘤组织、肿瘤细胞坏死及脱落的肿瘤细胞进入血液后凋亡释放游离DNA进入外周血。ctDNA用于肿瘤突变检测优势在于:操作无创;在疾病的任一进程中都可获取;可以作为一种肿瘤标记物,实现实时检测和动态监测;克服肿瘤组织的异质性。因此,使用外周血游离DNA监测患者EGFR基因突变状态,探索患者EGFR-TKI耐药机制及预测预后成为一条可行的途径。然而,目前使用ctDNA检测EGFR基因突变仍有一些技术上的挑战。1)ctDNA含量因人而异,并且大多数人含量较低;2)ctDNA片段相对小,约为180bp:3)ctDNA中肿瘤相关的DNA所占比例不同人差别较大,并且常因比例小而难以测出;4)以前的研究显示,与肿瘤组织相比,ctDNA检测EGFR突变灵敏度仅为43-66%。因此,高灵敏度的ctDNAEGFR基因突变检测技术的发展十分重要。
中国非小细胞肺癌患者EGFR基因突变率约为34%,主要发生在外显子19和21,占所有突变的90%以上,存在以上两种发生在外显子19和21突变类型的患者对TKIs敏感。在EGFR突变中,约有40%的突变类型是L858R,现在常用的L858R的突变检测方法是ARMS-PCR,灵敏度约1%。但在ctDNA中,突变频率常常会低于1%,且ctDNA片段较小,用ARMS-PCR无法获得很好的检测效果。
公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术人员所公知的现有技术。
技术实现要素:
本发明的目的在于提供一种检测人类EGFR基因突变的试剂盒、反应体系及方法,该试剂盒针对EGFR基因L858R突变设计了特定序列的引物对和特定序列的探针,在优化的反应体系中通过Thermo QuantStudio 3D digital PCR平台的方法,实现对EGFR基因L858R突变的高灵敏度检测,并且在检测L858R突变的阴阳性的同时还可以获得样本中该突变的比例,从而为EGFR靶向治疗提供参考;进一步的本申请中可检测的样本来源多样,既可以是肿瘤组织,也可以是ctDNA,扩大了该试剂盒、反应体系和方法的使用范围。
本发明的具体技术方案如下:
一种检测人类EGFR基因L858R突变的试剂盒,包括:具有如SEQ ID NO:1所示序列的上游引物、具有如SEQ ID NO:2所示序列的下游引物、具有如SEQ ID NO:3所示序列的检测L858R突变的荧光探针和具有如SEQ ID NO:4所示序列的检测野生型的荧光探针。上游引物SEQ ID NO:1的序列为GCAGCATGTCAAGATCACAGATT,下游引物SEQ ID NO:2的序列为CCTCCTTCTGCATGGTATTCTTTCT。检测L858R突变的荧光探针序列SEQ ID NO:3为GTTTGGCCCGCCCAAA,检测野生型的荧光探针序列SEQ ID NO:4为GTTTGGCCAGCCCAAA。检测L858R突变的荧光探针5’端连接有荧光报告基团,优选为FAM,检测L858R突变的荧光探针3’端连接有淬灭基团,优选为MGB;检测野生型的荧光探针5’端连接有荧光报告基团,且该荧光报告基团不同于检测L858R突变的荧光探针中的荧光报告基团,优选为VIC,检测野生型的荧光探针3’端连接有淬灭接团,优选为MGB。
上述试剂盒在另一种实现方式中,所述上游引物、下游引物、检测L858R突变的荧光探针和检测野生型的荧光探针均以引物探针混合液的形式存在,即所述上游引物、下游引物、检测L858R突变的荧光探针和检测野生型的荧光探针均溶解在同一TE缓冲液中,所述上游引物在引物探针混合液中的浓度为12μM,所述下游引物在引物探针混合液中的浓度为12μM,所述检测L858R突变的荧光探针在引物探针混合液中的浓度为3μM,所述检测野生型的荧光探针在引物探针混合液中的浓度为3μM。
上述试剂盒在另一种实现方式中,还包括数字PCR反应预混液,优选QuantStudioTM3D Digital PCR Master Mix v2。
上述试剂盒在另一种实现方式中,还包括阳性质控品,所述阳性质控品通过以下方式制备获得:将EGFR L858R突变细胞系基因组DNA与野生型细胞系基因组DNA混合后使L858R突变比例占总DNA的约1.3%。
上述试剂盒在另一种实现方式中,还包括阴性质控品,所述阴性质控品为不含有EGFR L858R突变的EGFR野生型细胞系基因组DNA。
一种检测人类EGFR基因L858R突变的PCR反应体系,包括:
其中所述引物探针混合液中包括具有如SEQ ID NO:1所示序列的上游引物、具有如SEQ ID NO:2所示序列的下游引物、具有如SEQ ID NO:3所示序列的检测L858R突变的荧光探针、具有如SEQ ID NO:4所示序列的检测野生型的荧光探针;上游引物、下游引物、检测L858R突变的荧光探针和检测野生型的荧光探针在PCR反应体系的终浓度分别为800nM、800nM、200nM和200nM。
上述PCR反应体系在另一种实现方式中,所述DNA的来源为肿瘤组织中提取的DNA或血浆游离DNA。
一种检测人类EGFR基因L858R突变的芯片式数字PCR方法,包括以下步骤:
1.配制上述检测人类EGFR基因L858R突变的反应体系;
2.把反应体系上样到数字PCR芯片中;
3.把数字PCR芯片放入专用PCR仪中,进行PCR扩增;
4.从专用PCR仪中取出芯片并放至室温后,将芯片放入芯片扫描仪中扫描荧光信号;
5.计算机根据荧光信号计算突变比例。
上述芯片式数字PCR方法在另一种实现方式中,所述PCR扩增的程序为:(1)96℃,10min;(2)57℃,2min;(3)继续进行39个循环,每个循环包括98℃进行30sec,然后57℃进行2min;(4)39个循环之后在10℃下保持不超过12小时。
本申请采用的芯片式数字PCR的检测原理如下:数字PCR芯片上含有2万个纳米级微孔,用Chip-Loader将上述PCR反应体系的混合液加样到数字PCR芯片上,混合液由于亲疏水作用进入芯片的微孔中并在专用PCR仪中进行PCR反应。微孔中包含DNA模板,PCR扩增结束后,野生型DNA和突变型DNA分别对应的荧光信号会出现在含有相应DNA模板的微孔中,没有模板的微孔则没有荧光信号产生。用芯片扫描仪扫描并读取这些荧光信号信息,再根据泊松分布原理可以计算出DNA模板的拷贝数。由于数字PCR在进行结果判读时仅判断有无扩增,不依赖于Ct值,对PCR反应抑制剂的耐受能力大大提高,不需要参考品和标准曲线就可以精确定量。
与现有技术相比,本发明具有如下有益效果:
1.本申请根据EGFR L858位点设计了特异性的引物和探针,使得在Thermo QuantStudio 3D digital PCR平台上检测灵敏度达到万分之五~干分之一,与ARMS-PCR相比,灵敏度提高,并且在检测L858R突变的阴阳性的同时还可以获得样本中该突变的比例,可以更好的进行靶向药物的选择,病情监测和预后评估等。
2.该数字PCR可以扩增不到100bp的片段,因此既可用于肿瘤组织提取的DNA,也可以用于ctDNA的扩增。
3.与液滴式数字PCR(digital droplet PCR)相比,芯片式数字PCR无需对PCR反应体系进行液滴化处理,因此整个检测过程时间较短且不存在液滴不均一的情况,理论上结果稳定;并且成本较液滴式数字PCR低,反应通量灵活(1~24个样本均可),液滴式数字PCR一次反应为8个。
4.与NGS Ctdna测序对比,时间短,速度快,准确性高。
附图说明
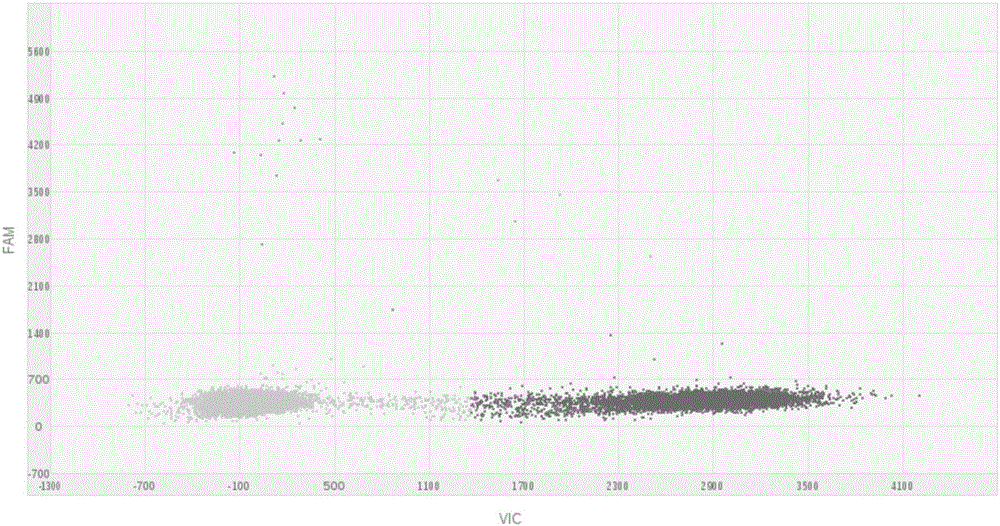
图1是本发明实施例2中EGFR基因L858R突变比例38%的样品的检测结果;
图2是本发明实施例2中EGFR基因L858R突变比例2%的样品的检测结果;
图3是本发明实施例2中EGFR基因L858R突变比例0.1%的样品的检测结果;
图4是本发明中EGFR基因无L858R突变的野生型样品进行检测的检测结果;
图1-图4中,显示的每个点对应芯片上的一个微孔,其中:既没有FAM荧光信号也没有VIC荧光信号的点代表该微孔没有进入DNA模板,因此没有任何扩增信号(即:区域1);有FAM荧光信号但没有VIC荧光信号的点(即:区域2)代表该微孔进入了发生L858R突变的DNA模板,因此有FAM荧光信号产生;有VIC荧光信号但没有FAM荧光信号的点(即:区域3)代表该微孔进入了野生型模板,因此有VIC荧光信号;既有FAM荧光信号也有VIC荧光信号的点(即:区域4)代表该微孔同时进入了野生型和突变型两种模板,因此同时出现了FAM+VIC信号。
具体实施方式
下面结合附图,对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
实施例1检测人类EGFR基因L858R突变的试剂盒的组成
一种检测人类EGFR基因L858R突变的试剂盒,包括:引物探针混合液和数字PCR反应预混液,其中:引物探针混合液是在TE缓冲液中溶解有具有如SEQ ID NO:1所示序列的上游引物、具有如SEQ ID NO:2所示序列的下游引物、具有如SEQ ID NO:3所示序列的检测L858R突变的荧光探针和具有如SEQ ID NO:4所示序列的检测野生型的荧光探针,其中:上游引物和下游引物在引物探针混合液中的浓度均为12μM,检测L858R突变的荧光探针和检测野生型的荧光探针在引物探针混合液中的浓度均为3μM,引物探针混合液的配制方法为:将上游引物、下游引物、检测L858R突变的荧光探针和检测野生型的荧光探针四种成分的干粉分别用TE缓冲液稀释到30μM,然后按照上游引物:下游引物:检测L858R突变的荧光探针:检测野生型的荧光探针=4∶4∶1∶1体积比混合,混合后的产物即为引物探针混合液;数字PCR反应预混液为QuantStudioTM 3D Digital PCR Master Mix v2。
检测人类EGFR基因L858R突变的试剂盒还可以包括:阳性质控品和阴性质控品,阳性质控品通过以下方式制备获得:将EGFR L858R突变细胞系基因组DNA与野生型细胞系基因组DNA混合后使L858R突变比例占总DNA的约1.3%;阴性质控品为不含有EGFR L858R突变的EGFR野生型细胞系基因组DNA。
实施例2检测人类EGFR基因L858R突变的方法
1.采用实施例1所述试剂盒;
2.按下表配制PCR反应体系:
3.按照CHIP-LOADER的说明书,将步骤2配制好的PCR反应体系的混合液加样至数字PCR芯片中,并用矿物油覆盖芯片,密封好芯片并检查确保无泄露;
4.把芯片放入专用PCR仪中,按照以下扩增程序进行设置;
5.扩增结束后,从PCR仪中取出芯片,室温放置10min,加入芯片扫描仪中读取;
6.计算机根据荧光信号计算突变比例。
实施例3使用实施例2中的方法对标准品进行检测
突变比例分别为38%、2%和0.1%的标准品的检测结果如图1-图3所示,野生型标准品的检测结果如图4所示,从图3中可以看出使用本申请试剂盒和检测方法,检测EGFR基因L858R突变的灵敏度可达到0.1%,其中:标准品是已知突变比例75%的EGFR突变型细胞系基因组DNA和野生型细胞系基因组DNA按照不同比例混合后得到的。
实施例4使用实施例2中的方法对实际样品进行检测
使用实施例2中的方法对20例临床为3~4期非小细胞肺癌病人的血样和与血样对应的组织样本进行检测。
一、血样中ctDNA的检测:
1.混匀保存在EDTA抗凝管中的全血样本10ml(样本采集不超过3小时)并转移到15ml离心管中,2000g、4℃离心10min,取澄清的血浆;
2.将血浆分装到1.5ml管中,放置于4℃离心机中设置转速为16000g离心15min,取澄清血浆;
3.用ctDNA提取试剂盒(Thermo Fisher Scientific公司的MagMAXTM Cell-Free DNAIsolation Kit),按照说明书操作提取ctDNA;
4.ctDNA经质检及Qubit3.0定量后确认总量不少于20ng,按照实施例2中的检测方法进行检测。
二、组织样本中的基因组DNA的检测:
与血样对应的20例组织样本用EGFR突变检测试剂盒(ARMS法)做了检测,发现的阳性样本继续用sanger测序做了验证,结果一致。
三、检测结果如下:
结果显示,20例样本的组织检测与ctdna检测结果完全一致,说明本试剂盒达到了非常好的效果。
前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
- 还没有人留言评论。精彩留言会获得点赞!