一种改性的聚缩酮PCADK及制备方法和医用用途与流程
技术领域
本发明提供一种改性的聚缩酮PCADK,同时还公开了制备方法和医用用途,属于药用材料领域。
背景技术:
蛋白质药物是一类新型的用于肿瘤治疗与预防的生物药物,与传统的化学药物相比,蛋白类药物作为治疗药物具有药效显著、靶点专一、副作用低、品种繁多等优点,有望成为未来临床治疗的重要发展方向。但是,由于蛋白质为生化制剂,其半衰期短、清除率高、渗透力差、易受环境中的复杂理化因素影响而失去其生物活性,使其作为治疗药物表现出较差的稳定性和治疗效果。因此,高效的运输载体是蛋白类药物应用的关键。
目前,生物可降解材料主要包括淀粉、明胶、葡聚糖、聚乳酸(PLA)和聚乳酸-乙醇酸共聚物(PLGA)等,其中,PLGA最为常用。PLGA缓释周期长,避免频繁给药,且使用安全,生物利用度显著提高,可应用于注射、口服、埋植等剂型。但PLGA体内降解产物为二氧化碳和水,酸性物质的产生会影响蛋白类药物的稳定性,带来后期不释放等问题。
聚缩酮家族,目前包括PPADK,PCADK及PK1-PK3。作为一类新型生物可降解材料,具有良好的生物兼容性、pH敏感性和蛋白友好性。与广泛应用的聚酯类高分子不同,聚缩酮在碱性或中性环境中相对稳定,在酸性条件下快速降解为无毒、中性小分子代谢产物,不改变环境pH值从而引起炎症反应,有效的避免了聚酯类降解产物产生的酸性环境对蛋白类药物稳定性的影响,解决了蛋白变性后释放困难等问题,弥补了聚酯类材料的不足。同时,能够对体内不同部位pH值的变化做出回应,是蛋白类药物靶向肿瘤(pH 6.0-7.0)及溶酶体(pH 4.0-6.0)等部位的理想载体。
但由于聚缩酮分子量偏低,力学性能较差,单独形成药物载体时外表易形成塌陷、结构松散、多孔洞、导致药物包封效率极低,只能采取与PLGA混用的办法,来提高载体的刚性结构和包封效率。此外,肿瘤靶向制剂通常以静脉注射方式给药,聚缩酮作为疏水性高聚物,进入人体血液系统后,将不可避免的吸附血浆蛋白,进而被巨噬细胞识别吞噬,因此,聚缩酮的生物兼容性有待提高。
聚乙二醇修饰pH敏感性聚合物,可以增加材料的亲水性,增加肿瘤细胞对载体的摄取,同时提高聚缩酮的分子量,改善聚缩酮的力学性能,使其能够自包封单独形成药物载体,增加蛋白类药物的包封效率。此外,聚乙二醇化技术仍有诸多优势,如降低免疫原性、延长载体循环时间及增加稳定性等。
技术实现要素:
本发明提供一种改性的聚缩酮PCADK及制备方法,解决了现有聚缩酮PCADK力学性质差、分散稳定性差及生物兼容性不好等问题,对聚缩酮PCADK进行亲水性修饰,从而获得一系列蛋白友好型的pH敏感双亲性材料。
一般地,材料表面亲水性越好,在血液环境中分散性越好,对血浆蛋白的阻抗能力越强,被免疫系统清除的概率越小,同时,作为双亲性材料,在溶液中自组装形成载体的能力更强。本发明选用聚乙二醇修饰聚缩酮,通过活性化合物作为中间连接分子,通过共价键与聚缩酮末端羟基连接,形成的氨酯键在酸性环境下为可降解化学键。与此同时,亲水性的聚乙二醇阻碍血浆蛋白的特异性吸附,延长载体材料在体内的血液循环周期,提高载体材料的分散稳定性。
本发明的另一目的是提供上述聚缩酮PCADK改性材料的制备方法。
本发明所述聚缩酮PCADK改性材料的结构式为:
其中,n = 31 ~ 34, 是聚乙二醇单甲醚链段,分子量分别为2000,5000和10000,m分别对应为45,113和227。a-c聚合物分别对应聚缩酮-聚乙二醇单甲醚2000,聚缩酮-聚乙二醇单甲醚5000和聚缩酮-聚乙二醇单甲醚10000。
本发明所述的一种聚缩酮PCADK改性材料的制备方法,步骤如下:
1)聚缩酮PCADK的合成
7.25mmol 的1, 4-环己烷二甲醇溶解在20 ~ 30mL蒸馏苯中,加热到90 ~ 100°C。35 ~ 55mg对甲苯磺酸溶解在0.5 ~ 1mL乙酸乙酯中,加入到上述苯溶液;加入7.25mmol的2, 2-二甲氧基丙烷,开始反应;每隔2h补偿2mL的苯和500μL 的2, 2-二甲氧基丙烷,氮气保护下搅拌反应24 ~ 48h,然后加入100 ~ 200μL三乙胺停止反应,合成的聚缩酮在0.5 ~ 1L冷的正己烷中沉淀分离;
2)聚乙二醇单甲醚的活化
聚乙二醇单甲醚的末端羟基的活化,0.2mmol的聚乙二醇单甲醚溶解在5~ 10mL的氯仿中,加入60 ~ 100倍摩尔比的1, 6-亚甲基二异氰酸酯,加热到60 ~ 80°C,过夜搅拌回流;粗产物在1~2L沉淀剂中多次沉淀,即获得活化的聚乙二醇单甲醚;
3)目标产物的合成
将步骤 (2) 获得的活化的0.2mmol聚乙二醇单甲醚溶解在6~8mL的氯仿中,0.8 ~ 1.2倍摩尔量的聚缩酮溶解在2 ~ 4mL氯仿中,聚缩酮溶液逐滴加入上述溶液,加热到60 ~ 80°C,过夜搅拌回流;粗产物在1 ~ 2L沉淀剂中多次沉淀,即获得目标产物。
本发明所述聚缩酮PCADK改性材料的制备方法,其特征在于:
所述步骤2)中聚乙二醇单甲醚分别是聚乙二醇单甲醚2000,聚乙二醇单甲醚5000和聚乙二醇单甲醚10000时,对应的产物分别为聚缩酮PCADK-聚乙二醇单甲醚2000,聚缩酮PCADK-聚乙二醇单甲醚5000和聚缩酮PCADK-聚乙二醇单甲醚10000。
本发明所述聚缩酮PCADK改性材料的制备方法,其特征在于:
所述步骤2)、3) 沉淀剂选自正己烷、石油醚、甲基叔丁基谜、乙醚、1,4-二氧六环等有机溶剂。
本发明的积极效果在于:
提供一种改性的聚缩酮PCADK,解决了现有聚缩酮PCADK力学性质差、分散稳定性差及生物相容性不好等问题,对聚缩酮进行亲水性修饰,从而获得一系列蛋白友好型的pH敏感双亲性材料,具有良好的pH敏感性、亲水性、稳定性和力学性能,能够独立作为药物载体使用,包封化药及蛋白类药物,靶向肿瘤及炎症部位。
附图说明
图1为实施例1聚缩酮PCADK改性材料的合成示意图;
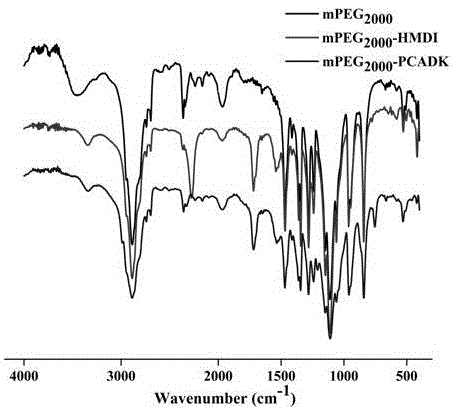
图2为实施例1聚缩酮PCADK改性材料的傅里叶红外光谱图;
图3为实施例1聚缩酮PCADK改性材料的凝胶渗透色谱图;
图4为实施例1 ~ 3聚缩酮PCADK改性材料的细胞毒性结果;
图5为实施例1 ~ 3聚缩酮PCADK改性材料制备人血清白蛋白(HSA)纳米粒的稳定性结果。
具体实施方式
通过以下实施例进一步举例描述本发明,并不以任何方式限制本发明,在不背离本发明的技术解决方案的前提下,对本发明所作的本领域普通技术人员容易实现的任何改动或改变都将落入本发明的权利要求范围之内。
实施例1
聚缩酮PCADK-聚乙二醇单甲醚2000,其结构式为:
其制备方法如下:
(1)聚缩酮PCADK的合成
1, 4-环己烷二甲醇溶解在20 ~ 30mL蒸馏苯中,加热到90 ~ 100°C。35 ~ 55mg对甲苯磺酸溶解在0.5 ~ 1mL乙酸乙酯中,加入到上述苯溶液。加入与1, 4-环己烷二甲醇等摩尔量的2, 2-二甲氧基丙烷,开始反应。随机补偿蒸馏的苯和2, 2-二甲氧基丙烷,氮气保护下搅拌反应24 ~ 48h,然后加入100 ~ 200μL三乙胺停止反应,合成的聚缩酮在0.5 ~ 1L冷的正己烷中沉淀分离。
(2)聚乙二醇单甲醚2000的活化
聚乙二醇单甲醚2000的末端羟基的活化,聚乙二醇单甲醚2000溶解在5 ~ 10mL氯仿中,加入60 ~ 100摩尔倍数的1, 6-亚甲基二异氰酸酯,加热到60 ~ 80°C,过夜搅拌回流。粗产物在1 ~ 2L正己烷中多次沉淀,即获得活化的聚乙二醇单甲醚2000。
(3)目标产物的合成
将步骤 (2) 获得的活化的聚乙二醇单甲醚2000溶解在5 ~ 10mL氯仿中,等摩尔量的聚缩酮 PCADK溶解在少量氯仿中,聚缩酮溶液逐滴加入上述溶液,加热到60 ~ 80°C,过夜搅拌回流。粗产物在1 ~ 2L正己烷中多次沉淀,即获得聚缩酮PCADK-聚乙二醇单甲醚2000。
聚缩酮PCADK-聚乙二醇单甲醚2000傅立叶红外谱图见图2,凝胶渗透色谱图见图3。如图2所示,中间产物红外谱图同时存在1, 6-亚甲基二异氰酸酯特征峰及氨酯键特征峰,说明聚乙二醇单甲醚2000与1, 6-亚甲基二异氰酸酯的成功连接,终产物红外谱图1, 6-亚甲基二异氰酸酯特征峰的消失与氨酯键特征峰的存在,说明聚乙二醇单甲醚2000与聚缩酮PCADK的成功连接。
实施例2
聚缩酮PCADK-聚乙二醇单甲醚5000,其结构式为:
其制备方法如下:
(1)聚缩酮PCADK的合成
1, 4-环己烷二甲醇溶解在20 ~ 30mL蒸馏苯中,加热到90 ~ 100°C。35 ~ 55mg对甲苯磺酸溶解在0.5 ~ 1mL乙酸乙酯中,加入到上述苯溶液。加入与1, 4-环己烷二甲醇等摩尔量的2, 2-二甲氧基丙烷,开始反应。随机补偿蒸馏的苯和2, 2-二甲氧基丙烷,氮气保护下搅拌反应24 ~ 48h,然后加入100 ~ 200μL三乙胺停止反应,合成的聚缩酮在0.5 ~ 1L冷的正己烷中沉淀分离。
(2)聚乙二醇单甲醚5000的活化
聚乙二醇单甲醚5000的末端羟基的活化,聚乙二醇单甲醚5000溶解在5 ~ 10mL氯仿中,加入60 ~ 100摩尔倍数的1, 6-亚甲基二异氰酸酯,加热到60 ~ 80°C,过夜搅拌回流。粗产物在1 ~ 2L正己烷中多次沉淀,即获得活化的聚乙二醇单甲醚5000。
(3)目标产物的合成
将步骤 (2) 获得的活化的聚乙二醇单甲醚5000溶解在5 ~ 10mL氯仿中,等摩尔量的聚缩酮PCADK溶解在少量氯仿中,聚缩酮溶液逐滴加入上述溶液,加热到60 ~ 80°C,过夜搅拌回流。粗产物在1 ~ 2L正己烷中多次沉淀,即获得聚缩酮PCADK-聚乙二醇单甲醚5000。
实施例3
聚缩酮PCADK-聚乙二醇单甲醚10000,其结构式为:
其制备方法如下:
(1)聚缩酮PCADK的合成
1, 4-环己烷二甲醇溶解在20 ~ 30mL蒸馏苯中,加热到90 ~ 100°C。35 ~ 55mg对甲苯磺酸溶解在0.5 ~ 1mL乙酸乙酯中,加入到上述苯溶液。加入与1, 4-环己烷二甲醇等摩尔量的2, 2-二甲氧基丙烷,开始反应。随机补偿蒸馏的苯和2, 2-二甲氧基丙烷,氮气保护下搅拌反应24 ~ 48h,然后加入100 ~ 200μL三乙胺停止反应,合成的聚缩酮在0.5 ~ 1L冷的正己烷中沉淀分离。
(2)聚乙二醇单甲醚10000的活化
聚乙二醇单甲醚10000的末端羟基的活化,聚乙二醇单甲醚10000溶解在5 ~ 10mL氯仿中,加入60 ~ 100摩尔倍数的1, 6-亚甲基二异氰酸酯,加热到60 ~ 80°C,过夜搅拌回流。粗产物在1 ~ 2L乙醚/正己烷中多次沉淀,即获得活化的聚乙二醇单甲醚10000。
(3)目标产物的合成
将步骤 (2) 获得的活化的聚乙二醇单甲醚10000溶解在5 ~ 10mL氯仿中,等摩尔量的聚缩酮PCADK溶解在少量氯仿中,聚缩酮溶液逐滴加入上述溶液,加热到60 ~ 80°C,过夜搅拌回流。粗产物在1 ~ 2L正己烷中多次沉淀,即获得聚缩酮PCADK-聚乙二醇单甲醚10000。
实验例1
细胞毒性实验:
人类乳腺癌细胞株MCF7培养于含10% 胎牛血清、1%青霉素-链霉素的DMEM细胞培养液中,培养瓶置于37°C,含5% CO2培养箱中。取对数生长期的细胞进行以下实验。
以1×104个/孔的密度将处于对数期的MCF7细胞接种于在96孔板中,37°C培养24h使其贴壁,第二天去除培养液,分别加入100mg/mL预先制备的含聚缩酮改性材料的培养基,继续培养24h。去除培养基,每孔加入20μL、5mg/mL MTT试剂,37°C孵育4h,DMSO溶解生成的甲瓒结晶,酶标仪492nm分析溶液吸光度,并计算细胞存活率。
实验结果如图4所示,聚缩酮-聚乙二醇单甲醚(PCADK-mPEG)对MCF7细胞24h后的杀伤作用明显低于聚缩酮PCADK。这归功于表面聚乙二醇单甲醚的修饰,降低其材料毒性,屏蔽聚缩酮表面负电荷,增加材料的亲水性和生物兼容性。
实验例2
聚缩酮改性材料制备HSA纳米粒:
采用双乳化溶剂挥发法制备HSA纳米粒。200μL的20mg/mL的HSA逐滴加入含有40mg聚缩酮或聚缩酮改性材料的2mL二氯甲烷中,高压均质剪切机22000rpm均质1.5min形成初乳,初乳立即注入到20mL含有1%PVA的外水相,高压均质剪切机22000rpm均质2min,形成的复乳过夜磁力搅拌挥发有机溶剂。去离子水离心洗涤三次,获得的HSA纳米粒-40°C条件下冷冻干燥,4°C保存。
实验例3
HSA纳米粒稳定性表征:
称取冷冻干燥后的聚缩酮或聚缩酮改性材料制备HSA纳米粒20mg,重悬在2mL pH 7.4 PBS中,静置三周,观察沉淀或聚集现象。
实验结果如图5所示,图A为静置一天现象,图B为静置三周现象,聚缩酮 PCADK组EP管底部明显有沉淀现象,而聚缩酮修饰材料组依旧呈悬浮状态,说明聚缩酮修饰材料亲水性和稳定性较好。
实验例4
HSA纳米粒的粒径及电位分布检测:
采用激光粒度仪分析HSA纳米粒粒径及电位分布,HSA纳米粒测试浓度0.5mg/mL。实验结果如表1所示,HSA纳米粒平均粒径基本在200 ~ 300 nm之间,电位在 -2 ~ 0 mV之间。亲水性的修饰提高了聚缩酮表面电位,同时也增加了在溶液中的粒径,这归功于聚乙二醇单甲醚的亲水作用。
表1.实施例1 ~ 3聚缩酮PCADK改性材料制备纳米粒粒径及电位分布
实验例5
HSA纳米粒的包封效率检测:
采用BCA蛋白浓度试剂盒检测纳米粒的包封效率。20mg的纳米粒溶解于1mL,1M的NaOH溶液放置一天,随后加入2mL,1M的HCl溶液放置一天,最后NaOH溶液中和降解液。降解液中的蛋白浓度稀释后使用BCA蛋白试剂盒分析。实验结果如表1所示,纳米粒的实际包封效率分布在 73.2%~ 85.8%之间。聚缩酮PCADK改性材料包封率稍低于聚缩酮PCADK,可能归功于聚缩酮改性材料的亲水性,在纳米粒的制备过程中导致蛋白药物趋于分布于纳米粒的表面,从而降低了药物包封效率。
- 还没有人留言评论。精彩留言会获得点赞!