具有类四面体构形的有机化合物的制作方法
本发明涉及一种有机化合物,且尤其涉及一种具有类四面体构形的有机化合物。
背景技术:
太阳能电池是一种将太阳光转成电能的装置。使用太阳能电池进行发电是一种可再生的环保发电方式,发电过程中不会产生二氧化碳等温室气体,因此不会对环境造成污染。反之,有机发光二极管是一种将电能转成光能的环保照明暨光电显示装置,发光过程的能量损耗低,故也不会对环境造成过大的负面影响。
太阳能电池暨有机发光二极管中使用的空穴传输材料暨电子传输材料对于相关光电器件的能量转换效率有很大的影响。因此,开发更优异的空穴暨电子传输材料是本领域人员非常重视的议题。现有的有机的空穴暨电子传输材料均具有对称的构形,惟其应用于太阳能电池暨有机发光二极管的能量转换效率不佳,未能满足业界期待。
技术实现要素:
本发明提供一种具有类四面体构形的有机化合物,其具有优异的光电性质。
本发明提供一种具有类四面体构形的有机化合物,其具有由以下通式(I)所表示的结构:
其中A1至A4各自独立地为不饱和的五元环或不饱和的六元环;B1为直接键结、-C-、-O-、-N-、-S-或-C=C-;m为0或1;Ra为氢、氟、经取代或未经取代的C1-C12烷基或经取代或未经取代的C6-C12芳基;以及n为0~2的整数。
在一实施例中,上述的A1为不饱和的六元环,A2为不饱和的五元环,且A3与A4的结构实质上相同。
在一实施例中,上述的有机化合物具有由以下通式(IA)所表示的结构:
其中X1至X9各自独立地为碳或氮;R1及R2各自独立地为氢、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基、经取代或未经取代的C6-C12芳基或-CyF2y+1,y为0~3的整数;a为0~4的整数;b为0~3的整数;R3为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基、经取代或未经取代的C6-C12芳基、经取代或未经取代的胺基或经取代或未经取代的次膦酰基;c为0~4的整数;当c大于或等于1时,各R3可为相同或不同;B1为直接键结、-C-、-O-、-N-、-S-或-C=C-;m为0或1;Ra为氢、氟、经取代或未经取代的C1-C12烷基或经取代或未经取代的C6-C12芳基;以及n为0~2的整数。
在一实施例中,上述的有机化合物具有由以下通式(IA-a)所表示的结构:
其中R4为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基或经取代或未经取代的C6-C12芳基;d为0~4的整数;当d大于或等于1,各R4可为相同或不同,且两个或两个以上的R4可彼此连接形成C3-C8芳香环;B2为-O-、-S-、-C-或-N-;p为0或1;Rb为氢、氟、经取代或未经取代的C1-C12烷基;以及q为0~2的整数。本发明的具有类四面体构形的有机化合物备有优异的空穴传输性质,当其应用于制作前述光电元件时可提供优异的能量转换效率,具有相当高的应用价值。
在一实施例中,上述的有机化合物具有由以下通式(IA-b)所表示的结构:
其中X10至X12各自独立地为碳或氮;各X10可为相同或不同;各X11可为相同或不同;各X12可为相同或不同;R5为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基或经取代或未经取代的C6-C12芳基;e为0~5的整数;以及当e大于或等于1时,各R5可为相同或不同。本发明提及的具有类四面体构形的有机化合物具备有优异的电子传输性质,当其应用于制作前述光电元件时可提供优异的能量转换效率,具有相当高的应用价值。
在一实施例中,上述的有机化合物具有由以下通式(IA-c)所表示的结构:
其中R6为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基或经取代或未经取代的C6-C12芳基;f为0~5的整数;以及当f为大于或等于1的整数时,各R6可为相同或不同。
在一实施例中,上述的X1至X4中至少一者为氮。
基于上述,本发明的有机化合物中,将至少一C-N键取代现有的C-C键,使本发明的有机化合物具有不对称的有类四面体构形。本发明的具有类四面体构形的有机化合物具备有优异的电子传输性质,当其应用于制作光电元件可提供优异的能量转换效率,具有相当高的应用价值。
为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合附图作详细说明如下。
附图说明
图1是本发明的实施例的化合物(IA-10)~(IA-18)各自的吸收光谱图。
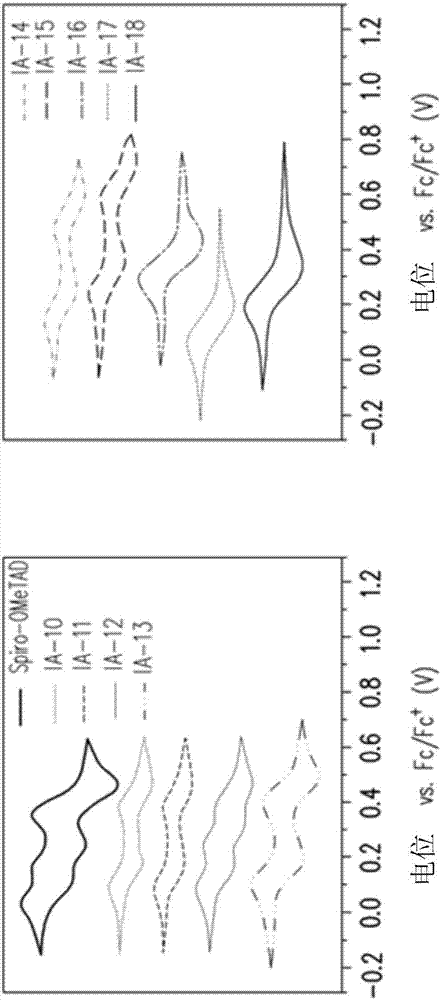
图2是本发明的实施例的化合物(IA-10)~(IA-18)各自的循环伏安图。
图3是本发明的实施例的化合物(IA-19)~(IA-23)各自的吸收光谱图。
图4是本发明的实施例的化合物(IA-19)~(IA-23)各自的循环伏安图。
图5是本发明的实施例的化合物(IA-1)~(IA-5)各自的吸收光谱图。
图6是本发明的实施例的化合物(IA-1)~(IA-5)各自的循环伏安图。
具体实施方式
本发明提供一种具有类四面体构形的有机化合物,其具有由以下通式(I)所表示的结构:
其中A1至A4各自独立地为不饱和的五元环或不饱和的六元环;B1为直接键结、-C-、-O-、-N-、-S-或-C=C-;m为0或1;Ra为氢、氟、经取代或未经取代的C1-C12烷基或经取代或未经取代的C6-C12芳基;以及n为0~2的整数。
上述段落中所指的直接键结,例如是A3上的原子与A4上的原子之间的单键。也就是说,A3上的原子与A4上的原子之间不通过额外的桥架原子而直接相连。
如通式(I)所示,将至少一C-N键取代现有的C-C键,使本发明的有机化合物具有不对称的有类四面体构形。具有类四面体构形的有机化合物的光电性质较容易被调整,在光电材料的领域具有较高的应用性。
在一实施例中,如通式(I)所示的具有类四面体构形的有机化合物中,A3与A4上的取代基具较佳的施体(donor)性质,会提供较好的空穴传导能力,可使本发明的有机化合物充当空穴传输材料。当A3与A4上的取代基具较佳的受体(acceptor)性质,会提供较好的电子传导能力,可使本发明的有机化合物充当电子传输材料。当A1与A2具有较佳的受体(acceptor)性质,而A3与A4上的取代基具有较佳的施体(donor)性质,可使本发明的有机化合物具有较高的热激发延迟荧光性(thermally activated delayed fluorescence),增广其应用层面。
在一实施例中,上述的A1为不饱和的六元环,A2为不饱和的五元环,且A3与A4的结构实质上相同。不饱和的五元环与不饱和的六元环的反应性不同,较容易将不同的取代基分别修饰在不饱和的五元环与不饱和六元环上,以调整本发明的有机化合物的性质。
在本文中,术语“结构实质上相同”定义为环结构完全相同,而环结构上的取代基可完全相同或部分相同。在一实施例中,A3与A4均为不饱和的五元环或六元环。在一实施例中,A3与A4均为含有0、1或2个氮原子以及0个氧原子或硫原子的不饱和的五元环或六元环。
在一实施例中,上述的具有类四面体构形的有机化合物具有由以下通式(IA)所表示的结构:
其中X1至X9各自独立地为碳或氮;R1及R2各自独立地为氢、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基、经取代或未经取代的C6-C12芳基或-CyF2y+1,y为0~3的整数;a为0~4的整数;b为0~3的整数;R3为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基、经取代或未经取代的C6-C12芳基、经取代或未经取代的胺基或经取代或未经取代的次膦酰基;c为0~4的整数;当c大于或等于1时,各R3可为相同或不同;B1为直接键结、-C-、-O-、-N-、-S-或-C=C-;m为0或1;Ra为氢、氟、经取代或未经取代的C1-C12烷基或经取代或未经取代的C6-C12芳基;以及n为0~2的整数。
上述段落中所指的直接键结,例如是位于B1左侧的碳与位于B1右侧的碳之间的单键。也就是说,位于B1左侧的碳与位于B1右侧的碳之间不通过额外的桥架原子而直接相连。
在一实施例中,上述的具有类四面体构形的有机化合物具有由以下通式(IA-a)所表示的结构:
其中R4为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基或经取代或未经取代的C6-C12芳基;d为0~4的整数;当d大于或等于1,各R4可为相同或不同,且两个或两个以上的R4可彼此连接形成C3-C8芳香环;B2为-O-、-S-、-C-或-N-;p为0或1;Rb为氢、氟、经取代或未经取代的C1-C12烷基;以及q为0~2的整数。
上述芳香环可包括芳香烃环(aromatic hydrocarbon)或芳香杂环(heterocyclic aromatics)。特定的芳香环实例包括苯环(phenyl ring)、吡啶环(pyridine)、吡嗪环(pyrazine)、嘧啶环(pyrimidine)、哒嗪环(pyridazine)、三嗪环(triazine)、吡咯环(pyrrole)、呋喃环(furan)、噻吩环(thiophene)、硒吩环(selenophene)、碲吩环(tellurophene)、咪唑环(imidazole)、噻唑环(thiazole)、硒唑环(selenazole)、碲唑环(tellurazole)、噻二唑环(thiadiazole)、恶二唑环(oxadiazole)以及吡唑环(pyrazole)。
如通式(IA-a)所表示的具有类四面体构形的有机化合物中,在其两侧修饰有经取代或未经取代的胺基。经取代或未经取代的胺基具有较多的施体性质,可使本发明的有机化合物具有较高的热激发延迟荧光性及优越的空穴传输性能。
在一实施例中,上述的具有类四面体构形的有机化合物具有由式(IA-1)至式(IA-30)中任一者所表示的结构:
在一实施例中,上述的具有类四面体构形的有机化合物具有由以下通式(IA-b)所表示的结构:
其中X10至X12各自独立地为碳或氮;各X10可为相同或不同;各X11可为相同或不同;各X12可为相同或不同;R5为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基或经取代或未经取代的C6-C12芳基;e为0~5的整数;以及当e大于或等于1时,各R5可为相同或不同。
如通式(IA-b)所表示的具有类四面体构形的有机化合物中,其具有较好的电子传输性能。
在一实施例中,上述的具有类四面体构形的有机化合物具有由式(IA-31)至式(IA-42)中任一者所表示的结构:
在一实施例中,上述的具有类四面体构形的有机化合物具有由以下通式(IA-c)所表示的结构:
其中R6为氢、氟、经取代或未经取代的C1-C12烷基、经取代或未经取代的C1-C6烷氧基或经取代或未经取代的C6-C12芳基;f为0~5的整数;以及当f为大于或等于1的整数时,各R6可为相同或不同。
如通式(IA-c)所表示的具有类四面体构形的有机化合物中,其具有较好的电子传输性能。
在一实施例中,上述的具有类四面体构形的有机化合物具有由式(IA-43)至式(IA-44)中任一者所表示的结构:
在一实施例中,上述的具有类四面体构形的有机化合物具有由式(IA-45)至式(IA-46)中任一者所表示的结构:
在一实施例中,上述的X1至X4中至少一者为氮。更具体地说,当通式(IA)、(IA-a)、(IA-b)、(IA-c)所表示的有机化合物中的X1至X4中至少一者为氮时,表示其左上的不饱和六元环上具有较多的氮原子。具有较多的氮原子的不饱和六元环具有较多的受体性质,可使本发明的有机化合物具有较高的热激发延迟荧光性。
基于上述,本发明的有机化合物具有不对称的类四面体构形,使得本发明的有机化合物具有优异的光电性质。此外,含有本发明的有机化合物的太阳能电池相较于现有技术而言,具有相当甚至更优异的能量转换效率,故本发明的有机化合物具有相当高的应用价值。
[本发明的具有类四面体构形的有机化合物的形成方法]
本发明的具有类四面体构形的有机化合物例如是以下述方式进行合成:
详细来说,本发明的具有类四面体构形的有机化合物的合成方式例如是先进行本发明的有机化合物的第一部分与第二部分的合成,再使有机化合物的第一部分与第二部分进行反应,而得到本发明的有机化合物。本领域中具有通常知识者可依据各个有机化合物的变化选用适当的反应物及反应条件制备各个有机化合物,且反应制备方式可依据本领域所熟知的技术进行变化,于此不再赘述。
[实施例]
以下将通过多个实施例对本发明作进一步说明,但所述实施例仅为例示说明之用,而非用以限制本发明的范围。由前述式(IA-1)、(IA-2)、(IA-3)…所表示的具有类四面体构形的有机化合物,后文将其简称为化合物(IA-1)、(IA-2)、(IA-3)…。此种简称方式也套用于下文中以其他化学结构式表达的有机化合物。
实施例1
化合物(IA-10)的制备:
化合物1的合成:将2-溴苯甲酸(2-bromobenzoic acid)(2.0g,10mmol)溶解于乙醇(80mL)中,加入硫酸(3mL),回流12小时。将混合物倒入水中,并使用乙酸乙酯进行萃取。依序使用碳酸氢钠、盐水、水清洗有机层,再使用硫酸钠进行干燥。纯白色的产物(1.8g)可通过管柱层析而获得,使用正己烷:乙酸乙酯=30:1作为冲提液,产率为80%。
化合物1的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.76(dd,J=7.6,1.9Hz,1H),7.64(dd,J=7.6,1.6Hz,1H),7.37-7.28(m,2H),4.39(q,J=6.8Hz,2H),1.39(t,J=7.1Hz,3H)。
化合物2的合成:将氢化钠(478mg,19mmol)在氮气下悬浮于16mL的干燥四氢呋喃中。将3,3-二甲基丁-2-酮(3,3-dimethylbutan-2-one)(1.27g,12.6mmol)溶于8mL的干燥四氢呋喃中,并在0℃下逐滴滴入。接着,将混合物在室温下搅拌1小时。之后,将1(4.38g,18.7mmol)溶于16mL的干燥四氢呋喃,并在0℃下逐滴滴入。将混合物加热,回流4小时。接着,将混合物倒入水和乙酸乙酯的混合物中,并用2M盐酸进行酸化。使用盐水、水清洗有机层,再使用硫酸钠进行干燥。粗产物可通过将所有的溶剂去除而获得。接着,将粗产物、联胺水合物(3mL,63mmol)和对甲苯磺酸单水合物(228mg,1.2mmol)在氮气下加入乙醇(65mL)并加热,回流12小时。接着,将混合物倒入水和乙酸乙酯的混合物中,并用2M盐酸进行酸化。依序使用碳酸氢钠、盐水、水清洗有机层,再使用硫酸钠进行干燥。纯产物可通过管柱层析而获得,使用正己烷:乙酸乙酯=4:1作为冲提液,在三个阶段下的产率为60%。
化合物2的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.63(d,J=8.0Hz,1H),7.59(d,J=7.8Hz,1H),7.31(t,J=7.5Hz,1H),7.16(t,J=8.4Hz,1H),6.48(s,1H),1.33(s,9H)。
化合物3的合成:2(2.09mg,7.5mmol)、3,4-二氢-2H-吡喃(3,4-dihydro-2H-pyran)(2.52g,30mmol)、对甲苯磺酸单水合物(140mg,0.75mmol)和二氯甲烷(50mL)的混合物在氮气下回流过夜。依序使用碳酸氢钠、盐水、水清洗有机层,再使用硫酸钠进行干燥。混合产物可通过管柱层析而获得,使用正己烷:乙酸乙酯=20:1作为冲提液,产率为77%。
化合物3的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.65(dd,J=7.8,1.1Hz,1H),7.43(dd,J=7.6,1.7Hz,1H),7.35(td,J=7.5,1.3Hz,1H),7.27-7.22(m,1H),6.16(s,1H),4.93-4.87(m,1H),4.00-3.96(m,1H),3.39-3.33(m,1H),2.46-2.40(m,1H),2.03-1.99(m,1H),1.88-1.83(m,2H),1.67-1.64(m,1H),1.45-1.41(m,1H),1.33(s,9H)。
化合物(IA-10)的合成:将正丁基锂(731μL,2.5M,溶于正己烷中)于氮气、-78℃下加入含有3(433mg,1.22mmol)的干燥四氢呋喃(5mL)中。30分钟后,将溶于四氢呋喃(5mL)的2,7-双(双(4-甲氧基苯基)胺)-9H-芴-9-酮(2,7-bis(bis(4-methoxyphenyl)amino)-9H-fluoren-9-one)(551mg,0.87mmol)逐滴加入。混合物在-78℃下搅拌30分钟,再回到室温。12小时后,溶液被浓缩且使用二氯甲烷萃取剩余物,再依序使用盐水、水清洗,最后使用硫酸钠进行干燥。三级醇的中间产物可通过管柱层析获得,使用正己烷:乙酸乙酯=4:1作为冲提液。接着,中间产物被加入浓缩的盐酸(1.5mL)和醋酸的混合物中(30mL)。在室温下反应1小时后,使用冰水终止反应,并使用碳酸氢钠水溶液进行中和。使用二氯甲烷对粗产物进行萃取,并用水进行清洗。使用无水硫酸钠干燥有机层,并以硅胶管柱层析进行纯化,使用正己烷:乙酸乙酯=8:1作为冲提液,在三个阶段下的产率为45%。
化合物(IA-10)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.59-7.56(m,3H),7.34(t,J=7.6Hz,1H),7.17(t,J=7.6Hz,1H),6.81-6.72(m,19H),6.33(s,1H),6.00(s,2H),3.64(s,12H),1.19(s,9H).MS[FAB],m/z 816.4,M+.Anal.Calcd.for C54H48N4O4:C,79.39;H,5.92;N,6.86.Found:C,78.52;H,5.90;N,6.16。
实施例2
化合物(IA-11)的制备:
化合物4的合成:将对叔丁基甲苯(5.0mL,29mmol)溶于60mL的乙腈。加入溶于水(45mL)中的溴酸钠(13.2g,87.0mmol),接着以15分钟的时间加入溶于水(90mL)中的亚硫酸氢钠(9.0g,87.0mmol)。反应被搅伴16小时,并以乙醚萃取。使用饱和硫代硫酸钠、盐水、水清洗合并的有机层,再使用硫酸钠进行干燥。粗产物通过将所有的溶剂去除而获得。接着,溶于叔丁醇(50mL)和水(50mL)中。加入过锰酸钾(13.8g,87mmol)并使混合物回流16小时。混合物被降回室温并以硅藻土进行过滤。以2M盐酸对滤液进行酸化,并以乙酸乙酯进行萃取。使用盐水、水清洗有机层,再使用硫酸钠进行干燥。白色粗产物通过将所有的溶剂去除而获得。将2-溴苯甲酸(2-bromobenzoic acid)(2.0g,10mmol)溶解于乙醇(100mL)中,加入硫酸(1.5mL),回流12小时。将混合物倒入水中,并使用乙酸乙酯进行萃取。依序使用碳酸氢钠、盐水、水清洗有机层,再使用硫酸钠进行干燥。纯白色的产物(4.8g)可通过管柱层析而获得,使用正己烷:乙酸乙酯=30:1作为冲提液,在三个阶段下的产率为58%。
化合物4的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.73(d,J=8.2Hz,1H),7.63(d,J=1.9Hz,1H),7.35(dd,J=7.3,2.8Hz,1H),4.37(q,J=7.2Hz,2H),1.38(t,J=7.1Hz,3H),1.30(s,9H)。
化合物5的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物2的合成中的描述,可得到白色产物,产率75%。
化合物5的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.69(d,J=8.8Hz,2H),7.66(d,J=1.9Hz,1H),7.52(d,J=8.1Hz,1H),7.38(dd,J=8.2,1.9Hz,1H),6.95(d,J=8.8Hz,2H),6.82(s,1H),3.84(s,3H),1.33(s,9H)。
化合物6的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物3的合成中的描述,可得到白色产物,产率85%。
化合物6的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.80(d,J=8.9Hz,2H),7.68-7.67(m,1H),7.39(d,J=1.1Hz,2H),6.91(d,J=8.9Hz,2H),6.53(s,1H),4.98-4.96(m,1H),4.04-4.01(m,1H),3.82(s,3H),3.46-3.40(m,1H),2.59-2.57(m,1H),2.10-2.05(m,1H),1.97-1.93(m,1H),1.74-1.68(m,2H),1.63-1.60(m,1H),1.35(s,9H).MS[FAB],m/z 470.2,M+。
化合物(IA-11)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到淡黄色产物,产率54%。
化合物(IA-11)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.65-7.56(m,5H),7.44(d,J=8.0Hz,1H),6.92(d,J=12.9Hz,2H),6.79-6.74(m,12H),6.66-6.64(m,9H),6.10(s,1H),3.74(s,3H),3.60(s,12H),1.18(s,9H).MS[FAB],m/z 922.5,M+.Anal.Calcd.for C61H54N4O5:C,79.37;H,5.90;N,6.07.Found:C,78.66;H,5.91;N,6.14。
实施例3
化合物(IA-12)的制备:
化合物7的合成:将含有醋酸钯(Pd(OAc)2)(97mg,0.44mmol)和三-叔丁基磷(tri-tert-butylphosphine)(3.6g,0.87mmol,5%,溶于正己烷中)的无水甲苯(20mL)在氮气下加入含有双(4-甲氧基苯基)胺(bis(4-methoxyphenyl)amine)(2.00g,8.7mmol)、4'-溴苯乙酮(4'-bromoacetophenone)(2.6g,13.1mmol)和叔丁醇钠(1.67g,17.4mmol)的无水甲苯(50mL)悬浮液中。将混合物加热,回流24小时。降温后,将反应混合物过滤,接着将所有的溶剂去除。接着,加入二氯甲烷和水,再使用盐水、水清洗有机层,并使用硫酸钠进行干燥。纯产物(1.6g)可通过管柱层析而获得,使用正己烷:乙酸乙酯=10:1作为冲提液,产率为55%。
化合物7的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.73(d,J=9.0Hz,2H),7.09(d,J=9.0Hz,4H),6.86(d,J=9.0Hz,4H),6.79(d,J=6.9Hz,2H),3.79(s,6H),2.48(s,3H)。
化合物8的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物2的合成中的描述,可得到白色产物,产率63%。
化合物8的光谱数据:1H NMR(400MHz,acetone-d6)[ppm]:δ7.71(d,J=1.9Hz,1H),7.68-7.64(m,3H),7.49(dd,J=8.2,2.0Hz,1H),7.07-6.90(m,11H),3.78(s,6H),1.34(s,9H)。
化合物9的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物3的合成中的描述,可得到白色产物,产率90%。
化合物9的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.66(d,J=7.5Hz,1H),7.50-7.46(m,3H),7.39-7.33(m,1H),7.11(d,J=8.7Hz,1H),7.05-7.03(m,3H),6.94(d,J=7.5Hz,2H),6.86-6.79(m,4H),6.50(s,1H),5.23-5.20(m,1H),4.17-4.13(m,1H),3.78(s,6H),3.64-3.60(m,1H),2.69-2.62(m,1H),2.08-2.04(m,1H),1.84-1.72(m,4H).MS[FAB],m/z 667.3,M+。
化合物(IA-12)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到淡黄色产物,产率36%。
化合物(IA-12)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.58(d,J=8.3Hz,2H),7.56-7.51(m,3H),7.42(dd,J=8.1,1.6Hz,1H),6.97-6.96(m,4H),6.88-6.85(m,4H),6.78-6.72(m,15H),6.66-6.63(m,8H),6.09(s,1H),3.70(s,6H),3.60(s,12H),1.16(s,9H).MS[FAB],m/z1119.5,M+.Anal.Calcd.for C74H65N5O6:C,79.33;H,6.25;N,5.85.Found:C,78.50;H,6.24;N,5.89。
实施例4
化合物(IA-14)的制备:
化合物10的合成:将含有1-溴萘(1-bromonaphthalene)(1.03g,5mmol)、4-甲氧基苯胺(4-methoxybenzenamine)(739mg,6mmol)、醋酸钯(22mg,0.1mmol)和(±)-2,2'-双(二苯基磷)-1,1'-双萘((±)-2,2'-bis(diphenylphosphino)-1,1'-binaphthalene;BINAP)(99mg,0.16mmol)和碳酸铯(Cs2CO3)(1.95g,6mmol)的无水甲苯(25mL)在氮气下加热,回流12小时。降温后,将反应混合物过滤,接着将所有的溶剂去除。接着,加入二氯甲烷和水,再使用盐水、水清洗有机层,并使用硫酸钠进行干燥。纯产物(750mg)可通过管柱层析而获得,使用正己烷:乙酸乙酯=6:1作为冲提液,产率为60%。
化合物10的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.99(d,J=9.5Hz,1H),7.83(d,J=9.4Hz,1H),7.50-7.42(m,3H),7.31(t,J=7.8Hz,1H),7.10(d,J=7.5Hz,1H),7.05(d,J=8.8Hz,2H),6.87(d,J=8.9Hz,2H),3.81(s,3H)。
化合物11的合成:将含有2,7-二溴-9H-芴-9-酮(2,7-dibromo-9H-fluoren-9-one)(1.2g,3.5mmol)、N-(4-甲氧基苯基)萘-1-胺(N-(4-methoxyphenyl)naphthalen-1-amine)(1.83g,7.35mmol)、双(二亚芐基丙酮)钯(Pd(dba)2)(200mg,0.35mmol)、三叔丁基磷(P(t-Bu)3)(141mg,0.7mmol)和叔丁醇钠(NatOBu)(1.03g,10.85mmol)的无水甲苯溶液(30mL)在氮气下加热,回流12小时。降温后,将反应混合物过滤,接着将所有的溶剂去除。接着,加入二氯甲烷和水,再使用盐水、水清洗有机层,并使用硫酸钠进行干燥。纯产物(1.97g)可通过管柱层析而获得,使用正己烷:乙酸乙酯=5:1作为冲提液,产率为83%。
化合物11的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.87(dd,J=15.1,8.3Hz,4H),7.73(d,J=8.1Hz,2H),7.45-7.41(m,4H),7.34-7.32(m,2H),7.25(d,J=8.1Hz,2H),7.10(d,J=2.1Hz,2H),7.06-7.02(m,6H),6.79-6.77(m,6H),3.76(s,6H)。
化合物(IA-14)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到淡黄色产物,产率36%。
化合物(IA-14)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.86(d,J=8.2Hz,2H),7.72(d,J=8.2Hz,2H),7.65(d,J=8.5Hz,2H),7.53(d,J=8.4Hz,2H),7.46(d,J=7.3Hz,1H),7.42-7.35(m,4H),7.31-7.25(m,3H),7.15-7.11(m,3H),6.81(d,J=8.8Hz,4H),6.72-6.64(m,5H),6.63(dd,J=8.3,2.1Hz,2H),6.20(s,1H),5.92(d,J=2.0Hz,2H),3.60(s,6H),1.12(s,9H).MS[FAB],m/z 856.4M+.Anal.Calcd.for C60H48N4O2:C,84.08;H,5.65;N,6.54.Found:C,83.48;H,5.71;N,6.65。
实施例5
化合物(IA-15)的制备:
化合物12的合成:依照化合物10的合成中描述的过程进行实验,可得到纯产物,产率82%。
化合物12的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.01(d,J=7.6Hz,2H),7.86(d,J=7.4Hz,2H),7.56(d,J=7.3Hz,1H),7.51-7.44(m,2H),7.41-7.37(m,2H),7.27-7.23(m,2H),6.98(d,J=7.4Hz,2H),6.93-6.88(m,1H)。
化合物13的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物11的合成中的描述,可得到纯产物,产率86%。
化合物13的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.87(d,J=9.3Hz,4H),7.76(d,J=8.3Hz,2H),7.47-7.42(m,4H),7.36-7.32(m,2H),7.29(dd,J=7.3,1.1Hz,2H),7.23(d,J=2.2Hz,2H),7.21-7.17(m,4H),7.13(d,J=8.2Hz,2H),7.02-7.00(m,4H),6.97-6.94(m,4H)。
化合物(IA-15)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到淡黄色产物,产率30%。
化合物(IA-15)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.89(d,J=8.1Hz,2H),7.78(d,J=8.1Hz,2H),7.62(dd,J=8.4,3.0Hz,4H),7.51(d,J=7.2Hz,1H),7.42(t,J=7.7Hz,4H),7.32-7.27(m,3H),7.18-7.14(m,3H),7.05(t,J=7.7Hz,4H),6.85-6.72(m,9H),6.25(s,1H),6.14(d,J=2.0Hz,2H),1.14(s,9H).MS[FAB],m/z 796.4M+.Anal.Calcd.for C58H44N4:C,87.41;H,5.56;N,7.03.Found:C,87.30;H,5.60;N,6.82。
实施例6
化合物(IA-16)的制备:
化合物14的合成:将正丁基锂(n-BuLi)(2.02mL,2.5M,溶于正己烷中)在-78℃、氮气下加入含有3-叔丁基-5-(2-溴苯基)-1-(四氢-2H-吡喃-2-基)-1H-吡唑(3-tert-butyl-5-(2-bromophenyl)-1-(tetrahydro-2H-pyran-2-yl)-1H-pyrazole)(1.7g,4.55mmol)的干燥四氢呋喃(15mL)溶液中。30分钟后,将溶于四氢呋喃(10mL)的2,7-双(双(4-甲氧基苯基)胺)-9H-芴-9-酮(2,7-bis(bis(4-methoxyphenyl)amino)-9H-fluoren-9-one)(1.18g,3.5mmol)逐滴加入。混合物在-78℃下搅拌30分钟,再回到室温。12小时后,溶液被浓缩且使用二氯甲烷萃取剩余物,再依序使用盐水、水清洗,最后使用硫酸钠进行干燥。三级醇的中间产物可通过管柱层析获得,使用正己烷:乙酸乙酯=10:1作为冲提液。接着,中间产物被加入浓缩的盐酸(2mL)和醋酸的混合物中(30mL)。在室温下回流1小时后,使用冰水终止反应,并使用碳酸氢钠水溶液进行中和。使用二氯甲烷对粗产物进行萃取,并用水进行清洗。使用无水硫酸钠干燥有机层,并以硅胶管柱层析进行纯化,使用正己烷:乙酸乙酯=10:1作为冲提液,在三个阶段下的产率为40%。
化合物14的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.64-7.60(m,3H),7.52(dd,J=8.1,1.6Hz,2H),7.38(t,J=7.5Hz,1H),7.12(t,J=7.5Hz,1H),6.88(d,J=1.5Hz,2H),6.65(d,J=7.7Hz,1H),6.38(s,1H).MS[EI],m/z 520.0M+。
化合物(IA-16)的合成:将含有2,7-二溴-9H-芴-9-酮(2,7-dibromo-9H-fluoren-9-one)(302mg,0.58mmol)、N-(10-甲氧基苯基)萘-1-胺(N-(4-methoxyphenyl)naphthalen-1-amine)(254mg,1.27mmol)、双(二亚芐基丙酮)钯(Pd(dba)2)(33mg,0.058mmol)、三叔丁基磷(P(t-Bu)3)(23mg,0.116mmol)和叔丁醇钠(NatOBu)(169mg,1.79mmol)的无水甲苯溶液(5mL)在氮气下加热,回流12小时。降温后,将反应混合物过滤,接着将所有的溶剂去除。接着,加入二氯甲烷和水,再使用盐水、水清洗有机层,并使用硫酸钠进行干燥。纯产物(359mg)可通过管柱层析而获得,使用正己烷:乙酸乙酯=2:1作为冲提液,产率为82%。
化合物(IA-16)的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.07(d,J=7.9Hz,2H),7.57(d,J=7.5Hz,1H),7.50(d,J=7.8Hz,2H),7.35(t,J=7.5Hz,1H),7.15(t,J=7.6Hz,1H),6.97-6.89(m,7H),6.77(br,8H),6.28(s,1H),6.15-6.14(br,4H),1.24(s,9H).MS[EI],m/z 756.2M+.Anal.Calcd.for C50H36N4S2:C,79.33;H,4.79;N,7.40.Found:C,79.40;H,4.80;N,7.20。
实施例7
化合物(IA-17)的制备:
化合物(IA-17)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率78%。
化合物(IA-17)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.98(d,J=8.2Hz,2H),7.68(d,J=7.5Hz,1H),7.36(t,J=7.6Hz,1H),7.21(dd,J=8.3,1.9Hz,2H),7.15(td,J=7.6,1.0Hz,1H),6.79-6.76(m,5H),6.56(dd,J=8.9,2.6Hz,4H),6.49(d,J=8.9Hz,4H),6.41(s,1H),6.28(d,J=1.8Hz,2H),3.63(s,12H),1.10(s,9H).MS[EI],m/z 876.2M+.Anal.Calcd.forC54H44N4O4S2:C,73.95;H,5.06;N,6.39.Found:C,73.90;H,5.00;N,6.30。
实施例8
化合物(IA-18)的制备:
化合物(IA-18)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率80%。
化合物(IA-18)的光谱数据:1H NMR(400MHz,CD2Cl2)[ppm]:δ8.07-8.05(m,2H),7.62-7.59(m,1H),7.46(br,2H),7.39-7.34(m,1H),7.20-7.16(m,1H),6.95-6.91(m,1H),6.80(br,6H),6.61(br,4H),6.31(s,1H),6.10(br,4H),2.14(s,12H),1.24(s,9H).MS[FAB],m/z 812.3M+.Anal.Calcd.for C54H46N4S2:C,79.77;H,5.45;N,6.89.Found:C,79.70;H,5.51;N,6.81。
实施例9
化合物(IA-13)的制备:
化合物15的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物2的合成中的描述,可得到纯产物,产率70%。
化合物15的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.62(d,J=1.7Hz,1H),7.50(dd,J=8.2,2.3Hz,1H),7.34(dd,J=8.2,2.0Hz,1H),6.45(s,1H),1.36(s,9H),1.31(s,9H)。
化合物16的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物3的合成中的描述,可得到纯产物,产率82%。
化合物16的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.65-7.64(m,1H),7.35(d,J=1.1Hz,2H),6.14(s,1H),4.92-4.88(m,1H),4.00-3.95(m,1H),3.43-3.37(m,1H),2.49-2.41(m,1H),2.05-1.98(m,1H),1.91-1.83(m,4H),1.34(s,9H),1.32(s,9H)。
化合物(IA-13)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到纯产物,产率40%。
化合物(IA-13)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.58(d,J=8.3Hz,2H),7.49(d,J=8.1Hz,1H),7.39(dd,J=8.1,1.7Hz,1H),6.80-6.75(m,9H),6.74-6.70(m,9H),6.67(d,J=1.7Hz,1H),6.28(s,1H),6.03(d,J=2.2Hz,2H),3.64(s,12H),1.18(s,9H),1.15(s,9H).MS[EI],m/z 872.4M+.Anal.Calcd.for C58H56N4O4:C,79.79;H,6.46;N,6.42.Found:C,79.90;H,6.64;N,6.31。
实施例10
化合物(IA-19)的制备:
化合物17的合成:将9H-占吨-9-酮(9H-xanthen-9-one)(5g,25mmol)溶解于50mL的醋酸中,并将10mL的Br2于室温下逐滴加入,再加热回流20小时。之后,将混合物降温再倒入冰水中。依序以饱和碳酸氢钠溶液、20%亚硫酸氢钠水溶液、水清洗沉淀物。将固态粗产物于真空下干燥,并于甲苯中进行再结晶,得到6.1g的黄色固体,产率69%。
化合物17的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.41(d,J=1.7Hz,2H),7.79(d,J=9.0,1.6Hz,2H),7.38(dd,J=8.9Hz,2H)。
化合物18的合成:将含有化合物17(708mg,2mmol)、双(4-甲氧基苯基)胺(bis(4-methoxyphenyl)amine)(983mg,4.2mmol)、双(二亚芐基丙酮)钯(Pd(dba)2)(114mg,0.2mmol)、三叔丁基磷(P(t-Bu)3)(81mg,0.4mmol)和叔丁醇钠(NatOBu)(588mg,6.2mmol)的无水甲苯溶液(15mL)在氮气下加热,回流12小时。降温后,将反应混合物过滤,接着将所有的溶剂去除。接着,加入二氯甲烷和水,再使用盐水、水清洗有机层,并使用硫酸钠进行干燥。纯产物(1.22g)可通过管柱层析而获得,使用正己烷:二氯甲烷=1:1作为冲提液,产率为94%。
化合物18的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.74(d,J=2.7Hz,2H),7.34(dd,J=9.1,2.8Hz,2H),7.28(d,J=9.1Hz,2H),7.02(d,J=9.0Hz,8H),6.81(d,J=9.0Hz,8H),3.82(s,12H)。
化合物(IA-19)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到纯产物,产率35%。
化合物(IA-19)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.54(d,J=7.9Hz,1H),7.36-7.27(m,1H),7.23-7.19(m,3H),7.02(d,J=8.1Hz,1H),6.75(dd,J=8.9,2.8Hz,2H),6.70(s,16H),6.26(s,1H),5.73(d,J=2.7Hz,2H),3.64(s,12H),1.11(s,9H).MS[FAB],m/z 832.4M+.Anal.Calcd.for C54H48N4O5:C,77.86;H,5.81;N,6.73.Found:C,78.01;H,5.90;N,6.70。
实施例11
化合物(IA-20)的制备:
化合物19的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物17的合成中的描述,可得到纯产物,产率74%。
化合物19的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.72(dd,J=2.3,0.9Hz,2H),7.72(ddd,J=8.6,2.3,1.2Hz,2H),7.45(dd,J=8.6,0.8Hz,2H)。
化合物20的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物18的合成中的描述,可得到纯产物,产率92%。
化合物20的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.00(d,J=2.0Hz,2H),7.33(d,J=8.8Hz,2H),7.24(dd,J=8.4,3.0Hz,2H),7.04(d,J=8.8Hz,8H),6.81(d,J=8.9Hz,8H),3.77(s,12H)。
化合物(IA-20)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到纯产物,产率54%。
化合物(IA-20)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.90(d,J=7.8Hz,1H),7.57(d,J=7.5Hz,1H),7.35(d,J=8.6Hz,2H),7.31(d,J=7.5Hz,1H),7.14(t,J=7.7Hz,1H),6.74(s,16H),6.66(dd,J=8.5,2.5Hz,2H),6.23(s,1H),5.66(d,J=2.4Hz,2H),3.61(s,12H),0.94(s,9H).MS[FAB],m/z 848.4M+.Anal.Calcd.for C54H48N4O4S:C,76.39;H,5.70;N,6.60.Found:C,76.13;H,5.57;N,6.60。
实施例12
化合物(IA-21)的制备:
化合物21的合成:将含有吖啶-9(10H)-酮(acridin-9(10H)-one)(2.93g,15mmol)、4-碘苯甲醚(4-iodoanisole)(5.4g,22.5mmol)、碘化亚铜(CuI)(278mg,1.5mmol)、碳酸钾(K2CO3)(3.09g,22.5mmol)和2,2,6,6-四甲基庚-3,5-二酮(2,2,6,6-tetramethylheptane-3,5-dione)(627μL,3mmol)的无水二甲基甲酰胺(35mL)在氮气下加热回流20小时。降温后,将反应混合物倒入水中,过滤、水洗并在真空下完全干燥。纯产物(4g)可通过管柱层析而获得,使用正己烷:二氯甲烷=3:1作为冲提液,产率为89%。
化合物21的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.56(ddd,J=8.0,1.7,0.5Hz,2H),7.51-7.46(m,2H),7.27-7.23(m,4H),7.18-7.16(m,2H),6.80(d,J=10.1Hz,2H),3.94(s,3H)。
化合物22的合成:将化合物21(903mg,3mmol)溶解于27mL的二甲基甲酰胺,并将9mL的溶解于二甲基甲酰胺的N-溴代丁二酰亚胺(NBS)(1.12g,6.3mmol)于0℃下逐滴加入,在80℃下加热6小时。之后,将混合物降温并倒入水中、过滤,并依序以水、乙醇、热正己烷清洗,再于真空下干燥以获得黄色产物(1.2g),产率88%。
化合物22的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.61(d,J=2.4Hz,1H),7.54(dd,J=9.1,2.5Hz,2H),7.25-7.22(m,3H),7.18(d,J=9.0Hz,2H),6.69(dd,J=9.1,2.8Hz,2H),3.94(s,3H)。
化合物23的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物18的合成中的描述,可得到纯产物,产率87%。
化合物23的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.59(d,J=2.5Hz,2H),7.39(d,J=8.8Hz,2H),7.22-7.17(m,4H),6.93(d,J=8.9Hz,8H),6.85(d,J=8.9Hz,8H),6.65(d,J=9.3Hz,2H),3.84(s,3H),3.69(s,12H)。
化合物(IA-21)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到纯产物,产率40%。
化合物(IA-21)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.54(d,J=7.6Hz,1H),7.48(d,J=8.6Hz,2H),7.36-7.29(m,2H),7.25-7.22(m,3H),6.66-6.59(m,18H),6.27(d,J=8.9Hz,2H),6.25(s,1H),5.71(d,J=2.6Hz,2H),3.84(s,3H),3.61(s,12H),1.07(s,9H).MS[FAB],m/z 937.4M+.Anal.Calcd.for C61H55N5O5:C,78.10;H,5.91;N,7.47.Found:C,77.85;H,5.70;N,7.35。
实施例13
化合物(IA-22)的制备:
化合物24的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物14的合成中的描述,可得到纯产物,产率20%。
化合物24的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.59(d,J=7.6Hz,1H),7.38-7.31(m,3H),7.16-7.12(m,3H),6.94(d,J=7.7Hz,1H),6.45(d,J=2.3Hz,2H),6.42(s,1H),1.34(s,9H).MS[FAB],m/z 536.0M+。
化合物(IA-22)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率70%。
化合物(IA-22)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.66(d,J=7.5Hz,1H),7.50(d,J=8.8Hz,2H),7.37(t,J=7.8Hz,1H),7.23(t,J=7.6Hz,1H),7.17(dd,J=8.9,2.5Hz,2H),7.11(d,J=7.3Hz,1H),6.74(d,J=2.7Hz,4H),6.48(dd,J=8.9,2.7Hz,4H),6.40(s,1H),6.26(d,J=8.9Hz,4H),5.99(d,J=2.5Hz,2H),3.62(s,12H),1.09(s,9H).MS[FAB],m/z 892.2M+.Anal.Calcd.for C54H44N4O5S2:C,72.62;H,4.97;N,6.27.Found:C,72.57;H,4.90;N,6.20。
实施例14
化合物(IA-23)的制备:
化合物25的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物14的合成中的描述,可得到纯产物,产率22%。
化合物25的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.83(d,J=7.3Hz,1H),7.56(d,J=7.6Hz,1H),7.34-7.28(m,5H),7.06(t,J=8.2Hz,1H),6.50(s,1H),6.35(d,J=1.5Hz,2H),1.43(s,9H).MS[FAB],m/z 551.9M+。
化合物(IA-23)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率82%。
化合物(IA-23)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.71(d,J=7.7Hz,1H),7.65(d,J=7.8Hz,1H),7.51(d,J=8.5Hz,2H),7.33(t,J=8.2Hz,1H),7.15(t,J=7.7Hz,1H),6.93(d,J=8.7Hz,2H),6.85(s,4H),6.60(s,8H),6.42(s,1H),5.82(br,2H),3.66(s,12H),1.01(s,9H).MS[FAB],m/z 908.2M+.Anal.Calcd.for C54H44N4O4S3:C,71.34;H,4.88;N,6.16.Found:C,71.20;H,4.90;N,6.10。
实施例15
化合物(IA-1)的制备:
化合物26的合成:在三颈瓶中将二苯胺(1.47g,8.72mmol)和叔丁醇钠(1.2g,12.49mmol)在氮气下溶解于25mL无水二甲基甲酰胺中。接着,将含有双(4-氟苯基)甲酮(bis(4-fluorophenyl)methanone)(0.86g,3.94mmol)的无水二甲基甲酰胺溶液15mL缓慢地逐滴滴入。将反应混合物回流12小时。降温时,将混合物倒入水中、过滤,并在真空下干燥。纯产物可通过再结晶而获得,使用正己烷:DCM=5:1作为溶剂,产率为70%。
化合物26的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.68-7.64(m,4H),7.32-7.27(m,7H),7.25-7.23(m,1H),7.16-7.07(m,12H),7.02-6.98(m,4H)。
化合物(IA-1)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到纯产物,产率34%。
化合物(IA-1)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.67(d,J=7.0Hz,1H),7.53(d,J=7.5Hz,1H),7.40(td,J=7.5,1.1Hz,1H),7.34(td,J=7.5,1.2Hz,1H),7.27-7.22(m,8H),7.02-6.95(m,16H),6.84(d,J=8.9Hz,4H),6.44(s,1H),1.25(s,9H).MS[FAB],m/z 698.3M+.Anal.Calcd.for C50H42N4:C,85.93;H,6.06;N,8.02.Found:C,85.91;H,6.10;N,8.01。
实施例16
化合物(IA-2)的制备:
化合物27的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物26的合成中的描述,可得到纯产物,产率64%。
化合物27的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.63(d,J=8.6Hz,4H),7.10(d,J=7.7Hz,8H),7.04(d,J=8.2Hz,8H),6.92(d,J=8.0Hz,4H),2.32(s,12H)。
化合物(IA-2)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到纯产物,产率44%。
化合物(IA-2)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.65(d,J=7.5Hz,1H),7.48(d,J=7.6Hz,1H),7.38(t,J=7.5Hz,1H),7.31(t,J=7.5Hz,1H),7.05(d,J=8.2Hz,8H),6.92(d,J=8.7Hz,4H),6.85(d,J=8.2Hz,8H),6.74(d,J=8.7Hz,4H),6.42(s,1H),2.20(s,12H),1.24(s,9H).MS[FAB],m/z 754.4M+.Anal.Calcd.for C54H50N4:C,85.90;H,6.68;N,7.42.Found:C,85.89;H,6.70;N,7.42。
实施例17
化合物(IA-3)的制备:
化合物28的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物26的合成中的描述,可得到纯产物,产率76%。
化合物28的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.61(d,J=7.7Hz,4H),7.10(d,J=8.9Hz,8H),6.85(d,J=9.0Hz,10H),6.81(d,J=1.0Hz,2H),3.79(s,12H)。
化合物(IA-3)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-10)的合成中的描述,可得到纯产物,产率43%。
化合物(IA-3)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.64(d,J=7.4Hz,1H),7.44(d,J=7.6Hz,1H),7.38-7.35(m,1H),7.31-7.27(m,1H),6.98-6.94(m,8H),6.87-6.82(m,12H),6.59(d,J=8.9Hz,4H),6.40(s,1H),3.68(s,12H),1.23(s,9H).MS[FAB],m/z 818.4M+.Anal.Calcd.for C54H50N4O4:C,79.19;H,6.15;N,6.84.Found:C,79.20;H,6.13;N,6.83。
实施例18
化合物(IA-4)的制备:
化合物29的合成:将正丁基锂(n-BuLi)(742μL,2.5M,溶于正己烷中)在-78℃、氮气下加入含有3-叔丁基-5-(2-溴苯基)-1-(四氢-2H-吡喃-2-基)-1H-吡唑(3-tert-butyl-5-(2-bromophenyl)-1-(tetrahydro-2H-pyran-2-yl)-1H-pyrazole)(673mg,1.8mmol)的干燥四氢呋喃(7mL)溶液中。30分钟后,将溶于四氢呋喃(6mL)的2,7-双(双(4-甲氧基苯基)胺)-9H-芴-9-酮(2,7-bis(bis(4-methoxyphenyl)amino)-9H-fluoren-9-one)(425mg,1.25mmol)逐滴加入。混合物在-78℃下搅拌30分钟,再回到室温。12小时后,溶液被浓缩且使用二氯甲烷萃取剩余物,再依序使用盐水、水清洗,最后使用硫酸钠进行干燥。三级醇的中间产物可通过管柱层析获得,使用正己烷:乙酸乙酯=8:1作为冲提液。接着,中间产物被加入浓缩的盐酸(1.5mL)和醋酸的混合物中(15mL)。在室温下搅拌1小时后,使用冰水终止反应,并使用碳酸氢钠水溶液进行中和。使用二氯甲烷对粗产物进行萃取,并用水进行清洗。使用无水硫酸钠干燥有机层,并以硅胶管柱层析进行纯化,使用正己烷:乙酸乙酯=12:1作为冲提液,在三个阶段下的产率为40%。
化合物29的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.72(d,J=7.4Hz,1H),7.56-7.52(m,5H),7.45(t,J=7.5Hz,1H),7.36(t,J=8.1Hz,1H),7.02(d,J=8.6Hz,4H),6.49(s,1H),1.25(s,9H).MS[FAB],m/z 522.0M+。
化合物(IA-4)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率79%。
化合物(IA-4)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.66(d,J=7.3Hz,1H),7.48(d,J=7.7Hz,1H),7.38(t,J=7.4Hz,1H),7.29(t,J=7.6Hz,1H),6.99-6.93(m,12H),6.85(d,J=8.8Hz,4H),6.77(dd,J=8.8,2.8Hz,4H),6.42(s,1H),3.69(s,12H),1.24(s,9H).MS[FAB],m/z 878.3M+.Anal.Calcd.for C54H46N4O4S2:C,73.78;H,5.27;N,6.37.Found:C,73.88;H,5.30;N,6.25。
实施例19
化合物(IA-5)的制备:
化合物(IA-5)的合成:依照化合物(IA-16)的合成中描述的过程进行实验,可得到纯产物,产率83%。
化合物(IA-5)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.73(d,J=7.5Hz,1H),7.66(d,J=7.8Hz,1H),7.47-7.43(m,1H),7.40-7.36(m,1H),7.26(d,J=8.5Hz,4H),7.17(d,J=8.5Hz,4H),6.97-6.94(m,4H),6.79(d,J=9.2Hz,4H),6.49(s,1H),6.37(d,J=8.1Hz,4H),2.13(s,12H),1.27(s,9H).MS[FAB],m/z 814.3M+.Anal.Calcd.for C54H46N4S2:C,79.57;H,5.69;N,6.87.Found:C,79.65;H,5.70;N,6.80。
实施例20
化合物(IA-6)的制备:
化合物30的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物2的合成中的描述,可得到纯产物,产率80%。
化合物30的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.70(d,J=8.0Hz,1H),7.49(d,J=7.7Hz,1H),7.42-7.38(m,1H),7.31-7.26(m,1H),6.82(s,1H).19F NMR(376MHz,CDCl3):δ-62.11(s,3F)。
化合物31的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物3的合成中的描述,可得到纯产物,产率70%。
化合物31的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.70(d,J=7.9Hz,1H),7.41-7.40(m,2H),7.36-7.32(m,1H),6.56(s,1H),5.00(dd,J=9.8,2.4Hz,1H),3.99-3.94(m,1H),3.37(td,J=11.4,2.5Hz,1H),2.48-2.39(m,1H),2.07-2.02(m,1H),1.94-1.89(m,1H),1.71-1.62(m,1H),1.51-1.45(m,2H).19F NMR(376MHz,CDCl3):δ-62.05(s,3F)。
化合物32的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物29的合成中的描述,可得到纯产物,产率55%。
化合物32的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.66(d,J=6.9Hz,1H),7.47-7.34(m,7H),7.04-7.01(m,4H),6.68(s,1H).19F NMR(376MHz,CDCl3):δ-62.11(s,3F).MS[EI],m/z 533.2M+。
化合物(IA-6)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率70%。
化合物(IA-6)的光谱数据:1H NMR(400MHz,DMSO-d6)[ppm]:δ7.84(d,J=6.9Hz,1H),7.57(d,J=6.8Hz,1H),7.52-7.44(m,2H),7.27-7.23(m,8H),7.10(s,1H),7.04-7.00(m,4H),6.98-6.95(m,12H),6.85(d,J=8.8Hz,4H).19F NMR(376MHz,CDCl3):δ-60.35(s,3F).MS[FAB],m/z 710.3M+。
实施例21
化合物(IA-7)的制备:
化合物(IA-7)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率60%。
化合物(IA-7)的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.79-7.75(m,1H),7.65(m,J=4.8,3.1Hz,1H),7.57-7.49(m,6H),7.43(dd,J=7.6,1.6Hz,4H),7.36-7.32(dd 4H),6.98-6..88(m,8H),6.81(s,1H),6.24(dd,J=8.1,1.3Hz,4H),1.65(s,12H).19F NMR(376MHz,CDCl3):δ-61.80(s,3F)。
实施例22
化合物(IA-8)的制备:
化合物(IA-8)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中描述的过程进行实验,可得到纯产物,产率50%。
化合物(IA-8)的光谱数据:1H NMR(400MHz,CD2Cl2)[ppm]:δ7.78(d,J=6.2Hz,1H),7.58(d,1H),7.55-7.47(m,2H),7.40(d,J=8.8Hz,4H),7.31(d,J=8.7Hz,4H),7.08(dd,J=1.8Hz,4H),6.90(m,J=12.2,6.2Hz,8H),6.81(s,1H),6.45(dd,J=1.3Hz,4H).19F NMR(376MHz,CD2Cl2):δ-62.17(s,3F)。
实施例23
化合物(IA-9)的制备:
化合物33的合成:将含有甲基氯化镁(6.6mL,19.8mmol)的混合物溶液于0℃、氮气下缓慢地逐滴加入含有2-溴-4-氟苯甲醛(2-bromo-4-fluorobenzaldehyde)(2g,9.9mmol)的干燥乙醚(19.8mL)溶液中。将得到的混合物溶液于0℃下搅拌3小时,接着以饱和液态氯化铵溶液终止反应,再以乙酸乙酯进行萃取。使用盐水清洗有机层,再使用硫酸钠进行干燥,过滤后于真空下进行浓缩。以管住层析对粗产物进行纯化,以得到33,产率为92%。
化合物33的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.56(dd,J=8.7,6.1Hz,1H),7.28-7.22(m,1H),7.06(td,J=8.3,2.6Hz,1H),5.20(q,J=6.4Hz,1H),1.97(s,1H),1.45(d,J=6.4Hz,3H).19F NMR(376MHz,CDCl3):δ-113.55(s,1F)。
化合物34的合成:在含有化合物33(1.83g,8.35mmol)的干二氯甲烷(41.75mL)加入均匀的氯铬酸吡啶盐(pyridinium chlorochromate;PCC)(5.4g,25.1mmol)混合物。将得到的悬浮液于室温下搅拌2小时,接着以硅胶进行过滤,以二氯甲烷进行清洗,并在真空下进行浓缩。以快速管住层析(flash column chromatography)对粗产物进行纯化,以得到化合物34,产率为92%。
化合物34的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.54(dd,J=8.6,5.9Hz,1H),7.35(dd,J=8.3,2.5Hz,1H),7.08(ddd,J=8.6,7.7,2.5Hz,1H),2.62(s,3H).19F NMR(376MHz,CDCl3):δ-107.01(s,1F)。
化合物35的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物2的合成中的描述,可得到粗产率38%,在未进行进一步纯化的情形下于下个步骤中继续使用。
化合物36的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物3的合成中的描述,可得到纯产物,产率71%。
化合物36的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.47-7.38(m,2H),7.13(td,J=8.0,2.2Hz,1H),6.55(s,1H),5.01-4.92(dd,1H),3.96(d,J=11.5Hz,1H),3.38(td,J=11.2,2.4Hz,1H),2.44(d,J=12.1Hz,1H),2.05(d,J=13.2Hz,1H),1.91(dd,J=13.3,3.1Hz,1H),1.72-1.61(m,1H),1.53-1.45(m,2H).19F NMR(376MHz,CDCl3):δ-62.12(s,3F),-108.60(s,1F)。
化合物37的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物29的合成中的描述,可得到纯产物,产率23%。
化合物37的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ7.63(dd,J=8.4,4.9Hz,1H),7.48-7.42(d,4H),7.17(t,J=8.6Hz,1H),7.07(d,J=8.1Hz,1H),7.03-6.98(d,4H),6.64(s,1H).19F NMR(376MHz,CDCl3):δ-62.04(s,3F),-109.77(s,1F)。
化合物(IA-9)的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物(IA-16)的合成中的描述,可得到纯产物,产率66%。
化合物(IA-9)的光谱数据:1H NMR(400MHz,CD2Cl2)[ppm]:δ7.55(d,J=8.7Hz,4H),7.45(dd,J=7.6,1.6Hz,5H),7.39(d,J=8.7Hz,6H),6.98–6.88(m,8H),6.82(s,1H),6.26(dd,J=8.0,1.2Hz,4H),1.66(s,12H).19F NMR(376MHz,CD2Cl2):δ-62.21(s,3F),-110.71(s,1F)。
实施例24
化合物(IA-31)的制备:
化合物38的合成:除使用的起始物不同之外,合成实验的反应试剂、实验条件等依照化合物29的合成中的描述,可得到纯产物,产率23%。
化合物38的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.23(dd,J=8.1,0.4Hz,1H),7.60–7.57(d 1H),7.40(dd,J=8.2,1.9Hz,2H),7.36–7.30(t,1H),7.25–7.24(m,1H),7.23(s,1H),7.17–7.11(m,1H),6.95(s,2H),6.92(s,1H),6.42(d,J=1.9Hz,2H).19F NMR(376MHz,CDCl3)δ-62.21(s,3F)。
化合物39的合成:将正丁基锂(1.4mL,3.5mmol)在-78℃下逐滴滴入含有2-溴吡啶(2-bromopyridine)(0.5g,3.19mmol)的干燥四氢呋喃(7mL)溶液中,并搅拌1小时。将氯化三丁基锡(tributyltin chloride)(0.87mL,3.19mmol)在-78℃下加入溶液中,并在-78℃下持续搅拌3小时。接着,在室温下继续搅拌30分钟。以饱和氯化铵溶液将反应终止,并使用乙酸乙酯进行萃取(3×25mL)。以盐水清洗合并的有机层,再使用无水硫酸钠进行干燥。在减压下使溶剂蒸发,并在不进行进一步纯化的情形下,于下一步骤中使用。
化合物39的光谱数据:1H NMR(400MHz,CDCl3)[ppm]:δ8.75–8.68(m,1H),7.46(td,J=7.5,1.8Hz,1H),7.38(d,J=7.4Hz,1H),7.09(m,J=4.9,4.1,1.7Hz,1H),1.56(m,J=17.2,15.9,7.1Hz,6H),1.31(dd,J=14.6,7.3Hz,6H),1.19–1.01(m,6H),0.91–0.81(m,9H)。
化合物(IA-31)的合成:将含有化合物38(0.1g,0.18mmol)、化合物39(0.16g,0.43mmol)、(1,1'-双(二苯基膦)二茂铁)二氯化钯(PdCl2(dppf))(0.013g,0.018mmol)的除气甲苯(4mL)在氮气下加热,回流12小时。降温后,将反应混合物过滤,除去所有溶剂。接着,加入乙酸乙酯和水,以盐水、水清洗有机层,再以硫酸钠干燥。以管柱层析进行纯化,使用正己烷:乙酸乙酯=3:1作为冲提液,可获得产率为80%的纯产物。
化合物(IA-31)的光谱数据:1H NMR(400MHz,CD2Cl2)[ppm]:δ8.58(ddd,J=4.8,1.8,0.9Hz,2H),8.38(d,J=8.1Hz,2H),8.03(dd,J=8.0,1.7Hz,2H),7.69–7.62(m,3H),7.54(d,J=8.0Hz,4H),7.48(d,J=8.1Hz,3H),7.12(s,2H),6.98(d,J=1.7Hz,2H),6.95(s,1H).19F NMR(376MHz,CDCl3)δ-62.06(s,3F)。
图1是本发明的实施例的化合物(IA-10)~(IA-18)各自的吸收光谱图。上述的吸收光谱的测量使用的溶剂为四氢呋喃,使用化合物Spiro-OMeTAD(2,2',7,7'-四[N,N-二(4-甲氧基苯基)胺]-9,9'-螺二芴(2,2',7,7'-tetrakis[N,N-di(4-methoxyphenyl)amino]-9,9'-spirobifluorene))作为比较例。图2是本发明的实施例的化合物(IA-10)~(IA-18)各自的循环伏安图。上述的循环伏安图的测量使用的溶剂为二氯甲烷,使用化合物Spiro-OMeTAD作为比较例,Fc為二茂铁(ferrocene)。表1为本发明的实施例的化合物(IA-10)~(IA-18)各自的吸收波长(λabs)、能阶差(Eg,opt)、氧化电位(Eox)、最高占有分子轨道(HOMO)、最低未填满分子轨域(LUMO)。
由图1、表1可知,本发明的化合物在短波长的范围内有良好的吸收,在光电材料的领域内有优异的应用性。由图2、表1可知,本发明的化合物具有良好的可逆氧化还原性及适当的轨域能量差,在光电材料的领域内有优异的应用性。
表1
a量测自吸收的起始点
b HOMO=-(Eox+5.1)eV
c LUMO=HOMO+Eg,opt
图3是本发明的实施例的化合物(IA-19)~(IA-23)各自的吸收光谱图。上述的吸收光谱的测量使用的溶剂为四氢呋喃。图4是本发明的实施例的化合物(IA-19)~(IA-23)各自的循环伏安图。上述的循环伏安图的测量使用的溶剂为二氯甲烷。表2为本发明的实施例的化合物(IA-19)~(IA-23)各自的吸收波长(λabs)、能阶差(Eg,opt)、氧化电位(Eox)、最高占有分子轨道(HOMO)、最低未填满分子轨域(LUMO)。
由图3、表2可知,本发明的化合物在短波长的范围内有良好的吸收,在光电材料的领域内有优异的应用性。由图4、表2可知,本发明的化合物具有良好的可逆氧化还原性及适当的轨域能量差,在光电材料的领域内有优异的应用性。
表2
a量测自吸收的起始点
b HOMO=-(Eox+5.1)eV
c LUMO=HOMO+Eg,opt
图5是本发明的实施例的化合物(IA-1)~(IA-5)各自的吸收光谱图。上述的吸收光谱的测量使用的溶剂为四氢呋喃。图6是本发明的实施例的化合物(IA-1)~(IA-5)各自的循环伏安图。上述的循环伏安图的测量使用的溶剂为二氯甲烷。表3为本发明的实施例的化合物(IA-1)~(IA-5)各自的吸收波长(λabs)、能阶差(Eg,opt)、氧化电位(Eox)、最高占有分子轨道(HOMO)、最低未填满分子轨域(LUMO)。
由图5、表3可知,本发明的化合物在短波长的范围内有良好的吸收,在光电材料的领域内有优异的应用性。由图6、表3可知,本发明的化合物具有良好的可逆氧化还原性及适当的轨域能量差,在光电材料的领域内有优异的应用性。
表3
a量测自吸收的起始点
b HOMO=-(Eox+5.1)eV
c LUMO=HOMO+Eg,opt
表4为使用本发明的实施例的化合物(IA-10)~(IA-12)、(IA-19)~(IA-20)制造而得的太阳能电池元件各自的元件表现数据。JSC为短路电流密度,VOC为开路电压,FF为填充因子,PCE为能量转换效率。
由表4可知,使用本发明的实施例的错合物制造而得的太阳能电池相较于现有技术而言,具有相当甚至更优异的能量转换效率,在光电材料的领域内有优异的应用性。
表4
综上所述,本发明的有机化合物中,将至少一C-N键取代现有的C-C键,使本发明的有机化合物具有不对称的有类四面体构形。本发明的有机化合物在短波长的范围内有良好的吸收,且具有良好的可逆氧化还原性及适当的轨域能量差,在光电材料的领域内有优异的应用性。此外,含有本发明的有机化合物的太阳能电池相较于现有技术而言,具有相当甚至更优异的能量转换效率,故本发明的有机化合物具有相当高的应用价值。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!